一种多西紫杉醇复合缓释剂及其制备方法与流程
本发明涉及医药类抗肿瘤药物制剂领域,特别涉及一种多西紫杉醇复合缓释剂及其制备方法。
背景技术:
多西紫杉醇(docetaxel,dtx),cas号为33069-62-4,mr807.8792,又名多西他赛。是紫杉醇衍生物,是一种从天然植物浆果紫杉的树叶或针叶中直接提取得到的抗癌药物,属细胞周期非特异性抗肿瘤药物,抗肿瘤谱广。dtx为白色或类白色结晶性粉末,熔点为213℃。具有良好的脂溶性,易溶于乙醇、丙酮、乙醚、苯等有机溶剂,极不溶于水和正己烷。
dtx的作用机制:dtx的药理作用与其他紫杉醇衍生物相似。微管是真核细胞的一种重要组成成分,它由两条类似的多肽亚单位构成的微管二聚体形成。在正常情况下,微管和微管蛋白二聚体之间存在动态平衡。dtx作为一种新型抗微管药物,可使二者之间失去这种动态平衡,诱导和促进微管蛋白聚合抑制解聚,保持微管蛋白稳定。这些作用致使细胞在进行有丝分裂时不能形成纺锤体和纺锤丝,有效抑制了细胞分裂和增殖,从而发挥抗肿瘤作用。
该药物临床用于治疗乳腺癌、肺癌、卵巢癌、胃肠道癌、白血病等多种肿瘤。但其具有全身毒性,特别是持久的骨髓抑制,过敏反应。其不良反应主要表现为:腹泻、呕吐、恶心粘膜炎、脱发、关节痛和肌肉痛、无力、注射部位反应和低血压等反应,不良反应的发生率和强度也呈线性增加。据文献报道,在接受dtx治疗5-12个月后,将引起患者肾功能衰退。此外,dtx对心、肺等器官的毒性亦有报道,这些毒副作用极大的限制了它的应用。因此如何提高dtx的生物利用度、降低其毒副作用是人们所期待和关注的。
纳米药物粒子属超微粒子(粒径为1-100nm)范畴,通常由无机材料或天然/合成高分子材料制备而成。主要通过共价连接、静电吸附将药物结合在其表面,或直接将药物分子包裹在里面。纳米粒子作为药物载体进入体内,可以有效地减少人体网状内皮系统(res)巨噬细胞的吞噬,作为纳米级的粒子能穿越细胞间隙,可通过人体最小的毛细血管及血脑屏障(bbb),并被细胞组织吸收,纳米粒子药物载体可以控制药物在靶向部位控制释放、减少药物用量、增强药物疗效并降低药物毒性。同时,粒子系统可以避免药物活性丧失,有利于药物的贮藏和运输。因此纳米粒子是一种很有前途的药物新剂型。
目前,疏水性药物主要通过自组装技术制备形成核壳结构的纳米粒子。自组装法制备的纳米粒子粒径均匀,杂质较少,制备方法简单,应用愈趋广泛。然而,涉及dtx纳米粒子的专利主要以脂质体为主。专利文献cn101884616a公开了一种dtx长循环脂质体及其制备方法,该制剂相对于普通dtx注射制剂而言,载药量和稳定性极大提高,毒副作用极大减小。而如何制备相比dtx脂质体为主的dtx纳米粒子具有更高载药量、更长循环、更低毒性、治疗效果更佳的dtx制剂成为了医药类抗肿瘤药物制剂领域所要解决的技术难题。
技术实现要素:
本发明所要解决的技术问题是:如何制备相比多西紫杉醇脂质体为主的dtx纳米粒子具有更高载药量、更长循环、更低毒性、治疗效果更佳的多西紫杉醇制剂。
为了解决上述技术问题,本发明采用的技术方案为:提供一种多西紫杉醇复合缓释剂制备方法,包括以下步骤:
s1:将多西紫杉醇粉末和卵磷脂溶于易于形成复合物的非质子四氢呋喃溶剂中,于45℃水浴反应3小时,得到多西紫杉醇磷脂复合溶液;
s2:通过旋转蒸发去除多西紫杉醇磷脂复合溶液中的四氢呋喃,得到多西紫杉醇磷脂复合物;
s3:将上述多西紫杉醇磷脂复合物投入正己烷溶剂中(多西紫杉醇难溶于正己烷),通过过滤收集正己烷溶剂中的多西紫杉醇磷脂复合物;
s4:通过旋转蒸发去除多西紫杉醇磷脂复合物中的正己烷,通过干燥得到淡黄色的多西紫杉醇磷脂复合物;
s5:将上述淡黄色的多西紫杉醇磷脂复合物与胆固醇、泊洛沙姆投入四氢呋喃中,得到含有多西紫杉醇磷脂复合物的有机溶液;
s6:将上述含有多西紫杉醇磷脂复合物的有机溶液逐滴加入至纯水中并搅拌,通过减压旋转蒸发去除上述有机溶液中的四氢呋喃,得到多西紫杉醇磷脂复合物水溶液;
s7:将上述多西紫杉醇磷脂复合物水溶液分别通过0.45μm及0.22μm微孔滤膜过滤,得到多西紫杉醇磷脂复合物纳米粒子溶液;
s8:在上述多西紫杉醇磷脂复合物纳米粒子溶液中加入冻干保护剂,进行冻干,得到的冻干制剂即为多西紫杉醇复合缓释剂。
本发明的有益效果在于:本发明多西紫杉醇复合缓释剂中的载体材料为卵磷脂;形状为球形(见图4),粒径在100~150nm之间,稳定性好,相比多西紫杉醇脂质体而言,在多西紫杉醇复合缓释剂中,多西紫杉醇与磷脂之间通过弱相互作用力作用,而不是简单的药物通过磷脂被包裹在囊泡里,因此具有载药量高、长循环、低毒性、治疗效果佳等特点。
附图说明
图1为本发明实施例1中多西紫杉醇复合缓释剂的透射电子显微镜图;
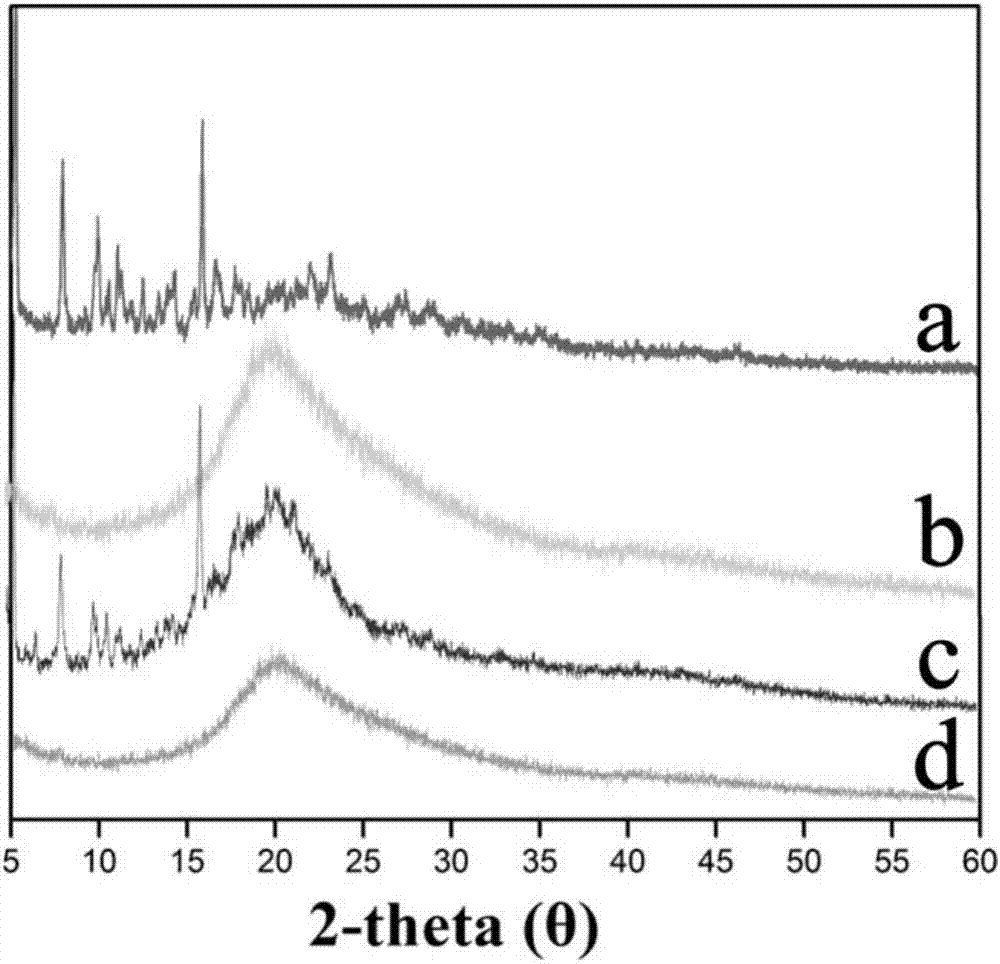
图2为本发明实施例1中多西紫杉醇、卵磷脂、多西紫杉醇和卵磷脂的物理混合物、多西紫杉醇复合缓释剂的x-射线衍射图谱;(a)多西紫杉醇,(b)卵磷脂,(c)多西紫杉醇和卵磷脂的物理混合物,(d)多西紫杉醇复合缓释剂;
图3为本发明实施例1中多西紫杉醇、卵磷脂、多西紫杉醇和卵磷脂的物理混合物、多西紫杉醇复合缓释剂的红外光谱图谱;(a)多西紫杉醇,(b)卵磷脂,(c)多西紫杉醇和卵磷脂的物理混合物,(d)多西紫杉醇复合缓释剂;
图4为本发明实施例1中多西紫杉醇复合缓释剂的透射电子显微镜图;
图5为本发明实施例1中多西紫杉醇复合缓释剂的(a)水化动力学直径和水化动力学直径分布和(b)zeta电位;
图6为多西紫杉醇、本发明实施例1中多西紫杉醇复合缓释剂的药物释放曲线;(a)多西紫杉醇,(b)多西紫杉醇复合缓释剂。
具体实施方式
为详细说明本发明的技术内容、所实现目的及效果,以下结合实施方式并配合附图予以说明。
本发明最关键的构思在于:本发明在多西紫杉醇复合缓释剂制备方法中,通过将多西紫杉醇粉末与卵磷脂通过四氢呋喃复合,并通过正己烷洗涤,并经过减压旋转蒸发、超滤及冻干步骤,制得具有载药量高、长循环、低毒性、治疗效果佳的多西紫杉醇复合缓释剂。
本发明涉及一种多西紫杉醇复合缓释剂制备方法,包括以下步骤:
s1:将多西紫杉醇粉末和卵磷脂溶于四氢呋喃溶剂中,于45℃水浴反应3小时,得到多西紫杉醇磷脂复合溶液;
s2:通过旋转蒸发去除多西紫杉醇磷脂复合溶液中的易于形成复合物的非质子四氢呋喃,得到多西紫杉醇磷脂复合物;
s3:将上述多西紫杉醇磷脂复合物投入正己烷溶剂中,通过过滤收集正己烷溶剂中的多西紫杉醇磷脂复合物;
s4:通过旋转蒸发去除多西紫杉醇磷脂复合物中的正己烷(多西紫杉醇难溶于正己烷),通过干燥得到淡黄色的多西紫杉醇磷脂复合物;
s5:将上述淡黄色的多西紫杉醇磷脂复合物与胆固醇、泊洛沙姆投入四氢呋喃中,得到含有多西紫杉醇磷脂复合物的有机溶液;
s6:将上述含有多西紫杉醇磷脂复合物的有机溶液逐滴加入至纯水中并搅拌,通过减压旋转蒸发去除上述有机溶液中的四氢呋喃,得到多西紫杉醇磷脂复合物水溶液;
s7:将上述多西紫杉醇磷脂复合物水溶液分别通过0.45μm及0.22μm微孔滤膜过滤,得到多西紫杉醇磷脂复合物纳米粒子溶液;
s8:在上述多西紫杉醇磷脂复合物纳米粒子溶液中加入冻干保护剂,进行冻干,得到的冻干制剂即为多西紫杉醇复合缓释剂。
上述多西紫杉醇复合缓释剂的制备方法所制得的多西紫杉醇复合缓释剂为球形且粒径在100~150nm之间,(见图1、图4和图5(a)),平均粒径为130nm左右;由zeta电位分布图可以看出多西紫杉醇复合缓释剂的电位为-17.9mv左右(见图5(b)),稳定性好,具有较好的缓释特性(其药物释放曲线见图6);细胞毒性试验表明多西紫杉醇复合缓释剂具有较强的癌细胞杀灭效果。(结果显示,多西紫杉醇复合缓释剂浓度为5μg/ml,培养时间24h的条件下,多西紫杉醇复合缓释剂对宫颈癌细胞的细胞毒性为dtx纯药的1.5倍)。该制剂相比多西紫杉醇脂质体而言,具有载药量高、长循环、低毒性、治疗效果佳等特点。
进一步的,上述多西紫杉醇复合缓释剂的制备方法中,所述紫杉醇粉末与卵磷脂的质量比为1∶3-5。
进一步的,上述多西紫杉醇复合缓释剂的制备方法中,所述紫杉醇粉末与卵磷脂的质量比为1∶5。
进一步的,上述多西紫杉醇复合缓释剂的制备方法中,所述胆固醇的质量为卵磷脂质量的10%,所述泊洛沙姆的质量为卵磷脂质量的0.5-2.0%。
进一步的,上述多西紫杉醇复合缓释剂的制备方法中,所述冻干保护剂包括右旋糖酐和甘露醇。
进一步的,上述多西紫杉醇复合缓释剂的制备方法中,所述冻干保护剂由右旋糖酐和甘露醇按照1-2∶1混合而成。
进一步的,上述多西紫杉醇复合缓释剂的制备方法中,所述冻干保护剂由右旋糖酐和甘露醇按照1∶1-2混合而成。
进一步的,上述多西紫杉醇复合缓释剂的制备方法中,所述冻干保护剂的终浓度为1-2%。
进一步的,上述多西紫杉醇复合缓释剂的制备方法中,所述卵磷脂为大豆卵磷脂。
一种上述多西紫杉醇复合缓释剂的制备方法制得的多西紫杉醇复合缓释剂。
实施例1:
一种多西紫杉醇复合缓释剂的制备方法,包括以下步骤:
s1:将多西紫杉醇粉末和大豆卵磷脂(质量比为:1∶5)溶于易于形成复合物的非质子四氢呋喃溶剂中,于45℃水浴反应3小时,得到多西紫杉醇磷脂复合溶液;
s2:通过旋转蒸发去除多西紫杉醇磷脂复合溶液中的四氢呋喃,得到多西紫杉醇磷脂复合物;
s3:将上述多西紫杉醇磷脂复合物投入正己烷溶剂中,通过过滤收集正己烷溶剂中的多西紫杉醇磷脂复合物;
s4:通过旋转蒸发去除多西紫杉醇磷脂复合物中的正己烷,通过干燥得到淡黄色的多西紫杉醇磷脂复合物;
s5:将上述淡黄色的多西紫杉醇磷脂复合物与胆固醇、泊洛沙姆投入四氢呋喃中,得到含有多西紫杉醇磷脂复合物的有机溶液;所述胆固醇的质量为卵磷脂质量的10%,所述泊洛沙姆的质量为卵磷脂质量的0.5-2.0%;
s6:将上述含有多西紫杉醇磷脂复合物的有机溶液逐滴加入至纯水中并搅拌,通过减压旋转蒸发去除上述有机溶液中的四氢呋喃,得到多西紫杉醇磷脂复合物水溶液;
s7:将上述多西紫杉醇磷脂复合物水溶液分别通过0.45μm及0.22μm微孔滤膜过滤,得到多西紫杉醇磷脂复合物纳米粒子溶液;
s8:在上述多西紫杉醇磷脂复合物纳米粒子溶液中加入冻干保护剂(右旋糖酐和甘露醇,质量比为:1∶1,使其最终浓度为1%),进行冻干,得到的冻干制剂即为多西紫杉醇复合缓释剂。
利用本法制备的多西紫杉醇复合缓释剂平均粒径约为140nm,载药量为17.83%。
实施例2:
一种如实施例1所述的多西紫杉醇复合缓释剂的制备方法,其中s1中多西紫杉醇粉末和大豆卵磷脂的质量比为:1∶4。
利用本法制备的多西紫杉醇复合缓释剂平均粒径约为130nm,载药量为14.42%。
实施例3:
一种如实施例1所述的多西紫杉醇复合缓释剂的制备方法,其中s1中多西紫杉醇粉末和大豆卵磷脂的质量比为:1∶3。
利用本法制备的多西紫杉醇复合缓释剂平均粒径约为125nm,载药量为12.42%。
实施例4:
一种如实施例1所述的多西紫杉醇复合缓释剂的制备方法,其中s8中右旋糖酐和甘露醇质量比为:2∶1。
利用本法制备的多西紫杉醇复合缓释剂平均粒径约为125nm,载药量为17.93%。
实施例5:
一种如实施例1所述的多西紫杉醇复合缓释剂的制备方法,其中s8中右旋糖酐和甘露醇质量比为:1∶2。
利用本法制备的多西紫杉醇复合缓释剂平均粒径约为118nm,载药量为16.92%。
实施例6:
一种如实施例1所述的多西紫杉醇复合缓释剂的制备方法,其中s8中冻干保护剂的最终浓度为2%。
利用本法制备的多西紫杉醇复合缓释剂平均粒径约为135nm,载药量为13.8%。
综上所述,本发明提供的多西紫杉醇复合缓释剂的制备方法所制得的多西紫杉醇复合缓释剂为球形且粒径在100~150nm之间,(见图1、图4和图5(a)),平均粒径为130nm左右;由zeta电位分布图可以看出多西紫杉醇复合缓释剂的电位为-17.9mv左右(见图5(b)),稳定性好,具有较好的缓释特性(其药物释放曲线见图6);细胞毒性试验表明多西紫杉醇复合缓释剂具有较强的癌细胞杀灭效果。(结果显示,多西紫杉醇复合缓释剂浓度为5μg/ml,培养时间24h的条件下,多西紫杉醇复合缓释剂对宫颈癌细胞的细胞毒性为dtx纯药的1.5倍)。该制剂相比多西紫杉醇脂质体而言,具有载药量高、长循环、低毒性、治疗效果佳等特点。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等同变换,或直接或间接运用在相关的技术领域,均同理包括在本发明的专利保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!