含有度他雄胺和坦索罗辛的硬胶囊复合物及其制备方法与流程
本公开涉及包含度他雄胺和坦索罗辛作为活性成分的硬胶囊复合制剂,更具体地,本发明涉及包含度他雄胺和坦索罗辛的硬胶囊复合制剂以及制备所述硬胶囊复合制剂的方法,其中所述硬胶囊复合制剂通过具有减小的尺寸而展示出度他雄胺的快速起效效能并具有改善的药物依从性。
背景技术:
良性前列腺增生是50岁或更大年龄的男性中频发的典型疾病之一,由于前列腺增大而引起排尿困难。良性前列腺增生也会引起并发症,如尿路感染、尿石症、血尿、肾功能衰竭等。
度他雄胺是一种5-α还原酶抑制剂(化学名:17β-n-(2,5-双(三氟甲基))苯基氨基甲酰基-4-氮杂-5α-雄甾-1-烯-3-酮),已知可用于治疗良性前列腺增生、前列腺癌和男性型秃发(专利文献1)。度他雄胺目前在市场上以商品名avodart提供。avodart是通过下述方法制备的软胶囊制剂:将0.5mg度他雄胺溶解在丁基化羟基甲苯(bht)和辛酸/癸酸的甘油单酯油和甘油二酯油的349.5mg混合物中,然后将所得物填充到软胶囊中,avodart用作良性前列腺增生、前列腺癌和男性型秃发的治疗剂。
坦索罗辛是可有效治疗良性前列腺增生、慢性前列腺炎和慢性腹痛的症状的α1a阻断剂。此外,通过阻断α1a,坦索罗辛还可经由骨骼肌松弛机制有效治疗尿石症。坦索罗辛由yamanouchiphannaceuticalco.,ltd.于1996年研发,并且已知含有盐酸坦索罗辛的各种产品(专利文献2)。
度他雄胺和坦索罗辛是具有彼此不同的作用机制的良性前列腺增生的治疗剂,当它们被同时施用或间隔施用作为联合疗法时,在治疗效果更好且副作用更少方面存在优势。因此,开发了一种硬胶囊复合制剂,其中度他雄胺和坦索罗辛以完全分离的状态包含在硬胶囊中,并且该硬胶囊复合制剂目前在美国以商品名jalyn(glaxosmithkline)在市场上提供。jalyn在hpmc硬胶囊中包含缓释型坦索罗辛颗粒和速释型软胶囊制剂,该速释型软胶囊制剂是通过下述方法制备的:将度他雄胺溶解在丁基羟基甲苯(bht)和辛酸/癸酸的甘油单酯油和甘油二酯油的混合物中,然后将所得物填充到软胶囊中(参见https://www.gsksource.com/pharma/content/gsk/source/us/en/brands/jalyn.html,11.description)。已知由于jalyn包含速释型度他雄胺和缓释型坦索罗辛,它们各自独立存在于一种复合制剂中,因此,由于各成分的独立作用,可有效用于治疗良性前列腺增生。然而,jalyn的硬胶囊具有非常的大尺寸:00号,因此在老年患者当中的药物依从性差,并且其度他雄胺的初始溶出度低于单一度他雄胺制剂的初始溶出度,这倾向于降低度他雄胺的快速作用。
[现有技术文献]
[专利文献]
专利文献1:美国专利no.5,565,467
专利文献2:美国专利公开no.2004-0058896
技术实现要素:
技术问题
本公开的一个目的是提供包含度他雄胺和坦索罗辛的硬胶囊复合制剂,其中患者的药物依从性可以得以明显改善,并且可以通过减小包含度他雄胺和坦索罗辛的硬胶囊复合制剂的尺寸来提高度他雄胺的初始溶出度。
本公开的另一个目的是提供制备包含度他雄胺和坦索罗辛的硬胶囊复合制剂的方法。
技术方案
本公开的一个方面提供了一种硬胶囊复合制剂,所述制剂包含:独立的度他雄胺部分,该部分包含度他雄胺或其药学上可接受的盐;和独立的坦索罗辛部分,该部分包含包括坦索罗辛或其或其药学上可接受的盐,其中所述独立的度他雄胺部分是包含含有度他雄胺、油和表面活性剂的自乳化乳剂的制剂,所述独立的坦索罗辛部分是包含缓释剂的固体制剂,并且所述独立的度他雄胺部分和所述独立的坦索罗辛部分可以以分离状态被包含并被填充到0至3号尺寸的胶囊中。
本公开的另一方面提供了制备根据本公开的一个方面的硬胶囊复合制剂的方法,所述方法包括:
通过混合度他雄胺或其药学上可接受的盐、油和表面活性剂来制备度他雄胺的自乳化乳剂;
制备度他雄胺的软胶囊,其包含所述度他雄胺的自乳化乳剂;
将坦索罗辛或其药学上可接受的盐与药学上可接受的添加剂一起粒化以产生坦索罗辛颗粒,或将所述颗粒压片为坦索罗辛片剂;和
用所述度他雄胺的软胶囊和所述坦索罗辛的颗粒或片剂填充空胶囊以获得一个包含所述度他雄胺的软胶囊和所述坦索罗辛的颗粒或片剂的硬胶囊。
有益效果
与已知的市售制剂相比,根据本公开的一个方面的包含度他雄胺和坦索罗辛的硬胶囊复合制剂可具有更小的硬胶囊尺寸,从而明显改善患者的药物依从性。此外,与已知的市售制剂相比,根据本公开的一个方面的包含度他雄胺和坦索罗辛的硬胶囊复合制剂可以具有明显高的度他雄胺的初始溶出度,因此可以预期更快的药效。
附图说明
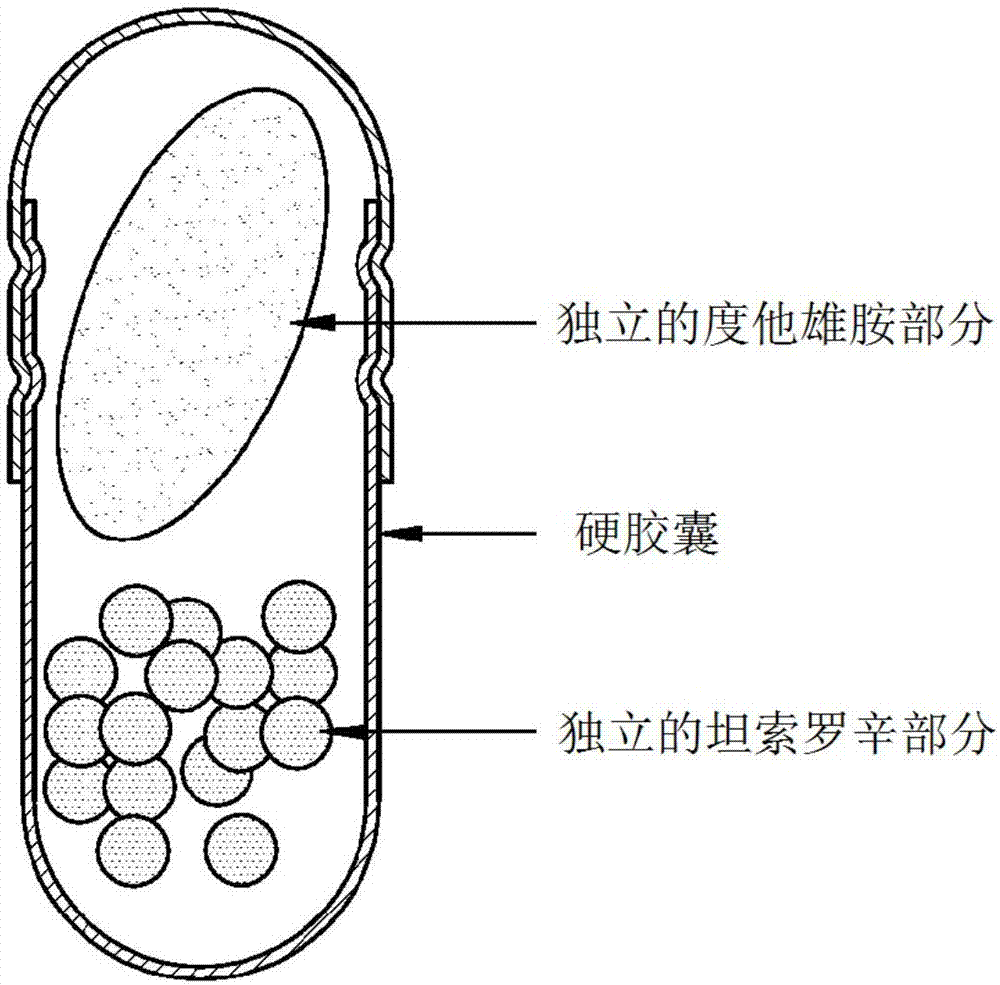
图1示出了根据本公开一个具体实施方式的硬胶囊复合制剂;
图2是根据本公开的一个实施方式的包含含有度他雄胺的自乳化乳剂的软胶囊(底部)和根据对比例1的软胶囊(顶部)的照片;
图3是根据本公开的一个实施方式的硬胶囊复合制剂(底部)和根据对比例1的硬胶囊复合制剂(顶部)的照片;
图4是显示实施例1至4和对比例1的硬胶囊复合制剂中度他雄胺的溶出度的测试结果的图像;
图5是显示实施例1至4和对比例1的硬胶囊复合制剂中坦索罗辛的溶出度的测试结果的图像。
具体实施方式
除非另外定义,否则本文使用的所有技术术语均与本公开所属领域的普通技术人员所通常理解的含义具有相同的含义。此外,虽然本文描述了方法或样品,但与其类似或等同的那些也包含在本公开的范围内。除非另有说明,否则本文所述的数值被认为包括“约”的含义。本文中作为参考文献公开的所有出版物的内容都包含在本公开中。
本公开的一个方面提供了一种硬胶囊复合制剂,所述制剂包含:独立的度他雄胺部分,该部分包含度他雄胺或其药学上可接受的盐;和独立的坦索罗辛部分,该部分包含包括坦索罗辛或其或其药学上可接受的盐,其中所述独立的度他雄胺部分是包含含有度他雄胺、油和表面活性剂的自乳化乳剂的制剂,所述独立的坦索罗辛部分是包含缓释剂的固体制剂,并且所述独立的度他雄胺部分和所述独立的坦索罗辛部分可以以分离状态被包含并被填充到0至3号尺寸的胶囊中。
“包含处于分离状态的:独立的度他雄胺部分和独立的坦索罗辛部分”是指将相应活性成分作为单独的制剂填充到硬胶囊中以防止其物理混合。
在硬胶囊复合制剂中,可将独立的度他雄胺部分制备成包含自乳化乳剂的软胶囊制剂,这允许将难溶性药理学活性成分填充到小尺寸的软胶囊中。因此,预期可以减小最终硬胶囊的尺寸以提高患者的药物依从性。
自乳化乳剂是指与水混合时可通过自乳化形成乳剂的组合物。更具体地,基于自乳化乳剂的总重量,自乳化乳剂可以包括0.1重量%至1重量%的度他雄胺、50重量%至98重量%的油和1重量%至40重量%的表面活性剂。
基于自乳化乳剂的总重量,自乳化乳剂可包含0.1重量%至1重量%、更具体地0.3重量%至0.7重量%、具体得多地0.4重量%至0.6重量%的度他雄胺;50%重量至98%重量、更具体地60%重量至96%重量、具体得多地65%重量至95%重量的油;和1%重量至40%重量、更具体地3重量%至40重量%、具体得多地4重量%至35重量%的表面活性剂。
当基于自乳化乳剂的总重量,作为自乳化乳剂的活性成分的度他雄胺的含量低于0.1重量%时,增加了赋形剂的相对量从而增大胶囊的体积,这使得吞咽不方便。当含量高于1重量%时,难以制备软胶囊,因为难以溶解活性成分。
油与表面活性剂很好地混溶,并在水中乳化形成稳定的乳剂,并且对作为活性成分的度他雄胺具有足够的溶解度。可以使用药学上可接受的油。在一个具体实施方式中,油可以是选自如下的油:①脂肪酸甘油单酯、脂肪酸甘油二酯或脂肪酸甘油单酯/脂肪酸甘油二酯,例如辛酸/癸酸的甘油单酯或甘油二酯(商品名:capmulmcm),②脂肪酸甘油三酯,更具体地,中链脂肪酸甘油三酯,例如,分馏椰子油(商品名:capryol),③脂肪酸与一价至三价烷醇的酯,更具体地,具有8-20个碳原子的脂肪酸与一价至三价的具有2-3个碳原子的烷醇的酯,例如肉豆蔻酸异丙酯,棕榈酸异丙酯,亚油酸乙酯,油酸乙酯或丙二醇单月桂酸酯;和④游离脂肪酸,例如液体油酸或亚油酸。
基于自乳化乳剂的总重量,油的含量可以为50重量%至98重量%。当油的含量低于50重量%时,油可能不能充分溶解活性成分,从而产生沉淀物。当油的含量高于98重量%时,可能会减少表面活性剂的使用,从而使制剂的乳化能力劣化。
作为使用capmulmcm油检测度他雄胺的溶解度的实验结果,溶解0.5mg度他雄胺所需的最少量的油为32mg,这指示要使用的油的总量超过50mg。然而,考虑到软胶囊的微型化,油的量可以不超过200mg。因此,当自乳化乳剂包含0.5mg度他雄胺时,油的使用量可以为约50mg至约200mg。
表面活性剂通过稳定地乳化水中的油组分而用于形成稳定的乳剂。可以使用非离子表面活性剂作为表面活性剂。非离子表面活性剂可包括tweens、spans、labrasols、brij、myrj、蓖麻油如聚乙二醇蓖麻油、取代的蓖麻油如cremophor或氢化cremophor、聚氧乙烯-聚氧丙烯嵌段共聚物、聚氧乙烯-聚氧丙烯共聚物(商品名:pluronics)、辛酸/癸酸的甘油单酯或甘油二酯(商品名:imwitors)等。更具体地,表面活性剂可选自由取代的蓖麻油、聚氧乙烯-聚氧丙烯嵌段共聚物及其任何组合所组成的组。聚氧乙烯-聚氧丙烯嵌段共聚物可包括泊洛沙姆(poloxamer)407、泊洛沙姆188或泊洛沙姆124。取代的蓖麻油可包括氢化蓖麻油例如hco-50(peg50氢化蓖麻油)或hco-40(peg40氢化蓖麻油),或聚氧乙烯化蓖麻油例如
基于自乳化乳剂的总重量,表面活性剂的含量可以为1重量%至40重量%。与添加量相比,当表面活性剂的量小于1重量%时,乳剂形成能力可能降低,而当表面活性剂的量大于40重量%时,难以获得期望的效果。
在一个具体实施方式中,基于自乳化乳剂的总重量,自乳化乳剂可包括0.3重量%至0.7重量%的度他雄胺、60重量%至96重量%的油和3重量%至40重量%的表面活性剂。
在一个具体实施方式中,基于自乳化乳剂的总重量,自乳化乳剂可包含0.4重量%至0.6重量%的度他雄胺、65重量%至95重量%的油和4重量%至35重量%的表面活性剂。
考虑到溶解有效量的度他雄胺所需的最少量的油和软胶囊的微型化,自乳化乳剂可以以70mg至200mg的量包含在独立的度他雄胺部分中。在一个具体实施方式中,独立的度他雄胺部分可以是软胶囊,其包含约70mg至约200mg的自乳化乳剂。
在一个具体实施方式中,独立的度他雄胺部分可以是软胶囊,其包含70mg至200mg的自乳化乳剂,基于所述自乳化乳剂的总重量,所述自乳化乳剂包括0.1重量%至1重量%的度他雄胺、50重量%至98重量%的油和1重量%至40重量%的表面活性剂。
在一个具体实施方式中,独立的度他雄胺部分可以是软胶囊,其包含70mg至200mg的自乳化乳剂,基于所述自乳化乳剂的总重量,所述自乳化乳剂包括0.3重量%至0.7重量%的度他雄胺、60重量%至96重量%的油和3重量%至40重量%的表面活性剂。
在一个具体实施方式中,度他雄胺的自乳化乳剂可包括重量比为约1:100~500:1~100、具体地约1:150~250:5~80、更具体地约1:150~200:40~80的度他雄胺:油:表面活性剂。
度他雄胺的自乳化乳剂还可包括性质稳定剂。性质稳定剂可以为活性成分提供适于制备的适当溶解度,并且还有助于稳定活性成分的性质,从而即使在制剂保存期间也能防止相分离和沉淀并确保组合物的均匀性。
性质稳定剂可选自由水、乙醇、甘油、丙二醇、聚乙二醇、二甘醇单乙醚(商品名:transcutols)、二甲基异山梨醇(商品名:arlasolve)、十六醇及其任何组合所组成的组,并且可以是例如水、乙醇或甘油。
基于自乳化乳剂的总重量,性质稳定剂的含量可以为0.5重量%至3重量%,或1重量%至3重量%。
度他雄胺的自乳化乳剂还可包括用于口服给药的药学上可接受的添加剂,例如抗氧化剂。抗氧化剂可选自亲脂性生育酚、二丁基羟基甲苯、亲水性抗坏血酸、亚硫酸钠、焦亚硫酸钠及其任何组合。
在一个具体实施方式中,独立的度他雄胺部分可以是包含自乳化乳剂的软胶囊,所述软胶囊可以使用体积为0.07cc至0.30cc的2至4号尺寸的软胶囊制备。此外,可以使用圆形、椭圆形或卵形软胶囊制备所述软胶囊。在一个具体实施方式中,所述软胶囊可以使用2至4号尺寸(0.07cc至0.25cc)的圆形软胶囊、2至4号尺寸(0.09cc至0.25cc)的卵形软胶囊或者2至4号尺寸(0.08cc至0.30cc)的椭圆形软胶囊制备;更具体地,使用2至3号尺寸(0.07cc至0.19cc)的圆形软胶囊或2至3号尺寸(0.09cc至0.19cc)的卵形软胶囊制备;具体得多地,使用2号尺寸的圆形或卵形软胶囊制备(参见catalent,inc.,https://www.catalent.com/index.php/content/download/1230/14867/file/catalent_shapes_sizes_info.pdf.和ep2575788a1)。
所述软胶囊可以是由制药领域中通常使用的材料制成的软胶囊。
独立的坦索罗辛部分可以是片剂、胶囊剂或颗粒剂的形式。
为了制备成上述制剂,独立的坦索罗辛部分可进一步包括药学上可接受的添加剂。所述添加剂可包括稀释剂、崩解剂、粘合剂、稳定剂、润滑剂、着色剂及其任何组合。
稀释剂可选自由微晶纤维素、乳糖、ludipress、甘露醇、磷酸二氢钙、淀粉、低取代羟丙基纤维素、以及它们的任意组合所组成的组。基于颗粒剂、片剂或胶囊剂的总重量,稀释剂可以以约1重量%至约95重量%、特别是约5重量%至约95重量%的量使用。
崩解剂可选自由交聚维酮、甘醇酸淀粉钠、交联羧甲基纤维素钠、低取代羟丙基纤维素、淀粉、海藻酸或其钠盐、以及它们的任意组合所组成的组。基于颗粒剂、片剂或胶囊剂的总重量,崩解剂可以以约0.1重量%至约30重量%、特别是约2重量%至约15重量%的量使用。
粘合剂可选自由羟丙基纤维素,羟丙基甲基纤维素,聚乙酸乙烯酯,聚乙烯吡咯烷酮,共聚维酮,聚乙二醇,十二烷基硫酸钠,轻质无水硅酸,硅酸盐衍生物如合成硅酸铝、硅酸钙或者偏硅酸铝镁(magnesiummetasilicatealuminate),磷酸盐如磷酸氢钙,碳酸盐如碳酸钙,以及它们的任意组合所组成的组。基于颗粒、片剂或胶囊的总重量,粘合剂可以以约0.1重量%至约30重量%、特别是约2重量%至约20重量%的量使用。
润滑剂可选自由硬脂酸,硬脂酸金属盐例如硬脂酸钙或硬脂酸镁,滑石,胶质硅石,蔗糖脂肪酸酯,氢化植物油,高熔点蜡,甘油基脂肪酸酯,甘油二山嵛酸酯,以及它们的任意组合所组成的组。基于颗粒、片剂或胶囊的总重量,润滑剂可以以约0.3重量%至约5重量%、特别是约0.5重量%至约3重量%的量使用。
可以用药学上可接受的包衣剂包被独立的坦索罗辛部分,特别是坦索罗辛颗粒或片剂。包衣剂可以是本领域常用的包衣剂。
在一个具体实施方式中,独立的坦索罗辛部分可以是通过用缓释包衣剂或肠溶包衣剂包被坦索罗辛颗粒或片剂而获得的缓释或肠溶颗粒或片剂。缓释包衣剂可选自聚维酮、甲基纤维素、乙基纤维素、柠檬酸三乙酯、羟丙甲纤维素、乙酸纤维素、聚乙酸乙烯酯、丙二醇、滑石、以及它们的任意组合;肠溶包衣剂可选自甲基丙烯酸-丙烯酸乙酯共聚物、三乙酸甘油酯、乙酸琥珀酸纤维素、邻苯二甲酸羟丙甲纤维素、乙酸琥珀酸羟丙甲纤维素、聚乙酸邻苯二甲酸酯乙烯(polyvinylacetatephthalate)、海藻酸钠、以及它们的任意组合。包衣剂可以单独使用或以其任何组合使用以包被坦索罗辛颗粒或片剂。通过引入包衣剂,独立的坦索罗辛部分可以表现出缓释或肠溶性质,因此可以与速释型度他雄胺一起有效用于治疗前列腺增生。
在一个具体实施方式中,包衣剂可选自由聚维酮、丙二醇、聚乙酸乙烯酯、甲基丙烯酸-丙烯酸乙酯共聚物、滑石及其任何组合所组成的组,但不限于此。
当肠溶包衣剂被用作包衣剂时,可以进一步加入增塑剂以在即使长时间储存时也会防止肠溶包衣膜破裂。增塑剂可以是乙酰化甘油单酯、三乙酸甘油酯、其混合物等。
为了实现最佳制剂尺寸和有效制备,可以将包衣剂的使用保持在最少量。例如,基于独立的坦索罗辛部分的总重量,包衣剂可以以0.1重量%至20重量%、特别是2重量%至10重量%的量使用。
在一个具体实施方式中,如图1所示,根据本公开的硬胶囊复合制剂可以呈在硬胶囊中包含度他雄胺软胶囊和坦索罗辛颗粒两者的形式。
在硬胶囊复合制剂中,包含独立的度他雄胺部分和独立的坦索罗辛部分的硬胶囊(即硬胶囊空胶囊)可以是本领域已知的任何空胶囊。
在一个具体实施方式中,包含独立的度他雄胺部分和独立的坦索罗辛部分的硬胶囊可选自明胶硬明胶硬胶囊和hpmc硬胶囊。
在一个具体实施方式中,硬胶囊可以是明胶硬胶囊。
当使用明胶硬胶囊时,与使用hpmc硬胶囊相比,度他雄胺的初始溶出度可得以明显改善,因此,具有可以获得度他雄胺的快速起效性质的优点。因此,可以进一步增强速释型独立的度他雄胺部分的预期速释性质,从而获得增强的度他雄胺的快速起效性质而不影响缓释型独立的坦索罗辛部分。因此,具有可以选择性地增强度他雄胺的快速起效性质而不影响坦索罗辛的缓释性质的优点(参见实验实施例1)。
在一个具体实施方式中,硬胶囊可以是hpmc硬胶囊。
与明胶硬胶囊相比,hpmc硬胶囊在高温、潮湿储存条件下的储存稳定性和活性成分的溶出度方面可以是有利的,这是因为明胶胶囊可粘附到内部度他雄胺软胶囊,使其在高温、潮湿条件下老化,因此存在度他雄胺的溶出度可能降低的风险。
在本公开中,“hpmc硬胶囊”是指通过使用羟丙基甲基纤维素作为主要基础材料而制备的硬胶囊。
在本公开中,“明胶硬胶囊”是指通过使用明胶作为主要基础材料而制备的硬胶囊。
在一个具体实施方式中,本公开的硬胶囊复合制剂可以是如下的硬胶囊复合制剂:根据依照美国药典(usp)的溶出试验的桨法进行的溶出试验,其在15分钟内具有高于约85%、更具体地高于约90%的度他雄胺溶出度。
在一个具体实施方式中,本公开的硬胶囊复合制剂可以是如下的硬胶囊复合制剂:根据依照usp的溶出试验的桨法进行的溶出试验,其在30分钟内具有约80%或更高的度他雄胺溶出度。
在一个具体实施方式中,可以口服给药硬胶囊复合制剂。
为了制备硬胶囊复合制剂,填充有独立的度他雄胺部分和独立的坦索罗辛部分的空胶囊具有任何尺寸而没有限制,只要该尺寸是用于医药产品的一般胶囊尺寸即可。
可以将硬胶囊复合制剂与包含自乳化乳剂的软胶囊一起引入,从而减小独立的度他雄胺部分的体积,因此,独立的度他雄胺部分和独立的坦索罗辛部分均可以以药学有效量被填充到0至3号尺寸的硬胶囊(内部容积为约0.27cc至0.68cc的硬胶囊)中。取决于胶囊的尺寸号,胶囊可具有多种内部容积。例如,00号尺寸的胶囊具有约0.95cc的内部容积,0号尺寸的胶囊具有约0.68cc的内部容积,1号尺寸的胶囊具有约0.47cc的内部容积,2号尺寸的胶囊具有约0.37cc的内部容积,3号尺寸的胶囊具有约0.27cc的内部容积,4号尺寸的胶囊具有约0.20cc的内部容积(suheungco.,ltd.,参见http://www.suheung.com/korea/embocaps31.html)。
因此,在一个具体实施方式中,与已知的市售制剂(参见实施例1和2)相比,硬胶囊复合制剂的尺寸可明显减小,从而显著提高口服给药时患者的便利性。在一个具体实施方式中,硬胶囊复合制剂的空胶囊可以是0号、1号、2号或3号尺寸的硬胶囊。
硬胶囊复合制剂可以包括度他雄胺(其是5-α还原酶抑制剂)作为第一活性成分,从而在治疗良性前列腺增生、前列腺癌和男性型秃发方面显示出快速效果,并且可以包括坦索罗辛(其是α1a阻滞剂)作为第二活性成分,从而在治疗良性前列腺增生、慢性前列腺炎、慢性腹痛、泌尿疾病(例如尿石症等)方面显示出持续效果。在一个具体实施方式中,硬胶囊复合制剂可用于治疗良性前列腺增生。
在制备期间,硬胶囊复合制剂可以在单位制剂中包含度他雄胺和坦索罗辛作为复合制剂,并且可以包括其任何已知的内容物。例如,硬胶囊复合制剂可在单位制剂中包含约0.2mg至约1mg作为游离碱的度他雄胺和约0.1mg至约0.8mg作为游离碱的坦索罗辛。在一个具体实施方式中,硬胶囊复合制剂可包含约0.5mg度他雄胺游离碱作为独立的度他雄胺部分的活性成分,和约0.4mg盐酸坦索罗辛作为独立的坦索罗辛部分的活性成分。
本公开的另一方面提供固定剂量复合制剂,其是如下的单位剂量制剂:其包含独立的度他雄胺部分,该部分包含度他雄胺或其药学上可接受的盐;和独立的坦索罗辛部分,该部分包含坦索罗辛或其药学上可接受的盐,其中所述独立的度他雄胺部分每单位剂量包含量为约0.5mg的度他雄胺或其药学上可接受的盐,所述量是以度他雄胺的游离碱计算的,并且根据依照usp的溶出试验的桨法进行的溶出试验,所述度他雄胺在30分钟内的溶出度为约80%重量或更高,更具体地,所述度他雄胺在15分钟内的溶出度高于约85重量%,并且所述独立的坦索罗辛部分每单位剂量包含量为0.2mg或0.4mg的坦索罗辛或其药学上可接受的盐,所述量是以坦索罗辛的游离碱计算的,并且根据依照usp的溶出试验的桨法进行的溶出试验,所述坦索罗辛在2小时内的溶出度为34重量%或更低,所述坦索罗辛在3小时内的溶出度为约47重量%至68重量%,且所述坦索罗辛在8小时内的溶出度为约80%重量或更高。
此外,所述固定剂量复合制剂是胶囊复合制剂,其包含处于分离状态的独立的度他雄胺部分和独立的坦索罗辛部分,它们可以被填充到0至3号尺寸的胶囊中。
此外,所述固定剂量复合制剂是如下的制剂:其包含独立的度他雄胺部分,该部分包含含有度他雄胺、油和表面活性剂的自乳化乳剂;和独立的坦索罗辛部分,该部分包括含有缓释剂的固体制剂。
本公开的另一方面提供了制备根据本公开的一个方面的硬胶囊复合制剂的方法,所述方法包括:
通过混合度他雄胺或其药学上可接受的盐、油和表面活性剂来制备度他雄胺的自乳化乳剂;
制备度他雄胺的软胶囊,其包含所述度他雄胺的自乳化乳剂;
通过将坦索罗辛或其药学上可接受的盐与药学上可接受的添加剂一起粒化以产生坦索罗辛颗粒来制备坦索罗辛颗粒,或将所述颗粒压片为坦索罗辛片剂;和
用所述度他雄胺的软胶囊和所述坦索罗辛的颗粒或片剂填充空胶囊以获得一个硬胶囊,其包含所述度他雄胺的软胶囊和所述坦索罗辛的颗粒或片剂。
提供了制备根据本公开的一个方面的硬胶囊复合制剂的方法。
根据本公开的一个方面的硬胶囊复合制剂的描述也可以适用于制备所述硬胶囊复合制剂的方法的详细描述。
可以通过混合并搅拌度他雄胺、油和表面活性剂以均匀地溶解混合物而以液体形式制备度他雄胺的自乳化乳剂,并且根据需要,可以向其中进一步加入性质稳定剂和/或抗氧化剂,然后混合并搅拌。
可以通过根据常规药学制备方法用度他雄胺的自乳化乳剂填充软胶囊来制备包含度他雄胺的自乳化乳剂的度他雄胺软胶囊。
可根据制备颗粒或片剂的常规方法进行坦索罗辛颗粒或片剂的制备。为了制备颗粒或片剂,根据需要,该方法可以进一步包括根据常规包衣方法用包衣剂(例如缓释包衣剂或肠溶包衣剂)包被颗粒或片剂的过程。
[实施例]
在下文中,将参考以下实施例详细描述本公开。然而,这些实施例仅用于说明性目的,并且本公开的范围不旨在由其限制。
实施例1:制备硬胶囊复合制剂(1)
根据以下药方制备独立的度他雄胺部分和独立的坦索罗辛部分:
-独立的度他雄胺部分-
-独立的坦索罗辛部分-
通过下述来制备独立的度他雄胺部分:将度他雄胺溶解在甘油单酯油和甘油二酯油中,向其中加入所有其余组分,并溶解混合物以制备自乳化乳剂。将制备的自乳化乳剂填充到软胶囊中以制备度他雄胺软胶囊。详细地,根据制备包衣的常规方法,使用具有重量比为81:46:1的明胶:甘油:甘氨酸的胶囊基础材料来制备包衣组合物。接下来,根据常规填充方法,使用旋转式自动填充机将制备的自乳化乳剂填充成2圆形和0.65mm的带厚度,或者2卵形和0.75mm的带厚度,然后修整并干燥,以制备度他雄胺软胶囊制剂。图2(底部)示出了所制备的胶囊的照片。
通过下述来制备独立的坦索罗辛部分:将所有列出的盐酸坦索罗辛、微晶纤维素和羟丙甲纤维素以粉末形式混合,并使用通过对于每粒胶囊将18mg聚乙酸乙烯酯溶解在水中而制备的粘合剂溶液,以制备颗粒。接着,使用内包衣溶液来包被所制备的坦索罗辛颗粒,所述内包衣溶液是通过将聚维酮和丙二醇以及对于每粒胶囊的2mg聚乙酸乙烯酯溶解在水中而制备的;然后用外包衣溶液进一步包被,所述外包衣溶液是通过将甲基丙烯酸-丙烯酸乙酯共聚物和三乙酸甘油酯溶解在水中而制备的,从而制备盐酸坦索罗辛颗粒,向其中加入蔗糖硬脂酸酯并混合。
将所制备的度他雄胺软胶囊和坦索罗辛颗粒填充到1号尺寸的明胶硬胶囊(suheungco.,ltd.)中,从而制备包含0.5mg度他雄胺和0.4mg盐酸坦索罗辛的明胶硬胶囊复合制剂。图3(底部)示出了所制备的胶囊的照片。
实施例2:制备硬胶囊复合制剂(2)
以与实施例1相同的方式制备坦索罗辛颗粒,然后将其与9mg(5%)作为崩解剂的交聚维酮进一步混合,随后通过直径为6.5mm的圆形冲压机进行压片。将得到的坦索罗辛片剂和度他雄胺软胶囊填充到0号尺寸的明胶硬胶囊(suheungco.,ltd.)中,从而制备胶囊复合制剂。
实施例3:制备硬胶囊复合制剂(3)
以与实施例1相同的方式制备独立的度他雄胺部分,并通过以下药方制备独立的坦索罗辛部分:
-独立的坦索罗辛部分-
通过下述来制备独立的坦索罗辛部分:将所有列出的盐酸坦索罗辛、微晶纤维素、羟丙甲纤维素和6.0mg滑石以粉末形式混合,并使用通过将12.0mg甲基丙烯酸-丙烯酸乙酯共聚物溶解在水中而制备的粘合剂溶液,以制备颗粒。接着,使用肠溶衣溶液来包被所制备的坦索罗辛颗粒,所述肠溶衣溶液是通过将7.0mg甲基丙烯酸-丙烯酸乙酯共聚物、三乙酸甘油酯和3.0mg滑石溶解在水中而制备的,从而制备盐酸坦索罗辛颗粒。向其中加入蔗糖硬脂酸酯并与其混合以制备坦索罗辛颗粒。
将得到的坦索罗辛颗粒和实施例1中制备的度他雄胺软胶囊填充到1号尺寸的明胶硬胶囊(suheungco.,ltd.)中,从而制备包含0.5mg度他雄胺和0.4mg盐酸坦索罗辛的明胶硬胶囊复合制剂。
实施例4:制备硬胶囊复合制剂(4)
以与实施例1相同的方式制备包含0.5mg度他雄胺和0.4mg盐酸坦索罗辛的hpmc硬胶囊复合制剂,不同之处在于:使用1号尺寸的hpmc硬胶囊
对比例1:制备硬胶囊复合制剂(5)
使用可从美国glaxosmithkline商购的jalyn胶囊制剂作为对比例1。发现jalyn胶囊制剂的硬胶囊具有00号尺寸。图3(顶部)中示出了硬胶囊的照片,图2(顶部)中示出了存在于硬胶囊内部的度他雄胺软胶囊制剂。
实验实施例1:溶出试验
按照以下条件,对实施例1至4和对比例1的包含度他雄胺和坦索罗辛的硬胶囊复合制剂进行溶出试验。
<度他雄胺溶出条件>
根据美国药典(usp)的溶出试验的桨法,使用900ml含有1%(w/v)十六烷基三甲基溴化铵(ctab)的0.1n盐酸溶液进行溶出试验。在初始点以及试验开始后5分钟、10分钟、15分钟、30分钟、45分钟和60分钟时收集溶出试验样品,并对其在以下条件下进行液相色谱分析以计算度他雄胺的溶出度。
-柱:为其中内径为约4.6mm且长度为约15cm的不锈钢管填充有粒度为约3.5μm的用于液相色谱分析的苯基硅胶的柱(zorbaxsb-phenyl,agilentzorbax)
-检测器:uv分光光度计(测量波长:210nm)
-流速:1.0ml/min
-输入体积:100μl
-柱温:40℃
-流动相:乙腈与纯化水的混合溶液(60:40,v/v)
-溶出介质:含有1%(w/v)十六烷基三甲基溴化铵(ctab)的0.1n盐酸溶液
<坦索罗辛溶出条件>
根据usp的溶出试验的桨法,使用助沉物(sinker)和750ml酸性溶液以50rpm进行初始120分钟的溶出试验,然后通过向其中加入250ml缓冲试验溶液进一步进行溶出试验,直至试验开始后480分钟。作为样品,在初始点以及试验开始后的120分钟、180分钟、240分钟、360分钟和480分钟时收集10ml溶出试验溶液。对收集的样品在以下条件下进行液相色谱分析以计算坦索罗辛的溶出度。
-柱:为其中内径为约4.6mm且长度为约5cm的不锈钢管填充有粒度为约5μm的用于液相色谱的十八烷基甲硅烷基硅胶的柱(kromasileternity-5-c18,akzonobel)
-检测器:uv分光光度计(测量波长:225nm)
-流速:1.3ml/min
-输入体积:100μl
-柱温:30℃
-流动相:将8.7ml高氯酸和3.0g氢氧化钠溶解在1900ml水中,用氢氧化钠将溶液的ph调节至ph2.0,然后加入水至2000ml。将480ml乙腈加入1520ml该溶液中,将其用作流动相。
-溶出介质:酸性溶液-0.1n盐酸溶液
缓冲试验溶液-0.2m磷酸三钠(12水合物),ph6.8
度他雄胺溶出结果显示在下表1和图4中,坦索罗辛溶出结果显示在下表2和图5中。
[表1]
根据表1和图4,与对比例1和实施例4的hpmc胶囊复合制剂相比,实施例1、2和3的明胶胶囊复合制剂在30分钟之前显示出明显高的度他雄胺的初始溶出度;实施例1、2和3的坦索罗辛制剂之间的差异对度他雄胺的溶出影响不大。因此,预期根据本公开的具体实施方式的明胶硬胶囊复合制剂具有度他雄胺的速效性质。
[表2]
根据表2和图5,实施例3和对比例1的制剂由于药方不同而显示出高耐酸性,而实施例1和2的明胶胶囊复合制剂以及实施例4的hpmc胶囊复合制剂显示出类似的溶出结果。因此,证实了硬胶囊制剂的空胶囊的改变不影响独立的坦索罗辛部分的缓释溶出模式。
以上结果合起来表明:根据本公开的具体实施方式的明胶胶囊复合制剂可以获得度他雄胺的速效性质,这是由于速释型独立的度他雄胺部分的预期速释性质得以改善;但不影响坦索罗辛的功效,这是由于对缓释型独立的坦索罗辛部分没有影响。
已经参考本公开的优选实施方式描述了本公开。本公开所属领域的技术人员应理解,本公开可以以不同的具体形式实现而不改变其本质特征。因此,应该理解,上述实施方式不是限制性的,而是在所有方面都是说明性的。本公开的范围由所附权利要求限定,而不是由前面的描述限定,并且在其等同物的范围内的所有差异应被解释为包括在本公开中。
- 还没有人留言评论。精彩留言会获得点赞!