包含亲脂性抗炎剂的脂质纳米颗粒及其使用方法与流程
在设计药物载体中,安全和有效地将药物活性成分递送至靶组织和细胞是至关重要的。已知的药物载体,例如脂质体和脂质纳米颗粒(lnp),促进药物靶向性、位点特异性递送至靶向的组织和细胞,从而增强其生物利用度。然而,开发此类载体的主要障碍是与这些配制品的关键组分相关的免疫原性应答。
适于多核苷酸递送的脂质体载体通常包括能够通过细胞膜递送到靶细胞的细胞质中的阳离子脂质组分。已知这样的阳离子脂质体激活已用于疫苗中的免疫系统(peer,d.,advanceddrugdeliveryreviews[高级药物递送综述]64:1738-1748(2012))。相比之下,lnp被设计为在生理ph7.4下具有零净电荷,因此降低(尽管不完全消除)与带正电的粒子相关的免疫应答。虽然脂质体可以帮助将药物递送至靶组织和细胞,但它们也激活免疫系统,导致急性超敏反应,这增加了过敏性休克的风险。(kumar,v.等人,moleculartherapy-nucleicacids[分子治疗-核酸],3(e210):1-7(2014);abrams,mt等人,moleculartherapy[分子治疗],18(1):171-180(2010))。
尽管努力减少与脂质体和lnp相关的免疫原性应答,例如向lnp添加聚乙二醇屏障以避免被单核吞噬细胞系统识别以及使用修饰的sirna以最小化免疫刺激,但它们仍然引发免疫应答,因此限制了它们作为治疗性替代方案的有效性。(kumar,v.等人,2014,同上)。还研究了在给予脂质体或lnp之前共同给予抗炎药物,但结果有限。(tao,w.等人,moleculartherapy[分子疗法],19(3):567-575(2011);abrams等人(2010),同上)。在给予lnp201(一种脂质体构建体)前一小时用地塞米松预处理,该预处理部分抑制炎性mrna,但不消除炎症效应。(abrams等人(2010),同上)。在lnp05-ssbsirna或lnp05-apo5sirna之前用各种抗炎药预处理的大鼠中发现了类似的结果。(tao,w.等人(2011),同上)。
lnp的免疫刺激作用继续阻碍其用于安全有效地递送药物。因此,需要开发具有增加的治疗窗口的有效lnp递送系统,这些有效lnp递送系统不会引发炎症应答。
技术实现要素:
该说明书部分地披露了包含至少一种亲脂性抗炎剂的抗炎脂质纳米颗粒。在一个实施例中,披露了抗炎脂质纳米颗粒,其包含脂质相和至少一种亲脂性抗炎剂。在另一个实施例中,披露了抗炎脂质纳米颗粒,其进一步包含至少一种核酸区段。
在另一个实施例中,披露了包含多种抗炎脂质纳米颗粒的药物组合物,所述抗炎脂质纳米颗粒包含脂质相、至少一种亲脂性抗炎剂,以及药学上可接受的载体、稀释剂或赋形剂。在另一个实施例中,披露了包含多种抗炎脂质纳米颗粒的药物组合物,所述抗炎脂质纳米颗粒包含脂质相、至少一种亲脂性抗炎剂、和至少一种核酸区段,以及药学上可接受的载体、稀释剂或赋形剂。
还披露了将包含多种抗炎脂质纳米颗粒的药物组合物给予对其有需要的受试者的方法。
在另一个实施例中,披露了一种将至少一种核酸区段递送至靶细胞的方法,所述方法包括使细胞与包含多种抗炎脂质纳米颗粒和治疗有效量的至少一种核酸区段的药物组合物接触。
在另一个实施例中,披露了一种向对其有需要的受试者递送至少一种核酸区段的方法,所述方法包括给予所述受试者包含多种抗炎脂质纳米颗粒和治疗有效量的至少一种核酸区段的药物组合物。
还披露了一种治疗患有疾病或失调的受试者的方法,所述方法包括给予受试者包含多种抗炎脂质纳米颗粒和治疗有效量的至少一种核酸区段的药物组合物。
在另一个实施例中,披露了抑制与非抗炎lnp给药相关的免疫应答的方法,所述方法包括给予受试者包含本文披露的多种抗炎脂质纳米颗粒的药物组合物。抑制免疫应答的方法包括抑制至少一种生物标志物的表达或活性或免疫应答的症状,例如:(a)抑制促炎性标志物的表达或活性;(b)减轻炎症(例如水肿);和(c)减少与炎症或免疫应答有关的血浆触珠蛋白的产生。
在又另一个实施例中,披露了用于调节对其有需要的受试者的靶细胞中蛋白质或肽表达的方法,所述方法包括给予有效量的药物组合物,所述药物组合物包含本文披露的多种抗炎脂质纳米颗粒和治疗有效量的至少一种核酸区段。
在另一个实施例中,披露了用于制备抗炎脂质纳米颗粒的方法。在一个实施例中,披露了一种用于制备抗炎脂质纳米颗粒的方法,所述方法包括:
a)提供至少一种任选地包含至少一种核酸区段的水溶液;
b)提供至少一种包含至少一种亲脂性抗炎剂的有机溶液;
c)将至少一种水溶液与至少一种有机溶液混合以产生含有多种脂质纳米颗粒的脂质纳米颗粒溶液。
具体实施方式
附图说明
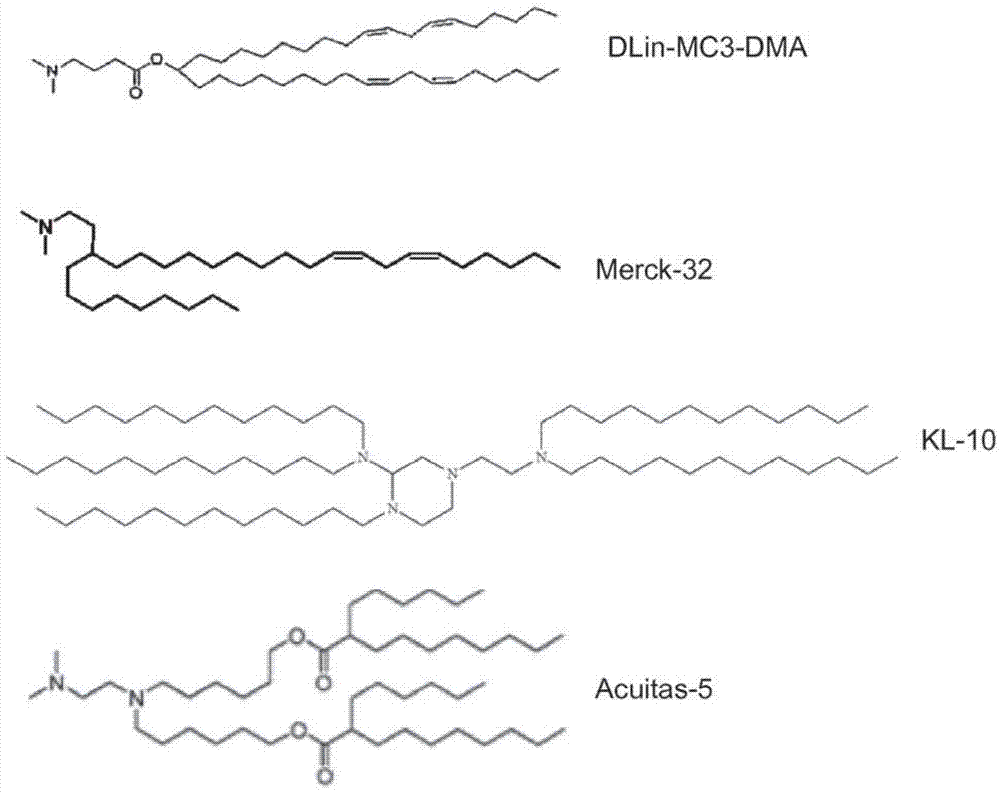
图1a说明了存在于抗炎脂质纳米颗粒中的可电离的脂质组分的化学结构。
图1b说明了罗氟奈德和代表性罗氟奈德前药的化学结构以及使用acdchemsketch2014的计算的辛醇-水对数(分配系数)。
图1c说明了布地奈德和代表性布地奈德前药的化学结构以及使用acdchemsketch2014的计算的辛醇-水对数(分配系数)。
图2a-d说明了(a):给药后24小时的水肿评分;(b):给药后24小时的血浆触珠蛋白浓度;(c):给药后8小时和24小时的血浆细胞因子/趋化因子浓度;和(d)皮下给予pbs(磷酸盐缓冲液,ph7.4)、基于dlin-mc3-dma的lnp(不含与含罗氟奈德棕榈酸酯(r-c16))之后,mrna1蛋白浓度与时间。
图3a-c说明了(a):给药后24小时的水肿评分;(b):给药后24小时的血浆触珠蛋白浓度;(c):皮下给予pbs(磷酸盐缓冲液,ph7.4)、基于dlin-mc3-dma的lnp(不含与含罗氟奈德棕榈酸酯(r-c16))/mrna1:1w/w、1:10w/w和1:30w/w之后,mrna1蛋白浓度与时间。
图4a-c说明了(a):给药后24、48和72小时的水肿评分;(b):血浆触珠蛋白浓度与时间;(c):皮下给予含有罗氟奈德棕榈酸酯(r-c16)或罗氟奈德的lnp之后,mrna1蛋白浓度与时间。
图5说明了皮下给予含有罗氟奈德棕榈酸酯(r-c16,图a)或罗氟奈德(图b)的lnp之后,罗氟奈德血浆浓度与时间。
图6a-c说明了(a):水肿评分;(b):给药后24小时的血浆触珠蛋白浓度;(c):皮下给予含有不同脂肪酸链长的罗氟奈德前药的lnp之后,mrna1蛋白浓度与时间,这些不同脂肪酸链长的罗氟奈德前药为:罗氟奈德戊酸酯(c5)、罗氟奈德肉豆蔻酸酯(c14)、罗氟奈德棕榈酸酯(c16)和罗氟奈德硬脂酸酯(c18)。
图7a-c说明了(a):给药后24小时的水肿评分;(b)给药后24小时的血浆触珠蛋白浓度;(c)皮下给予dlin-mc3-dma和merck-32lnp与dlin-mc3/罗氟奈德棕榈酸酯(r-c16)和merck-32/罗氟奈德棕榈酸酯(r-c16)lnp之后,mrna1蛋白浓度与时间。
图8a-c说明了(a):相比较不同剂量的mrna1,给药后24小时的水肿评分;(b)给药后24小时的血浆触珠蛋白浓度;(c)相比较不同剂量的mrna1,皮下给予dlin-mc3-dma和merck-32(含罗氟奈德肉豆蔻酸酯,r-c14)lnp之后,mrna1蛋白浓度与时间。
图9a-c说明了(a):相比较不同剂量的mrna1,给药后24小时的水肿评分;(b)给药后24小时的血浆触珠蛋白浓度;(c)相比较不同剂量的mrna1,皮下给予dlin-mc3-dma、kl10(不含/含r-c14)和acuitas-5(不含/含r-c14)lnp之后,mrna1蛋白浓度与时间。
图10a-g说明了(a):水肿评分;(b):给药后24小时的血浆触珠蛋白浓度;(c):给药后7小时和24小时的血浆il-6浓度;(d):给药后7小时和24小时的血浆kc浓度;(e)给药后7小时和24小时的血浆ip-10浓度;(f):给药后7小时和24小时的血浆mcp-1浓度;(g)皮下给予含有不同脂肪酸链长的布地奈德前药的lnp之后,mrna1蛋白浓度与时间,这些不同脂肪酸链长的布地奈德前药为:布地奈德肉豆蔻酸酯(c14)、布地奈德棕榈酸酯(c16)或布地奈德油酸酯(c18:1)。
抗炎脂质纳米颗粒
根据本披露,抗炎脂质纳米颗粒具有电子致密的纳米结构核心,该纳米结构核心通过将含有脂质的乙醇溶液与含有一种或多种核酸区段的水溶液进行微流体混合而产生。应理解,本文披露的抗炎脂质纳米颗粒不具有超过50%(按体积计)的连续水性区域,并且因此不包括常规脂质体,例如单层囊泡等。
在一个方面,抗炎脂质纳米颗粒包含脂质相和至少一种亲脂性抗炎剂。脂质纳米颗粒可进一步包含至少一种核酸区段。
本披露的一个方面涉及在直径方面平均粒径为约200nm或更小的抗炎脂质纳米颗粒,例如,小于或等于约100nm,或者,例如,小于或等于约75nm。在本披露的至少一个实施例中,抗炎脂质纳米颗粒的平均粒径的范围为从约50nm至约75nm,例如约60nm至约65nm,例如约64nm。
在某些实施例中,抗炎脂质纳米颗粒具有约80%或更高,例如高于约90%,例如范围从约95%-100%,例如约99%的核酸区段的包封效率(%ee)。如本文所使用的,术语“包封效率”是指抗炎脂质纳米颗粒中包封的核酸区段与通过使用洗涤剂(例如tritonx-100)裂解脂质纳米颗粒而测量的药物组合物中的总核酸区段含量的比率。(参见例如,leung等人(2012),同上)。
脂质相
本文披露的抗炎脂质纳米颗粒的脂质相可以由常规纳米颗粒技术中使用的任何材料构建,例如,可电离的脂质、中性脂质、固醇和聚合物缀合的脂质,只要纳米颗粒的净电荷约为零。
可电离的脂质的非限制性实例包括,例如,在生理ph下含有正电荷的脂质,例如1,2-二亚油基氧基-3-二甲基氨基丙烷(dlin-dma)、二亚油基甲基-4-二甲基氨基丁酸酯(dlin-mc3-dma)(参见例如美国专利号8,158,601)、2-二亚油基-4-二甲基氨基乙基-[1,3]-二氧戊环(dlin-kc2-dma)、merck-32(参见例如wo2012/018754)、acuitas-5(参见例如wo2015/199952)、kl-10(参见例如美国专利申请公开2012/0295832)、c12-200(参见例如love,kt等人,pnas,107:1864(2009))等。可电离的脂质可以相对于抗炎脂质纳米颗粒中存在的总脂质,以从约5%至约90%的范围、例如从约10%至约80%、例如从约25%至约75%、例如从约40%至约60%、例如约50%摩尔百分比的量存在。
中性脂质在生理ph下具有零净电荷。中性脂质的非限制性实例包括在生理ph下以不带电荷形式或中性两性离子形式存在的那些脂质,例如二硬脂酰磷脂酰胆碱(dspc)、二油酰磷脂酰乙醇胺(dope)、二棕榈酰磷脂酰胆碱(dppc)、二肉豆蔻酰磷脂酰胆碱(dmpc)等。中性脂质可以相对于抗炎脂质纳米颗粒中存在的总脂质,以从约1%至约50%的范围、例如从约5%至约20%、例如从约7.5%至约12.5%、例如约10%摩尔百分比的量存在。
固醇的非限制性实例包括胆固醇等。固醇可以相对于抗炎脂质纳米颗粒中存在的总脂质,以从约10%至约90%的范围、例如从约20%至约50%、例如从约35%-45%、例如约38.5%摩尔百分比的量存在。
聚合物缀合的脂质包含脂质部分和聚合物部分,例如包含脂质部分和聚乙二醇部分的聚乙二醇化脂质。非限制性实例包括二肉豆蔻酰磷脂酰乙醇胺-聚(乙二醇)2000(dmpe-peg2000)、dppe-peg2000、dmg-peg2000、dpg-peg2000、peg2000-c-domg、peg2000-c-dopg等。可以使用的聚(乙二醇)的分子量的范围可以为从约500至约10,000da,或约1,000至约5,000da。
聚合物缀合的脂质可以相对于抗炎脂质纳米颗粒中存在的总脂质,以从约0%至约20%的范围、例如从约0.5%至约5%、例如从约1%至约2%、例如约1.5%摩尔百分比的量存在。
在本披露的至少一个实施例中,抗炎脂质纳米颗粒可以通过组合多种脂质组分来制备。例如,抗炎脂质纳米颗粒可以相对于存在的总脂质,以50:40-xpeg脂质:10:xpeg脂质的摩尔比组合可电离的脂质、固醇、中性脂质和聚合物缀合的脂质来制备。例如,抗炎脂质纳米颗粒能以50:37:10:3(mol/mol)的摩尔比,或者例如50:38.5:10:1.5(mol/mol)的摩尔比,或者例如50:39.5:10:0.5(mol/mol)的摩尔比,或者50:39.75:10:0.25(mol/mol)的摩尔比组合可电离的脂质、固醇、中性脂质和聚合物缀合的脂质来制备。
在另一个实施例中,脂质纳米颗粒可以使用可电离的脂质(例如dlin-dma、dlin-kc2-dma、dlin-mc3-dma、merck-32、kl10或acuitas-5)、固醇(例如胆固醇)、中性脂质(例如dspc)和聚合物缀合的脂质(例如dmpe-peg2000)以相对于存在的总脂质约为50:38.5:10:1.5(mol/mol)的摩尔比来制备。又另一个非限制性实例是如下抗炎脂质纳米颗粒,其包含:相对于存在的总脂质,摩尔比约为47.7:36.8:12.5:3(mol/mol)的可电离的脂质(例如dlin-dma、dlin-kc2-dma、dlin-mc3-dma、merck-32、kl10或acuitas-5)、固醇(例如胆固醇)、中性脂质(例如dspc)和聚合物缀合的脂质(例如dmpe-peg2000)。另一个非限制性实例是如下抗炎脂质纳米颗粒,其包含:相对于存在的总脂质,摩尔比约为52.4:40.4:6.4:0.8(mol/mol)的可电离的脂质(例如dlin-dma、dlin-kc2-dma、dlin-mc3-dma、merck-32、kl10或acuitas-5)、固醇(例如胆固醇)、中性脂质(例如dspc)和聚合物缀合的脂质(例如dmpe-peg2000)。在另一个实施例中,非限制性实例是如下抗炎脂质纳米颗粒,其包含:相对于存在的总脂质,摩尔比约为53.5:41.2:4.6:0.7(mol/mol)的可电离的脂质(例如dlin-dma、dlin-kc2-dma、dlin-mc3-dma、merck-32、kl10或acuitas-5)、固醇(例如胆固醇)、中性脂质(例如dspc)和聚合物缀合的脂质(例如dmpe-peg2000)。另一个非限制性实例是如下抗炎脂质纳米颗粒,其包含:相对于存在的总脂质,摩尔比约为30:50:19:1(mol/mol)的可电离的脂质(例如c12-200)、固醇(例如胆固醇)、中性脂质(例如dspc)和聚合物缀合的脂质(例如dmpe-peg2000)。
构成抗炎脂质纳米颗粒的可电离的脂质、中性脂质、固醇和/或聚合物缀合的脂质的选择,以及这些脂质彼此的相对摩尔比,可以通过所选择的一种或多种脂质的特征、预期靶细胞的性质、以及待递送的核酸(例如像mrna)的特征来确定。例如,在某些实施例中,抗炎脂质纳米颗粒中可电离的脂质的摩尔百分比可以大于约10%、大于约20%、大于约30%、大于约40%、大于约50%、大于约60%、或大于约70%,相对于存在的总脂质。抗炎脂质纳米颗粒中中性脂质的摩尔百分比可以大于约5%、大于约10%、大于约20%、大于约30%、或大于约40%,相对于存在的总脂质。抗炎脂质纳米颗粒中固醇的摩尔百分比可以大于约10%、大于约20%、大于约30%、或大于约40%,相对于存在的总脂质。抗炎脂质纳米颗粒中聚合物缀合的脂质的摩尔百分比可以大于约0.25%,例如大于约1%、大于约1.5%、大于约2%、大于约5%、或大于约10%,相对于存在的总脂质。
根据本披露,抗炎脂质纳米颗粒可包含所需的任何有用取向的可电离的脂质、中性脂质、固醇和/或聚合物缀合的脂质中的每一种。例如,纳米颗粒的核心可包含可电离的脂质和固醇,并且包含中性脂质和/或聚合物缀合的脂质的一个或多个层可随后包围该核心。例如,根据一个实施例,抗炎脂质纳米颗粒的核心可包含如下核心(其包含任何特定比例的可电离的脂质(例如,dlin-mc3-dma)和固醇(例如,胆固醇)),其被任何特定厚度的中性脂质单层(例如,dspc)包围,其进一步被任何特定厚度的外部聚合物缀合的脂质单层包围。在这样的实例中,根据预期靶细胞的性质和待递送的核酸(例如像mrna)的特征,可将亲脂性抗炎剂和核酸区段掺入核心或后续层中的任何一个中。核心和外层可以进一步包含通常掺入本领域已知的脂质纳米颗粒中的其他组分。
此外,可以选择构成抗炎脂质纳米颗粒的可电离的脂质、中性脂质、固醇和/或聚合物缀合的脂质的摩尔百分比,以提供整个脂质纳米颗粒的特定物理参数,例如一种或多种脂质的表面积。例如,可以选择构成抗炎脂质纳米颗粒的可电离的脂质、中性脂质、固醇和/或聚合物缀合的脂质的摩尔百分比以产生每中性脂质(例如dspc)的表面积。作为非限制性实例,可确定可电离的脂质、中性脂质、固醇和/或聚合物缀合的脂质的摩尔百分比以产生每dspc的表面积为约1.0nm2至约2.0nm2,例如约1.2nm2。
亲脂性抗炎剂
根据本披露,抗炎脂质纳米颗粒进一步包含治疗有效量的至少一种亲脂性抗炎剂。
术语“炎症”和“炎性”是指涉及免疫系统上调的生物应答,所述生物应答可包括与炎症或免疫应答相关的蛋白质活性的增加(例如,促炎标志物如趋化因子和细胞因子,血浆触珠蛋白的产生)和炎症症状(例如,疼痛、发热、发红和/或水肿)。在一些实施例中,该炎症是急性的。在一些实施例中,该炎症是慢性的。
术语“抗炎剂”包括在受试者中引发生物或医学应答的药剂,这些药剂减少炎症(急性或慢性)或下调免疫应答,例如,通过减少或抑制与炎症或免疫应答相关的酶或蛋白质活性(例如抑制促炎标志物或减少血浆触珠蛋白的产生);通过改善炎症或免疫应答的一种或多种症状(例如,疼痛、发红、发热或水肿);或通过减缓或延迟炎症过程或免疫应答。
术语“亲脂性抗炎剂”是指显示logp值为约5.0或更高的抗炎剂。术语“logp”是指确定分配系数p的对数基数-10函数;其中p是有机相中化合物浓度相对于水相中相同化合物浓度的相对比例。抗炎剂的亲脂性可以通过将抗炎剂的亲水部分转化为亲脂部分来实现,例如通过将羧基基团、氨基基团、羟基基团或其他亲水基团转化为烷基和烷基酯、酸酯、芳基和芳基酯、杂芳基酯、酰胺基团或其他亲脂基团。本文的亲脂性抗炎剂表现出约5或更高的logp值。如上所述,可以合成亲脂性抗炎剂以通过将抗炎剂改变为更具亲脂性来增加其logp值。抗炎剂可以通过已知技术制备,例如亲本药物分子上存在的任何一种或多种亲水基团的酯化或烷基化。(参见,例如,waring,mj,expertopin.drugdiscov.[关于药物发现的专家意见],5(3):235-248(2010))。
在至少一种亲脂性抗炎剂之前的术语“治疗有效量”是指抑制和/或改善与非抗炎性lnp给药相关的任何或所有生物标志物或炎症应答症状的抗炎剂的量。
术语“非抗炎性lnp”是指不包含抗炎剂的脂质纳米颗粒。
已知的抗炎剂包括但不限于皮质类固醇(例如,罗氟奈德、布地奈德等)和细胞因子抑制剂(例如,jak1、jak2、jak3、trl1-9、nf-κb、irak-1、irak-2、irak-4、irf-3、tbk-1、traf-3、p38、ikkε等)等。
在本披露的至少一个实施例中,亲脂性抗炎剂是罗氟奈德前药。罗氟奈德前药的实例包括但不限于罗氟奈德戊酸酯(c5)、罗氟奈德己酸酯(c6)、罗氟奈德辛酸酯(c8)、罗氟奈德癸酸酯(c10)、罗氟奈德月桂酸酯(c12)、罗氟奈德肉豆蔻酸酯(c14)、罗氟奈德棕榈酸酯(c16)或罗氟奈德硬脂酸酯(c18)。
在另一个实施例中,亲脂性抗炎剂是布地奈德前药。非限制性实例包括布地奈德肉豆蔻酸酯(c14)、布地奈德棕榈酸酯(c16)、布地奈德硬脂酸酯(c18)、布地奈德油酸酯(c18:1)和布地奈德亚油酸酯(c18:2)。
亲脂性抗炎剂可以相对于抗炎脂质纳米颗粒的总重量以约0.001%至约50%(按重量计)的量存在。在一些实施例中,亲脂性抗炎剂可以相对于抗炎脂质纳米颗粒的总重量以约0.5%至约20%的范围、例如约1%至约10%、例如约8%(按重量计)的量存在。
核酸区段
根据本披露,抗炎脂质纳米颗粒可以进一步包含治疗有效量的核酸区段,该核酸区段可以结合在抗炎脂质纳米颗粒的表面上,和/或包封在相同的抗炎脂质纳米颗粒内。
术语“核酸区段”应理解为意指选自反义寡核苷酸、dna、mrna、sirna、cas9-指导rna复合物或其组合的任何一种或多种核酸区段。本文的核酸区段可以是野生型或修饰的。在至少一个实施例中,抗炎脂质纳米颗粒可包含多个不同的核酸区段。在又另一个实施例中,至少一种核酸区段(野生型或修饰的)编码目的多肽。
在至少一种核酸区段之前的术语“治疗有效量”是指足以调节靶组织和/或细胞类型中蛋白质表达的核酸的量。在一些实施例中,至少一种核酸区段的治疗有效量是足以治疗与由该至少一种核酸区段表达的蛋白质相关的疾病或失调的量。
在至少一个实施例中,总脂质相与核酸区段的重量比的范围为从约40:1至约1:1,例如约10:1。这对应于可电离的脂质与核酸单体的近似摩尔比为约3:1。在又另一个实例中,总脂质相与核酸区段的重量比的范围为从约30:1至约1:1,例如约17:1,其对应于可电离的脂质与核酸单体的近似摩尔比为约6:1。然而,脂质相和/或脂质相组分与核酸单体的相对摩尔比可以通过预期靶细胞的性质和核酸区段的特征来确定,因此,不限于上述确认的实施例范围。
在另一个实施例中,抗炎脂质纳米颗粒包含重量比范围为约10:1(亲脂性抗炎剂比核酸区段)至约1:100的亲脂性抗炎剂和核酸区段。在又另一个实施例中,脂质纳米颗粒中存在的核酸区段与总脂质的重量比的范围为从约2:1至约1:50,例如约1:1至约1:10。
组合物
本披露的药物组合物包含本文披露的抗炎脂质纳米颗粒,治疗有效量的至少一种抗炎剂和治疗有效量的至少一种核酸区段,和/或一种或多种药学上可接受的赋形剂、载体或稀释剂。如本文所使用的,术语“药学上可接受的赋形剂、载体或稀释剂”包括在合理的医学判断的范围,适合用于与人类和动物的组织接触而不产生过度毒性、刺激、过敏反应、或其他问题或并发症,同时具有相称的合理受益/风险比的那些化合物、材料、组合物、和/或剂型。在某些实施例中,药物组合物可进一步包含至少一种组织靶向剂,例如肽缀合物,例如dspe-peg3400-crppr或dspe-crppr等。
这些药物组合物可以处于适合于肠胃外给予的形式。取决于治疗应用,对于体内给药,包含本文披露的抗炎脂质纳米颗粒的组合物可以通过静脉内、皮内、肌内、皮下、舌下、瘤内、心内、通过气管内滴注、支气管滴注和/或吸入给予对其有需要的受试者。
这些药物组合物可以处于无菌的可注射水性或悬浮液形式,其可以根据已知的程序配制。无菌可注射制剂还可以是于无毒肠胃外可接受的缓冲液中的无菌可注射悬浮液。在其他实施例中,可以将药物组合物冻干,得到干粉形式,其中稍后可以根据需要重构干粉以进行给药。干粉组合物可进一步包含膨胀剂,例如蔗糖或海藻糖。
可以通过使用惰性气体来雾化药物液体组合物。雾化悬浮液可以从雾化装置直接呼吸,或者可以将该雾化装置连接于面罩,或者连接于间歇性正压呼吸机。此外,固体剂型也可以使用干粉吸入器经由吸入给药。悬浮液或干粉药物组合物可以从以适当方式递送药物组合物的装置口服或经鼻给予。
结合一种或多种赋形剂以产生单一剂型的核酸区段的量将必然变化,这取决于该治疗的受试者和具体给药途径。对于给药途径和给药方案的进一步的信息,读者可参考comprehensivemedicinalchemistry[综合药物化学数据库](corwinhansch;编委会主席)的第5卷第25.3章,培格曼出版社(pergamonpress)1990。
本文进一步提供了包含药物组合物的药物试剂盒,所述药物组合物包含如本文所披露的治疗有效量的至少一种抗炎剂和治疗有效量的至少一种核酸区段。此类试剂盒可进一步包含各种常规药物试剂盒组分,例如包含药学上可接受的佐剂、稀释剂或载体的容器,以及本领域技术人员显而易见的其他容器。作为插入物或作为标记指示有待给予的组分的量的说明书、给药指南和/或混合组分用的指南也可以被包括在试剂盒中。
方法
在一个实施例中,本披露提供了向对其有需要的受试者给予包含多种抗炎脂质纳米颗粒的药物组合物的方法。
术语“受试者”包括温血哺乳类动物,例如,灵长类、牛、猪、羊、狗、猫、兔、大鼠和小鼠。在一些实施例中,该受试者是灵长类,例如,人类。在一些实施例中,该受试者需要治疗(例如,该受试者将从生物学或医学治疗上收益)。
本文披露的抗炎脂质纳米颗粒可以进一步用作选择性递送例如核酸区段(例如反义寡核苷酸、dna、mrna、sirna、cas9-指导rna复合物)至靶细胞和组织的平台。因此,在一个实施例中,是将至少一种核酸区段递送至细胞的方法,所述方法包括在体外或体内使细胞与包含多种抗炎脂质纳米颗粒和治疗有效量的至少一种核酸区段的药物组合物接触。在一些实施例中,核酸区段调节表达,例如,通过增加或减少表达,或通过上调或下调多肽的表达。
另一个实施例提供了向对其有需要的受试者递送治疗有效量的至少一种核酸区段的方法,所述方法包括给予所述受试者包含多种抗炎脂质纳米颗粒和治疗有效量的至少一种核酸区段的药物组合物。
包含多种抗炎脂质纳米颗粒和本文披露的至少一种核酸区段的药物组合物可用于治疗多种失调和疾病,所述失调和疾病的特征在于受试者中多肽的低表达、受试者中多肽的过表达、和/或受试者中多肽的存在/不存在。因此,还披露了治疗患有疾病或失调的受试者的方法,所述方法包括给予受试者包含多种抗炎脂质纳米颗粒和治疗有效量的至少一种核酸区段的药物组合物。
进一步披露了抑制与非抗炎lnp给药相关的免疫应答的方法,所述方法包括给予对其有需要的受试者包含多种抗炎脂质纳米颗粒的药物组合物,所述抗炎脂质纳米颗粒包含治疗有效量的至少一种亲脂性抗炎剂。例如,根据本披露的抗炎脂质纳米颗粒可以抑制和/或改善至少一种生物标志物的表达或活性或免疫应答的症状。在至少一个实施例中,本文披露的方法减少和/或抑制注射部位的炎症(如通过水肿评分确定),减少和/或抑制血浆触珠蛋白的产生,并减少和/或抑制促炎标志物(例如,细胞因子、趋化因子)的量。因此,本披露包括用于抑制促炎标志物的表达或活性、减少炎症(例如,水肿)和减少血浆触珠蛋白的产生的方法,所述方法包括给予包含多种抗炎脂质纳米颗粒的药物组合物,所述抗炎脂质纳米颗粒包含治疗有效量的至少一种亲脂性抗炎剂和治疗有效量的至少一种核酸区段。
在至少一个实施例中,观察到水肿的减轻或抑制。在另一个实施例中,观察到血浆触珠蛋白水平的降低或抑制。在又另一个实施例中,观察到血浆炎性标志物的减少或抑制。在任何一种披露的方法中,包封的核酸区段的靶活性不受抑制。例如,披露了用于增加细胞中蛋白质表达的方法,所述方法包括给予包含多种本文披露的抗炎脂质纳米颗粒的药物组合物,所述抗炎脂质纳米颗粒包含治疗有效量的至少一种抗炎剂和治疗有效量的至少一种核酸区段。
促炎标志物的非限制性实例包括细胞因子和趋化因子,例如il-1、il-2、il-3、il-4、il-5、il-6、il-8、il-9、ip-10、il-12(p40)、il-12(p70)、il-13、il-15、il-16、il-17、外毒素、碱性fgf、g-csf、gm-csf、lif、mig、mip-1、mip-2、mcp-1、inf-γ、infα2、rantes、tnfα和il-1β。例如,本文披露的方法减少和/或抑制水肿,以及减少和/或抑制血浆触珠蛋白的产生,和/或减少和/或抑制与非抗炎lnp给药相关的促炎标志物的产生,以大于对照水平的百分比。
如本文所使用的,术语“减少和/或抑制”是指与对照水平相比大约10%、20%、30%、40%、50%、60%、70%、80%、90%或更高的变化(阳性或阴性)。如本文所使用的,术语“对照水平”表示未处理的样品或受试者,或不含披露的亲脂性抗炎剂的脂质纳米颗粒处理的样品或受试者。举例来说,对照水平是在不存在亲脂性抗炎剂的情况下对照样品中的表达或活性水平。
例如,本文披露的方法减少和/或抑制il-6、il-8、kc、ip-10和mcp-1的产生约80%或更高(例如约85%或更高)的百分比,所述方法包括给予对其有需要的受试者包含多种抗炎脂质纳米颗粒的药物组合物。
本文还披露了用于抑制与非抗炎lnp给药相关的注射部位的水肿的方法,其中所述方法包括给予对其有需要的受试者包含多种抗炎脂质纳米颗粒的药物组合物。例如,本文披露的方法在注射部位基本上不产生水肿。如本文所使用的,术语“基本上没有水肿”应理解为意指无肉眼明显可见的肿胀和/或发红。
还披露了用于抑制与非抗炎lnp给药相关的血浆触珠蛋白的产生的方法,所述方法包括给予对其有需要的受试者包含多种抗炎脂质纳米颗粒的药物组合物。根据至少一个实施例,本文的方法抑制血浆触珠蛋白的产生约60%或更高(例如约80%或更高)的百分比,所述方法包括给予对其有需要的受试者包含多种抗炎脂质纳米颗粒的药物组合物。在另一个实施例中,本文的方法包括给予对其有需要的受试者包含多种抗炎脂质纳米颗粒的药物组合物,同时维持正常的血浆触珠蛋白水平。如本文所使用的,术语“正常血浆触珠蛋白水平”包括范围为3200ng/ml-65000ng/ml的血浆触珠蛋白水平。
进一步披露了增加细胞中蛋白质表达的方法,所述方法包括给予对其有需要的受试者包含本文披露的多种抗炎脂质纳米颗粒的药物组合物。在至少一个实施例中,蛋白质表达可以增加约2小时至24小时。在另一个实施例中,蛋白质表达可以增加约3小时至72小时。
实例
本披露的多个方面可以通过参考以下非限制性实例进一步定义,这些实例详细描述了本披露的脂质纳米颗粒和组合物的制备以及用于使用本披露的脂质纳米颗粒的方法。本领域普通技术人员应当清楚的是在不背离本披露的范围的情况下,可以对材料和方法二者做出许多修改。
制备含有mrna的lnp
通过混合溶于milliq-水中的mrna1,100mm柠檬酸盐缓冲液(ph3)和milliq-水,制备mrna1在柠檬酸盐缓冲液中的溶液,以给出50mm柠檬酸盐溶液。用四种不同的脂质组分制备乙醇中的脂质溶液(99.5%):可电离的脂质(dlin-mc3-dma、merck-32、kl10或acuitas-5);胆固醇(西格玛-奥德里奇公司(sigma-aldrich));dspc(二硬脂酰磷酯酰胆碱,阿凡提极性脂质公司(avantipolarlipids));和dmpe-peg2000(二肉豆蔻酰磷脂酰乙醇胺-聚(乙二醇)2000,nof公司)。可电离的脂质的化学结构如图1a所示。在所有实验中,脂质的总浓度为12.5mm。通过将前药添加到脂质乙醇溶液中来制备含有亲脂性抗炎剂前药的脂质纳米颗粒。罗氟奈德和不同前药的化学结构缩写为r-c5、r-c14。基于脂肪酸链长度的r-c16和r-c18显示在图1b中。基于脂肪酸链长度缩写为b-c14、b-c16和b-c18:1的布地奈德和不同前药的化学结构如图1c所示。
将mrna和脂质溶液在nanoassemblr(精度纳米系统公司(precisionnanosystems),温哥华(vancouver),不列颠哥伦比亚省(bc),加拿大)微流体混合系统中以aq:etoh=3:1的混合比和12ml/min的恒定流速混合。在混合时,可电离的脂质上的氮原子与mrna链上的磷原子之比等于3.1。
弃去制备的第一个0.2-0.35ml和最后0.05-0.1ml的lnp悬浮液,同时收集剩余体积作为样品级分。从样品级分中将25μl样品注入975μl10mm磷酸盐缓冲液(ph7.4)中并用于测量malvernzetasizer(zetasizernanozs,马尔文仪器有限公司(malverninstrumentsltd.),韦斯特伯鲁(westborough),马萨诸塞州,美国)上的强度平均粒径(“透析前粒径”)和多分散指数(pdi)。剩余的样品体积立即转移到slide-a-lyzerg2透析盒(10000mwco,赛默飞世尔科技公司(thermofisherscientificinc.)),并在4℃对pbs(ph7.4)透析过夜。pbs缓冲液的体积为样品级分体积的500-1000倍。然后收集样品级分,并从该体积中将25μl注射到975μl10mm磷酸盐缓冲液(ph7.4)中,并再次测量粒径(透析后粒径)以及pdi。
使用破坏lnp的triton-x100,通过quant-itribogreen测定试剂盒(赛默飞世尔科技公司(thermofisherscientificinc.))测量最终mrna浓度和包封效率百分比(%ee)。
体内小鼠实验
给予不同组的5只小鼠(雌性,年龄约12周,crl:cd1(icr),查尔斯河实验室(charlesriver))pbs(阴性对照)或配制在脂质纳米颗粒中的mrna1。在给药之前,用5%异氟醚轻度麻醉小鼠并给注射区域剃毛。然后将配制品在肩胛内区域皮下注射(5ml/kg或0.3mgmrna/kg)给不同组的小鼠。收集给药后的血液样品并通过离心制备血浆。将等分试样的血浆转移到冷冻管(0.5mlu形聚丙烯冷冻管(带盖的sarstedtmicrotube,参考号72.730)中并冷冻储存直至定量触珠蛋白、细胞因子/趋化因子和mrna1蛋白浓度。在一些研究中,还对血浆样品中的亲脂性抗炎剂进行了定量。在给药后24小时,通过在注射区域轻轻按压手指以确定水肿来评估炎症应答的临床体征,并在不同小鼠中通过目测判断为水肿或无水肿。将每组(每组具有5只小鼠)显示水肿的可见体征的小鼠的数量相加以给出0-5的水肿评分。
血浆中触珠蛋白的定量
通过emd密理博公司(emdmillipore)的
血浆中细胞因子/趋化因子的定量
通过emd密理博公司(emdmillipore)的
血浆中mrna1蛋白的定量
用milliplex人肝蛋白磁珠[默克密理博公司(merckmillipore),达姆施塔特(darmstadt),德国]测量mrna1蛋白质作为单一分析物。使用bioplex多重悬浮阵列系统[luminex100tm]和bioplexmanager6.1软件曲线拟合软件[伯乐实验室公司(bio-radlabboratories),赫拉克勒斯(hercules),加州]进行测定。简而言之,根据制造商的说明(具有额外的校准点以扩展标准曲线的下限范围),根据修改的方案进行测定。从标准曲线(5pl曲线拟合)反算样品数据。
血浆中亲脂性抗炎剂的定量
通过蛋白质沉淀法然后通过具有质谱检测的液相色谱法测定血浆中亲脂性抗炎剂的浓度。用含有10nmol/l的5,5-二乙基-1,3-二苯基-2-氨基巴比妥酸作为体积标志物的乙腈中的180μl0.2%甲酸沉淀50μl血浆样品。涡旋3分钟并离心(4000rpm,4℃,20分钟)后,取出上清液并分析。上清液的分析在短反相hplc柱上进行,使用具有电喷雾电离和多反应监测(mrm)采集的三重四极杆仪器进行快速梯度洗脱和ms/ms检测。
实例1:含有罗氟奈德棕榈酸酯/mrna(1:1w/w)的lnp
用于制备脂质溶液的脂质的摩尔组成是dlin-mc3-dma:dspc:胆固醇:dmpe-peg2000=50:10:38.5:1.5(mol/mol)。此外,该溶液还含有一定量的罗氟奈德棕榈酸酯(r-c16),该量在透析前lnp溶液中导致r-c16=0.25mm的总浓度。lnp中四种脂质和r-c16的最终摩尔组成显示于下表1中。
根据上述方法,将1.05ml等分试样的mrna1溶液和0.35ml的脂质和r-c16溶液混合。此外,在如上所述的相同混合条件下制备仅含有r-c16和dmpe-peg2000(“r-c16对照”)的无定形r-c16纳米颗粒。在制备后立即使用针对lnp描述的方案测量粒径,之后还透析这些粒子。测量的透析前和透析后粒径以及%ee示于下表1a中。
表1a.最终摩尔组成,测量的样品s1和s2的粒径和%ee
为了确定lnp中掺入的罗氟奈德棕榈酸酯(r-c16)的量,将900μl样品在500000g下超速离心60分钟,并使用具有用pda-cad检测器检测的信号的hplc来分析300μl的底部级分和原始样品(未离心)的dlin-mc3-dma和r-c16含量。将cad信号用于dlin-mc3-dma和r-c16,使用235nm处的uv-吸光度最大值,并用外部标准曲线测定浓度。将分析的两种组分之间的比例与原始样品中的比例进行比较。此外,将来自lnp样品的不同级分中的r-c16浓度与仅含有r-c16和dmpe-peg2000(“r-c16对照”)的纳米颗粒的样品中的r-c16的浓度进行比较。对“r-c16对照”样品的分析显示,在超速离心后,与含有r-c16的lnp样品不同,罗氟奈德棕榈酸酯完全位于底部相中。这表明完全不溶于水的罗氟奈德棕榈酸酯在混合物中不形成单独的药物颗粒,而是掺入lnp中。
r-c16lnp的hplc结果示于表1b中。dlin-mc3-dma和r-c16之间的比例在所有级分中是相似的,并且接近于在原始样品中看到的,这表明罗氟奈德棕榈酸酯(r-c16)掺入到lnp中。
表1b.在原始样品和超速离心的底部相样品中分析的dlin-mc3-dma和r-c16之间的重量比
实例2:非抗炎lnp与罗氟奈德棕榈酸酯/mrna(1:1w/w)lnp
用于制备脂质溶液的脂质的摩尔组成是dlin-mc3-dma:dspc:胆固醇:dmpe-peg2000=50:10:38.5:1.5。此外,对于样品s4,该溶液还含有一定量的罗氟奈德棕榈酸酯(r-c16),该量在透析前lnp溶液中导致r-c16=0.25mm的总浓度。lnp中四种脂质和r-c16的最终摩尔组成显示于下表2中。根据通用描述,将1.05ml的mrna1溶液和0.35ml的脂质和r-c16溶液混合。测量的透析前和透析后粒径以及%ee示于下表2中。
表2.最终摩尔组成,测量的样品s3和s4的粒径和%ee
如上所述,将磷酸盐缓冲液(pbs)和样品s3和s4皮下给予不同组的小鼠(n=5),以0.3mgmrna/kg的剂量。获得的水肿评分、血浆触珠蛋白、血浆细胞因子/趋化因子和血浆mrna1蛋白浓度的结果显示在图2a-d中。细胞因子/趋化因子的数据在8小时和24小时显示。结果显示,通过使用根据本披露的lnp,生物标志物或免疫应答的症状例如炎症(测量为水肿评分)、血浆中的触珠蛋白和细胞因子/趋化因子显著降低。此外,根据本披露的lnp引起蛋白质表达增加。
实例3:非抗炎lnp与罗氟奈德棕榈酸酯/mrna(1:1,1:10和1:30w/w)lnp
用于制备脂质溶液的脂质的摩尔组成是dlin-mc3-dma:dspc:胆固醇:dmpe-peg2000=50:10:38.5:1.5。此外,对于样品s5、s6和s7,该溶液还含有一定量的罗氟奈德棕榈酸酯(r-c16),该量在透析前lnp溶液中导致r-c16=0.25mm(s5)、0.025mm(s6)或8.3μm(s7)的总浓度。lnp中四种脂质和r-c16的最终摩尔组成显示于下表3中。根据以上描述,将1.29ml的mrna1溶液和0.43ml的脂质和r-c16溶液混合。测量的透析前和透析后粒径以及%ee示于下表3中。
表3.最终摩尔组成,测量的样品s5-s8的粒径和%ee
如上所述,将磷酸盐缓冲液(pbs)和样品s5-s8皮下给予不同组的小鼠(n=5),以0.3mgmrna/kg的剂量。获得的水肿评分、血浆触珠蛋白和血浆蛋白浓度的结果显示在图3a-c中。结果显示,通过使用r-c16lnp(在所有比例下),以水肿评分和触珠蛋白测量的炎症显著降低。此外,与非抗炎dlin-mc3-dmalnp相比,r-c16lnp(在所有比例下)引起蛋白质表达增加。
实例4:罗氟奈德棕榈酸酯与罗氟奈德lnp
用于制备脂质溶液的脂质的摩尔组成是dlin-mc3-dma:dspc:胆固醇:dmpe-peg2000=50:10:38.5:1.5。此外,对于样品s9,该溶液还含有一定量的罗氟奈德棕榈酸酯(r-c16),该量在透析前lnp溶液中导致r-c16=0.25mm的总浓度。对于该样品,根据以上描述,将1.05ml的mrna1溶液和0.35ml的脂质和r-c16溶液混合。在透析步骤后,通过向dlin-mc3-dma:dspc:胆固醇:dmpe-peg2000lnp中添加16μl21mm罗氟奈德的乙醇溶液制备样品s10,以给出所需组合物,然后平衡2天。lnp中四种脂质和r-c16或罗氟奈德的最终摩尔组成显示于下表4中。测量的透析前和透析后粒径以及%ee示于下表4中(对于粒径测量,使用ph7.4的pbs)。
表4.最终摩尔组成,测量的样品s9和s10的粒径和%ee
如上所述,将磷酸盐缓冲液(pbs)样品s9和s10皮下给予两组小鼠(n=15),以0.3mgmrna/kg的剂量。获得的水肿评分、血浆触珠蛋白和血浆蛋白浓度的结果显示在图4a-c中。结果显示,通过使用根据本披露的r-c16lnp,与含有相同摩尔剂量的罗氟奈德的lnp相比,以水肿评分和触珠蛋白测量的炎症显著降低。此外,与含有罗氟奈德的lnp相比,r-c16lnp产生增加和延长的蛋白质表达蛋白质。
实例5:前药罗氟奈德棕榈酸酯向罗氟奈德的转化
如上所述,将样品s9和s10(参见上文)以0.3mgmrna/kg的剂量皮下给予小鼠(n=16)。获得的罗氟奈德血浆浓度的结果与时间的关系示于图5中。结果显示皮下给予小鼠罗氟奈德棕榈酸酯lnp后,罗氟奈德棕榈酸酯转化为罗氟奈德。此外,结果还清楚地表明,与使用罗氟奈德棕榈酸酯lnp时相比,罗氟奈德lnp产生显著更高的初始血浆浓度。这表明,与具有罗氟奈德母化合物的lnp相比,大部分罗氟奈德位于细胞中而不是位于给予了包含罗氟奈德棕榈酸酯的lnp的血浆中,其中显著量的罗氟奈德从给药部位泄漏到血浆中。因此,根据本披露的lnp导致治疗窗口的总增加,这允许向有需要的受试者给予显著更小的剂量。
实例6:具有罗氟奈德戊酸酯、罗氟奈德肉豆蔻酸酯、罗氟奈德棕榈酸酯或罗氟奈德硬脂酸酯的lnp
用于制备脂质溶液的脂质的摩尔组成是dlin-mc3-dma:dspc:胆固醇:dmpe-peg2000=50:10:38.5:1.5。此外,该溶液还含有一定量的罗氟奈德戊酸酯(r-c5,样品s12)、罗氟奈德肉豆蔻酸酯(r-c14,样品s13)、罗氟奈德棕榈酸酯(r-c16,样品s14)或罗氟奈德硬脂酸酯(r-c18,样品s15),该量在透析前lnp溶液中导致r-cx=0.25mm(其中x=链中的碳数)的总浓度。lnp中四种脂质和r-cx的最终摩尔组成显示在下表6中。根据通用描述,将2.475ml的mrna1溶液和0.825ml的脂质和r-cx溶液混合。测量的透析前和透析后粒径以及%ee示于下表6中(对于粒径测量,使用ph7.4的pbs)。
表6.最终摩尔组成,测量的样品s11-s15的粒径和%ee
如上所述,将磷酸盐缓冲液(pbs)和样品s11-s15皮下给予不同组的小鼠(n=5),以0.3mgmrna/kg的剂量。获得的水肿评分、血浆触珠蛋白和血浆蛋白浓度的结果显示在图6a-c中。结果显示,通过使用根据本披露的r-c14、r-c16或r-c18lnp,与非抗炎lnp相比,以水肿评分和触珠蛋白测量的炎症显著降低,尽管使用罗氟奈德戊酸酯(r-c5)没有显著影响炎症。此外,与非抗炎lnp相比,r-c14、r-c16或r-c18lnp引起蛋白质表达增加和延长,尽管r-c5lnp没有显著增加总蛋白表达(0-24小时)。
实例7:具有merck-32的、具有和不具有罗氟奈德棕榈酸酯的lnp
制备两个样品(s16和s17),在这两个样品中,用于制备脂质溶液的脂质的摩尔组成是merck-32:dspc:胆固醇:dmpe-peg2000=50:10:38.5:1.5。此外,用于s16的溶液还含有一定量的罗氟奈德棕榈酸酯(r-c16),该量在透析前lnp溶液中导致r-c16=0.14mm的总浓度。lnp中四种脂质和r-c16的最终摩尔组成显示于下表7中。根据以上描述,对于s16,将2.925ml的mrna1溶液和0.975ml的脂质和r-c16溶液混合,并且对于s17,将0.75ml的mrna1溶液和0.25ml的脂质和r-c16溶液混合。对于s16和s17两者,可电离的脂质(merck-32)和mrna核苷酸的摩尔比均为6.0。测量的透析前和透析后粒径以及%ee示于下表7中(对于粒径测量,使用ph7.4的pbs)。
表7.最终摩尔组成,测量的样品s16和s17的粒径和%ee
如上所述,将磷酸盐缓冲液(pbs)、含有dlin-mc3-dma的样品s11和s14(参见表6)和含有merck-32的样品s16-s17皮下给予不同组的小鼠(n=5),以0.3mgmrna/kg的剂量。获得的水肿评分、血浆触珠蛋白和血浆蛋白浓度的结果显示在图7a-c中。结果显示,通过使用在基于dlin-mc3-dma或merck-32的lnp中的罗氟奈德棕榈酸酯,以水肿评分和触珠蛋白测量的炎症显著降低。此外,在基于dlin-mc3-dma或merck-32的lnp中罗氟奈德棕榈酸酯的存在引起mrna1蛋白的表达增加。
实例8:具有merck-32的、具有罗氟奈德肉豆蔻酸酯的、在更高mrna剂量下的lnp(罗氟奈德肉豆蔻酸酯/mrna比例1:1和0.3:1w/w)
制备三个样品(s18-s20),用于制备脂质溶液的脂质的摩尔组成显示于下表8中。对于样品s19和s20,脂质混合物包含mc3、dspc、胆固醇和peg-脂质、以及一定量的罗氟奈德肉豆蔻酸酯(r-c14),该量在透析前lnp溶液中导致r-c14=0.083mm(s19)或0.25mm(sc20)的总浓度。根据以上通用描述,混合所有样品。对于样品s18,mrna1溶液的体积为2.13ml,脂质溶液的体积为0.71ml。对于样品s19,mrna1溶液的体积为3.12ml,脂质和r-c14溶液的体积为1.04ml。样品s20由两批相同批次组成,其中对于每个批次,mrna1溶液的体积为3.21ml,脂质和r-c14溶液的体积为1.07ml。使用amiconultra-15离心过滤器浓缩样品s19和s20,以达到体内给药所需的浓度。在浓缩步骤之前,将构成样品s20的两个批次混合在一起。测量的透析前和透析后粒径以及%ee示于下表8中(对于粒径测量,使用ph7.4的pbs)。
表8.最终摩尔组成,测量的样品s18-s20的粒径和%ee样品s20的透析前和透析后的粒径和pdi的两个值代表用于制备该样品的两个不同批次。
如上所述,将磷酸盐缓冲液(pbs)、含有dlin-mc3-dma的样品s18、以及含有merck-32和罗氟奈德肉豆蔻酸酯的样品s20皮下给予不同组的小鼠(n=5),以0.3mgmrna/kg的剂量。此外,样品s19-s20也以更高的mrna剂量即1mg/kg皮下给予各组小鼠(n=5)。获得的水肿评分、血浆触珠蛋白和血浆mrna1蛋白浓度的结果显示在图8a-c中。结果表明,通过使用基于merck-32的lnp(r-c14/mrna比例为1:1)中的罗氟奈德肉豆蔻酸酯,在0.3和1mg/kg下以水肿评分测量的炎症减少。此外,当比较0.3和1mg/kg剂量时,蛋白质表达显示近似剂量成比例增加(在0-24小时的时间间隔内)。
实例9:具有kl10和acuitas-5的、具有和不具有罗氟奈德肉豆蔻酸酯的lnp(罗氟奈德肉豆蔻酸酯/mrna比例1:1w/w)
用于制备脂质溶液的脂质的摩尔组成显示于下表9中。对于样品s23和s25,除了可电离的脂质外,脂质混合物还含有dspc、胆固醇和peg-脂质、一定量的罗氟奈德肉豆蔻酸酯(r-c14),该量在透析前lnp溶液中导致r-c14=0.28mm或0.17mm(s25)的总浓度。根据通用描述,混合所有样品,除了样品s22和s23的n:p=3以及样品s24和s25的n:p=4.9。对于样品s21,mrna1溶液的体积为2.16ml,脂质溶液的体积为0.72ml。对于样品s22和s23,mrna1蛋白溶液的体积为1.41ml,并且脂质和r-c14溶液的体积为0.47ml,对于样品s24和s25,mrna1蛋白溶液的体积为1.77ml,并且脂质和r-c14溶液的体积为0.59ml。测量的透析前和透析后粒径以及%ee示于下表9中(对于粒径测量,使用ph7.4的pbs)。
表9.最终摩尔组成,测量的样品s21-s25的粒径和%ee
如上所述,将磷酸盐缓冲液(pbs)、含有dlin-mc3-dma的样品s21、含有acuitas-5的样品s22-23(不含和含有罗氟奈德肉豆蔻酸酯(r-c14))以及含有kl10的样品s24-25(不含和含有罗氟奈德肉豆蔻酸酯(r-c14))皮下给予不同组的小鼠(n=5),以0.3mgmrna/kg的剂量。获得的水肿评分、血浆触珠蛋白和血浆mrna1蛋白浓度的结果显示在图9a-c中。结果显示,通过使用在基于acuitas-5和kl10两者的lnp中的罗氟奈德肉豆蔻酸酯,与基于dlin-mc3-dma(0.3mg/kg)的lnp相比,以水肿评分和触珠蛋白测量的炎症减少。此外,当罗氟奈德肉豆蔻酸酯掺入lnp时,mrna1蛋白表达(在0-24小时的时间间隔内)增加。
实例10:只具有merck-32的lnp和具有罗氟奈德肉豆蔻酸酯、布地奈德肉豆蔻酸酯、布地奈德棕榈酸酯或布地奈德油酸酯的lnp
用于制备脂质溶液的脂质的摩尔组成是l608:dspc:胆固醇:dmpe-peg2000=50:10:38.5:1.5(样品s26)。样品s27还含有罗氟奈德肉豆蔻酸酯(r-c14),且对于样品s29、s30和s31,该溶液还分别含有一定量的布地奈德肉豆蔻酸酯(b-c14)、布地奈德棕榈酸酯(b-c16)和布地奈德油酸酯(b-c18:1),该量在透析前lnp溶液中导致r-c14、b-c14、b-c16和b-c18:1=0.154mm的总浓度。lnp中四种脂质和r-c14、b-c14、b-c16或b-c18:1的最终摩尔组成显示于下表10中。根据上文描述的在“含有mrna的lnp的制备”部分中的通用描述,将3.36ml等分试样的mrna1蛋白质溶液以及1.12ml的脂质和r-c14、b-c14、b-c16或b-c18:1溶液混合。使用amiconultra-4离心过滤器浓缩所有样品,然后在3000rpm和8℃下旋转,直到配制品具有显著高于0.2mg/ml的估计的mrna浓度。收集剩余的配制品体积,并用小等份的pbs缓冲液洗涤这些离心过滤器,将收集的剩余配制品添加至主要样品级分中,以给出约0.2mg/ml的估计的mrna浓度。然后再次测量粒径。测量的透析前和浓缩后粒径以及%ee示于下表10中。
表10.最终摩尔组成,测量的样品s26-s31的粒径和%ee
如上所述,将样品s26-s31皮下给予不同组的小鼠(n=5),以0.3mgmrna/kg的剂量。获得的水肿评分、血浆触珠蛋白、血浆细胞因子/趋化因子和血浆mrna1浓度的结果显示在图10a-g中。结果表明,与传统的lnp(样本s26)相比,罗氟奈德肉豆蔻酸酯(r-c14)、布地奈德棕榈酸酯(b-c16)或布地奈德油酸酯(b-c18:1)lnp显著减少以水肿评分、触珠蛋白以及细胞因子il-6和kc测量的炎症。此外,当使用布地奈德肉豆蔻酸酯(b-c14)时,炎症不会受到相同程度的影响。此外,与常规lnp(样品s26)相比,r-c14、b-c16或b-c18:1lnp导致mrna1的表达增加和延长。
- 还没有人留言评论。精彩留言会获得点赞!