MT1-MMP特异性双环肽-毒素缀合物的制作方法
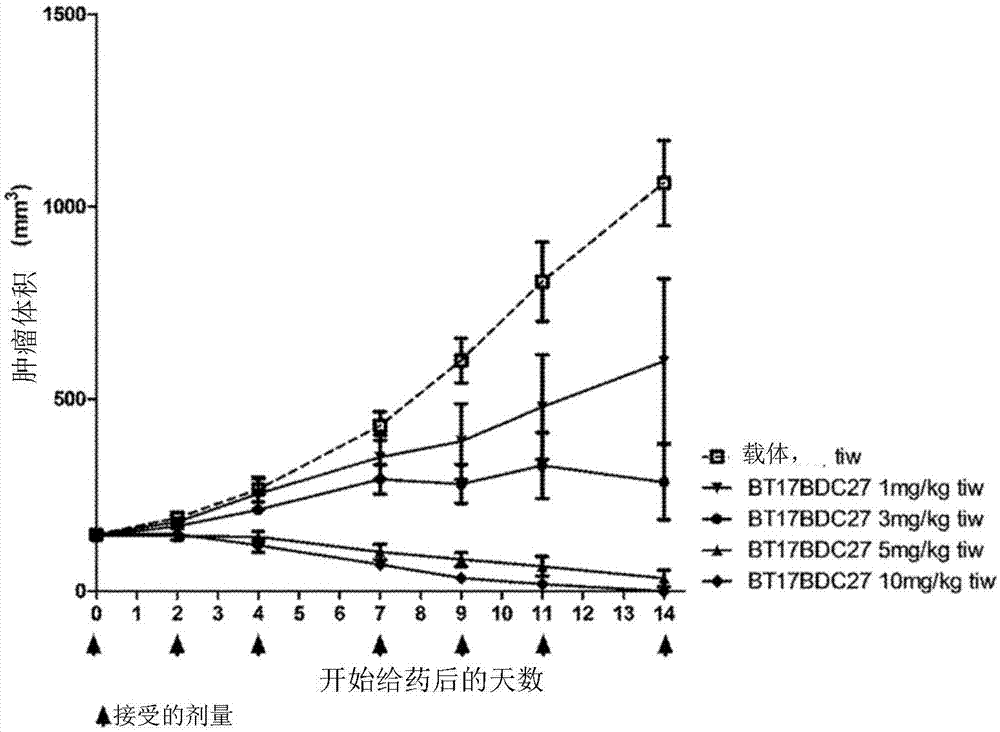
本发明涉及药物缀合物,其包含mt1-mmp特异性双环肽,所述双环肽与一种或多种已经用于靶向癌症疗法的效应物和/或官能团缀合。
背景技术:
:环肽能够以高亲和力和靶特异性结合蛋白质靶标,因此是用于开发治疗剂的有吸引力的分子类别。事实上,几种环肽已经成功用于临床,例如抗菌肽万古霉素、免疫抑制剂药物环孢菌素或抗癌药物奥曲肽(driggers等人(2008),natrevdrugdiscov7(7),608-24)。良好的结合特性来自肽和靶标之间形成的相对大的相互作用表面以及降低的环结构的构象柔性。通常,大环化合物与数百平方埃的表面结合,例如环肽cxcr4拮抗剂cvx15(2;wu等人(2007),science330,1066-71),具有arg-gly-asp基序与整合素αvb3结合的环肽(xiong等人(2002),science296(5565),151-5)或与尿激酶型纤溶酶原激活物结合的环肽抑制剂upain-1(zhao等人(2007),jstructbiol160(1),1-10)。由于它们的环构型,肽大环化合物比线性肽柔性差,导致与靶标结合时较小的熵损失并导致更高的结合亲和力。与线性肽相比,降低的柔性还导致锁定靶标特异性构象、增加结合特异性。这种效应已经被基质金属蛋白酶8(mmp-8)的有效选择性抑制剂所证明,当其环被打开时,其失去了对其它mmp的选择性(cherney等人(1998),jmedchem41(11),1749-51)。通过大环化实现的有利结合特性在具有多于一个肽环的多环肽中甚至更明显,例如在万古霉素、乳链菌肽和放线菌素中。不同研究小组先前已将具有半胱氨酸残基的多肽与合成的分子结构连接(kemp和mcnamara(1985),j.org.chem;timmerman等人(2005),chembiochem)。meloen及其同事使用三(溴甲基)苯和相关分子将多个肽环快速和定量环化到用于结构模拟蛋白质表面的合成支架上(timmerman等人(2005),chembiochem)。用于产生候选药物化合物的方法公开于wo2004/077062和wo2006/078161中,其中所述化合物通过将含有半胱氨酸的多肽与分子支架(例如三(溴甲基)苯)连接而产生。已经开发了基于噬菌体展示的组合方法来产生和筛选针对感兴趣靶标的双环肽的大文库(heinis等人(2009),natchembiol5(7),502-7和wo2009/098450)。简而言之,在噬菌体上展示含有三个半胱氨酸残基和两个区域的六个随机氨基酸(cys-(xaa)6-cys-(xaa)6-cys)的线性肽的组合文库,并通过将半胱氨酸侧链与小分子(三-(溴甲基)苯)共价连接进行环化。技术实现要素:根据本发明的第一方面,提供了式(i)的药物缀合物:或其药学上可接受的盐,其中r1和r2均表示氢;r3和r4均表示c1-6烷基;n表示选自1至10的整数;m表示选自0至10的整数;毒素是指细胞毒性剂;双环表示mt1-mmp特异性肽配体,其包含多肽和分子支架,所述多肽包含由至少两个环序列隔开的至少三个半胱氨酸残基,所述分子支架与多肽的半胱氨酸残基形成共价键,使得在分子支架上形成至少两个多肽环,其中所述肽配体包含式(ii)的氨基酸序列:-ci-x1-u/o2-x3-x4-g5-cii-e6-d7-f8-y9-x10-x11-ciii-(seqidno:1)(ii)其中:ci、cii和ciii分别表示第一、第二和第三半胱氨酸残基;x表示任何氨基酸残基;u表示选自n、c、q、m、s和t的极性不带电荷的氨基酸残基;和o表示选自g、a、i、l、p和v的非极性脂族氨基酸残基。根据本发明的另一方面,提供了一种药物组合物,其包含如本文所定义的药物缀合物与一种或多种药学上可接受的赋形剂的组合。根据本发明的另一方面,提供了如本文所定义的药物缀合物,其用于预防、抑制或治疗癌症,特别是实体瘤,如非小细胞肺癌的用途。附图说明图1:ebc-1异种移植小鼠中针对bt17bdc-27的平均肿瘤体积对时间的图。在第0天、第2天、第4天、第7天、第9天、第11天和第14天施用剂量。图2:用bt17bdc-27处理ebc-1异种移植小鼠期间的体重,其表明药物相关的毒理学和整体动物健康。图3:ebc-1异种移植小鼠中针对bt17bdc-28的平均肿瘤体积对时间的图。在第0天、第2天、第4天、第7天、第9天、第11天和第14天施用剂量。图4:用bt17bdc-28处理ebc-1异种移植小鼠期间的体重,其表明药物相关的毒理学和整体动物健康。具体实施方式除非另外定义,本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的含义相同的含义,如在肽化学、细胞培养和噬菌体展示、核酸化学和生物化学领域。对于分子生物学、遗传学和生物化学方法使用标准技术(参见sambrook等人,molecularcloning:alaboratorymanual,第3版,2001,coldspringharborlaboratorypress,coldspringharbor,ny;ausubel等人,shortprotocolsinmolecularbiology(1999)第4版,johnwiley&sons,inc.),其通过引用并入本文。药物缀合物根据本发明的第一方面,提供了式(i)的药物缀合物:或其药学上可接受的盐,其中r1和r2均表示氢;r3和r4均表示c1-6烷基;n表示选自1至10的整数;m表示选自0至10的整数;毒素是指细胞毒性剂;双环表示mt1-mmp特异性肽配体,其包含多肽和分子支架,所述多肽包含由至少两个环序列隔开的至少三个半胱氨酸残基,所述分子支架与多肽的半胱氨酸残基形成共价键,使得在分子支架上形成至少两个多肽环,其中所述肽配体包含式(ii)的氨基酸序列:-ci-x1-u/o2-x3-x4-g5-cii-e6-d7-f8-y9-x10-x11-ciii-(seqidno:1)(ii)其中:ci、cii和ciii分别表示第一、第二和第三半胱氨酸残基;x表示任何氨基酸残基;u表示选自n、c、q、m、s和t的极性不带电荷的氨基酸残基;和o表示选自g、a、i、l、p和v的非极性脂族氨基酸残基。在本发明的一个具体实施方案中,所述细胞毒性剂选自:烷化剂,如顺铂和卡铂、以及奥沙利铂、氮芥、环磷酰胺、苯丁酸氮芥、异环磷酰胺;抗代谢剂,包括嘌呤类似物硫唑嘌呤和巯基嘌呤或嘧啶类似物;植物生物碱和萜类化合物,包括长春花生物碱,如长春新碱、长春碱、长春瑞滨和长春地辛;鬼臼毒素及其衍生物依托泊苷和替尼泊苷;紫杉烷,包括紫杉醇,最初称为泰素(taxol);拓扑异构酶抑制剂,包括喜树碱:伊立替康和托泊替康,以及ii型抑制剂,包括安吖啶、依托泊苷、磷酸依托泊苷和替尼泊苷。其它试剂可包括抗肿瘤抗生素,其包括免疫抑制剂放线菌素d(用于肾移植)、多柔比星、表柔比星、博来霉素、加利霉素等。在本发明的另一个具体实施方案中,所述细胞毒性剂选自美登木素生物碱(如dm1)或单甲基奥瑞他汀(如mmae)。dm1是细胞毒性剂,其是美登素的含巯基衍生物并具有以下结构:单甲基奥瑞他汀e(mmae)是一种合成的抗肿瘤剂,其具有以下结构:在本文的实施例1至3中呈现数据,其证实了缀合至含有dm1的毒素的肽配体的作用。本文所用的术语c1-6烷基是指分别含有1至6个碳原子的直链或支链饱和烃基团。这类基团的实例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基或己基等。在一个实施方案中,r3和r4均为甲基。在一个实施方案中,n表示1。在一个实施方案中,m表示1。在一个实施方案中,r3和r4均为甲基,n表示1,m表示1。在一个实施方案中,毒素是美登素,并且缀合物包含式(iii)的化合物:其中r1、r2、r3、r4、n、m和双环如本文所定义。在式(iii)的缀合物的另一个实施方案中,n和m均表示1,r1和r2均表示氢,r3和r4均表示甲基,即式(iii)a的化合物:在又一个实施方案中,式(iii)或(iii)a的缀合物选自bt17bdc-27:或bt17bdc-28:bt17bdc-28采用与毒素-二硫化物构建体酰胺键合的稳定的双环肽对应物(17-69-07-n241)。这种具有n=1的美登素的非受阻(non-hindered)衍生物称为dm1。该分子在双环侧含有两个阻碍甲基,并且在抗体药物缀合物的情况下其对还原剂如二硫苏糖醇的敏感性降低14倍。该降低的对还原的敏感性与较低的毒素释放率相关。bt17bdc-27采用与毒素-二硫化物构建体酰胺键合的稳定的双环肽对应物(17-69-07-n268),其缺乏17-69-07-n241的bala-sar10分子间隔。分子间隔的缺失提供较小的整体分子,降低了合成成本,具有更高的毒素与api比率。这种具有n=1的美登素的非受阻衍生物称为dm1。该分子在双环侧包含两个阻碍甲基,并且在抗体药物缀合物的情况下其对还原剂如二硫苏糖醇的敏感性降低14倍。该降低的对还原的敏感性与较低的毒素释放率相关。命名法编号当提及式(ii)化合物中的氨基酸残基位置时,半胱氨酸残基(ci、cii和ciii)从编号中省略,因为它们是不变的,因此,式(ii)化合物中的氨基酸残基的编号如下所述:-ci-x1-u/o2-x3-x4-g5-cii-e6-d7-f8-y9-x10-x11-ciii-(seqidno:1)。为了本说明书的目的,假设所有双环肽都用tbmb(1,3,5-三(溴甲基)苯)环化,产生三-取代的1,3,5-三甲基苯结构。使用tbmb的环化发生在ci、cii和ciii上。双环肽核心序列本文公开的每个双环肽已经被指定了独特的核心序列号,其定义为第一个n-末端半胱氨酸(ci)和最后一个c-末端半胱氨酸(ciii)之间的氨基酸序列。在标识符17-69-07的实例中,核心序列是ciynefgciiedfydiciii(seqidno:2),并且被称为“17-69-07”或“(17-69-07)”。肽代码本文公开的某些双环肽也已经使用肽代码被指定了独特的标识符,如17-69-07-n241,其中n241表示17-69-07双环核心序列的特定衍生物。17-69-07的不同衍生物具有不同的n-数,即n001、n002、nxxx。分子格式向双环核心序列的左侧或右侧添加核心序列的n-或c-末端延伸,由连字符隔开。例如,n-末端bala-sar10-ala尾可表示为:bala-sar10-a-(17-69-07)并且具有完整序列βala-sar10-a-cynefgcedfydic(seqidno:3)。修饰在分子格式描述之后指示双环核心序列内的非天然氨基酸替换。例如,如果17-69-07中的酪氨酸1被d-丙氨酸替换,则描述为(17-69-07)d-ala1,并且完整序列将被描述为c(d-ala1)nefgcedfydic(seqidno:4)。如果n-末端或c-末端尾连接到还包含核心序列修饰的双环肽,那么,用17-69-07-n241作为实例,分子格式描述为:bala-sar10-a-(17-69-07)dala11nal4dala5tbugly11。因此,17-69-07-n241的完整氨基酸序列是:bala-sar10-a-c(d-ala)ne(1nal)(d-ala)cedfyd(tbugly)c(seqidno:5)。式(ii)的双环肽配体如本文所提及的肽配体是指与分子支架共价结合的肽。通常,此类肽包含两个或多个能够与支架形成共价键的反应基团(即半胱氨酸残基),以及所述反应基团之间的对向序列,其被称为环状序列,因为当肽与支架结合时其形成环。在本发明的情况下,肽包含至少三个半胱氨酸残基(本文称为ci、cii和ciii),在支架上形成至少两个环。本领域技术人员将理解,式(ii)的1、3、4、10和11位的x可以表示丙氨酸扫描结果和选择输出之后的任何氨基酸,其允许在这些位置处的良好耐受的替换。在一个实施方案中,式(ii)的1位的x选自以下氨基酸中的任一个:y、m、f或v。在另一个实施方案中,式(ii)的1位的x选自y、m或f。在另一个实施方案中,式(ii)的1位的x选自y或m。在又一个实施方案中,式(ii)的1位的x选自y。在一个实施方案中,式(ii)的2位的u/o选自u,如n。在替代的实施方案中,式(ii)的2位的u/o选自o,如g。在一个实施方案中,式(ii)的3位的x选自u或z,其中u表示选自n、c、q、m、s和t的极性不带电荷的氨基酸残基,并且z表示选自d或e的极性带负电荷的氨基酸残基。在另一个实施方案中,式(ii)的3位的u选自q。在另一个实施方案中,式(ii)的3位的z选自e。在一个实施方案中,式(ii)的4位的x选自j,其中j表示选自f、w和y的非极性芳香族氨基酸残基。在另一个实施方案中,式(ii)的4位的j选自f。在替代的实施方案中,式(ii)的4位的j选自y。在替代的实施方案中,式(ii)的4位的j选自w。在一个实施方案中,式(ii)的10位的x选自z,其中z表示选自d或e的极性带负电荷的氨基酸残基。在一个实施方案中,式(ii)的10位的z选自d。在一个实施方案中,式(ii)的11位的x选自o,其中o表示选自g、a、i、l、p和v的非极性脂族氨基酸残基。在一个实施方案中,式(ii)的11位的o选自i。在一个实施方案中,式(ii)的化合物为式(iia)的化合物:-ci-y/m/f/v-u/o-u/z-j-g-cii-e-d-f-y-z-o-ciii-(seqidno:6)(iia);其中u、o、j和z如上所定义。在一个实施方案中,式(ii)的化合物为式(iib)的化合物:ci-y/m/f/v-n/g-e/q-f-g-cii-e-d-f-y-d-i-ciii-(seqidno:7)(iib)。在一个实施方案中,式(ii)的化合物为式(iic)的化合物:-ci-y/m/f-n/g-e/q-f-g-cii-e-d-f-y-d-i-ciii-(seqidno:8)(iic)。在一个实施方案中,式(ii)的化合物为式(iid)的化合物:-ci-y/m-n-e/q-f-g-cii-e-d-f-y-d-i-ciii-(seqidno:9)(iid)。在一个实施方案中,式(ii)的化合物为式(iie)的化合物:-ci-y-n-e-f-g-cii-e-d-f-y-d-i-ciii-(17-69-07)(seqidno:2)(iie)。在又一个实施方案中,式(ii)的肽包含选自以下的序列:-ci-y-n-e-f-g-cii-e-d-f-y-d-i-ciii-(17-69-07)(seqidno:2);-ci-m-n-q-f-g-cii-e-d-f-y-d-i-ciii-(17-69-12)(seqidno:10);-ci-f-g-e-f-g-cii-e-d-f-y-d-i-ciii-(17-69-02)(seqidno:11);-ci-v-n-e-f-g-cii-e-d-f-y-d-i-ciii-(17-69-03)(seqidno:12);-ci-f-n-e-f-g-cii-e-d-f-y-d-i-ciii-(17-69-04)(seqidno:13);-ci-y-n-e-y-g-cii-e-d-f-y-d-i-ciii-(17-69-07-n057)(seqidno:14);和-ci-y-n-e-w-g-cii-e-d-f-y-d-i-ciii-(17-69-44-n002)(seqidno:15)。在针对mt1-mmp的血红素结合蛋白结构域的亲和力成熟后,该实施方案的肽被鉴定为有效的候选物。在又一个实施方案中,式(ii)的肽包含选自以下的序列:-ci-y-n-e-f-g-cii-e-d-f-y-d-i-ciii-(17-69-07)(seqidno:2);和-ci-m-n-q-f-g-cii-e-d-f-y-d-i-ciii-(17-69-12)(seqidno:10)。在针对mt1-mmp的血红素结合蛋白结构域的亲和力成熟,核心双环序列的合成,以及使用竞争实验的亲和力的定量测量之后,该实施方案的肽被鉴定为最高亲和力的候选物。在又一个实施方案中,式(ii)的肽包含选自-ci-y-n-e-f-g-cii-e-d-f-y-d-i-ciii-(17-69-07)(seqidno:2)的序列。该实施方案的肽被鉴定为式(ii)中肽配体家族中最有效和稳定的成员。在又一个实施方案中,式(ii)的肽分别包含选自以下的序列:bala-sar10-a-(17-69-07)d-ala11nal4d-ala5tbugly11(17-69-07-n241,其完整序列(bala)-sar10-aci(d-ala)ne(1nal)(d-ala)ciiedfyd(tbugly)ciii,);或a-(17-69-07)d-ala11nal4d-ala5tbugly11(17-69-07-n268,其完整序列aci(d-ala)ne(1nal)(d-ala)ciiedfyd(tbugly)ciii),其中n-末端作为游离氨基存在,并且c-末端被酰胺化。数据在实施例1-3中给出,其证明了包含这些双环肽的药物缀合物在体外和体内的有利特性。在一个实施方案中,某些式(ii)的肽与鼠、狗、食蟹猴和人mt1-mmp完全交叉反应。在进一步的实施方案中,本发明具体的示例性肽配体与鼠、狗、食蟹猴和人mt1-mmp完全交叉反应。例如,17-69-07的非稳定和稳定的衍生物(即17-69-07-n219、17-69-07-n241和17-69-07-n268)都是完全交叉反应的。在又一个实施方案中,式(ii)的肽对mt1-mmp具有选择性,但不与mmp-1、mmp-2、mmp-15和mmp-16交叉反应。17-69-07核心序列和稳定的变体17-69-07-n258独特地对mt1-mmp具有选择性。肽配体的优点某些式(ii)的双环肽具有许多有利的性质,使得它们被认为是能够用于注射、吸入、鼻内、眼内、经口或局部施用的合适的药物样分子。这些有利的性质包括:-物种交叉反应性。这是临床前药效学和药代动力学评估的典型要求;-蛋白酶稳定性。双环肽配体理想地应显示对血浆蛋白酶、上皮(“膜锚定”)蛋白酶、胃和肠蛋白酶、肺表面蛋白酶、细胞内蛋白酶等的稳定性。应该在不同物种之间保持蛋白酶稳定性,使得可以在动物模型中开发双环先导候选物并且有信心地施用于人;-理想的溶解度曲线。这是带电荷亲水与疏水残基的比例和分子内/分子间氢键的函数,这对于配制和吸收目的是重要的;和-循环中的最佳血浆半衰期。根据临床适应症和治疗方案,可能需要开发在急性疾病管理情况中用于短期暴露的双环肽,或开发具有增强的循环中滞留的双环肽,其因此对于更慢性疾病状态的管理是最佳的。其它驱使期望的血浆半衰期的因素是为了最大治疗效率的持续暴露对抗由于试剂持续暴露所伴随的毒理学的要求。药学上可接受的盐应理解,盐形式在本发明的范围内,并且对式(ii)的双环肽化合物的提及包括所述化合物的盐形式。本发明的盐可以通过常规化学方法,如pharmaceuticalsalts:properties,selection,anduse,p.heinrichstahl(编辑),camilleg.wermuth(编辑),isbn:3-90639-026-8,hardcover,第388页,2002年8月中描述的方法,由含有碱性或酸性部分的母体化合物合成。通常,这些盐可以通过使这些化合物的游离酸或碱形式与水中或有机溶剂中或两者的混合物中的适当的碱或酸反应来制备。可以与多种酸(包括无机酸和有机酸)形成酸加成盐(单盐或二盐)。酸加成盐的实例包括与选自以下的酸形成的单盐或二盐:乙酸、2,2-二氯乙酸、己二酸、海藻酸、抗坏血酸(例如l-抗坏血酸)、l-天冬氨酸、苯磺酸、苯甲酸、4-乙酰氨基苯甲酸、丁酸、(+)樟脑酸、樟脑磺酸、(+)-(1s)-樟脑-10-磺酸、癸酸、己酸、辛酸、肉桂酸、柠檬酸、环拉酸、十二烷基硫酸、乙烷-1,2-二磺酸、乙磺酸、2-羟基乙磺酸、甲酸、富马酸、半乳糖二酸、龙胆酸、葡庚糖酸、d-葡萄糖酸、葡萄糖醛酸(如d-葡萄糖醛酸)、谷氨酸(如l-谷氨酸)、α-氧代戊二酸、乙醇酸、马尿酸、氢卤酸(如氢溴酸、盐酸、氢碘酸)、羟乙磺酸、乳酸(例如(+)-l-乳酸、(±)-dl-乳酸)、乳糖醛酸、马来酸、苹果酸、(-)-l-苹果酸、丙二酸、(±)-dl-扁桃酸、甲磺酸、萘-2-磺酸、萘-1,5-二磺酸、1-羟基-2-萘甲酸、烟酸、硝酸、油酸、乳清酸、草酸、棕榈酸、双羟萘酸、磷酸、丙酸、丙酮酸、l-焦谷氨酸、水杨酸、4-氨基水杨酸、癸二酸、硬脂酸、琥珀酸、硫酸、丹宁酸、(+)-l-酒石酸、硫氰酸、对甲苯磺酸、十一烯酸和戊酸、以及酰化氨基酸和阳离子交换树脂。一组具体的盐由以下的酸形成的盐组成:乙酸、盐酸、氢碘酸、磷酸、硝酸、硫酸、柠檬酸、乳酸、琥珀酸、马来酸、苹果酸、羟乙磺酸、富马酸、苯磺酸、甲苯磺酸、硫酸、甲磺酸(甲磺酸盐)、乙磺酸、萘磺酸、戊酸、丙酸、丁酸、丙二酸、葡萄糖醛酸和乳糖醛酸。一种具体的盐是盐酸盐。另一种具体的盐是乙酸盐。如果化合物是阴离子,或具有可以是阴离子的官能团(例如,-cooh可以是-coo-),则可以与有机或无机碱形成盐,产生合适的阳离子。合适的无机阳离子的实例包括但不限于碱金属离子如li+、na+和k+,碱土金属阳离子如ca2+和mg2+,和其它阳离子如al3+或zn+。合适的有机阳离子的实例包括但不限于铵离子(即nh4+)和取代的铵离子(例如nh3r+、nh2r2+、nhr3+、nr4+)。一些合适的取代铵离子的实例是衍生自以下的那些:甲胺、乙胺、二乙胺、丙胺、二环己胺、三乙胺、丁胺、乙二胺、乙醇胺、二乙醇胺、哌嗪、苄胺、苯基苄胺、胆碱、葡甲胺和氨丁三醇、以及氨基酸,如赖氨酸和精氨酸。常见的季铵离子的实例是n(ch3)4+。当式(ii)的化合物含有胺官能团时,它们可以,例如通过根据本领域技术人员熟知的方法与烷化剂反应形成季铵盐。这种季铵化合物在式(ii)的范围内。修饰的衍生物应理解,如本文所定义的肽配体的修饰衍生物也在本发明的范围内。这种合适的修饰衍生物的实例包括选自以下的一种或多种修饰:n-末端和/或c-末端修饰;用一个或多个非天然氨基酸残基置换一个或多个氨基酸残基(如用一个或多个等排或等电子氨基酸置换一个或多个极性氨基酸残基;用其它非天然等排或等电子氨基酸置换一个或多个非极性氨基酸残基);添加间隔基团;用一个或多个抗氧化氨基酸残基置换一个或多个氧化敏感的氨基酸残基;用丙氨酸置换一个或多个氨基酸残基,用一个或多个d-氨基酸残基置换一个或多个l-氨基酸残基;双环肽配体内一个或多个酰胺键的n-烷基化;用替代键置换一个或多个肽键;肽骨架长度的修饰;用另一个化学基团取代一个或多个氨基酸残基的α-碳上的氢,用适当的胺、硫醇、羧酸和苯酚反应试剂修饰氨基酸如半胱氨酸、赖氨酸、谷氨酸/天冬氨酸和酪氨酸,以便使所述氨基酸官能化,以及引入或置换引入正交反应性的适合官能化的氨基酸,例如带有叠氮基或炔基的氨基酸,其分别允许用带有炔基或叠氮基的部分官能化。在一个实施方案中,修饰的衍生物包含在氨基酸1和/或9位的修饰。这些位置,特别是存在酪氨酸的位置,最易受蛋白水解降解。在一个实施方案中,修饰的衍生物包含n-末端和/或c-末端修饰。在进一步的实施方案中,其中所述修饰的衍生物包含使用合适的氨基反应化学的n-末端修饰,和/或使用合适的羧基反应化学的c-末端修饰。在进一步的实施方案中,所述n-末端或c-末端修饰包括添加效应基团,其包括但不限于细胞毒性剂、放射性螯合剂或发色团。在进一步的实施方案中,修饰的衍生物包含n-末端修饰。在进一步的实施方案中,n-末端修饰包含n-末端乙酰基。在该实施方案中,n-末端半胱氨酸基团(本文中称为ci的基团)在肽合成期间用乙酸酐或其它合适的试剂封端,产生n-末端乙酰化的分子。该实施方案提供了去除氨肽酶的潜在识别点并避免双环肽降解的可能性的优点。在一个替代实施方案中,n-末端修饰包含添加分子间隔基团,如ala、g-sar10-a或bala-sar10-a基团,其促进效应基团的缀合和双环肽对其靶标的效力的保留。在一个实施方案中,间隔基团选自bala-sar10-a(即17-69-07-n241)。向双环肽17-69-07中添加这些间隔基团不会改变对靶蛋白的效力。在进一步的实施方案中,修饰的衍生物包含c-末端修饰。在进一步的实施方案中,c-末端修饰包含酰胺基团。在该实施方案中,c-末端半胱氨酸基团(本文中称为ciii的基团)在肽合成期间作为酰胺合成,产生c-末端酰胺化的分子。该实施方案提供了去除羧肽酶的潜在识别点并降低双环肽蛋白水解降解的可能性的优点。在一个实施方案中,修饰的衍生物包含用一个或多个非天然氨基酸残基置换一个或多个氨基酸残基。在该实施方案中,可以选择具有等排/等电子侧链的非天然氨基酸,其既不被降解蛋白酶识别也不会对靶标效力产生任何不利影响。可选地,可以使用具有受限氨基酸侧链的非天然氨基酸,使得附近肽键的蛋白水解在构象上和空间上受阻。特别地,这些非天然氨基酸涉及脯氨酸类似物、庞大侧链、cα-二取代的衍生物(例如,氨基异丁酸,aib)和环氨基酸,一种为氨基-环丙基羧酸的简单衍生物。在一个实施方案中,非天然氨基酸残基在4位替换。许多非天然氨基酸残基在该位置处是耐受良好的。在进一步的实施方案中,如存在于4位的那些非天然氨基酸残基选自:1-萘基丙氨酸;2-萘基丙氨酸;环己基甘氨酸,苯基甘氨酸;叔丁基甘氨酸;3,4-二氯苯基丙氨酸;环己基丙氨酸和高苯基丙氨酸。在又一个实施方案中,如存在于4位的那些非天然氨基酸残基选自:1-萘基丙氨酸;2-萘基丙氨酸和3,4-二氯苯基丙氨酸。与未修饰的野生型序列相比,这些替换增强了亲和力。在又一个实施方案中,如存在于4位的那些非天然氨基酸残基选自:1-萘基丙氨酸。与野生型相比,这种替换提供了最大程度的亲和力增强(大于7倍)。在一个实施方案中,在9和/或11位引入非天然氨基酸残基。许多非天然氨基酸残基在这些位置是耐受良好的。在进一步的实施方案中,如存在于9位的那些非天然氨基酸残基选自:4-溴苯基丙氨酸、五氟-苯基丙氨酸,如4-溴苯基丙氨酸。在又一个实施方案中,如存在于11位的那些非天然氨基酸残基选自:叔丁基甘氨酸。通过空间阻碍实现活性的增强,并强力保护邻位氨基酸骨架免受蛋白水解。在一个实施方案中,修饰的衍生物包含多个上述修饰,如2、3、4或5或更多个修饰。在进一步的实施方案中,修饰的衍生物包含2、3、4或5或更多个以下修饰,如全部以下5个修饰:1和5位的d-丙氨酸,4位的1-萘基丙氨酸,9位的4-溴苯基丙氨酸和11位的叔丁基甘氨酸。这种与优于野生型的效力相呼应的多重替换是可耐受的。在又一个实施方案中,修饰的衍生物包含以下修饰:1和5位的d-丙氨酸,4位的1-萘基丙氨酸和11位的叔丁基甘氨酸。这种与优于野生型的效力相呼应的多重替换是可耐受的。在一个实施方案中,修饰的衍生物包括添加间隔基团。在进一步的实施方案中,修饰的衍生物包括向n-末端半胱氨酸(ci)和/或c-末端半胱氨酸(ciii)添加间隔基团。在一个实施方案中,修饰的衍生物包括用一个或多个抗氧化氨基酸残基置换一个或多个氧化敏感的氨基酸残基。在进一步的实施方案中,修饰的衍生物包括用萘基丙氨酸或丙氨酸残基置换色氨酸残基。该实施方案提供了改善所得双环肽配体的药物稳定性特征的优点。在一个实施方案中,修饰的衍生物包括用一个或多个疏水氨基酸残基置换一个或多个带电荷的氨基酸残基。在一个替代实施方案中,修饰的衍生物包括用一个或多个带电荷的氨基酸残基置换一个或多个疏水氨基酸残基。带电荷对疏水氨基酸残基的正确平衡是双环肽配体的重要特征。例如,疏水氨基酸残基影响血浆蛋白结合的程度,从而影响血浆中游离可用级分的浓度,而带电荷的氨基酸残基(特别是精氨酸)可能影响肽与细胞表面上的磷脂膜的相互作用。两者的组合可以影响肽药物的半衰期、分布体积和暴露,并且可以根据临床终点进行定制。此外,带电荷对疏水氨基酸残基的正确的组合和数量可减少注射部位的激惹(如果肽药物已经皮下施用)。在一个实施方案中,修饰的衍生物包括用一个或多个d-氨基酸残基置换一个或多个l-氨基酸残基。据信该实施方案通过空间位阻和d-氨基酸倾向来增加蛋白水解稳定性,以稳定β-转角构象(tugyi等人(2005)pnas,102(2),413–418)。在进一步的实施方案中,1位的氨基酸残基被d-氨基酸替换,例如被d-丙氨酸替换。这种替换实现了效力的保留而没有随之发生的降解。在进一步的实施方案中,5位的氨基酸残基被d-氨基酸替换,例如被d-丙氨酸或d-精氨酸替换。这种替换实现了效力的保留而没有随之发生的降解。在一个实施方案中,修饰的衍生物包括去除任何氨基酸残基和用丙氨酸替换。该实施方案提供了去除潜在的蛋白水解攻击位点的优点。应注意,上述修饰中的每个用于有意地改善肽的效力或稳定性。可以通过以下机制实现基于修饰的进一步效力改善:-并入疏水部分,其利用疏水效应并导致降低的解离速率(offrates),从而获得更高的亲和力;-并入带电荷基团,其利用长程(long-range)离子相互作用,导致更快的结合速率(onrates)和更高的亲和力(参见例如schreiber等人,rapid,electrostaticallyassistedassociationofproteins(1996),naturestruct.biol.3,427-31);和-向肽中并入其它限制,例如通过正确限制氨基酸的侧链使得在靶标结合时熵的损失最小,限制骨架的扭转角使得在靶标结合时熵的损失最小,以及出于同样的原因在分子中引入其它的环化。(综述参见gentilucci等人,curr.pharmaceuticaldesign,(2010),16,3185-203,和nestor等人,curr.medicinalchem(2009),16,4399-418)。同位素变异本发明包括所有药学上可接受的(放射性)同位素标记的本发明化合物,即式(ii)的化合物,其中一个或多个原子被具有相同原子序数、但原子质量或质量数不同于通常在自然界中发现的原子质量或质量数的原子置换,和式(ii)的化合物,其中连接能够容纳相关的(放射性)同位素的金属螯合基团(称为“效应物”),和式(i)的化合物,其中某些官能团被相关的(放射性)同位素或同位素标记的官能团共价置换。适合包括在本发明化合物中的同位素的实例包括氢的同位素,如2h(d)和3h(t),碳的同位素,如11c、13c和14c,氯的同位素,如36cl,氟的同位素,如18f,碘的同位素,如123i、125i和131i,氮的同位素,如13n和15n,氧的同位素,如15o、17o和18o,磷的同位素,如32p,硫的同位素,如35s,铜的同位素,如64cu,镓的同位素,如67ga或68ga,钇的同位素,如90y,和镥的同位素,如177lu,和铋的同位素,如213bi。某些同位素标记的式(ii)化合物,例如并入放射性同位素的化合物,可用于药物和/或底物组织分布研究中,并用于临床评估在患病组织如肿瘤等组织上mt1-mmp靶标的存在和/或不存在。式(ii)的化合物还可具有有价值的诊断性质,因为它们可用于检测或鉴定标记化合物与其它分子、肽、蛋白质、酶或受体之间复合物的形成。检测或鉴定方法可以使用标记有标记试剂,如放射性同位素、酶、荧光物质、发光物质(例如鲁米诺、鲁米诺衍生物、荧光素、水母发光蛋白和荧光素酶)等的化合物。鉴于放射性同位素氚(即3h(t))和碳-14(即14c)易于并入和现成的检测手段,其特别适合用于此目的。用较重的同位素如氘(即2h(d))置换可以提供某些治疗优势,这是由于更高的代谢稳定性,例如延长的体内半衰期或减少的剂量需求,因此在某些情况下可能是优选的。用正电子发射同位素(如11c、18f、15o和13n)置换可用于正电子发射断层扫描(pet)研究以检查靶标占有率。将同位素并入金属螯合效应基团(如64cu、67ga、68ga和177lu)可用于使用pet或spect成像可视化肿瘤特异性抗原。将同位素并入金属螯合效应基团(如但不限于90y、177lu和213bi)可以提供靶向放射疗法的选择,其中带有金属螯合剂的式(ii)的化合物携带针对靶蛋白和作用位点的治疗性放射性核素。同位素标记的式(ii)的化合物通常可以通过本领域技术人员已知的常规技术,或通过与所附实施例中描述的那些方法类似的方法,使用适当的同位素标记的试剂代替先前使用的未标记的试剂来制备。结合活性在本文中,特异性是指配体与其同族靶标(排除与靶标相似的实体)结合或以其它方式相互作用的能力。例如,特异性可以指配体抑制人酶相互作用、而不抑制来自不同物种的同源酶相互作用的能力。使用本文所述的方法,可以调节特异性,即增加或减少特异性,以使配体或多或少地能够与预期靶标的同源物或旁系同源物相互作用。特异性不旨在与活性、亲和力或活动性(avidity)同义,并且配体对其靶标的作用效力(如,例如结合亲和力或抑制水平)不一定与其特异性相关。如本文所用,结合活性是指从结合试验获得的定量结合测量,例如如本文所述。因此,结合活性是指在给定的靶标浓度下结合的肽配体的量。多特异性是指结合两个或更多个靶标的能力。通常,由于其构象特性,结合肽能够结合单个靶标,如抗体情况下的表位。然而,可以开发能够结合两个或更多个靶标的肽;例如,本领域已知的如上所述的双特异性抗体。在本发明中,肽配体能够结合两个或更多个靶标,因此是多特异性的。适当地,它们结合两个靶标,是双特异性的。结合可以是独立的,这意味着肽上对靶标的结合位点在结构上不受别的靶标结合的阻碍。在这种情况下,两个靶标都可以独立结合。更一般地,预期一个靶标的结合将至少部分地阻碍另一个靶标的结合。双特异性配体和具有包括两个相关靶标的特异性的配体之间存在根本区别。在第一种情况下,配体单独地对两个靶标都是特异性的,并且以特定方式与每个靶标相互作用。例如,配体中的第一环可以结合第一靶标,第二环结合第二靶标。在第二种情况下,配体是非特异性的,因为例如通过与两个靶标共同的靶标表位相互作用,它不区分两个靶标。在本发明的上下文中,例如对靶标和直系同源物具有活性的配体可以是双特异性配体。然而,在一个实施方案中,配体不是双特异性的,但其具有较不明确的特异性,使得其结合靶标和一个或多个直系同源物。通常,由于缺乏对双特异性的选择压力,未针对靶标及其直系同源物进行选择的配体不太可能是双特异性的。在提供定制的结合表面,使得可以获得良好的靶标和直系同源物交叉反应性、同时保持对较不相关的同源物的高选择性方面,双环肽中的环长度是决定性的。如果配体真正是双特异性的,在一个实施方案中,配体的靶标特异性中的至少一个是所选择的配体中共同的,并且该特异性的水平可以通过本文公开的方法调节。第二或进一步的特异性不需要共有,并且不需要是本文阐述的步骤的主旨。靶标是与肽配体结合或以其它方式相互作用的分子或其部分。虽然结合被视为大多数种类的活性的先决条件,并且结合本身可能就是一种活性,但设想了其它活性。因此,本发明不需要测量直接或间接结合。分子支架是能够在多个点连接肽以赋予肽一种或多种结构特征的任何分子。优选地,分子支架包含至少三个肽的连接点,称为支架反应基团。这些基团能够与肽上的半胱氨酸残基(ci、cii和ciii)反应形成共价键。它们不仅形成二硫键(其可经受还原裂解以及伴随的分子分解),但还形成稳定的共价硫醚键。分子支架的优选结构如下所述。分子支架分子支架描述于例如wo2009/098450和其中引用的参考文献,特别是wo2004/077062和wo2006/078161。如前述文献中所述,分子支架可以是小分子,如小的有机分子。在一个实施方案中,分子支架可以是,或可以基于,天然单体,如核苷、糖或类固醇。例如,分子支架可包含这种实体的短聚合物,如二聚体或三聚体。在一个实施方案中,分子支架是已知毒性的化合物,例如低毒性化合物。合适的化合物的实例包括胆固醇、核苷酸、类固醇或现有药物如替马西泮(tamazepam)。在一个实施方案中,分子支架可以是大分子。在一个实施方案中,分子支架是由氨基酸、核苷酸或碳水化合物组成的大分子。在一个实施方案中,分子支架包含能够与多肽的一个或多个官能团反应以形成共价键的反应基团。分子支架可包含与肽形成连接的化学基团,如胺、硫醇、醇、酮、醛、腈、羧酸、酯、烯烃、炔烃、叠氮化物、酸酐、琥珀酰亚胺、马来酰亚胺、烷基卤化物和酰基卤化物。在一个实施方案中,分子支架可包含或可由三(溴甲基)苯组成,尤其是可包含或可由1,3,5-三(溴甲基)苯('tbmb')或其衍生物组成。在一个实施方案中,分子支架是2,4,6-三(溴甲基)三甲基苯。该分子类似于1,3,5-三(溴甲基)苯,但含有三个与苯环连接的额外的甲基。这具有以下优点:额外的甲基可以与多肽形成进一步的接触,因此增加了额外的结构限制。本发明的分子支架含有化学基团,其允许本发明编码文库的多肽的官能团与分子支架形成共价连接。所述化学基团选自多种官能团,包括胺、硫醇、醇、酮、醛、腈、羧酸、酯、烯烃、炔烃、酸酐、琥珀酰亚胺、马来酰亚胺、叠氮化物、烷基卤化物和酰基卤化物。在分子支架上可用于与半胱氨酸的巯基反应的支架反应基团是烷基卤化物(或也称为卤化烷(halogenoalkanes)或卤代烷(haloalkanes))。实例包括溴甲基苯(支架反应基团,例如tbmb)或碘乙酰胺。可用于选择性地将化合物偶联到蛋白质中的半胱氨酸的其它支架反应基团是马来酰亚胺。可用作本发明的分子支架的马来酰亚胺的实例包括:三-(2-马来酰亚胺基乙基)胺、三-(2-马来酰亚胺基乙基)苯、三-(马来酰亚胺基)苯。硒代半胱氨酸也是一种天然氨基酸,其与半胱氨酸具有相似的反应性,可用于相同的反应。因此,在提及半胱氨酸的任何地方,除非上下文另有说明,其通常可接受用于替代硒代半胱氨酸。合成式(ii)的肽可以通过标准固相肽合成技术合成制备,然后在体外与分子支架反应。当进行该操作时,可以使用标准化学方法。这使得能够快速大规模制备可溶性材料用于进一步的下游实验或验证。这些方法可以使用如timmerman等人(同上)中公开的常规化学方法完成。因此,本发明还涉及制备如本文所述选择的多肽或缀合物,其中制备包括如下所述的任选的进一步的步骤。在一个实施方案中,这些步骤在通过化学合成制备的最终产物多肽/缀合物上进行。任选地,当制备缀合物或复合物时,可以替换感兴趣多肽中的氨基酸残基。肽也可以延伸,例如以并入另一个环,由此引入多特异性。为了延伸肽,可以使用标准固相或溶液相化学方法,使用正交保护的赖氨酸(和类似物),简单地在其n-末端或c-末端或在环内或其它位置进行化学延伸。标准(生物)缀合技术可用于引入活化的或可活化的n-或c-末端。可选地,可以通过片段缩合或天然化学连接进行添加,例如,如(dawson等人1994.synthesisofproteinsbynativechemicalligation.science266:776-779)中所述,或通过酶,例如使用如(chang等人procnatlacadsciusa.1994dec20;91(26):12544-8,或hikari等人bioorganic&medicinalchemistryletters第18卷,第22期,2008年11月15日,第6000-6003页)中所述的枯草杆菌酶(subtiligase)进行添加。可选地,可以通过二硫键进一步缀合来延伸或修饰肽。这具有一旦在细胞的还原环境中允许第一和第二肽彼此解离的额外优点。在这种情况下,可以在第一肽的化学合成期间加入分子支架(例如tbmb),以便与三个半胱氨酸基团反应;然后可以将另外的半胱氨酸或巯基附加到第一肽的n或c-末端,使得该半胱氨酸或巯基仅与第二肽的游离半胱氨酸或巯基反应,形成二硫键连接的双环肽-肽缀合物。类似的技术同样适用于两个双环和双特异性大环化合物的合成/偶联,可能产生四特异性分子。此外,可以使用适当的化学方法,在n-或c-末端偶联或通过侧链,以相同的方式实现其它官能团或效应基团的添加。在一个实施方案中,偶联以这样的方式进行,即它不阻断任一实体的活性。根据本发明的另一方面,提供了制备如本文所定义的药物缀合物的方法,其包括方案i中描述的合成路线。药物组合物根据本发明的另一方面,提供了一种药物组合物,其包含如本文所定义的药物缀合物与一种或多种药学上可接受的赋形剂的组合。通常,所述药物缀合物将以纯的形式与药理学上合适的赋形剂或载体一起使用。典型地,这些赋形剂或载体包括水性或醇/水性溶液、乳液或混悬液,包括盐水和/或缓冲介质。肠胃外载剂包括氯化钠溶液、林格氏右旋糖、右旋糖和氯化钠以及乳酸林格氏液(lactatedringer’s)。如果需要将多肽复合物保持在混悬浮液中,合适的生理学上可接受的佐剂可选自增稠剂,如羧甲基纤维素、聚乙烯吡咯烷酮、明胶和海藻酸盐。静脉内载剂包括流体和营养补充剂和电解质补充剂,如基于林格氏右旋糖的那些。还可以存在防腐剂和其它添加剂,如抗微生物剂、抗氧化剂、螯合剂和惰性气体(mack(1982)remington'spharmaceuticalsciences,第16版)。本发明的药物缀合物可以作为单独施用的组合物使用或与其它试剂联合使用。这些其它试剂可包括抗体,抗体片段和各种免疫治疗药物,如环孢菌素、甲氨蝶呤、阿霉素或顺铂和免疫毒素。药物组合物可包括与本发明的药物缀合物联合的各种细胞毒性剂或其它试剂的“混合物(cocktails)”,或甚至具有不同特异性的根据本发明的药物缀合物的组合,如包含使用不同靶配体选择的多肽的那些,无论其是否在施用之前汇集。根据本发明的药物组合物的施用途径可以是任何本领域普通技术人员公知的那些途径。对于疗法,包括但不限于免疫疗法,可以根据标准技术将本发明的药物缀合物施用给任何患者。施用可以通过任何适当的模式进行,包括肠胃外、静脉内、肌肉内、腹膜内、经皮、通过肺部途径,或者适当地,也通过导管直接输注。施用的剂量和频率将取决于患者的年龄、性别和状况、其它药物的同时施用、禁忌症和临床医生应考虑的其它参数。可以将本发明的药物缀合物冻干储存,并在使用前在合适的载体中重构。已经证明该技术是有效的,并且可以采用本领域已知的冻干和重构技术。本领域技术人员将理解,冻干和重构可导致不同程度的活性损失,并且可能必须向上调整水平以补偿。可以施用含有本发明药物缀合物或其混合物(cocktail)的组合物用于预防和/或治疗。在某些治疗应用中,将足以完成对所选细胞群的至少部分抑制(inhibition)、抑制(suppression)、调节、杀伤、或一些其它可测量参数的量定义为“治疗有效量”。达到该剂量所需的量将取决于疾病的严重程度和患者自身免疫系统的一般状态,但通常为每千克体重0.005至5.0mg所选药物缀合物,更常用的剂量为0.05至2.0mg/kg/剂量。对于预防性应用,含有本发明药物缀合物或其混合物的组合物也可以相似或稍低的剂量施用。含有根据本发明的药物缀合物的组合物可用于预防和治疗环境中,以帮助改变、灭活、杀伤或除去哺乳动物中选择的靶细胞群。此外,本文所述的药物缀合物可以在身体外(extracorporeally)或体外(invitro)用于选择性地杀伤、耗尽或以其它方式有效地去除异质细胞集合中的靶细胞群。来自哺乳动物的血液可以在身体外与所选择的药物缀合物组合,从而将不需要的细胞杀伤或以其它方式从血液中除去,以便根据标准技术返回哺乳动物。治疗用途作为膜1型金属蛋白酶(mt1-mmp,也称为mmp14)的高亲和力结合剂,式(ii)的双环肽具有特定的用途。mt1-mmp是跨膜金属蛋白酶,其直接通过降解细胞外基质中的几种组分并间接通过激活pro-mmp2,在细胞外基质重塑中起主要作用。mt1-mmp对于肿瘤血管生成是至关重要的(sounni等人(2002)fasebj.16(6),555-564),并且在多种实体瘤上过表达,因此本发明的包含结合mt1-mmp的双环肽的药物缀合物特别适用于癌症(特别是实体瘤如非小细胞肺癌)的靶向治疗。在一个实施方案中,式(ii)的双环肽对人mt1-mmp是特异的。在进一步的实施方案中,式(ii)的双环肽对小鼠mt1-mmp是特异的。在又一个实施方案中,式(ii)的双环肽对人和小鼠mt1-mmp是特异的。在又一个实施方案中,式(ii)的双环肽对人、小鼠和狗mt1-mmp是特异的。式(ii)的多肽配体可用于体内治疗和预防应用、体外和体内诊断应用、体外测试和试剂应用等。具有所选特异性水平的配体可用于涉及在需要交叉反应性的非人动物中进行的试验的应用中,或用于在需要小心控制与同源物或旁系同源物的交叉反应性的诊断应用中。在一些应用,如疫苗应用中,可以利用对预定范围的抗原引发免疫应答的能力来定制针对特定疾病和病原体的疫苗。优选对哺乳动物施用至少90-95%同质性的基本上纯的肽配体,对于药物用途,最优选98-99%或更高的同质性,特别是当哺乳动物是人时。一旦根据需要纯化、部分纯化或同质化,所选择的多肽可用于诊断或治疗(包括身体外)或开发和进行测试程序、免疫荧光染色等(lefkovite和pernis,(1979和1981)immunologicalmethods,volumesiandii,academicpress,ny)。本发明的肽配体的缀合物通常可用于预防、抑制或治疗癌症,特别是实体瘤,例如非小细胞肺癌。因此,根据本发明的另一方面,提供了如本文所定义的肽配体的药物缀合物,其用于预防、抑制或治疗癌症,特别是实体瘤,如非小细胞肺癌的用途。根据本发明的另一方面,提供了预防、抑制或治疗癌症(特别是实体瘤,如非小细胞肺癌)的方法,其包括向有需要的患者施用如本文所定义的肽配体的药物缀合物。可以治疗(或抑制)的癌症(及其良性对应物)的实例包括但不限于上皮来源的肿瘤(腺瘤和各种类型的癌,包括腺癌、鳞状细胞癌、移行细胞癌和其它癌),如膀胱癌和尿道癌、乳腺癌、胃肠道癌(包括食道癌、胃(stomach)(胃(gastric))癌、小肠癌、结肠癌、直肠癌和肛门癌)、肝癌(肝细胞癌)、胆囊和胆道系统癌、外分泌胰腺癌、肾癌、肺癌(例如腺癌、小细胞肺癌、非小细胞肺癌、支气管肺泡癌和间皮瘤)、头颈部癌(例如舌癌、口腔癌、喉癌、咽癌、鼻咽癌、扁桃体癌、唾液腺癌、鼻腔癌和鼻旁窦癌)、卵巢癌、输卵管癌、腹膜癌、阴道癌、外阴癌、阴茎癌、子宫颈癌、子宫肌癌、子宫内膜癌、甲状腺癌(例如甲状腺滤泡癌)、肾上腺癌、前列腺癌、皮肤和附属器癌(例如黑色素瘤、基底细胞癌、鳞状细胞癌、角化棘皮瘤、发育异常的痣);血液系统恶性肿瘤(即白血病、淋巴瘤)和癌前病变血液病和边缘恶性肿瘤疾病,包括血液系统恶性肿瘤和淋巴系的相关病症(例如急性淋巴细胞白血病[all]、慢性淋巴细胞白血病[cll]、b细胞淋巴瘤如弥漫性大b细胞淋巴瘤[dlbcl]、滤泡性淋巴瘤、伯基特淋巴瘤、套细胞淋巴瘤、t细胞淋巴瘤和白血病、自然杀伤[nk]细胞淋巴瘤、霍奇金淋巴瘤、毛细胞白血病、意义不明的单克隆丙种球蛋白病、浆细胞瘤、多发性骨髓瘤和移植后淋巴组织增生性疾病),和血液系统恶性肿瘤和髓系相关病症(例如急性髓性白血病[aml]、慢性髓性白血病[cml]、慢性髓单核细胞细胞白血病[cmml]、嗜酸性粒细胞增多症、骨髓及外骨髓增生性疾病如红细胞增多症、原发性血小板增多症和原发性骨髓纤维化、骨髓及外骨髓增生综合征、骨髓增生异常综合征和早幼粒细胞白血病);间充质来源的肿瘤,例如软组织肉瘤、骨或软骨瘤如骨肉瘤、纤维肉瘤、软骨肉瘤、横纹肌肉瘤、平滑肌肉瘤、脂肪肉瘤、血管肉瘤、卡波西氏肉瘤、尤文氏肉瘤、滑膜肉瘤、上皮样肉瘤、胃肠道间质瘤、良性和恶性组织细胞瘤、和皮肤纤维肉瘤;中枢或外周神经系统肿瘤(例如星形细胞瘤、神经胶质瘤和胶质母细胞瘤、脑膜瘤、室管膜瘤、松果体肿瘤和神经鞘瘤);内分泌肿瘤(例如垂体肿瘤、肾上腺肿瘤、胰岛细胞瘤、甲状旁腺肿瘤、类癌和甲状腺髓样癌);眼和附属器肿瘤(例如视网膜母细胞瘤);生殖细胞和滋养细胞肿瘤(例如畸胎瘤、精原细胞瘤、未分化胚细胞瘤、葡萄胎和绒毛膜癌);和儿科和胚胎肿瘤(例如成神经管细胞瘤、神经母细胞瘤、肾胚细胞瘤和原始神经外胚层肿瘤);或先天性或其它综合征,其使患者易患恶性肿瘤(例如着色性干皮病)。本文提及的术语“预防”包括在疾病诱导之前施用保护性组合物。“抑制”是指在诱导事件后但在临床出现疾病之前施用组合物。“治疗”涉及在疾病症状变得明显后施用保护性组合物。用于筛选在保护或治疗疾病中药物缀合物的有效性的动物模型系统是可获得的。本发明促进了动物模型系统的使用,其允许开发可与人和动物靶标交叉反应的多肽配体,以允许使用动物模型。下面参考以下实施例进一步描述本发明。实施例材料和方法蛋白质表达使用pexpr-iba42(iba)表达载体,在hek293细胞中作为分泌的n-末端his6-标记的可溶性蛋白瞬时表达mt1-mmp血红素结合蛋白样重复序列(也称为mt1-mmp血红素结合蛋白结构域,来自人类基因的残基cys319-gly511)。表达后,通过镍-nta亲和色谱法纯化蛋白,然后进行凝胶过滤,通过sds-page检查纯度。在存在/不存在血红素结合蛋白结构域结合双环的情况下,还通过荧光热移位实验监测批次间的可变性。肽合成使用peptideinstruments制造的symphony肽合成仪和multisyntech的syroii合成仪,基于fmoc化学方法进行肽合成。使用标准fmoc-氨基酸(sigma,merck),其具有以下侧链保护基团:arg(pbf);asn(trt);asp(otbu);cys(trt);giu(otbu);gln(trt);his(trt);lys(boc);ser(tbu);thr(tbu);trp(boc);和tyr(tbu)(sigma)。偶联试剂是hctu(pepceuticals),二异丙基乙胺(dipea,sigma)用作碱,并用dmf中20%的哌啶(agtc)实现脱保护。使用0.37mmol/grfmoc-rink酰胺am树脂(agtc)进行合成,fmoc-氨基酸以4倍过量使用,碱相对于氨基酸4倍过量。将氨基酸以0.2m溶解于dmso中,hctu以0.4m溶解于dmf中,dipea以1.6m溶解于n-甲基吡咯烷酮(alfaaesar)中。这些条件使得偶联反应含有dmf中20-50%的dmso,这减少了固相合成期间的聚集和缺失并提高了产率。偶联时间通常为30分钟,脱保护时间为2×5分钟。将fmoc-n-甲基甘氨酸(fmoc-sar-oh,merck)偶联1小时,以下残基的脱保护和偶联时间分别为20分钟和1小时。合成后,用二氯甲烷洗涤树脂,并干燥。使用10ml95:2.5:2.5:2.5v/v/v/w的tfa/h2o/ipr3sih/二硫苏糖醇持续3小时实现侧链保护基团和从支持物的裂解。裂解后,通过过滤除去废树脂,将滤液加入到已冷却至-80℃的35ml乙醚中。离心肽沉淀(peptidepellet),弃去醚的上清液,再用冷乙醚洗涤肽沉淀两次。然后将肽在5-10ml乙腈-水中再溶解并冻干。取出少量样品用于通过质谱法(来自appliedbiosystems的maldi-tof,voyagerde)分析粗产物的纯度。冻干后,将肽粉末吸收于10ml6m盐酸胍的h2o溶液中,补充有0.5ml1m的二硫苏糖醇,并加载到c8luna制备型hplc柱(phenomenex)上。用0.1%七氟丁酸酸化溶剂(h2o,乙腈)。使用gilson制备型hplc系统,在15分钟内梯度范围为30-70%乙腈,流速为15-20ml/min。将含有纯的线性肽材料的级分(如通过maldi鉴定)组合,并用1,3,5-三(溴甲基)苯(tbmb,sigma)修饰。为此,将线性肽用h2o稀释至~35ml,加入~500μl100mm的tbmb的乙腈溶液,并用5ml1m的nh4hco3的h2o溶液引发反应。使反应在室温进行~30-60分钟,并在反应完成后冻干(通过maldi判断)。冻干后,如上纯化修饰的肽,同时用geminic18柱(phenomenex)替换lunac8,并将酸改变为0.1%三氟乙酸。合并含有正确tmb修饰材料的纯的级分,冻干并保持在-20℃,储存。除非另有说明,所有氨基酸均为l-构型。使用上述一般方法将非天然氨基酸并入肽序列中。本文使用的非天然氨基酸前体的列表总结在下表中:将用于药代动力学研究的肽从0.1%tfa的水溶液中冻干,得到化合物的tfa盐或游离酸。使用17-69-07-n268和17-69-07-n241作为前体双环肽合成bt17bdc-27和bt17bdc-28前体肽17-69-07-n241和17-69-07-n268分别具有序列(bala)-sar10-ac(d-ala)ne(1nal)(d-ala)cedfyd(tbugly)c和ac(d-ala)ne(1nal)(d-ala)cedfyd(tbugly)c。如前所述,两者都用tbmb环化,在n-末端含有用作缀合位点的独特的氨基,并在c-末端酰胺化。合成方案如下所示:方案i前体和中间体巯基肽的分子量示于下表1中:表1:bt17bdc-27和bt17bdc-28的分子性质17-69-07-n331的合成将2.1mldmso中的20.1mm双环溶液(17-69-07-n268)(0.042mmol,80mg)加入到0.6ml无水dmso(0.0546mmol)中的94.0mmsmppnhs酯溶液(casnr:890409-85-5)中,然后加入154μl净(neat)dipea(0.884mmol),将得到的混合物在室温搅拌。1.5小时后,对反应取样并通过lcms分析,判断反应完成。在室温,将423μl的200mmtcep溶液(用碳酸氢铵中和至ph~8的三(2-羧乙基)磷(0.0846mmol)直接加入到反应混合物中。30分钟后,对还原反应取样并通过lcms判断完成。为了纯化,将溶液(~3.0ml)稀释并用配备有c18柱(ymc-actustriartc18制备型hplc柱,12nm,10μm,250×50.0mm)(ymc)(35×200mm)的纯化器100纯化,使用水(0.1%tfa)和乙腈(0.1%tfa)作为流动相。在20分钟内梯度为35-65%乙腈,流速为100ml/min。将含有产物的级分(通过uv判断并通过lcms测定的纯度选择)组合在一起并冻干,得到73mg纯的17-69-07-n331(83%产率)。17-69-07-n319的合成条件和纯化同17-69-07-n331,从0.219mmol(583mg)17-69-07-n241开始,得到417mg17-69-07-n319(68%产率)。dm1-s-s-py的合成将二硫吡啶(341mg,1.55mmol)加入到含有dipea(531μl,3.1mmol)的dm1-sh(229mg,0.31mmol)的无水dmf(12.43ml)溶液中。将反应混合并在室温放置1.5小时;通过esims评估反应进程。esims证实产物已形成mz847.3da并且起始材料已被消耗。使用phenomenexlunac18制备型柱和含有0.1%tfa的流动相,在9个柱体积的20-80%乙腈梯度上纯化产物。将反应混合物稀释到乙腈中,然后用水稀释(最终乙腈浓度20%,最终4%dmf)。合并通过分析型反相hplc得到>95%纯度的级分。产物(dm1-s-s-py)通过uv吸光度在280nm(e=5935mcm-1)在1:1mecn:水中定量,得到分离的185mg(70%产率)。bt17bdc-27的合成将肽17-69-07-n331(239mg,119mmol)在含有dipea(123ml,59mmol)的无水dmf中溶解至浓度为30mm。还将dm1-s-s-吡啶基(60mg,71mmol)在无水dmf中溶解至浓度为25mm。将dm1-s-s-吡啶基溶液加入到肽溶液中并混合。1小时后,通过hplc和ms分析反应进程。总反应时间为2小时。将反应混合物稀释到20%乙腈/水的溶液中,使最终dmf浓度为2%。使用phenomenexlunac18制备型柱和含有0.1%tfa的流动相,在9个柱体积的20-90%乙腈梯度上纯化粗反应混合物。从两个反应获得190mg>95%纯化的肽,总的肽输入量为461mg(产率36.2%)。使用在280nm处测量的吸光度定量肽(e=13225mmm-1)。bt17bdc-28的合成将肽17-69-07-n319(206mg,74mmol)在含有dipea(100ml,59mmol)的无水dmf中溶解至浓度为30mm。还将dm1-s-s-吡啶基(50mg,59mmol)在无水dmf中溶解至浓度为25mm。将dm1-s-s-吡啶基溶液加入到肽溶液中并混合。1小时后,通过hplc和ms分析反应进程。总反应时间为3小时。将反应混合物稀释到乙腈中,然后稀释到水中,最终dmf浓度为4%,乙腈为20%。过滤反应混合物,然后通过rp-hplc纯化。如上所述纯化粗反应混合物,从两个反应中获得230mg>95%纯化的肽,总的肽输入量为395mg(产率55.3%)。在50mmhepesph7.5中使用在280nm处测量的吸光度定量缀合物(e=13225mmm-1)。双环结合物对mt1-mmp的解离速率常数测定直接结合荧光偏振(各向异性)测试通过用其结合配偶体(此处为mt1-mmp血红素结合蛋白结构域)滴定恒定浓度的荧光示踪剂(此处为待研究的荧光双环肽)来进行直接结合荧光偏振或各向异性测试。随着在滴定期间结合配偶体浓度的增加,偏振信号与结合和未结合材料的分数成比例地变化。这允许定量地测定解离速率(kd)。可以使用标准配体结合方程拟合测试数据。典型地,示踪剂的浓度理想地远低于示踪剂:滴定剂对的kd,并且选择的浓度通常为~1nm或更低。滴定剂(结合配偶体)浓度在0.1nm至典型地5μm之间变化。选择该范围使得可以观察到荧光偏振的最大变化。使用的缓冲剂是在0.01%吐温存在下的磷酸盐缓冲盐水。实验在黑色384孔低结合/低体积板(corning3820)中进行,并且使用bmgpherastarfs板读数器测量荧光偏振信号。本文中提到的荧光示踪剂是使用5,6-羧基荧光素进行荧光素化的双环肽。荧光素化可以在肽的n-末端氨基上进行,其通过肌氨酸间隔(通常为sar5)与双环核心序列隔开。如果n-末端氨基对肽是独特的,则这可以在fmoc固相合成期间或合成后(在用tbmb环化和纯化后)进行。荧光素化也可以在c-末端进行,通常在作为第一个c-末端残基引入的赖氨酸上进行,然后其通过肌氨酸间隔(通常为sar6)与双环核心序列隔开。因此,n-末端示踪剂可具有描述为fluo-gly-sar5-a(双环核心序列)的分子格式,并且对于c-末端荧光素化构建体为(双环核心序列)-a-sar6-k(fluo)。实施例中使用的荧光示踪剂是a-(17-69)-a-sar6-k(fluo)、a-(17-69-07)-a-sar6-k(fluo)和a-(17-69-12)-a-sar6-k(fluo)。由于17-69荧光肽的酸性性质,它们通常被制备成浓缩的dmso储液,在100mmtrisph8缓冲液中从该储液制备稀释液。使用荧光偏振(各向异性)的竞争测试由于其对mt1-mmp血红素结合蛋白结构域(pex)的高亲和力,17-69-07和17-69-12的荧光素化衍生物(分别表示为17-69-07-n040和17-69-12-n005)可以用于竞争实验(使用fp进行检测)。在此,用游离的非荧光素化双环肽滴定预先形成的pex与荧光pex结合示踪剂的复合物。由于预期所有基于17-69的肽都在同一位点结合,因此滴定剂将置换pex中的荧光示踪剂。可以定量测量复合物的解离,并测定竞争物(滴定剂)对靶蛋白的kd。竞争方法的优点是可以准确且快速地确定非荧光素化的双环肽的亲和力。示踪剂的浓度通常为kd或更低(此处为1nm),并且结合蛋白(此处为mt1-mmp的血红素结合蛋白)为15倍过量,使得>90%的示踪剂结合。随后,滴定非荧光竞争物双环肽(通常仅是双环核心序列),使得其置换靶蛋白的荧光示踪剂。测量示踪剂的置换并与荧光偏振中的下降相关联。荧光偏振中的下降与结合非荧光滴定剂的靶蛋白的部分成比例,因此是滴定剂与靶蛋白的亲和力的量度。将原始数据拟合于描述荧光示踪剂、滴定剂和结合蛋白之间平衡的三次方程的分析解法(analyticalsolution)。拟合需要荧光示踪剂对靶蛋白的亲和力的值,其可以通过直接结合fp实验单独测定(参见前一部分)。使用sigmaplot12.0进行曲线拟合,并使用zhi-xinwang(febsletters360(1995)111-114)描述的等式的改编版本。血浆稳定性分析方法#1:开发了快速血浆稳定性分析测试,其采用亲本质量以及血浆-蛋白酶诱导的其片段的质谱检测(maldi-tof,voyagerde,appliedbiosystems)。通过评估片段的性质,可以确定优选的裂解位点。在此,将1-1.5mm肽储备液(在dmso中)直接稀释到小鼠/大鼠/人血浆(seralabs,使用柠檬酸盐作为抗凝血剂)中,得到50μm肽的终浓度,并在37℃孵育长达48小时。在适当的时间点取5μl样品并在-80℃冷冻。为了分析,将样品解冻,与25μl3:3:1的乙腈:甲醇:水混合,并在13k离心5分钟。吸出5μl含有肽的上清液,并与30mm碳酸氢铵在1:1的乙腈:h2o的混合物中混合。然后将其1μl在maldi板上点样,干燥,并使基质(α-氰基肉桂酸,sigma,在含有0.1%三氟乙酸的1:1乙腈:水的饱和溶液中制备)在样品(1μl)上成层,干燥并使用malditof分析。应当注意,这是用于检测不同双环肽序列之间的血浆稳定性的比较变化的定性测试,并且用作确定优选裂解位点的优异工具。方法#2为了定量地获得双环肽的血浆稳定性,将肽储备溶液(在dmso中160μm)与血浆(人、大鼠或小鼠)混合,使得最终浓度为4μm,并在37℃孵育。定期取40μl样品最多24小时,在-80℃冷冻。在lc-ms分析之前,将样品解冻,并与3体积(此处,120μl)的1份水、3份乙腈和3份甲醇混合。将乳状混悬液在冷却的离心机中以14000rpm离心40分钟,并使用watersxevotq-d仪器对含有肽的上清液进行双重/三重带电物质及其ms/ms片段定量,同时使用相同肽的血浆提取标准曲线作为参考。血浆中降解的半衰期用于评估分子的比较稳定性。bt17bdc-27和bt17bdc-28在ebc-1异种移植小鼠中的功效。用bdc或载体处理携带皮下ebc-1异种移植肿瘤的balb/c裸鼠。bdc每周给药3次,持续2周,当测量的肿瘤大约150-200mm3时,开始给药。监测小鼠,每周记录3次肿瘤体积和体重的测量值。实施例1:bt17bdc-27和bt17-bdc-28的亲和力分析制备两种dm1-毒素bdc(在下文中称为bt17bdc-27和bt17bdc-28),由此在分子构建体的双环侧引入相同的阻碍。阻碍基团是位于r3和r4位置的甲基。bt17bdc-28采用双环肽17-69-07-n241,其含有bala-sar10分子间隔n-末端连接的,含有4个修饰(d-ala11nal4d-ala5tbugly11)的双环肽。bt17bdc-27采用双环肽17-69-07-n268,其缺少bala-sar10分子间隔n-末端连接的17-69-07-n241的双环肽,但含有相同的4个修饰(d-ala11nal4d-ala5tbugly11)。通过荧光偏振竞争实验测定的17-69-07-n241和17-69-07-n268的双环肽序列及其对mt1-mmp的亲和力显示在表2中:表2:17-69-07-n241和17-69-07-n268的结合亲和力肽代码分子说明kd(nm)17-69-07-n241bala-sar10-a-(17-69-07)d-ala11nal4d-ala5tbugly111.21±0.2417-69-07-n268a-(17-69-07)d-ala11nal4d-ala5tbugly111.70±0.28从数据可以清楚地看出,bala-sar10分子间隔不是保持对靶标的亲和力所必需的,因此可以相信与效应物(此处为dm1)的缀合是可以耐受的。此外,缺乏亲水性分子sar10间隔的bdc具有较低的分子量和较高的毒素与重量比,以及较高的整体疏水性,这些可能一致性地影响药代动力学和药效学行为。根据方案i合成bt17bdc-27和bt17bdc-28。此处,含胺的双环肽前体(分别为17-69-07-n268和17-69-07-n241)与smpp(其引入吡啶基-二硫化物保护的受阻二硫化物)缀合,并被还原以暴露双环肽上的游离但受阻的巯基。然后用吡啶基-二硫化物活化的dm1(dm1-s-s-py)进行二硫化物交换,得到所需产物。实施例2:bt17bdc-27和bt17bdc-28的体外表征评估两种bdc缀合物结构的几种体外参数,如对人mt1-mmp血红素结合蛋白结构域的效力保留,在小鼠、大鼠和人血浆中的稳定性,以及对还原剂如二硫苏糖醇的稳定性。数据总结在下表3中:表3:bt17bdc-27和bt17bdc-28的体外特性其中n=重复次数a:使用17-69-07-n040作为示踪剂,通过荧光偏振竞争实验测定b:使用定量lc-ms测定。血浆中的孵育时间长达24小时,含有4μmbdc。c:来自kellogg等人(2011)bioconjugatechemistry,22,717。注意这些值涉及含有本文中描述的二硫化物连接子的抗体药物缀合物。d:通过定量lc-ms测定。注意,这些值涉及含有本文中描述的二硫化物连接子的双环药物缀合物。方法改编自kellogg等人(2011)bioconjugatechemistry,22,717。数据表明即使不存在sar10分子间隔,构建体也能耐受毒素附着,因为保留了对mt1-mmp靶标的亲和力。此外,与无阻碍二硫化物bdc相比,dtt的相对稳定性对于bt17bdc-27和bt17bdc-28几乎相同,表明分子间隔的存在或不存在不影响毒素释放速率。实施例3:bt17bdc-27和bt17bdc-28的体内功效使用人肺鳞状细胞癌系ebc-1测试两种bdc在小鼠异种移植模型中的体内功效。bt17bdc-27比bt17bdc-28更有效,因为它在14天内(图1)以10mg/kg清除肿瘤。在该剂量下可观察到体重轻微降低(图2)。相反,在10mg/kg时,bt17bdc-28导致肿瘤生长停滞但没有主动消退(图3),而针对bt17bdc-28未观察到体重减轻(图4)。由于bt17bdc-27在等于或低于5mg/kg的剂量下可观的功效和耐受性而值得进一步关注。序列表<110>拜斯科治疗有限公司<120>mt1-mmp特异性双环肽-毒素缀合物<130>bic-c-p2017pct<150>1607827.1<151>2016-05-04<160>15<170>patentinversion3.5<210>1<211>14<212>prt<213>人工的<220><223>合成肽<220><221>misc_feature<222>(2)..(5)<223>xaa可以是任何天然存在的氨基酸<220><221>misc_feature<222>(12)..(13)<223>xaa可以是任何天然存在的氨基酸<400>1cysxaaxaaxaaxaaglycysgluaspphetyrxaaxaacys1510<210>2<211>14<212>prt<213>人工的<220><223>合成肽<400>2cystyrasnglupheglycysgluaspphetyraspilecys1510<210>3<211>15<212>prt<213>人工的<220><223>合成肽<400>3alacystyrasnglupheglycysgluaspphetyraspilecys151015<210>4<211>15<212>prt<213>人工的<220><223>合成肽<400>4cysaspalaasnglupheglycysgluaspphetyraspilecys151015<210>5<211>17<212>prt<213>人工的<220><223>合成肽<220><221>misc_feature<222>(2)..(2)<223>xaa可以是任何天然存在的氨基酸<220><221>misc_feature<222>(8)..(8)<223>xaa可以是任何天然存在的氨基酸<220><221>misc_feature<222>(16)..(16)<223>xaa可以是任何天然存在的氨基酸<400>5alaxaaalacysalaasngluxaaalacysgluaspphetyraspxaa151015cys<210>6<211>14<212>prt<213>人工的<220><223>合成肽<220><221>misc_feature<222>(2)..(5)<223>xaa可以是任何天然存在的氨基酸<220><221>misc_feature<222>(12)..(13)<223>xaa可以是任何天然存在的氨基酸<400>6cysxaaxaaxaaxaaglycysgluaspphetyrxaaxaacys1510<210>7<211>14<212>prt<213>人工的<220><223>合成肽<220><221>misc_feature<222>(2)..(4)<223>xaa可以是任何天然存在的氨基酸<400>7cysxaaxaaxaapheglycysgluaspphetyraspilecys1510<210>8<211>14<212>prt<213>人工的<220><223>合成肽<220><221>misc_feature<222>(2)..(4)<223>xaa可以是任何天然存在的氨基酸<400>8cysxaaxaaxaapheglycysgluaspphetyraspilecys1510<210>9<211>14<212>prt<213>人工的<220><223>合成肽<220><221>misc_feature<222>(2)..(2)<223>xaa可以是任何天然存在的氨基酸<220><221>misc_feature<222>(4)..(4)<223>xaa可以是任何天然存在的氨基酸<400>9cysxaaasnxaapheglycysgluaspphetyraspilecys1510<210>10<211>14<212>prt<213>人工的<220><223>合成肽<400>10cysmetasnglnpheglycysgluaspphetyraspilecys1510<210>11<211>14<212>prt<213>人工的<220><223>合成肽<400>11cyspheglyglupheglycysgluaspphetyraspilecys1510<210>12<211>14<212>prt<213>人工的<220><223>合成肽<400>12cysvalasnglupheglycysgluaspphetyraspilecys1510<210>13<211>14<212>prt<213>人工的<220><223>合成肽<400>13cyspheasnglupheglycysgluaspphetyraspilecys1510<210>14<211>14<212>prt<213>人工的<220><223>合成肽<400>14cystyrasnglutyrglycysgluaspphetyraspilecys1510<210>15<211>14<212>prt<213>人工的<220><223>合成肽<400>15cystyrasnglutrpglycysgluaspphetyraspilecys1510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1