防粘连用组合物的制作方法
本发明涉及防粘连材料、其制造方法和海绵状层合体。
背景技术:
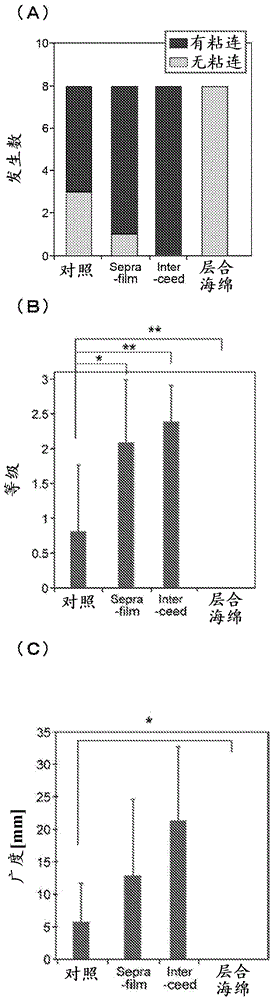
:粘连是指,应该彼此分离的组织的表面被纤维性组织连接或融合的状态。粘连通过如下产生:伴随着外伤或炎症,在组织的表面产生包含纤维蛋白的渗出液,该渗出液机化(organization)而使组织表面连接或融合。外科手术中在组织的表面出现的外伤、因外伤而引起的炎症、和外科手术中组织表面干燥所致的炎症,成为产生粘连的原因。粘连有时可导致不孕、肠梗阻、慢性骨盆痛。另外,为了剥离外科手术后所产生的粘连,还需要进行再次的外科手术。例如,对于肝癌的复发例,多次手术是有效的,但可否应用再次手术的判断、治疗的风险、手术时的出血量、手术时间等,均大大地取决于前次手术术后的防粘连的情况。根据这些情况,有必要防粘连,为了防粘连,至今已经采取了各种手段。用于防粘连的此种手段的几种中,有设置在外伤或炎症部位与其相邻组织之间配置以防止组织的连接或融合的物理性屏障。作为此种物理性屏障,已知有片状的屏障等。具体而言,作为片状的屏障,有聚四氟乙烯(ptfe)膜(preclude(商品名)(wlgoreandassociates,inc.))、含有透明质酸(ha)和羧基甲基纤维素(cmc)的片(seprafilm(商品名)(genzymegmbh))、再生氧化纤维素片(interceed(商品名)(johnson&johnson))等。其中,ptfe膜是非生物分解性,因此存在残留于体内的问题。含有ha和cmc的片和再生氧化纤维素片,虽然是生物分解性,但完全无法防止如肝脏切除后所产生的粘连这样的重度粘连,在防粘连的效果方面仍存在改善的空间。在此,已知有:将选自胶原蛋白等蛋白质、或羧基甲基纤维素、透明质酸、海藻酸等多糖的生物体适合性的材料制成片状、粒子状,用作医疗用吸收物质、医疗用粘贴材料、防粘连材料、生物体组织补强材料等(专利文献1~6)。现有技术文献专利文献专利文献1:日本特开昭48-79870号公报专利文献2:日本特开2003-126235号公报专利文献3:国际公开第2005/26214号专利文献4:日本特开2011-25013号公报专利文献5:日本特开2013-165884号公报专利文献6:日本特表2016-502874号公报。技术实现要素:发明所要解决的课题在此种情况下,需求具有防粘连效果高、可以抑制创伤部的粘连与新生粘连(denovoadhesion)这两者、不会对应用的生物体(活体)产生不良影响、不会妨碍创伤部的愈合、还可用于肠道吻合等、内窥镜手术中通过套管针容易应用、可调节粘贴位置而重新粘贴等的至少一个性能的防粘连材料。用于解决课题的手段本发明人在基于假设了临床中的各种手术的动物的粘连模型中,对兼具膜(片)状防粘连材料的优点和喷雾(液/凝胶)状防粘连材料的优点的防粘连材料进行了反复深入的研究,结果发现:第1层与第2层的溶解速度不同的可应用于生物体的海绵状的防粘连材料,具体而言,包含可应用于生物体的海绵状层合体的防粘连材料不仅防止手术部位(局所)的粘连,而且在应用区域的广范围中具有防粘连效果等,所述海绵状层合体包含:含有重均分子量较高的低内毒素海藻酸的1价金属盐的海绵状的第1层和含有重均分子量较低的低内毒素海藻酸的1价金属盐的海绵状的第2层,从而完成了本发明。本发明如下所示。[1-1]防粘连材料,其包含经灭菌的可应用于生物体的海绵状层合体,所述海绵状层合体包含:至少一部分用固化剂交联的低内毒素海藻酸的1价金属盐的海绵状的第1层和第2层,第1层的海藻酸的1价金属盐的重均分子量为10,000~2,000,000,第2层的海藻酸的1价金属盐的重均分子量为1,000~1,000,000,上述重均分子量是在脱交联处理后利用gpc-mals法测定而得的,第1层的海藻酸的1价金属盐的重均分子量高于第2层的海藻酸的1价金属盐的重均分子量。[1-1a]防粘连材料,其包含可应用于生物体的海绵状层合体,所述海绵状层合体包含:含有重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐的海绵状的第1层和含有重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐的海绵状的第2层,上述重均分子量是利用gpc-mals法测定而得的,第1层的海藻酸的1价金属盐的重均分子量高于第2层。[1-2]上述[1-1]或[1-1a]所述的防粘连材料,其中,第1层和第2层中的任一包含固化剂。[1-3]上述[1-1]~[1-2]中任一项所述的防粘连材料,其中,第1层和第2层两者均包含固化剂。[1-4]上述[1-1]~[1-3]中任一项所述的防粘连材料,其中,低内毒素海藻酸的1价金属盐在第1层与第2层中的使用量的总计为0.1mg/cm2~3mg/cm2的范围。[1-5]上述[1-1]~[1-4]中任一项所述的防粘连材料,其中,第1层与第2层的海藻酸的1价金属盐的内毒素含量为500eu/g以下。[1-6]上述[1-1]~[1-5]中任一项所述的防粘连材料,其中,第1层与第2层的海藻酸的1价金属盐为海藻酸钠或海藻酸钾。[1-7]上述[1-1]~[1-6]中任一项所述的防粘连材料,其中,第1层与第2层的固化剂为选自cacl2、caso4、zncl2、srcl2、fecl3和bacl2的至少一种金属离子化合物。[1-8]上述[1-1]~[1-7]中任一项所述的防粘连材料,其用于使第1层朝向创伤部侧的表面进行应用。[1-9]上述[1-1]~[1-7]中任一项所述的防粘连材料,其中,海绵状层合体是通过作为吸收剂量的10kgy~150kgy的电子射线和/或γ射线照射进行灭菌而得的。[1-10]防粘连材料,其包含可应用于生物体的海绵状层合体,所述海绵状层合体包含:分别含有至少一部分用固化剂交联的低内毒素海藻酸的1价金属盐的第1层和第2层,第1层的溶解速度较第2层慢。[1-10a]防粘连材料,其包含可应用于生物体的海绵状层合体,所述海绵状层合体包含:分别含有低内毒素海藻酸的1价金属盐的第1层和第2层,第1层的溶解速度较第2层慢。[1-11]上述[1-10]或[1-10a]的防粘连材料,其中,在以海藻酸的1价金属盐相对于ph7.5的磷酸缓冲液的洗脱为指标的溶解试验中,将第2层的海藻酸的1价金属盐的洗脱量设为100%时的、第1层的海藻酸的1价金属盐的洗脱量的比例,在从测定开始起1小时的时间点为低于50%,在2小时的时间点为低于70%。[1-12]上述[1-10]或[1-10a]的防粘连材料,其中,在以海藻酸的1价金属盐相对于ph7.5的磷酸缓冲液的洗脱为指标的溶解试验中,第1层是海藻酸的1价金属盐的25±10重量%在1小时以内洗脱、80±10重量%在4小时以内洗脱的层,第2层是海藻酸的1价金属盐的70±10重量%在1小时以内洗脱、90±10重量%在4小时以内洗脱的层。[1-13]上述[1-1]~[1-12]中任一项所述的防粘连材料,其中,海绵状层合体是经加压的制品。[2-1]防粘连的方法,所述方法包括:将经灭菌的可应用于生物体的海绵状层合体以第1层朝向创伤部侧的表面而应用于需要防粘连的对象,其中,所述海绵状层合体包含:至少一部分用固化剂交联的低内毒素海藻酸的1价金属盐的海绵状的第1层和第2层,第1层的海藻酸的1价金属盐的重均分子量为10,000~2,000,000,第2层的海藻酸的1价金属盐的重均分子量为1,000~1,000,000,上述重均分子量是在脱交联处理后利用gpc-mals法测定而得的,第1层的海藻酸的1价金属盐的重均分子量高于第2层的海藻酸的1价金属盐的重均分子量。[2-1a]防粘连的方法,所述方法包括:将可应用于生物体的海绵状层合体应用于需要防粘连的对象,其中,所述海绵状层合体包含:含有重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐的海绵状的第1层和含有重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐的海绵状的第2层,上述分子量是利用gpc-mals法测定而得的,第1层的海藻酸的1价金属盐的重均分子量高于第2层。[2-2]上述[2-1]或[2-1a]所述的防粘连的方法,其中,第1层和第2层的任一包含固化剂。[2-3]上述[2-1]~[2-2]中任一项所述的防粘连的方法,其中,第1层和第2层两者均包含固化剂。[2-4]上述[2-1]~[2-3]中任一项所述的防粘连的方法,其中,低内毒素海藻酸的1价金属盐在第1层与第2层中的使用量的总计为0.1mg/cm2~3mg/cm2的范围。[2-5]上述[2-1]~[2-4]中任一项所述的防粘连的方法,其中,第1层与第2层的海藻酸的1价金属盐的内毒素含量为500eu/g以下。[2-6]上述[2-1]~[2-5]中任一项所述的防粘连的方法,其中,第1层与第2层的海藻酸的1价金属盐为海藻酸钠或海藻酸钾。[2-7]上述[2-1]~[2-6]中任一项所述的防粘连的方法,其中,第1层与第2层的固化剂为选自cacl2、caso4、zncl2、srcl2、fecl3和bacl2的至少一种金属离子化合物。[2-8]上述[2-1]~[2-7]中任一项所述的防粘连的方法,其中,海绵状层合体是通过作为吸收剂量的10kgy~150kgy的电子射线和/或γ照射进行灭菌而得的。[2-9]防粘连的方法,所述方法包括:将可应用于生物体的海绵状层合体应用于需要防粘连的对象,其中,所述海绵状层合体包含:分别含有至少一部分用固化剂交联的低内毒素海藻酸的1价金属盐的第1层和第2层,第1层的溶解速度较第2层慢。[2-9a]防粘连的方法,所述方法包括:将可应用于生物体的海绵状层合体应用于需要防粘连的对象,其中,所述海绵状层合体包含:分别含有低内毒素海藻酸的1价金属盐的第1层和第2层,第1层的溶解速度较第2层慢。[2-10]上述[2-9]或[2-9a]的防粘连材料,其中,在以海藻酸的1价金属盐相对于ph7.5的磷酸缓冲液的洗脱为指标的溶解试验中,将第2层的海藻酸的1价金属盐的洗脱量设为100%时的、第1层的海藻酸的1价金属盐的洗脱量的比例是,在从测定开始起1小时的时间点为低于50%、在2小时的时间点为低于70%。[2-11]上述[2-9]或[2-9a]的防粘连的方法,其中,在以海藻酸的1价金属盐相对于ph7.5的磷酸缓冲液的洗脱为指标的溶解试验中,第1层是海藻酸的1价金属盐的25±10重量%在1小时以内洗脱、80±10重量%在4小时以内洗脱的层,第2层是海藻酸的1价金属盐的70±10重量%在1小时以内洗脱、90±10重量%在4小时以内洗脱的层。[2-12]上述[2-1]~[2-11]中任一项所述的防粘连的方法,其中,海绵状层合体是经加压的制品。[3-1]包含可应用于生物体的海绵状层合体的防粘连材料的制造方法,所述方法包括以下的工序:(1)使重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐利用固化剂进行固化的工序;(2)将已固化的海藻酸的1价金属盐进行冷冻的工序;(3)在(2)中所得的海藻酸的1价金属盐之上,将重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐利用固化剂进行固化而得到层合体的工序;(4)将所得的层合体进行冷冻干燥而得到海绵状层合体的工序,在此,上述分子量是利用gpc-mals法测定而得的,上述海绵状层合体包含:含有重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐的海绵状的第1层和含有重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐的海绵状的第2层,第1层的海藻酸的1价金属盐的重均分子量高于第2层。[3-2]上述[3-1]所述的防粘连材料的制造方法,其中,海绵状层合体是通过作为吸收剂量的10kgy~150kgy的电子射线和/或γ照射进行灭菌而得的。[3-3]上述[3-1]或[3-2]所述的防粘连材料的制造方法,所述方法进一步包括:将(4)中所得的层合体进行加压的工序。[4-1]可应用于生物体的海绵状层合体,其通过以下的工序(1)~(4)而得到:(1)使重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐利用固化剂进行固化的工序;(2)将已固化的海藻酸的1价金属盐进行冷冻的工序;(3)在(2)中所得的海藻酸的1价金属盐之上,将重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐利用固化剂进行固化而得到层合体的工序;(4)将所得的层合体进行冷冻干燥而得到海绵状层合体的工序,在此,上述分子量是利用gpc-mals法测定而得的,上述海绵状层合体包含:含有重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐的海绵状的第1层和含有重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐的海绵状的第2层,第1层的海藻酸的1价金属盐的重均分子量高于第2层。[4-2]上述[4-1]的海绵状层合体,其用作防粘连材料。[4-3]上述[4-1]或[4-2]所述的海绵状层合体,其中,海绵状层合体是通过作为吸收剂量的10kgy~150kgy的电子射线和/或γ照射进行灭菌而得的。[4-4]上述[4-1]~[4-3]中任一项所述的海绵状层合体,其中,进一步包括对(4)中所得的层合体进行加压的工序。[5-1]用于制造防粘连材料的原料组合,其包含:含有重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐的第1原料和含有重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐的第2原料,第1原料的重均分子量高于第2原料。[5-2]上述[5-1]所述的原料组合,其是用于制造海绵状层合体的原料组合。发明效果根据本发明,可以提供:具有防粘连效果高、可以抑制创伤部的粘连和新生粘连这两者、不会对应用的生物体产生不良影响、不会妨碍创伤部的愈合、还可以用于肠道吻合等、内窥镜手术中通过套管针容易应用、可调节粘贴位置而重新粘贴等的至少一个性能的防粘连材料。附图说明[图1]是显示防粘连材料的一个例子的图。[图2]是显示防粘连材料的各层的溶解速度的评价的图。[图3]是显示在部分肝脏切除模型中的粘连形成的评价的图。(a)在离断面形成了粘连的个体数,(b)离断面等级,(c)离断面广度(extent)(mm)。**p<0.01,*p<0.05。[图4]是显示在部分肝脏切除模型中的粘连形成的评价的图。(a)在非离断面粘连形成的个体数,(b)非离断面等级,(c)非离断面广度(mm)。**p<0.01,*p<0.05。[图5]是显示在部分肝脏切除模型中的体重变化和脾脏重量的评价的图。(a)体重变化,(b)脾脏重量。[图6]是显示在pean(ペアン)肝脏切除模型中的粘连形成的评价的图。(a)在离断面粘连形成的个体数,(b)离断面等级,(c)离断面广度(mm)。**p<0.01,*p<0.05。[图7]是显示在pean肝脏切除模型中的粘连形成的评价的图。(a)在非离断面粘连形成的个体数,(b)非离断面等级,(c)非离断面广度(mm)。**p<0.01,*p<0.05。[图8]是显示在pean肝脏切除模型中的体重变化和脾脏重量的评价的图。(a)体重变化,(b)脾脏重量。[图9]是显示加压(press)前后的海绵的溶胀试验结果的图。[图10]是显示喷雾后的各试验片前端的高度(a)和与试验台的角度(b)的经时变化的图。具体实施方式以下,对本发明进行详细地说明,但以下的实施方案是用于说明本发明的示例,本发明在不脱离其要旨的情况下能够以各种各样的方式进行实施。1.防粘连“粘连”是指,应该彼此分离的组织的表面被纤维性的组织连接或融合的状态。粘连的原因在于,外科手术中在组织的表面出现的外伤、因外伤而引起的炎症、外科手术中组织表面干燥所致的炎症等。伴随这些外伤或炎症,在组织的表面产生包含纤维蛋白的渗出液,该渗出液进行机化而使组织表面连接或融合,由此形成粘连。“防粘连”是指,使粘连的形成减少。防粘连未必需要完全防止粘连的形成,只要与不应用本发明的防粘连材料的情况的状态相比,可防止粘连的形成即可。即“防粘连”可理解为粘连的减轻,例如,只要选自粘连的频率、范围和程度的至少1种减轻即可。关于“防粘连”,例如,在进行实施例所记载的粘连的等级评价的情况下,与不应用本发明的防粘连材料的情况的平均粘连的等级相比,只要平均粘连的等级更低即可。或者,关于“防粘连”,例如,在进行实施例所记载的粘连的广度评价的情况下,与不应用本发明的防粘连材料的情况的平均粘连的广度相比,只要平均粘连的广度更低即可。“防粘连”优选为因外科手术而产生的粘连的防止,更优选为因外科手术而产生的腹膜粘连的防止。即,“防粘连”优选为术后的防粘连。另外,如实施例所示,作为成为对象的粘连,有手术时的对象脏器的切除部位的粘连和新生粘连(与手术部位以外的周边、腹腔和体内的广泛部位的粘连)。2.防粘连材料本发明提供防粘连材料(以下,有时称为“防粘连材料a”),其包含可应用于生物体的海绵状层合体,所述海绵状层合体包含至少一部分用固化剂交联的低内毒素海藻酸的1价金属盐的海绵状的第1层和第2层,其中包含含有重均分子量较高的低内毒素海藻酸的1价金属盐的海绵状的第1层和含有重均分子量较低的低内毒素海藻酸的1价金属盐的海绵状的第2层。第1层与第2层中所用的低内毒素海藻酸的1价金属盐的重均分子量例如分别为10,000~2,000,000和1,000~1,000,000。这样的重均分子量是在脱交联处理、例如溶解于螯合剂溶液之后利用gpc-mals法测定而得的。需说明的是,本说明书中,在数值范围中使用“~”符号的情况下,是指“下限值以上、且上限值以下”的范围,符号两端的数值包含在该范围内。防粘连材料a在海绵状层合体的第1层与第2层中包含不同分子量的低内毒素海藻酸的1价金属盐。具体而言,第1层的海藻酸的1价金属盐的重均分子量高于第2层。关于包含海藻酸的1价金属盐的层,若海藻酸的1价金属盐的重均分子量大则溶解速度变慢,另一方面,若重均分子量小则溶解速度变快。所以,通过使第1层朝向创伤部侧、第2层朝向腹腔侧来应用本发明的防粘连材料a,可以期待第1层残留于创伤部,同时第2层较快溶解而抑制整个腹腔内的粘连。另外,本发明提供防粘连材料(“防粘连材料b”),其包含可应用于生物体的海绵状层合体,所述海绵状层合体包含:分别含有至少一部分用固化剂交联的低内毒素海藻酸的1价金属盐的第1层和第2层,第1层与第2层的溶解速度不同。具体而言,第1层的溶解速度较第2层慢。为了使第1层的溶解速度较第2层的溶解速度变慢,例如可举出:如防粘连材料a那样使第1层的海藻酸的1价金属盐的重均分子量高于第2层;通过变更交联剂的种类、或变更交联剂的浓度等使第1层的海藻酸的1价金属盐的交联度高于第2层,等。优选防粘连材料b如下:在以海藻酸的1价金属盐的洗脱为指标的溶解试验中,将第2层的海藻酸的1价金属盐的洗脱量设为100%时的、第1层的海藻酸的1价金属盐的洗脱量的比例,在从测定开始起1小时的时间点为低于50%、在2小时的时间点为低于70%。作为另外的优选实例,防粘连材料b如下:在以海藻酸的1价金属盐的洗脱为指标的溶解试验中,第1层是海藻酸的1价金属盐的25±10重量%在1小时以内洗脱、80±10重量%在4小时以内洗脱的层,第2层是海藻酸的1价金属盐的70±10重量%在1小时以内洗脱、90±10重量%在4小时以内洗脱的层。关于溶解试验,具体而言,如下述的实施例所述。在此,本说明书中,有时将“防粘连材料a”与“防粘连材料b”合在一起称为“防粘连材料”。另外,“第1层”是将海绵状层合体应用于对象时成为下层的层、即与对象的应该应用的组织表面接触之侧的层。“第2层”是将海绵状层合体应用于对象时成为上层的层、即不与对象的应该应用的组织表面接触之侧的层。“可应用于生物体”是指,可作为医疗材料配置于应该应用的组织表面。用于防粘连材料的可应用于生物体的海绵状的层合体,除了上述的第1层、第2层以外,还可具有包含任意成分的第3层,另外也可具有多层结构。另外,也包含各层不具有清晰的界面、而具有如分子量连续地渐增或渐减那样的结构的海绵状层合体。将防粘连材料的一个例子示于图1。防粘连材料1包含含有第1层2和第2层3的海绵状层合体4。第1层2和第2层3分别是海绵状。“海绵状”是指,具有多孔性的状态。可应用于生物体的海绵状层合体的形状不受特别限定,可以考虑要应用的表面的范围、形状、凹凸等而适当选择。关于海绵状层合体的形状,例如,可以是如图1所示的平板状,或者可以制成圆板状、圆筒状、长方体状等的形状。优选为平板状或圆板状。为平板状或圆板状时,可以根据要应用的表面范围、形状、凹凸等进一步切割防粘连材料而应用于表面,因此平板或圆板的尺寸不受特别限定。例如,若将平板状的形状以长×宽×高度(厚度)表示,则长与宽的长度不受特别限定,高度(厚度)优选为0.2mm~30mm、更优选为0.3mm~15mm、进一步优选为0.5mm~10mm。进一步优选:除了为这样的高度(厚度)之外,长与宽的长度分别为1mm~300mmx1mm~300mm、特别优选为3mm~200mmx3mm~200mm、进一步优选为5mm~150mmx5mm~150mm。需说明的是,厚度不均匀也可,可以是一层厚而另一层薄、倾斜结构。本发明的防粘连材料的海绵状层合体,与seprafilm(商品名)相比,柔软性高、不易破裂。在若干方案中,海绵状层合体是经加压的制品。“加压”如下所述。在海绵状层合体为经加压的制品的情况下,其高度(厚度)优选为0.02mm~3mm、更优选为0.03mm~1.5mm、进一步优选为0.05mm~1mm。进一步优选:除了为这样的高度(厚度)之外,长与宽的长度分别为1mm~300mmx1mm~300mm、特别优选为3mm~200mmx3mm~200mm、进一步优选为5mm~150mmx5mm~150mm。需说明的是,在若干方案中,加压后的厚度是均匀的。3.海藻酸的1价金属盐“海藻酸的1价金属盐”是通过将海藻酸的6位羧酸的氢原子与na+或k+等1价金属离子进行离子交换而形成的水溶性盐。作为海藻酸的1价金属盐,具体而言,可举出海藻酸钠、海藻酸钾等,但特别优选可由市售品获取的海藻酸钠。海藻酸的1价金属盐的溶液在与固化剂混合时形成凝胶。本发明中使用的“海藻酸”是生物分解性的高分子多糖类,是d-甘露糖醛酸(m)和l-葡萄糖醛酸(g)这两种糖醛酸聚合成直链状所得的聚合物。更具体地说,是d-甘露糖醛酸的均聚物部分(mm部分)、l-葡萄糖醛酸的均聚物部分(gg部分)、以及d-甘露糖醛酸和l-葡萄糖醛酸无规排列而成的部分(mg部分)任意结合而成的嵌段共聚物。海藻酸的d-甘露糖醛酸和l-葡萄糖醛酸的构成比(m/g比)主要根据海藻等的来源生物的种类而不同,还受该生物生长发育场所、季节的影响,m/g比在约0.4的高g型至m/g比为约5的高m型的高范围内。海藻酸的1价金属盐是高分子多糖类,准确地确定分子量是困难的,在天然物来源的高分子物质的分子量测定中,已知根据测定方法可产生值的差异。根据gpc-mals法,可以测定绝对重均分子量。关于用作原料的海藻酸的1价金属盐的利用gpc-mals法测定而得的重均分子量,在海绵状层合体的第1层中,例如为10,000~2,000,000、优选为15,000~1,500,000、更优选为20,000~1,000,000、特别优选为25,000~500,000。除了这样的第1层之外,关于利用gpc-mals法测定而得的重均分子量,在第2层中,例如为1,000~1,000,000、优选为1,000~500,000、更优选为2,000~250,000、特别优选为3,000~100,000。在若干方案、例如通过电子射线和/或γ射线灭菌的照射后,关于利用gpc-mals法测定而得的重均分子量,在海绵状层合体的第1层中,例如为10,000~300,000、优选为10,000~200,000、更优选为10,000~100,000、特别优选为10,000~80,000。除了这样的第1层之外,关于利用gpc-mals法测定而得的重均分子量,在第2层中,例如为1,000~100,000、优选为1,000~80,000、更优选为2,000~60,000、特别优选为3,000~60,000。关于至少一部分用固化剂交联的海藻酸的1价金属盐,通过在任意的脱交联处理后利用gpc-mals法进行测定,可以测定作为未交联的海藻酸的1价金属盐的重均分子量。作为脱交联处理,例如可举出:溶解于任意的螯合剂、例如edta(乙二胺四乙酸)、植酸等的螯合剂溶液中。作为所用的螯合剂,优选edta。海绵状层合体的第1层的海藻酸的1价金属盐的重均分子量高于第2层。海绵状层合体的原料、或者海绵状层合体所含的第1层的海藻酸的1价金属盐的重均分子量相比第2层,例如高1,000~1,000,000、优选高2,000~500,000、更优选高3,000~300,000。通常,在将高分子多糖类的分子量用如上述的方法进行计算的情况下,会产生10~20重量%的测定误差。例如,若为10,000则在8,000~12,000、若为100,000则在80,000~120,000、若为200,000则在160,000~240,000、若为400,000则在320,000~480,000、若为500,000则在400,000~600,000左右的范围内可产生值的变动。海藻酸类的分子量的测定可以按照常规方法进行测定。在分子量测定中使用gpc-mals的情况的代表性条件,如本说明书的实施例1中所述。作为检测器,例如可以使用ri检测器和光散射检测器(mals)。关于海藻酸类,在从褐藻类提取的初期通常分子量较大,但在用热干燥、纯化等的过程中,分子量逐渐变小。通过制造工序的温度等的条件管理、作为原料的褐藻类的选择、制造工序中的分子量的分级等的方法可以制造分子量不同的海藻酸类。此外,通过与具有不同的分子量的其它批次的海藻酸类混合,也可制成具有目标分子量的海藻酸类。本发明中所用的海藻酸的1价金属盐是经低内毒素处理而得的。低内毒素处理可通过公知的方法或仿照其的方法进行。例如,可以通过下述的方法或仿照它们的方法实施:管等人的纯化透明质酸钠的方法(例如,参照日本特开平9-324001号公报等),吉田等人的纯化β1,3-葡聚糖的方法(例如,参照日本特开平8-269102号公报等),william等人的纯化海藻酸盐、结冷胶等的生物体高分子盐的方法(例如,参照日本特表2002-530440号公报等),james等人的纯化多糖的方法(例如,参照国际公开第93/13136号小册子等)、lewis等人的方法(例如,参照美国专利第5589591号说明书等),hermannfrank等人的纯化海藻酸盐的方法(例如,参照applmicrobiolbiotechnol(1994)40:638-643等)等。本发明的低内毒素处理不限于这些,可以通过洗涤、用滤器(除去内毒素的滤器或带电的滤器等)过滤、超滤、使用柱(内毒素吸附亲和柱、凝胶过滤柱、基于离子交换树脂的柱等)的纯化、吸附到疏水性物质、树脂或活性炭等、有机溶剂处理(用有机溶剂的提取、添加有机溶剂导致的析出/沉降等)、表面活性剂处理(例如,参照日本特开2005-036036号公报等)等公知的方法或者将它们适当组合进行实施。在这些处理的工序中,也可适当组合离心分离等公知的方法。根据海藻酸的种类适当选择为宜。内毒素水平可按照公知的方法确认,例如可通过鲎(limulus)试剂(lal)的方法、使用endospecy(注册商标)es-24s试剂盒(生化学工业株式会社)的方法等进行测定。本发明中所用的海藻酸的1价金属盐的内毒素的处理方法不受特别限定,但作为其结果,生物体内吸收性多糖类的内毒素含量在通过鲎试剂(lal)进行内毒素测定的情况下,优选为500内毒素单位(eu)/g以下、进一步优选为100eu/g以下、尤其优选为50eu/g以下、特别优选为30eu/g以下。经低内毒素处理的海藻酸钠例如可由seamatrix(注册商标)(持田制药株式会社)、pronovatmuplvg(fmcbiopolymer)等市售品获取。海绵状层合体中的海藻酸的1价金属盐的使用量可考虑防粘连效果而适当选择。关于海藻酸的1价金属盐的使用量,按海绵状层合体的第1层与第2层的总计,例如可举出0.1mg/cm2~10.0mg/cm2、优选为0.1mg/cm2~3.0mg/cm2、更优选为0.5mg/cm2~2.5mg/cm2、进一步优选为1.8mg/cm2~2.2mg/cm2、特别优选为2.0mg/cm2。海藻酸的1价金属盐的使用量按海绵状层合体的第1层与第2层的总计为1.0mg/cm2~3.0mg/cm2,由此,可期待更高的防粘连效果。如果使用量为10.0mg/cm2以下则生物体内的蓄积或特定脏器的肥大等的有害现象的担忧少,如果使用量为0.1mg/cm2以上则可期待充分的防粘连效果。第1层与第2层的海藻酸的1价金属盐的使用量之比(重量比)优选为1:20~20:1、更优选为1:5~5:1、进一步优选为1:3~3:1、特别优选为1:2~2:1。4.固化剂(交联剂)防粘连材料中,第1层和第2层的任一可含有固化剂(即,第1层和第2层的任一可不含有固化剂),或者第1层和第2层两者均可含有固化剂。或者,防粘连材料中,第1层或第2层均可不含有固化剂。在此,在若干方案中,第1层和第2层是至少一部分用固化剂交联而得的层。固化剂通过将海藻酸的1价金属盐的溶液交联而进行固化的物质。关于固化剂,例如可举出:ca2+、mg2+、ba2+、sr2+、zn2+、fe3+等的2价以上的金属离子化合物,分子内具有2~4个氨基的交联性试剂等。更具体而言,作为2价以上的金属离子化合物,可举出:cacl2、mgcl2、caso4、zncl2、fecl3、bacl2、srcl2等(优选为cacl2、caso4、zncl2、srcl2、fecl3、bacl2等);作为分子内具有2~4个氨基的交联性试剂,包含可在氮原子上具有赖氨酰基(-coch(nh2)-(ch2)4-nh2)的二氨基链烷烃,即二氨基链烷烃及其氨基被赖氨酰基取代而形成了赖氨酰基氨基的衍生物,具体而言,可举出二氨基乙烷、二氨基丙烷、n-(赖氨酰基)-二氨基乙烷等。关于第1层和第2层中的固化剂的使用量,根据海藻酸的一价金属盐的使用量或分子量等适当调节为宜。在使用固化剂的情况下,第1层中的固化剂的使用量例如为0.1μmol/cm2~100μmol/cm2、优选为0.5μmol/cm2~2.0μmol/cm2。在使用固化剂的情况下,第2层中的固化剂的使用量例如为0.1μmol/cm2~10μmol/cm2、优选为0.6μmol/cm2~2.4μmol/cm2。5.防粘连材料的制作方法包含生物体可应用的海绵状层合体的防粘连材料或生物体可应用的海绵状层合体,例如可经以下的工序进行制作。(1)使重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐利用固化剂进行固化的工序;(2)将已固化的海藻酸的1价金属盐进行冷冻的工序;(3)在(2)中所得的海藻酸的1价金属盐之上,将重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐利用固化剂进行固化而得到层合体的工序;(4)将所得的层合体进行冷冻干燥而得到海绵状层合体的工序。上述工序(1)中,首先,准备重均分子量10,000~2,000,000的低内毒素海藻酸的1价金属盐(以下,称为“第1海藻酸盐”)的溶液和固化剂的溶液。第1海藻酸盐的溶液和固化剂的溶液可通过公知的方法或仿照其的方法进行调制。溶剂只要是可应用于生物体的溶剂则不受特别限定,优选为水性溶剂,例如有净化水、纯水(例如,蒸馏水、离子交换水)、milli-q水、生理盐水、磷酸缓冲生理盐水、dmso等,更优选为纯水。优选将它们进行灭菌,优选经低内毒素处理。然后,通过将第1海藻酸盐的溶液和固化剂的溶液混合,可使第1海藻酸盐固化。上述工序(2)中,使工序(1)中固化的第1海藻酸盐通过常规方法进行冷冻。通过在工序(3)之前进行一次冷冻,可减低第1层与第2层混合的比例。冷冻温度和时间例如为-20℃下4小时。上述工序(3)中,首先,准备重均分子量1,000~1,000,000的低内毒素海藻酸的1价金属盐(以下,称为“第2海藻酸盐”)的溶液和固化剂的溶液。第2海藻酸盐的溶液和固化剂的溶液可通过公知的方法或仿照其的方法进行调制。溶剂与上述工序(1)中所说明的溶剂同样。然后,通过将第2海藻酸盐的溶液和固化剂的溶液混合,可使第2海藻酸盐固化。进一步可使已固化的第2海藻酸盐在工序(4)之前进行冷冻。冷冻温度和时间例如为-20℃下4小时。上述工序(4)中,将工序(3)中所得的层合体进行冷冻干燥而得到海绵状层合体。冷冻干燥可通过公知的方法进行。冷冻干燥的条件可适当调节,也可设置一次干燥工序、二次干燥工序等。通过这些工序,可以得到生物体可应用的海绵状层合体、以及包含该海绵状层合体的防粘连材料,所述海绵状层合体包含:含有第1海藻酸盐和固化剂的海绵状的第1层和含有第2海藻酸盐和固化剂的海绵状的第2层,第1层的海藻酸的1价金属盐的重均分子量高于第2层。需说明的是,上述的方法中,首先制作包含第1海藻酸盐和固化剂的海绵状的第1层,在其上制作包含第2海藻酸盐和固化剂的海绵状的第2层;但也可首先制作第2层,在其上制作第1层。该情况下,海绵状层合体例如可经过以下的工序进行制作。(1’)使第2海藻酸盐利用固化剂进行固化的工序,(2’)将已固化的第2海藻酸盐进行冷冻的工序,(3’)在(2’)中所得的第2海藻酸盐之上,将第1海藻酸盐利用固化剂进行固化而得到层合体的工序,(4’)将所得的层合体进行冷冻干燥而得到海绵状层合体的工序。各工序的具体说明与上述的方法同样。或者,通过使第1海藻酸盐进行固化并冷冻干燥来制作海绵状的第1层,另行地,通过使第2海藻酸盐进行固化并冷冻干燥来制作海绵状的第2层,将所得的海绵状的各层进行贴合,由此,也可得到海绵状层合体。各工序的具体说明与上述的方法同样。使第1海藻酸盐和第2海藻酸盐固化时,通过使用所期望的大小、高度和形状的容器、模具、基板、多孔膜、无纺布、织物等可得到包含所期望的大小、高度和形状的海绵状层合体的防粘连材料。优选防粘连材料的海绵状层合体进一步进行灭菌处理。灭菌可举出:γ射线灭菌、电子射线灭菌、环氧乙烷气体灭菌、乙醇灭菌等,但不限于这些。更优选防粘连材料通过电子射线和/或γ射线照射进行灭菌处理。通过将高分子材料利用γ射线、电子射线等照射处理,可得到优选地控制了在生物体内的保留性的生物体适合性高的医用材料(例如,参照日本特开2000-237294号)。作为进行电子射线和/或γ射线灭菌时的照射条件,例如可举出吸收剂量为10kgy~150kgy、更优选可举出为20kgy~100kgy、进一步优选可举出为40kgy~80kgy。作为进行电子射线和/或γ射线灭菌时的照射条件的另外的优选方案,例如可举出:吸收剂量为20kgy~80kgy、20kgy~60kgy、40kgy~60kgy等。相比γ射线灭菌,优选电子射线灭菌。在若干方案中,进一步包括将上述工序(4)等中所得的层合体进行加压的工序。加压用手动来进行、或者通过用压机夹持层合体并加压来进行。另外,通常所用的压缩、薄层化等的工序也包含在本发明中所述的加压中。作为加压压力,例如可举出1kpa~100mpa、可举出更优选为10kpa~80mpa、进一步优选为100kpa~60mpa。用手动的加压是隔着可以压力均匀地施加于层合体上的方式用手按压的物体、例如亚克力(acryl)尺、亚克力板、玻璃板、金属板等进行的。另外,作为所用的压机,例如可举出:热压机(asone株式会社制ah-1t)。6.使用方法防粘连材料通过应用于需要防粘连的对象而使用。优选防粘连材料通常在应用部位(局所)滞留用以发挥防粘连效果所需要的1周左右后被吸收分解,最终在1~2个月左右被代谢、排泄而消失,因此安全性优异。防粘连材料可应用于创伤部的表面、例如与外科手术相关的组织表面。“与外科手术相关的组织”是指,外科手术中表面受到外伤的组织、或外科手术中由于表面干燥而产生炎症或者有可能产生炎症的组织。与外科手术相关的组织优选为腹膜所包裹的脏器(例如,胃、空肠、回肠、阑尾、结肠、肝脏、脾脏、十二指肠和胰腺)。本发明的优选方案的防粘连材料可有效地防止如肝脏切除后所产生的粘连那样的重度粘连。另外,“应用”是指,将防粘连材料置于创伤部的表面(例如,与外科手术相关的组织表面)。具体而言,将防粘连材料置于创伤部侧的表面(例如,与外科手术相关的组织的表面),使海绵状层合体的第1层的表面与创伤部侧的表面(例如,组织的表面)接触,且使第2层的表面朝向与创伤部侧的表面(例如,组织的表面)的相反侧(例如,腹腔侧)。海绵状层合体的第1层的重均分子量较高,因此在组织的表面残留对防粘连足够的时间而不被分解,作为创伤面的物理性屏障发挥作用。另一方面,海绵状层合体的第2层的重均分子量较低,因此迅速溶解并扩展,发挥防止非创伤面粘连的作用。优选防粘连材料的海绵状层合体与seprafilm(商品名)相比柔软性高、不易破裂。所以,在优选方案中,防粘连材料不规定要应用的组织表面,例如肠道吻合时也可卷绕于肠道而使用。另外,在另外的优选方案中,即使在使用内窥镜的外科手术时,也可从手术器具在对象中进出的通路容易地插入。在另外的优选方案中,可重新粘贴防粘连材料。另外,优选防粘连材料的海绵层合体,与interceed(商品名)相比,防粘连对象广泛。优选防粘连材料根据要应用的表面的范围、形状、凹凸等准备适当大小的材料,应用于应该防粘连的与外科手术相关的组织表面。“对象”是指,人或人以外的生物,例如鸡和非人哺乳动物(例如,牛、猴、猫、小鼠、大鼠、豚鼠、仓鼠、猪、狗、兔、绵羊和马)。在防粘连材料的海绵层合体、尤其是海绵层合体为经加压的制品的情况下,可以紧凑地汇集,因此,例如在内窥镜手术中可以经由套管针等将防粘连材料比较容易地应用于患部。而且,应用于患部的防粘连材料优选吸收存在于患部的水分或者应用于患部的水分而恢复厚度。优选防粘连材料与seprafilm(商品名)或interceed(商品名)同样,可以在对象中安全地使用。应用于与外科手术相关的组织表面之后,通常无需将防粘连材料和与外科手术相关的组织表面缝合,但根据需要,也可将防粘连材料和与外科手术相关的组织表面缝合。另外,提供防粘连的方法,所述方法包括将海绵状层合体应用于需要防粘连的对象。具体的方法如上所述。另外,提供海绵状层合体的用途,其用于制造防粘连材料。具体的用途如上所述。此外,提供用于防粘连的海绵状层合体。具体的海绵状层合体如上所述。7.并用药物在将本发明的防粘连材料应用于与外科手术相关的组织之前、或者同时、或者之后,可以给予链霉素、青霉素、妥布霉素、阿米卡星、庆大霉素、新霉素和两性霉素b等抗生素,阿司匹林、非类固醇性解热镇痛剂(nsaid)、对乙酰氨基酚等抗炎药等的并用药物。这些药剂可以混入到本发明的防粘连材料中使用。海绵状层合体为多孔性且还具有吸水能力,因此例如与无孔性的seprafilm(商品名)相比,基于用时调节的药物负载是容易的。通过使药剂溶液含浸于海绵并进行给予,在腹腔、胸腔、心腔等中,可以同时达成防粘连和药物的局部(局所)持续释放。此外,通过将药物加载于溶解速度不同的层,还能够以快速的持续释放速度和缓慢的持续释放速度来持续释放药物。需说明的是,在本说明书中引用的所有出版物、例如现有技术文献和公开公报、专利公报和其它的专利文献,其整体在本说明书中以参照方式并入。通过以下的实施例进一步详述本发明,但本发明不应理解为限于这些实施例。实施例实施例1:海藻酸层合海绵的制作如下进行操作制作了海藻酸层合海绵。[试剂]用于调制海藻酸层合海绵的各试剂如下所示。低内毒素海藻酸钠从持田制药株式会社获取。・al10:(批号5k12202),内毒素量4eu/g。・al500:(批号bl150713-500),内毒素量19eu/g。氯化钙从和光纯药工业株式会社获取(商品编码:036-00485)。[使用仪器]35mm无处理培养皿(iwaki公司商品编码1000-035)微量吸管(gilson公司pipetman(商品名))纯水制造装置(merckmillipore公司elixessentialuv5(商品名))冰柜(sharp公司sj-56s(商品名))冷冻干燥器(taitec公司vd-550r(商品名))[调制程序](1)溶液的调制使al500以1.0wt%浓度溶解于纯水中,调制al500溶液。同样地,使al10以1.0wt%浓度溶解于纯水中,调制al10溶液。此外,使氯化钙溶解于纯水,分别调制10mm和15mm的氯化钙水溶液。(2)al500层(下层)的调制将al500溶液1.0ml和10mm氯化钙水溶液1.0ml使用微量吸管加入至35mm无处理培养皿中,通过移液混合至均匀。将其静置过夜以使其凝胶化。将培养皿转移至冰柜中,在-20℃下冷冻4小时。(3)al10层(上层)的层合将培养皿从冰柜中取出,在已冷冻的al500层之上,利用微量吸管添加al10溶液1.0ml和15mm氯化钙水溶液1.0ml,通过移液混合至均匀。将该培养皿再次转移至冰柜中,在-20℃下冷冻4小时。(4)海绵的制作将冷冻后的培养皿置于冷冻干燥器中,进行2晩冷冻干燥,得到目标海藻酸层合海绵。目标海藻酸层合海绵包含:含有al500和氯化钙的海绵状的下层(即,第1层)、以及含有al10和氯化钙的海绵状的上层(即,第2层)。海藻酸层合海绵为直径35mm、厚度1.83±0.13cm(n=4)的近似圆形。海藻酸钠的上层和下层中的使用量的总计为约2.0mg/cm2。另外,海藻酸钠的上层和下层中的使用量之比(重量比)为1:1。此外,关于氯化钙的使用量,在上层中为约1.0μmol/cm2,在下层中为约1.5μmol/cm2。(5)重均分子量的测定对于用作制造原料的海藻酸,利用以下的gpc-mals法测定了重均分子量。[前处理方法]在试样中加入洗脱液进行溶解后,经0.45μm膜滤器过滤,将该溶液作为测定溶液。[测定条件(折射率增量(dn/dc)测定)]示差折射率计:optilabt-rex测定波长:658nm测定温度:40℃溶剂:200mm硝酸钠水溶液试样浓度:0.5~2.5mg/ml(5种浓度)[测定条件(绝对分子量分布测定)]柱:tskgelgmpw-xl×2+g2500pw-xl(7.8mmi.d.×300mm×3根)洗脱液:200mm硝酸钠水溶液流量:1.0ml/分钟浓度:0.05%检测器:ri检测器,光散射检测器(mals)柱温度:40℃注入量:200μl[结果]al10:55,000al500:280,000另外,将依据上述工序(1)、(2)和(4)的方法制造的含有al10的单层海绵、以及含有al500的单层海绵进行电子射线灭菌后,溶解于edta(乙二胺四乙酸)溶液中,利用gpc-mals法分别测定了分子量。将结果示于以下。[结果](电子射线灭菌的照射剂量为20kgy的情况)al10:36,000al500:75,000(电子射线灭菌的照射剂量为40kgy的情况)al10:27,000al500:45,000下述的实施例3、实施例3-2和4中,作为层合海绵,使用了将所得层合海绵进行了电子射线灭菌(20kgy)的层合海绵。需说明的是,下述的实施例6和7中,作为层合海绵,使用了非灭菌的层合海绵。实施例1-2:海藻酸层合海绵的制作(1)海绵的制作使用以下的[试剂]中所记载的海藻酸,将al100或al500作为下层的原料使用,将al10或al20作为上层的原料使用,依据实施例1中所记载的方法,基于al10(上层)-al100(下层)、al20(上层)-al100(下层)、al20(上层)-al500(下层)的组合,制作了各海藻酸层合海绵。[试剂]・al10:与实施例1相同・al20:(批号bl150713-20),内毒素量为13eu/g・al100:(批号5g17201),内毒素量为6eu/g・al500:与实施例1相同(2)重均分子量的测定另外,用于海绵制作的海藻酸中,对于al20和al100,使用实施例1中所记载的方法,利用gpc-mals法测定了重均分子量。[结果]al20:82,000al100:170,000另外,对于依据实施例1中所记载的方法制造的含有al20的单层海绵、和含有al100的单层海绵,使用实施例1中所记载的方法,测定了电子射线灭菌后的分子量。将结果示于以下。[结果](电子射线灭菌的照射剂量为20kgy的情况)al20:46,000al100:63,000(电子射线灭菌的照射剂量为40kgy的情况)al20:33,000al100:40,000。实施例2:海藻酸层合海绵的各层的溶解速度的测定分别制作上层或下层经荧光修饰的层合海绵,进行了溶解速度的测定。具体的方法示于以下。需说明的是,作为荧光标记试剂,使用ftsc(荧光素-5-氨基硫脲,fluorescein-5-thiosemicarbazide),海藻酸的标记通过常规方法进行。使用经荧光标记的海藻酸,依据实施例1中所记载的方法制作了层合海绵。[材料]低内毒素海藻酸钠如实施例1中所记载。磷酸缓冲液使用磷酸二氢钠(和光纯药公司,197-09705(商品名))、磷酸二氢钾(和光纯药公司,166-04255(商品名))、氯化钠(和光纯药公司,191-01665(商品名))、氯化钾(和光纯药公司,166-17945(商品名))进行调节。乙二胺四乙酸钠(n001)购自dojindo公司。[使用仪器]直径8mm活检环锯(kaimedical公司bp-80f(商品名))96孔黑色微孔板(nunc公司137101(商品名))荧光读板器(perkinelmer公司arvox3(商品名))[程序]首先,用直径8mm的活检环锯(kaimedical公司bp-60f(商品名))冲切经荧光修饰的层合海绵。将其浸渍于150mm磷酸缓冲液(ph7.5)10ml中,每隔规定时间回收各200μl的浸渍液。将回收的溶液转移至96孔板,通过利用荧光读板器测定荧光强度,对溶解的海藻酸量进行定量。[结果]将层合海绵的各层的溶解行为的测定结果示于图2。如图2所示,下层中,海藻酸的1价金属盐的25±10重量%在1小时以内洗脱、80±10重量%在4小时以内洗脱。另一方面,上层中,海藻酸的1价金属盐的70±10重量%在1小时以内洗脱、90±10重量%在4小时以内洗脱。另外,将上层的海藻酸的1价金属盐的洗脱量设为100%时的、下层的海藻酸的1价金属盐的洗脱量的比例,在从测定开始起1小时的时间点为36%(低于50%)、在2小时的时间点为55%(低于70%)。如此,可确认上层的溶解速度比下层快。认为:通过将下层朝向创伤部侧、将上层朝向腹腔侧应用海藻酸海绵,下层残留于创伤部而可防止创伤部的粘连,同时上层较快溶解而可以抑制在远离创伤部的部位也大量形成的新生粘连、例如整个腹腔内的粘连等。需说明的是,对于实施例1-2中制作的各层合海绵(al10(上层)-al100(下层);al20(上层)-al100(下层);al20(上层)-al500(下层)),也同样地进行了溶解速度的测定,结果显示出:与实施例1中制作的层合海绵(al10(上层)-al500(下层))同样的溶解行为。实施例3:大鼠部分肝脏切除模型使用大鼠部分肝脏切除模型,对粘连的形成进行评价。大鼠部分肝脏切除模型是可高再现性地观察引起重度的炎症、且具有高强度的粘连形成的模型(shimizua等人,(2014)surgtoday.(44):314-323)。具体而言,如下对粘连的形成进行评价。[材料]低内毒素海藻酸钠如实施例1中所记载。seprafilm(商品名)是将羧基甲基纤维素(cmc)与透明质酸混合而得的片状材料,自genzymegmbh获取。interceed(商品名)是再生氧化纤维素片,自johnson&johnson获取。[实验组]对照组(n=8):测量3cm左外侧叶的边缘、切离并凝固止血(无处置对照组)。500-10层合海绵组(n=8):将实施例1中制作的海藻酸海绵作为防粘连材料应用。seprafilm组(n=8):将2×3cm的seprafilm作为防粘连材料应用。interceed组(n=8):将2×3cm的interceed作为防粘连材料应用。[程序]通过相当于戊巴比妥35mg/kg的腹腔给予对大鼠实施麻醉,利用电子天平测定体重。然后,对大鼠以正中切开进行剖腹。接下来,用镊子夹住腹壁并向上提拉,切割腹壁。作为进行肝脏切除的前准备,将左外侧叶从腹腔的内部拉出,在其下铺上纱布。接下来,转向实际的肝脏切除。具体而言,将标尺放在肝脏上,寻找离断面为3cm的位置,对其两端用双极进行灼烧而作记号。在作记号的2点之间进行线性切除。对照组中,此后立即关闭腹部结束处置。在应用防粘连材料的组中,此后,去除纱布后应用防粘连材料。接下来,将腹壁与皮肤分为二次缝合而关闭腹部。缝合腹壁时使用生物分解线,缝合皮肤时使用非吸收线。自关闭腹部起一周后,通过对大鼠过剩给予约2ml的戊巴比妥作为过量的麻醉来使其安乐死,利用电子天平测定体重。之后,再次剖腹,如下对粘连进行评价。关于脾脏重量,自腹腔摘出脾脏之后,利用电子天平进行测定。[粘连的评价]如下,进行了粘连的评价。(1)离断面对于上述[程序]中所记载的肝离断面,进行了以下(a)、(b)的评价。(a)粘连等级粘连的评价通过目视进行。对于肝离断面,基于下述的评分法记粘连评分。粘连评分:等级0:完全观察不到粘连等级1:通过自重而剥离的程度的粘连(生理性粘连)等级2:通过镊子可剥离的粘连(钝性粘连)等级3:若不使用剪刀、手术刀则无法剥离的粘连(锐性粘连)。(b)粘连广度(extent)3cm的肝离断面中,将形成有粘连的宽度利用尺(标尺)进行测量,用长度(单位:mm)表示(因此,离断面的最大广度为30mm)。(2)非离断面对于肝离断面以外、具体而言肝表面、大网膜、腹膜、小肠、正中创口下面等,进行了以下(a)、(b)的评价。(a)粘连等级粘连的评价通过目视进行。对于肝离断面以外的部位,基于下述的评分法记粘连评分。部位不特定,将所见的粘连评分的最大值作为该试验动物的粘连评分进行记录。粘连评分:等级0:完全观察不到粘连等级1:通过自重而剥离的程度的粘连(生理性粘连)等级2:通过镊子可剥离的粘连(钝性粘连)等级3:若不使用剪刀、手术刀则无法剥离的粘连(锐性粘连)。(b)粘连广度关于肝离断面以外的部位,对于形成有粘连的组织部分,利用尺(标尺),测量其粘接的宽度,用长度(单位:mm)表示。与上述(2)(a)同样,部位不特定,将所见的形成有粘连的宽度的最大值作为该试验动物的粘连广度进行记录。[结果]将粘连的评价结果示于图3(离断面)和图4(非离断面)。另外,将体重测定和脾脏重量测定的结果示于图5。离断面中,与对照组相比,各组均可见粘连得到抑制的倾向(图3(a)~(c))。非离断面中,确认到500-10层合海绵组的显著的防粘连效果(图4(a)~(c))。用作阳性对照的seprafilm(商品名)和interceed(商品名)中,未见防粘连效果,与对照组相比,可见粘连增剧的倾向。另一方面,在500-10层合海绵组中,确认到显著的防粘连效果。对于体重和脾脏重量,在对照组、seprafilm组、interceed组、和500-10层合海绵组间没有显著差异,确认即使应用500-10层合海绵,也对生物体没有不良影响(图5(a)和(b))。在此,关于实施例中的显著差异检验,在没有特别说明的情况下,通过学生t检验(student’st-test)进行,仅等级的评价利用mann-whitneyu检验进行。实施例3-2:使用皮氏钳(peanforceps)的大鼠部分肝脏切除模型除了在肝脏的离断时使用皮氏钳之外,采用与实施例3相同的材料、实验组、程序和粘连的评价方法,评价了肝离断面与非离断面的粘连等级和粘连广度。关于使用皮氏钳的肝脏的离断,具体而言,如下进行。即,在实施例3的[程序]中,通过用皮氏钳破碎肝实质、并用双极灼烧暴露的血管来实施“在作记号的2点之间进行线性切除”。[结果]将粘连的评价结果示于图6(离断面)和图7(非离断面)。另外,将体重测定和脾脏重量测定的结果示于图8。离断面中,与对照组(n=8)相比,各组(n=8)均确认到粘连得到抑制的倾向,500-10层合海绵组中,与对照组之间确认到统计学上的显著差异(图6(a)~(c))。非离断面中,在500-10层合海绵组中确认到显著的防粘连效果(图7(a)~(c))。对于用作阳性对照的seprafilm(商品名),未确认到防粘连效果,对于interceed(商品名),与对照组相比,确认到粘连增剧的倾向。另一方面,在500-10层合海绵组中,确认到显著的防粘连效果。对于体重和脾脏重量,在对照组、seprafilm组、interceed组、和500-10层合海绵组间没有显著差异,确认即使应用500-10层合海绵,也对生物体没有不良影响(图8(a)和(b))。实施例4:海藻酸层合海绵的各层的利用荧光标记的可视化对于海藻酸层合海绵的各层,如下进行了利用荧光标记的可视化试验。[材料]低内毒素海藻酸钠如实施例1中所记载。[使用仪器]手持紫外线灯(uvp公司uvgl-58(商品名))[程序]大鼠的肝脏切除的程序如实施例3中所记载。在所制作的肝脏的离断面粘贴第1层或第2层经荧光标记的海藻酸海绵。粘贴中,为了容易观察材料的残存,依据实施例1的方法制作了使用较实施例1多的4.0mg/cm2海藻酸的层合海绵,并进行使用。之后,利用实施例3中所记载的程序关闭腹部,在1周后进行剖腹。在暴露的腹腔内用灯照射紫外线,使经荧光标记的海藻酸的腹腔内分布可视化。其结果,可确认:al10层除了在离断面之外、也广泛分布于腹膜的表面。由此示意:海绵状层合体的第2层由于海藻酸的1价金属盐的重均分子量较低,而在腹腔内迅速溶解并扩展。另外,尽管在一部分腹壁等处也观察到al500层,但更明显地观察到来自离断面的荧光。由此示意:海绵状层合体的第1层由于海藻酸的1价金属盐的重均分子量较高,而保留在离断面成为物理性屏障。实施例5:卷绕试验为了显示海藻酸层合海绵对曲面的粘贴追随性,如下进行了卷绕试验。[材料]低内毒素海藻酸钠如实施例1中所记载。琼脂(010-08725)购自和光纯药。[程序]将琼脂溶解于热水中之后,倒入圆柱状的模具中并进行冷却,以制作直径20mm的琼脂糖凝胶圆柱。将其作为模型管状脏器,通过卷绕实施例1中制作的海绵,来验证卷绕的追随性。其结果,可确认:由于海藻酸层合海绵的柔软性,因此可卷绕到模仿肠道的圆柱上。由此示意:包含海绵状层合体的防粘连材料也可用于肠道吻合等。实施例6:海绵的加压和溶胀试验如下进行了海藻酸层合海绵的加压、加压后的厚度的测定和溶胀试验。[材料]海藻酸层合海绵(al10(上层)-al500(下层))如实施例1中所记载。[试剂]琼脂糖自和光纯药工业株式会社获取(商品编码:010-08725)。[程序](1)加压和加压后的厚度的测定(1-1)手动加压将海藻酸层合海绵静置于平面上,用手掌隔着亚克力尺以对海绵整体均匀地施加压力的方式按压。用电子游标卡尺测量按压前后的海绵的厚度,并计算平均值(n=4)。(1-2)通过压机进行的加压将海藻酸层合海绵设置于压机(asone株式会社制,制品名ah-1t)上。以10mpa的压力在室温下对海藻酸层合海绵进行加压,并保持5分钟。利用电子游标卡尺测定加压后的海绵的厚度,并计算平均值(n=4)。(2)溶胀试验使琼脂糖以2重量%溶解于热水中,冷却至室温,由此制作了琼脂糖凝胶。将琼脂糖凝胶切成2cm×2cm的正方形,在玻璃培养皿上浸渍于纯水中,使其湿润。将切成1cm×1cm的正方形的加压前后的海藻酸层合海绵静置于琼脂糖凝胶上。每隔规定时间从宽度方向进行拍摄,根据已拍摄的图像计算海绵的厚度,确认了加压对溶胀有无影响(加压前:n=3;加压后:n=3)。需说明的是,溶胀试验中,作为已加压的海藻酸层合海绵,使用通过压机进行加压而得的制品。[结果]将加压后的厚度的测定结果示于表1。[表1]加压前手动加压后通过压机进行的加压后平均厚度(mm)1.50.330.16关于海绵的厚度的平均值,加压前为约1.5mm,手动加压后为约0.33mm,通过压机进行的加压后为约0.16mm。需说明的是,经加压的海绵随着时间的经过厚度不会增加,维持着上述的厚度。将溶胀试验中的经时性的海绵厚度的变化示于图9。根据溶胀试验的结果,确认到:经加压的海藻酸层合海绵吸水,而变成与未加压的海藻酸海绵为几乎同等的厚度。由此示意:海绵通过进行加压可以紧凑地汇集,因此在内窥镜手术中经由套管针等可以比较容易地将作为防粘连材料的海绵应用于患部。此外还示意:应用于患部的经加压的海绵吸收存在于患部、或应用于患部的水分,而恢复厚度。通过恢复厚度,可发挥作为层合海绵的功能。实施例7:喷雾试验对于海藻酸层合海绵和seprafilm(商品名),为了评价吸水时的脆弱性而进行了以下的试验。[材料]海藻酸层合海绵如实施例1中所记载,seprafilm(商品名)如实施例3中所记载。另外,作为海藻酸层合海绵的加压过的制品,使用了实施例6中所记载的通过压机进行加压而得的制品。[程序]由海藻酸层合海绵和seprafilm(商品名)制作了1cm×2cm的试验片。在试验片的一端1cm×1cm处粘贴双面胶带,并把持于试验台的端部。由此,以使另一端1cm×1cm露出在空中的方式固定试验片。利用喷雾器对各试验片喷雾5次纯水。对试验片伴随湿润而向下方弯曲的过程进行动画拍摄。通过所得动画的图像分析,计算试验片前端距试验台的高度和与试验台的角度这两者,并对其时间变化绘图。[结果]将结果示于图10。对于高度,海藻酸层合海绵在喷雾后50秒为止,高度的降低为2mm以内,即使在90秒后也才3mm左右(图10(a))。另外,加压过的海藻酸层合海绵即使在喷雾后的90秒后高度的降低也仅为9mm左右。另一方面,seprafilm(商品名)自刚刚喷雾后即可见显著的高度降低(图10(a))。对于角度,也与高度的结果为同样的结果(图10(b))。由此示意:无论有无加压,海藻酸层合海绵即使在吸水状态下也会维持其形状、强度一段时间。所以,在作为防粘连材料应用于患部时,可调节粘贴位置而重新粘贴;或者在内窥镜手术时,经由套管针等而将作为防粘连材料的海绵应用于患部时,具有下述的优点:可避免吸收套管针内的水分而不能很好地扩展等的情形等。需说明的是,实施例3、实施例5等中确认到:海藻酸层合海绵对患部、或者其模型体系具有适合的压粘性。符号说明1防粘连材料2第1层3第2层4海绵状层合体。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1