治疗卵巢癌的方法与流程
癌症是严重的公共卫生问题,仅在2009年在美国有562,340人死于癌症。美国癌症协会(americancancersociety),cancerfacts&figures2009(可在美国癌症协会网站获得)。癌症治疗中的主要挑战之一是发现患者自身癌症的有关临床有用特征,然后基于这些特征,施用最适合患者癌症的治疗计划。
卵巢癌是女性癌症死亡的第5大总体原因,并且占女性所有癌症死亡的5%。据估计,在2014年将有21,980个卵巢癌新病例,并且估计有14,270个女性死于这种疾病。在2012年在美国女性中的上皮性卵巢癌的预期发生率为大约22,280例(15,500例死亡),并且在2012年在欧洲估计为65,538个患者病例(42,704例死亡)。上皮癌构成卵巢癌的85%至90%。虽然历史上认为从卵巢的表面开始,但新的证据提示,至少一些卵巢癌始于输卵管的部分中的特殊细胞。输卵管,将女性卵巢与其子宫连接的小管,是女性生殖系统的部分。在正常的女性生殖系统中,存在两个输卵管,一个位于子宫的每一侧上。始于输卵管的癌细胞可能早期到达卵巢的表面。术语‘卵巢癌’经常用于描述始于卵巢、输卵管和称为腹膜的腹腔衬里的上皮癌。在诊断时,大多数妇女呈现晚期疾病,这解释了高死亡率的原因。
用于晚期卵巢癌的标准疗法通常由手术减瘤和化学治疗方案组成。初始化学疗法由紫杉烷或铂化学疗法、或其组合组成。虽然大约75%的患者响应第一线治疗,但最初响应的患者中的70%最终在1至3年内复发。复发后,患者对后续化学疗法中等或不良响应。另外,对铂试剂的不耐受是临床问题,因为累积毒性的风险在持续治疗过程中增加。尽管最初的高响应率,但由于高复发率,存在显著的未满足需求。通过添加第三种细胞毒性药物(托泊替康、吉西他滨或多西环素)来改善标准双药化学疗法(卡铂和紫杉醇)的尝试已失败(dubois等人,2006和pfisterer等人,2006)。不久的将来的巨大挑战将是患有晚期卵巢癌的患者的选择,所述患者将在第一线治疗或维持背景下受益于特定的靶向试剂。在实现初始化学疗法的响应后的维持治疗可以代表通过延迟疾病进展副作用,延迟对毒性化学疗法的需要和延长的总生存期来提供临床益处的方法。
聚(adp-核糖)聚合酶(parp)是涉及响应dna损伤的各种活性的酶家族。parp-1是关键的dna修复酶,其通过碱基切除修复(ber)途径介导单链断裂(ssb)修复。parp抑制剂已证实选择性杀死具有brca1和brca2突变的肿瘤细胞。另外,临床前和初步临床数据提示,parp抑制剂对于具有由除brca1或brca2外的基因功能障碍引起的同源重组修复缺陷的肿瘤是选择性细胞毒性的。
技术实现要素:
本发明部分基于以下发现:parp抑制剂可以用于治疗以野生型或突变型brca1和/或brca2(“brca基因”)为特征的癌症,例如,在brca基因中不存在或存在突变的情况下。相应地,本发明的方面涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,而不依赖于brca状态或者不依赖于患者或癌症的dna修复状态。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,其中在确定患者或癌症的brca状态或hrd状态之前开始治疗。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,其中在不确定患者或癌症的brca状态或dna修复状态的情况下开始治疗。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,所述患者的特征在于brca1和/或brca2中突变的不存在。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,所述患者的特征在于涉及dna修复的基因中突变的不存在。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,所述患者的特征在于涉及同源重组的基因中突变的不存在。在一些方面,本发明涉及用于治疗癌症患者的方法,其涉及向患有癌症的患者施用抗parp疗法,所述癌症的特征在于brca1或brca2中突变的不存在。在一些方面,本发明涉及用于治疗癌症患者的方法,其涉及向患有癌症的患者施用抗parp疗法,所述癌症的特征在于涉及同源重组的基因中突变的不存在。
在实施例中,抗parp疗法以等价于约100mg、约200mg或约300mg尼拉帕尼或其盐或衍生物的剂量施用。在某些实施例中,抗parp疗法以等价于约100mg尼拉帕尼或其盐或衍生物的剂量施用。在某些实施例中,抗parp疗法以等价于约200mg尼拉帕尼或其盐或衍生物的剂量施用。在某些实施例中,抗parp疗法以等价于约300mg尼拉帕尼或其盐或衍生物的剂量施用。
在一些实施例中,抗parp疗法在确定为实现以下的方案中施用:i)与对照相比,延长的无进展生存期,ii)与对照相比,降低的疾病进展或死亡的风险比,iii)与对照相比,延长的总生存期,或iv)至少30%的总体响应率。
在实施例中,抗parp疗法包括施用抑制parp-1和/或parp-2的试剂。在一些实施例中,该试剂是小分子、核酸、多肽(例如抗体)、碳水化合物、脂质、金属或毒素。在相关实施例中,该试剂是abt-767、azd2461、bgb-290、bgp15、cep9722、e7016、e7449、氟唑帕尼、ino1001、jpi289、mp124、尼拉帕尼、奥拉帕尼、ono2231、芦卡帕尼、sc101914、他拉唑帕尼、维利帕尼、ww46、或其盐或衍生物。在一些相关的实施例中,该试剂是尼拉帕尼、奥拉帕尼、芦卡帕尼、他拉唑帕尼、维利帕尼、或其盐或衍生物。在某些实施例中,该试剂是尼拉帕尼或其盐或衍生物。在某些实施例中,该试剂是奥拉帕尼或其盐或衍生物。在某些实施例中,该试剂是芦卡帕尼或其盐或衍生物。在某些实施例中,该试剂是他拉唑帕尼或其盐或衍生物。在某些实施例中,该试剂是维利帕尼或其盐或衍生物。
在一些实施例中,与对照相比,该方法延长了无进展生存期。在一些实施例中,与对照相比,该方法降低了疾病进展或死亡的风险比。在一些实施例中,与对照相比,该方法延长了总生存期。在一些实施例中,该方法实现了至少30%的总体响应率。在一些实施例中,与对照相比,该方法实现了改善的无进展生存期2。在一些实施例中,与对照相比,该方法实现了改善的无化学疗法间隔。在一些实施例中,与对照相比,该方法实现了改善的第一后续治疗时间。在一些实施例中,与对照相比,该方法实现了改善的第二后续治疗时间。在一些实施例中,如通过fosi和/或eq-5d-5l确定的,该方法已确定为对生活质量没有不利影响。在一些实施例中,该方法已确定为不影响用化学治疗剂(例如铂试剂,包括但不限于顺铂、卡铂、奥沙利铂、奈达铂、四硝酸三铂、菲铂、吡铂、或沙铂的后续治疗的有效性。
在一些实施例中,此类癌症选自妇科癌症(即,女性生殖系统的癌症)。在一些实施例中,女性生殖系统的癌症包括但不限于卵巢癌、输卵管癌、腹膜癌和乳腺癌。在一些实施例中,妇科癌症与同源重组修复缺陷/同源修复缺陷(“hrd”)和/或brca1/2突变相关。在一些实施例中,妇科癌症是铂敏感的。在一些实施例中,妇科癌症响应基于铂的疗法。在一些实施例中,妇科癌症已发展对基于铂的疗法的抗性。在一些实施例中,妇科癌症一度已显示对基于铂的疗法的部分或完全响应。在一些实施例中,妇科癌症现在对基于铂的疗法是抗性的。
在某些实施例中,癌症是卵巢癌、输卵管癌或腹膜癌。在某些实施例中,癌症是乳腺癌。
在一些实施例中,癌症是复发性癌症。
在一些实施例中,抗parp疗法可用于治疗显示出阳性hrd状态的癌症患者。在一些实施例中,抗parp疗法可用于治疗显示出阳性hrd状态的癌症患者,其中患者的特征还在于brca1和/或brca2中突变的不存在。在一些实施例中,抗parp疗法可用于治疗显示出阳性hrd状态的癌症患者,其中患者的特征还在于brca1和/或brca2中的种系突变的不存在。在一些实施例中,通过在患者样品中定量许多指示剂染色体畸变(“ca”)区域来确定阳性hrd状态。在一些实施例中,来自患者的肿瘤样品具有阳性hrd状态。
在一些实施例中,抗parp疗法可用于治疗显示出brca1和brca2中的种系突变的不存在的癌症患者。在一些实施例中,抗parp疗法可用于治疗患有铂敏感性肿瘤的癌症患者,所述铂敏感性肿瘤也显示出brca1和brca2中的种系突变的不存在。
在一些实施例中,抗parp疗法可用于治疗显示出hrd的不存在的癌症患者。在一些实施例中,抗parp疗法可用于治疗铂敏感性、复发性卵巢癌患者,其中患者不具有hrd或其中患者的特征在于hrd的不存在。在一些实施例中,hrd的不存在的特征还在于缺乏“染色体畸变”或“ca”。ca指样品的染色体dna中的可检测变异。在一些实施例中,ca可以落入三个重叠类别中的至少一个内:杂合性丢失(loh)、等位基因失衡(例如,端粒等位基因失衡(tai))或大规模跃迁(lst)。
相应地,在一些实施例中,本发明提供了向患有选自卵巢癌、输卵管癌或原发性腹膜癌的复发性和/或铂敏感性癌症的患者施用抗parp疗法的方法,其包括根据确定为实现与对照相比延长的无进展生存期的方案,向患者施用抗parp疗法。
尤其地,本发明证实了尼拉帕尼的显著临床功效,例如当施用于某些患者群体时(例如,患有或易患某些肿瘤的群体;特征在于特定标记物例如hrd状态和/或brca1/2突变等的存在或水平的群体;可能已接受或可能未接受或正在接受其它治疗的群体等)和/或根据某些方案。在一些实施例中,本发明提供了向患有选自卵巢癌、输卵管癌或原发性腹膜癌的复发性和/或铂敏感性癌症的患者施用抗parp疗法的方法,其包括根据确定为实现与对照相比降低的疾病进展或死亡风险比的方案,向患者施用抗parp疗法。
在一些实施例中,本发明提供了向患有选自卵巢癌、输卵管癌或原发性腹膜癌的复发性和/或铂敏感性癌症的患者施用抗parp疗法的方法,其包括根据确定为实现与对照相比延长的总生存期的方案,向患者施用抗parp疗法。
在一些实施例中,本发明提供了向患有选自卵巢癌、输卵管癌或原发性腹膜癌的复发性和/或铂敏感性癌症的患者施用抗parp疗法的方法,其包括根据确定为实现至少30%的总体响应率的方案,向患者施用抗parp疗法。在一些实施例中,根据recistv1.1指南评价总体响应率。
在一些实施例中,施用抗parp疗法的方法是根据确定为实现与对照相比延长的无进展生存期2的方案。
在一些实施例中,施用抗parp疗法的方法是根据确定为实现与对照相比延长的无化学疗法间隔的方案。
在一些实施例中,施用抗parp疗法的方法是根据确定为实现与对照相比延长的第一后续治疗时间的方案。
在一些实施例中,施用抗parp疗法的方法是根据确定为实现与对照相比延长的第二后续治疗时间的方案。
在一些实施例中,复发性和/或铂敏感性癌症是卵巢癌。在一些实施例中,卵巢癌是在抗parp疗法施用开始时的铂敏感性卵巢癌。在一些实施例中,卵巢癌是在抗parp疗法施用开始时复发的铂敏感性卵巢癌。在一些实施例中,卵巢癌响应在开始抗parp疗法施用之前的最近的基于铂的化学疗法方案。在一些实施例中,对最近的基于铂的化学疗法方案的响应是完全响应。在一些实施例中,对最近的基于铂的化学疗法方案的响应是部分响应。在一些实施例中,卵巢癌响应在开始抗parp疗法施用之前的倒数第二个基于铂的化学疗法方案。
在一些实施例中,复发性和/或铂敏感性癌症是输卵管癌。在一些实施例中,输卵管癌在抗parp疗法施用开始时是铂敏感的。在一些实施例中,复发性输卵管癌在抗parp疗法施用开始时是铂敏感的。在一些实施例中,输卵管癌响应在开始抗parp疗法施用之前的最近的基于铂的化学疗法方案。在一些实施例中,对最近的基于铂的化学疗法方案的响应是完全响应。在一些实施例中,对最近的基于铂的化学疗法方案的响应是部分响应。在一些实施例中,输卵管癌响应在开始抗parp疗法施用之前的倒数第二个基于铂的化学疗法方案。
在一些实施例中,复发性和/或铂敏感性癌症是原发性腹膜癌。在一些实施例中,原发性腹膜癌在抗parp疗法施用开始时是铂敏感的。在一些实施例中,复发的原发性腹膜癌在抗parp疗法施用开始时是铂敏感的。在一些实施例中,原发性腹膜癌响应在开始抗parp疗法施用之前的最近的基于铂的化学疗法方案。在一些实施例中,对最近的基于铂的化学疗法方案的响应是完全响应。在一些实施例中,对最近的基于铂的化学疗法方案的响应是部分响应。在一些实施例中,原发性腹膜癌响应在开始抗parp疗法施用之前的倒数第二个基于铂的化学疗法方案。
在一些实施例中,患者具有选自(i)brca1和/或brca2中的种系突变,或(ii)brca1和/或brca2中的散发突变的至少一个突变。
在一些实施例中,患者具有在brca1和/或brca2中的种系突变。
在一些实施例中,方案确定为实现小于约0.5的疾病进展的风险比。在一些实施例中,疾病进展的风险比小于约0.4。在一些实施例中,疾病进展的风险比小于约0.3。
在一些实施例中,方案确定为实现至少9个月的延长的无进展生存期。在一些实施例中,延长的无进展生存期为至少12个月。在一些实施例中,延长的无进展生存期为至少15个月。在一些实施例中,延长的无进展生存期为至少21个月。
在一些实施例中,患者具有在brca1或brca2中的散发突变。
在一些实施例中,患者的特征在于brca1或brca2中的种系突变的不存在。在一些实施例中,患者的特征在于hrd的不存在。在一些实施例中,患者的特征在于brca1或brca2中的种系突变的不存在以及hrd的不存在。
在一些实施例中,患者的特征在于brca1或brca2中的散发突变的不存在。在一些实施例中,患者的特征在于hrd的不存在。在一些实施例中,患者的特征在于brca1或brca2中的散发突变的不存在和hrd的不存在。在一些实施例中,hrd的不存在的特征还在于缺乏“染色体畸变”或“ca”。ca指样品的染色体dna中的可检测变异。在一些实施例中,ca可以落入三个重叠类别中的至少一个内:杂合性丢失(loh)、等位基因失衡(例如,端粒等位基因失衡(tai))或大规模跃迁(lst)。
在一些实施例中,患者的特征在于brca1或brca2中突变的不存在(例如,缺少种系brca1/2和散发性brca1/2突变两者)。
在一些实施例中,患者患有具有阳性同源重组缺陷状态的肿瘤。
在一些实施例中,本发明提供了向患者施用抗parp疗法的方法,其特征在于种系brca1/2突变的不存在,其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。
在一些实施例中,本发明提供了向具有在brca1或brca2中的散发突变的患者施用抗parp疗法的方法,其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。
在一些实施例中,本发明提供了向患者施用抗parp疗法的方法,所述患者的特征在于brca1/2中突变的不存在(即,brcawt患者),其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。
在一些实施例中,患者患有具有阴性同源重组缺陷状态的肿瘤。在一些实施例中,患者具有特征还在于brca1或brca2中的种系突变为阴性的肿瘤。
在一些实施例中,本发明提供了根据确定为实现小于约0.4的疾病进展风险比的方案,向患者施用抗parp疗法的方法,所述患者的特征在于brca1或brca2中的种系突变(gbrcamut)。在一些此类实施例中,疾病进展的风险比小于约0.3。
在一些实施例中,本发明提供了根据确定为实现至少9个月的延长的无进展生存期的方案,向患者施用抗parp疗法的方法,所述患者的特征在于brca1或brca2中的种系突变(gbrcamut)。在一些此类实施例中,延长的无进展生存期为至少12个月或至少21个月。
在一些实施例中,本发明提供了根据确定为实现小于约0.5的疾病进展风险比的方案,向患者施用抗parp疗法的方法,所述患者的特征在于种系brca1/2突变的不存在,其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。在一些此类实施例中,疾病进展的风险比小于约0.4。
在一些实施例中,本发明提供了根据确定为实现至少12个月的延长的无进展生存期的方案,向患者施用抗parp疗法的方法,所述患者的特征在于种系brca1/2突变的不存在,其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。
在一些实施例中,本发明提供了根据确定为实现小于约0.5的疾病进展风险比的方案,向患者施用抗parp疗法的方法,所述患者的特征在于种系brca1/2突变的不存在。
在一些实施例中,本发明提供了根据确定为实现至少9个月或至少12个月的延长的无进展生存期的方案,向患者施用抗parp疗法的方法,所述患者的特征在于种系brca1/2突变的不存在。
在一些实施例中,本发明提供了根据确定为实现小于约0.4的疾病进展风险比的方案,向具有在brca1或brca2中的散发突变的患者施用抗parp疗法的方法,其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。在一些实施例中,疾病进展的风险比小于约0.3。
在一些实施例中,本发明提供了根据确定为实现至少20个月的延长的无进展生存期的方案,向具有在brca1或brca2中的散发突变的患者施用抗parp疗法的方法,其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。
在一些实施例中,本发明提供了根据确定为实现小于约0.5的疾病进展风险比的方案,向特征在于brca1/2突变的不存在的患者(即,brcawt患者)施用抗parp疗法的方法,其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。在一些实施例中,疾病进展的风险比小于约0.4。
在一些实施例中,本发明提供了根据确定为实现至少9个月或至少12个月的延长的无进展生存期的方案,向特征在于brca1/2突变的不存在的患者(即,brcawt患者)施用抗parp疗法的方法,其中所述患者患有具有阳性同源重组缺陷状态的肿瘤。
在一些实施例中,本发明提供了向患者施用抗parp疗法的方法,所述患者的特征在于种系brca1/2突变的不存在,其中所述患者患有具有阴性同源重组缺陷状态的肿瘤。
在一些实施例中,患者患有高级别浆液性卵巢癌或高级别占优势地浆液性组织学卵巢癌。
在一些实施例中,该方法涉及持续治疗直至疾病进展或无法接受的毒性。
在一些实施例中,该方法涉及响应治疗毒性而减少抗parp疗法的剂量。在一些相关的实施例中,该方法包括将抗parp疗法的剂量从约等价于约300mg的剂量减少到等价于约200mg的剂量。
在一些实施例中,该方案包括多个经口剂量。
在一些实施例中,该方案包括每天一次(qd)给药。
在一些实施例中,该方案包括至少一个28天的抗parp治疗给药周期。
在一些实施例中,经口剂量以一个或多个单位剂型施用。
在一些实施例中,一个或多个单位剂型是胶囊。
在一些实施例中,经口剂量是等价于约5至约400mg尼拉帕尼的范围的抗parp疗法。在一些实施例中,抗parp疗法的量等价于约5、约10、约25、约50、约100、约150、约200、约250、约300、约350或约400mg尼拉帕尼。在一些实施例中,抗parp疗法的量等价于约300mg尼拉帕尼。在一些实施例中,抗parp疗法的量等价于约200mg尼拉帕尼。
在一些实施例中,每个单位剂型等价于约100mg、约200mg或约300mg尼拉帕尼。
在一些实施例中,每个qd剂量等价于约100mg、约200mg或约300mg尼拉帕尼。在一些实施例中,每个qd剂量以等价于约100mg尼拉帕尼的三个单位剂型施用。
在一些实施例中,无进展生存期的特征在于一种或多种靶肿瘤的完全响应。
在一些实施例中,无进展生存期的特征在于一种或多种靶肿瘤的部分响应。
在一些实施例中,患者处于禁食状态。
在一些实施例中,患者处于进食状态。
在一些实施例中,延长的无进展生存期为至少9个月。在一些实施例中,延长的无进展生存期为至少12个月。在一些实施例中,延长的无进展生存期为至少18个月。在一些实施例中,延长的无进展生存期为至少21个月。在一些实施例中,延长的无进展生存期为至少24个月。在一些实施例中,延长的无进展生存期为至少27个月。在一些实施例中,延长的无进展生存期为至少30个月。在一些实施例中,延长的无进展生存期为至少33个月。在一些实施例中,延长的无进展生存期为至少36个月。
在一些实施例中,疾病进展的风险比为约0.3。在一些实施例中,疾病进展的风险比为约0.45。在一些实施例中,疾病进展的风险比为约0.5。在一些实施例中,疾病进展的风险比小于约0.5。在一些实施例中,疾病进展的风险比小于约0.45。在一些实施例中,疾病进展的风险比小于约0.4。在一些实施例中,疾病进展的风险比小于约0.35。在一些实施例中,疾病进展的风险比小于约0.3。
在一些实施例中,抗parp疗法作为维持疗法施用。
在一些实施例中,抗parp疗法维持疗法对下一线疗法(例如,后续疗法)的功效没有显著影响。在一些实施例中,下一线疗法包括化学治疗剂的施用。在一些实施例中,化学治疗剂是铂试剂。在一些此类实施例中,铂试剂选自顺铂、卡铂、奥沙利铂、奈达铂、四硝酸三铂、菲铂、吡铂或沙铂。
附图说明
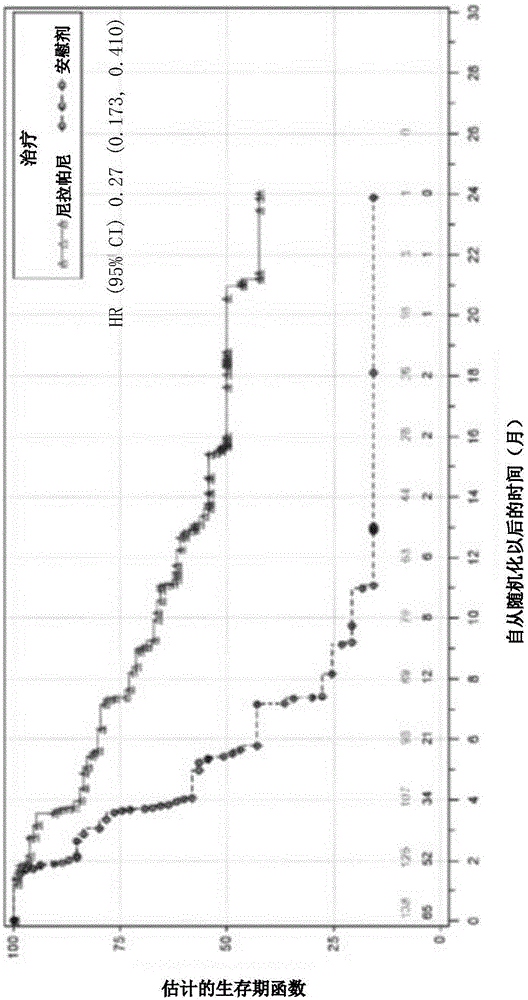
图1描绘了当用尼拉帕尼或安慰剂治疗时,携带基因组brca突变(gbrcamut)的患者的无进展生存期的图示。y轴显示估计的生存期函数值,并且x轴显示自从随机化以后的时间(以月计)。疾病进展的风险比在图上显示为hr(95%ci)0.27(0.173,0.410)。
图2描绘了当用尼拉帕尼或安慰剂治疗时,缺乏基因组brca突变(非gbrca)但具有hrd阳性肿瘤(阳性hrd状态)的患者的无进展生存期的图示。y轴显示估计的生存期函数值,并且x轴显示自从随机化以后的时间(以月计)。疾病进展的风险比在图上显示为hr(95%ci)0.38(0.243,0.586)。
图3描绘了当用尼拉帕尼或安慰剂治疗时,缺乏基因组brca突变(非gbrca)的患者的无进展生存期的图示。该群体包括具有或不具有hrd的患者。y轴显示估计的生存期函数值,并且x轴显示自从随机化以后的时间(以月计)。疾病进展的风险比在图上显示为hr(95%ci)0.45(0.338,0.607)。
图4描绘了当用尼拉帕尼或安慰剂治疗时,缺乏基因组brca突变(非gbrca)且具有hrd阴性肿瘤(阴性hrd状态)的患者的无进展生存期的图示。y轴显示估计的生存期函数值,并且x轴显示自从随机化以后的时间(以月计)。疾病进展的风险比在图上显示为hr(95%ci)0.58(0.361,0.922)。
图5描绘了当用尼拉帕尼或安慰剂治疗时,由gbrcamut和非gbrcamut群体组成的组合研究群体的无进展生存期的图示。y轴显示估计的生存期函数值,并且x轴显示自从随机化以后的时间(以月计)。
图6描绘了当用尼拉帕尼或安慰剂治疗时,非gbrcamut群组的hrdpos/brcawt亚组中的无进展生存期的图示。y轴显示估计的生存期函数值,并且x轴显示自从随机化以后的时间(以月计)。
图7描绘了当用尼拉帕尼或安慰剂治疗时,非gbrcamut群组的hrdpos/体细胞brcamut亚组中的无进展生存期的图示。y轴显示估计的生存期函数值,并且x轴显示自从随机化以后的时间(以月计)。
图8描绘了随着时间过去血小板从基线(±se)的平均变化的图示:所有患者群组。
图9描绘了基于通过施用最长持续时间的尼拉帕尼剂量(安全性群体中的尼拉帕尼患者)的irc评价,在gbrcamut群组中的无进展生存期的图示。
图10描绘了基于通过施用最长持续时间的尼拉帕尼剂量(安全性群体中的尼拉帕尼患者)的irc评价,在非gbrcamut群组中的无进展生存期的图示。
图11阐述了主要功效群体中的次要终点的表。
图12描绘了在(图12a)gbrcamut群组、(图12b)非gbrcamut、hrdpos亚组和(图12c)总体非gbrcamut群组中的无进展生存期分析的图示。
图13描绘了在(左图)gbrcamut群组、(中)总体非gbrcamut群组和(右图)非gbrcamut、hrdpos亚组中,无化学疗法生存期间隔的分析的图示。
图14描绘了在(左图)gbrcamut群组、(中)总体非gbrcamut群组和(右图)非gbrcamut、hrdpos亚组中,第一后续治疗时间分析的图示。
图15描绘了在合并的gbrcamut和非gbrcamut群组中,下一线治疗的功效分析的图示。
图16描绘了在最后一个剂量的基于铂的疗法后6个月时,进行性疾病的估计概率的图示。
图17描绘了对于基于铂的化学疗法gbrcamut(a)、基于铂的化学疗法非gbrcamut(b)、总化学疗法gbrcamut(c)和总化学疗法非gbrcamut(d)群组显示的,化学疗法的线数目对患者的疾病进展时间的比例的作用的图示。
图18描绘了使用癌症疗法的功能评价-卵巢症状指数(fosi)和eq-5d-5l的患者报告的结果的图示。
具体实施方式
定义
如本文使用的,术语“施用”通常指将组合物施用于受试者或系统。本领域普通技术人员将了解,在适当的情况下,各种途径可以用于对于受试者例如人受试者施用。例如,在一些实施例中,施用可以是眼部、经口、肠胃外、局部等。在一些特定实施例中,施用可以是支气管(例如,通过支气管滴注)、颊、皮肤(其可以是或包括例如对真皮、皮内、皮间、透皮等局部中的一种或多种)、肠内、动脉内、皮内、胃内、髓内、肌内、鼻内、腹膜内、鞘内、静脉内、心室内、在特定器官内(例如肝内)、粘膜、鼻、口腔、直肠、皮下、舌下、局部、气管(例如通过气管内滴注)、阴道、玻璃体等。在一些实施例中,施用可以涉及其为间歇(例如,在时间上分开的多个剂量)和/或定期(例如,通过共同的时间段分开的各个剂量)的施用。在一些实施例中,施用可涉及连续给药(例如,灌注)至少所选择的时间段。
如本文使用的,术语“剂型”或“单位剂型”指用于施用于受试者的活性剂(例如治疗剂或诊断剂)的物理上离散单元。通常,每个此类单元含有预定数量的活性剂。在一些实施例中,此类数量是适合于根据方案施用的单位剂量量(或其整个部分),所述方案已确定与当施用于有关群体(即,用治疗方案)时的所需结果或有益结果相关联。本领域普通技术人员应了解,施用于特定受试者的治疗组合物或试剂的总量由一个或多个主治医师确定,并且可以涉及多重剂型的施用。
如本文使用的,术语“方案”指通常通过一个或多个时间段分开的一组单独剂量(通常多于一个),其个别施用于受试者。在一些实施例中,根据方案施用给定的治疗剂,所述方案可以涉及一个或多个剂量。在一些实施例中,方案包括多个剂量,所述剂量各自在时间上与其它剂量分开。在一些实施例中,各个剂量彼此分开相同长度的时间段;在一些实施例中,方案包括多个剂量,其中剂量由不同长度的时间段分开。在一些实施例中,方案包括相同量的剂量。在一些实施例中,方案包括不同量的剂量。在一些实施例中,方案包括至少一个剂量,其中所述剂量包含一个单位剂量的治疗剂。在一些实施例中,方案包括至少一个剂量,其中所述剂量包含两个或更多个单位剂量的治疗剂。例如,250mg的剂量可以作为单个250mg单位剂量或两个125mg单位剂量施用。在一些实施例中,当跨越有关群体施用(即,是治疗方案)时,方案与所需结果或有益结果相关联或者导致所需结果或有益结果。
如本文使用的,术语“患者”、“受试者”或“测试受试者”指根据本发明向其施用本文所述的提供的一种或多种化合物的任何生物,例如用于实验、诊断、预防和/或治疗目的。通常的受试者包括动物(例如哺乳动物,如小鼠、大鼠、兔、非人灵长类动物和人;昆虫;蠕虫等)。在一个优选实施例中,受试者是人。在一些实施例中,受试者可能患有和/或易患疾病、病症和/或状况(例如癌症,如卵巢癌、输卵管癌,腹膜癌和乳腺癌)。在一些实施例中,患者是具有一个或多个女性生殖器官的人。在一些实施例中,患者是已被诊断有妇科癌症(例如癌症,如卵巢癌、输卵管癌、腹膜癌和乳腺癌)的人类女性(即,女性)。如本文使用的,“患者群体”或“受试者群体”指多个患者或受试者。
如本文使用的,“治疗有效量”指产生它为了其施用的所需效应的治疗剂的量。在一些实施例中,该术语指当根据方案施用于患有或易患疾病、病症和/或状况的群体时,足以治疗所述疾病、病症和/或状况的量。在一些实施例中,治疗有效量是降低疾病、病症和/或状况的一种或多种症状的发生率和/或严重性,和/或延迟其发作的量。本领域普通技术人员将了解,术语“治疗有效量”实际上不需要实现在特定个体中的成功治疗。相反,治疗有效量可以是当施用于需要此类治疗的患者时,在大量受试者中提供特定的所需药理学应答的量。在一些实施例中,提及治疗有效量可以指如在一种或多种特定组织(例如,受疾病、病症或状况影响的组织)或流体(例如,血液、唾液、血清、汗液、泪、尿等)中测量的量。本领域普通技术人员将了解,在一些实施例中,治疗有效量的特定试剂或疗法可以以单一剂量配制和/或施用。在一些实施例中,治疗有效试剂可以以多个剂量配制和/或施用,例如,作为方案的部分。
如本文使用的,“化学治疗剂”指抑制癌细胞的增殖、生长、寿命和/或转移活性的化学试剂。在一些实施例中,化学治疗剂是铂试剂。在一些此类实施例中,铂试剂选自顺铂、卡铂、奥沙利铂、奈达铂、四硝酸三铂、菲铂、吡铂或沙铂。
如本文使用的,“ca-125”意指癌抗原125。ca-125测试用于测量患者的血液中的蛋白质ca-125的量。ca-125测试可以用于监测在治疗期间和治疗之后的某些癌症,包括用于评估无进展生存期的延长。在某些情况下,ca-125测试可以用于寻找具有非常高的疾病风险的女性中的卵巢癌的早期体征。
如本文使用的,“同源重组”指其中交换不同dna链之间的核苷酸序列的过程。同源重组涉及许多不同的生物过程,例如,同源重组作为dna修复过程的部分(例如,双链断裂修复途径和合成依赖性链退火途径)、以及在真核生物的减数分裂/配子发生过程期间发生。如本文使用的,“同源重组缺陷”、“同源重组修复缺陷”、“同源修复缺陷”或“hrd”指同源重组过程的减少或损害。不希望受理论束缚,认为因为同源重组涉及dna修复,所以同源重组缺陷样品将不能修复dna损伤或具有降低的修复dna损伤的能力,所述dna损伤例如双链断裂。像这样,其为hrd的样品将积累可以用作hrd的生物标记物的基因组错误或染色体畸变。如本文使用的,“染色体畸变”或“ca”指样品的染色体dna中的可检测变异。在一些实施例中,ca可以落入三个重叠类别中的至少一个内:杂合性丢失(loh)、等位基因失衡(例如,端粒等位基因失衡(tai))或大规模跃迁(lst)。在一些实施例中,通过从患者获得的样品(例如,肿瘤样品)中的ca检测来确定“hrd状态”。在一些实施例中,阳性hrd状态指从患者获得的样品满足在指定数目的染色体指示剂区域处的ca阈值数目或水平。在一些实施例中,使用商购可得的诊断剂测定hrd状态,以检测样品(例如肿瘤样品)中的染色体畸变和/或评价样品是否无法修复双链dna断裂。评价hrd状态的商购可得的诊断剂包括hrdtm诊断试剂盒。
如本文使用的,杂合性缺失(loh)指目的多态性基因座从杂合性到纯合性的变化。在人基因组内的多态性基因座(例如,单核苷酸多态性(snp))一般在个体的种系内是杂合的,因为该个体通常接受来自生物学父亲的一个拷贝和来自生物学母亲的一个拷贝。然而,在体细胞上,这种杂合性可以(经由突变)变为纯合性,在本文中称为loh。loh可以来源于几种机制。例如,在一些情况下,一条染色体的基因座可以在体细胞中缺失。保留存在于另一条染色体上的基因座(男性的另一条非-性染色体)是loh基因座,因为在受影响细胞的基因组内仅存在该基因座的一个拷贝(而不是两个拷贝)。这种类型的loh事件导致拷贝数减少。在其它情况下,体细胞中的一条染色体的基因座(例如,男性的一条非-性染色体)可以替换为来自另一条染色体的该基因座的拷贝,从而消除可能已存在于替换的基因座内的任何杂合性。在这种情况下,保留存在于每条染色体上的基因座是loh基因座,并且可以称为复制中性loh基因座。loh及其在确定hrd中的用途在国际申请号pct/us2011/040953(作为wo/2011/160063公开)中详细描述,所述国际申请的全部内容以引用的方式并入本文。
涵盖loh的更广泛类别的染色体畸变是等位基因失衡。当体细胞中的特定基因座处的相对拷贝数(即,拷贝比例)与种系不同时,发生等位基因失衡。例如,如果种系在特定基因座处具有等位基因a的一个拷贝和等位基因b的一个拷贝,并且体细胞具有a的两个拷贝和b的一个拷贝,则在该基因座处存在等位基因失衡,因为体细胞的拷贝比例为(2:1)不同于种系(1:1)。loh是等位基因失衡的一个例子,因为体细胞具有与种系(1:1)不同的拷贝比例(1:0或2:0)。但等位基因失衡涵盖更多类型的染色体畸变,例如2:1种系成为1:1体细胞;1:0种系成为1:1体细胞;1:1种系成为2:1体细胞等。涵盖染色体端粒的等位基因失衡区域的分析在本发明中特别有用。因此,“端粒等位基因失衡区域”或“tai区域”被定义为具有等位基因失衡的区域,其(a)延伸至一个亚端粒,且(b)不穿过着丝粒。tai及其在确定hrd中的用途在国际申请号pct/us2011/048427(作为wo/2012/027224公开)中详细描述,所述国际申请的全部内容以引用的方式并入本文。
涵盖loh和tai的一类更宽的染色体畸变在本文中称为大规模跃迁(“lst”)。lst指沿着染色体长度的任何体细胞拷贝数跃迁(即,断点),在所述染色体中,在过滤掉短于某个最大长度(例如,0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4或更多兆碱基)的区域后,它在至少某个最小长度(例如,3、4、5、6、7、89、10、1112、13、14、15、16、17、18、19或20或更多兆碱基)的两个区域之间。例如,如果在过滤掉短于3兆碱基的区域后,体细胞具有对于例如至少10兆碱基1:1的拷贝数,然后断点跃迁到例如具有拷贝数2:2的至少10兆碱基的区域,则这是一个lst。定义相同现象的替代方法是作为lst区域,其为受限于断点(即,跃迁)、具有跨越至少某个最小长度(例如,至少3、4、5、6、7、8、9、10、1112、13、14、15、16、17、18、19或20兆碱基)的稳定拷贝数的基因组区域,其中关于另一个区域的拷贝数变化也至少该最小长度。例如,如果在过滤掉短于3兆碱基的区域后,体细胞具有拷贝数为1:1的至少10兆碱基的区域,其在一侧上通过断点跃迁到例如拷贝数为2:2的至少10兆碱基的区域界定,并且在另一侧上通过断点跃迁到例如拷贝数为1:2的至少10兆碱基的区域界定,则这是两个lst。请注意,这比等位基因失衡更广泛,因为此类拷贝数变化不视为等位基因失衡(因为复制比例1:1和2:2是相同的,即复制比例中不存在变化)。popova等人,ploidyandlarge-scalegenomicinstabilityconsistentlyidentifybasal-likebreastcarcinomaswithbrca1/2inactivation,cancerres.(2012)72:5454-5462中详细描述了lst及其在确定hrd中的用途。
如本文使用的,“brca突变”或“brca的突变”指相对于适当的参考序列(例如,野生型参考和/或存在于受试者的非癌细胞中的序列),brca1或brca2基因中的任一或两者的至少一个拷贝的序列中的变化或差异。brca1/2基因中的突变可以导致brca1/2缺陷,其可以包括例如brca基因和/或编码蛋白的表达或功能中的丧失或减少。此类突变也可以被称为“有害突变”或可以被怀疑是有害突变。brca突变可以是“种系brca突变”,其指示它从一个或两个亲本遗传。种系突变影响生物中的每一个细胞且传递给后代。brca突变也可以在一个人的寿命期间获得,即在患者的一生期间的任何时间在身体的任何细胞(“soma”)中散发地出现(即,非遗传的),这在本文中可互换地称为“散发性brca突变或“体细胞brca突变”。遗传测试是可用的,并且是本领域技术人员已知的。例如,bracanalysis
如本文使用的,术语“涉及dna修复的基因”指涉及细胞中dna修复的任何基因。表8列出了涉及dna修复的代表性基因集合。这些包括涉及同源重组(“hr”)的基因,所述同源重组是其中核苷酸序列在两个相似或相同的dna分子之间交换的遗传重组。hr由细胞最广泛地用于准确地修复在dna的两条链上发生的有害断裂,称为双链断裂。例如,brca1、brca2、atm、bard1、brip1、chek2、dmc1、eme1(mms4l)、eme2、gen1、giyd2(slx1b)、mre11a、mus81、nbn、palb2、rad50、rad51、rad51b、rd51c、rad51d、rad52、rad54b、rad54l、rbbp8、shfm1(dss1)、xrcc2、xrcc3是已知涉及hr的基因。本领域技术人员将能够确定基因是否涉及dna修复或同源重组。dna修复状态指涉及dna修复的一个或多个基因中突变的存在或不存在。在某些实施例中,本发明涉及使用parp抑制剂来治疗癌症患者,而不管dna修复状态如何。
如本文使用的,术语“parp抑制剂”意指抑制聚(adp-核糖)聚合酶(parp)蛋白质家族中任何一种的活性或降低其功能的试剂。这可以包括parp家族中超过15种不同酶中的任何一种或多种的抑制剂,所述parp家族参与各种细胞功能,包括细胞周期调节、转录和dna损伤的修复。
如本文使用的,术语“无进展生存期”意指患有疾病(例如癌症)的受试者对于其存活而无疾病状态的显著恶化的时间段。无进展生存期可以评价为其中不存在肿瘤生长进展和/或其中患者的疾病状态未被确定为进行性疾病的时间段。在一些实施例中,通过评估肿瘤(病变)大小、肿瘤(病变)数目和/或转移来评价患有癌症的受试者的无进展生存期。
如本文使用的,“无进展生存期2”(pfs2)定义为从治疗随机化到关于研究治疗后的下一个抗癌疗法的评价进展的较早日期或由于任何原因的死亡的时间段。在一些实施例中,可以通过临床和/或放射照相评价来评价进展的确定。
如本文提及癌症状态使用的,术语肿瘤生长的“进展”或“进行性疾病”(pd)指示靶病变(肿瘤)的直径总和中的增加。在一些实施例中,肿瘤生长的进展指靶病变的直径总和中的至少20%增加,以研究中的最小总和(这包括基线总和,如果这是研究中最小的)作为参考。在一些实施例中,除20%的相对增加之外,靶病变的直径总和还必须证实至少5mm的绝对增加。在确定肿瘤生长的进展中也可以考虑一个或多个新病变出现的因素。如果满足下述标准中的至少一个,则还可以确定用于确定无进展生存期目的的进展:1)通过ct/mri的肿瘤评价明确地显示根据recist1.1标准的进行性疾病;或2)另外的诊断测试(例如组织学/细胞学、超声技术、内窥镜检查、正电子发射断层扫描)鉴定新病变,或确定符合明确进行性疾病的现有病变和ca-125-根据妇科癌症协会(gynecologiccancerintergroup)(gcig)的进展-标准(参见rustin等人,intjgynecolcancer2011;21:419-423,其整体并入本文);3)与非恶性或医源性原因无关的pd的确定临床体征和症状([i]难治性癌症相关疼痛;[ii]恶性肠梗阻/恶化功能障碍;或[iii]腹水或胸腔积液的明确症状性恶化)和ca-125-根据gcig的进展-标准。
如本文使用的,术语“部分响应”或“pr”指受试者中肿瘤进展的减少,如通过靶病变的直径总和中的减少指示的,以基线直径总和作为参考。在一些实施例中,pr指靶病变的直径总和中的至少30%减少,以基线直径总和作为参考。用于评估部分响应的示例性方法由recist指南鉴定。参见e.a.eisenhauer等人,“newresponseevaluationcriteriainsolidtumors:revisedrecistguideline(version1.1.),”eur.j.ofcancer,45:228-247(2009)。
如本文使用的,肿瘤生长的“稳定化”或“稳定疾病”(sd)指既没有足够缩小至对于pr合格,也没有足够增加至对于pr合格。在一些实施例中,稳定化指靶病变的直径总和中小于30%、25%、20%、15%、10%或5%的变化(增加或减少),以基线直径总和作为参考。通过recist指南鉴定用于评估肿瘤生长的稳定化或稳定疾病的示例性方法。参见e.a.eisenhauer等人,“newresponseevaluationcriteriainsolidtumors:revisedrecistguideline(version1.1.),”eur.j.ofcancer,45:228-247(2009)。
如本文使用的,术语“完全响应”或“cr”用于意指所有或基本上所有靶病变的消失。在一些实施例中,cr指靶病变的直径总和中的80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%减少(即病变的消失),以基线直径总和作为参考。在一些实施例中,cr指示在治疗后保留总病变直径的小于10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少。用于评估完全响应的示例性方法由recist指南鉴定。参见e.a.eisenhauer等人,“newresponseevaluationcriteriainsolidtumors:revisedrecistguideline(version1.1.),”eur.j.ofcancer,45:228-247(2009)。
如本文使用的,“风险比”(或在用于尼拉帕尼治疗效应计算的背景下的“hr”,例如hr0.38)是作为对照臂中发生的事件比率,治疗臂中发生的事件的风险或机会的表达。风险比可以通过cox模型确定,所述cox模型是生存期数据的回归方法,其提供风险比及其置信区间的估计。风险比是对治疗组相对于对照组的风险率之比的估计。风险率是如果所讨论的事件尚未发生,则它将在下一个时间间隔内发生的概率,除以该间隔的长度。比例风险回归的假设是风险比随着时间过去是恒定的。
在一些实施例中,本发明涉及对于两种或更多种试剂、实体、情况、条件组、群体等实现的结果的比较。如本领域技术人员将理解的,当此类试剂、实体、情况、条件组、群体等不相同,但足够相似以允许其间的比较时,它们可以视为彼此“可比较的”,从而可以基于观察到的差异或相似性合理地得出结论。在一些实施例中,可比较的条件、环境、个体或群体组的特征在于多个基本上相同的特点和一个或少量变化的特征。在上下文中,本领域普通技术人员将理解,在任何给定情况下,对于两种或更多种此类试剂、实体、情况、条件组,需要何种程度的同一性以被视为可比较的。例如,本领域普通技术人员将了解,当特征在于足够数目和类型的基本上相同的特点,以保证在不同环境、个体或群体组下或者用不同环境、个体或群体组所得到的结果或观察到的现象中的差异由改变的那些特点中的变化引起或指示改变的那些特点中的变化的合理结论时,环境、个体或群体组是彼此可比较的。
如本文所述的比较经常针对适当的“参考”进行。如本文使用的,术语“参考”指相对于其执行比较的标准或对照。例如,在一些实施例中,将目的试剂、动物、个体、群体、样品、序列或值与参照或对照试剂、动物、个体、群体、样品、序列或值进行比较。在一些实施例中,参考或对照基本上与目的测试或确定同时进行测试和/或确定。在一些实施例中,参考或对照是历史参考或对照,任选地在有形介质中体现。通常,如本领域技术人员所理解的,参考或对照在与处于评价的那些可比较的条件或环境下进行确定或表征。本领域技术人员将了解何时存在足够的相似性,以证明对特定的可能参考或对照的依赖和/或与特定的可能参考或对照的比较。
如本文使用的,术语“治疗(treatment)”(也称为“治疗(treat)”或“治疗(treating)”)指疗法的任何施用,所述疗法部分或完全减轻、改善、解除、抑制特定疾病、病症和/或状况,延迟其发作,降低其严重性,和/或降低特定疾病、病症和/或状况的一种或多种症状的发生率、特点和/或原因。在一些实施例中,此类治疗可以针对未显示出有关疾病、病症和/或状况的体征的受试者,和/或仅显示出疾病、病症和/或状况的早期体征的受试者。可替代地或另外地,此类治疗可为显示出相关疾病、病症和/或状况的一种或多种确定体征的受试者具有的。在一些实施例中,治疗可为已被诊断为患有相关疾病、病症和/或状况的受试者具有的。在一些实施例中,治疗可为已知具有一种或多种易感因子的受试者具有的,所述易感因子与相关疾病、病症和/或状况的发展风险增加在统计学上相关。
如本文使用的,术语“禁食状态”指其中受试者在某一时间段内没有消耗食物的受试者状态。在一些实施例中,禁食状态指示在受试者的胃中基本上不存在残留食物。在一些实施例中,禁食状态指在食物消耗后约2小时或更长时间直至下一次食物消耗前约30分钟的时间过程中的受试者状态。在一些实施例中,受试者的禁食状态包括从食物消耗后约2小时、食物消耗后3小时、食物消耗后3.5小时、食物消耗后4小时、食物消耗后6小时、食物消耗后8小时、或食物消耗后12小时,直至下一次食物消耗前约30分钟的时间,或其间的任何时间点,包括终点在内。
如本文使用的,术语“进食状态”指其中在治疗剂(例如,尼拉帕尼)施用时,在受试者的胃中存在食物的受试者状态。在一些实施例中,进食状态指在从食物消耗开始到食物消耗后约2小时的时间期间的受试者状态,例如在食物消耗期间、在食物消耗后立即、在食物消耗后约30分钟、在食物消耗后约1小时、在食物消耗后约1.5小时、或在食物消耗后约2小时、或任何两个数字之间的任何时间,包括终点在内。如本文使用的,食物消耗指消耗大量食物,例如受试者正常一餐的至少三分之一,按体积或消耗的卡路里总数计。
如本文使用的,术语“多晶型物”指化合物的晶体结构。如本文使用的,术语“溶剂化物”指具有掺入晶体结构内的化学计量或非化学计量的溶剂的结晶形态。类似地,术语“水合物”指具有掺入晶体结构内的化学计量或非化学计量的水的结晶形态。
如本文使用的,术语“药学可接受的盐”指那些盐,在合理的医学判断的范围内,所述盐适用于与人和低等动物的组织接触而无过度毒性、刺激、变应性应答等等,并且与合理的利益/风险比相称。药学可接受的盐是本领域众所周知的。例如,s.m.berge等人在j.pharmaceuticalsciences,1977,66,1–19中详细描述了药学可接受的盐,所述参考文献以引用的方式并入本文。本发明化合物的药学可接受的盐包括源自合适的无机和有机酸和碱的那些盐。药学可接受的、无毒的酸加成盐的例子是与无机酸如盐酸、氢溴酸、磷酸、硫酸和高氯酸或者有机酸如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸,或者通过使用本领域中使用的其它方法如离子交换形成的氨基的盐。其它药学可接受的盐包括己二酸盐、海藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、延胡索酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、扑酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐、戊酸盐等等。
源自适当的碱的盐包括碱金属、碱土金属、铵和n+(c1–4烷基)4盐。代表性的碱金属盐或碱土金属盐包括钠、锂、钾、钙、镁等等。进一步的药学可接受的盐包括(适当时)无毒铵盐、季铵盐和使用抗衡离子形成的胺阳离子,例如卤化物、氢氧化物、羧酸盐、硫酸盐、磷酸盐、硝酸盐、低级烷基磺酸盐和芳基磺酸盐。
如本文使用的,术语“药物组合物”指其中活性剂连同一种或多种药学可接受的载体一起配制的组合物。在一些实施例中,活性剂以适合于在治疗方案中施用的单位剂量存在,当施用于有关群体时,所述治疗方案显示实现预定疗效的统计学显著概率。在一些实施例中,药物组合物可以特别配制用于以固体或液体形式施用,包括适于经口施用的那些形式,例如,浸液(水性或非水性溶液或悬浮液)、片剂(例如靶向颊、舌下和全身吸收的那些片剂)、大丸剂、粉末、颗粒、用于施加于舌的糊剂。药物组合物还可以指药剂。
如本文使用的,术语“尼拉帕尼”意指任何游离碱化合物((3s)-3-[4-{7-(氨基羰基)-2h-吲唑-2-基}苯基]哌啶),(3s)-3-[4-{7-(氨基羰基)-2h-吲唑-2-基}苯基]哌啶的盐形式,包括药学可接受的盐(例如,(3s)-3-[4-{7-(氨基羰基)-2h-吲唑-2-基}苯基]哌啶甲苯磺酸盐),或其溶剂化或水合形式(例如,(3s)-3-[4-{7-(氨基羰基)-2h-吲唑-2-基}苯基]哌啶甲苯磺酸盐一水合物)。在一些实施例中,这些形式可分别地个别地被称为“尼拉帕尼游离碱”、“尼拉帕尼甲苯磺酸盐”和“尼拉帕尼甲苯磺酸盐一水合物”。除非另有说明,否则术语“尼拉帕尼”包括化合物(3s)-3-[4-{7-(氨基羰基)-2h-吲唑-2-基}苯基]哌啶的所有形式。
如本文使用的,术语“维持疗法”或“维持治疗”是用于预防疾病复发的治疗。例如,在癌症已在初始疗法(癌症治疗)后显著减少或消除之后,维持疗法可以预防或最小化癌症的生长。维持治疗可以是连续治疗,其中以间隔开的间隔,例如每天、每隔一天、每周、每2周、每3周、每4周或每6周,施用多重剂量。在一些实施例中,维持疗法可以持续预定的时间长度。在一些实施例中,维持疗法可以持续直到发生无法接受的毒性和/或发生疾病进展。在维持治疗的过程中,如通过不良事件指示的,在毒性发生时可以中断治疗。如果毒性在28天内适当地消退至基线或者1级或更低,则患者可以重新开始用尼拉帕尼的治疗,这可以包括剂量水平降低,如果预防视为不可行的话。
如本文使用的,总生存期(“os”)定义为从治疗开始到出于任何原因的死亡的时间。关于用作临床试验终点,它定义为从随机化到出于任何原因的死亡的时间,并且在预期治疗群体中进行测量。
如本文使用的,“客观响应率”(“orr”)定义为具有预定量的肿瘤尺寸减少和最小时间段的患者的比例。应答持续时间通常从初始响应时间到记录的肿瘤进展来测量。一般地,orr可以定义为部分响应加上完全响应的总和。
如本文使用的,“第一后续治疗时间”(tfst)定义为当前研究中随机化的日期至第一后续治疗方案(例如,抗癌疗法)的开始日期。
如本文使用的,“第二后续治疗时间”(tsst)定义为当前研究中的随机化日期至第二后续治疗方案(例如,抗癌疗法)的开始日期。
如本文使用的,“无化学疗法间隔”(cfi)定义为从最后一次抗癌疗法(例如,基于铂的化学疗法)的最后剂量到下一次开始的时间。
卵巢癌
当卵巢中的健康细胞改变并且不受控制地生长时,卵巢癌开始,形成称为肿瘤的肿块。肿瘤可以是癌性的或良性的。癌性肿瘤是恶性的,意味着它可以生长并扩散到身体的其它部分。良性肿瘤意味着肿瘤可以生长但不传播。去除卵巢或肿瘤位于其中的卵巢部分可以治疗非癌性卵巢肿瘤。在卵巢的表面上形成的卵巢囊肿不同于非癌性肿瘤,并且通常无需治疗而消失。简单的卵巢囊肿不是癌性的。它们经常在正常月经周期过程中发生。卵巢癌的类型包括:上皮癌、生殖细胞肿瘤或间质瘤。
上皮癌构成卵巢癌的85%至90%。虽然历史上认为从卵巢的表面开始,但新的证据提示,至少一些卵巢癌始于输卵管的部分中的特殊细胞。输卵管是将女性卵巢与子宫连接的小管,其为女性生殖系统的部分。每一个女性都具有两个输卵管,一个位于子宫的每一侧上。始于输卵管的癌细胞可能早期到达卵巢的表面。术语‘卵巢癌’经常用于描述始于卵巢、输卵管和称为腹膜的腹腔衬里的上皮癌。生殖细胞肿瘤。这种罕见类型的卵巢癌在卵巢的产卵细胞中发展。这种类型的肿瘤在10至29岁的女性中更常见。间质瘤。这种罕见形式的卵巢癌在将卵巢固定在一起的结缔组织细胞中发展,所述结缔组织细胞有时是制备称为雌激素的女性激素的组织。超过90%的这些肿瘤是成人或儿童期颗粒细胞瘤。颗粒细胞瘤可以分泌雌激素,导致在诊断时异常的阴道出血。
在2012年在美国女性中的上皮性卵巢癌的预期发生率为大约22,280例(15,500例死亡),并且在2012年在欧洲估计为65,538个患者病例(42,704例死亡)。在诊断时,大多数妇女呈现晚期疾病,这解释了高死亡率的原因。初始化学疗法由紫杉烷或铂化学疗法或两者的组合组成。虽然大约75%的患者响应第一线治疗,但其中的70%最终在1至3年内复发。尽管最初的高响应率,但由于高复发率,存在显著的未满足需求。通过添加第三种细胞毒性药物(托泊替康、吉西他滨或多西环素)来改善标准双药化学疗法(卡铂和紫杉醇)的尝试已失败(dubois等人,2006和pfisterer等人,2006)。不久的将来的巨大挑战将是患有晚期卵巢癌的患者的选择,所述患者将在第一线维持背景下受益于特定的靶向试剂。在实现初始化学疗法的响应后的维持治疗可以代表通过延迟疾病进展副作用,延迟对毒性化学疗法的需要和延长的总生存期来提供临床益处的方法。然而,目前在卵巢癌维持背景下不存在广泛公认的护理标准。
缺乏成功的治疗策略导致癌症基因组图谱(cancergenomeatlas)(tcga)研究人员全面测量临床注释的hgs-ovca样品的基因组和表观基因组异常,以鉴定影响病理生理学、影响后果并构成治疗靶的分子因素(tcga,2011)。卵巢肿瘤的特征在于dna修复中的缺陷,例如brca突变。brca1和2最初被鉴定为肿瘤抑制基因,其与当缺陷时某些恶性肿瘤包括卵巢癌的发生率增加相关。由于种系和散发突变以及启动子高甲基化的组合,在34%的卵巢癌中注意到在brca缺陷。brca在dna修复包括同源重组中起关键作用。该研究估计超过一半的高级别浆液性卵巢癌具有dna修复中的缺陷。具有brca缺陷/同源重组缺陷(hrd)的肿瘤细胞可以提供用于使用试剂的治疗干预的机会,所述试剂抑制dna修复途径且利用癌症治疗的合成致死机制。最近的研究已提示,上皮性卵巢癌(eoc)中的hr缺乏不仅仅是由于种系brca1和brca2突变(hennessy,2010;tcga,2011;bylerdann,2012)。癌症基因组图谱研究网络报道了数据集中~500eoc的大约一半中的至少一个hr途径基因的缺陷。
聚(adp-核糖)聚合酶(parp)的作用
聚(adp-核糖)聚合酶(parp)是切割nad+,释放烟酰胺,并且连续添加adp-核糖单元以形成adp-核糖聚合物的酶家族。相应地,parp酶的激活可以导致细胞nad+水平的耗尽(例如,作为nad+消耗者的parp),并且介导通过下游靶的adp-核糖基化的细胞信号传导。parp-1是锌指dna结合酶,其通过与dna双链或单链断裂结合而被激活。已知抗烷化剂可以耗尽肿瘤细胞的nad+含量,并且parp的发现解释了这些现象。(parpinhibitorsandcancertherapy.curtinn.inpolyadpribosylation.编辑alexanderburke,landsbioscienceandspringerbioscience,2006:218-233)。抗烷化剂诱导dna链断裂,其激活其为dna修复途径的部分的parp-1。核蛋白通过parp-1的聚adp-核糖基化将dna损伤转换成细胞内信号,其可以激活dna修复(例如通过碱基切除修复(ber)途径);或者在dna损伤的存在下触发细胞死亡,所述dna损伤太广泛且无法有效修复。
parp酶在dna损伤应答(例如响应基因毒性应激的dna修复)中的作用已导致令人信服的建议:parp抑制剂可能是有用的抗癌剂。众多研究涉及单独或与其它试剂组合的parp抑制剂作为癌症治疗剂的活性的研究。parp抑制剂可以特别有效地治疗来源于同源重组dna修复途径中的种系或散发缺陷的癌症,例如brca-1、brca-2和/或atm缺陷型癌症。另外,基因毒性化学疗法与parp抑制的同时施用可以通过压制ber来增强此类化学疗法的杀伤效应。
临床前离体和体内实验提示,parp抑制剂对于brca-1或brca-2基因纯合失活的肿瘤是选择性细胞毒性的,所述brca-1或brca-2基因已知在同源重组(hr)dna修复途径中是重要的。在具有hr中的缺陷的癌症中使用parp-1抑制剂作为单一试剂的生物学基础是parp-1和parp-2对于受损dna的碱基切除修复(ber)的需要。在形成单链dna断裂后,parp-1和parp-2在病变部位处结合,变得激活,并且催化在与染色质相关的几种蛋白质(包括组蛋白、parp本身和各种dna修复蛋白)上的adp-核糖长链聚合物(par链)添加。这导致染色质松弛和dna修复因子的快速募集,所述dna修复因子接近且修复dna断裂。正常细胞每天修复高达10,000个dna缺陷,并且单链断裂是最常见形式的dna损伤。具有ber途径中的缺陷的细胞伴随未修复的单链断裂进入s期。当复制机制通过断裂时,预先存在的单链断裂转换为双链断裂。在s期期间存在的双链断裂优先通过无错误的hr途径修复。无法使用hr的细胞(即,由于hr所需基因例如brca-1或brca-2的失活)在s期期间积累停滞的复制叉,并且可能使用易错的非同源末端连接(nhej)来修复受损的dna。无法完成s期(由于停滞的复制叉)和通过的nhej易错修复两者被认为促成细胞死亡。
不希望受理论束缚,假设用parp抑制剂治疗代表了选择性杀死具有dna修复途径中的缺陷的癌细胞子集的新机会。例如,在具有种系brca突变的患者中出现的肿瘤具有缺陷的同源重组dna修复途径,并且将越来越多地依赖于ber,由parp抑制剂阻断的途径,用于维持基因组完整性。同源重组dna修复基因中的非brca缺陷也可以增强肿瘤细胞对parp抑制剂的敏感性。通过使用parp抑制剂来阻断具有预先存在的互补dna修复途径缺陷的肿瘤中的一种dna修复途径而诱导死亡的这种概念称为合成致死。
在具有遗传性乳腺癌或卵巢癌的大多数患者中发现brca-1和brca-2基因的种系突变。通过其它机制使brca-1和brca-2基因失活在几种散发性癌症的显著部分中发生,所述其它机制包括体细胞brca-1/2突变和/或通过启动子高甲基化的基因沉默。特别地,对于卵巢癌,在所有上皮性卵巢癌(eoc)的10%-15%中发现体细胞brca-1或brca-2突变,并且在散发性卵巢癌的大部分中已观察到brca-1的强烈降低的表达。总的来说,由于brca-hr途径中的缺陷,高达40%-60%的卵巢癌可能对parp抑制剂有响应,指示这种方法在卵巢癌的治疗中的巨大潜力。
hr是复杂途径,并且需要除brca-1和brca-2外的几种基因,以经由hr途径感知或修复dna双链断裂。因此,parp抑制剂对于具有除brca-1和brca-2外的dna修复蛋白中的缺陷的癌细胞也是选择性细胞毒性的,所述dna修复蛋白包括reca同源物(rad51和rad54)、中国仓鼠细胞中的x射线修复互补缺陷修复(xrcc2和xrcc3)、dss1、复制蛋白a1(rpa1)、共济失调性毛细血管扩张症突变(atm)、atm和rad3相关(atr)、检查点激酶(chk1、chk2)、nijmegen断裂综合征1(nbs1)、以及范科尼贫血修复途径的组分。已知这些基因中的一些在不同的散发性肿瘤中是突变或下调的,其因此可能“依赖”hr,但也可能是非hr介导的dna修复,并且因此响应parp抑制剂。最近以来,还已证实了具有pten基因缺失的肿瘤细胞确实对parp抑制剂敏感,可能是hr缺陷的结果。
parp抑制剂的治疗潜力通过以下观察进一步扩展:parp-1抑制剂不仅在hr缺陷肿瘤中具有单一疗法活性,而且在与顺铂、卡铂、烷化剂和甲基化试剂、放射疗法和拓扑异构酶i抑制剂组合时在临床前模型中也是有效的。与其中单独的parp抑制足以使hr缺陷癌症中的细胞死亡(由于内源性dna损伤)的单一疗法的原理形成对比,parp是修复由标准细胞毒性化学疗法诱导的dna损伤所必需的。在一些情况下,parp的特定作用尚不清楚,但已知parp-1是从dna中释放被捕获的拓扑异构酶i/伊立替康复合物所必需的。替莫唑胺诱导的dna损伤通过ber途径修复,所述ber途径需要parp来募集修复蛋白。增强细胞毒性剂或与细胞毒性剂协同作用而不显著增加毒性的组合疗法对卵巢以及其它类型的癌症患者提供大量益处。
用parp抑制剂(例如,parp-1/2抑制剂)治疗代表了通过利用其在dna修复中的缺陷来选择性杀死癌细胞类型子集的新机会。由于dna修复中的潜在缺陷,人癌症显示出基因组不稳定性和增加的突变率。这些缺陷致使癌细胞更依赖于剩余的dna修复途径,并且靶向这些途径预期对肿瘤细胞的存活具有比对正常细胞大得多的影响。虽然parp抑制剂代表了一类有希望的潜在癌症治疗剂,但这些化合物的临床疗效尚不明确。具体地,关于不同parp抑制剂(例如,parp-1/2抑制剂)作为癌症治疗剂的临床后果的结果在某些情况下是不明确的并且甚至可能是相矛盾的。例如,对测试parp抑制剂奥拉帕尼的临床试验结果的分析已显示患有卵巢癌的患者中关于总生存期的相矛盾的长期结果。例如,三项临床试验的分析发现,虽然与安慰剂或无治疗相比,当加入常规治疗中时,奥拉帕尼平均起来减缓了具有种系brca突变的女性中的铂敏感性上皮性卵巢癌的进展,然而,在患者的总生存期中未观察到显著变化。此外,奥拉帕尼试验发现,与对照组相比,严重不良事件在奥拉帕尼组中更常见。参见,wiggins等人,(2015)“poly(adp-ribose)polymerase(parp)inhibitorsforthetreatmentofovariancancer.”cochranedatabaseofsystematicreviews,issue5.art.no.:cd007929。使用parp抑制剂维利帕尼的另一项临床试验具有相对较小的样本容量,并且无法显示维利帕尼对卵巢癌进展的任何作用。因此,本领域未能为这些parp抑制剂建立临床功效,并且仍然需要鉴定、表征和/或开发parp抑制剂作为有效的癌症治疗剂。本公开内容满足了这种需要。尤其地,本公开内容提供了实现有效癌症治疗的尼拉帕尼组合物和方法,特别是作为用于女性生殖系统癌症(例如卵巢癌)的治疗。在一些实施例中,本公开内容提供了实现如本文所述的无进展生存期率和/或风险比的尼拉帕尼组合物和/或方法。在一些实施例中,提供的组合物和/或方法实现这样的效应,其总体治疗出现的不良事件率(teae)高于用可比较的安慰剂治疗观察到的那种的不超过约三倍,或在一些实施例中两倍。提供的组合物和/或方法实现这样的效应,其严重teae率高于用可比较的安慰剂治疗观察到的那种的不超过约5倍、或约4.5倍、或约4倍。
铂敏感的、复发性卵巢癌仍然是未满足的医学需求。美国国家综合癌症网络(nationalcomprehensivecancernetwork)(nccn)和欧洲肿瘤内科学会(europeansocietyofmedicaloncology)(esmo)指南两者均推荐,在对初始基于铂的治疗响应后>6个月出现复发时,用基于铂的组合化学疗法重新治疗患者。对于已复发的铂敏感性患者,紫杉醇加上卡铂是最常用的方案。复发且用第二轮基于铂的化学疗法治疗的大多数患者在响应化学疗法后未接受任何类型的治疗,因为在美国不存在化学疗法后批准用于维持使用的产品。美国的护理标准是“观察等待”。
不幸的是,基于铂的化学疗法的效用随着时间过去而变小;pfs和无铂间隔一般在每次后续治疗后变得更短,其中肿瘤最终变成铂抗性或难治性的。此外,由于伴随铂试剂和紫杉烷的累积毒性,患者一般每个疗程不接受多于6个周期的基于铂的化学疗法。需要新的试剂来延长对基于铂的化学疗法的响应,降低复发或死亡的风险,并且增加无铂间隔。
聚(adp-核糖)聚合酶(parp)蛋白质家族由超过15种不同的酶组成,其参与各种细胞功能,包括细胞周期调节、转录和dna损伤的修复。brca1、brca2和palb2是对于通过无错误的同源重组修复或hrr途径的双链dna断裂修复重要的蛋白质。当任一蛋白质的基因突变时,变化可以导致dna修复中的错误,其最终可以引起癌症,包括例如乳腺癌或卵巢癌。
parp-1是该组中最丰富和最佳表征的蛋白质,并且对于通过碱基切除修复途径的单链dna断裂修复是至关重要的。如果此类断裂持续未修复,直到dna被复制(其必须在细胞分裂之前),那么复制本身可以引起双链断裂形成。parp-1的有效抑制导致单链断裂的积累,其最终导致双链断裂。通常此类双链断裂通过同源重组(hr)修复,但在缺陷型hr的细胞中,parp抑制可以导致染色体不稳定性、细胞周期停滞和随后的细胞凋亡。dna在每个细胞周期期间损伤数千次,并且该损伤必须被修复。当一度经受足够的损伤时,改变的基因可以引起细胞的死亡。不像癌细胞那样经常复制其dna的正常细胞,以及缺乏任何突变的brca1或brca2的正常细胞仍然具有同源修复操作,这允许它们在parp抑制后存活。parp抑制剂通过阻断parp酶活性起作用,其阻止dna损伤的修复并且最终可以引起细胞死亡。它们还被认为通过在dna损伤的位点处定位parp蛋白而起作用,这已与其抗肿瘤活性有关。捕获的parp蛋白–dna复合物对细胞是高度毒性的,因为它们阻断dna复制。
一旦dna结合和修复过程在进行中,parp蛋白通常就从dna中释放。有证据证实当蛋白质与parp抑制剂结合时,它们变得捕获在dna上。捕获的parp–dna复合物对细胞的毒性大于未修复的单链dna断裂,其在不存在parp活性的情况下积累。因此,不受理论束缚,parp抑制剂存在至少两种机制-修复的抑制和parp捕获。
在乳腺癌相关基因brca1和brca2中具有突变的肿瘤中已观察到hr无法纠正双链断裂,所述乳腺癌相关基因编码对于正常hr功能必需的蛋白质。使用小分子parp抑制剂以在dna损伤修复中利用这种基因易损性是合成致死的一个例子,其中两种途径的同时抑制导致细胞死亡,而单独阻断任一途径不是致命的。parp抑制剂在治疗brca突变的肿瘤细胞中鼓舞人心的临床前结果对于在最可能携带这些突变的患者群体中临床测试这些药物提供了强有力的理论基础,所述患者群体例如患有乳腺癌或卵巢癌的那些。这种治疗策略目前已通过最近美国食品和药物管理局(fda)得到确认-parp抑制剂奥拉帕尼和芦卡帕尼作为治疗患有brca突变的晚期卵巢癌的患者的单一疗法的加速批准。令人惊讶的是,本发明证实parp抑制在延长人癌症患者中的无进展生存期方面是有效的,不管brca1或brca2中突变的存在或不存在。尼拉帕尼是证实这种能力的首个parp抑制剂,但结果可以用其它parp抑制剂实现。下文讨论了尼拉帕尼及其它此类parp抑制剂。
尼拉帕尼,(3s)-3-[4-{7-(氨基羰基)-2h-吲唑-2-基}苯基]哌啶,是经口可用的、有效的聚(二磷酸腺苷[adp]-核糖)聚合酶(parp)-1和-2抑制剂。参见wo2008/084261(于2008年7月17日公开)和wo2009/087381(于2009年7月16日公开),所述专利各自的全部内容在此以引用的方式并入。可以根据wo2008/084261的方案1制备尼拉帕尼。
在一些实施例中,可以将尼拉帕尼制备为药学可接受的盐。本领域技术人员将了解,此类盐形式可以作为溶剂化或水合多晶型形式存在。在一些实施例中,尼拉帕尼以水合物的形式制备。
在某些实施例中,尼拉帕尼以甲苯磺酸盐的形式制备。在一些实施例中,尼拉帕尼以甲苯磺酸盐一水合物的形式制备。
尼拉帕尼的结晶甲苯磺酸盐一水合物盐正在开发为用于具有同源重组(hr)脱氧核糖核酸(dna)修复途径中的缺陷的肿瘤的单一治疗试剂,以及作为与细胞毒素剂和放射疗法组合的致敏剂。
尼拉帕尼是有效的选择性parp-1和parp-2抑制剂,其对照50%的抑制浓度分别为(ic50)=3.8和2.1nm,并且选择性超过其它parp家族成员至少100倍。在各种细胞系中,尼拉帕尼抑制由于通过过氧化氢添加引起的dna损伤而刺激的parp活性,其中ic50和对照90%的抑制浓度(ic90)分别为约4和50nm。
尼拉帕尼证实对于癌细胞系的选择性抗增殖活性,与其野生型对应物相比,所述癌细胞系已对于brca-1或brca-2沉默,或者携带brca-1或brca-2突变。尼拉帕尼对brca缺陷细胞的抗增殖活性是g2/m中的细胞周期停滞随后为细胞凋亡的后果。对于选择的尤文氏肉瘤、急性淋巴细胞白血病(all)、非小细胞肺癌(nsclc)和小细胞肺癌(sclc)细胞系,以及携带atm基因的纯合子失活的肿瘤细胞系,尼拉帕尼也是选择性细胞毒性的。尼拉帕尼证实对正常人细胞的弱活性。体内研究证实对brca-1突变型乳腺癌(mda-mb-436)、brca-2突变型胰腺癌(capan-1)、atm突变型套细胞淋巴瘤(granta-519)、浆液性卵巢癌(ovcar3)、结肠直肠癌(ht29和dld-1)、患者衍生的尤文氏肉瘤和小鼠中的tnbc异种移植物模型的强抗肿瘤活性。
还已通过测量来自肿瘤异种移植物研究的肿瘤匀浆物中的parp活性证实了靶接合。还已在来自用尼拉帕尼给药的小鼠的外周血单核细胞(pbmc)中测量了parp活性的抑制。尼拉帕尼已显示诱导细胞周期停滞,特别是在细胞周期的g2/m期中的停滞。相应地,在一些实施例中,本发明提供了诱导肿瘤细胞的细胞周期停滞的方法,该方法包括将尼拉帕尼施用于有此需要的患者。在一些实施例中,本发明提供了诱导肿瘤细胞的细胞周期的g2/m期停滞的方法,该方法包括将尼拉帕尼施用于有此需要的患者。在一些实施例中,本发明提供了诱导brca-1和/或brca-2缺陷细胞的细胞周期的g2/m期中的停滞的方法,该方法包括将尼拉帕尼施用于有此需要的患者。
奥拉帕尼充当酶聚adp核糖聚合酶(parp)的抑制剂,并且称为parp抑制剂。化学名称为4-[(3-{[4-(环丙基羰基)哌嗪-1-基]羰基}-4-氟苯基)甲基]酞嗪-1(2h)-酮。奥拉帕尼的临床试验在乳腺癌、卵巢癌和结肠直肠癌中开始。在卵巢癌中可见初步活性,其中在17个具有brca1或brca2突变的患者中有7个应答,并且在46个不具有这些突变的患者中有11个应答。然而,察看使用奥拉帕尼维持无进展生存期或使用基于铂的化学疗法成功后的响应的ii期研究的中期分析指示,报告的无进展生存期益处不太可能转变成预期治疗群体的总生存期益处。然而,对具有brca突变的患者子集的计划分析发现了使用奥拉帕尼的明确优点(ledermann等人,newenglandjournalofmedicine,366;15(2012);lancetoncol.15(8):852–61)。奥拉帕尼被批准作为在种系brca突变(gbrcamut)晚期卵巢癌中的单一疗法,推荐剂量为每天两次服用400mg,所述晚期卵巢癌已接受三次或更多次的先前化学疗法线。brca1/2突变可能在遗传上倾向于发展某些形式的癌症,并且可能对其它形式的癌症治疗是抗性的。然而,这些癌症有时具有独特的易损性,因为癌细胞越来越多地依赖于parp来修复其dna,并且致使它们能够继续分裂。这意味着如果癌症对这种治疗敏感,则选择性抑制parp的药物可能是有益的。因此,奥拉帕尼临床数据证实parp抑制剂不利于延长癌症治疗中的无进展生存期,所述癌症的特征在于brca1或brca2中突变的不存在。
类似地,芦卡帕尼充当酶聚adp核糖聚合酶(parp)的抑制剂,并且也称为parp抑制剂。化学名称为8-氟-2-{4-[(甲氨基)甲基]苯基}-1,3,4,5-四氢-6h-氮杂卓并[5,4,3-cd]吲哚-6-酮((1s,4r)-7,7-二甲基-2-氧代双环[2.2.1]庚-1-基)甲磺酸盐。对于已用两种或更多种化学疗法治疗的具有有害brca突变(种系和/或体细胞)相关的晚期卵巢癌患者的治疗,它也被批准作为单一疗法。在两项多中心、单臂、标签公开的临床试验,研究1和研究2中,在患有晚期brca突变型卵巢癌的患者中,研究了芦卡帕尼在106个患者中的疗效,所述患者在2次或更多次先前化学疗法后已进展。所有106个患者每天两次经口接受芦卡帕尼600mg作为单一疗法,直至疾病进展或无法接受的毒性。通过独立放射学检查的响应评价为42%(95%ci[32,52]),其中中值dor为6.7个月(95%ci[5.5,11.1])。研究者评价的orr在铂敏感性患者中为66%(52/79;95%ci[54,76]),在铂抗性患者中为25%(5/20;95%ci[9,49]),并且在铂难治性患者中为0%(0/7;95%ci[0,41])。orr对于具有brca1基因突变或brca2基因突变的患者是相似的。因此,芦卡帕尼临床数据证实parp抑制剂不利于延长癌症治疗中的无进展生存期,所述癌症的特征在于brca1或brca2中突变的不存在。
类似地,他拉唑帕尼充当酶聚adp核糖聚合酶(parp)的抑制剂,并且也称为parp抑制剂。它目前正在临床研究中评估用于治疗患有gbrca突变乳腺癌的患者(即,其brca基因含有种系突变的患者中的晚期乳腺癌)。该研究的主要目的是比较用他拉唑帕尼作为单一疗法治疗的患者相对于用方案指定医生的选择治疗的患者的pfs。
类似地,维利帕尼充当酶聚adp核糖聚合酶(parp)的抑制剂,并且也称为parp抑制剂。维利帕尼的化学名称是2-[(r)-2-甲基吡咯烷-2-基]-1h-苯并咪唑-4-甲酰胺。
在卵巢癌的诊断时,大多数女性呈现有晚期疾病,这解释了高死亡率的原因。如果疾病是潜在可切除的,患有2、3或4期疾病的患者将经历肿瘤减灭术,并且可以经历4-8个周期的后续化学疗法。初始化学疗法可以由iv化学疗法或iv和腹膜内(ip)化学疗法的组合组成。iv化学疗法通常由紫杉烷(紫杉醇或多西他赛)和铂(顺铂或卡铂)组成。大约75%的患者响应一线治疗并且视为铂敏感性的,标准定义为治疗后6个月的最短持续时间无复发或疾病进展。然而,高达70%的患者最终在1至3年内复发。尝试通过添加第三种细胞毒性药物来改善标准基于铂的双药化学疗法未能影响无进展生存期或总生存期,并且导致毒性效应中的增加(dubois等人,2006和pfisterer,2006等人)。即使在最初的高响应率之后,由于高复发率也存在很高的未满足需求。
癌症基因组图谱(tcga)研究人员测试了临床注释的hgs-ovca样品,以鉴定影响病理生理学、影响后果并构成治疗靶的分子因素(tcga,2011)。卵巢肿瘤的特征在于dna修复中的缺陷,例如brca突变。brca1和2已被鉴定为肿瘤抑制基因,其与当缺陷时某些恶性肿瘤包括卵巢癌的发生率增加相关。brca在dna修复包括同源重组中起关键作用。具有brca缺陷/同源重组缺陷(hrd)的肿瘤细胞对dna损伤特别敏感。尼拉帕尼抑制由于dna损伤而刺激的parp活性,并且证实对于癌细胞系的选择性抗增殖活性,与其野生型对应物相比,所述癌细胞系已对于brca1或brca2沉默,或者携带brca-1或brca-2突变。尼拉帕尼对brca缺陷细胞的抗增殖活性是g2/m中的细胞周期停滞随后为细胞凋亡的后果。parp抑制剂阻断alt-nhej和ber,迫使具有brca缺陷的肿瘤使用易错nhej来修复双链断裂。同源重组dna修复基因中的非brca缺陷也可以增强肿瘤细胞对parp抑制剂的敏感性。parp抑制剂包括尼拉帕尼可用于治疗具有肿瘤的个体,所述肿瘤具有dna修复途径中的突变,包括发展卵巢癌的具有种系brca突变(gbrcamut)的那些。
在解决高复发率的尝试中,抗parp疗法可以在患有复发性和/或铂敏感性卵巢癌(包括输卵管癌和腹膜癌)的患者中作为维持治疗施用,作为延长与第一线铂化学疗法相关的最初高响应率的方法,其中所述施用延长无进展生存期和/或延长总生存期。此类无进展生存期的延长可以导致降低的疾病进展或死亡的风险比。延长的无进展生存期具有以几种方式提供临床益处的潜力,包括延迟疾病症状、延迟化学疗法的毒性负担和延迟生活质量恶化。在另一个实施例中,患有铂敏感性卵巢癌的患者特征还在于具有brca缺陷和/或hrd(例如,阳性hrd状态)。在另一个实施例中,患有复发性和/或铂敏感性卵巢癌的患者的特征还在于不存在有害或怀疑有害的种系brca突变。在另一个实施例中,患有复发性和/或铂敏感性卵巢癌的患者的特征还在于种系或散发性brca突变的不存在。
本发明部分基于以下发现:parp抑制剂可以用于治疗以野生型或突变型brca1和/或brca2(“brca基因”)为特征的癌症,例如,在brca基因中不存在或存在突变的情况下。相应地,本发明的方面涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,而不依赖于brca状态或者不依赖于患者或癌症的dna修复状态。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,其中在确定患者或癌症的brca状态或hrd状态之前开始治疗。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,其中在不确定患者或癌症的brca状态或dna修复状态的情况下开始治疗。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,所述患者的特征在于brca1和/或brca2中突变的不存在。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,所述患者的特征在于涉及dna修复的基因中突变的不存在。在其它方面,本发明涉及用于治疗癌症患者的方法,其涉及向患者施用抗parp疗法,所述患者的特征在于涉及同源重组的基因中突变的不存在。在一些方面,本发明涉及用于治疗癌症患者的方法,其涉及向患有癌症的患者施用抗parp疗法,所述癌症的特征在于brca1或brca2中突变的不存在。在一些方面,本发明涉及用于治疗癌症患者的方法,其涉及向患有癌症的患者施用抗parp疗法,所述癌症的特征在于涉及同源重组的基因中突变的不存在。
在实施例中,抗parp疗法以等价于约100mg、约200mg或约300mg尼拉帕尼或其盐或衍生物的剂量施用。在某些实施例中,抗parp疗法以等价于约100mg尼拉帕尼或其盐或衍生物的剂量施用。在某些实施例中,抗parp疗法以等价于约200mg尼拉帕尼或其盐或衍生物的剂量施用。在某些实施例中,抗parp疗法以等价于约300mg尼拉帕尼或其盐或衍生物的剂量施用。
在一些实施例中,抗parp疗法在确定为实现以下的方案中施用:i)与对照相比,延长的无进展生存期,ii)与对照相比,降低的疾病进展或死亡的风险比,iii)与对照相比,延长的总生存期,或iv)至少30%的总体响应率。
在实施例中,抗parp疗法包括施用抑制parp-1和/或parp-2的试剂。在一些实施例中,该试剂是小分子、核酸、多肽(例如抗体)、碳水化合物、脂质、金属或毒素。在相关实施例中,该试剂是abt-767、azd2461、bgb-290、bgp15、cep9722、e7016、e7449、氟唑帕尼、ino1001、jpi289、mp124、尼拉帕尼、奥拉帕尼、ono2231、芦卡帕尼、sc101914、他拉唑帕尼、维利帕尼、ww46、或其盐或衍生物。在一些相关的实施例中,该试剂是尼拉帕尼、奥拉帕尼、芦卡帕尼、他拉唑帕尼、维利帕尼、或其盐或衍生物。在某些实施例中,该试剂是尼拉帕尼或其盐或衍生物。在某些实施例中,该试剂是奥拉帕尼或其盐或衍生物。在某些实施例中,该试剂是芦卡帕尼或其盐或衍生物。在某些实施例中,该试剂是他拉唑帕尼或其盐或衍生物。在某些实施例中,该试剂是维利帕尼或其盐或衍生物。
在一些实施例中,与对照相比,该方法延长了无进展生存期。在一些实施例中,与对照相比,该方法降低了疾病进展或死亡的风险比。在一些实施例中,与对照相比,该方法延长了总生存期。在一些实施例中,该方法实现了至少30%的总体响应率。在一些实施例中,与对照相比,该方法实现了改善的无进展生存期2。在一些实施例中,与对照相比,该方法实现了改善的无化学疗法间隔。在一些实施例中,与对照相比,该方法实现了改善的第一后续治疗时间。在一些实施例中,与对照相比,该方法实现了改善的第二后续治疗时间。在一些实施例中,如通过fosi和/或eq-5d-5l确定的,该方法已确定为对生活质量没有不利影响。在一些实施例中,该方法已确定为不影响用化学治疗剂(例如铂试剂,包括但不限于顺铂、卡铂、奥沙利铂、奈达铂、四硝酸三铂、菲铂、吡铂、或沙铂的后续治疗的有效性。
在一些实施例中,此类癌症选自妇科癌症(即,女性生殖系统的癌症)。在一些实施例中,女性生殖系统的癌症包括但不限于卵巢癌、输卵管癌、腹膜癌和乳腺癌。在一些实施例中,妇科癌症与同源重组修复缺陷/同源修复缺陷(“hrd”)和/或brca1/2突变相关。在一些实施例中,妇科癌症是铂敏感的。在一些实施例中,妇科癌症响应基于铂的疗法。在一些实施例中,妇科癌症已发展对基于铂的疗法的抗性。在一些实施例中,妇科癌症一度已显示对基于铂的疗法的部分或完全响应。在一些实施例中,妇科癌症现在对基于铂的疗法是抗性的。
在某些实施例中,癌症是卵巢癌、输卵管癌或腹膜癌。在某些实施例中,癌症是乳腺癌。
在一些实施例中,癌症是复发性癌症。
在一个实施例中,尼拉帕尼在患有复发性卵巢癌(包括输卵管癌和腹膜癌)的患者中作为维持治疗施用,其中所述尼拉帕尼的施用导致无进展生存期的延长。在一个实施例中,尼拉帕尼作为单一疗法施用,用于患有复发性卵巢癌、输卵管癌或原发性腹膜癌的患者的维持治疗,其中所述患者响应基于铂的化学疗法。在一个实施例中,尼拉帕尼作为单一疗法施用,用于患有有害或疑似有害的种系或体细胞brca突变或同源重组缺陷的复发性卵巢癌、输卵管癌或原发性腹膜癌的患者的维持治疗,其中所述患者响应基于铂的化学疗法。
此类无进展生存期的延长可以导致降低的疾病进展或死亡的风险比。在初始治疗中止之间的间隔期间施用维持治疗,目的是延迟疾病进展和可能给患者带来耐受性问题的后续强化治疗。在另一个实施例中,患有复发性卵巢癌的患者的特征还在于具有brca缺陷或hrd。在另一个实施例中,患有复发性卵巢癌的患者的特征还在于有害或怀疑有害的种系brca突变的不存在。
在一个实施例中,尼拉帕尼在患有复发性卵巢癌(包括输卵管癌和腹膜癌)的患者中作为维持治疗施用,所述患者在多重基于铂的化学疗法治疗后具有完全响应或部分响应,其中所述尼拉帕尼的施用导致无进展生存期的延长。此类无进展生存期的延长可以导致降低的疾病进展或死亡的风险比。在化学治疗中止之间的间隔期间施用维持治疗,目的是延迟疾病进展和可能给患者带来耐受性问题的后续强化治疗。在另一个实施例中,患有复发性卵巢癌的患者的特征还在于具有brca缺陷或hrd。在另一个实施例中,患有复发性卵巢癌的患者的特征还在于有害或怀疑有害的种系brc突变的不存在。
在另一个实施例中,解决卵巢癌的高复发率的第二种方法是选择患有晚期卵巢癌的患者,所述患者将最获益于在第一线治疗或维持环境中的特异性靶向试剂。相应地,尼拉帕尼作为患有晚期卵巢癌的患者中的治疗施用,其中所述施用导致总生存期中的增加,并且其中施用作为治疗(在1-4次先前治疗线之后继续疾病的情况下)或维持治疗(在对先前治疗具有pr或cr的患者的情况下)。在另一个实施例中,患有晚期卵巢癌的患者的特征还在于具有brca缺陷或hrd。在另一个实施例中,患有复发性卵巢癌的患者的特征还在于有害或怀疑有害的种系brc突变的不存在。
在一些实施例中,本发明提供了向患有复发性或铂敏感性卵巢癌、输卵管癌或原发性腹膜癌的患者施用尼拉帕尼的方法,其包括根据确定为实现延长的无进展生存期的方案施用尼拉帕尼。在一些实施例中,例如与未接受尼拉帕尼的患者相比,无进展生存期在接受尼拉帕尼的患者中更大。在一些实施例中,无进展生存期在接受尼拉帕尼的患者中大于接受替代癌症疗法例如用不同parp抑制剂的疗法的患者。
在一些实施例中,延长的无进展生存期为至少9个月。在一些实施例中,无进展生存期为至少12个月。在一些实施例中,无进展生存期为至少15个月。在一些实施例中,无进展生存期为至少18个月。在一些实施例中,无进展生存期为至少21个月。在一些实施例中,无进展生存期为至少24个月。在一些实施例中,无进展生存期为至少27个月。在一些实施例中,无进展生存期为至少30个月。在一些实施例中,无进展生存期为至少33个月。在一些实施例中,无进展生存期为至少36个月。
在一些实施例中,患者具有在brca1和/或brca2中的种系突变(gbrcamut)。在一些实施例中,延长的无进展生存期为至少9个月。在一些实施例中,延长的无进展生存期为至少12个月。在一些实施例中,延长的无进展生存期为至少15个月。在一些实施例中,延长的无进展生存期为至少18个月。在一些实施例中,延长的无进展生存期为至少21个月。在一些实施例中,延长的无进展生存期为至少24个月。在一些实施例中,延长的无进展生存期为至少27个月。在一些实施例中,延长的无进展生存期为至少30个月。在一些实施例中,延长的无进展生存期为至少33个月。在一些实施例中,延长的无进展生存期为至少36个月。
在一些实施例中,患者的特征在于brca1和/或brca2中的种系突变的不存在(非gbrcamut)。在一些实施例中,患者患有具有阳性同源重组缺陷状态的肿瘤。在一些实施例中,患者具有阴性重组缺陷状态。在一些实施例中,延长的无进展生存期为至少9个月。在一些实施例中,延长的无进展生存期为至少12个月。在一些实施例中,延长的无进展生存期为至少15个月。在一些实施例中,延长的无进展生存期为至少18个月。在一些实施例中,延长的无进展生存期为至少21个月。在一些实施例中,延长的无进展生存期为至少24个月。在一些实施例中,延长的无进展生存期为至少27个月。在一些实施例中,延长的无进展生存期为至少30个月。在一些实施例中,延长的无进展生存期为至少33个月。在一些实施例中,延长的无进展生存期为至少36个月。
在一些实施例中,患者的特征在于brca1和/或brca2中突变的不存在(brcawt)。在一些实施例中,患者患有具有阳性同源重组缺陷状态的肿瘤。在一些实施例中,患者具有阴性同源重组缺陷状态。在一些实施例中,延长的无进展生存期为至少9个月。在一些实施例中,延长的无进展生存期为至少12个月。在一些实施例中,延长的无进展生存期为至少15个月。在一些实施例中,延长的无进展生存期为至少18个月。在一些实施例中,延长的无进展生存期为至少21个月。在一些实施例中,延长的无进展生存期为至少24个月。在一些实施例中,延长的无进展生存期为至少27个月。在一些实施例中,延长的无进展生存期为至少30个月。在一些实施例中,延长的无进展生存期为至少33个月。在一些实施例中,延长的无进展生存期为至少36个月。
在一些实施例中,本发明提供了向患有复发性或铂敏感性卵巢癌、输卵管癌或原发性腹膜癌的患者施用尼拉帕尼的方法,其包括根据确定为实现疾病进展或死亡的风险比的方案施用尼拉帕尼。一些实施例中,例如与未接受尼拉帕尼的患者相比,风险比在接受尼拉帕尼的患者中得到改善。在一些实施例中,与接受替代癌症疗法例如用不同parp抑制剂的疗法的患者相比,风险比在接受尼拉帕尼的患者中得到改善。
在一些实施例中,疾病进展的风险比为约0.3。在一些实施例中,疾病进展的风险比为约0.4。在一些实施例中,疾病进展的风险比为约0.45。在一些实施例中,疾病进展的风险比为约0.5。在一些实施例中,疾病进展的风险比小于约0.5。在一些实施例中,疾病进展的风险比小于约0.45。在一些实施例中,疾病进展的风险比小于约0.4。在一些实施例中,疾病进展的风险比小于约0.35。在一些实施例中,疾病进展的风险比小于约0.3。
在一些实施例中,患者具有在brca1和/或brca2中的种系突变(gbrcamut)。在一些实施例中,疾病进展的风险比为约0.3。在一些实施例中,疾病进展的风险比为约0.4。在一些实施例中,疾病进展的风险比为约0.45。在一些实施例中,疾病进展的风险比为约0.5。在一些实施例中,疾病进展的风险比小于约0.5。在一些实施例中,疾病进展的风险比小于约0.45。在一些实施例中,疾病进展的风险比小于约0.4。在一些实施例中,疾病进展的风险比小于约0.35。在一些实施例中,疾病进展的风险比小于约0.3。
在一些实施例中,患者的特征在于brca1和/或brca2中的种系突变的不存在(非gbrcamut)。在一些实施例中,患者患有具有阳性同源重组缺陷状态的肿瘤。在一些实施例中,患者具有阴性重组缺陷状态。在一些实施例中,疾病进展的风险比为约0.3。在一些实施例中,疾病进展的风险比为约0.4。在一些实施例中,疾病进展的风险比为约0.45。在一些实施例中,疾病进展的风险比为约0.5。在一些实施例中,疾病进展的风险比小于约0.5。在一些实施例中,疾病进展的风险比小于约0.45。在一些实施例中,疾病进展的风险比小于约0.4。在一些实施例中,疾病进展的风险比小于约0.35。在一些实施例中,疾病进展的风险比小于约0.3。
在一些实施例中,本发明提供了向患有复发性和/或铂敏感性卵巢癌、输卵管癌或原发性腹膜癌的患者施用尼拉帕尼的方法,其包括根据确定为实现延长的总生存期的方案施用尼拉帕尼。在一些实施例中,例如与未接受尼拉帕尼的患者相比,延长的总生存期在接受尼拉帕尼的患者中更大。在一些实施例中,延长的总生存期在接受尼拉帕尼的患者中大于接受替代癌症疗法例如用不同parp抑制剂的疗法的患者。
在一些实施例中,患者具有至少(i)在brca1或brca2中的种系突变,或者(ii)在brca1或brca2中的散发突变。
在一些实施例中,患者患有高级别浆液性卵巢癌或高级别占优势地浆液性组织学卵巢癌。
在一些实施例中,患者的特征还在于brca1或brca2中的种系突变的不存在。
在一些实施例中,患者的特征还在于brca1或brca2中的散发突变的不存在。
在一些实施例中,患者的特征还在于阴性brca1/2状态。在一些实施例中,在来自患者的样品中未检测到brca1或brca2中的种系突变。
在一些实施例中,用于确定无进展生存期的目的的进展通过以下确定:1)通过ct/mri的肿瘤评价,显示根据recist1.1标准的明确进行性疾病;和/或2)鉴定新病变的另外诊断测试(例如组织学/细胞学、超声技术、内窥镜检查、正电子发射断层扫描)。
在一些实施例中,患者的特征在于具有同源重组缺陷。在一些实施例中,患者具有阳性同源重组缺陷状态。可以根据本领域技术人员已知的方法确定同源重组缺陷状态。例如,在一些实施例中,通过在患者样品中确定指示剂ca区域的数目来确定重组缺陷状态。在一些实施例中,指示剂ca区域的数目包括选自癌细胞的至少两对人染色体中的指示剂loh区域、指示剂tai区域或指示剂lst区域的至少两种类型。在一些实施例中,ca区域(无论是loh区域、tai区域还是lst区域)是指示剂ca区域(无论是指示剂loh区域、指示剂tai区域还是指示剂lst区域),如果它为长度至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、60、70、80、90或100兆碱基或更多。在一些实施例中,指示剂loh区域是这样的loh区域,其长于约1.5、5、12、13、14、15、16、17或更多(优选14、15、16或更多,更优选15或更多)兆碱基,但短于loh区域位于其内的相应染色体的整个长度。可替代地或另外地,可以确定此类指示剂loh区域的总组合长度。在一些实施例中,指示剂tai区域是具有等位基因失衡的tai区域,其(a)延伸至一个亚端粒,(b)不穿过着丝粒,并且(c)长于1.5、5、12、13、14、15、16、17或更多(优选10、11、12或更多,更优选11或更多)兆碱基。可替代地或另外地,可以确定此类指示剂tai区域的总组合长度。因为lst的概念已经涉及具有一些最小尺寸的区域(此类最小尺寸基于其区分hrd与hdr完整样品的能力来确定),所以如本文使用的,指示剂lst区域与lst区域相同。此外,lst区域得分可以从如上所述显示lst的区域的数目或lst断点的数目推导。在一些实施例中,界定lst断点的稳定拷贝数的区域的最小长度为至少3、4、5、6、7、8、9、10、1112、13、14、15、16、17、18、19或20兆碱基(优选8、9、10、11或更多兆碱基,更优选10兆碱基),并且剩余未过滤的最大区域小于0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、2.5、3、3.5、4或更少兆碱基(优选2、2.5、3、3.5或4或更少兆碱基,更优选少于3兆碱基)。如本文使用的,当来自所述患者的样品具有超过参考或阈值那种的多个指示剂ca区域或ca区域得分(如本文定义的)时,患者确定为具有阳性hrd状态。
在一些实施例中,本发明提供了施用尼拉帕尼的方法,该方法包括以下步骤:
将尼拉帕尼施用于具有下述特点中的一个或多个的受试者群体:
brca突变;
阳性同源重组缺陷状态;或
显示出对先前疗法的响应;
根据确定为实现延长的无进展生存期的方案。
在一些实施例中,受试者群体具有brca突变。在一些实施例中,brca突变是种系brca突变(gbrcamut)。在一些实施例中,brca突变是体细胞(或散发性)brca突变(sbrcamut)。在一些实施例中,受试者群体具有阳性同源重组缺陷状态。在一些实施例中,受试者群体显示出未突变的brca1/2“brcawt”或“brcawt”。
测量肿瘤响应
肿瘤响应可以通过例如recistv1.1指南来测量。该指南由e.a.eisenhauer等人,“newresponseevaluationcriteriainsolidtumors:revisedrecistguideline(version1.1.),”eur.j.ofcancer,45:228-247(2009)提供,所述参考文献整体以引用的方式并入。该指南首先要求估计在基线时的总体肿瘤负荷,其用作后续测量的比较物。可以经由使用本领域已知的任何成像系统,例如通过ct扫描或x射线来测量肿瘤。可测量的疾病由至少一种可测量的病变的存在来定义。在其中主要终点是肿瘤进展(进展的时间或在固定日期时的进展比例)的研究中,方案必须指定进入是否限于患有可测量疾病的患者,或者仅患有无法测量疾病的患者是否也是合格的。
当在基线时存在多于一个可测量的病变时,代表所有受累器官的最多总共五个病变(以及最多两个病变/器官)的所有病变应该被鉴定为靶病变,并且将在基线时被记录并且测量(这意味着在其中患者仅具有一个或两个器官部位受累的情况下,将分别记录最多两个和四个病变)。
靶病变应该基于其大小(具有最长直径的病变)选择,代表所有受累的器官,但另外应该是能够进行再现性重复测量的那些。
淋巴结值得特别提及,因为它们是正常的解剖结构,即使不被肿瘤涉及,其也可通过成像看到。定义为可测量且可以被鉴定为靶病变的病理性结节必须满足通过ct扫描p15mm的短轴标准。只有这些结节的短轴才促成基线总和。结节的短轴是通常由放射科医师用于判断结节是否被实体瘤涉及的直径。结节尺寸通常报告为在其中获得图像的平面(对于ct扫描,这几乎总是轴向平面;对于mri,采集平面可以是轴向、矢状或冠状)中的两个维度。这些测量中较小的是短轴。
例如,报告为20mm·30mm的腹部结节具有20mm的短轴,并且作为恶性、可测量的结节合格。在该例子中,20mm应该记录为结节测量。所有其它病理性结节(具有短轴p10mm但<15mm的那些)应该视为非靶病变。短轴<10mm的结节视为非病理性的,并且不应该被记录或跟踪。
计算所有靶病变的直径总和(非结节病变最长,结节病变的短轴),并且报告为基线直径总和。如果总和中要包括淋巴结,则如上所述,仅将短轴加入总和内。基线直径总和将用作参考,以进一步表征疾病的可测量维度中的任何客观肿瘤消退。
所有其它病变(或疾病部位)包括病理性淋巴结应该被鉴定为非靶病变,并且还应该在基线时进行记录。不需要进行测量,并且这些病变应该作为“存在”、“不存在”、或者在极少数情况下“明确的进展”进行跟踪。另外,有可能记录多个非靶病变,涉及与病例记录形式上的单个项目相同的器官(例如‘多个扩大的盆腔淋巴结’或‘多重肝转移灶’)。
一般方案
如本文所述,提供的方法包括根据实现以下任何一种或组合的方案,将尼拉帕尼施用于患者、受试者或受试者群体:延长的无进展生存期中的;降低的疾病进展或死亡风险比;和/或延长的总生存期或阳性总体响应率。在一些实施例中,尼拉帕尼与另外的治疗剂同时或序贯施用,所述另外的治疗剂例如化学治疗剂(例如,基于铂的试剂)。在一些实施例中,在化学治疗剂施用之前、化学治疗剂施用期间、或化学治疗剂施用之后施用尼拉帕尼。
尼拉帕尼与另外的治疗剂(例如,化学治疗剂)的同时或序贯施用被称为“组合疗法”。在组合疗法中,可以在化学治疗剂施用于有此需要的受试者之前(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周前)、同时或之后(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周或12周后)施用尼拉帕尼。在一些实施例中,尼拉帕尼和化学治疗剂相隔1分钟、相隔10分钟、相隔30分钟、相隔小于1小时、相隔1小时至2小时、相隔2小时至3小时、相隔3小时至4小时、相隔4小时至5小时、相隔5小时至6小时、相隔6小时至7小时、相隔7小时至8小时、相隔8小时至9小时、相隔9小时至10小时、相隔10小时至11小时、相隔11小时至12小时、相隔不超过24小时、或相隔不超过48小时施用。
在一些实施例中,尼拉帕尼施用于已显示出对先前疗法的响应的患者或受试者群体。在一些实施例中,患者或受试者群体已显示出对用化学治疗剂的先前疗法的响应。在一些此类实施例中,化学治疗剂是铂试剂。
在一些实施例中,在对至少一种基于铂的疗法的完全或部分响应后,尼拉帕尼作为维持疗法施用。在一些实施例中,至少一种基于铂的疗法包括向有此需要的患者施用选自顺铂、卡铂、奥沙利铂、奈达铂、四硝酸三铂、菲铂、吡铂或沙铂的基于铂的试剂。在一些实施例中,对最近的基于铂的化学疗法方案的响应是完全响应。在一些实施例中,对最近的基于铂的化学疗法方案的响应是部分响应。
在一些实施例中,该方案包括尼拉帕尼的至少一个经口剂量。在一些实施例中,该方案包括多个经口剂量。在一些实施例中,该方案包括每天一次(qd)给药。
在一些实施例中,该方案包括至少一个28天周期。在一些实施例中,该方案包括多个28天周期。在一些实施例中,该方案包括一个28天周期。在一些实施例中,该方案包括两个28天周期。在一些实施例中,该方案包括三个28天周期。在一些实施例中,该方案包括连续的28天周期。在一些实施例中,该方案包括每天施用有效剂量的尼拉帕尼,直至疾病进展或发生无法接受的毒性。在一些实施例中,该方案包括每天给药的至少100、200或300mg尼拉帕尼的日剂量,直至疾病进展或发生无法接受的毒性。
在一些实施例中,经口剂量是在约5至约400mg范围内的尼拉帕尼的量。在一些实施例中,尼拉帕尼的量为约5、约10、约25、约50、约100、约150、约200、约250、约300、约350或约400mg。在一些实施例中,尼拉帕尼的量为约300mg尼拉帕尼。在一些实施例中,该方案包括每天一次300mg尼拉帕尼的施用。
在一些实施例中,经口剂量以一个或多个单位剂型施用。在一些实施例中,一个或多个单位剂型是胶囊。在一些实施例中,每个单位剂型包含约5、约10、约25、约50或约100mg尼拉帕尼。应理解,单位剂型的任何组合可以组合以形成每天一次(qd)剂量。例如,可以每天一次服用三个100mg单位剂型,使得每天一次施用300mg或尼拉帕尼。在一些实施例中,尼拉帕尼以单一300mg单位剂型施用。在一些实施例中,尼拉帕尼施用300mgqd。在一些实施例中,尼拉帕尼作为3x100mgqd施用(即,尼拉帕尼以100mg的三个单位剂型施用)。在一些实施例中,尼拉帕尼作为2x150mgqd施用(即,尼拉帕尼以150mg的两个单位剂型施用)
药代动力学
药代动力学数据可以通过本领域的已知技术获得。由于人受试者中药物代谢的药代动力学和药效学参数中的固有变化,描述特定组合物的适当药代动力学和药效学概况组分可以变化。通常,药代动力学和药效学概况基于确定一组受试者的平均参数。该组受试者包括适合于确定代表性平均值的任何合理数目的受试者,例如,5个受试者、10个受试者、16个受试者、20个受试者、25个受试者、30个受试者、35个受试者或更多。通过计算对于测量的每个参数的所有受试者测量值的均值来确定平均值。
在一些实施例中,药代动力学参数可以是适合于描述本组合物的任何参数。例如,在一些实施例中,cmax不小于约500ng/ml;不小于约550ng/ml;不小于约600ng/ml;不小于约700ng/ml;不小于约800ng/ml;不小于约880ng/ml,不小于约900ng/ml;不小于约100ng/ml;不小于约1250ng/ml;不小于约1500ng/ml,不小于约1700ng/ml,或适合于描述尼拉帕尼的药代动力学概况的任何其它cmax。
在其中在向受试者施用药物后体内形成活性代谢产物的一些实施例中,cmax不小于约500pg/ml;不小于约550pg/ml;不小于约600pg/ml;不小于约700pg/ml;不小于约800pg/ml;不小于约880pg/ml,不小于约900pg/ml;不小于约1000pg/ml;不小于约1250pg/ml;不小于约1500pg/ml,不小于约1700pg/ml,或适合于描述在向受试者施用尼拉帕尼后在体内形成的化合物的药代动力学概况的任何其它cmax。
在一些实施例中,tmax例如不大于约0.5小时、不大于约1.0小时、不大于约1.5小时、不大于约2.0小时、不大于约2.5小时、或不大于约3.0小时、或适合于描述尼拉帕尼的药代动力学概况的任何其它tmax。
一般而言,如本文所述的auc是曲线下面积的量度,其对应于在施用治疗剂的剂量后的选择时间段内的分析物浓度。在一些实施例中,此类时间段在剂量施用时(即,剂量施用后0小时)开始,并且在剂量施用后延伸约2、约3、约4、约5、约6、约7、约8、约9、约10、约11、约12、约14、约16、约18、约20、约22、约24、约30、约40或更多小时。在一些实施例中,auc是在施用本文所述的剂量后0小时至12小时实现的auc。在一些实施例中,auc是在施用本文所述的剂量后0小时至18小时实现的auc。在一些实施例中,auc是在施用本文所述的剂量后0小时至24小时实现的auc。在一些实施例中,auc是在施用本文所述的剂量后0小时至36小时实现的auc。
auc(0-inf)可以是例如不小于约590ng·hr/ml、不小于约1500ng·hr/ml、不小于约2000ng·hr/ml、不小于约3000ng.×.hr/ml、不小于约3500ng·hr/ml、不小于约4000ng·hr/ml、不小于约5000ng·hr/ml、不小于约6000ng·hr/ml、不小于约7000ng·hr/ml、不小于约8000ng·hr/ml、不小于约9000ng·hr/ml、或适合于描述治疗剂(例如,尼拉帕尼)的药代动力学概况的任何其它aucco-int)。在其中在向受试者施用治疗剂(例如,尼拉帕尼)后在体内形成活性代谢产物的一些实施例中;auc(0-inf)可以是例如不小于约590pg·hr/ml、不小于约1500pg·hr/ml、不小于约2000pg·hr/ml、不小于约3000pg·hr/ml、不小于约3500pg·hr/ml、不小于约4000pg·hr/ml、不小于约5000pg·hr/ml、不小于约6000pg·hr/ml、不小于约7000pg·hr/ml、不小于约8000pg·hr/ml、不小于约9000pg·hr/ml、或适合于描述在向受试者施用尼拉帕尼后在体内形成的化合物的药代动力学概况的任何其它auc(0-inf)。
在施用后约一小时的尼拉帕尼的血浆浓度可以是例如不小于约140ng/ml、不小于约425ng/ml、不小于约550ng/ml、不小于约640ng/ml、不小于约720ng/ml、不小于约750ng/ml、不小于约800ng/ml、不小于约900ng/ml、不小于约1000ng/ml、不小于约1200ng/ml、或尼拉帕尼的任何其它血浆浓度。
在一些实施例中,患者群体包括患有转移性疾病的一个或多个受试者(“受试者群体”)。
在一些实施例中,患者群体包括患有或易患癌症的一个或多个受试者。在一些此类实施例中,癌症是卵巢癌、输卵管癌、腹膜癌或乳腺癌。在一些实施例中,患者群体包括患有癌症的一个或多个受试者(例如,包括受试者或由受试者组成)。例如,在一些实施例中,患有癌症的患者群体可能先前已用化学疗法治疗,例如用化学治疗剂例如基于铂的试剂治疗。
在一些实施例中,本公开内容提供了当施用于处于进食状态或禁食状态的患者时,令人惊讶地可以实现基本上相同的尼拉帕尼的pk概况的方法。尼拉帕尼可以施用于处于进食状态或禁食状态的患者。具体地,已惊讶地发现,对于在进食状态或禁食状态下施用尼拉帕尼的患者,尼拉帕尼的生物利用度是基本上相似的。在一些实施例中,将尼拉帕尼施用于处于进食状态或禁食状态的患者产生基本上生物等价的尼拉帕尼血浆cmax值。在一些实施例中,对处于进食状态或禁食状态的患者的施用产生生物等价的尼拉帕尼血浆tmax值。在一些实施例中,对处于进食状态或禁食状态的患者的施用产生生物等价的尼拉帕尼血浆auc值。相应地,在一些实施例中,尼拉帕尼在进食状态或禁食状态下施用。在一些实施例中,尼拉帕尼在禁食状态下施用。在一些实施例中,尼拉帕尼在进食状态下施用。
在一些实施例中,尼拉帕尼的单位剂量可以在禁食状态下施用于患者。在一些实施例中,尼拉帕尼的单位剂量可以在进食状态下施用于患者。在一些实施例中,排除在进食状态或禁食状态之一中的施用。在一些实施例中,单位剂量可以在进食状态或禁食状态下施用用于治疗目的,其中受试者具有关于每个个别剂量是否与食物一起服用的选项。在一些实施例中,尼拉帕尼的单位剂量可以在食物摄入之前立即施用(例如,在之前30或60分钟内),与食物一起施用,在食物摄入之后立即施用(例如,在食物摄入后30、60或120分钟内)。在一些实施例中,它可以在食物摄入后例如至少2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时或更长时间、或两者之间的任何时间施用。在一些实施例中,在禁食过夜后施用尼拉帕尼的单位剂量。在一些实施例中,组合物的单位剂量可以在食物摄入前30分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时或更长时间、或两者之间的任何时间施用。
实例
提供下述实例以说明而不是限制本发明。
实例1.铂敏感性卵巢癌的治疗
在nova中,在基于铂的治疗后响应的铂敏感性复发性卵巢癌患者被前瞻性随机化,以接受尼拉帕尼或安慰剂。治疗了两个群组:种系brca突变型阳性群组(gbrcamut)和非种系brca群组(非gbrcamut)。因此,nova的gbrcamut群组被设计为前瞻性地测试尼拉帕尼相对于安慰剂在患有铂敏感性复发性卵巢癌的患者中的治疗效应,所述患者在基于铂的治疗后作出响应。该群组中的患者是种系brca突变携带者,如通过fda批准的integratedbracanalysis测试评价的。非gbrcamut的患者在fda批准的integratedbracanalysis测试中为阴性。
双盲、2:1随机化研究评估了尼拉帕尼作为患有复发性和/或铂敏感性卵巢癌的患者中的维持治疗,所述患者具有gbrcamut或具有高级浆液组织学的肿瘤。该研究比较了用尼拉帕尼与安慰剂的维持疗法,并且评估了尼拉帕尼在患有复发性卵巢癌的患者中作为维持治疗的疗效,如通过延长的无进展生存期(pfs)评价的。该目标在具有种系brca突变(gbrcamut)的患者群组中、以及在具有高级别浆液性或高级别占优势地浆液性组织学,但不含此类gbrca突变(非gbrcamut)的患者群组中独立地评估。非gbrcamut群组中的一些患者已报道与gbrcamut携带者共享独特的dna修复缺陷,被广泛描述为“brcaness”的现象。(参见turner,n.,a.tutt和a.ashworth,hallmarksof'brcaness'insporadiccancers.nat.rev.cancer4(10),814-9,(2004))。最近的研究已提示,上皮性卵巢癌(eoc)中的同源重组缺陷(hrd)不仅仅是由于种系brca1和brca2突变。(参见hennessy,b.t.等人.somaticmutationsinbrca1andbrca2couldexpandthenumberofpatientsthatbenefitfrompoly(adpribose)polymeraseinhibitorsinovariancancer.journalofclinicaloncology:officialjournaloftheamericansocietyofclinicaloncology28,3570-3576,(2010);tcga"integratedgenomicanalysesofovariancarcinoma."nature474(7353),609-615,(2011);以及dannrb,deloiaja,timmskm,zornkk,potterj,flakedd2nd,lanchburyjs,krivaktc.brca1/2mutationsandexpression:responsetoplatinumchemotherapyinpatientswithadvancedstageepithelialovariancancer.gynecoloncol.125(3),677-82,(2012))。同源重组dna修复基因中的非brca缺陷也可以增强肿瘤细胞对parp抑制剂的敏感性。相应地,hrd用作待评估的肿瘤生物标记物分类器。
入选该研究的患者已接受至少两种基于铂的方案,对其最后一种方案具有应答(完全或部分),并且在其最后一次治疗没有可测量的疾病>2cm和正常癌抗原ca125(或>90%降低)。患者根据下述标准被分配到两个独立群组之一–一个具有有害的gbrca突变(gbrcamut),且另一个具有高级别浆液组织学但不含此类gbrca突变(非gbrcamut):
还评价患者的hrd状态,并且进一步分类为hrd阳性(hrdpos)或hrd阴性(hrdneg)。
在第1天和其后的每个周期(28天),将研究治疗分配给患者,直到患者中断研究治疗。研究治疗连续地每天一次经口施用。在每次剂量施用时服用三个100mg强度的胶囊。临床就诊在每个周期(每4周±3天)中发生。在每2个周期结束时(8周,其中窗口从就诊日期开始±7天)直到第14周期,然后在每3个周期结束时(12周,其中窗口从就诊日期开始±7天)直至进展结束,需要经由腹部/骨盆以及临床指示区域的计算机断层扫描(ct)或磁共振成像(mri)扫描的实体瘤响应评估标准(recist)肿瘤评价。
通过无进展生存期(pfs)的延长来评价患者。更具体而言,如果满足下述标准中的至少一个,则确定进展:1)通过ct/mri的肿瘤评价明确地显示根据recist1.1标准的进行性疾病;2)另外的诊断测试(例如组织学/细胞学、超声技术、内窥镜检查、正电子发射断层扫描)鉴定新病变,或确定符合明确进行性疾病的现有病变和ca-125-根据妇科癌症协会(gynecologiccancerintergroup)(gcig)的进展-标准(参见rustin等人,intjgynecolcancer2011;21:419-423);3)与非恶性或医源性原因无关的pd的确定临床体征和症状([i]难治性癌症相关疼痛;[ii]恶性肠梗阻/恶化功能障碍;或[iii]腹水或胸腔积液的明确症状性恶化)和根据gcig标准的ca-125进展。实体瘤响应评估标准(recist)用于经由腹部/骨盆以及临床指示区域的计算机断层扫描(ct)或磁共振成像(mri)扫描的肿瘤评价,其在每2个周期结束时(8周)直到第14周期(56周),然后在每3个周期结束时(12周)直至进展结束时需要。
患者继续接受他们指定的治疗,直至疾病进展、无法接受的毒性、死亡、撤回同意书和/或失去随访。对于由患者视为无法耐受的任何等级毒性,在任何时候可获得剂量中断和/或减少。
结果
在不管hrd状态的种系brca突变(gbrcamut)携带者的患者中,在并非种系brca突变(非gbrcamut)携带者但具有同源重组缺陷(hrd)肿瘤的患者中,以及在总体并非gbrcamut的患者中,与对照相比,尼拉帕尼显著延长pfs。非gbrcamut群组中的总体群体还包括具有hrdneg的肿瘤的患者。分析证实hrdneg群体也受益于尼拉帕尼治疗。gbrca状态和hrd状态的确定可以包括通过标准化实验室测试进行的确定,所述测试例如myriad
对于所有群体,中值pfs对于接受尼拉帕尼的患者显著长于接受安慰剂的患者。非gbrcamut群组中的两个主要功效群体(hrd阳性和总体)证实与安慰剂相比,尼拉帕尼的显著治疗效应(分别为hr0.38相对于hr0.45;hr=风险比)。如通过kaplanmeyer曲线证明的,所有群体都显示出一致且持久的尼拉帕尼治疗效应(参见图1-4)。重要的是,在该群组内测试的所有探索性亚组中观察到尼拉帕尼治疗的这种相同的一致持久益处。在非gbrcamut群组中,hrd阳性组包括具有体细胞瘤brca突变的患者(hrdpos/sbrcamut)和对于brca野生型的患者hrdpos/brcawt)。重要的是,在hrdpos组内观察到的治疗益处不仅仅受hrdpos/sbrcamut亚组中的效应驱动。相对于hrdpos总体组,hrdpos/brcawt亚组也经历尼拉帕尼治疗的一致、持久的益处;其中风险比为0.38(图6)。
在其为种系brca突变携带者(gbrcamut)的患者中,对于pfs的主要终点,尼拉帕尼臂成功地实现了超过对照臂的统计学显著性,其中风险比为0.27。与对照的5.5个月相比,中值pfs对于用尼拉帕尼治疗的患者为21.0个月(p<0.0001)。图1描绘了用尼拉帕尼和安慰剂治疗的gbrcamut患者的pfs曲线。这些结果明显优于“研究19”(nengljmed.2012;366(15):1382-1392),所述研究19在研究设计中与nova相似,并且评价了parp抑制剂奥拉帕尼相对于安慰剂在类似患者群体中的活性。研究19报道,对于具有brca突变的患者,奥拉帕尼相对于对照臂中的11.2相对于4.3个月的中值pfs。对于并非种系brca突变携带者(非gbrcamut),但使用myriad
尼拉帕尼在总体非种系brca突变体群组(非gbrcamut)中也显示统计学显著性,所述群组包括具有hrd阳性和hrd阴性肿瘤两者的患者。对于pfs的主要终点,尼拉帕尼臂成功地实现了超过对照臂的统计学显著性,其中风险比为0.45。与对照的3.9个月相比,中值pfs对于用尼拉帕尼治疗的患者为9.3个月(p<0.0001)。图3描绘了用尼拉帕尼和安慰剂治疗的非gbrcamut患者(包括hrd阳性和hrd阴性患者两者)的pfs曲线。
在具有hrd阴性肿瘤的非种系brca突变型(非gbrcamut)患者中,尼拉帕尼也显示统计学显著性。对于pfs的主要终点,尼拉帕尼臂成功地实现了超过对照臂的统计学显著性,其中风险比为0.58。与对照的3.8个月相比,中值pfs对于用尼拉帕尼治疗的患者为6.9个月(p<0.0226)。具有hrd阴性肿瘤的非种系brca突变型(非gbrcamut)患者的pfs显示于图4中。
在察看组合的研究群体(组合gbrcamut和非gbrcamut的2个群组)的探索性合并分析中,使用尼拉帕尼的pfs比使用安慰剂更长。与安慰剂治疗患者的4.7个月相比,用尼拉帕尼治疗的所有患者的中值pfs为11.3个月,hr0.38,95%ci,0.303,0.488,p<0.0001)(图5)。另外,如在来自gbrcamut和非gbrcamut群组、在非gbrcamut群组内的亚组和组合的群组分析的kaplanmeier(km)曲线中观察到的,治疗效应是大量、持久且一致的。
下表1到3中提供了不同患者群组的无进展生存期的概述。“nr”意指“未达到”。“95%ci”意指95%置信区间。执行非gbrcamut群组中的生物标记物相关亚组的探索性分析;分析的亚组是hrdpos/体细胞brcamut、hrdpos/brcawt和hrdneg。
表1:无进展生存期(主要)
表2:无进展生存期,非gbrca
表3:在nova患者群体中尼拉帕尼相对于安慰剂的治疗效应
ci=置信区间;pfs=无进展生存期;nr=未达到;sbrcamut=体细胞brca突变;brcawt=brca野生型;hrd=同源重组缺陷
(1)无进展生存期定义为从随机化日期到进展或死亡以月计的时间。
(2)尼拉帕尼:安慰剂,基于使用随机化分层因子的分层cox比例风险模型。
(3)基于使用随机化分层因子的分层时序检验。
:(4)来自产物限制方法的估计值。使用对数-对数转化构建的置信区间。
在用尼拉帕尼治疗的所有患者中最常见(>10%)的治疗出现的3/4级不良事件是血小板减少症(28.3%)、贫血(24.8%)和嗜中性粒细胞减少症(11.2%)。在所有患者中经由剂量修改来管理不良事件。在itt群体中,尼拉帕尼(1.3%)和对照(1.2%)臂中的mds/aml比率是相似的。在研究治疗期间,在患者中不存在死亡。
在该研究中,非gbrcamut群组(hrdpos和总体)中的两个主要功效群体均证实了与安慰剂相比的尼拉帕尼的显著治疗效应(分别为hr0.38相对于hr0.45;(表3)。如通过kaplan-meier曲线证明的,两个群体均显示出一致且持久的尼拉帕尼治疗效应。在该群组内测试的所有探索性亚组中观察到尼拉帕尼治疗的这种相同的一致的持久益处。
在非gbrcamut群组中,hrdpos组包括具有体细胞瘤brca突变的患者(hrdpos/sbrcamut)和对于brca野生型的患者(hrdpos/brcawt)。在hrdpos组内观察到的治疗益处不仅仅受hrdpos/sbrcamut亚组中的效应驱动。相对于hrdpos总体组,hrdpos/brcawt亚组也经历尼拉帕尼治疗的一致、持久的益处;其中风险比为0.38(图6)。
值得注意的是,在gbrcamut群组中观察到的hr(0.27)等同于在hrdpos/sbrcamut亚组中观察到的hr,证实了跨越群组和具有相似的潜在肿瘤生物学的两个独立患者群体中尼拉帕尼治疗效应的一致性(图7)。
关于风险比的所有点估计值都<1,指示对于gbrcamut群组(图12a)、非gbrcamut群组的hrd阳性组(图12b)和总体非gbrcamut群组(图12c),接受尼拉帕尼的患者的无进展生存期更长。
在非gbrcamut群组内的亚组分析
如先前所述,非gbrcamut群组包括3组患者:hrdpos、hrdneg和无法确定其肿瘤hrd状态的那些(hrdnd)。此外,hrdpos组包括2个另外的亚组,具有体细胞brca突变肿瘤的女性(sbrcamut)、以及由于hr途径中的非brca相关缺陷而具有hrdpos肿瘤的那些(hrdpos/brcawt)。
在非gbrcamut群组的hrdpos组内,47个患者具有sbrcamut肿瘤,并且115个患者具有brcawt肿瘤。图7和图6提供了关于这2个患者亚组的pfs分析的结果。
在具有hrdpos/sbrcamut的患者中,中值pfs在尼拉帕尼臂中为20.9个月(95%ci:9.7,ne),相对于安慰剂臂中的11.0个月(95%ci:2.0,ne)(11.0个月)。hr为0.27(95%ci:0.081,0.903)(p=0.0248)。(参见图7)sbrcamut亚组中0.27的hr证实了在gbrcamut群组中观察到的0.27hr。
在具有hrdpos/brcawt肿瘤的患者中,中值pfs在尼拉帕尼臂中为9.3个月(95%ci:5.8,15.4),相对于安慰剂臂中的3.7个月(95%ci:3.3,5.6)。hr为0.38(95%ci:0.231,0.628)(p=0.0001),显示即使在不存在sbrca突变的情况下,对于hrd患者的强大治疗效应。(参见图6)。
非gbrcamut群组中的总体群体还包括具有hrdneg的肿瘤的患者,并且探索性分析证实该群体经历了来自尼拉帕尼治疗的益处(hr0.58)。kaplan-meier曲线(图4)显示了尼拉帕尼相对于安慰剂的一致且持久的效应,尽管量级较低。尼拉帕尼效应的影响和持久性在评价pfs的益处方面很重要。例如,在12个月时保持无进展的概率在尼拉帕尼相对于安慰剂臂中为27%相对于7%。在18个月时,多达两倍的尼拉帕尼相对于安慰剂治疗的患者估计为无进展的(19%相对于7%;表3)。关于这20-25%的复发性卵巢癌患者的益处是癌症治疗中的重要且令人惊讶的进步。
对于由患者视为无法耐受的任何等级毒性,在任何时候可以实现剂量中断和/或减少。如果研究者认为该事件与研究药物的施用有关,则根据ncictcaev.4.02,对于3级或4级的任何非血液学ae,需要中断治疗。如果毒性在28天内适当地消退至基线或者1级或更低,则允许患者重新开始用研究药物的治疗,但使用根据表4的剂量水平降低,如果预防视为不可行的话。如果事件在类似或更差的等级复发,则患者的治疗再次中断;在事件解决后,需要进一步的剂量减少;对于任何患者,允许不超过2次剂量减少。
表4:关于非血液学毒性的剂量减少
缩写:ae=不良事件;nci-ctcae=美国国立癌症研究所不良事件的常用术语标准;qd=每天一次;sae=严重不良事件
(1)对于由患者视为无法耐受的任何等级毒性,在任何时候可以实现剂量中断和/或减少。
(2)剂量不下降低于100mgqd
如果需要剂量中断的毒性在最大28天剂量中断期间没有完全消退或者到达ncictcae1级或更低,和/或患者已经经历了最多2次剂量减少(至100mgqd的最小剂量),患者被要求永久中止用研究药物的治疗。
在研究期间没有报告治疗中死亡。两个治疗组中的大多数患者经历至少1个teae,包括接受尼拉帕尼的所有患者和接受安慰剂的96%患者。安慰剂臂中teae的高比率指示先前化学疗法和患者的潜在卵巢癌的滞留效应。
总之,治疗有关的teae的发生率在尼拉帕尼臂中为98%且在安慰剂臂中为71%;接受安慰剂的患者中治疗有关的teae的高比率显示了将事件归因于研究治疗的挑战,并且证实了在该群体中的安全性评估中包括安慰剂臂的重要性。
在尼拉帕尼相对于安慰剂治疗的患者中,teae的发生率如下:ctcae≥3级teae,74%相对于23%;sae,30%相对于15%;导致治疗中断的teae,69%相对于5%;导致剂量减少的teae,67%相对于15%;以及导致治疗中止的teae,15%相对于2%。在尼拉帕尼组中最常报告的teae与尼拉帕尼和其它parp抑制剂的已知安全性概况一致。据报道,大多数常见的teae在尼拉帕尼组的发生率高于安慰剂组,除了疾病有关的症状之外,包括腹痛和腹胀,以及其它疼痛相关症状,包括背痛、关节痛和肌痛。
尽管3级或4级teae是频繁的,但剂量修改在治疗期间有效降低这些事件的频率。随着时间过去血小板减少症的发生率例证了剂量修改的有效性。图8显示了对于总体尼拉帕尼治疗群体,随着时间过去的平均血小板计数。由于在第一个周期期间每周收集血小板计数,因此前四个时间点包括c1d1、c1d8、c1d15和c1d21。后续时间点是所有剩余周期的第1天。平均血小板计数到第15天大幅下降;然而,在此时间点后血小板计数继续增加,并且一般到第4周期恢复到接近基线。
重要的是,在调整至较低剂量水平的患者中,功效没有妥协。为了评价剂量减少对尼拉帕尼功效的可能影响,基于每个患者的最后处方剂量和他们接受最长持续时间的剂量进行pfs分析。注意到对于这些分析,仅包括接受至少1个剂量的尼拉帕尼的患者。图9中提供了通过基于最长持续时间的尼拉帕尼剂量的km分析结果。
在gbrcamut(136个中的74个,54%)和非gbrcamut(231个中的107个,46%)群组两者中,最长持续时间的最常见剂量为200mg;300mg剂量是gbrcamut和非gbrcamut群组中分别25个(18%)和73个(32%)患者的最长持续时间剂量,并且100mg分别是37个(27%)和51个(22%)患者中的最长持续时间剂量。
图9和图10分别呈现了对于gbrcamut和非gbrcamut群组,通过最长持续时间的尼拉帕尼剂量的pfs的km图;如所示的,以所有3个剂量的pfs与总体群体一致,指示相对于保持在300mg起始剂量的患者,需要剂量减少的患者的功效没有降低。
尼拉帕尼的次要功效分析
次要功效终点包括第一后续治疗时间(tfst)、第二后续治疗时间(tsst)、无进展生存期2(pfs2)、无化学疗法间隔(cfi)和总生存期(os)。跨越评估的大多数次要疗效终点,尼拉帕尼具有比安慰剂更大的功效(图11)。使用分层时序检验分析次要终点如pfs2、os和cfi。分层cox比例风险模型用于估计治疗hr及其95%ci。对于两个群组中的患者,用尼拉帕尼的维持治疗显著改善了无化学疗法间隔和第一后续治疗时间;接受安慰剂的患者需要比用尼拉帕尼治疗的患者更快的后续治疗开始,不管其生物标记物状态如何(图11、13和14)。对于两个群组接受尼拉帕尼的患者,无进展生存期2显著更长。对于gbrcamut群组中的患者,与安慰剂组中的19.5个月相比,无进展生存期2在尼拉帕尼组中为25.8个月(风险比,0.48;95%ci,0.280至0.821;p=0.0062)。在总体非gbrcamut群组中,与安慰剂的15个月相比,中值pfs2对于尼拉帕尼为18.64个月;风险比,0.649;95%ci0.494,0.964;p=0.0293)。第二后续治疗时间也是次要终点,然而,在数据截止时,太少的患者已接受第二次治疗以执行该分析(在gbrcamut群组中的34/138尼拉帕尼和26/65安慰剂,以及在非gbrcamut群组中的90/234尼拉帕尼和53/116安慰剂)。
察看组合研究群体(组合gbrcamut和非gbrcamut的2个群组)的合并分析用于下一线治疗的功效。pfs2–pfs1在尼拉帕尼和安慰剂治疗的患者中是相似的。(参见图15)。
下表5中提供了gbrcamut、非gbrcamut和组合的患者群组的次要功效分析的概述。“hr”指示风险比,并且“95%ci”意指95%置信区间。
表5–次要功效分析–在gbrcamut、非gbrcamut和组合的患者群组中的pfs2、后续治疗时间和总生存期。
次要终点,包括cfi、tfst、tsst和pfs2,在gbrcamut和非gbrcamut群组两者中均证实有利于尼拉帕尼治疗臂的持久治疗效应。此外,没有观察到尼拉帕尼治疗对os的不利影响。
在尼拉帕尼相对于安慰剂治疗的患者中,teae的发生率如下:在接受尼拉帕尼的1.4%(367个中的5个)患者和接受安慰剂的1.1%(179个中的2个)患者中发生mds/aml。没有患者具有3级或4级出血事件,尽管1个患者具有与全血细胞减少症并发的3级瘀点和血肿。没有发生5级事件。通过剂量个体化可管理≥3级的血液学治疗有关teae。
基于最后一次基于铂的化学疗法响应的亚组分析
在接受安慰剂治疗的患者中评价铂抗性状态。铂抗性状态定义为对最近(最终)铂方案的铂响应持续时间<6个月。使用kaplan-meier方法,计算在其最近的铂疗法的最后一个剂量后6个月具有疾病进展的患者的估计概率。181个患者被随机化至安慰剂(65个gbrcamut和116个非gbrcamut)。铂抗性率估计值对于gbrcamut、非gbrcamut和合并的群组分别为42%、53%和49%,参见图16。因此,大约一半的试验患者已发展针对其最后一线化学疗法的铂抗性。还评估了每个群组在12个月后的疾病进展。表6中显示了在6个月和12个月内的疾病进展概括。
表6–在其基于铂的治疗的最后一个剂量后,具有pd<6或<12个月的安慰剂患者的估计百分比
基于患者对其最近的铂治疗的响应(cr或pr)将患者分层。gbrcamut群组中49%的患者(尼拉帕尼:67/138;安慰剂:32/65)和非gbrcamut群组中~49%的患者(尼拉帕尼:117/234[50%];安慰剂:56/116[48%])在其最近的基于铂的化学疗法后具有pr进入了nova试验。在非盲法时,非gbrcamut群组中的30个(45%)尼拉帕尼和23个(72%)安慰剂患者,以及非gbrcamut群组中的65个(56%)尼拉帕尼和45个(80%)安慰剂患者具有pfs事件。对于具有针对其最近的铂方案的pr的患者,pfs风险比(95%ci)在gbrcamut群组中为0.24(0.131-0.441),并且在非gbrcamut群组中为0.35(0.230-0.532)。在其最近的基于铂的化学疗法治疗中具有部分响应的受试者中的响应与上述总体nova研究结果有利地相比较。
安慰剂治疗的患者还基于其对最后两次铂治疗的响应进行分层。这些安慰剂治疗的患者的特征显示于表7中。在非gbrcamut群组中,与pd≥6个月的那些(铂敏感性)相比,更大比例的pd<6个月的患者(铂抗性)在倒数第二个和最后一个铂基化学疗法两者后具有pr(对于倒数第二个,39.7%相对于14.6%,并且对于最后一个,65.5%相对于22.9%)。
表7–在基线时安慰剂治疗的患者特征
安慰剂治疗的患者也基于其接受的先前治疗线的数目(2相对于3或更多)进行分层,结果显示于图17中。与在其最近的基于铂的化学疗法后具有pd≥6个月的患者相比,在其最后一次化学疗法后具有pd<6个月的患者已接受更多的先前基于铂的疗法线(图17,小图a和b)和更多的化学疗法总线(图17,小图c和d)。
患者报告的结果
使用癌症治疗功能评价–卵巢症状指数(functionalassessmentofcancertherapy–ovariansymptomindex)(fosi)和eq-5d-5l健康效用指数(healthutilityindex)(hui)得分,来测量患者报告的结果。在以下情况下收集患者报告的结果(pro)调查:筛选就诊,每隔一个周期直到第14周期和进展后。构建混合效应生长曲线模型,以建模对于每个测量的治疗和pro得分之间的关系。使用最不重要的差异阈值和从基线值的变化评价响应者比例。通过对调整后的eq-5d-5l健康效用指数(hui)得分的横断面分析,评估健康状况与患者报告的健康结果之间的关系。两个治疗组之间的依从率很高且相似:尼拉帕尼:fosi完成率范围为75.0%至97.1%,并且安慰剂:fosi完成率范围为77.6%至97.4%。在研究自始至终,在gbrcamut、非gbrcamut群组两者中,pro对于尼拉帕尼和安慰剂是相似的。参见图18。在任一群组中,在尼拉帕尼和安慰剂臂之间未观察到平均pro得分中的显著差异。响应者比例的分析也没有证实任何显著差异,除了在第2周期的非gbrcamut群组中之外。调整的hui得分在基线时在两个臂中相似,但平均调整的hui进展前得分在尼拉帕尼臂中趋于更高(gbrcamut群组中的0.812相对于0.803;非gbrcamut群组中的0.845相对于0.828。血液学毒性对患者的总体健康效用没有不利影响。这些数据支持在对基于铂的化学疗法完全或部分响应后,用尼拉帕尼治疗的患有复发性卵巢癌的患者可以在用尼拉帕尼治疗时(例如,在接受尼拉帕尼维持治疗时)维持其生活质量。
结论
该研究代表parp抑制剂首次已在患者群体中证实确定的活性,所述患者群体可以通过其铂敏感性最佳定义。这些数据支持parp抑制剂的扩展使用超出具有brca突变的癌症,并且显示了尼拉帕尼在hrd阳性和非gbrca卵巢癌(包括hrd阴性卵巢癌)两者中的功效。每天一次的尼拉帕尼剂量显著延长了所有三个主要疗效群体中患者的无进展生存期时间:gbrcamut群组、非gbrcamut群组中具有hrd阳性肿瘤的前瞻性限定的患者亚组、以及总体非gbrcamut群组。如kaplan-meier曲线中体现的,尼拉帕尼治疗效应对于所有三个主要功效群体是临床上有意义、一致且持久的。另外,无化学疗法间隔、第一后续治疗时间和无进展生存期2的次要终点在两个群组中对于尼拉帕尼治疗臂是统计学显著和临床上有意义的。重要的是,患者报告的结果显示,尼拉帕尼维持治疗的结果至少与安慰剂一样好。总的来说,这些数据强烈支持尼拉帕尼在该患者群体中的使用,所述患者群体否则可能根本不接受任何治疗。
探索性分析和所得的kaplan-meier曲线指示,在所有探索性亚组中,与安慰剂相比,使用尼拉帕尼的治疗对患者提供了一致且持久的益处,不管生物标记物状态如何,该发现与对于主要疗效群体做出的观察一致。尽管不同生物标记物群体中存在对尼拉帕尼的响应中的变化,但对于缺乏brca突变并且具有在同源重组中并非缺陷(hrd阴性)的肿瘤的患者,观察到显著改善的无进展生存期。
如通过显著延长的pfs2、cfi和tfst所证实的,用尼拉帕尼改善了次要终点。此外,尼拉帕尼对下一线疗法的功效没有影响,提示延长的临床益处。不管brca突变或hrd状态如何,在对基于铂的化学疗法方案的部分或完全响应后,尼拉帕尼显著改善患有复发性卵巢癌的患者中的结果。
尼拉帕尼副作用概况是可管理的,并且对于在基于铂的化学疗法的应答后的长期给药是可接受的。300mg的剂量适合于大多数患者,并且考虑到疾病的危及生命的性质是可接受的;需要时,该剂量可以对于各个患者进行修改,极大减少了由于副作用而中止药物的需要。总之,在治疗期间不存在死亡,并且~85%的患者对于研究的持续时间保持使用尼拉帕尼,进一步提示副作用是可接受且耐受的。可以使用血液学实验室参数的标准评价来常规监测不良事件,这是接受抗癌疗法的患者的标准。骨髓增生异常综合征和/或急性髓样白血病的发生率非常低(1%),在尼拉帕尼和安慰剂治疗臂中具有相似比率。
尼拉帕尼是每日经口治疗,其通过基本上改善无进展生存期而不降低生活质量来延长基于铂的化学疗法的效应,延迟了患有复发性卵巢癌的患者中伴随其相关累积毒性的另外基于铂的化学疗法的需求,不管其生物标记物状态如何。尼拉帕尼治疗在广泛的患者群体中提供了显著的疗效,现在将parp抑制剂的益处扩展到非brca卵巢癌患者,其在对铂化学疗法响应后具有铂敏感性、复发性卵巢癌。
实例2.尼拉帕尼的食物效应
14天、标签公开、2-治疗、交叉子研究评估了高脂肪膳食对尼拉帕尼(单一剂量)暴露的作用。
不管铂敏感性和疾病负担如何,患有卵巢癌的患者被随机化到a组或b组,其中6个患者被分配到每组。在a组中,患者在接受300mg尼拉帕尼的单一剂量之前禁食(除了水之外没有吃或喝任何东西)至少10小时;患者在剂量后继续禁食至少2小时。在b组中,患者在消耗高脂肪膳食之前禁食至少10小时。在用餐后5分钟内,经口施用单一剂量的300mg尼拉帕尼,并且患者恢复禁食至少4小时。在7天的pk评价和清洗期后,所有患者都在第8天时在相反(禁食与高脂肪餐)情况下接受其第二个单一剂量的尼拉帕尼:a组中的前6个患者在高脂肪膳食后接受其单一剂量的尼拉帕尼,并且b组中的患者在禁食条件下接受其第二个单一剂量的尼拉帕尼。在14天食物效应子研究完成后,在研究开始后大约2周,患者在第1周期/第1天时开始以300mgqd尼拉帕尼的每天给药。
已因此描述了本发明的几个方面,应了解,各种改变、修改和改善对于本领域技术人员将是显而易见的。这些改变、修改和改善预期成为本公开内容的部分,并且预期在本发明的精神和范围内。相应地,前文描述和附图仅是示例性的,并且本发明通过下附权利要求详细描述。
实例3.dna修复基因
表8是dna修复基因的列表
参考文献:
dubois,a,floqueta,kimjw,rauj,delcampojm,friedlanderm,pignatas,fujiwarak,vergotei,colombo,n,mirzamr,monkbj,wimbergerp,ray-coquardi,zangr,padillaid,baumannkh,kimjh和harterp.randomized,double-blind,phaseiiitrialofpazopanibversusplaceboinwomenwhohavenotprogressedafterfirst-linechemotherapyforadvancedepithelialovarian,fallopiantube,orprimaryperitonealcancer(aeoc):resultsofaninternationalintergrouptrial(ago-ovar16).
pfisterer,j.,m.plante,i.vergote,a.dubois,h.hirte,a.j.lacave,u.wagner,a.stahle,g.stuart,r.kimmig,s.olbricht,t.le,j.emerich,w.kuhn,j.bentley,c.jackisch,h.j.luck,j.rochon,a.h.zimmermann,e.eisenhauer,o.ago,c.t.g.ncic和g.c.g.eortc(2006)."gemcitabinepluscarboplatincomparedwithcarboplatininpatientswithplatinum-sensitiverecurrentovariancancer:anintergrouptrialoftheago-ovar,thencicctg,andtheeortcgcg."jclinoncol24(29):4699-4707.
tcga(2011).“integratedgenomicanalysesofovariancarcinoma.”nature474:609-615.
等价方案
除非明确指出相反,否则如本文在说明书和权利要求中使用的冠词“一个”和“一种”应该理解为包括复数指示物。如果组成员中的一个、多于一个或全部存在于给定产物或过程中、用于给定产物或过程中、或者以其它方式与给定产物或过程相关,则包括组中一个或多个成员之间的“或”的声明或描述视为满足的,除非另有相反说明或从上下文中显而易见。本发明包括这样的实施例,其中组中的一个确切成员存在于、被应用于给定的产品或方法中,或以其他方式与给定的产品或方法相关。本发明还包括这样的实施例,其中多于一个组成员或全部组成员存在于、被应用于给定的产品或方法中,或以其他方式与给定的产品或方法相关。此外,应当理解,本发明包括涵盖所有的变型、组合和取代,其中来自一条或多条所列权利要求的一个或多个限制、要素、子句、描述性用语被引入从属于同一基础权利要求的另一个权利要求(或者相关的任何其他权利要求)中,除非另外指出或除非对于本领域普通技术人员来说明显会引起矛盾或不一致。当元素呈现为列表时(例如,以马库什组或类似格式),应理解还公开了元素的每个子组,并且可从组中去除任何元素。应当理解,通常,当本发明或本发明的方面被称为包含特定的要素、特征等时,本发明的某些实施例或本发明的方面由此类要素、特征等组成或基本上由它们组成。为了简化的目的,这些实施例并不是在每种情况下都明确用本文陈述的那么多用词来具体描述。应当理解,本发明的任何实施例或方面可明确地从权利要求排除,不管在说明书中是否描述了此类具体排除。描述本发明的背景并提供关于其实践的另外细节的本文引用的出版物、网站和其它参考材料在此以引用的方式并入。
- 还没有人留言评论。精彩留言会获得点赞!