包含壳体装配抑制剂的组合和方法与流程
本申请要求2016年4月15日提交的美国临时申请no.62/323,251和2016年11月11日提交的美国临时申请no.62/421,035的权益。这些申请中的每一者的内容全文以引用方式并入本文。
本公开涉及使用壳体装配抑制剂来治疗乙型肝炎病毒感染的方法。
背景技术:
慢性乙型肝炎病毒(hbv)感染是一种与慢性hbv感染相关的持续潜在进行性肝坏死性炎性疾病。在世界范围内有约2.40-4亿人口被慢性感染上hbv,并且慢性hbv感染是严重肝发病率和肝相关死亡率的主要全球致因(hepatitisbfactsheet,worldhealthorganization,2013;hoofnaglejh等人,managementofhepatitisb:summaryofaclinicalresearchworkshop,hepatology,2007,45(4):1056-1075;easlclinicalpracticeguidelines:managementofchronichepatitisbvirusinfection,j.hepatology,2012,57:167-185(easl2012);lesmanala等人hepatitisb:overviewoftheburdenofdiseaseintheasia-pacificregion,liverinternational,2006,26:3-10;lokasf和mcmahonbj,chronichepatitisb:update2009,hepatology,september2009:1-36(lok2009))。
个体受治疗者的慢性hbv感染状态一般通过证实受治疗者血清内乙型肝炎表面抗原(hbsag)6个月或更久的持续可检测性来建立。美国疾病控制中心(u.s.centerfordiseasecontrol,cdc)认为符合慢性hbv感染的血清学特征为:hbsag-阳性和hbsab-阴性,具有可检测的针对乙型肝炎核心抗原的igg抗体(igghbcab),以及不可检测的针对乙型肝炎核心抗原的igm抗体(igmhbcab)。在此类个体中,血清乙型肝炎e抗原(hbeag)可为可检测或不可检测的,并且更可能在慢性hbv感染后期可检测到。
目前管理机构批准的用于慢性hbv感染的疗法包括胃肠外施用的α-干扰素(非聚乙二醇化或聚乙二醇化的)以及各种口服施用的hbv聚合酶/逆转录酶(hbvpol-rt)的核苷/核苷酸抑制剂。每种这些试剂在治疗一年之后仅在约20-35%的hbeag阳性患者中抑制hbv复制并诱导hbeag损失/血清转化(easl2012;lok2009;sorrellmf等人,nationalinstitutesofhealthconsensusdevelopmentconferencestatement:managementofhepatitisb,anninternmed,2009,150(2):104-110;woog等人,tenofovirandentecavirarethemosteffectiveantiviralagentsforchronichepatitisb:asystematicreviewandbayesianmeta-analyses,gastroenterology,2010:1-17)。虽然呈hbeag-阳性的具有慢性hbv感染的患者在目前48周的聚乙二醇化干扰素(pegifn)治疗方案下经历高达30-35%的hbeag损失,但在治疗后2-5年内有20-50%的患者回归至其初始hbeag水平(perillor,benefitsandrisksofinterferontherapyforhepatitisb,hepatology,2009,49:s103-s111)。因此,目前的hbv疗法可提供hbv复制的长效抑制,但大多数患者仍无法实现持久的治疗后响应。
相比之下,在具有或不具有hbeag损失或血清转化情况下,hbv复制被抑制至较低或不可检测水平可在用有效hbv核苷/核苷酸连续治疗的大多数患者中维持较长时段,但此类核苷/核苷酸治疗的长效时段与耐受性风险、病毒抵抗力,以及患者的顺从性困难相关联(chotiyaputtaw等人,persistenceandadherencetonucleos(t)ideanaloguetreatmentforchronichepatitisb,j.hepatology,2011,54:12-18;leem和keeffeeb,studyofadherencecomestothetreatmentofchronichepatitisb,j.hepatology,2011年1月,54(1):12-18;scaglionesj和lokasf,effectivenessofhepatitisbtreatmentinclinicalpractice,gastroenterology,2012,142:1360-1368)。
随着hbv-相关的死亡率和严重的发病率在世界范围继续普及,仍然需要可在治疗期间和之后实现持续病毒应答的改善的hbv抗病毒疗法。
技术实现要素:
在一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的核心蛋白变构调节剂(cpam)和逆转录酶抑制剂。在一个实施方案中,cpam是导致hbv壳体异常、缺陷或不完全装配的核心蛋白变构调节剂。在另一个实施方案中,cpam是导致关于其病毒内容物基本上为空的壳体装配的核心蛋白变构调节剂。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的:
式i的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及
逆转录酶抑制剂,或其药学上可接受的盐或前药。
在该方法的另一个实施方案中,式i的化合物为式ia的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式。
在该方法的另一个实施方案中,式i的化合物为式ib的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式。
在该方法的一个实施方案中,式i或式ib的化合物为式ii的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式。
在该方法的另一个实施方案中,式i或式ib的化合物为式iiia的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式。
在该方法的另一个实施方案中,式i或式ib的化合物为式iiib的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式。
在一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1:
4-氟-3-((4-羟基哌啶-1-基)磺酰基)-
n-(3,4,5-三氟苯基)苯甲酰胺
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及
逆转录酶抑制剂,或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2:
(s)-n-(3-氰基-4-氟代苯基)-1-甲基-4-(n-(1,1,1-三氟丙烷-2-基)氨磺酰)-1h-吡咯-2-甲酰胺
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及
逆转录酶抑制剂,或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物3:
(r)-n-(2-氯吡啶-4-基)-1-甲基-4-(n-(1,1,1-三氟丙烷-2-基)氨磺酰)-1h-吡咯-2-甲酰胺
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及
逆转录酶抑制剂,或其药学上可接受的盐或前药。
在一个实施方案中,逆转录酶抑制剂是基于嘌呤的逆转录酶抑制剂,诸如恩替卡韦或替诺福韦。
在另一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、以及拉米夫定,或它们的药学上可接受的盐或前药。
在一个实施方案中,cpam和逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,cpam和逆转录酶抑制剂处于分开的制剂中。
在另一个实施方案中,化合物1、化合物2、或化合物3以及逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,化合物1、化合物2、或化合物3以及逆转录酶抑制剂处于分开的制剂中。
在一个实施方案中,患者对用逆转录酶抑制剂治疗是抵抗性或顽固性的。在另一个实施方案中,患者对用核苷试剂治疗是抵抗性或顽固性的。在另一个实施方案中,患者是未接受过治疗的患者。
在一个实施方案中,化合物1以50mg/天至3000mg/天的量施用。在一个实施方案中,化合物1以约2000mg/天的量施用。在另一个实施方案中,化合物1以约1000mg的量每天施用两次。在一个实施方案中,化合物1以1200mg/天的量施用。在一个实施方案中,化合物1以600mg的量每天施用两次。在一个实施方案中,化合物1以600mg/天的量施用。在一个实施方案中,化合物1以400mg/天的量施用。在一个实施方案中,化合物1以200mg/天的量施用。在一个实施方案中,化合物1以100mg/天的量施用。
在一个实施方案中,化合物2或化合物3以5mg/天至600mg/天的量施用。在另一个实施方案中,化合物2或化合物3以10mg/天至50mg/天的量施用。在一个具体的实施方案中,化合物2或化合物3以约25mg/天的量施用。在另一个实施方案中,化合物2或化合物3以约25mg的量每天施用四次。在另一个实施方案中,化合物2或化合物3第一天以约100mg的量施用,然后以25mg每天施用四次。在另一个实施方案中,化合物2或化合物3以10mg每日一次至200mg每日一次的量施用。
在一个实施方案中,化合物1呈结晶形式。在另一个实施方案中,结晶形式的特征在于具有以2-θ度表示在17.1、20.8、22.2、24.9和26.6的角度(±0.2°)处的峰的x-射线粉末衍射图案(形式xvi)。
在另一个实施方案中,所公开化合物以及逆转录酶抑制剂的施用发生在短于48周的时间段内。
在一个实施方案中,患者是慢性hbv-感染的患者。
在一个方面,本文提供了一种包含cpam和逆转录酶抑制剂的组合产品。在组合产品的一个实施方案中,cpam是导致hbv壳体异常、缺陷或不完全装配的核心蛋白变构调节剂。在组合产品的另一个实施方案中,cpam是导致关于其病毒内容物基本上为空的壳体装配的核心蛋白变构调节剂。在一个方面,本文提供了一种组合产品,该组合产品包含cpam、式i、式ia、式ib、式iia、式iiia或式iiib的化合物或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在一个方面,本文提供了一种组合产品,该该组合产品包含化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。在组合产品的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、以及拉米夫定,或它们的药学上可接受的盐或前药。
在另一方面,本文提供了一种组合产品,该组合产品包含式ib的化合物、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。在组合产品的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、以及拉米夫定,或它们的药学上可接受的盐或前药。
在组合产品的一个实施方案中,逆转录酶抑制剂是基于嘌呤的逆转录酶抑制剂。在组合产品的另一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在组合产品的一个实施方案中,式i、式ia、式ib、式iia、式iiia或式iiib的化合物以及逆转录酶抑制剂处于同一制剂中。在组合产品的另一个实施方案中,式i、式ia、式ib、式iia、式iiia或式iiib的化合物以及逆转录酶抑制剂处于分开的制剂中。在该实施方案的另一个实施方案中,制剂用于同时或顺序施用。
在组合产品的一个实施方案中,化合物1、化合物2、或化合物3以及逆转录酶抑制剂处于同一制剂中。在组合产品的另一个实施方案中,化合物1、化合物2、或化合物3以及逆转录酶抑制剂处于分开的制剂中。在该实施方案的另一个实施方案中,制剂用于同时或顺序施用。
在组合产品的一个实施方案中,式ib的化合物以及逆转录酶抑制剂处于同一制剂中。在组合产品的另一个实施方案中,式ib的化合物以及逆转录酶抑制剂处于分开的制剂中。在该实施方案的另一个实施方案中,制剂用于同时或顺序施用。
在一个实施方案中,组合产品用于在患者中治疗hbv感染。
在一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者对用逆转录酶抑制剂治疗是抵抗性的。在另一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者对用核苷试剂治疗是抵抗性的。
在一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者未接受过治疗。在组合产品的一个实施方案中,化合物1的量为600mg至3000mg。在组合产品的另一个实施方案中,化合物1的量为约2000mg。在组合产品的另一个实施方案中,化合物1的量为约1000mg。
在组合产品的一个实施方案中,化合物2或化合物3的量为5mg至600mg。在组合产品的另一个实施方案中,化合物2或化合物3的量为10mg至50mg。在组合产品的另一个实施方案中,化合物2或化合物3的量为约25mg。在组合产品的另一个实施方案中,化合物2或化合物3的量为约10mg至200mg。在组合产品的一个实施方案中,化合物1呈结晶形式。在另一个实施方案中,结晶形式的特征在于具有以2-θ度表示在17.1、20.8、22.2、24.9和26.6的角度(±0.2°)处的峰的x-射线粉末衍射图案(形式xvi)。
在一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者被慢性感染上hbv。
在另一方面,本文提供了一种包含核心蛋白变构调节剂(cpam)以及逆转录酶抑制剂的药物组合物。在药物组合物的一个实施方案中,cpam是导致hbv壳体异常、缺陷或不完全装配的核心蛋白变构调节剂。在药物组合物的另一个实施方案中,cpam是导致关于其病毒内容物基本上为空的壳体装配的核心蛋白变构调节剂。
在另一方面,本文提供了一种药物组合物,该药物组合物包含式i、式ia、式ib、式iia、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在另一方面,本文提供了一种药物组合物,该药物组合物包含式ib的化合物、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在药物组合物的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、以及拉米夫定,或它们的药学上可接受的盐或前药。在另一个实施方案中,逆转录酶抑制剂是基于嘌呤的逆转录酶抑制剂。
在另一个实施方案中,药物组合物还包含一种或多种药学上可接受的载体。
在另一方面,本文提供了一种药物组合物,该药物组合物包含化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在药物组合物的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、以及拉米夫定,或它们的药学上可接受的盐或前药。在药物组合物的实施方案中,逆转录酶抑制剂是基于嘌呤的逆转录酶抑制剂。
在药物组合物的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一个实施方案中,药物组合物还包含一种或多种药学上可接受的载体。
在一个方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i、式ia、式ib、式iia、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,其中患者对用逆转录酶抑制剂治疗是抵抗性或顽固性的。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i、式ia、式ib、式iia、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,其中患者对用核苷试剂治疗是抵抗性或顽固性的。
在一个方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,其中患者对用逆转录酶抑制剂治疗是抵抗性或顽固性的。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,其中患者对用核苷试剂治疗是抵抗性或顽固性的。
在用于治疗hbv感染的一个实施方案中,化合物1以600mg/天至3000mg/天的量施用。在另一个实施方案中,化合物1以约2000mg/天的量施用。在该实施方案的一个实施方案中,化合物1以约1000mg的量每天施用两次。
在用于治疗hbv感染的一个实施方案中,化合物2或化合物3以5mg/天至600mg/天的量施用。在另一个实施方案中,化合物2或化合物3以10mg/天至50mg/天的量施用。在一个具体的实施方案中,化合物2或化合物3以约25mg/天的量施用。在另一个实施方案中,化合物2或化合物3以约10mg每日一次至200mg每日一次的量施用。
在这些方法的另一个实施方案中,式i、式ia、式ib、式iia、式iiia或式iiib的化合物、化合物1、化合物2、或化合物3以及逆转录酶抑制剂的施用发生在短于48周的时间段内。
在另一个实施方案中,患者是慢性hbv-感染的患者。
在一个方面,本文提供了一种抑制核苷抗性hbv变体复制的方法,包括使所述变体与有效量的式i、式ia、式ib、式iia、式iiia或式iiib的化合物、化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式接触。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i、式ia、式ib、式iia、式iiia或式iiib的化合物、化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及化合物a,
或其药学上可接受的盐。
附图说明
图1示出将经野生型hbv(实心圆)和包含rtl180m/m204v(实心三角形)或rtl180m/m204v/n236t(实心方块)氨基酸变化的变体瞬时转染的hepg2细胞用增大浓度的lmv(图1a)、etv(图1b)、或tdf(图1c)温育。针对野生型hbv的剂量响应曲线显示为虚线。数据点表示至少三个独立转染研究的平均值,并且标准偏差示为误差线。
图2示出在得自供体hum4038的原代人肝细胞中化合物1与核苷类似物对细胞活力的联合效应。化合物1单独(圆形,实线)或与如下核苷类似物组合(正方形,虚线)的细胞活力剂量响应曲线:(图2a)300μmlmv,(图2b)30μmetv,或(图2c)30μmtfv。将得自供体hum4038的原代人肝细胞用受试化合物处理6天。数据点示为平均值,并且误差线为三次平行测定的标准偏差。
图3示出在得自供体hum4055a的原代人肝细胞中化合物1与核苷类似物对细胞活力的联合效应。化合物1单独(圆形,实线)或与如下核苷类似物组合(正方形,虚线)的细胞活力剂量响应曲线:(图3a)300μmlmv,(图3b)30μmetv,或(图3c)30μmtfv。将得自供体hum4055a的原代人肝细胞用受试化合物处理6天。数据点示为平均值,并且误差线为三次平行测定的标准偏差。
图4示出在得自供体hum4059的原代人肝细胞中化合物1与核苷类似物对细胞活力的联合效应。化合物1单独(圆形,实线)或与如下核苷类似物组合(正方形,虚线)的细胞活力剂量响应曲线:(图4a)300μmlmv,(图4b)30μmetv,或(图4c)30μmtfv。将得自供体hum4059的原代人肝细胞用受试化合物处理6天。数据点示为平均值,并且误差线为三次平行测定的标准偏差。
图5示出化合物1单独施用或与pegifn一起施用的患者试验中的功效结果。
图6示出施用安慰剂(pcb)、化合物1(600mgbd)、180μg/周聚乙二醇化干扰素(peg-ifn)、以及这些剂量的化合物1与peg-ifn的组合的患者中血清hbvrna的下降。
图7示出化合物1与核苷类似物的联合效应。将化合物1与lmv(图7a)、tfv(图7b)和etv(图7c)联合使用。
图8示出化合物1与bay41-4109(另一种核心调节剂)的联合效应。由经化合物1与bay41-4109联合处理的hepg2.2.15细胞的macsynergy,以95%置信度绘制协同作用。
图9示出形式xvi的化合物1的x-射线粉末衍射图案。
图10示出形式iii的化合物1的x-射线粉末衍射图案。
图11a、11b和11c示出化合物2与etv的组合在hepg2.2.15细胞中的协同作用图。协同作用图的计算基于95%ci的下限值(y-轴)。化合物浓度以nm提供于x-和z-轴上。图11a对应于实验1。图11b对应于实验2。图11c对应于实验3。
图12a、12b和12c示出化合物2与tfv的组合在hepg2.2.15细胞中的协同作用图。协同作用图的计算基于95%ci的下限值(y-轴)。化合物浓度以nm提供于x-和z-轴上。图12a对应于实验1。图12b对应于实验2。图12c对应于实验3。
图13示出化合物3与etv的组合在hepg2.2.15细胞中的协同作用图。协同作用图的计算基于95%ci的下限值(y-轴)。化合物浓度以nm提供于x-和z-轴上。
图14示出化合物3与tfv的组合在hepg2.2.15细胞中的协同作用图。协同作用图的计算基于95%ci的下限值(y-轴)。化合物浓度以nm提供于x-和z-轴上。
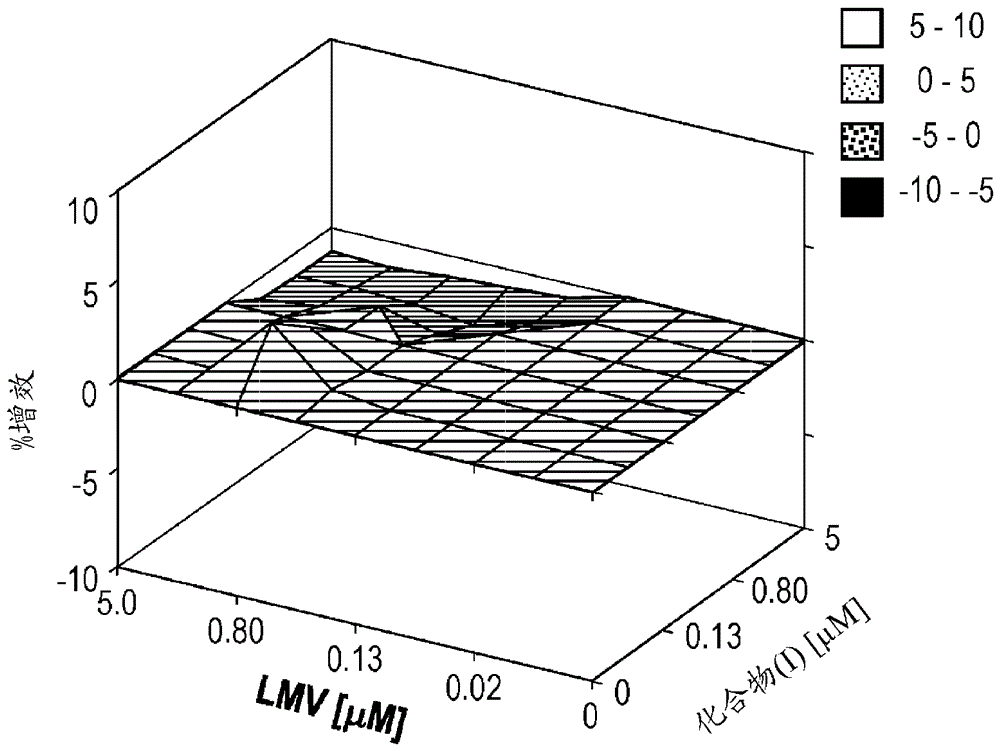
图15a、15b、15c和15d示出在浓度范围内的化合物2和etv或tfv存在下,hbv复制被抑制的百分比。各个图显示出在另一者浓度设定为零时每种化合物的抑制百分比。
具体实施方式
本公开涉及使用壳体装配抑制剂来治疗乙型肝炎病毒(hbv)感染的方法。具体地,本文提供了在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的核心蛋白变构调节剂(cpam)和逆转录酶抑制剂。在一个实施方案中,cpam是导致hbv壳体异常、缺陷或不完全装配的核心蛋白变构调节剂。在另一个实施方案中,cpam是导致关于其病毒内容物基本上为空的壳体装配的核心蛋白变构调节剂。本文还提供了用于在对其有需要的患者中治疗hbv感染的方法,包括施用cpam(例如,式i、式ia、式ib、式iia、式iiia或式iiib的化合物,化合物1,化合物2,或化合物3)以及逆转录酶抑制剂。本文还提供了包含如下的组合产品和药物组合物:cpam(例如,式i、式ia、式ib、式iia、式iiia或式iiib的化合物,化合物1,化合物2,或化合物3)以及逆转录酶抑制剂。本文还提供了包含具有式ib的cpam以及逆转录酶抑制剂的组合产品和药物组合物。另外,本文提供了在对用逆转录酶抑制剂或核苷/核苷酸试剂治疗是抵抗性或顽固性的患者中治疗hbv感染的方法,包括施用式i、式ia、式ib、式iia、式iiia或式iiib的化合物,化合物1,化合物2,或化合物3。另外,本文提供了在对用逆转录酶抑制剂或核苷/核苷酸试剂治疗是抵抗性或顽固性的患者中治疗hbv感染的方法,包括施用式ib的化合物。
i.定义
如说明书和权利要求书中所用,术语“包括”可包括实施方案“由...组成”和“基本上由...组成”。如本文所用,术语“包含”、“包括”、“具有”、“有”、“可以”、“含有”以及它们的变型意欲为需要存在指定成分/步骤并允许存在其它成分/步骤的开放式过渡型短语、术语、或词语。然而,此类说明应理解成也将组合物或过程描述为“包括”和“基本上包括”所枚举的化合物,其允许仅存在所指定化合物,连同任何药学上可接受的载体,并且排除其它化合物。
本文所公开的所有范围包括所指定端值并且可独立地组合(例如,“600mg至3000mg”的范围包括端值600mg和3000mg以及所有中间值,诸如2000mg)。本文公开的这些范围的端点和任何数值均不限于该精确的范围或数值;它们并不十分精确,从而包括接近这些范围和/或数值的数。
如本文所用,可使用近似语言来修饰任何可变化的定量表述,而不导致其所涉及的基本功能变化。因此,由术语例如“约”和“基本上”修饰的值在一些情况下可不限于所指定的精确值。至少在某些情况中,近似语言可对应于测量该值的仪器的精度。修饰语“约”也应被认为公开由两个端值的绝对值所限定的范围。例如,表达“约600至约3000”也公开了“600至3000”的范围。术语“约”可指加或减所述数目的10%。例如“约10%”可指示9%至11%的范围,并且“约1”可意指0.9至1.1。“约”的其它含义可从上下文中显而易见,诸如四舍五入,因此例如“约1”也可意指0.5至1.4。
如本文所用,短语“核心蛋白变构调节剂(cpam)”是指改变核心蛋白装配或活性的化合物(zlotnick,antiviralresearch121(2015)82-93)。至少两类cpam已被鉴定为以两种不同的方式改变核心蛋白装配。
第一类cpam显示为误导壳体装配,以形成异常非壳体聚合物。该第一类在下文称为“导致hbv壳体异常、缺陷或不完全装配的核心蛋白变构调节剂”。该类别的一个示例为基于杂芳基二氢嘧啶(hap)的化合物。在较高浓度下,hap导致误导的壳体装配,以形成异常非壳体聚合物。在亚化学计量浓度下,当相比于cp浓度时,hap使壳体装配率增大。hbv壳体与hap之间的晶体结构示出壳体的四级结构变化,从而形成三级结构几乎没有变化的连接的刚性体。hap的一个示例包括但不限于4-(2-氯-4-氟代苯基)-6-甲基-2-(吡啶-2-基)-1,4-二氢嘧啶-5-羧酸甲酯(hap-1)。
另一种类型的cpam使壳体装配率增大而不影响壳体形态,下文称为“导致关于其病毒内容物基本上为空的壳体装配的核心蛋白变构调节剂”。
该类型的一个示例为基于非核苷-基苯基丙烯酰胺(ppa)的化合物。ppa使壳体装配率增大而不影响壳体形态。细胞培养研究显示,ppa存在下所形成的壳体关于其病毒内容物是空的,这是阻止病毒rna包装的结果。hbv与ppa之间的晶体结构也示出四级和三级结构变化两者。此类形成空壳体的cpam的另一个示例包括但不限于本文所述的式i、式ia、式ib、式iia、式iiia或式iiib的化合物,化合物1,化合物2,以及化合物3。
式ib也为“导致基本上空的壳体装配的核心蛋白变构调节剂”的一个示例。
如本文所用,术语“逆转录酶抑制剂”是指抑制hbv逆转录酶活性的核苷和核苷酸以及它们的类似物。示例包括但不限于例如恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
如本文所用,“逆转录酶抑制剂”可为“基于嘌呤的逆转录酶抑制剂”,即为具有嘌呤环的逆转录酶抑制剂,诸如但不限于恩替卡韦和替诺福韦。
如本文所用,术语“处理”或“治疗”被定义为向具有hbv感染,hbv感染的症状或者有发展成hbv感染的潜能的患者施加或施用治疗剂,即本发明的化合物(单独或与另一种药剂组合),或者将治疗剂施加或施用于从患者分离的组织或细胞系(例如,用于诊断或离体应用),目的在于治愈、愈合、减轻、缓解、改变、治疗、改善、改良或影响hbv感染、hbv感染的症状或者发展成hbv感染的潜能。此类治疗可基于获自药物基因组学领域的知识进行特别调整或修改。
如本文所用,术语“患者”、“个体”或“受治疗者”是指人或非人哺乳动物。非人哺乳动物包括例如牲畜和宠物,诸如绵羊、牛、猪、犬科、猫科和鼠科哺乳动物。优选地,患者、受治疗者或个体为人类。
如本文所用,术语“药学上可接受的”指没有消除化合物的生物活性或特性并且相对无毒的材料,诸如载体或稀释剂,即可将材料施用于个体而不引起不期望的生物效应或者以有害方式与包含其的组合物中的任何组分相互作用。
如本文所用,术语“药学上可接受的盐”是指所公开化合物的衍生物,其中通过将现有的酸或碱部分转化为其盐形式来修饰母体化合物。药学上可接受的盐的示例包括但不限于碱性残基诸如胺的无机或有机酸盐;酸性残基诸如羧酸的碱性或有机盐;等。本发明的药学上可接受的盐包括例如由无毒的无机或有机酸形成的母体化合物的常规无毒盐。本发明的药学上可接受的盐可通过常规化学方法由包含碱或酸部分的母体化合物合成。通常,这些盐可通过以下过程制备:使游离酸或碱形式的这些化合物与化学计算量的合适碱或酸在水中或在有机溶剂中或者在这两者的混合物中反应;通常优选非水性介质,如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈。合适的盐的列表见于雷明顿药物科学,第17版(remington′spharmaceuticalsciences,17thed.),宾夕法尼亚州伊斯顿的麦克出版公司,1985,第1418页(mackpublishingcompany,easton,pa.,1985,p.1418)和药物科学杂志,第66卷,第2期(1977)(journalofpharmaceuticalscience,66,2(1977)),其各自内容全文以引用方式并入本文。
如本文所用,术语“组合物”或“药物组合物”是指本发明内可用的至少一种化合物与药学上可接受的载体的混合物。药物组合物有助于将化合物施用于患者或受治疗者。本领域存在的多种施用化合物的技术包括但不限于静脉内、口服、气雾剂、肠胃外、眼部、肺部以及局部施用。
如本文所用,术语“药学上可接受的载体”是指参与在患者体内运载或转运本发明内可用的化合物或者将其运载或转运给患者使得其可执行其预期功能的药学上可接受的材料、组合物或载体,例如液体或固体填料、稳定剂、分散剂、悬浮剂、稀释剂、赋形剂、增稠剂、溶剂或包封材料。通常,此类构建体从一个器官或身体的部分运载或转运到另一个器官或身体部分。各载体必须是“可接受的”,其意指与制剂(包括本发明内可用的化合物)中其它成分相容并且对患者无害。可用作药学上可接受的载体的材料的一些示例包括:糖,诸如乳糖、葡萄糖和蔗糖;淀粉,诸如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,诸如羧甲基纤维素钠、乙基纤维素和醋酸纤维素。粉末化黄蓍胶;麦芽;明胶;滑石;赋形剂,诸如可可油和栓剂蜡;油,诸如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;二醇,诸如丙二醇;多元醇,诸如甘油、山梨糖醇、甘露糖醇和聚乙二醇;酯,诸如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,诸如氢氧化镁和氢氧化铝;表面活性剂;藻酸;不含热原的水;等渗盐水;林格氏液;乙醇;磷酸盐缓冲溶液;以及用于药物制剂中的其它非毒性相容物质。如本文所用,“药学上可接受的载体”还包括与本发明内可用的化合物的活性相容的任何和所有包衣、抗菌剂和抗真菌剂、以及吸收延迟剂等等,并且对于患者是生理上可接受的。还可将辅助活性化合物掺入组合物中。“药学上可接受的载体”还可包括本发明内可用的化合物的药学上可接受的盐。用于实施本发明的药物组合物中可包含的其它附加成分在本领域中是已知的并且描述于例如remington′spharmaceuticalsciences(genaro编辑,mackpublishingco.,1985,easton,pa),其以引用方式并入本文。
如本文所用,术语“组合”、“治疗组合”、“药物组合”或“组合产品”是指一个剂量单位形式的固定组合,或非固定组合、或成套药盒,以用于其中两种或更多种治疗剂可独立、同时或在一定时间间隔内分开施用的联合施用,尤其是这些时间间隔允许组合伴侣示出合作效应(例如协同效应等)的情况下更是如此。术语“联合疗法”是指施用两种或更多种治疗剂来治疗本公开中所述的治疗病症或障碍。此类施用包括以基本同时的方式共同施用这些治疗剂,例如以具有固定比率的活性成分的单一制剂或者每种活性成分的分开的制剂(例如胶囊和/或静脉内制剂)共同施用。此外,此类施用也包括以顺序或分开的方式约同时或不同时使用各种类型的治疗剂。无论活性成分是否作为单一制剂或以分开的制剂施用,药物作为同一个疗程的一部分施用给同一患者。在任何情况下,治疗方案将提供治疗本文所述的病症或障碍的有益效果。
术语“协同效应”是指两种试剂例如壳体装配抑制剂和逆转录酶抑制剂的作用,从而产生例如减缓hbv-感染或其症状的症状进展的效应,该效应大于单独施用的各个药物的效应的简单累加。协同效应可例如使用合适的方法例如sigmoid-emax方程(holford,n.h.g.和scheiner,l.b.,clin.pharmacokinet.6:429-453(1981))、loewe相加模型公式(loewe,s.和muischnek,h.,arch.exp.patholpharmacol.114:313-326(1926))和中值效应公式(chou,t.c.和talalay,p.,adv.enzymeregul.22:27-55(1984)以及chou,pharmacol.rev.58:621-681(2006))进行计算。可将以上提及的各个公式用于实验数据来生成对应的图,以助于评估药物组合的效应。与以上提及的公式相关的对应曲线图分别是浓度-效应曲线、等效应曲线以及结合指数曲线。在一些实施方案中,化合物的组合在治疗hbv感染中表现出协同效应(即大于累加效应)。在另一些实施方案中,化合物的组合在治疗hbv-感染中表现出协同效应(即大于累加效应)。
协同作用体积<-100、-100至-50、-50至-25、-25至25、25至50、50至100、以及>100分别指示强拮抗作用、中等拮抗作用、轻微拮抗作用、不显著协同作用/拮抗作用(累加性)、轻微协同作用、中等协同作用、以及强协同作用。
如本文所用,在涉及hbv患者时,术语对治疗剂呈“抵抗性”或“顽固性”意指hbv患者作为与治疗剂接触的结果对治疗剂的效应有先天抗性或获得抗性。换言之,hbv患者对与特定治疗剂相关的普通标准护理是抵抗性的。
如本文所用,“未接受过治疗”是指患者先前并未接受过用研究或批准用于hbv感染的药物,特别是核苷/核苷酸药物治疗。
另选地,根据本公开的方法治疗的患者可为“经历治疗的”。如本文所用,“经历治疗的”是指已具有至少一个先前hbv抗病毒疗程(具体是核苷/核苷酸)的患者。在一些实施方案中,该先前疗程内的最后剂量发生在实施根据本公开的方法之前的至少三个月。
可根据所公开的方法治疗的hbv感染包括hbv基因型a、b、c和/或d感染。然而,在一个实施方案中,所公开的方法可治疗任何hbv基因型(“全-基因型(pan-genotypic)治疗”)。hbv基因分型可使用本领域已知的方法进行,例如
除非另行指出,否则如本文所用,术语“烷基”本身或作为另一取代基的一部分是指具有指定碳原子数(即,c1-c6-烷基意指具有一至六个碳原子的烷基)的直链或支链烃,并且包括直链和支链。示例包括甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、新戊基和己基。c1-c6-烷基的其它示例包括乙基、甲基、异丙基、异丁基、正戊基和正己基。
如本文所用,术语“烯基”代表衍生自含有至少两个碳原子和至少一个碳-碳双键的烃部分的一价基团。双键可以或不可为与另一个基团的连接点。烯基基团(例如,c2-c8-烯基)包括但不限于例如乙烯基、丙烯基、丙-1-烯-2-基、丁烯基、1-甲基-2-丁烯-1-基、庚烯基、辛烯基等等。
如本文所用,“炔基”意指含有多至6个碳原子且具有至少一个碳-碳三键的直链或支链烃基。炔基基团的示例包括但不限于乙炔基、1-丙炔基、1-丁炔基等等。
如本文所用,术语“烷氧基”是指基团-o-烷基,其中烷基如本文所定义。烷氧基以举例的方式包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基等。
除非另行指出,否则如本文所用,术语“卤”或“卤素”单独或作为另一取代基的一部分是指氟、氯、溴或碘原子,优选氟、氯、或溴,更优选氟或氯。
如本文所用,术语“环烷基”意指具有1、2或3个环的部分或完全饱和的非芳族碳环体系,其中此类环可为稠合的。术语“稠合的”意指通过具有与第一环共有(即共享)的两个相邻原子而(即连接或形成)存在第二环。环烷基也包括本质上可为桥联或螺环的二环结构,并且二环之内每个独立的环在3-8个原子之间变化。术语“环烷基”包括但不限于环丙基、环丁基、环戊基、环己基、二环[3.1.0]己基、螺[3.3]庚基、以及二环[1.1.1]戊基。
如本文所用,术语“杂环烷基”意指含有1、2、3或4个独立地选自n、o和s的杂原子且具有1、2或3个环的非芳族碳环体系,其中此类环可为稠合的,其中稠合在上文有所定义。杂环烷基也包括本质上可为桥联或螺环的二环结构,并且二环之内每个独立的环在3-8个原子之间变化,并且包含0、1、或2个n、o、或s原子。术语“杂环烷基”包括环酯(即内酯)和环酰胺(即内酰胺)并且还具体地包括但不限于环氧基(epoxidyl)、氧杂环丁烷基、四氢呋喃基、四氢吡喃基(即oxanyl)、吡喃基、二氧杂环己烷基、氮丙啶基、氮杂环丁烷基、吡咯烷基、2,5-二氢-1h-吡咯基、噁唑烷基、噻唑烷基、哌啶基、吗啉基、哌嗪基、硫代吗啉基、1,3-噁嗪烷基、1,3-噻嗪烷基、2-氮杂双环[2.1.1]己烷基、5-氮杂双环[2.1.1]己烷基、6-氮杂双环[3.1.1]庚烷基、2-氮杂双环[2.2.1]庚烷基、3-氮杂双环[3.1.1]庚烷基、2-氮杂双环[3.1.1]庚烷基、3-氮杂双环[3.1.0]己烷基、2-氮杂双环[3.1.0]己烷基、3-氮杂双环[3.2.1]辛烷基、8-氮杂双环[3.2.1]辛烷基、3-氧杂-7-氮杂双环[3.3.1]壬烷基、3-氧杂-9-氮杂双环[3.3.1]壬烷基、2-氧杂-5-氮杂双环[2.2.1]庚烷基、6-氧杂-3-氮杂双环[3.1.1]庚烷基、2-氮杂螺[3.3]庚烷基、2-氧杂-6-氮杂螺[3.3]庚烷基、2-氧杂螺[3.3]庚烷基、2-氧杂螺[3.5]壬烷基、3-氧杂螺[5.3]壬烷基、以及8-氧杂二环[3.2.1]辛烷基。
如本文所用,术语“芳族”是指具有一个或多个多不饱和环且具有芳族特征(即具有(4n+2)离域π(pi)电子,其中n为整数)的碳环或杂环。
如本文所用,术语“芳基”意指含有1、2或3个环的芳族碳环体系,其中此类环可为稠合的,其中稠合在上文有所定义。如果环是稠合的,一个环必须完全不饱和,并且稠环可完全饱和、部分不饱和或完全不饱和的。术语“芳基”包括但不限于苯基、萘基、茚满基、以及1,2,3,4-四氢萘基。
如本文所用,术语“杂芳基”意指含有1、2、3、或4个独立地选自n、o和s的杂原子且具有1、2、或3个环的芳族碳环体系,其中此类环可为稠合的,其中稠合在上文有所定义。术语“杂芳基”包括但不限于呋喃基、苯硫基、噁唑基、噻唑基、咪唑基、吡唑基、三唑基、四唑基、异噁唑基、异噻唑基、噁二唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、咪唑并[1,2-a]吡啶基、吡唑并[1,5-a]吡啶基、5,6,7,8-四氢异喹啉基、5,6,7,8-四氢喹啉基、6,7-二氢-5h-环戊二烯并[b]吡啶基、6,7-二氢-5h-环戊二烯并[c]吡啶基、1,4,5,6-四氢环戊二烯并[c]吡唑基、2,4,5,6-四氢环戊二烯并[c]吡唑基、5,6-二氢-4h-吡咯并[1,2-b]吡唑基、6,7-二氢-5h-吡咯并[1,2-b][1,2,4]三唑基、5,6,7,8-四氢-[1,2,4]三唑并[1,5-a]吡啶基、4,5,6,7-四氢吡唑并[1,5-a]吡啶基、4,5,6,7-四氢-1h-吲唑基以及4,5,6,7-四氢-2h-吲唑基。
应当理解,如果芳基、杂芳基、环烷基、或杂环烷基部分通过不同的环原子(即在未指示特定连接点情况下所示出或描述的)结合或以其它方式连接至指定部分,则所有可能的点是预期的,无论是通过碳原子,还是例如通过三价氮原子。例如,术语“吡啶基”意指2-、3-或4-吡啶基,术语“苯硫基”意指2-或3-苯硫基等。
如本文所用,术语“取代的”意指原子或原子团作为连接至另一个基团的取代基来取代氢。
i.化合物
本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的核心蛋白变构调节剂(cpam)和逆转录酶抑制剂。在一个实施方案中,cpam是导致hbv壳体异常、缺陷或不完全装配的核心蛋白变构调节剂。在另一个实施方案中,cpam是导致关于其病毒内容物基本上为空的壳体装配的核心蛋白变构调节剂。本文所提供的方法、组合产品、以及组合物包含式i的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及
逆转录酶抑制剂,或其药学上可接受的盐或前药。
其中
a为苯基或吡啶基;
b为单环5-至6-元芳环或杂芳环,其中所述芳环或杂芳环任选地被各自独立地选自卤素或c1-c6烷基的一个或多个取代基所取代;
r1为h或c1-c6烷基;
r2为c1-c6烷基,其中所述c1-c6烷基任选地被各自独立地选自以下的一个或多个取代基所取代:卤素、c1-c6烷氧基、氧代、c1-c6烷基、oh、cn、cfh2、cf2h和cf3;或
r1和r2一起形成c2-c7杂环烷基环,其中所述c2-c7杂环烷基环任选地被各自独立地选自以下的一个或多个取代基所取代:卤素、c1-c6烷氧基、氧代、c1-c6烷基、oh、cn、cfh2、cf2h和cf3;
每个r3独立地选自:卤素、c1-c6烷基、c1-c6烷氧基、氰基、c1-c6烯基、c1-c6炔基、以及oh;并且
n为0、1、2、或3。
在式i的一个实施方案中,b为任选且独立地被卤素或c1-c6烷基取代一次或多次的5-元杂芳环。
在一个实施方案中,式i的化合物为式ia的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,
其中
a为苯基或吡啶基;
r1为h或c1-c6烷基;
r2为c1-c6烷基,其任选地且独立地被卤素、c1-c6烷氧基、氧代、c1-c6烷基、oh、cn、cfh2、cf2h或cf3取代一次或多次;
r3每次出现时独立地为卤素、c1-c6烷基、c1-c6烷氧基、氰基、c1-c6烯基、c1-c6炔基、或oh;
x为cr4;
g3为h或c1-c6烷基;
r4每次出现时独立地为h、卤素、c1-c3烷基、或氰基;并且
n为0、1、2、或3。
在一个实施方案中,式i的化合物为式ib的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,
其中
x为cr或n;
b为c5-c6芳基、c5-c6环烷基、5至6-元杂芳基、或5至6-元杂环基,其全部可任选地被c1-c4烷基或卤素取代;
r1为h或c1-c6烷基;
r2为c1-c6烷基,其任选地且独立地被卤素、c1-c6烷氧基、氧代、c1-c6烷基、oh、cn、cfh2、cf2h或cf3取代一次或多次;
r3每次出现时独立地为卤素、c1-c6烷基、c1-c6烷氧基、氰基、c1-c6烯基、c1-c6炔基、或oh;
r为c1-c4烷基、或卤素;并且
n为0、1、2、或3。
在一个实施方案中,式i的化合物为式ii的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,
其中
r3为卤素;
g1为h、c1-c4烷基、或卤素;
g2选自:h、卤素、c1-c4烷基、以及oh;
n为0、1、2、或3;并且
m为0、1或2。
在另一个实施方案中,式i的化合物为式iiia的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,
其中
r1为h或c1-c6烷基;
r2为c1-c6烷基,其任选地且独立地被卤素、c1-c6烷氧基、氧代、c1-c6烷基、oh、cn、cfh2、cf2h或cf3取代一次或多次;
r3每次出现时独立地为卤素、c1-c6烷基、c1-c6烷氧基、氰基、c1-c6烯基、c1-c6炔基、或oh;
r4为h、卤素、c1-c3烷基、或氰基;并且
在另一个实施方案中,式i的化合物为式iiib的化合物,
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,
其中
r1为h或c1-c6烷基;
r2为c1-c6烷基,其中所述c1-c6烷基任选地被各自独立地选自以下的一个或多个取代基所取代:卤素、c1-c6烷氧基、氧代、c1-c6烷基、oh、cn、cfh2、cf2h和cf3;
每个r3独立地选自:卤素、c1-c6烷基、c1-c6烷氧基、氰基、c1-c6烯基、c1-c6炔基、以及oh;
g3为h或c1-c6烷基;
x为cr4;
r4选自:h、卤素、c1-c3烷基、以及氰基;并且
n为0、1、2、或3。
本文所提供的方法、组合产品、以及组合物可包含化合物1:
化合物1也在本文称为“化合物i”或“化合物(i)”。化合物1(包括其合成)公开于pct公开no.wo/2013/096744中,其全文以引用方式并入本文。
此外,化合物1可以以结晶形式,优选地在暴露于较高温度和湿度时稳定的结晶形式存在。化合物1的各种晶体形式描述于wo/2017/059059中,其全文以引用方式并入本文。
例如,形式(xvi)的化合物1具有如图9所示的x-射线粉末衍射图案。对应的°2-θ值可见于表12中。
因此,在一个实施方案中,化合物1呈结晶形式,该结晶形式的特征在于具有以2-θ度表示在17.1、20.8、22.2、24.9和26.6的角度(±0.2°)处的峰的x-射线粉末衍射图案(形式xvi)。
在另一个实施方案中,结晶形式的特征在于具有以2-θ度表示在14.4、17.1、18.5、20.0、20.8、22.2、23.4、24.9、26.6、28.0和36.4的角度(±0.2°)处的峰的x-射线粉末衍射图案(形式xvi)。
在另一个实施方案中,结晶形式的特征在于具有以2-θ度表示在8.3、10.9、14.4、14.9、15.8、16.5、17.1、18.5、18.9、20.0、20.8、21.6、22.2、22.8、23.4、23.6、24.9、26.6、28.0、28.4、29.6、29.8、30.5、31.2、31.7、32.9、34.2、34.5、35.6、36.4、36.8、38.4、39.7、40.2、41.7、43.6、和44.7的角度(±0.2°)处的峰的x-射线粉末衍射图案(形式xvi)。
在另一个实施方案中,结晶形式的特征在于具有以2-θ度表示在8.33、10.93、14.37、14.92、15.84、16.46、17.07、18.53、18.90、20.02、20.77、21.60、22.16、22.83、23.44、23.63、24.93、26.60、28.00、28.38、29.56、29.77、30.45、31.20、31.70、32.93、34.16、34.54、35.60、36.37、36.75、38.37、39.71、40.17、41.71、43.64、和44.69的角度(±0.2°)处的峰的x-射线粉末衍射图案(形式xvi)。
在一个实施方案中,结晶形式的特征在于与图9的x-射线粉末衍射图案基本上相同的x-射线粉末衍射图案。
形式iii的化合物1的x-射线粉末衍射图案示于图10中。对应的°2-θ值可见于表11中。
在另一方面,本文所提供的方法、组合产品、以及组合物包含化合物2:
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式。化合物2也在本文称为“化合物ii”或“cmpdii”。化合物2(包括其合成)公开于pct公开no.wo2014/184350中,其全文以引用方式并入本天。
在另一方面,本文所提供的方法、组合产品、以及组合物包含化合物3:
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式。化合物3也在本文称为“化合物iii”或“化合物(iii)”。化合物3(包括其合成)公开于pct公开nowo2015/118057中,其全文以引用方式并入本文。
ii.方法
在一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的核心蛋白变构调节剂(cpam)和治疗有效量的逆转录酶抑制剂。在该方法的一个实施方案中,cpam是导致hbv壳体异常、缺陷或不完全装配的核心蛋白变构调节剂。在该方法的另一个实施方案中,cpam是导致关于其病毒内容物基本上为空的壳体装配的核心蛋白变构调节剂。在一个方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i的化合物、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ia的化合物、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ib的化合物、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ii的化合物、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式iiia的化合物、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式iiib的化合物、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1:
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2:
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及
逆转录酶抑制剂,或其药学上可接受的盐或前药。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物3:
或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及
逆转录酶抑制剂,或其药学上可接受的盐或前药。
可使用所述方法治疗的患者在一些实施方案中是人。也可治疗其它温血动物。
在该方法的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、以及拉米夫定,或它们的药学上可接受的盐或前药。替诺福韦的药学上可接受的前药包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一个实施方案中,逆转录酶抑制剂是基于嘌呤的逆转录酶抑制剂。
在一个实施方案中,式i、式ia、式ib、式ii、式iiia或式iiib的化合物以及逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,式i、式ia、式ib、式ii、式iiia或式iiib的化合物以及逆转录酶抑制剂处于分开的制剂中。
在另一个实施方案中,式ia的化合物以及逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,式ia的化合物以及逆转录酶抑制剂处于分开的制剂中。
在另一个实施方案中,式ib的化合物以及逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,式ib的化合物以及逆转录酶抑制剂处于分开的制剂中。
在一个实施方案中,式ii和逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,式ii和逆转录酶抑制剂处于分开的制剂中。
在一个实施方案中,式iii和逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,式iii和逆转录酶抑制剂处于分开的制剂中。
在一个实施方案中,化合物1和逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,化合物1和逆转录酶抑制剂处于分开的制剂中。
在一个实施方案中,化合物2或化合物3以及逆转录酶抑制剂处于同一制剂中。在另一个实施方案中,化合物2或化合物3以及逆转录酶抑制剂处于分开的制剂中。
在该方法的一个实施方案中,患者对用逆转录酶抑制剂治疗是抵抗性或顽固性的。在另一个实施方案中,患者对用核苷试剂治疗是抵抗性或顽固性的。在另一个实施方案中,患者是未接受过治疗的患者。
在一个实施方案中,化合物1以600mg/天至3000mg/天(例如约600mg、约800mg、约1000mg、约1200mg、约1400mg、约1600mg、约1800mg、约2000mg,包括端值在内)的量施用。在一个实施方案中,化合物1以600mg/天至3000mg/天的量施用。在一个具体实施方案中,化合物1以约2000mg/天的量施用。在另一个实施方案中,化合物1以约1000mg的量每天施用两次。
在一个实施方案中,化合物2或化合物3以5mg/天至600mg/天(例如约5mg、约25mg、约50mg、约100mg、约200mg、约300mg、约400mg、约500mg、约600mg,包括端值在内)的量施用。在一个实施方案中,化合物2或化合物3以5mg/天至600mg/天的量施用。在一个具体的实施方案中,化合物2或化合物3以约25mg/天的量施用。在另一个实施方案中,化合物2或化合物3以约10mg每日一次至200mg每日一次的量施用。
在本文提供的一个实施方案中,化合物1呈结晶形式。在另一个实施方案中,结晶形式的特征在于具有以2-θ度表示在17.1、20.8、22.2、24.9和26.6的角度(±0.2°)处的峰的x-射线粉末衍射图案(形式xvi)。
在本文所提供方法的另一个实施方案中,式i、式ia、式ib、式ii、式iiia或式iiib的化合物以及逆转录酶抑制剂的施用发生在短于48周的时间段内。
在本文所提供方法的另一个实施方案中,化合物1以及逆转录酶抑制剂的施用发生在短于48周的时间段内。
在本文所提供方法的另一个实施方案中,化合物2或化合物3以及逆转录酶抑制剂的施用发生在短于48周的时间段内。
在一个实施方案中,患者是慢性hbv-感染的患者(具有或不具有潜在肝脏炎症迹象)。
在一个实施方案中,该方法还包括附加的hbv抗病毒剂的施用。在一个具体的实施方案中,附加的hbv抗病毒剂是聚乙二醇化干扰素α-2a。
在一个方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i、式ia、式ib、式ii、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、它们的结晶形式,其中患者对用逆转录酶抑制剂治疗是抵抗性或顽固性的。
在一个方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,其中患者对用逆转录酶抑制剂治疗是抵抗性或顽固性的。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,其中患者对用逆转录酶抑制剂治疗是抵抗性或顽固性的。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i、式ia、式ib、式ii、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,其中患者对用核苷试剂治疗是抵抗性或顽固性的。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,其中患者对用核苷试剂治疗是抵抗性或顽固性的。
在一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1和替诺福韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i的化合物和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i的化合物和替诺福韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ia的化合物和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ia的化合物和替诺福韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ib的化合物和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ib的化合物和替诺福韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ii的化合物和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式ii的化合物和替诺福韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式iiia的化合物和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式iiia的化合物和替诺福韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式iiib的化合物和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式iiib的化合物和替诺福韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2和替诺福韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物3和恩替卡韦。
在另一个实施方案中,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物3和替诺福韦。
在用于治疗hbv感染的一个实施方案中,化合物1以600mg/天至3000mg/天(例如约600mg、约800mg、约1000mg、约1200mg、约1400mg、约1600mg、约1800mg、约2000mg)的量施用。在另一个实施方案中,化合物1以600mg/天至2000mg/天的量施用。在另一个实施方案中,化合物1以约2000mg/天的量施用。在该实施方案的一个实施方案中,化合物1以约1000mg的量每天施用两次。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,其中患者对用核苷试剂治疗是抵抗性或顽固性的。
在用于治疗hbv感染的一个实施方案中,化合物2或化合物3以5mg/天至600mg/天(例如约5mg、约25mg、约50mg、约100mg、约200mg、约300mg、约400mg、约500mg、约600mg)的量施用。在另一个实施方案中,化合物2或化合物3以5mg/天至600mg/天的量施用。在另一个实施方案中,化合物2或化合物3以约25mg/天的量施用。在该实施方案的一个实施方案中,化合物2或化合物3以约10mg每日一次至200mg每日一次的量施用。
在这些方法的另一个实施方案中,式i、式ia、式ib、式ii、式iiia或式iiib的化合物以及逆转录酶抑制剂的施用发生在短于48周的时间段内。
在这些方法的另一个实施方案中,化合物1以及逆转录酶抑制剂的施用发生在短于48周的时间段内。
在这些方法的另一个实施方案中,化合物2或化合物3以及逆转录酶抑制剂的施用发生在短于48周的时间段内。
在另一个实施方案中,患者是慢性hbv-感染的患者(具有或不具有潜在肝脏炎症迹象)。
在一个方面,本文提供了一种抑制核苷抗性hbv变体复制的方法,包括使所述变体与有效量的式i、式ia、式ib、式ii、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式接触。
在一个方面,本文提供了一种抑制核苷抗性hbv变体复制的方法,包括使所述变体与有效量的化合物1、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式接触。在另一方面,本文提供了一种抑制核苷抗性hbv变体复制的方法,包括使所述变体与有效量的化合物2或化合物3或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们结晶形式相接触。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i、式ia、式ib、式ii、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及化合物a,
或其药学上可接受的盐。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及化合物a或其药学上可接受的盐。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及化合物a或其药学上可接受的盐。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i、式ia、式ib、式ii、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及恩替卡韦或其药学上可接受的盐。在一个实施方案中,式i、式ia、式ib、式ii、式iiia或式iiib的化合物和恩替卡韦以产生协同效应的剂量和时间间隔施用。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及恩替卡韦或其药学上可接受的盐。在一个实施方案中,化合物1和恩替卡韦以产生协同效应的剂量和时间间隔施用。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及恩替卡韦或其药学上可接受的盐。在一个实施方案中,化合物2和恩替卡韦以产生协同效应的剂量和时间间隔施用。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物3、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及恩替卡韦或其药学上可接受的盐。在一个实施方案中,化合物3和恩替卡韦以产生协同效应的剂量和时间间隔施用。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的式i、式ia、式ib、式ii、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及替诺福韦或其药学上可接受的盐或前药。在一个实施方案中,替诺福韦是替诺福韦地索普西富马酸盐或替诺福韦艾拉酚胺富马酸盐。在另一个实施方案中,式i、式ia、式ib、式ii、式iiia或式iiib的化合物以及替诺福韦以产生协同效应的剂量和时间间隔施用。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物1、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及替诺福韦或其药学上可接受的盐或前药。在一个实施方案中,替诺福韦是替诺福韦地索普西富马酸盐或替诺福韦艾拉酚胺富马酸盐。在另一个实施方案中,化合物1和替诺福韦以产生协同效应的剂量和时间间隔施用。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物2、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及替诺福韦或其药学上可接受的盐或前药。在一个实施方案中,替诺福韦是替诺福韦地索普西富马酸盐或替诺福韦艾拉酚胺富马酸盐。在另一个实施方案中,化合物2和替诺福韦以产生协同效应的剂量和时间间隔施用。
在另一方面,本文提供了一种在对其有需要的患者中治疗hbv感染的方法,包括向患者施用治疗有效量的化合物3、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及替诺福韦或其药学上可接受的盐或前药。在一个实施方案中,替诺福韦是替诺福韦地索普西富马酸盐或替诺福韦艾拉酚胺富马酸盐。在另一个实施方案中,化合物3和替诺福韦以产生协同效应的剂量和时间间隔施用。
在一个实施方案中,本文提供了用于治疗的核心蛋白变构调节剂(cpam)以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于治疗的式i的化合物以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于治疗的式ib的化合物以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于治疗的化合物1以及逆转录酶抑制剂。
在另一个实施方案中,本文提供了用于治疗的化合物2以及逆转录酶抑制制。
在另一个实施方案中,本文提供了用于治疗的化合物3以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的核心蛋白变构调节剂(cpam)以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式i的化合物以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式ia的化合物以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式ib的化合物以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式ii的化合物以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式iiia的化合物以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式iiib的化合物以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的化合物1以及逆转录酶抑制剂。
在另一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的化合物2以及逆转录酶抑制剂。
在另一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的化合物3以及逆转录酶抑制剂。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的核心蛋白变构调节剂(cpam),其中cpam用于与逆转录酶抑制剂联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式i的化合物,其中式i的化合物用于与逆转录酶抑制剂联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式ia的化合物,其中式ia的化合物用于与逆转录酶抑制剂联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式ib的化合物,其中式ib的化合物用于与逆转录酶抑制剂联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式ii的化合物,其中式ii的化合物用于与逆转录酶抑制剂联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式iiia的化合物,其中式iiia的化合物用于与逆转录酶抑制剂联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的式iiib的化合物,其中式iiib的化合物用于与逆转录酶抑制剂联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的化合物1,其中化合物1用于与逆转录酶抑制剂联合使用。
在另一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的化合物2,其中化合物2用于与逆转录酶抑制剂联合使用。
在另一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的化合物3,其中化合物3用于与逆转录酶抑制剂联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与核心蛋白变构调节剂(cpam)联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与式i的化合物联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与式ia的化合物联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与化合物1联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与核心蛋白变构调节剂(cpam)联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与式i的化合物联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与式ia的化合物联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与式ib的化合物联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与式ii的化合物联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与式iiia的化合物联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与式iiib的化合物联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与化合物1联合使用。
在另一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与化合物2联合使用。
在另一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的逆转录酶抑制剂,其中逆转录酶抑制剂用于与化合物3联合使用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的核心蛋白变构调节剂(cpam)以及逆转录酶抑制剂,其中cpam以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的式i的化合物以及逆转录酶抑制剂,其中式i的化合物以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的式ia的化合物以及逆转录酶抑制剂,其中式ia的化合物以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的式ib的化合物以及逆转录酶抑制剂,其中式ib的化合物以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的式ii的化合物以及逆转录酶抑制剂,其中式ii的化合物以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的式iiia的化合物以及逆转录酶抑制剂,其中式iiia的化合物以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的式iiib的化合物以及逆转录酶抑制剂,其中式iiib的化合物以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的化合物1以及逆转录酶抑制剂,其中化合物1以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在另一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的化合物2以及逆转录酶抑制剂,其中化合物2以及逆转录酶抑制剂用于同时、顺序、或分开施用。
在另一个实施方案中,本文提供了用于在对其有需要的患者中治疗hbv感染的联合治疗中的化合物3以及逆转录酶抑制剂,其中化合物3以及逆转录酶抑制剂用于同时、顺序、或分开施用。
就约60至约70kg的平均体重而言计算本文所述日剂量,并且应当在儿科应用的情况下,或者在用于体重大幅度变换的患者时重新计算。
iii.组合产品和组合物
在一个方面,本文提供了一种包含核心蛋白变构调节剂(cpam)和逆转录酶抑制剂的组合产品。在组合产品的一个实施方案中,cpam是导致hbv壳体异常、缺陷或不完全装配的核心蛋白变构调节剂。在组合产品的另一个实施方案中,cpam是导致关于其病毒内容物基本上为空的壳体装配的核心蛋白变构调节剂。在式i、式ia、式ib、式ii、式iiia或式iiib的组合产品的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在实施方案中,组合产品包含至少化合物1、或其药学上可接受的盐、其水合物、其溶剂化物,以及恩替卡韦。
在实施方案中,组合产品包含至少化合物1或其药学上可接受的盐、其水合物、其溶剂化物,以及替诺福韦。
在实施方案中,组合产品包含至少一种式i的化合物以及恩替卡韦。
在实施方案中,组合产品包含至少一种式i的化合物以及替诺福韦。
在实施方案中,组合产品包含至少一种式ia的化合物以及恩替卡韦。
在实施方案中,组合产品包含至少一种式ia的化合物以及替诺福韦。
在实施方案中,组合产品包含至少一种式ib的化合物以及恩替卡韦。
在实施方案中,组合产品包含至少一种式ib的化合物以及替诺福韦。
在实施方案中,组合产品包含至少一种式ii的化合物以及恩替卡韦。
在实施方案中,组合产品包含至少一种式ii的化合物以及替诺福韦。
在实施方案中,组合产品包含至少一种式iiia的化合物以及恩替卡韦。
在实施方案中,组合产品包含至少一种式iiia的化合物以及替诺福韦。
在实施方案中,组合产品包含至少一种式iiib的化合物以及恩替卡韦。
在实施方案中,组合产品包含至少一种式iiib的化合物以及替诺福韦。
在实施方案中,组合产品包含至少化合物1、或其药学上可接受的盐、其水合物、其溶剂化物,以及恩替卡韦。
在实施方案中,组合产品包含至少化合物1或其药学上可接受的盐、其水合物、其溶剂化物,以及替诺福韦。
在实施方案中,组合产品包含至少化合物2、或其药学上可接受的盐、其水合物、其溶剂化物,以及恩替卡韦。
在实施方案中,组合产品包含至少化合物2或其药学上可接受的盐、其水合物、其溶剂化物,以及替诺福韦。
在实施方案中,组合产品包含至少化合物3、或其药学上可接受的盐、其水合物、其溶剂化物,以及恩替卡韦。
在实施方案中,组合产品包含至少化合物3或其药学上可接受的盐、其水合物、其溶剂化物,以及替诺福韦。
在一个方面,本文提供了一种组合产品,该组合产品包含化合物1、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在组合产品的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在组合产品的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、以及拉米夫定,或它们的药学上可接受的盐。替诺福韦的药学上可接受的前药包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一方面,本文提供了一种组合产品,该组合产品包含化合物2、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在化合物2的组合产品的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一方面,本文提供了一种组合产品,该组合产品包含化合物3、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在化合物3的组合产品的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在组合产品的一个实施方案中,化合物1以及逆转录酶抑制剂处于同一制剂中。在组合产品的另一个实施方案中,化合物1以及逆转录酶抑制剂处于分开的制剂中。在该实施方案的另一个实施方案中,制剂用于同时或顺序施用。
在组合产品的一个实施方案中,化合物2或化合物3以及逆转录酶抑制剂处于同一制剂中。在组合产品的另一个实施方案中,化合物2或化合物3以及逆转录酶抑制剂处于分开的制剂中。在该实施方案的另一个实施方案中,制剂用于同时或顺序施用。
在一个实施方案中,组合产品用于在患者中治疗hbv感染。
在一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者对用逆转录酶抑制剂治疗是抵抗性的。在另一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者对用核苷试剂治疗是抵抗性的。
在一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者未接受过治疗。
在一个实施方案中,化合物2或化合物3的组合产品用于在患者中治疗hbv感染。
在一个实施方案中,化合物2或化合物3的组合产品用于在患者中治疗hbv感染,其中患者对用逆转录酶抑制剂治疗是抵抗性的。在另一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者对用核苷试剂治疗是抵抗性的。
在一个实施方案中,化合物2或化合物3的组合产品用于在患者中治疗hbv感染,其中患者未接受过治疗。
在一个实施方案中,组合产品用于在患者中治疗hbv感染,其中患者是慢性hbv感染的患者(具有或不具有潜在肝脏炎症迹象)。
在组合产品的一个实施方案中,化合物1的量为600mg至3000mg(例如约600mg、约800mg、约1000mg、约1200mg、约1400mg、约1600mg、约1800mg、约2000mg)。在组合产品的另一个实施方案中,化合物1的量为600mg至2000mg。在组合产品的另一个实施方案中,化合物1的量为约2000mg。在组合产品的另一个实施方案中,化合物1的量为约1000mg。
在组合产品的一个实施方案中,化合物2或化合物3的量为5mg至600mg(例如约5mg、约25mg、约50mg、约100mg、约200mg、约300mg、约400mg、约500mg、约600mg)。在组合产品的另一个实施方案中,化合物2或化合物3的量为5mg至600mg。在组合产品的另一个实施方案中,化合物2或化合物3的量为约25mg。在组合产品的另一个实施方案中,化合物2或化合物3为10mg至200mg。
在组合产品的一个实施方案中,化合物1呈结晶形式。在另一个实施方案中,结晶形式的特征在于具有以2-θ度表示在17.1、20.8、22.2、24.9和26.6的角度(±0.2°)处的峰的x-射线粉末衍射图案(形式xvi)。
在一个实施方案中,组合产品还包含附加的hbv抗病毒剂。在一个实施方案中,附加的hbv抗病毒剂是聚乙二醇化干扰素α-2a。
在一个方面,本文提供了一种组合产品,该组合产品包含化合物1或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在组合产品的一个实施方案中,cpam与逆转录酶抑制剂的比率在700∶1-1∶40的范围内。在另一个实施方案中,cpam与逆转录酶抑制剂的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在一个方面,本文提供了一种组合产品,该组合产品包含式i、式ia、式ib、式ii、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在组合产品的一个实施方案中,式i与逆转录酶抑制剂的比率在700∶1-1∶40的范围内。在组合产品的另一个实施方案中,式i与逆转录酶抑制剂的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3:1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在组合产品的一个实施方案中,式ia与逆转录酶抑制剂的比率在700∶1-1∶40的范围内。在组合产品的另一个实施方案中,式i与逆转录酶抑制剂的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在组合产品的一个实施方案中,式ib与逆转录酶抑制剂的比率在700∶1-1∶40的范围内。在组合产品的另一个实施方案中,式i与逆转录酶抑制剂的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在组合产品的一个实施方案中,式ii与逆转录酶抑制剂的比率在700∶1-1∶40的范围内。在组合产品的另一个实施方案中,式i与逆转录酶抑制剂的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在组合产品的一个实施方案中,式iiia与逆转录酶抑制剂的比率在700∶1-1∶40的范围内。在组合产品的另一个实施方案中,式i与逆转录酶抑制剂的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1:2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在组合产品的一个实施方案中,式iiib与逆转录酶抑制剂的比率在700∶1-1∶40的范围内。在组合产品的另一个实施方案中,式i与逆转录酶抑制剂的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在组合产品的一个实施方案中,化合物1与恩替卡韦的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在组合产品的一个实施方案中,化合物1与替诺福韦的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2;在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1;在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1;或在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。
在组合产品的一个实施方案中,化合物2与恩替卡韦的比率在200∶1至1∶40,例如200∶1、175∶1、150∶1、125∶1、100∶1、90∶1、80∶1、70∶1、60∶1、50∶1、40∶1、30∶1、20∶1、15∶1、10∶1、8∶1、5∶1、2∶1、1∶1、1∶2、1∶5、1∶8、1∶10、1∶15、1∶20、1∶30、或1∶40的范围内。在组合产品的另一个实施方案中,化合物2与恩替卡韦的比率在40∶1至1∶1的范围内,例如40∶1、30∶1、20∶1、10∶1、8∶1、6∶1、4∶1、2∶1、或1∶1。在组合产品的另一个实施方案中,化合物2与恩替卡韦的比率在30∶1至10∶1的范围内,例如30∶1、20∶1或10∶1。在组合产品的另一个实施方案中,化合物2与恩替卡韦的比率为20∶1。
在组合产品的一个实施方案中,化合物2与替诺福韦的比率在40∶1至1∶40的范围内,例如40∶1、30∶1、20∶1、15∶1、10∶1、8∶1、5∶1、2∶1、1∶1、1∶2、1∶5、1∶8、1∶10、1∶15、1∶20、1∶30、或1∶40。在组合产品的另一个实施方案中,化合物2与替诺福韦的比率在10∶1至1∶1的范围内,例如10∶1、8∶1、6∶1、4∶1、2∶1、或1∶1。在组合产品的另一个实施方案中,化合物2与替诺福韦的比率在3∶1至1∶1的范围内,例如3∶1、2∶1或1∶1。在组合产品的另一个实施方案中,化合物2与替诺福韦的比率为2∶1。
在组合产品的一个实施方案中,化合物3与恩替卡韦的比率在700∶1至1∶30的范围内,例如700∶1、600∶1、500∶1、400∶1、300∶1、200∶1、190∶1、180∶1、170∶1、160∶1、150∶1、140∶1、130∶1、120∶1、110∶1、100∶1、20∶1、15∶1、10∶1、8∶1、5∶1、2∶1、1∶1、1∶2、1∶5、1∶8、1∶10、1∶15、或1∶20。在组合产品的另一个实施方案中,化合物3与恩替卡韦的比率在180∶1至1∶2的范围内,例如180∶1、170∶1、160∶1、150∶1、140∶1、130∶1、120∶1、110∶1、100∶1、50∶1、20∶1、10∶1、1∶1、或1∶2。在组合产品的另一个实施方案中,化合物3与恩替卡韦的比率在170∶1至150∶1的范围内,例如170∶1、160∶1或150∶1。在组合产品的另一个实施方案中,化合物3与恩替卡韦的比率为160∶1。
在组合产品的一个实施方案中,化合物3与替诺福韦的比率在80∶1至1∶10的范围内,例如80∶1、70∶1、60∶1、50∶1、40∶1、30∶1、20∶1、15∶1、10∶1、1∶1、或1∶10。在组合产品的另一个实施方案中,化合物3与替诺福韦的比率在10∶1至1∶10的范围内,例如10∶1、8∶1、6∶1、4∶1、2∶1、1∶1、1∶2、1∶4、1∶6、1∶8、以及1∶10。在组合产品的另一个实施方案中,化合物3与替诺福韦的比率在2∶1至1∶2的范围内,例如2∶1、1∶1、或1∶2。在组合产品的另一个实施方案中,化合物3与替诺福韦的比率为1∶1。
在另一方面,本文提供了一种药物组合物,该药物组合物包含化合物1、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在药物组合物的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦(包括例如其前药,诸如替诺福韦地索普西和替诺福韦艾拉酚胺)以及拉米夫定、或它们的药学上可接受的盐。
在另一个实施方案中,药物组合物还包含一种或多种药学上可接受的载体。
在另一方面,本文提供了一种药物组合物,该药物组合物包含式i、式ia、式ib、式ii、式iiia或式iiib的化合物、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在式i、式ia、式ib、式ii、式iiia或式iiib的药物组合物的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一个实施方案中,式i、式ia、式ib、式ii、式iiia或式iiib的药物组合物还包含一种或多种药学上可接受的载体。
在另一方面,本文提供了一种药物组合物,该药物组合物包含化合物1、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在化合物1的药物组合物的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一个实施方案中,化合物1的药物组合物还包含一种或多种药学上可接受的载体。
在另一方面,本文提供了一种药物组合物,该药物组合物包含化合物2、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在化合物2的药物组合物的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一个实施方案中,化合物2的药物组合物还包含一种或多种药学上可接受的载体。
在另一方面,本文提供了一种药物组合物,该药物组合物包含化合物3、或其药学上可接受的盐、其水合物、其溶剂化物、或其结晶形式,以及逆转录酶抑制剂、或其药学上可接受的盐。
在化合物3的药物组合物的一个实施方案中,逆转录酶抑制剂选自恩替卡韦、替诺福韦、拉米夫定、替比夫定、阿德福韦、克拉夫定、cmx157、agx-1009、齐多夫定、地达诺新、扎西他滨、司他夫定、恩曲他滨、阿巴卡韦、d-d4fc、阿洛夫定、氨多索韦、艾夫他滨、地拉夫定、依法韦仑、奈韦拉平、卡普韦林、胡桐内酯a、tmc278、bms-561390、以及dpc-083,或它们的前药以及它们的药学上可接受的盐。替诺福韦的药学上可接受的前药例如包括替诺福韦地索普西富马酸盐和替诺福韦艾拉酚胺富马酸盐。
在另一个实施方案中,化合物3的药物组合物还包含一种或多种药学上可接受的载体。
在另一方面,本公开提供了一种用于治疗hbv感染的药盒,该药盒包含cpam、化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式(量为600mg/天至3000mg/天),以及逆转录酶抑制剂。在另一个实施方案中,本公开提供了一种用于治疗hbv感染的药盒,该药盒包含由以下项组成的组中的至少两种或更多种:cpam、化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式(量为600mg/天至3000mg/天);逆转录酶抑制剂;以及附加的hbv抗病毒剂。在一些实施方案中,药盒还包括包装和说明书。在某些实施方案中,药盒包括药物产品,该药物产品包含含有cpam、化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及药学上可接受的载体或稀释剂的药物组合物;以及包含逆转录酶抑制剂和药学上可接受的载体或稀释剂的药物组合物。
在一些实施方案中,药盒包括药物组合物,该药物组合物包含cpam、化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式;附加的hbv抗病毒剂;以及药学上可接受的载体或稀释剂。在另一个实施方案中,药盒包括药物产品,该药物产品包含:
包含600mg至3000mg的量的cpam、化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及药学上可接受的载体或稀释剂的药物组合物;以及
逆转录酶抑制剂;
用于容纳药物组合物的密封容器;
用于容纳逆转录酶抑制剂的密封容器;以及
使用说明。
在另一个实施方案中,药盒包括药物产品,该药物产品包含由以下项组成的组中的至少两种或更多种:
包含600mg至3000mg的量的cpam、化合物1、化合物2、或化合物3、或它们的药学上可接受的盐、它们的水合物、它们的溶剂化物、或它们的结晶形式,以及药学上可接受的载体或稀释剂的药物组合物;
逆转录酶抑制剂;以及
附加的hbv抗病毒剂;
其还包括:
用于容纳药物组合物的密封容器;
用于容纳干扰素的密封容器;以及
使用说明。
在附加实施方案中,提供了药物盒。药盒包括被批准用于储存药物组合物的密封容器,所述容器包含上述药物组合物中的一种。在一些实施方案中,密封容器使空气与成分的接触最小化,例如真空瓶。在其它实施方案中,密封容器是密封管。组合物使用和关于组合物信息的说明书包括在药盒中。
实施例:
实施例1——化合物1针对拉米夫定-、替诺福韦-、以及恩替卡韦-抗性hbv变体的抗病毒活性
在该实施例中,化合物1的抗病毒活性使用经质粒表达复制型hbvdna瞬时转染的hepg2肝细胞来测定,并且定量细胞内衣壳化hbvdna。针对核苷抑制剂敏感性野生型hbv,以及针对对包含如下逆转录酶蛋白的编码序列中的限定氨基酸变化的核苷类似物是抵抗性的hbv变体,测量化合物1的抗病毒活性:rtl180m/m204v、rtn236t、rta181v、rta181v/n236t、以及rtl180m/m204v/n236t。
实施例1.1——材料和方法
化合物
对化合物1进行合成。拉米夫定(lmv)、恩替卡韦(etv)、以及替诺福韦地索普西富马酸盐(tdf)购自torontoresearchchemicals(toronto,canada),其化学结构分别在下文示为化合物(iv)、(v)和(vi)。
hbv质粒
在lmv治疗之前(genbankay220698,中国复旦大学;seqidno:1,参见表1)且在发展出对lmv的抗性之后(genbankay220697,中国复旦大学;seqidno:2,参见表1)(zhangjm等人2005.jmedvirol77:203-208),将包含1.1xhbv基因组的质粒dna构建体在cmv启动子控制下预先从hbv感染的患者的血清进行克隆。基因分型分析证实,两种分离物均属于基因型bhbv,并且在发展出对lmv的抗性之后所收集的分离物在聚合酶基因之内包含两种氨基酸变化(l180m/m204v)。hbv变体称为rtl180m/m204v,以指示氨基酸变化存在于逆转录酶(rt)蛋白中。通过引入编码序列变化产生两种附加的质粒,从而分别导致hbv聚合酶中的氨基酸变化n236t和a181v。根据制造商推荐(agilenttechnologies;santaclara,ca;目录#200519),使用以下引物及其对应的反向互补序列(核苷酸变化加有下划线),通过定点诱变将核苷酸变化引入野生型基因型b质粒中:5’-ctttgggtatacatttaacccctcacaaaac-3’(rtn236t;seqidno:3)、5’-gtccgtttctcttggttcagtttactagtg-3’(rta181v;seqidno:4)。在两种附加的质粒构建体中,另外将rtn236t氨基酸变化加入rta181v和rtl180m/m204v质粒中,以分别产生rta181v/n236t双突变和rtl180m/m204v/n236t三突变hbv变体。在所有质粒中测序全长hbv基因组,以证实仅预期的核苷酸变化存在于最终hbv表达构建体中。
表1
质粒构建体的hbv基因组序列
细胞培养
hepg2细胞获自美国典型培养物保藏中心(manassas,va;atcc目录#hb-8065)并维持于37℃和5%co2的潮湿培养箱中的包含dulbecco改良的eagle培养基(dmem)(fisherscientific(lifetechnologies);waltham,ma;目录#11995-065)、10%胎牛血清(fbs)(lifetechnologies,目录#10082-147)、100单位/ml青霉素、10μg/ml链霉素、以及0.25μg/ml的二性霉素b(lifetechnologies,目录#15240-062)的完全培养基中。
瞬时转染
将hepg2细胞以20,000个细胞/孔的密度接种到胶原蛋白包被的96孔板(biocoattm;fisherscientific,目录#354407)中并允许在37℃和5%co2下附着过夜。根据制造商的推荐使用lipofectamineltxplus转染试剂(lifetechnologies,目录#15338-100),将细胞与hbv质粒(100ng/孔)和gaussia表达质粒(10ng/孔)(thermoscientifictm,fisherscientific,目录#16148)进行共转染。次日移除转染混合物,将细胞用10完全培养基洗涤两次并用连续稀释的化合物以0.5%的最终二甲基亚砜(dmso)浓度进行处理。将细胞与化合物一起温育三天,然后从细胞中提取细胞内hbvdna,并使用gaussiaflash荧光素酶测定试剂盒(thermoscientifictm,fisherscientific,目录#16158)从培养基测定所分泌的gaussian荧光素酶水平。为了提取细胞内hbvdna,将细胞用100μldulbecco磷酸盐缓冲盐水(lifetechnologies,目录#14190-144)洗涤一次,并通过在室温下温育30分钟(110μl/孔)用0.33%np-40(thermoscientifictm,fisherscientific,目录#85124)裂解。turbodna酶经5倍稀释到turbodna酶缓冲液(lifetechnologies,目录#am2238)中进行制备,并且s7核酸酶(roche目录#10-107-921-001,购自sigma-aldrich;st.louis,mo)经50倍稀释到包含25μmcacl2(gbiosciences;st.louis,mo;目录#r033)的
(e1):抑制%=(dmso平均-xi)/dmso平均×100%
其中dmso平均为从经dmso对照(0%抑制对照)处理的孔计算的信号平均值,并且xi为从各个孔测量的信号。ec50值(实现50%抑制作用的有效浓度)通过非线性拟合使用graphpadprism软件(sandiego,ca)和公式e2进行测定。
(e2):y=y最小+(y最大-y最小)/(1+10(logec50-x)×hillslope)
其中y表示抑制百分比值,并且x表示化合物浓度的对数。
为了测定hbv变体的复制能力,使用gaussian荧光素酶活性值对得自quantigene测定的hbvdna的背景校正值进行规一化,以便考虑转染效率的任何差异。然后,将获自经hbv变体转染的细胞的归一化hbvdna值与获自野生型hbv转染的那些进行比较,野生型hbv复制能力设定为100%。
实施例1.2——核苷抗性hbv变体的相对复制能力
产生五种hbv表达质粒,以代表最常在用核苷药物治疗的hbv感染的患者中观察到的一组核苷抗性hbv变体。hbv核苷抗性组由五种hbv变体组成,在hbv聚合酶蛋白中具有以下单个、两个、或三个突变:(1)l180m/m204v,(2)n236t,(3)a181v,(4)a181v/n236t,以及(5)l180m/m204v/n236t。将a181v、n236t和a181v/n236t引入获自基因型b临床分离物(genbankay220698)的hbvdna的主链中。a181v、n236t和a181v/n236t变体的测序证实了在野生型基因型bhbv构建体之内的预期氨基酸变化。为了产生三突变体,将n236t引入获自lmv抗性临床分离物(genbankay220697;seqidno:5(参见表1))的hbvdna的主链中。先前已报道,相比于lmv治疗之前获得的分离物,lmv抗性临床分离物在hbv基因组之内包含多个附加氨基酸变化(zhangjm等人2005.jmedvirol77∶203-208)。对l180m/m204v和l180m/m204v/n236t变体测序证实:在逆转录酶结构域内的271位存在一个附加的氨基酸变化,其与得自lmv抗性临床分离物(genbankay220697;seqidno:5)的所公布序列一致。
使用这些质粒来转染hepg2细胞,并且在转染后第3天对hbv复制所形成的细胞内衣壳化hbvdna的量进行定量。将gaussia荧光素酶表达质粒与hbv(gaussia-luc:hbv,1∶10比率)共转染,以允许对转染效率的任何差异归一化。在经野生型hbv转染的细胞中所获得的归一化hbvdna信号被定义为100%相对复制能力。n236t变体示出与野生型hbv类似的复制能力,而其它四种变体示出相比于野生型类似或多至高出两倍的复制能力。所有hbv变体的复制能力适于核苷类似物和化合物1的抗病毒活性研究。
实施例1.3——hbv变体对核苷类似物是抵抗性的但对化合物1保持敏感
首先,评价具有核苷抗性突变的hbv变体对核苷类似物抑制作用的易感性。可以从公布的数据预知(yang等人2005.antivirther10:625-633;brunelle等人2005.hep41:1391-1398),rtl180m/m204v和rtl180m/m204v/n236thbv变体均对拉米夫定(lmv)和恩替卡韦(etv)的抑制是抵抗性的:lmv以0.53μm的平均ec50值抑制野生型hbv,但多至最高浓度的受试lmv(100μm)不抑制两种变体中任一者的复制,同时etv针对rtl180m/m204v和rtl180m/m204v/n236t变体的抗病毒活性分别下降31-和14-倍(图1和表2)。
表2
化合物1、lmv、etv和tdf在经核苷抗性变体瞬时转染的hepg2细胞中的抗病毒活性
ec50和倍数变化示为至少三次独立研究的平均值±标准偏差(sd)。*由突变变体相对于野生型ec50平均值的各个倍数变化值计算的平均倍数变化和倍数变化sda相比于野生型,t检验p值<0.01;bt检验p值<0.05;nst检验p值>0.05。
替诺福韦地索普西富马酸盐(tdf)显示出针对野生型hbv以及rtl180m/m204v和rta181v变体类似的抗病毒活性(平均ec50值分别为0.032,0.034和0.043μm),但却显示出针对包含单独的或与rtl180m/m204v或rta181v组合的rtn236t突变的hbv变体的抗病毒活性平均下降2.2至2.9倍(图1;表2)。与n236t突变相关的这些相对倍数变化类似于此前公布的倍数变化值(delaney等人2006.antimicrobagentschemother50:2471-2477)。
类似于野生型hbv,包含rtn236t突变的hbv对lmv和etv的抑制保持敏感(表2)。当针对rta181v变体测试时,观察到lmv和etv的ec50平均值的略微增加(约2-倍)(表2)。rtn236t与rta181v突变结合到双突变变体中分别导致lmv和etv的ec50值提高平均4.8-倍和1.8-倍(表2)。
所有五种核苷抗性hbv变体对化合物1的抑制敏感,其中抗病毒ec50值类似于野生型hbv。平均ec50倍数变化的范围为0.82至1.4-倍,这指示赋予核苷抗性的此处所测试的突变不赋予对hbv核心抑制剂化合物1的交叉抗性(表2)。
如该实施例中所示,使用经核苷类似物瞬时转染的hepg细胞的表型分析测定示出交叉抗性可存在于不同类别的核苷类似物(包括lmv、etv和tdf)中。相比之下,化合物1对核苷抗性变体保持活性,并因此缺乏与核苷类似物的交叉抗性。
实施例2——原代人肝细胞在单独或组合的化合物1和核苷类似物存在下的活力
在该实施例中,在单独或组合的化合物1和核苷类似物存在下测定原代人肝细胞(phh)的活力。细胞活力被测定为经化合物处理的细胞相比于未经处理的细胞中的细胞内atp浓度的相对浓度。phh活力在未经处理的细胞和用300μm拉米夫定(lmv)、30μm替诺福韦(tfv)、或30μm恩替卡韦(etv)处理的细胞中较为类似。在用化合物1处理的细胞中观察到细胞活力的剂量依赖性减小;平均cc50值的范围为16至82μm。在300μm拉米夫定(lmv)、30μm替诺福韦(tfv)、或30μm恩替卡韦(etv)存在下用化合物1获得的cc50值类似于单独地用化合物1处理细胞时获得的那些。
实施例2.1——材料和方法
化合物
对化合物1进行合成。拉米夫定、替诺福韦和恩替卡韦购自torontoresearchchemicals(toronto,canada)。
细胞培养
得自单个供体的冷冻保存的原代人肝细胞(原代肝细胞id:hum4038、hum4055a和hum4059)购自triangleresearchlabs(trl;researchtrianglepark,nc)。根据制造商的推荐,利用肝细胞解冻培养基(trl,目录#mcht50)使细胞解冻。在离心之后,使细胞重悬于补充的肝细胞平板培养基(trl,目录#mp250)中。将细胞以40,000个细胞/孔的密度铺板到i型胶原蛋白包被的96-孔板(corning;corning,ny;目录#356407)中,并在添加受试化合物之前维持于37℃和5%co2的潮湿培养箱中过夜。
细胞活力测定
对于各个供体,设置三个96-孔板,以评价增大浓度的单独或与核苷类似物组合的化合物1对肝细胞活力的效应。在各个板上,将细胞与单独的化合物1一式两份一起温育,或与化合物1在lmv、tfv、或etv存在下一式三份一起温育。另外对各个供体一式三份测定单独的核苷类似物对肝细胞活力的效应。将化合物1半对数连续稀释于dmso(sigma,目录#d2650)中,并且单独地或与lmv(30和300μm)、tfv(30μm)、或etv(30μm)组合添加至原代人肝细胞中。将单一和组合药物以跨越所有浓度下0.5%的最终dmso(sigmad2650)浓度添加至原代人肝细胞中。将细胞用化合物温育三天,其后移除培养基并添加包含化合物的新鲜培养基并再温育三天。作为不含化合物的对照,用0.5%dmso处理原代人肝细胞,这些值随后被用于定义0%抑制水平。背景信号测定为来自仅包含培养基的孔的平均值。根据制造商的方案通过使用celltiter-glo细胞活力试剂(promega;madison,wi;g7573),对细胞活力进行监测。通过使用victorx4读板机(perkinelmer;waltham,ma)来测量与细胞atp的量成比例的化学发光信号。从所有其它样品减去来自仅含培养基的孔的背景信号平均值,并且使用公式e1(如实施例1中)来计算抑制百分比:
(e1):抑制%=(dmso平均-xi)/dmso平均×100%
其中dmso平均为从经0.5%dmso对照(0%抑制对照)处理的孔计算的信号平均值,并且xi为从各个孔测量的信号。使用graphpadprism软件和公式e3,通过非线性拟合由不同化合物浓度下获得的抑制%数据来确定cc50值,该情况为最高测试浓度下抑制%值超过50%。
(e3):y=y最小+(y最大-y最小)/(1+10(logcc50-x)×hillslope)
其中y表示抑制百分比值,并且x表示化合物浓度的对数。
实施例2.2——使用原代人肝细胞情况下化合物1或核苷类似物对细胞活力的效应
将得自三种不同供体(trlhum4038,hum4055a和hum4059)的原代人肝细胞与增大浓度的化合物1一起温育。另外将得自相同三种供体的细胞与lmv(30和300μm)、tfv(30μm)或etv(30μm)一起温育。细胞活力的分析基于药物处理6天之后的细胞内atp水平。当肝细胞与化合物1一起温育时,细胞活力存在浓度依赖性减小:化合物1的cc50值的范围为16μm至82μm(表3)。使用新鲜(bioreclamationivt)和冷冻保存的原代肝细胞(供体trlhum4038和invitrogenhu1457)的化合物1的先前所报道的cc50值的范围为14至27μm。当用30μm或300μmlmv、30μmtfv、或30μmetv处理肝细胞时并未观察到细胞活力有下降(表3)。
表3
化合物1、lmv、tfv、或etv在原代人肝细胞中对细胞活力的效应
实施例2.3——使用原代人肝细胞时化合物1与核苷类似物对细胞活力的联合效应
为了测定化合物1与核苷类似物对细胞活力的联合效应,将原代人肝细胞用增大浓度的化合物1与单一浓度的lmv(300μm)、tfv(30μm)、或etv(30μm)进行联合处理。如图2-4所示,所存在的lmv、tfv、或etv在三种不同供体上测试时不影响化合物1的剂量响应特征。当在存在或不存在核苷类似物的情况下测定时,化合物1的对应cc50值较为类似(表4-6)。
表4
单独和与300μmlmv组合的化合物1对原代人肝细胞活力的效应
表5
单独和与30μmtfv组合的化合物1对原代人肝细胞活力的效应
表6
单独和与30μmetv组合的化合物1对原代人肝细胞活力的效应
在该实施例中,在单独或组合的化合物1和核苷类似物存在下测定原代人肝细胞(phh)的活力。细胞活力测定为经化合物处理的细胞相比于未经处理的细胞中的细胞内atp浓度的相对浓度。phh活力在未经处理的细胞和用300μm拉米夫定(lmv)、30μm替诺福韦(tfv)、或30μm恩替卡韦(etv)处理的细胞中较为类似。在用化合物1处理的细胞中观察到细胞活力的剂量依赖性减小;cc50值的范围为16至82μm。在300μm拉米夫定(lmv)、30μm替诺福韦(tfv)、或30μm恩替卡韦(etv)存在下用化合物1获得的cc50值类似于单独地用化合物1处理细胞时获得的那些。
实施例3——hbv核心抑制剂化合物1与核苷类似物或其它hbv核心抑制剂的组合在hepg2.2.15细胞中对hbvdna复制抑制的效应
在该实施例中,hbv核心调节剂化合物1与lmv的组合示为累加性,如由macsynergy和calcusyn两者所分析。化合物1与tfv或etv联合示出如由macsynergy所分析的累加效应,以及如由calcusyn所分析的轻微至中等的协同作用。两种不同的hbv核心抑制剂的组合示出总体累加抗病毒活性。在单独或组合情况下,在用最高化合物浓度处理的所有样品中,细胞活力维持在85%以上。
实施例3.1——材料和方法
将hepg2.2.15细胞用增大浓度的化合物1(0.05-5μm)与增大浓度的拉米夫定(lmv)、替诺福韦(tfv)、恩替卡韦(etv)、或bay41-4109(0.01-5μm)联合处理六天。通过quantigene测定来测量分泌的hbvdna,并且通过celltiter-glo测定来测量细胞活力。通过macsyngergy分析和calcusyn分析两者来测量协同作用。
实施例3.2——结果
图7示出化合物1与核苷类似物的联合效应。使用经化合物1与lmv(图7a)、tfv(图7b)、或etv(图7c)联合处理的hepg2.2.15细胞的三个不同测定板,由macsynergy以95%置信度绘制协同作用。
表7示出化合物1与核苷类似物联合的协同作用/拮抗作用体积,示出macsynergy所预测的效应。95%置信度下协同作用/拮抗作用体积<25μm2%定义为不显著,25至50μm2%定义为轻度,50至100μm2%定义为中10等,并且>100μm2%定义为强协同作用/拮抗作用。如所示,当使用macsynergy时,化合物1在与lmv、tfv、或etv联合时示出累加效应。
表7
表8示出与核苷类似物组合的化合物1的联合指数(ci)值。这些结果示出,当使用calcusyn时化合物1与lmv联合示出累加效应,并且当化合物1与tfv或etv组合时示出轻微至中等的协同作用。
表8
图8示出化合物1与其它核心调节剂的联合效应。使用经化合物1与bay41-4109联合处理的hepg2.2.15细胞的三个不同测定板,由macsynergy以95%置信度绘制协同作用(图8)。
表9示出化合物1与另一种核心调节剂的协同作用/拮抗作用体积。使用macsynergy,化合物1在与bay41-4109(式b)组合时具有累加效应。
表9
表10示出化合物1与另一种核心调节剂bay41-4109组合的ci值,其示出该组合具有如用calcusyn所预测的累加效应。
表10
实施例4——hbv核心抑制剂化合物2和化合物3与核苷类似物的组合在hepg2.2.15细胞中对hbvdna复制的抑制的效应
在该实施例中,hbv核心调节剂化合物2或化合物3与tfv或etv的组合示为累加性至协同作用,如macsynergy所分析。
实施例4.1——材料和方法
使用qpcr检测细胞培养上清液中的hbvdna作为读出,在6-天hbv抗病毒测定中评价化合物2和化合物3与核苷/核苷酸类似物etv或tfv的组合的抗-hbv活性。用macsynergyii软件分析联合效应。etv和tfv的抗-hbv活性同样在hepg2.2.15细胞中作为单一试剂测试(表14)。
在抗病毒测试期间,将hepg2.2.15细胞在rpmi1640培养基中培养并且fbs下降至2%。将细胞以50.000个细胞/孔的密度铺板到96-孔板中。
在接种hepg2.2.15细胞一天后,移除上清液并将含有以棋盘方式稀释的受试化合物的200μl培养基添加到细胞中。在三天之后,将含有受试化合物的培养基更新并将细胞在化合物存在下再温育三天。在化合物处理结束时,将150μl细胞培养上清液和50μlpbs添加至96-孔板块,以使用magnapure96dna和viralna小体积试剂盒进行dna提取。hbvdna通过定量实时pcr(qpcr)进行检测。采用引物5’-gtgtctgcggcgttttatca-3’(有义)和5’-gacaaacgggcaacatacct-3’(反义,seqidno:7),使用lightcycler480probesmaster试剂盒(roche)通过实时pcr测定来定量hbvdna。hbv探针5’-cctctkcatcctgctgctatgcctcatc-3’(seqidno:8)在探针5’端包含荧光报告染料(fam)并在3′端包含猝灭剂染料(tamra)。pcr如下进行:95℃下变性10分钟,然后进行40个扩增循环,每个循环95℃15秒,并且60℃1分钟。使用与抗病毒测定中相同的实验设计,在hepg2.2.15上平行地进行化合物的细胞毒性测试。使用得自perkinelmer的atplite试剂盒来检测atp作为化合物处理的细胞毒性的标记。
化合物浓度的各个组合所获得的抑制百分比值计算为每个实验相同组合的3至5个平行测定板的平均值。为了稳健地识别出异常值,计算每个数据点相对于另4次平行测定平均值的差距。在所有数据点上这些差距的分布被发现近似正态分布并集中于零(如所预期),但具有长尾,这表明存在显著的异常值。为了测定截止以排除这些,使用图基异常值判据,其将限度设定为第一四分位数减去1.5倍的四分位数间距(q1-1.5*(q3-q1))以及第三四分位数加上1.5倍的四分位数间距(q3+1.5*(q3-q1))。为了使异常值滤除对称,采取这些限度的最大绝对值作为截止。标记为异常值并从计算中排除的是相对于另4次平行测定的平均值的绝对差距超出该截止的任何数据点。仅在实验2和3中实施异常值去除。利用macsynergytmii软件,基于prichard和shipman开发的算法(prichardmn,shipmancjr.athree-dimensionalmodeltoanalyzedrug-druginteractions.antiviralres.1990;14(4-5):181-205),使用bliss-独立模型来估计抗-hbv试剂的不同组合的抗-hbv活性。在该模型中,通过公式z=x+y×(1-x)由各个化合物的剂量响应曲线计算理论累加效应,其中x和y分别表示由单独的药物1和单独的药物2所产生的抑制,并且z表示由药物1和药物2的组合产生的效应。如果组合为累加效应,从实际实验表面减去理论累加表面,产生表现为0抑制%的水平平面的表面。该平面上方的任何峰指示协同作用,而该平面下方的任何凹陷指示拮抗作用。实验剂量响应表面的95%置信区间(ci)的下限用于评价统计学数据。计算峰或凹陷的体积,以定量所产生的总体协同作用或拮抗作用。根据macsynergyii手册(其可经由http://www.uab.edu/images/pediatrics/id/macsynergy.pdf获得),认为95%ci下协同作用和拮抗作用的值确定联合效应。
实施例4.2——结果
在实验1中实施上述atp细胞毒性测定。基于原始数据(未示出),化合物并未以任何组合示出毒性。
图11a-c和图12a-c示出化合物2与核苷类似物etv和tfv的联合效应。显示出了使用经化合物2与etv(图11a-c)和tfv(图12a-c)联合处理的hepg2.2.15细胞的三个不同测定板,得自macsynergy的95%置信度下的协同作用图。
图13和图14示出化合物3与核苷类似物etv和tfv的联合效应。显示出了使用经化合物3与etv(图13)和tfv(图14)联合处理的hepg2.2.15细胞的三个不同测定板,得自macsynergy的95%置信度下的协同作用图。
图15a-d示出化合物2与核苷类似物etv和tfv联合对hbv的抑制%。图15a的图显示当etv的浓度设定为零时,在所公开浓度范围的化合物2下的hbv抑制%。图15b的图显示当化合物2的浓度设定为零时,在所公开浓度范围的etv下的hbv抑制%。图15c的图显示当tfv的浓度设定为零时,在所公开浓度范围的化合物2下的hbv抑制%。图15d的图显示当化合物2的浓度设定为零时,在所公开浓度范围的tfv下的hbv抑制%。
本发明不限于本文所述的具体实施方案和实施例的范围。实际上,本发明的多种修饰加上描述的修饰根据前述说明书和附图对于本领域技术人员将变得显而易见的。此类修饰意欲落入所附权利要求的范围内。
本文引用的所有参考文献(例如出版物或专利或专利申请)全文以引用方式并入本文中,且为了所有目的达到相同的程度,正如各个单独的参考文献(例如出版物或专利或专利申请)具体并且逐一地指明为所有目的全文引入作为参考一样。其它实施方案均在以下权利要求书之内。
- 还没有人留言评论。精彩留言会获得点赞!
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程