虫草菌发酵物在制备防治肿瘤恶病质和抗肿瘤的药品或食品中的应用的制作方法
本发明涉及药物化学技术领域,具体涉及虫草菌发酵物在制备防治肿瘤恶病质和抗肿瘤的药品或食品中的应用。
背景技术
恶病质(cachexia)是一种进行性消耗综合征,表现为无意识的体重降低的衰弱状态。患有晚期恶病质的患者常出现厌食症、早饱感以及严重的体重降低、虚弱、贫血和水肿等症状。引起恶病质的因素有多种,例如:癌症,类风湿性关节炎,心脏、肝、肾衰竭,慢些阻塞性肺病,艾滋病以及中风和机体衰老等。
肿瘤恶病质(cancercachexia),是各种恶性肿瘤患者的主要并发症,其主要特点为进行性骨骼肌和脂肪的消耗以及体重下降,其中,最主要的特征就是骨骼肌萎缩所带来的病人体重的明显下降。不同类型的肿瘤恶病质的发生率不同,例如:胃癌和胰腺癌所引起的恶病质发生率为80%,肺癌、前列腺癌和结肠癌所引起的恶病质发生率为50%,乳腺癌和白血病所引起的恶病质发生率为40%。
肿瘤恶病质多发生在晚期肿瘤患者身上,可表现为厌食、营养不良、体重下降、肌肉及脂肪消耗、贫血、低蛋白血症、乳酸血症、衰竭等。肿瘤恶病质的发生既有肿瘤本身的原因,又有抗肿瘤治疗的因素。研究者们认为肿瘤恶病质的发生机理主要有几个方面:(1)厌食导致的患者摄食量的减少;(2)肿瘤释放的某些细胞因子以及相关基因的改变所导致的全身代谢紊乱;(3)机体对肿瘤的免疫与炎症反应。
目前,关于肿瘤恶病质的治疗策略主要有以下几种:(1)通过添加免疫营养物质改善机体的免疫功能,促进骨骼肌蛋白的合成;(2)通过注射糖皮质激素或醋酸甲地孕酮等来刺激神经肽y释放的增加,促进食欲;(3)通过采用非甾体类消炎药、受体激动剂等药物进行干预,延缓恶病质症状的进一步恶化;(4)通过传统医学手段,如调节相关基因的表达、抑制细胞因子分泌、增强免疫力、改善食欲和增加体质等来减轻恶病质症状。但是,上述治疗效果仍然不够理想,有待进一步发觉新的治疗方案和策略。
虫草是我国名贵的真菌药物和高级补品,在我国明代以前,人们已知道应用虫草,从明代中叶开始,虫草就受到东南亚人民的喜爱,在国际市场上享有很高的声誉。
广义上的虫草是指虫生子囊真菌侵染昆虫或节肢动物后形成的真菌子实体(子座)与昆虫或节肢动物的复合体。虫草属真菌约有400余种,其中最名贵的是冬虫夏草(cordycepssinensis),其是麦角菌科线形虫草属真菌(ophiocordyceps)寄生于蝙蝠蛾属(hepialusspp.)的幼虫体内形成的复合体,是青藏高原高海拔地区的特有物种,简称“虫草”,是中国传统的名贵中药。
世界上已发现同属“虫草属”的虫草已有三百五十种之多,其中在中国已发现过六十余种,包含冬虫夏草(c.sinensis)、北冬虫夏草(c.militaris)、大团虫草(c.ophioglossoides)、亚香棒虫草(c.hawkesii)、古尼虫草(c.gunnii)、珊瑚虫草(c.martialis)、镰刀状虫草(c.falcata)、泰山虫草(c.taishanensis)、山西虫草(c.shanxiensis)、凉山虫草(c.liangshanensis)、新疆虫草(c.gracilis)、香棒虫草(c.barnesii)、蝉花(c.sobolifera)等。
现今,已发现的虫草品种繁多且大多虫草都有非常强的提高免疫能力的作用。通过上述作用,研究者们先后成功开发出:(1)金水宝胶囊(1987年上市),由从青海冬虫夏草中分离所得的蝙蝠蛾拟青霉(paecilomyceshepiali)cs-4菌株制备而成;(2)百令胶囊,以沈南英等在1983年分离出的一种真菌中国被毛孢(又称中华束丝孢(synnematumsinenseyinetshensp.now),冬虫夏草头孢,蝙蝠蛾多毛孢)为菌种生产得到;(3)至灵胶囊,用从冬虫夏草分离纯化出来的被孢霉菌(mortierellasp)发酵得到的菌丝体制成;(4)宁心宝胶囊,由新鲜冬虫夏草中分离得到的麦角菌科真菌虫草头孢(cephalosporiumsinensischen.sp.nov)经液体深层发酵所得;(5)心肝宝胶囊,由1986年冬虫夏草新鲜标本中分离出来的虫草头孢菌制成,该虫草头孢菌是一种真菌寄生菌粉红胶霉[gliocladiumroseum(link)bain]。
目前,虫草真菌发酵物类产品作为饲料添加剂在动物上的应用较多,但对于人体疾病方面的研究,尤其是关于肿瘤恶病质方面的研究却鲜有报道。
技术实现要素:
本发明提供了虫草菌发酵物在制备防治肿瘤恶病质和抗肿瘤的药品或食品中的应用,首次提出将虫草菌发酵物应用到肿瘤和肿瘤恶病质的防治中,并发现虫草菌发酵物可有效抑制肿瘤的生长,缓解肿瘤恶病质引起的脂肪降解、厌食和体温下降等症状。
具体内容如下:
本发明提供了虫草菌发酵物在制备防治肿瘤恶病质药品或食品中的应用,所述虫草菌发酵物由虫草属真菌经液体和/或固体发酵后得到。
本发明所指虫草属真菌是指从虫草中分离得到的寄生真菌。所述虫草菌发酵物由具体的某一类虫草属真菌菌种进行发酵获得,而非多种虫草属真菌菌种的混合发酵物。
由于液体发酵产物中的菌丝体含量较少,故更优选,所述虫草菌发酵物先经液体发酵,再经固体发酵,防治效果更佳。
进一步地,所述肿瘤恶病质为恶性肿瘤引起的并发症。
进一步地,所述恶性肿瘤为胃癌、肝癌、肺癌、食管癌、子宫颈癌、乳腺癌、结肠癌、直肠癌、鼻咽癌、卵巢癌、肾癌、膀胱癌、甲状腺癌、皮肤癌、肉瘤、血癌、霍奇金淋巴瘤、肾母细胞瘤、黑色素瘤、视网膜细胞瘤、精原细胞瘤、颗粒细胞瘤、枯根勃氏瘤、尤文氏瘤、恶性血管内皮细胞瘤或湿疹样癌。
其中,所述肉瘤是指从间叶组织如肌肉、脂肪、骨骼、血管、淋巴等长出来的恶性肿瘤,包括:横纹肌肉瘤、平滑肌肉瘤、纤维肉瘤、脂肪肉瘤、骨肉瘤、软骨肉瘤、血管肉瘤、淋巴肉瘤等。
进一步地,所述恶性肿瘤为结肠癌。
更进一步地,所述恶性肿瘤为结肠癌c26细胞。
进一步地,所述并发症的生理症状为脂肪降解、厌食或体温下降。
本发明还提供了虫草菌发酵物在制备抗肿瘤药品或食品中的应用,所述虫草菌发酵物由虫草属真菌经液体和/或固体发酵后得到。
进一步地,所述肿瘤为结肠癌;更进一步地,所述肿瘤为结肠癌c26细胞。、
进一步地,所述虫草属真菌为冬虫夏草(c.sinensis)菌种、北冬虫夏草(c.militaris)菌种、大团虫草(c.ophioglossoides)菌种、亚香棒虫草(c.hawkesii)菌种、古尼虫草(c.gunnii)菌种、珊瑚虫草(c.martialis)菌种、镰刀状虫草(c.falcata)菌种、泰山虫草(c.taishanensis)菌种、山西虫草(c.shanxiensis)菌种、凉山虫草(c.liangshanensis)菌种、新疆虫草(c.gracilis)菌种、香棒虫草(c.barnesii)菌种、蝉花(c.sobolifera)菌种中的至少一种。
更进一步地,所述虫草属真菌为地顶孢霉(acremoniumterricola)、中国被毛孢(synnematiumsinensesp.)、蛹草拟青霉(paecilomycesmilitaris)、霍克斯拟青霉(paecilomyceshawkesii)、羽束梗孢霉(paraisariasp.)、大团囊菌(elaphomycesgranulatus)、蝉白僵菌(beauveriasobolifera)中的至少一种。
试验表明,地顶孢霉(acremoniumterricola)能够有效地抑制肿瘤的生长,缓解肿瘤恶病质引起的脂肪降解、厌食和体温下降等症状;所以,进一步地,所述虫草属真菌为地顶孢霉(acremoniumterricola)。
更进一步地,所述虫草属真菌为地顶孢霉(acremoniumterricola)mkl18,保藏编号为cctccno.m2013654。
地顶孢霉(acremoniumterricola)mkl18已于2013年12月12日保藏于武汉市武汉大学中国典型培养物保藏中心,本申请不涉及遗传资源的保藏。
所述液体发酵包括:(1)活化虫草属真菌;(2)取所述虫草属真菌接种于种子培养基中,进行种子培养;再转接至扩大培养基中,进行扩大培养,得到液体发酵菌液。
本发明采用的液体发酵培养基和固体培养基均为常规培养基,无特殊中药材等成分,获得的发酵物中仅含有虫草属真菌及其发酵代谢产物,以及极为少量的固体培养基组分,本发明发现利用虫草属真菌自身发酵产生的发酵产物能够有效抑制肿瘤的生长,缓解肿瘤恶病质引起的脂肪降解、厌食和体温下降等症状。
上述液体发酵培养基包括氮源、碳源和微量元素;其中,作为优选,氮源为蚕蛹粉、蛋白胨、酵母粉和黄豆粉中的至少一种,碳源为白砂糖、黄豆粉、玉米粉、麦芽粉和大米粉中的至少一种,微量元素为mgso4、kh2po4、nah2po4和vb中的至少一种。
更优选,所述液体培养基的组分为白砂糖、蚕蛹粉、黄豆粉、蛋白胨、酵母粉、mgso4和kh2po4。
上述固体发酵培养基也包括氮源、碳源和微量元素;其中,作为优选,氮源为豆粕、棉籽粉和小麦次粉中的至少一种,碳源为玉米粉和麦麸中的至少一种,微量元素为硫酸镁mgso4、kh2po4、nah2po4和vb中的至少一种。
更优选,所述固体发酵培养基的组分为玉米粉、棉籽粉、小麦次粉、豆粕、麦麸、硫酸镁、硫酸锌、磷酸二氢钾和磷酸二氢钠。
进一步地,上述制备的防治肿瘤恶病质的药品以及抗肿瘤的药品包括有效成分和药用辅料,所述有效成分为所述的虫草菌发酵物。
其中,所述的药用辅料是指药学领域常规的药物载体,如填充剂、粘合剂、湿润剂、吸收促进剂、表面活性剂等。
所述填充剂可采用淀粉、蔗糖或微晶纤维素;所述粘合剂可采用淀粉浆、羟丙纤维素、明胶或聚乙二醇;所述湿润剂可采用硬脂酸镁、微粉硅胶或聚乙二醇类;所述吸收促进剂可采用聚山梨脂或卵磷脂;所述表面活性剂可采用伯洛沙姆、脂肪酸山梨坦或聚山梨脂。另外,还可以加入其它辅剂如香味剂、甜味剂等。
所述药品的剂型可以是片剂,丸剂,粉剂,分散片,小药囊剂,酏剂,混悬剂,乳剂,溶液剂,糖浆剂,气雾剂,软胶囊,硬胶囊等;可制成常规、速释、缓释或延迟释放制剂。
上述虫草菌发酵物可以添加在如饮料、糖果、糕点、果酱、速食食品等中,也可以制成片剂,丸剂,粉剂,分散剂,气雾剂,溶液剂,软胶囊,硬胶囊。上文所述的食品均指常规食用食品以及保健食品。
本发明所述的虫草菌发酵物作为药品或食品服用时,用量范围在0.05g~100g。
与现有技术相比,本发明具有以下有益效果:
本发明提供了虫草菌发酵物在制备防治肿瘤恶病质和抗肿瘤的药品或食品中的新用途,尤其是在防治结肠癌和结肠癌引起的肿瘤恶病质疾病中的应用;通过小鼠模型试验证明,虫草菌发酵物能够有效抑制肿瘤的生长,并缓解肿瘤恶病质引起的脂肪降解、厌食和体温下降等症状。
附图说明
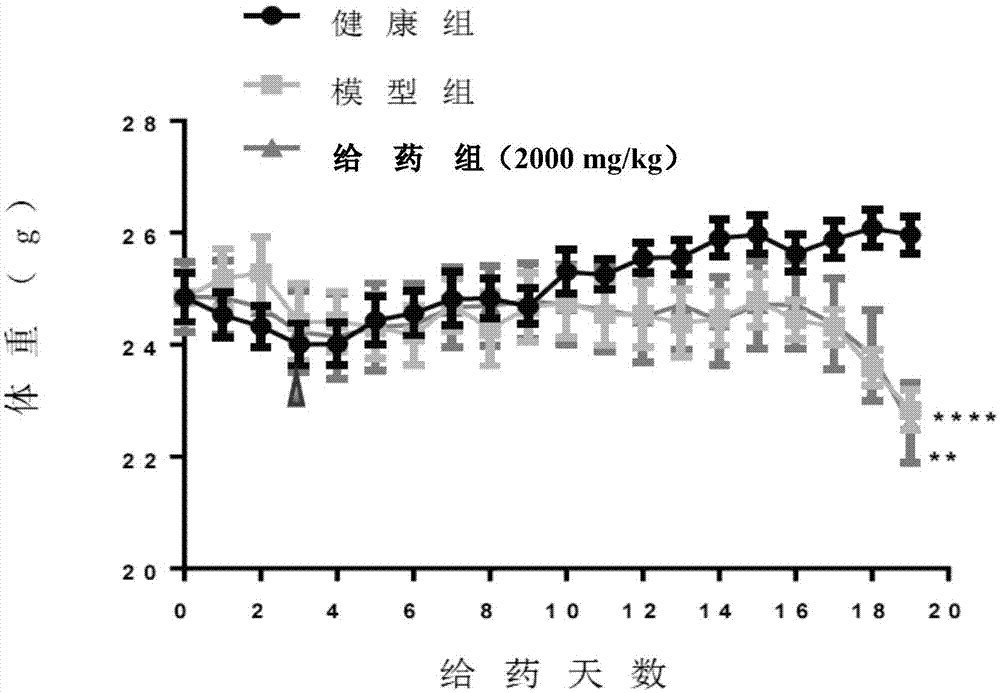
图1为实施例2中健康对照组、模型组和给药组小鼠的体重变化情况;
其中,
图2为实施例2中健康对照组、模型组和给药组小鼠的去瘤体重变化情况;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与健康组比较,**p<0.01,****p<0.0001。
图3为实施例2中健康对照组、模型组和给药组小鼠的去瘤体重改变情况;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与健康组比较,****p<0.0001。
图4为实施例2中健康对照组、模型组和给药组小鼠的累计摄食量变化情况;
图5为实施例2中健康对照组、模型组和给药组小鼠的平均小鼠累计摄食量。
图6为实施例2中实验结束时模型组和给药组小鼠的肿瘤体积变化情况;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与模型组比较,*p<0.05。
图7为实施例2中实验结束时模型组和给药组小鼠的肿瘤体积;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与模型组比较,*p<0.05。
图8为实施例2中实验结束时模型组和给药组小鼠的肿瘤重量;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与模型组比较,*p<0.05。
图9为实施例2中健康对照组、模型组和给药组小鼠的体温变化情况;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与健康组比较,***p<0.001;与模型组比较,##p<0.01。
图10为实施例2中实验结束时健康对照组、模型组和给药组小鼠的体温;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与健康组比较,***p<0.001;与模型组比较,##p<0.01。
图11为实施例2中实验结束时健康对照组、模型组和给药组小鼠的附睾脂肪重量;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与健康组比较,*p<0.05,**p<0.01;与模型组比较,#p<0.05。
图12为实施例2中实验结束时健康对照组、模型组和给药组小鼠的腓肠肌重量;
其中,所有数据都是各组的mean±se值,数据分析采用student'st-test,与健康组比较,**p<0.01。
具体实施方式
下面结合具体实施案例对本发明作进一步地详细说明。
实施例1虫草菌发酵物的制备
1、发酵菌液
(1)古尼虫草菌种:地顶孢霉(acremoniumterricola)mkl18(可购自合肥迈可罗生物工程有限公司);
(2)种子培养:
种子培养的培养基为:600g白砂糖,300g蚕蛹粉,200g黄豆粉,150g蛋白胨,100g酵母粉,10gmgso4,10gkh2po4,溶解于20l水,自然ph;121℃高压蒸汽灭菌30min。
种子发酵的条件为:温度为25℃,通气量为1.00l/(l·min),接种量为10%(质量分数),300l气升式发酵罐装液量67%,发酵时间为24h。
(3)扩大培养:
扩大培养的培养基为:6000g白砂糖,3000g蚕蛹粉,2000g黄豆粉,1500g蛋白胨,1000g酵母粉,100gmgso4,100gkh2po4,溶解于200l水,自然ph;121℃高压蒸汽灭菌30min。
扩大培养的条件为:温度为25℃,通气量为1.00l/(l·min),接种量为10%(质量分数),300l气升式发酵罐装液量67%,发酵时间为24h。
种子培养和扩大培养完成后,得到地顶孢霉菌液。
2、固体培养物
(1)将本实施例中制得的地顶孢霉菌液与固体培养基搅拌接种后(接种量为15%,质量分数),平铺在浅盘上发酵,物料厚度为3cm,温度恒定为25℃,湿度为70%,发酵时间为168h,得到固体培养物;
其中,固体发酵的培养基为:玉米粉45%、棉籽粉5%、小麦次粉4%、豆粕30%、麦麸15.8%、硫酸镁0.05%、硫酸锌0.05%、磷酸二氢钾0.05%、磷酸二氢钠0.05%;自然ph,100℃蒸汽灭菌6h。
(2)收集固体培养物,在60℃下热风干燥至水分降至8wt%以下,粉碎装袋,密封,避光储藏,即得虫草菌固体培养物。
测定本实施例制备获得的发酵菌液和固体培养物中的组分,结果如表1所示。
实施例2
一、实验方法
1、实验材料:spf级balb/c小鼠,雄性,6~7周龄,体重20~24g(北京维通利华实验动物技术有限公司);小鼠结肠腺癌colon26(c26)细胞系;实施例1制备的虫草菌固体培养物。
2、药物配制:200mg/ml的虫草菌固体培养物水溶液:取适量的虫草菌固体培养物在超净工作台里用研钵充分研磨至细腻均匀,先向研钵里加入少量无菌双蒸水研磨,让溶液呈粘稠状态,再加入一定体积的水研磨,使得虫草菌固体培养物的浓度为200mg/ml,溶液呈悬浮状态,于4℃存储备用,给小鼠灌胃时,需充分摇匀。
200mg/ml的虫草菌固体培养物0.5%(w/v)羧甲基纤维素钠(cmcna)溶液的配制:取适量的虫草菌固体培养物在超净工作台里用研钵充分研磨至细腻均匀,先向研钵里加入少量0.5%cmcna溶液研磨,让溶液呈粘稠状态,再加入一定体积的0.5%cmcna溶液研磨,使得虫草菌固体培养物的浓度为200mg/ml,溶液呈悬浮状态,于4℃存储备用,给小鼠灌胃时,需充分摇匀。
3、小鼠分组及接种
(1)分组:19只体重20~24g小鼠随机分组,每组平均体重24.8g:未接种的健康对照组,c-26模型组和给药组(2000mg/kg)。
(2)接种:
a、取新鲜c-26实体肿瘤组织,每1g肿瘤组织中加入3.5ml生理盐水匀浆后稀释成浓度约1×107/ml的细胞悬液,模型组和给药组每只腋下注射c26结肠癌细胞悬液0.1ml。
b、健康对照组每只腋下注射0.1ml生理盐水作为阴性对照。
4、具体实验方案及检测方法
(1)具体实验方案如表2所示。
表2具体实验方案
注:肿瘤接种后的第一天开始给药,前三天对照组和模型组用0.5%cmcna灌胃,给药组用含虫草菌固体培养物的0.5%cmcna溶液灌胃,发现0.5%cmcna降低小鼠摄食量,导致体重有所下降,故而从第四天开始,健康组和模型组用无菌双蒸水灌胃,给药组用含虫草菌固体培养物的水溶液灌胃。
(2)检测指标
a.小鼠体重:每天用百分之一天平称量小鼠体重,求各组体重平均值,绘制成体重变化曲线。
b.肿瘤体积:每天用游标卡尺测量小鼠肿瘤长和宽,肿瘤体积v=ab2/2(a、b分别为肿瘤的长和宽),计算各组肿瘤体积平均值,绘制成肿瘤生长曲线。
c.小鼠去瘤体重:去瘤体重=小鼠体重-肿瘤重量。肿瘤重量(g)=肿瘤体积×1/1000×α,α为校正参数,α=实验结束时肿瘤/实验结束时肿瘤体积。计算各组小鼠平均去瘤体重,描绘各组小鼠平均去瘤体重随给药时间变化曲线。
d.平均累计摄食量:每天用百分之一天平称量小鼠饲料重量,绘制各组平均累计摄食量变化曲线。每日平均每只小鼠摄食量=(前日饲料重量-今日剩余饲料量)/每组小鼠数量。各组平均每只小鼠累计摄食量=前几日平均每只小鼠摄食量+今日平均每只小鼠摄食量。
e.小鼠体温:每天用红外测温仪测量小鼠腋下温度体温,计算各组小鼠平均体温,绘制体温变化曲线。
f.肿瘤重量:实验结束时,处死小鼠,解剖取出小鼠瘤块,称重。
g.左后肢腓肠肌重量:实验结束时,断颈处死小鼠,分离小鼠左后肢完整腓肠肌,称重。
h.附睾脂肪重量:实验结束时,断颈处死小鼠,剖取小鼠腹股沟两侧的附睾脂肪,称重。
5、统计学分析:实验所得数据采用均数±标准误差(mean±se)表示,采用graphpad_prism_7.0.0.159和student'st-test进行统计分析,以p<0.05表示差异有统计学意义。
二、实验结果
实验结果如表3和图1~12所示。
1、虫草菌固体培养物对c-26肿瘤恶病质小鼠体重下降症状无缓解作用
未接种肿瘤的健康对照组(简称健康组或对照组)小鼠体重在实验中总体缓慢增长。前3天健康组体重下降,可能由于0.5%cmcna灌胃影响其食欲所致(如图1),实验开始时,健康组小鼠平均体重为24.8g,实验结束时,终体重为25.9g,健康组小鼠体重增加了4.44%((初始体重-终体重)/初始体重×100%)(图3)。
模型组小鼠实验初期体重维持不变。从给药10天至实验结束,荷瘤体重和去瘤体重低于健康组,给药14天时开始急剧降低(图1、2)。模型组初始体重为24.8g,实验结束时,终体重为22.8g,终去瘤体重(终体重-瘤重)为20.7g,模型组小鼠体重下降-16.53%((初始体重-终去瘤体重)/初始体重×100%),与健康组差异显著(图3)。
给药组的荷瘤体重和去瘤体重在实验第10天至实验结束都低于健康对照组,第14天开始急剧降低(图1、2);实验开始时,给药组小鼠体重为24.8g,实验结束时,终体重为22.6g,终去瘤体重为21.0g,给药组体重下降了15.32%,与健康组差异显著,和模型组相比,给药组去瘤体重虽然略微显高,但差异无统计学意义(图3)。
2、虫草菌固体培养物改善c-26肿瘤恶病质小鼠厌食症状
健康组小鼠平均累计摄食量持续增长(图4);实验结束时,其平均累计摄食量为73.28g(图5)。
模型组小鼠从第5天开始,其平均累计摄食量低于健康组,且与健康组之间的差距越来越大,实验结束时,模型组平均累计摄食量为55.25g(图4)。
给药组小鼠从第5天开始,其平均累计摄食量虽然低于健康组,但是逐渐高于模型组(图4);实验结束时,给药组平均累计摄食量为64.86g,比模型组平均累计摄食量增加了9.61g,增长率为17.4%((虫草组平均累计摄食量-模型组平均累计摄食量)/模型组平均累计摄食量×100%)(图5)。
以上数据说明给药组增加了c-26肿瘤恶病质小鼠的摄食量,改善了c-26肿瘤恶病质小鼠的厌食症状。
3、虫草菌固体培养物抑制c-26肿瘤的生长
模型组和给药组的小鼠在接种后第9天部分小鼠可于皮下接触到肿瘤结节,随后肿瘤体积持续增大,从第12天卡是,给药组瘤体积都低于模型组,差别有显著性(图6)。实验结束时,虫草组肿瘤体积为1573.4mm3,模型组肿瘤体积为2465.2mm3,虫草菌固体培养物对c-26肿瘤生长抑制率(tgi)为36.2%(tgi=(模型组终肿瘤体积-给药组终肿瘤体积)/模型组终肿瘤体积×100%)(图7)。
给药组肿瘤重量比模型组减少,差别有统计学意义。实验结束时,虫草组肿瘤为1.60g,模型组肿瘤为2.14g。
4、虫草菌固体培养物可减缓c-26肿瘤恶病质小鼠的体温下降趋势
从实验第14天开始,模型组和给药组小鼠体重急剧下降,体温也都开始骤降,两组都低于健康组,但是给药组体温明显高于模型组(图9,10)
实验结束时,健康组平均体温为36.73℃,给药组平均体温为33.97℃,模型组平均体温为32.53℃,虫草组的平均体温高于模型组1.44℃,且有显著性差异(图10)。
5、虫草菌固体培养物可缓解c-26肿瘤恶病质小鼠脂肪降解,但对于肌肉降解没有缓解作用
实验结束时,健康组、模型组和给药组的附睾脂肪重量分别为0.36g、0.12g、0.21g,健康组、模型组和给药组的腓肠肌重量分别为0.131g、0.105g、0.105g(图11、12)。
虽然,给药组和模型组腓肠肌重量没有差异(图12),但是给药组附睾脂肪重量高于模型组75%((健康组附睾脂肪重量-模型组附睾脂肪重量)/模型组附睾脂肪重量×100%),且有统计学意义(图11)。
6、健康组、模型组和给药组对c-26肿瘤恶病质小鼠模型实验治疗研究的指标对比(见表3)
表3不同处理对c-26肿瘤恶病质小鼠各指标的影响
注:数据分析采用student'st-test,与对照组比较,*p<0.05,**p<0.01,***p<0.001,****p<0.0001;与模型组比较,#p<0.05;##p<0.01。
基于上述实验可得出以下结论:
(1)给药组小鼠的荷瘤体重、去瘤体重以及腓肠肌重量和模型组相比没有差异,说明虫草菌固体培养物对c-26肿瘤恶病质小鼠的体重下降和肌肉萎缩没有缓解作用。
(2)给药组对于c-26肿瘤的生长抑制率达到36.2%,表明虫草菌固体培养物对c-26肿瘤生长有抑制作用。
(3)相对于模型组,给药组的附睾脂肪重量增加75%,平均体温上升1.44℃,平均累计摄食量增加17.4%,表明虫草菌固体培养物能够明显缓解由c-26肿瘤恶病质引起的小鼠脂肪降解、厌食和体温下降症状。
- 还没有人留言评论。精彩留言会获得点赞!