持续药物递送植入物的制作方法
相关申请的交叉引用
本申请要求2013年2月15日提交的美国临时申请号61/765,554的权益,所述临时申请的整个内容以引用的方式并入本文。
背景
领域
本申请的公开内容总体上涉及药物递送植入物,更具体地涉及用于治疗眼部病状的药物递送植入物。
相关技术的描述
糖尿病性视网膜病变是年龄在20至74岁的成人之中的主要失明病因。据估计每年出现75,000例新增黄斑水肿、65,000例增生性视网膜病变和12,000至24,000例新增失明。视网膜色素变性(rp)是一组异质遗传神经变性视网膜疾病,其导致感光细胞(视杆细胞和视锥细胞)死亡,这最终导致失明。青光眼是一种由视网膜神经节细胞损失、相应视神经萎缩、和视觉功能丧失所致的多因性视神经病变,其主要显现为视野损失以及视觉敏锐度和色彩视觉降低。地图状萎缩(“ga”)是2种晚期年龄相关的黄斑变性(“amd”)形式中的一个。晚期amd是指其中视觉敏锐度损失可因amd而发生的时段。视网膜脱离是眼部罹病的重要病因。存在3种类型的视网膜脱离:孔源性、牵拉性和渗出性。
溴莫尼定(brimonidine)(5-溴-6-(2-咪唑烷亚基氨基)喹喔啉)是一种通过降低水状液产生以及增加葡萄膜巩膜外流来有效治疗开角型青光眼的α-2选择性肾上腺素能受体激动剂。0.2%溴莫尼定酒石酸盐眼用溶液(以
溴莫尼定酒石酸盐的神经保护作用已于视神经挤压、中度高眼压、压力诱发的缺血和血管缺血的动物模型中被显示。表面施加溴莫尼定酒石酸盐的神经保护作用也已在临床上在患有青光眼、年龄相关的黄斑变性、视网膜色素变性、糖尿病性视网膜病变和急性非动脉炎性前部缺血性视神经病变的患者中加以探究。然而,在眼内植入物中使用溴莫尼定酒石酸盐存在某些限制。例如,由于溴莫尼定酒石酸盐分子的尺寸,可装载至植入物中的药物的量可受限制。此外,溴莫尼定酒石酸盐的亲水性性质可限制药物在持续释放制剂中使用的能力。
概述
因此,一实施方案提供一种用于治疗人患者的后眼部病状的眼内植入物,其包含可生物降解的聚合物基质(包括至少一种可生物降解的聚合物)和溴莫尼定游离碱药剂,其中所述植入物可被配置成持续多达六个月的溴莫尼定游离碱药剂递送持续时间向罹患后眼部病状的患者的眼的玻璃体递送所述溴莫尼定游离碱药剂,并且其中所述可生物降解的聚合物基质被配置成一旦置于所述眼的所述玻璃体中,即在约两倍于所述溴莫尼定游离碱药剂递送持续时间或更短的时段内完全或几乎完全降解。在一些实施方案中,以植入物的总重量计,溴莫尼定游离碱药剂是以植入物的约50重量%的量存在于植入物中。在一些实施方案中,植入物可具有杆状,并且所述杆状可具有约350μm的杆直径和约6mm的杆长度。根据其它实施方案,溴莫尼定游离碱药剂被分散在可生物降解的聚合物基质内。在一些实施方案中,至少一种可生物降解的聚合物包括聚(d,l-丙交酯-共-乙交酯)和聚(d,l-丙交酯)。在一些实施方案中,可生物降解的聚合物基质包括至少一种选自由以下组成的组的聚合物:酸封端的聚(d,l-丙交酯-共-乙交酯)和酸封端的聚(d,l-丙交酯)。在一些实施方案中,溴莫尼定游离碱药剂递送持续时间在约1个月至约6个月的范围内。
以下更详细描述这些和其它实施方案。
附图简述
现将参照以下概述的图式来描述这些和其它特征。这些图式和相关描述被提供来说明一个或多个实施方案,而非限制本发明的范围。
图1说明根据比较实施例制剂,在37c下溴莫尼定酒石酸盐植入制剂于具有ph7.4的0.01mpbs中的药物释放曲线。
图2显示根据实施例制剂,在37c下溴莫尼定游离碱植入制剂于具有ph7.4的0.01mpbs中的药物释放曲线。
图3显示根据比较实施例制剂,溴莫尼定酒石酸盐植入制剂于白化兔中的药物释放曲线。
图4显示根据比较实施例制剂,溴莫尼定酒石酸盐植入制剂于食蟹猕猴中的药物释放曲线。
图5说明根据实施例制剂,溴莫尼定游离碱植入制剂于白化兔中的药物释放曲线。
图6说明根据实施例制剂,溴莫尼定游离碱植入制剂于食蟹猕猴中的药物释放曲线。
图7显示根据比较实施例制剂,溴莫尼定酒石酸盐植入制剂于白化兔的视网膜(视神经)中随时间的药物浓度。点线指示人α2aec90浓度。
图8显示根据实施例制剂,溴莫尼定游离碱植入制剂于白化兔的视网膜(视神经)中随时间的药物浓度。点线指示人α2aec90浓度。
图9说明根据实施例制剂,溴莫尼定游离碱植入制剂于食蟹猕猴的视网膜(黄斑)中随时间的药物浓度。点线指示人α2aec90浓度。为进行比较,包括ce1溴莫尼定制剂。
图10说明根据比较实施例制剂,溴莫尼定酒石酸盐植入制剂于食蟹猕猴中随时间的聚合物基质降解。
图11显示根据实施例制剂,溴莫尼定游离碱植入制剂于食蟹猕猴中随时间的聚合物基质降解。
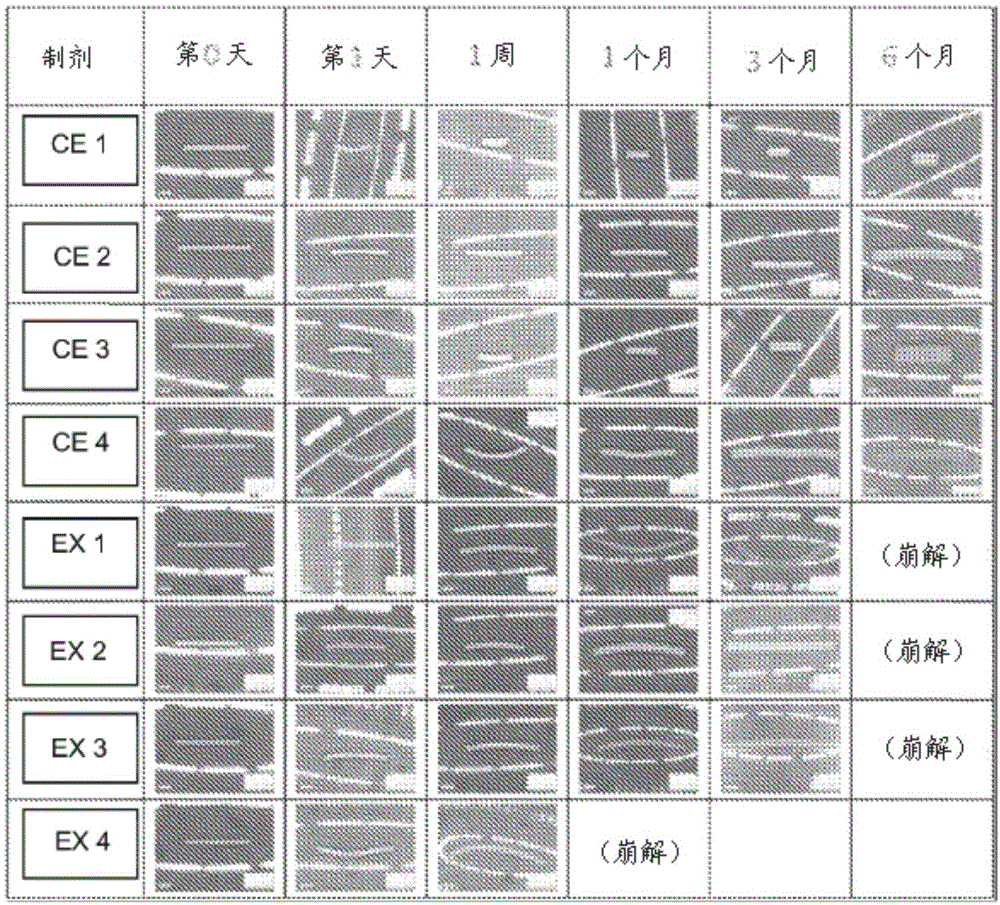
图12显示在37℃下于pbs(ph7.4,0.01m)中孵育时的植入物图像。
详细描述
一般来说,一实施方案涉及用于眼后部治疗应用的溴莫尼定游离碱持续递送。在一些实施方案中,溴莫尼定游离碱被与一种或多种聚合物一起于聚合物基质中配制成植入物,所述聚合物被选择来赋予溴莫尼定游离碱的靶标持续递送和/或一种或多种聚合物的靶标降解。根据一些实施方案,产生溴莫尼定游离碱和一种或多种可生物降解的聚合物的制剂以便聚合物基质将在不超过两倍于溴莫尼定游离碱释放持续时间但超过溴莫尼定游离碱释放持续时间的时段内降解。根据一些实施方案,溴莫尼定游离碱药物递送系统展现一至六个月的靶标药物递送持续时间和两至十二个月的靶标基质降解时间。
本文实施方案公开用于向眼中延长或持续释放药物以实现一种或多种所需治疗作用的新型药物递送系统以及制备和使用所述系统的方法。药物递送系统可呈可被放置在眼中的植入物或植入元件形式。在本文一些实施方案中公开的系统和方法可提供一种或多种治疗剂的释放时间延长。因此,例如,已在他们的眼中接受所述植入物的患者可持续长久或延长时段接受治疗量的药剂而无需额外施用所述药剂。根据一些实施方案,植入物在它完全或几乎完全降解之前也可仅在患者的眼内保持靶向或有限的时间量。通过限制如植入物的外来物体在患者的眼或玻璃体中的时间量,患者的舒适性得以优化,并且他们的感染或其它并发症风险得以最小。此外,可避免玻璃体的动态流体中可由植入物与眼的角膜或其它部分抵触引起的并发症。
如本文所用,“眼内植入物”是指被构造、定尺寸或另外被配置成放置在眼中的装置或元件。眼内植入物通常可与眼的生理条件生物相容。眼内植入物可被放置在眼中而不破坏眼的视力。
如本文所用,“治疗组分”是指眼内植入物的包含一种或多种用于治疗眼的医学病状的治疗剂或物质的部分。治疗组分可为眼内植入物的离散区域,或它可均质分布在整个植入物中。治疗组分的治疗剂通常是眼用可接受的,并且以在将植入物放置在眼中时不导致不利反应的形式提供。
如本文所用,“眼部病状”是影响或涉及眼或眼的一个部分或区域的疾病病痛或病状。眼可包括眼球以及构成眼球、眼周肌肉(如斜肌和直肌)和视神经的在眼球内或邻近于眼球的部分的组织和流体。
“前眼部病状”是影响或涉及前(即眼前部)眼部区域或部位,如眼周肌肉、眼睑或位于晶状体囊的后壁或睫状肌之前的眼球组织或流体的疾病、病痛或病状。因此,前眼部病状可影响或涉及结膜、角膜、前房、虹膜、后房(位于视网膜之后,但在晶状体囊的后壁之前)、晶状体或晶状体囊以及使前眼部区域或部位血管化或受神经支配的血管和神经。
“后眼部病状”是主要影响或涉及后眼部区域或部位,如脉络膜或巩膜(处于在穿过晶状体囊的后壁的平面之后的位置)、玻璃体、玻璃体房、视网膜、视神经或视神经盘、以及使后眼部区域或部位血管化或受神经支配的血管和神经的疾病、病痛或病状。
因此,后眼部病状可包括例如但不限于以下的疾病、病痛或病状:急性黄斑视神经视网膜病变;贝塞特氏病(behcet’sdisease);地图状萎缩;脉络膜新血管化;糖尿病性葡萄膜炎;组织胞浆菌病;感染,如真菌、细菌或病毒导致的感染;黄斑变性,如急性黄斑变性、非渗出性年龄相关的黄斑变性和渗出性年龄相关的黄斑变性;水肿,如黄斑水肿、囊样黄斑水肿和糖尿病性黄斑水肿;多灶性脉络膜炎;影响后眼部部位或位置的眼部创伤;眼部肿瘤;视网膜病症,如中心视网膜静脉阻塞、糖尿病性视网膜病变(包括增生性糖尿病性视网膜病变)、增生性玻璃体视网膜病变(pvr)、视网膜动脉阻塞性疾病、视网膜脱离、葡萄膜炎性视网膜疾病;交感性眼炎;伏格特小柳-原田(vogtkoyanagi-harada,vkh)综合征;葡萄膜扩散;由眼部激光治疗引起或影响的后眼部病状;或由光动力疗法、光凝固、放射视网膜疗法、前膜病症、分支视网膜静脉阻塞、前部缺血性视神经病变、非视网膜病变糖尿病性视网膜功能障碍、视网膜色素变性和青光眼引起或影响的后眼部病状。青光眼可被视为后眼部病状,因为治疗目标在于预防归因于视网膜细胞或视神经细胞损害或损失的视力损失,或降低所述视力损失的发生(例如神经保护)。
术语“可生物降解的聚合物”或“生物可侵蚀的聚合物”是指一种或多种在体内降解的聚合物,并且其中所述一种或多种聚合物随时间的侵蚀与治疗剂的释放同时和/或在治疗剂的释放之后发生。可生物降解的聚合物可为均聚物、共聚物或包含两个以上聚合单元的聚合物。在一些实施方案中,“可生物降解的聚合物”可包括两种或更多种均聚物或共聚物的混合物。
如本文所用的术语“治疗”是指减轻或消退或预防眼部病状、眼部损伤或损害,或促进损伤或损害的眼部组织的愈合。
如本文所用的术语“治疗有效量”是指为治疗眼部病状或减轻或预防眼部损伤或损害所需的治疗剂的水平或量。
本领域技术人员将了解本文所用的各种程度术语的含义。例如,如本文在涉及量(例如“约6%”)的情形下所用,术语“约”代表仍然执行所需功能或实现所需结果的接近于且包括所述量的量,例如“约6%”可包括6%以及仍然执行所需功能或实现所需结果的接近于6%的量。例如,术语“约”可指量在所述量的小于10%、小于5%、小于0.1%或小于0.01%内。
眼内植入物可包括治疗组分和一种或多种药物释放控制组分。治疗剂可包含α-2肾上腺素能受体激动剂或基本上由α-2肾上腺素能受体激动剂组成。α-2肾上腺素能受体激动剂可为例如通过结合α-2肾上腺素能受体来相对于其它类型的肾上腺素能受体(如α-1肾上腺素能受体),选择性活化α-2肾上腺素能受体的激动剂或药剂。选择性活化可在不同条件,如与人患者的眼相关的条件下实现。
植入物的α-2肾上腺素能受体激动剂通常是相对于α-2肾上腺素能受体,选择性活化α-2肾上腺素能受体的药剂。在某些植入物中,α-2肾上腺素能受体激动剂选择性活化α-2肾上腺素能受体的亚型。例如,在如生理条件的某些条件下,激动剂可选择性活化α-2a、α-2b或α-2c受体中的一个或多个。在其它条件下,植入物的激动剂可不对α-2肾上腺素能受体亚型具有选择性。激动剂可通过结合受体,或通过任何其它机理来活化受体。
根据一些实施方案,所用α-2受体拮抗剂是溴莫尼定。溴莫尼定是具有以下结构的喹喔啉衍生物:
作为有机碱的溴莫尼定可以溴莫尼定游离碱形式公开获得。溴莫尼定游离碱通常是疏水性的。
在一些实施方案中,α-2肾上腺素能受体拮抗剂可为溴莫尼定的药学上可接受的酸加成盐。一种所述盐可为溴莫尼定酒石酸盐(agn190342-f,5-溴-6-(2-咪唑烷亚基氨基)喹喔啉酒石酸盐)。溴莫尼定游离碱与溴莫尼定酒石酸盐两者均是化学稳定的,并且具有高于200℃的熔点。
因此,眼内植入物可包含以下、由以下组成或基本上由以下组成:治疗剂,如α-2肾上腺素能受体激动剂,如单独溴莫尼定盐(如溴莫尼定酒石酸盐)、单独溴莫尼定游离碱或其混合物。
在固体植入制剂中使用溴莫尼定游离碱具有超过溴莫尼定酒石酸盐的若干优势,如溴莫尼定游离碱的较低溶解度使潜在药物爆发效应降低,并且在相同重量下,每个植入物的游离碱药物等效剂量可更高。因此,根据一些实施方案,眼内植入物中不包括溴莫尼定酒石酸盐。根据某一实施方案,用于眼内植入物中的唯一治疗剂是溴莫尼定游离碱。
α-2肾上腺素能受体激动剂可呈颗粒或粉末形式,并且由可生物降解的聚合物基质包埋。根据一个实施方案,α-2肾上腺素能受体激动剂是具有小于约20μm的d90粒子尺寸的溴莫尼定游离碱。根据另一实施方案,α-2肾上腺素能受体激动剂是具有小于约10μm的d90粒子尺寸的溴莫尼定游离碱。根据另一实施方案,α-2肾上腺素能受体激动剂是具有在约10μm至约20μm的范围内的d90粒子尺寸的溴莫尼定游离碱。
根据一些实施方案,可配制溴莫尼定游离碱药剂的粒子分散在生物可侵蚀的聚合物基质内的植入物。根据一些实施方案,植入物可为整体的,具有贯穿可生物降解的聚合物基质均质分布的治疗剂;或囊封的,其中活性剂的储集囊由聚合基质囊封。在一些实施方案中,治疗剂可以非均质样式分布在可生物降解的聚合物基质中。例如,在一个实施方案中,植入物可包括相对于植入物的第二部分,具有更大浓度的治疗剂(如溴莫尼定游离碱)的第一部分。
以植入物的总重量计,α-2肾上腺素能受体激动剂可以在植入物的约20重量%至约70重量%的范围内的量存在于植入物中。在一些实施方案中,以植入物的总重量计,α-2肾上腺素能受体激动剂可以在植入物的约40重量%至约60重量%的范围内的量存在于植入物中。在一个实施方案中,以植入物的总重量计,α-2肾上腺素能受体激动剂可以植入物的约40重量%的量存在于植入物中。在另一实施方案中,以植入物的总重量计,α-2肾上腺素能受体激动剂可以植入物的约50重量%的量存在于植入物中。在一示例性实施方案中,以植入物的总重量计,溴莫尼定游离碱可以植入物的约50重量%、植入物的约55重量%、植入物的约60重量%、或植入物的约70重量%的量存在于植入物中。
适用于植入物中的聚合材料或组合物可包括可与眼相容以便不导致对眼的功能或生理机能的实质性干扰的那些材料。所述材料可为至少部分或完全可生物降解的。
适于聚合物基质的聚合材料的实例包括聚酯。例如,d-乳酸、l-乳酸、外消旋乳酸、乙醇酸、聚己内酯及其组合的聚合物可用于聚合物基质。在一些实施方案中,如果使用,那么聚酯可为均聚物、共聚物或其混合物。
在一些植入物中,使用乙醇酸和乳酸的共聚物,其中生物降解速率可通过乙醇酸与乳酸的比率来部分地控制。聚乳酸聚乙醇酸(plga)共聚物中的聚乳酸的摩尔百分比(mol%)可在15mol%与约85mol%之间。在一些实施方案中,(plga)共聚物中的聚乳酸的摩尔百分比在约35mol%与约65mol%之间。在一些实施方案中,具有50mol%聚乳酸和50mol%聚乙醇酸的plga共聚物可用于聚合物基质中。
也可基于组成聚合物基质的聚合物的分子量来选择它们。不同分子量的相同或不同聚合组合物可包括在植入物中以调节释放曲线。在一些实施方案中,治疗剂的释放曲线和聚合物的降解可受聚合物基质中的一种或多种聚合物的分子量影响。在一些实施方案中,可有利地选择一种或多种聚(d,l-丙交酯)组分的分子量以控制治疗剂的释放和聚合物的降解。根据一些实施方案,如聚(d,l-丙交酯)的聚合物的平均分子量可为“低的”。根据一些实施方案,如聚(d,l-丙交酯)的聚合物的平均分子量可为“中等的”。根据一些实施方案,在眼内植入物中的聚合物基质中仅包括低分子量聚(d,l-丙交酯)。根据一些实施方案,高分子量(mw)聚(d,l-丙交酯)不存在于可生物降解的聚合物基质中,或它们仅以可忽略量(以植入物的总重量计,植入物的约0.1重量%)存在。通过限制植入物中存在的高分子量聚(d,l-丙交酯)的量,基质降解持续时间可被缩短。
可单独或组合用于形成聚合物基质的一些示例性聚合物包括下表a中所列的那些,可商购获得的聚合物的数据表以引用的方式整体并入本文:
表a
眼内植入物的可生物降解的聚合物基质可包含两种或更多种可生物降解的聚合物的混合物。在一些实施方案中,仅一种上列可生物降解的聚合物用于可生物降解的聚合物基质中。在一些实施方案中,以上图表中所列的任一可生物降解的聚合物都可以各自在12.5%w/w至70%w/w的范围内的量用于药物递送系统或植入物中。在一些实施方案中,以上图表中所列的任一可生物降解的聚合物都可以各自在25%w/w至50%w/w的范围内的量用于药物递送系统或植入物中。在一些实施方案中,以上图表中所列的任一可生物降解的聚合物都可以各自在20%w/w至40%w/w的范围内的量用于药物递送系统或植入物中。在一些实施方案中,以上图表中所列的任一可生物降解的聚合物都可以各自约15%w/w、约25%w/w、约12.5%w/w、约37.5%w/w、约40%w/w、约50%w/w或约60%w/w的量用于药物递送系统或植入物中。例如,植入物可包含第一可生物降解的聚合物和不同第二可生物降解的聚合物的混合物。一种或多种可生物降解的聚合物可具有末端酸基团。
在一些实施方案中,治疗剂自眼内植入物中的可生物降解的聚合物基质的释放可为各种机理和考虑事项的结果。可通过侵蚀可生物降解的聚合物基质,继之以使先前包埋的药物粒子暴露于接受植入物的眼的玻璃体,并且随后溶解和释放治疗剂来实现药剂的释放。就这个药物释放形式来说的释放动力学不同于通过单独聚合物溶胀(如在水凝胶或甲基纤维素的情况下)来释放药剂的制剂的释放动力学。可决定释放动力学的参数包括药物粒子的尺寸、药物的水溶性、药物与聚合物的比率、以及聚合物的侵蚀速率。
根据一些实施方案,组合物和方法在伴随中度基质降解持续时间的情况下延长溴莫尼定游离碱在玻璃体中的递送。可通过与生物可侵蚀的聚(d,l-丙交酯)和/或聚(d,l-丙交酯-共-乙交酯)的适当选择的掺合物一起配制溴莫尼定游离碱来实现持续眼部药物递送。
根据一些示例性实施方案,药物递送系统或植入物可以在25%w/w至约50%w/w的范围内的量含有具有酸封端聚(d,l-丙交酯)的聚合物基质。根据一些示例性实施方案,药物递送系统或植入物可以在植入物的约25%w/w至约50%w/w或约37.5%至约50%w/w的范围内的量含有具有酸封端50:50聚(d,l-丙交酯-共-乙交酯)的聚合物基质。根据一些示例性实施方案,药物递送系统或植入物可以在植入物的约25%w/w至约50%w/w或约15%w/w至约50%w/w的范围内的量含有具有酸封端的75:25聚(d,l-丙交酯-共-乙交酯)的聚合物基质。根据一些示例性实施方案,药物递送系统或植入物可以在植入物的约25%w/w至约50%w/w或约30%至约60%w/w的范围内的量含有具有酸封端的85∶15聚(d,l-丙交酯-共-乙交酯)的聚合物基质。
药物递送系统被设计来在治疗水平下持续一定持续时段(溴莫尼定游离碱递送持续时间)向玻璃体释放溴莫尼定游离碱,接着历经在一半溴莫尼定游离碱递送持续时间至等于溴莫尼定游离碱递送持续时间的时间的范围内的时段降解。根据其它实施方案,包括聚合物基质的药物递送系统可历经约四分之一溴莫尼定游离碱递送持续时间至约一半溴莫尼定游离碱递送持续时间的时段降解。根据其它实施方案,包括聚合物基质的药物递送系统可历经约三分之一溴莫尼定游离碱递送持续时间至约一半溴莫尼定游离碱递送持续时间的时段降解。根据其它实施方案,包括聚合物基质的药物递送系统可历经等于约溴莫尼定游离碱递送持续时间至约两倍于溴莫尼定游离碱递送持续时间的时段降解。例如,在一个实施方案中,眼内植入物可包括溴莫尼定游离碱和可生物降解的聚合物基质的混合物,其历经三个月的时段释放溴莫尼定游离碱,接着聚合物基质持续额外2个月的时段降解直至植入物被完全降解或几乎完全降解。根据一些实施方案,溴莫尼定游离碱递送持续时间是在约1个月至约6个月、约1个月至约5个月、约1个月至约3个月、约1个月至约4个月、约2个月至约4个月、或约3个月至约6个月的范围内的时段。根据一些实施方案,总药物递送系统的聚合物基质降解时间在约1个月至约7个月、约1个月至约6个月、约3个月至约7个月、约1个月至约4个月、约3个月至约4个月、约4个月至约5个月、约5个月至约7个月、或约3个月至约6个月的范围内。根据一些实施方案,药物递送系统的聚合物基质降解时间少于10周、少于8周、少于6周或少于4周。
根据一个示例性实施方案,可生物降解的眼内植入物包含与可生物降解的聚合物基质缔合的溴莫尼定游离碱,所述基质包含不同可生物降解的聚合物的混合物。以植入物的总重量计,溴莫尼定游离碱是以50重量%的量存在于植入物中。第一可生物降解的聚合物是具有在0.16dl/g与0.24dl/g之间的固有粘度,并且以植入物的总重量计,占植入物的25重量%的酸封端的聚(d,l-丙交酯)。第二可生物降解的聚合物是具有75mol%聚乳酸和25mol%聚乙醇酸的plga共聚物。plga共聚物具有在0.16dl/g与0.24dl/g之间的固有粘度,并且以植入物的总重量计,plga共聚物占植入物的重量的25%。所述混合物历经约三个月的递送持续时间有效释放有效量的溴莫尼定游离碱,接着历经额外一至两个月,小于两倍于溴莫尼定游离碱递送持续时间的跨度降解聚合物基质。
根据另一示例性实施方案,可生物降解的眼内植入物包含与可生物降解的聚合物基质缔合的溴莫尼定游离碱,所述基质包含单一类型的可生物降解的聚合物。以植入物的总重量计,溴莫尼定游离碱是以50重量%的量存在于植入物中。在这个实施方案中,可生物降解的聚合物基质由具有85mol%聚乳酸和15mol%聚乙醇酸的plga共聚物制得。plga共聚物具有在1.3dl/g与1.7dl/g之间的固有粘度,并且以植入物的总重量计,plga共聚物占植入物的重量的50%。所述混合物历经约三或四个月的递送持续时间有效释放有效量的溴莫尼定游离碱,接着历经额外一至两个月,小于两倍于溴莫尼定游离碱递送持续时间的跨度降解聚合物基质。
制造植入物
根据一些实施方案,可通过适合聚合物加工方法来形成眼内植入物。在一个实施方案中,可在如turbula混合器的混合器中掺合治疗剂(如溴莫尼定游离碱)的混合物与pla和/或plga聚合物。在一个实施方案中,眼内植入物是通过挤出形成。挤出可通过如haake挤出机的适合挤出机来进行。在已将治疗剂和聚合物基质掺合在一起之后,它们可接着被强制馈入挤出机中,并且被挤出成为长丝。挤出的长丝可接着被切割成具有靶标重量的植入物。在一些实施方案中,可切割800μg植入物以历经溴莫尼定游离碱递送持续时间递送约300μg、400μg或500μg药物。可接着将植入物装载至如25g施加器的注射装置中并灭菌。根据一些实施方案,挤出的长丝被切割成小于1000μg、小于800μg、或小于600μg的重量。在一些实施方案中,植入物可被γ灭菌。植入物可在如20kgy至60kgy、25kgy至50kgy、25kgy至40kgy等的剂量下被γ灭菌。
治疗方法
根据一个实施方案,一种用于治疗后眼部病状的方法包括向人或动物患者,并且优选是活人或动物的眼的后段施用植入物,如本文公开的植入物。在一些实施方案中,一种治疗患者的方法可包括将植入物直接放置至眼的后房中。在一些实施方案中,一种治疗患者的方法可包括通过玻璃体内注射、结膜下注射、筋膜下注射、眼球后注射和脉络膜上注射中的至少一个向所述患者施用植入物。
在至少一个实施方案中,一种治疗患者的视网膜色素变性、青光眼、黄斑变性和/或地图状萎缩的方法包括通过玻璃体内注射、结膜下注射、筋膜下注射、眼球后注射和脉络膜上注射中的至少一个向患者施用一种或多种如本文公开的含有溴莫尼定游离碱的植入物。包括适当尺寸针(例如27规格(gauge)针或30规格针)的注射器装置可有效用于以组合物注射人或动物的眼的后段。根据一些实施方案,向患者施用至多一次注射以治疗病状。根据其它实施方案,向患者施用一次以上注射以治疗病状。
实施例
产生含有溴莫尼定酒石酸盐或溴莫尼定游离碱和可生物降解的聚合物基质的示例性眼内植入物,并且测试它们的释放和降解性质。首先称取溴莫尼定酒石酸盐或溴莫尼定游离碱,并且使其与pla和/或plga聚合物在turbula混合器中掺合30分钟。接着通过强制馈料器将所得粉末掺合物馈入haake挤出机中。将挤出的长丝切割成具有例如857μg或800μg的靶标重量以实现每个植入物递送300μg溴莫尼定酒石酸盐或400μg溴莫尼定游离碱的植入物。将植入物装载至25g施加器中,并且在25至40kgy剂量下进行γ灭菌。通过hplc测定确认每个植入物的效价。
使用溴莫尼定酒石酸盐(作为比较实施例1-4)和溴莫尼定游离碱(实施例1-4)作为药物的制剂组合物的实施例和比较实施例分别显示于表b和c中,并且它们的药物释放曲线分别显示于图1和2中。在图1和2中,y轴是天数,y轴是总释放百分比(%)。对于体外药物释放测试,自挤出的长丝随机切割每种各制剂四个植入物,γ灭菌,并且在设置在37℃和50rpm下的振荡水浴中在10ml0.01mpbs(ph7.4)中孵育。在指定时间点对药物释放取样,并且通过hplc测定分析药物含量。在各取样时间点期间,用新鲜介质完全替换释放介质。如通过在25℃下于0.01mpbs(ph7.4)中孵育植入物样品以及它们的通过尺寸排阻色谱法测定的mw确定的聚合物mw降解速率常数k也包括在表b和c中。
表b溴莫尼定酒石酸盐制剂比较实施例组成、尺寸和降解动力学参数
表c溴莫尼定游离碱实施例制剂组成、尺寸和降解动力学参数
接着在体外以及在体内分析聚合物基质降解。对于体外研究,如上所述的聚合物mw降解速率常数k用于通过假定降解遵循一级动力学来计算聚合物mw降解成1000da的时间t(1000)。对于体内研究,通过收集注射至新西兰兔的玻璃体中的植入物样品来测定聚合物基质降解。结果概述于表d中。
表d溴莫尼定制剂体外和体内药物释放和聚合物基质降解时间
含有溴莫尼定和可生物降解的聚合物基质的眼内植入物的体外测试
重量损失研究
对于植入物重量损失研究,首先称取各植入物,移动至塑料微孔盒中,并且在用pbs(ph7.4,0.01m)填充的玻璃缸中孵育,随后放置在设置在37℃和50rpm下的振荡水浴中。在指定时间点收集植入物,并且在真空下干燥。记录干燥植入物的重量,并且计算植入物重量损失。结果概述于表e中,并且显示溴莫尼定游离碱植入物比那些溴莫尼定酒石酸盐植入物更快速损失重量,从而暗示和说明基质降解速率存在差异。
表e在37℃下于pbs(ph7.4,0.01m)中的植入物重量损失
植入物溶胀
为探究植入物溶胀,在玻璃闪烁小瓶中于20mlpbs(ph7.4,0.01m)中孵育各植入物,并且放置在设置在37℃和50rpm下的振荡水浴中。记录植入物图像,并且概述于图12中。结果显示溴莫尼定游离碱植入物溶胀,并且降解比那些溴莫尼定酒石酸盐植入物快得多。
含有溴莫尼定和可生物降解的聚合物基质的眼内植入物的体内测试
溴莫尼定酒石酸盐制剂在兔和猴眼中的药物释放分别显示于图3和4中。溴莫尼定游离碱制剂在兔和猴眼中的药物释放显示于图5和6中。
通过在指定时间点自玻璃体液撷取植入物来测定体内药物释放曲线。在体内植入之前和之后记录植入物质量以测定残余聚合物基质的量。两种动物模型中的药物释放速率显示实施例4具有最高释放速率,继之以实施例1,接着实施例3,接着实施例2显示最慢药物释放速率。
白化兔眼的视网膜(视神经)中的溴莫尼定酒石酸盐制剂的药物浓度显示于图7中。所有制剂都维持溴莫尼定浓度高于人α2aec90(88nm,25.7ng/ml)超过3个月。对于溴莫尼定游离碱制剂,测定视网膜(兔中的视神经以及猴中的黄斑)中的药物浓度,并且兔和猴的结果分别显示于图8和9中。所有制剂在兔视神经中的溴莫尼定浓度高于人α2aec90的时段都≤3个月。相比之下,除持续约1个月的实施例4之外,所有制剂在猴黄斑中的溴莫尼定浓度高于人α2aec90的时间都≥4个月。
溴莫尼定酒石酸盐和游离碱制剂在猴眼中的聚合物基质降解分别显示于图10和11中。对于溴莫尼定酒石酸盐制剂,比较实施例1和比较实施例2制剂在1年内有小于50%的基质被降解,而比较实施例3和比较实施例4的基质降解达到90%以上。对于溴莫尼定游离碱制剂,所有制剂在一个月之后都变小且难以触摸,例外之处是聚合物基质被预期持续约六个月的实施例2。体外基质降解观察结果与体内结果匹配。
通过照片图像来分析溴莫尼定酒石酸盐和游离碱制剂在兔眼中的聚合物基质降解,并且溴莫尼定酒石酸盐制剂的基质降解时间长于6个月,而溴莫尼定游离碱制剂的基质降解时间短于4个月。
用于制剂中的聚合物包括但不限于聚(d,l-丙交酯)和聚(d,l-丙交酯-共-乙交酯)。它们概述于表a中。
四种溴莫尼定游离碱制剂显示植入物具有自一个月至四个月的控制药物释放,并且聚合物基质持续小于两倍于药物释放持续时间。相比之下,溴莫尼定酒石酸盐制剂与溴莫尼定游离碱制剂持续类似持续时间来递送药物,但聚合物基质持续超过两倍于药物释放持续时间。
尽管已在某些优选实施方案和实施例的上下文中公开了本发明,但本领域技术人员将了解本发明超出明确公开的实施方案扩展至本发明的其它替代性实施方案和/或用途以及其明显修改和等效物。此外,尽管已详细显示和描述本发明的许多变化,但在本发明的范围内的其它修改将为本领域技术人员基于本公开而易于显而易知。也预期可进行实施方案的特定特征和方面的各种组合或子组合,并且仍然属于本发明的范围。因此,应了解公开的实施方案的各种特征和方面可彼此组合或替换以执行公开的本发明的不同模式。因此,意图本文公开的本发明的范围不应受限于上述特定公开的实施方案,但应仅通过清楚阅读权利要求来确定。
- 还没有人留言评论。精彩留言会获得点赞!