一种奥利司他滴丸及其制备方法与流程
本发明属于医药制剂领域,具体涉及一种奥利司他滴丸及其制备方法。
背景技术:
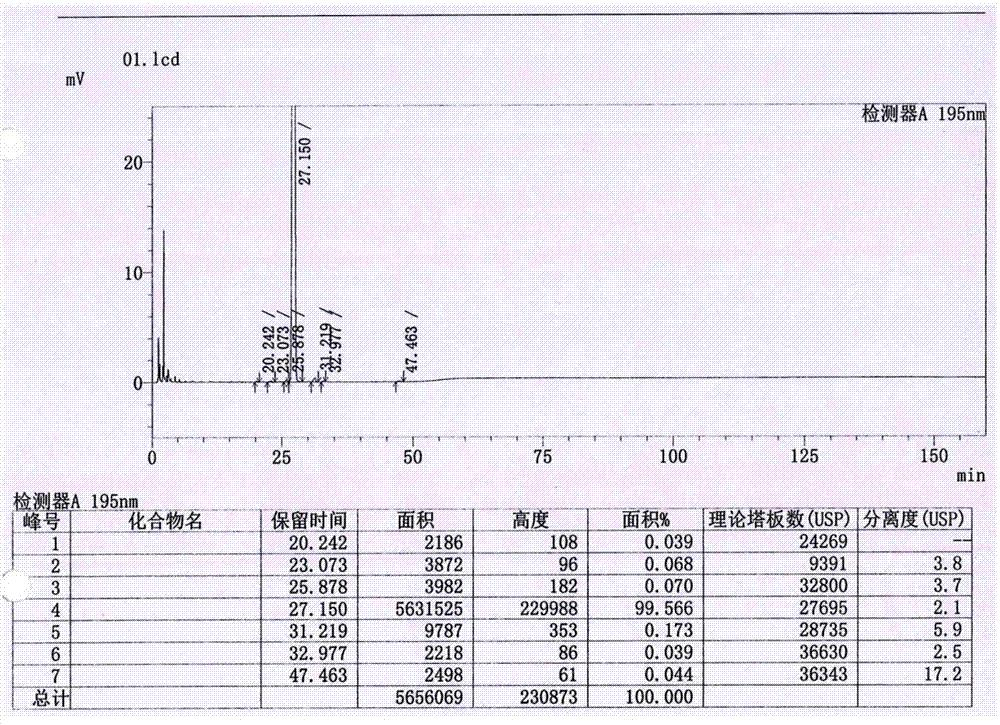
:奥利司他(orlistat)为由罗氏制药公司研发的脂肪酶抑制剂类减肥药,商品名为xenical,上个世纪九十年代末率先在欧美上市,2001年在中国上市,并于2005年被中国食品药品监督管理局批准转为非处方药。其化学名为n-甲酰-l-亮氨酸(s)-1[(2s,3s)3-己基-4氧基-2-环氧丙基甲基]十二酯,也称四氢脂抑素(tetrahydrolipstatin,thl),是一种半合成的脂抑素衍生物,其化学结构式如下所示:奥利司他以b晶型的胶囊剂与片剂供药用,也是目前国内外唯一一种不影响食欲、不作用于中枢神经系统的化学减肥药,安全性特征优越,brayga于《柳叶刀》杂志发表的一篇名为“managementofobesity”的文章中将奥利司他描述为“最安全”(safest)的减肥药。市售制剂中的b型奥利司他结晶为白色至灰白色结晶性粉末,基本不溶于水,易溶于氯仿,极易溶于甲醇与乙醇,且在生理ph值范围内无pka值。而b晶型奥利司他的熔点仅为43℃,高于此温度,奥利司他溶解为油状液体。由于奥利司他不溶于水,制备成固体口服制剂的胶囊剂和片剂,不利于奥利司他口服后的释放,生物利用度较低。因此,迫切需要改善奥利司他制剂所存在的不足,扩大临床应用,借以应对日趋严峻的肥胖症。中国专利申请cn102362863a公开了一种奥利司他的制剂及其制备方法,所述制剂通过将奥利司他熔融液,包衣在空白片或空白小丸表面形成所述的奥利司他包衣层后制备而成。该制剂有效解决了生成过程中因奥利司他融化而导致的粘冲问题,同时保持了较好的稳定性。中国专利cn103006601a公开了一种奥利司他片剂及其制备方法,该片剂由含二氧化硅的奥利司他磷脂组合物与药用辅料直接压片而成,所述含二氧化硅的奥利司他磷脂组合物中,奥利司他、磷脂和二氧化硅的重量比为1:0.5-1.5:0.5-3。该发明解决了奥利司他常规工艺压片粘冲、贮存中稳定性差的问题。上述2个专利均不同程度的解决了奥利司他制剂在生产中的粘冲和稳定性问题,但由于剂型和奥利司他本身的性质,奥利司他片剂、胶囊等制剂在胃肠道与食道混合消化时,很难分布均匀与胃肠道脂肪酶充分接触,从而导致局部药物浓度高,并且造成大部分药物未发挥作用,普遍存在溶出度差,生物利用度低的问题。另外的,在合成、制剂等过程中容易混入杂质,影响奥利司他的生物活性。因此,迫切需要开发一种杂质含量少、溶出度高、显著提高生物利用度的奥利司他滴丸及其制备方法。技术实现要素:为解决现有技术中存在的缺点和不足,本发明的主要目的在于提供一种杂质含量少、溶出度高、显著提高生物利用度的奥利司他滴丸及其制备方法。为了达到上述目的,本发明通过以下技术方案实现:一种奥利司他滴丸,所述滴丸包括以下原料及其重量份数:奥利司他100~200份、聚乙二醇150050~150份、聚乙二醇4005~15份、蔗糖脂肪酸酯5~15份和甘油5~15份。进一步地,所述滴丸包括以下原料及其重量份数:奥利司他100~150份、聚乙二醇1500100~150份、聚乙二醇40010~15份、蔗糖脂肪酸酯10~15份和甘油10~15份。更进一步地,所述滴丸包括以下原料及其重量份数:奥利司他120份、聚乙二醇1500100份、聚乙二醇40010份、蔗糖脂肪酸酯10份和甘油10份。进一步地,所述滴丸的制备方法包括以下步骤:s1、混合:取相应量聚乙二醇1500加热到40~42℃,加入相应量聚乙二醇400、蔗糖脂肪酸酯和甘油,水浴加热搅拌,得基质溶液;将相应量的奥利司他用无水乙醇溶解后加入所得的基质溶液中,搅拌均匀,保持温度为40~42℃,挥去乙醇至无醇味,静置除气泡,得奥利司他药液;s2、滴丸:将步骤s1所得奥利司他药液加入滴料缸中,保持滴料缸温度为40~42℃,冷却槽加入二甲基硅油,降低冷却槽温度,进行滴丸,控制滴丸为50mg/丸,用滤纸吸掉二甲基硅油,放入不锈钢盘中自然干燥,得干燥滴丸;s3、捡丸:挑捡出步骤s2所得干燥滴丸中圆整度、大小和重量不合格的滴丸,得圆整均匀的滴丸;s4、包装:将步骤s3所得圆整均匀的滴丸定量装入药用高密度聚乙烯瓶中,封口,即得。更进一步地,所述步骤s1中,奥利司他和无水乙醇的重量体积比为(1~2):1。进一步地,所述步骤s2中,冷却槽的温度为2~6℃。另外的,本发明还提供了一种所述奥利司他滴丸的制备方法,包括以下步骤:i、混合:取相应量聚乙二醇1500加热到40~42℃,加入相应量聚乙二醇400、蔗糖脂肪酸酯和甘油,水浴加热搅拌,得基质溶液;将重量体积比为(1~2):1的奥利司他和无水乙醇混合溶解,加入所得的基质溶液中,搅拌均匀,保持温度为40~42℃,挥去乙醇至无醇味,静置除气泡,得奥利司他药液;ii、滴丸:将步骤i所得奥利司他药液加入滴料缸中,保持滴料缸温度为40~42℃,冷却槽加入二甲基硅油,降低冷却槽温度为2~6℃,进行滴丸,控制滴丸为50mg/丸,用滤纸吸掉二甲基硅油,放入不锈钢盘中自然干燥,得干燥滴丸;iii、捡丸:挑捡出步骤ii所得干燥滴丸中圆整度、大小和重量不合格的滴丸,得圆整均匀的滴丸;iv、包装:将步骤iii所得圆整均匀的滴丸定量装入药用高密度聚乙烯瓶中,封口,即得。本发明奥利司他滴丸通过将奥利司他与聚乙二醇、蔗糖脂肪酸酯和甘油等基质加热溶解,使奥利司他与一定配比制备的基质形成共熔物,口服后以熔蚀的方式释放,释放速度快,生物利用度、释放度等诸多方面得到了显著的改善。这点由试验例1可以看出,本发明实施例1~3制备的奥利司他滴丸的溶出度均在95%以上,远高于对比例4~5市售的奥利司他片剂或胶囊剂,表明本发明的药物释放速度快,释放效果好,具有良好的生物利用度。而对比例1~3(分别去掉蔗糖脂肪酸酯、甘油和聚乙二醇400)溶出度显著降低20%左右。与现有技术相比,本发明具有以下有益效果:(1)本发明一种奥利司他滴丸通过将聚乙二醇、蔗糖脂肪酸酯和甘油按照一定的配比与奥利司他形成共熔物而制成,所得滴丸杂质含量少,安全性高,溶出度均在95%以上,显著提高了奥利司他的生物利用度。(2)本发明一种奥利司他滴丸的制备方法简单、易操作,适用于大规模生产,有利于奥利司他滴丸的推广和应用。附图说明图1是实施例1制备的奥利司他滴丸的有关物质检测图谱;图2是实施例2制备的奥利司他滴丸的有关物质检测图谱;图3是实施例3制备的奥利司他滴丸的有关物质检测图谱;图4~5是实施例1制备的奥利司他滴丸的含量检测图谱;图6~7是实施例2制备的奥利司他滴丸的含量检测图谱;图8~9是实施例3制备的奥利司他滴丸的含量检测图谱;图10是奥利司他标准品红外图谱;图11是实施例1制备的奥利司他滴丸的红外图谱;图12是实施例2制备的奥利司他滴丸的红外图谱;图13是实施例3制备的奥利司他滴丸的红外图谱。具体实施方式以下通过具体实施例再对本发明的上述内容作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅局限于以下的实施例。在不脱离本发明上述技术思想的情况下,根据本领域普通技术知识和惯用手段做出的各种替换或变更,均应包括在本发明的范围内。实施例1~3一种奥利司他滴丸由表1所示原料及其重量份数制成:表1实施例1~3滴丸的原料及重量份数原料实施例1实施例2实施例3奥利司他120100150聚乙二醇1500100120150聚乙二醇400101215蔗糖脂肪酸酯10815甘油101215制备方法:i、混合:取相应量聚乙二醇1500加热到42℃,加入相应量聚乙二醇400、蔗糖脂肪酸酯和甘油,水浴加热搅拌,得基质溶液;将重量体积比为1.5:1的奥利司他和无水乙醇混合溶解,加入所得的基质溶液中,搅拌均匀,保持温度为42℃,挥去乙醇至无醇味,静置除气泡,得奥利司他药液;ii、滴丸:将步骤i所得奥利司他药液加入滴料缸中,保持滴料缸温度为42℃,冷却槽加入二甲基硅油,降低冷却槽温度为4℃,进行滴丸,控制滴丸为50mg/丸,用滤纸吸掉二甲基硅油,放入不锈钢盘中自然干燥,得干燥滴丸;iii、捡丸:挑捡出步骤ii所得干燥滴丸中圆整度、大小和重量不合格的滴丸,得圆整均匀的滴丸;iv、包装:将步骤iii所得圆整均匀的滴丸定量装入药用高密度聚乙烯瓶中,封口,即得。对比例1一种奥利司他滴丸与实施例1不同之处在于,对比例1去掉蔗糖脂肪酸酯,增加聚乙二醇1500的重量份数至110份,其余参数及操作参考实施例1。对比例2一种奥利司他滴丸与实施例1不同之处在于,对比例2去掉甘油,增加聚乙二醇1500的重量份数至110份,其余参数及操作参考实施例1。对比例3一种奥利司他滴丸与实施例1不同之处在于,对比例3去掉聚乙二醇400,增加聚乙二醇1500的重量份数至110份,其余参数及操作参考实施例1。对比例4一种奥利司他片市售奥利司他片,购于浙江海正药业股份有限公司,国药准字h20100089。对比例5一种奥利司他胶囊市售奥利司他胶囊,购于重庆华森制药股份有限公司,国药准字h20103180。试验例1奥利司他体外溶出度检测1.试验材料:实施例1~3和对比例1~3制备的奥利司他滴丸还有对比例4奥利司他片和对比例5奥利司他胶囊。2.试验方法:以900ml含有3.0%sds和0.5%氯化钠的ph为6.0的磷酸盐缓冲溶液作为溶出介质,转速为75rpm,参考《中国药典》(2015年版第四部)通则0931溶出度与释放度测定法第二法进行测定,45min后取5ml续滤液作为供试品溶液,用高效液相色谱仪,以ultimatexb-c18(4.6mm×250mm,3μm)作为色谱柱,柱温设为35℃,使用紫外检测器,设置检测波长为195nm,进样量为10μl,以乙腈:水=83:17作为流动相,设置流速为1.3ml/min进行检测,按外标法计算奥利司他的溶出度。3.实验结果:表2奥利司他溶出度的测定结果组别45min溶出度(%)实施例196.9实施例296.5实施例395.7对比例175.3对比例278.1对比例373.4对比例455.1对比例557.8由表2可见,本发明制备的奥利司他滴丸的溶出度均在95%以上,远高于对比例4~5市售的奥利司他片剂或胶囊剂,表明本发明的药物释放速度快,释放效果好,具有良好的生物利用度。而对比例1~3(分别去掉蔗糖脂肪酸酯、甘油和聚乙二醇400)溶出度显著降低20%左右。试验例2奥利司他滴丸质量测定1.实验材料:实施例1~3制备的奥利司他滴丸。2.试验方法:对实施例1~3制备的奥利司他滴丸的杂质、有效成分含量、重量差异、红外图谱等指标进行测定。3.实验结果:奥利司他滴丸的杂质、含量、红外鉴别及重量差异参见表3,具体图谱参见图1~13。表3奥利司他滴丸的质量测定结果由表3可见,本发明实施例1~3制备的奥利司他滴丸杂质含量少,有效成分含量高,符合标准质量要求。上述实施例仅示例性说明本发明的原理及其性能,不应视为对本发明的限制,本发明的范围保护应当以权利要求所限定的范围为准。对于本
技术领域:
的普通技术人员而言,皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属
技术领域:
中具有通知常识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1