辅酶Q10包合物自组装脂质体前体及其制备方法与流程
本发明涉及一种辅酶q10包合物自组装脂质体前体及制备方法,该包合物自组装脂质体前体对心血管疾病、高山缺氧、糖尿病、免疫力低下等疾病具有较好治疗和保健作用,它属于药品、保健品
技术领域:
。
背景技术:
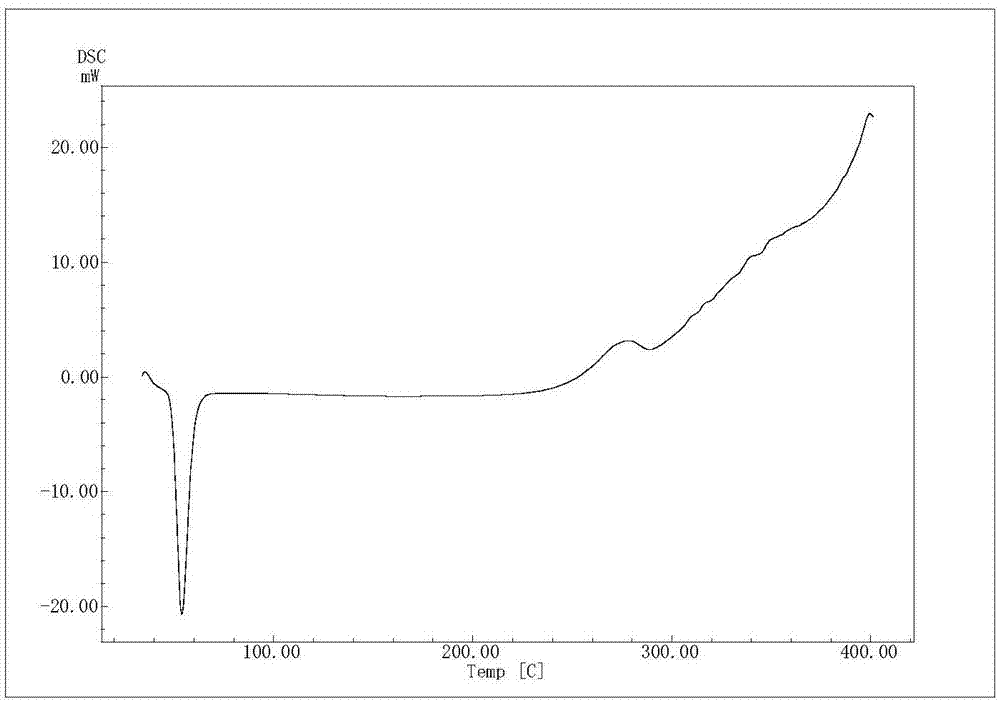
:辅酶q10(coenzymeq10)是一种由人体自行合成的化合物,因其母核六位上的侧链-聚异戊二烯基的聚合度为10而得名,结构与维生素k类似。辅酶q10分为还原型辅酶q10(coq10h2,ubiquinol,泛醇)与氧化型辅酶q10(coq10,ubiquinone,泛醌)两种形态,coq10h2是coq10的二电子还原体。在体内,coq10h2与coq10作为一类递氢/递电子体共同参与线粒体内膜呼吸链等跨膜电子运输体系和细胞氧化磷酸化过程,在三磷酸腺苷(atp)的合成中起着重要作用。辅酶q10是人体中不可缺少的重要生理物质,其化学结构特点决定了它在人体中具有许多重要生理功能,它是生命活动中重要的能量传递物质,是线粒体呼吸链限速反应的关键性物质,在细胞能量生成、抗氧化清除自由基、增强生物活力方面发挥重要作用。人体中含辅酶q10总量为500-1500mg,20岁左右达到高峰,然后迅速减少,70岁以后比20岁年轻人减少57%。研究发现,在很多患病病人中,辅酶q10生理水平下降明显,如心衰病人(hf)中,病人心肌及血液中辅酶q10含量明显降低,从外源补充辅酶q10后,明显改善病人症状。研究发现,很多免疫力低下的病人和肿瘤病人,其辅酶q10生理水平也较低,补充辅酶q10后,症状都得到改善。因此,人体从外源补充辅酶q10,治疗各种辅酶q10生理水平低下成为一种公认的临床治疗方法。辅酶q10是脂溶性物质,难溶于水,属于生物药剂学ⅱ类物质,溶解是其吸收限速步骤,口服给药生物利用度较低,其绝对生物利用度不足5%。其中辅酶q10对光、热、水不稳定,因而辅酶q10由于生物利用度和稳定性的问题限制了应用,针对这种情况,近年来已经开发出多种提高口服给药生物利用度和稳定性的方法,如包合技术、乳化技术、脂质体等。目前已公开发表的文献,经检索与本专利关联的有如下专利和文献:①在文献journalactapoloniaepharmaceutica(1995),vol.52,no.5,pp.379-386和1996,vol.53,no.3,pp.193-196.中描述了采用搅拌方法制备了辅酶q10的γ-环糊精包合物。②美国专利6861447,该专利公开了制备γ-环糊精包合物的方法。③世界专利wo2005/111224公开了一种新的辅酶q10的β-环糊精包合物制备方法,采用搅拌法制备。④中国专利cn200510048010.3公开了一种水溶性辅酶q10组合物的制备技术。⑤国际专利03802446.2公开了还原型辅酶q10的稳定方法和组合物。⑥中国专利zl200610046307.0公开了一种水溶性辅酶q10羟丙基-β-环糊精包合物及制备方法。⑦中国专利cn200510137887.x公开了辅酶q10脂质体的药物制剂及其制备工艺,⑧文献食品科学,2007,vol28,no3中描述了辅酶q10脂质体制备方法。⑨文献“食品工业科技”2015,vol.36,no.21中描述了辅酶q10脂质体前体制备和质量研究。上述文献主要是公开了辅酶q10的环糊精包合物和脂质体及其制备方法,包合技术和脂质体是解决辅酶q10溶解度和生物利用度的一个较好方法,虽然环糊精包合物和脂质体都提高了辅酶q10溶解度和生物利用度,但辅酶q10的环糊精包合物溶解度仍然较小,溶出不完全,而辅酶q10脂质体基本是液体形式,理化性质不稳定,无法长期放置,制备过程需要有机溶媒和胆固醇,产品中含有胆固醇和溶剂残留。两者的大鼠生物利用度报道一般在1-3倍,未达到理想水平。包合物自组装脂质体技术是将两者融合在一起的新型技术,可以发挥两者的长处,解决两种技术的缺陷,包合物自组装脂质体的制备方法包括一步法和两步法,两步法是先制备包合物,再用有机溶剂溶解脂质和附加剂,制备脂质体;一步法是将主药、环糊精、脂质、附加剂共同溶在有机溶剂中制备;两种方法都必须使用有机溶媒溶解主药和脂质及附加剂,附加剂通常是胆固醇,这些对人体安全性构成一定影响。目前包合物自组装脂质体一般为液体,稳定性较差。而且目前报道的脂质体固体前体基本是先制备好脂质体溶液再冻干成固体,其覆水重建脂质体稳定性差,未见不制备成脂质体的自组装成脂质体前体的方法,目前未见有包合物自组装脂质体前体文献报道和专利,其中更未见有辅酶q10包合物自组装脂质体和辅酶q10包合物自组装脂质体前体文献和专利。以上专利文献均未涉及本发明技术,目前未检索到辅酶q10包合物自组装脂质体和其包合物脂质体的专利及文献研究报道。技术实现要素:本发明就是为了解决上述技术问题,而提供了一种辅酶q10包合物自组装脂质体前体及制备方法,本发明利用环糊精对辅酶q10包合作用以及脂质体双相载药作用,形成了辅酶q10包合物自组装脂质体前体,它可以在模拟含有胆酸的人工肠液中可以自组装为脂质体,它与辅酶q10包合物和辅酶q10脂质体相比具有更显著的溶解度、溶出度和生物利用度,也具有较好的稳定性,在实际的工业化生产中更容易实现和更稳定的产品保质期。为了解决上述技术问题,本发明是通过下述技术方案实现的:辅酶q10包合物自组装脂质体前体,它是由下述原料按重量比制备而成:辅酶q10:环糊精:卵磷脂:甘露醇=1:5-15:0.5-1.5:5-15。上述辅酶q10包合物自组装脂质体前体,它是由下述原料按重量比制备而成:辅酶q10:环糊精:卵磷脂:甘露醇=1:7-10:0.8-1.5:5-10。上述的环糊精是γ-环糊精、β-环糊精或羟丙基-β-环糊精。上述的卵磷脂是大豆卵磷脂或蛋黄卵磷脂。上述的辅酶q10包合物自组装脂质体前体的制备方法,其工艺步骤如下:按所述重量比取环糊精和辅酶q10,加入到相当于环糊精5-8倍重量份的水混合分散均匀,搅拌成糊状,加热至50℃-60℃,放入胶体磨中,循环研磨5-10次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;按所述重量比取磷脂,加入到相当于环糊精5-8倍重量份的水混合分散均匀,得磷脂分散液备用;按所述重量比取甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度90-110℃,出风温度35-45℃,即得辅酶q10包合物自组装脂质体前体。由于采用上述技术方案,使得本发明具有如下特点和效果:本发明得到的辅酶q10包合物自组装脂质体前体具有如下特征:它是一种含有辅酶q10环糊精包合物的脂质体前体,辅酶q10与环糊精形成的包合物在磷脂膜存在的情况下遇水含胆酸肠液介质可以自组装为包合物脂质体,包合的和未被包合的辅酶q10均被磷脂双层分子包裹在内相和双层磷脂间,在含胆酸的人工肠液环境中,肠液中胆酸有利于这种脂质体的形成,类似胆酸混合胶束,粒径更小,促进生物膜吸收。出人意料的是这种包合物自组装脂质体前体与辅酶q10原型药或其包合物或单纯脂质体相比,在含有胆酸的人工肠液中具有极为显著的溶出度和溶解度,大鼠生物利用度试验显示其12小时生物利用度相当于原型药6.8倍,显著超过包合物的原型药3.7倍和单纯脂质体的原型药4.2倍,证明了其具有显著的生物吸收特性。分析其吸收机制,其除了形成脂质体促进吸收,也可能存在其他吸收机制,分析该前体遇肠液后,磷脂与环糊精包合的辅酶q10可能发生部分置换现象,因为磷脂与环糊精结合常数远大于辅酶q10与环糊精,置换出来的单分子状态辅酶q10可被胆酸分子捕获可形成脂质体胆酸混合胶束,而这种胆酸胶束具有较强的转运通过黏膜能力。体外溶出度试验证实,本发明的环糊精包合物自组装脂质体前体人工肠液60分钟溶出度达到90%以上,其原型药同条件下溶出度小于5%,包合物溶出度30%,单纯脂质体溶出度40%;大鼠生物利用度试验本发明的环糊精包合物自组装脂质体前体cmax达到30.78mg/l,其原型药的cmax为2.39mg/l,包合物的cmax为16.64mg/l,单纯脂质体的cmax为18.84mg/l;包合物自组装脂质体前体的12小时生物利用度相当于原型药6.8倍,包合物自组装脂质体前体、包合物、单纯脂质体的24小时生物利用度分别是原型药的4.8倍、2.7倍、2.9倍。辅酶q10包合物自组装脂质体前体其体外溶出和生物利用度显著优于单纯包合和脂质体技术,与原型药相比更为显著。本发明的环糊精包合物自组装脂质体前体与传统脂质体技术不同的是,可以在肠液中自组装形成包合物脂质体,不使用有机溶媒和胆固醇,没有事先形成脂质体再干燥过程,很容易进行工业化生产,制剂稳定性更高,服用更为安全。本发明得到的辅酶q10包合物自组装脂质体前体,它是在形成辅酶q10环糊精包合物的基础上,通过包裹在甘露醇颗粒上磷脂膜遇胆酸肠液介质与其包合物自组装形成包合物脂质体,重建的脂质体液体粒径为大约170~210nm。这主要通过如下试验来验证,将本发明的包合物自组装脂质体前体水介质重建液冻干物、辅酶q10、环糊精、卵磷脂、甘露醇物理混合物做热分析(dsc)和高效液相色谱,结果表明,本发明的包合物自组装脂质体前体重建液冻干物物相dsc图谱不同于其物理混合物物相图谱,新的包合物自组装脂质体前体重建液冻干物dsc图谱中辅酶q10熔点峰特征峰消失,本发明环糊精包合物自组装脂质体前体重建在含胆酸人工肠液中平均粒径为170~210nm,zeta电位为-40~-70mv,重建液脂质体包封率大于63%,透射电镜呈相显示形成的脂质体为圆形,证明形成了脂质体,体外溶出度测定和生物利用度试验表明,其显著优于原型药、包合物、脂质体。本发明的辅酶q10包合物自组装脂质体前体由于其较高的溶出度,因此在清除自由基试验中具有较好的效果,本发明的辅酶q10包合物自组装脂质体前体清除自由基能力显著超过其辅酶q10包合物、单纯脂质体、原型药。本发明的辅酶q10包合物自组装脂质体前体中辅酶q10含量测定方法,取辅酶q10包合物自组装脂质体前体适量,加少量水溶散,用乙醇加热超声,放冷定容至规定浓度后,过滤,取续滤液作为供试品溶液,进样,色谱条件:辅酶q10:c18柱,流动相为乙腈∶四氢呋喃∶水=55∶40∶5(体积比),检测波长280nm,外标法定量,即得。本发明的辅酶q10包合物自组装脂质体前体包封率的测定。取包合物自组装脂质体前体样品适量,分散于适量含胆酸人工肠液中,使充分溶解,过0.45μm的滤膜,取续滤液作为供试品溶液,进样,测定包合物自组装脂质体前体中不含游离药物的辅酶q10含量;另取辅酶q10包合物自组装脂质体前体样品适量,加少量水溶散,用乙醇加热超声,放冷定容至规定浓度后,过滤,取续滤液作为供试品溶液,进样,测定包合物自组装脂质体前体中辅酶q10总含量,计算包封率。本发明的辅酶q10包合物自组装脂质体前体覆水后粒径及zeta电位的测定。取辅酶q10包合物自组装脂质体前体用适量含胆酸人工肠液分散,测试温度均为25℃,测试次数为3次,采用动态激光光散射粒径测定仪测定粒径及zeta电位。本发明的辅酶q10包合物自组装脂质体前体覆水后透射电镜测定。取辅酶q10包合物自组装脂质体前体适量,加入适量含胆酸人工肠液分散,取适量分散液均匀铺展在铜网上,滴加2%的磷钨酸水溶液负染15min,自然干燥后,取出铜网,在透射电镜下观察样品的表面形态与结构,辅酶q10包合物自组装脂质体前体为圆形或类圆形实体小球,大小比较均匀,分散较好,基本无黏连。热分析(dsc)测定:取辅酶q10、卵磷脂、环糊精、甘露醇及它们的物理混合物及包合物自组装脂质体前体覆水冻干物各5mg,压片、进行热分析(dsc)测定,结果见图1、图2、图3、图4、图5、图6、图7、图8、图9、图10、图11、图12。附图说明图1是q10原料dsc谱图。图2是卵磷脂dsc谱图。图3是β-环糊精dsc谱图。图4是γ-环糊精dsc谱图。图5是羟丙基-β-环糊精dsc谱图。图6是甘露醇dsc谱图。图7是辅酶q10、卵磷脂、β-环糊精、甘露醇物理混合物dsc谱图。图8是辅酶q10、卵磷脂、羟丙基-β-环糊精、甘露醇物理混合物dsc谱图。图9是辅酶q10、卵磷脂、γ-环糊精、甘露醇物理混合物dsc谱图。图10是实施例5辅酶q10β-环糊精包合物自组装脂质体前体dsc谱图。图11是实施例10辅酶q10羟丙基-β-环糊精包合物自组装脂质体前体dsc谱图。图12是实施例15辅酶q10γ-环糊精包合物自组装脂质体前体dsc谱图。图13是包合物自组装脂质体前体分散液粒径图。图14是包合物自组装脂质体前体分散液zeta电位图。图15是包合物自组装脂质体前体分散液透射电镜图。图16是包合物自组装脂质体前体、包合物、单纯脂质体、物理混合物溶出度曲线。图17是包合物自组装脂质体前体、包合物、单纯脂质体、原型药的辅酶q10血药浓度-时间曲线。具体实施方式下面结合实施例对本发明进行进一步描述。以下实施例仅为本发明的几个具体实施例,但本发明的设计构思并不局限于此,凡利用此构思对本发明进行非实质性的改动,均应属于侵犯本发明保护范围的行为。下述实施例中的方法,如无特别说明,均为常规方法。下述实施例中的百分含量,如无特别说明,均为质量百分含量。实施例1本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:β-环糊精:大豆卵磷脂:甘露醇=1:5:0.5:5。取50质量份β-环糊精和10质量份氧化型辅酶q10,加入250质量份的水混合分散均匀,搅拌成糊状,加热至50℃,放入胶体磨中,循环研磨5次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取5质量份大豆卵磷脂,加入到250质量份的水混合分散均匀,得磷脂分散液备用;取50质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度100℃,出风温度40℃,即得氧化型辅酶q10包合物自组装脂质体前体。实施例2本发明还原型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,还原型辅酶q10:β-环糊精:蛋黄卵磷脂:甘露醇=1:7:0.8:8。取70质量份β-环糊精和10质量份还原型辅酶q10,加入560质量份的水混合分散均匀,搅拌成糊状,加热至55℃,放入胶体磨中,循环研磨7次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取8质量份蛋黄卵磷脂,加入到560质量份的水混合分散均匀,得磷脂分散液备用;取80质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度110℃,出风温度45℃,即得还原型辅酶q10包合物自组装脂质体前体。实施例3本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:β-环糊精:大豆卵磷脂:甘露醇=1:10:1.5:10。取100质量份β-环糊精和10质量份氧化型辅酶q10,加入700质量份的水混合分散均匀,搅拌成糊状,加热至60℃,放入胶体磨中,循环研磨10次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取15质量份大豆卵磷脂,加入到700质量份的水混合分散均匀,得磷脂分散液备用;取100质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度105℃,出风温度43℃,即得氧化型辅酶q10包合物自组装脂质体前体。实施例4本发明还原型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,还原型辅酶q10:β-环糊精:蛋黄卵磷脂:甘露醇=1:12:1.2:12。取120质量份β-环糊精和10质量份还原型辅酶q10,加入960质量份的水混合分散均匀,搅拌成糊状,加热至55℃,放入胶体磨中,循环研磨9次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取12质量份蛋黄卵磷脂,加入到960质量份的水混合分散均匀,得磷脂分散液备用;取120质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度98℃,出风温度38℃,即得还原型辅酶q10包合物自组装脂质体前体。实施例5本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:β-环糊精:大豆卵磷脂:甘露醇=1:15:1.5:15。取150质量份β-环糊精和10质量份氧化型辅酶q10,加入750质量份的水混合分散均匀,搅拌成糊状,加热至52℃,放入胶体磨中,循环研磨10次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取15质量份大豆卵磷脂,加入到750质量份的水混合分散均匀,得磷脂分散液备用;取150质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度105℃,出风温度43℃,即得氧化型辅酶q10包合物自组装脂质体前体。取该脂质体前体5mg,进行热分析dsc测定,结果表明该脂质体前体不同于辅酶q10与卵磷脂、β-环糊精及它们混合物dsc图谱,形成了新的物相。实施例6本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:羟丙基β-环糊精:大豆卵磷脂:甘露醇=1:5:1.5:5。取50质量份羟丙基β-环糊精和10质量份氧化型辅酶q10,加入250质量份的水混合分散均匀,搅拌成糊状,加热至50℃,放入胶体磨中,循环研磨5次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取15质量份大豆卵磷脂,加入到250质量份的水混合分散均匀,得磷脂分散液备用;取50质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度100℃,出风温度40℃,即得氧化型辅酶q10包合物自组装脂质体前体。实施例7本发明还原型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,还原型辅酶q10:羟丙基β-环糊精:蛋黄卵磷脂:甘露醇=1:7:0.8:8。取70质量份羟丙基β-环糊精和10质量份还原型辅酶q10,加入560质量份的水混合分散均匀,搅拌成糊状,加热至55℃,放入胶体磨中,循环研磨7次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取8质量份蛋黄卵磷脂,加入到560质量份的水混合分散均匀,得磷脂分散液备用;取80质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度97℃,出风温度42℃,即得还原型辅酶q10包合物自组装脂质体前体。实施例8本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:羟丙基β-环糊精:大豆卵磷脂:甘露醇=1:10:0.8:10。取100质量份羟丙基β-环糊精和10质量份氧化型辅酶q10,加入600质量份的水混合分散均匀,搅拌成糊状,加热至50℃,放入胶体磨中,循环研磨8次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取8质量份大豆卵磷脂,加入到600质量份的水混合分散均匀,得磷脂分散液备用;取100质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度101℃,出风温度41℃,即得氧化型辅酶q10包合物自组装脂质体前体。实施例9本发明还原型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,还原型辅酶q10:羟丙基β-环糊精:蛋黄卵磷脂:甘露醇=1:12:1.2:12。取120质量份羟丙基β-环糊精和10质量份还原型辅酶q10,加入840质量份的水混合分散均匀,搅拌成糊状,加热至54℃,放入胶体磨中,循环研磨6次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取12质量份蛋黄卵磷脂,加入到840质量份的水混合分散均匀,得磷脂分散液备用;取120质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度99℃,出风温度36℃,即得还原型辅酶q10包合物自组装脂质体前体。实施例10本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:羟丙基β-环糊精:大豆卵磷脂:甘露醇=1:15:1.5:15。取150质量份羟丙基β-环糊精和10质量份氧化型辅酶q10,加入800质量份的水混合分散均匀,搅拌成糊状,加热至50℃,放入胶体磨中,循环研磨10次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取15质量份大豆卵磷脂,加入到800质量份的水混合分散均匀,得磷脂分散液备用;取150质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度100℃,出风温度44℃,即得氧化型辅酶q10包合物自组装脂质体前体。取该脂质体前体5mg,进行热分析dsc测定,结果表明该脂质体前体不同于辅酶q10与卵磷脂、羟丙基β-环糊精及它们混合物dsc图谱,形成了新的物相。实施例11本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:γ-环糊精:大豆卵磷脂:甘露醇=1:5:0.5:15。取50质量份γ-环糊精和10质量份氧化型辅酶q10,加入350质量份的水混合分散均匀,搅拌成糊状,加热至54℃,放入胶体磨中,循环研磨5次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取5质量份大豆卵磷脂,加入到350质量份的水混合分散均匀,得磷脂分散液备用;取150质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度96℃,出风温度40℃,即得氧化型辅酶q10包合物自组装脂质体前体。实施例12本发明还原型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,还原型辅酶q10:γ-环糊精:蛋黄卵磷脂:甘露醇=1:10:0.8:8。取100质量份γ-环糊精和10质量份还原型辅酶q10,加入650质量份的水混合分散均匀,搅拌成糊状,加热至51℃,放入胶体磨中,循环研磨7次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取8质量份蛋黄卵磷脂,加入到650质量份的水混合分散均匀,得磷脂分散液备用;取80质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度102℃,出风温度37℃,即得还原型辅酶q10包合物自组装脂质体前体。实施例13本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:γ-环糊精:大豆卵磷脂:甘露醇=1:10:1.5:10。取100质量份γ-环糊精和10质量份氧化型辅酶q10,加入700质量份的水混合分散均匀,搅拌成糊状,加热至60℃,放入胶体磨中,循环研磨8次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取15质量份大豆卵磷脂,加入到700质量份的水混合分散均匀,得磷脂分散液备用;取100质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度97℃,出风温度37℃,即得氧化型辅酶q10包合物自组装脂质体前体。实施例14本发明还原型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,还原型辅酶q10:γ-环糊精:蛋黄卵磷脂:甘露醇=1:12:0.9:7。取120质量份γ-环糊精和10质量份还原型辅酶q10,加入900质量份的水混合分散均匀,搅拌成糊状,加热至55℃,放入胶体磨中,循环研磨9次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取9质量份蛋黄卵磷脂,加入到900质量份的水混合分散均匀,得磷脂分散液备用;取70质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度103℃,出风温度42℃,即得还原型辅酶q10包合物自组装脂质体前体。实施例15本发明氧化型辅酶q10包合物自组装脂质体前体,它由下述原料按重量比制备而成,氧化型辅酶q10:γ-环糊精:大豆卵磷脂:甘露醇=1:15:1.5:15。取150质量份γ-环糊精和10质量份氧化型辅酶q10,加入750质量份的水混合分散均匀,搅拌成糊状,加热至50℃,放入胶体磨中,循环研磨10次,加入水稀释至固形物浓度为10%,得环糊精辅酶q10研磨液备用;取15质量份大豆卵磷脂,加入到750质量份的水混合分散均匀,得磷脂分散液备用;取150质量份甘露醇,放入流化床中作为母核,喷入上述磷脂分散液,使甘露醇微粒表面覆层磷脂膜,再喷入上述环糊精辅酶q10研磨液,使流化干燥,流化床进风温度100℃,出风温度40℃,即得氧化型辅酶q10包合物自组装脂质体前体。取该脂质体前体5mg,进行热分析dsc测定,结果表明该脂质体前体不同于辅酶q10与卵磷脂、γ-环糊精及它们混合物dsc图谱,形成了新的物相。试验例1高效液相色谱法测定包合物中辅酶q10取本发明相应实施例制备的辅酶q10包合物自组装脂质体前体适量,加少量水溶散,用乙醇加热超声,放冷定容至规定浓度后,过滤,取续滤液作为供试品溶液,进样,色谱条件:辅酶q10:c18柱,流动相为乙腈∶四氢呋喃∶水=55∶40∶5(体积比),检测波长280nm,外标法定量,即得。试验例2包合物自组装脂质体前体包封率测定取包合物自组装脂质体前体样品适量,分散于适量含胆酸人工肠液中,使充分溶解,过0.45μm的滤膜,取续滤液作为供试品溶液,进样,测定包合物自组装脂质体前体中不含游离药物的辅酶q10含量;另取包合物自组装脂质体前体样品适量,加少量水溶散,用乙醇加热超声,放冷定容至规定浓度后,过滤,取续滤液作为供试品溶液,进样,测定包合物自组装脂质体前体中辅酶q10总含量,计算包封率,结果见表1。试验例3包合物自组装脂质体前体覆水后粒径及zeta电位测定取辅酶q10包合物自组装脂质体前体用适量含胆酸人工肠液分散,测试温度均为25℃,测试次数为3次,采用动态激光光散射粒径测定仪测定粒径及zeta电位,结果见表1。表1辅酶q10的包封率、粒径和电位试验例4溶解度测定分别取本发明实施例1~15制备的辅酶q10包合物自组装脂质体前体、包合物、单纯脂质体、辅酶q10环糊精卵磷脂物理混合物适量,分别加入到100ml的纯水中,使成过饱和溶液,37℃水浴搅拌24小时,过滤。取滤液1ml,用无水乙醇定容至10ml,50℃超声20min,冷却至室温,用0.45um滤膜过滤,采用高效液相法测定辅酶q10含量,结果见表1。结果表明,本发明实施例1~15制备的包合物自组装脂质体前体中辅酶q10溶解度为174-289μg/ml;辅酶q10包合物中辅酶q10的溶解度为21.3μg/ml;辅酶q10单纯脂质体中辅酶q10的溶解度为49.6μg/ml;辅酶q10环糊精卵磷脂物理混合物中辅酶q10原料未测出。试验例5溶出度测定分别称取本发明实施例1~15制备的辅酶q10包合物自组装脂质体前体、包合物、单纯脂质体、辅酶q10环糊精卵磷脂物理混合物适量,用溶出仪测定不同时间药物溶出。介质为0.165%牛磺胆酸钠溶液900ml,转速为75转/分,温度(37℃±0.5),定时取样5ml,过滤,采用高效液相法测定辅酶q10含量,结果见表2。表2表明,本发明组合物溶出更快、更多。表2辅酶q10的溶解度和相对溶出度试验例6包合物自组装脂质体前体稳定性测定本发明辅酶q10包合物自组装脂质体前体的稳定性试验:取本发明实施例制备的包合物自组装脂质体前体、包合物、单纯脂质体、辅酶q10原型药适量,进行影响因素试验考察。取上述物质在4000lx光下,温度40℃,相对湿度92.5%放置10天,分别于0天、5天、10天取样测定辅酶q10含量,结果见表3。表3表明本发明包合物自组装脂质体前体光稳定性优于包合物、单纯脂质体、原型药。表3影响试验实施例7清除dpph自由基法测抗氧化性试验:测试方法:分别取待测样品和空白样品(不含辅酶q10的环糊精及磷脂)150μl加入2.85ml超纯水中,即稀释20倍;样品为按照实施例制备的辅酶q10包合物自组装脂质体前体、辅酶q10包合物、辅酶q10单纯脂质体、辅酶q10原型药。dpph(2,2-diphenyl-1-picrylhydrazyl(freeradical))溶液的配制:准确称取8mgdpph粉末用无水乙醇定容到100ml容量瓶中,得2×10-4mol/ldpph溶液,再稀释到5×10-5mol/l待用;取试管编号,按表4进行加样,混合均匀,水浴37℃下反应60min后,在517nm波长处测定待测样品反应液吸光度值,以及空白样品的吸光度值。(调零参比为1ml空白样品与2ml超纯水混合)表4清除dpph自由基实验各成分所需量组别待测样品/ml空白样品/mldpph/ml超纯水/mla待测样.dpph2.004.00a待测样.水2.0004.0a空白样.dpph02.04.00利用下述公式计算抑制率:抑制率e(%)=(1-(a待测样.dpph-a待测样.水)/a空白样.dpph)×100%对辅酶q10包合物自组装脂质体前体、辅酶q10包合物、辅酶q10单纯脂质体、辅酶q10原型药进行比较清除dpph自由基能力,结果如表5:表5清除dpph自由基法实验结果结果表明本发明的辅酶q10包合物自组装脂质体前体清除自由基能力显著超过其辅酶q10包合物、单纯脂质体、原型药。实施例8生物利用度1、给药方案及大鼠血样采集大鼠共24只,雌雄各半,适应性饲养3天后分成两组,6只/组。按照辅酶q10的人体日服量为100mg/60kg,大鼠给药量为10mg/kg,根据灌胃量推出配制浓度。精密称取实施例2包合物自组装脂质体前体、辅酶q10包合物(与实施例2辅酶q10含量相同)、辅酶q10单纯脂质体样品(与实施例2辅酶q10含量相同),加水于37℃水浴搅拌制成混悬液;精密称取辅酶q10原型药,加入0.5%cmc-na溶液中制成混悬液给药。采用一次口服灌胃给药。试验前动物禁食12小时,期间可自由饮水。给药后分别于0、2、4、6、7、8、9、10、12、24小时,采用眼眶静脉取血,采集血样0.5ml,置于事先准备好的肝素钠抗凝管中,于4℃,5000rmp离心10min,分离血浆,-20℃冷冻保存备用,测定前于室温下解冻2小时。2、血样处理方法取大鼠血浆100ul置离心管中,加入提取溶剂1ml(正己烷:无水乙醇=8:1),涡旋提取,离心后取上清液于另一离心管中,真空挥干。残渣加无水乙醇100ul复溶,涡旋混匀,离心,取上清液用于分析。3、液相色谱条件色谱柱:c18柱;流动相:四氢呋喃:乙腈:水(40:55:5);进样体积:10ul;流速:1ml/min;检测波长:280nm。4、标准曲线精密吸取不同浓度的辅酶q10标准溶液50ul,加空白血浆100ul,制成标准辅酶q10质量分别为0、1、2、4、8、16、32、64ug/ml的模拟血浆样品,按“血样处理方法”项下自加入提取溶剂起同法操作。5、方法的回收率和精密度:取空白血浆100μl,分别配制2、8、32μg/ml三个浓度的辅酶q10样品以及空白样品,每个浓度6样本分析。取各浓度辅酶q10标准溶液50μl,按“血样处理方法”项下自加入提取溶剂起同法操作,计算回收率。辅酶q10在低、中、高三个浓度的回收率分别为90.8%、92.7%和88.1%。通过一天内平行测定6次和平行测定三天计算日内和日间rsd值。结果表明辅酶q10的日内rsd<14.6%,日间rsd<16.4%。6、方法的专属性取“血样处理方法”项下处理好的空白大鼠血浆样品、空白大鼠血浆加对照品样品、给药后的大鼠血浆样品以及对照品溶液分别进样,记录色谱图,结果表明辅酶q10与血浆中杂质分离良好,内源性物质不干扰测定。7、血药浓度和时间曲线大鼠口服给药10mg/kg实施例2包合物自组装脂质体前体、包合物、单纯脂质体、原型药后,作血药浓度-时间曲线,经das2.0软件拟合后,计算药物动力学参数于表6。根据的auc0-t计算包合物自组装脂质体前体、包合物、单纯脂质体的生物利用度分别是原型药的4.8、2.7、2.9倍。生物利用度试验数据表明,当sd大鼠给药12小时,包合物自组装脂质体前体的auc0-12为141.5mg·h/l,包合物的auc0-12为77.05mg·h/l,单纯脂质体的auc0-12为86.43mg·h/l,原型药的auc0-12为20.80mg·h/l,包合物自组装脂质体前体、包合物、单纯脂质体的12小时生物利用度相当于原型药6.8、3.7、4.2倍。表6sd大鼠给药后辅酶q10的主要药动学参数当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1