一种将砒霜和全反式维甲酸联合使用的用于清除残留肝癌干细胞的药物组合物及其应用的制作方法
本发明涉及抗癌药
技术领域:
,具体涉及一种将砒霜和全反式维甲酸联合使用的用于清除残留肝癌干细胞的药物组合物及其应用。
背景技术:
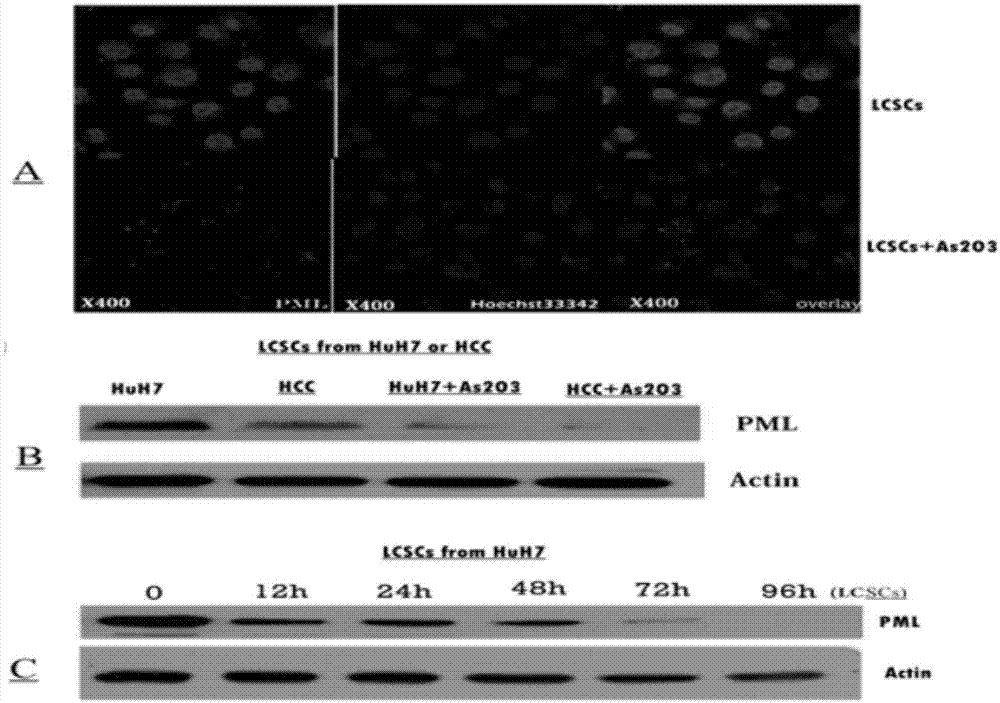
:肝细胞癌(hepatocellarcarcinoma,hcc)发病率居世界恶性肿瘤第五位,死亡率则为恶性肿瘤第二位。我国为hcc高发区,发病人数几乎占全球的50%。hcc与乙型肝炎病毒感染和肝硬化密切相关,我国乙型肝炎病毒感染者占总人口10%,hcc发病率可能长期居高不下。hcc诊断时多数已属进展期,手术切除率低于50%,即使手术切除也易复发和转移,5年生存率只有10%~30%,故有“癌中之王”之称。hcc治疗主要采用手术、介入治疗,射频及肝移植等方法,治疗效果总体仍然不好,hcc复发和转移则是迫切需要解决的关键问题。越来越多的研究证实包括肝癌在内的实体肿瘤存在肿瘤干细胞(cancerstemcells,cscs)。cscs是肿瘤组织中少数具有无限增殖和多向分化的潜能的一类细胞,表现出极强的自我更新能力,是肿瘤恶性增殖的“根源细胞”,同时其具有强大的耐药能力和浸润转移能力。肿瘤的生长是由cscs进行驱动,治疗后少量残存的cscs可促使肿瘤复发和转移,这是目前各治疗方案效果欠佳的关键原因。针对cscs的靶向治疗可能成为防止癌肿复发和转移的关键。hcc的治疗不仅仅局限杀灭快速增殖的癌细胞,更应清除cscs。然而,到目前为止,尚无有效清除cscs,阻止手术后癌复发和转移的方法。故进一步研究清除cscs的方法对hcc的综合治疗具有重要意义。鉴于hcc诊断明确时多数已属进展期,外科切除hcc作为首选治疗(手术固然可以切除hcc细胞和肝癌干细胞(livercancerstemcells,lcscs),已经转移出切除范围lcscs则不能根除,hcc手术切除率低于50%,即使手术切除癌肿也易复发和转移,5年生存率10%~30%。即使完全切除了病肝的肝移植,仍有hcc复发(血循环内可能转移lcscs)。hcc对传统的化疗药物不敏感,而且休眠的lcscs易于耐受抗癌药物。残留或已经移出lcscs是肝癌根治性切除后复发和转移的根源,但是现有的常规性临床治疗只针对增殖快的癌细胞,没有针对性清除lcscs,现有技术条件下,临床常规治疗不能根除lcscs,基础和临床研究尚未找到防治hcc复发和转移的良方。砒霜(arsenictrioxide,as2o3)是剧毒中药,自20世纪70年代以来,我国成功用as2o3治疗急性早幼粒细胞白血病(acutepromyelocyticleukaemia,apl)取得了世人瞩目的突破性进展,95%apl患者得以治愈。as2o3具有明显抑制hcc增殖、细胞周期阻滞和诱导癌细胞凋亡的作用。2004年国家食品药品监督管理局(sfda)批准了as2o3可用于治疗晚期hcc,但是,多中心ii期临床试验治疗晚期hcc,结果显示单用as2o3抗癌效果很不满意,而且as2o3治疗hcc机制不清,此后as2o3抗hcc研究几乎陷入停滞状态。as2o3虽然具有抑制肝癌细胞增殖,诱导肝癌细胞凋亡的作用,亚砷酸钠也有抑制肝癌细胞增殖和抑制lcscs的功能,但是,研究发现0.8μg/mlas2o3处理hcc细胞96小时,as2o3方能显著地阻止huh7细胞的生长。按此浓度以60kg体重hcc患者及60%体液计算,每日至少需28.8mgas2o3才可诱导肝癌细胞凋亡和抑制肝癌细胞增殖,此量砒霜毒性很大,按0.5μg/mlas2o3诱导lcscs分化,至少需每日需用14.4mgas2o3,也就是说按照sfda推荐剂量10mg/日治疗晚期肝癌(诱导肝癌细胞凋亡)几乎是无效的。如何使用低剂量as2o3,又能清除lcscs是治疗hcc的关键。维甲酸(ra)又称视黄酸或维生素a酸,是维生素a的衍生物。机体内一定浓度的维甲酸可调节细胞的增殖、分化、成熟,是机体正常生长发育和各种生理活动必不可少的重要因子。维甲酸类化合物受体属于类固醇-甲状腺素核转录因子超家族,现已发现两大类受体可与维甲酸结合,介导维甲酸作用。全反式维甲酸(atra)抗癌通过诱导癌细胞的分化和癌细胞凋亡,影响肿瘤细胞周期(atra可影响细胞dna的合成,改变细胞周期和信号传导途径,使细胞在g1期前停滞,还可影响某些癌基因及细胞因子基因的表达),减缓癌细胞能量代谢和肿瘤相关蛋白表达。atra治疗apl针对pml-rara融合癌蛋白的rara部分,atra诱导实体癌分化通过何种途径,目前尚不清楚。技术实现要素:本发明的目的就是针对上述现有技术中的缺陷,提供了一种用于清除残留肝癌干细胞的药物组合物及其应用。为了实现上述目的,本发明提供的技术方案为:一种将as2o3和atra联合使用的用于清除残留肝癌干细胞的药物组合物,所述药物组合物中的有效成分为:按照患者总体液量终浓度计为1.0μg/ml的as2o3和atra。进一步的,上述的一种将as2o3和atra联合使用的用于清除残留肝癌干细胞的药物组合物,所述药物组合物中得有效成分为:按照患者总体液量终浓度计为0.25μg/ml的as2o3和患者总体液量终浓度计为0.75μg/ml的atra。本发明的第二个目的是提供了一种将as2o3和atra联合使用的用于清除残留肝癌干细胞的药物组合物在制备用于防治肝癌切除后复发转移的药物中的应用。本发明的有益效果为:本发明提供的将as2o3和atra联合使用的用于清除残留肝癌干细胞的药物组合物及其应用,首次披露砒霜具有诱导肝癌干细胞分化的作用,as2o3和atra都抑制pml蛋白,即肝癌干细胞pml蛋白是二者的靶蛋白;且as2o3和atra分别作用可以调低pml下游肝癌干细胞关键基因oct4表达。本发明打破传统诱导肝癌细胞凋亡的方式,旨在用小剂量as2o3诱导肝癌干细胞分化,针对肝癌切除后残留的肝癌干细胞;用atra和as2o3组合,能够起到协同作用,减少砒霜用量,达到清除残留的肝癌干细胞的作用。附图说明图1显示为(a)免疫荧光分析as2o3处理前后lcscspml蛋白表达;(b)westernblotting分析0.5μg/mlas2o3处理前后选自huh7和hcc组织lcscspml蛋白表达;(c)huh7分选的lcscs经0.5μg/mlas2o3处理5d内pml蛋白表达。图2显示为(a)0.5μg/mlas2o3处理5~7d,lcscs关键基因oct4,sox2,klf4表达明显下调(p<0.05),c-myc表达无显著变化;(b)as2o3处理oct4,sox2,klf4蛋白表达明显降低(p<0.05),c-myc蛋白表达无显著变化。图3显示为(a).自huh7分选的lcscs培养的肿瘤球;(b).自huh7分选的lcscs经0.5μg/mlas2o3处理培养的肿瘤球;(c).自hcc组织分选的lcscs培养的肿瘤球;(d).自hcc组织分选的lcscs经0.5μg/mlas2o3处理培养的肿瘤球。图4显示为sipml和as2o3处理7dcd133+cd13+lcscs表达pml和oct4蛋白。图5显示为(a).0.5μg/mlas2o3处理7d后cd133+cd13+lcscs对alb,ck18,tat,apob和afp基因表达变化(**p<0.01,*p<0.05);(b).0.5μg/mlofas2o3处理7d后cd133+cd13+lcscs对afp,alb和ck18蛋白表达变化;(c).0.5μg/mlas2o3处理前后cd133+cd13+lcscs摄入icg变化;(d).0.5μg/mlas2o3处理前后cd133+cd13+lcscspas染色变化。图6显示为(a)lcscs经atra处理5d后pml蛋白表达;(b)lcscs经atra处理12h~96h后pml蛋白表达。图7显示为(a)lcscs经pml-sirna和as2o3处理后pml及oct4蛋白表达;(b)lcscs经pml-sirna和atra处理后pml及oct4蛋白表达。图8显示为lcscs经不同浓度atra和as2o3处理后pml及oct4蛋白表达。图9显示为lcscs经不同浓度atra或as2o3诱导后肿瘤球生成情况。图10显示为肝癌两种治疗模式图。具体实施方式实施例1:砒霜降低lcscs表达pml蛋白:【实验目的】:需明确as2o3是否下调lcscs表达pml蛋白。【实验方法】:(1)cd133+cd13+lcscs分选:huh7细胞在10%fbs的dmem培养液,37℃、5%co2、饱和湿度的培养箱孵育,待细胞汇合度达到70~80%时0.25%胰酶消化细胞制成单细胞悬液,进行细胞计数,pbs洗1遍,分别装入1.5mlep管中,设置空白对照管、cd13、cd133、cd13-cd133双抗体四组,每管中加入5μl抗体,4℃避光孵育30min,700r/min离心5min,弃上清,pbs洗3遍,300μlpbs重悬细胞,进行流式细胞仪(bdfacsariaii和bdfacscalibur)检测cd13、cd133标志表达和lcscs分选。(2)免疫荧光分析as2o3处理7d后lcscspml蛋白表达:分选的cd133+cd13+lcscs普通培养在10mm盖玻片上,经过24h培养,待细胞融合度达60%~80%时,用37℃预热pbs振遥清洗5min×2次,4%多聚甲醛室温固定15min,pbs洗5min×2次,0.5%triton-x100的pbs室温下脱色摇床振遥15min,pbs洗3次。取出盖玻片放至载玻片上,10%山羊血清37℃封闭30min,pml抗体湿盒内4℃孵化过夜。pbs脱色摇床洗3次,滴加荧光抗体,37℃避光孵育60min。pbs清洗3次、hoechst33342染色细胞核,pbs清洗2次,取出盖玻片,封片后激光共聚焦显微镜下观察记录细胞pml蛋白表达。自huh7分选的lcscs,收集经0.5μg/mlas2o3处理5d后的细胞,同法进行免疫荧光分析。(3)westernblot分析0.5μg/mlas2o3处理5d后lcscspml蛋白表达:选自huh7和hcc组织的lcscs,收集经0.5μg/mlas2o3处理前和处理5d后的细胞,进行下面步骤:①细胞总蛋白提取:hcc细胞常规胰酶消化制成细胞悬液,细胞数1.0×106细胞,1500rpm,5min,移入1.5mlep管,pbs洗2次。细胞悬液离心吸尽上清液,加入蛋白酶抑制剂的裂解液200μl,冰上裂解30min,4℃12000rpm离心15min,上清液移入ep管,蛋白定量后蛋白上样缓冲液稀释,煮3min,分后置-70℃备用。②hcc组织总蛋白提取:切取hcc组织(癌肿边缘),称取100mghcc加入遇冷500μl细胞裂解液,冰上玻璃匀浆器碾磨消冰上裂解30min,4℃12000rpm离心15min,上清液移入ep管,蛋白定量后蛋白上样缓冲液稀释,煮3min,分后置-70℃备用。③westernblot检测pml蛋白表达:配置10%分离胶和4%积层胶。上样量为每泳道90μg,体积25~30μl。电泳,积层胶电压80v,分离胶电压100~120v,电泳2~3h。切胶后padv膜向正极,胶在负极,将滤纸、pvdf膜及凝胶整齐重叠后放在湿转槽、电流150ma转移90min。取下pvdf膜,5%脱脂奶粉pbs封闭,室温震摇1~2h。将封闭的膜滴加一抗按1:100(3%bsa),4℃湿盒内过夜,次日pbs漂洗15min×1,5min×4,二抗按1:2500(3%bsa),25℃震摇1h,pbs漂洗15min×1,5min×4。混合等体积a液和b液(各500μl,共1ml),将显色剂滴加到pvdf膜正面,开始显色记录图像。(4)westernblot分析0.5μg/mlas2o3处理12~96h小时lcscspml蛋白表达:选自huh7的lcscs,收集经0.5μg/mlas2o3处理12h,24h,48h,72h和96h后的细胞,提取蛋白,进行westernblot分析(具体过程同上)。【实验结果】:0.5μg/mlas2o3处理7d后免疫荧光显示cd133+cd13+lcscs表达pml蛋白显着减少(图1a)。westernblotting显示自huh7和hcc组织分选的lcscs经0.5μg/mlas2o3处理7d后pml蛋白明显减少(图1b)。自huh7分选的lcscs经0.5μg/mlas2o3处理5dpml蛋白表达逐渐减少,最后消失(图1c)。【实验结论】:as2o3处理使lcscs表达pml蛋白下调。实施例2:砒霜诱导lcscs分化:(1)砒霜(as2o3)下调肝癌干细胞关键基因oct4,sox2,klf4表达【实验目的】:已经发现as2o3高于0.8μg/ml抑制肝癌细胞增殖,可能高浓度诱导肝癌细胞凋亡,现在需要观察0.5μg/mlas2o3对cd133+cd13+lcscs功能特征和关键基因表达有无作用,是否可以诱导lcscs分化.【实验方法】:①cd133+cd13+lcscs分选:肝癌组织和huh7细胞在10%fbs的dmem培养液,37℃、5%co2、饱和湿度的培养箱孵育,待细胞汇合度达到70~80%时0.25%胰酶消化细胞制成单细胞悬液,进行细胞计数,pbs洗1遍,分别装入1.5mlep管中,设置空白对照管、cd13、cd133、cd13-cd133双抗体四组,每管中加入5μl抗体,4℃避光孵育30min,700r/min离心5min,弃上清,pbs洗3遍,300μlpbs重悬细胞,进行流式细胞仪(bdfacsariaii和bdfacscalibur)检测cd13、cd133标志表达和lcscs分选。②as2o3处理huh7和hcc组织分选cd133+cd13+lcscs:自肝癌组织和huh7细胞系分选的lcscs,用dmem培养液配成终浓度为含0.5μg/mlas2o3继续培养5~7d,细胞汇合度达到70~80%时0.25%胰酶消化,继续培养72h~96h,0.25%胰酶消化,收集细胞提取细胞rna和总蛋白。③实时定量pcr分析lcscs关键基因oct4,sox2,c-myc和klf4表达:经过0.5μg/mlas2o3处理的lcscs,①用trizolreagent提取细胞总rna,检测rna含量后立即置-130℃保存。②逆转录:按bioktcdnafirststrandcynthesiskit使用说明设置20μl反应体系,在室温10min,42℃45min,95℃5min,冰浴5min的循环条件进行反应。逆转录后检测cdna含量,在-20℃保存。③引物:gapdh:5'-tgcaaccgggaaggaaatga-3',5'-gcccaatacgaccaaatcaga-3,oct4:5'-ggctcgagaaggatgtggtc-3'5'-gaagtgagggctcccatagc-3'c-myc,5'-acaacacccgagcaagggac-3';5'-ggaggctgctggttttccacta-3';klf4,5'-ccgctccattaccaagagc-3';5'-tttctcacctgtgtgggttc-3'.sox2:5'-caggagttgtcaaggcagaga-3'5'-cgccgccgatgattgttatt-3'④荧光定量pcr:按promegagotaqqpcrmastermixkit使用说明,配制20μl反应体系,stratagnemx3000p荧光定量pcr仪进行反应。反应条件:预变性95℃4min,95℃30s,55℃20s,72℃20s,反应40个循环。扩增产物经过3%琼脂糖凝胶电泳,鉴定为目标条带。⑤westernblot分析lcscs关键基因oct4,sox2,c-myc和klf4的蛋白表达:经过0.5μg/mlas2o3处理lcscs,进行下面步骤:①细胞总蛋白提取:hcc细胞常规胰酶消化制成细胞悬液,细胞数1.0×106细胞,1500rpm,5min,移入1.5mlep管,pbs洗2次。细胞悬液离心吸尽上清液,加入蛋白酶抑制剂的裂解液200μl,冰上裂解30min,4℃12000rpm离心15min,上清液移入ep管,蛋白定量后蛋白上样缓冲液稀释,煮3min,分后置-70℃备用。②hcc组织总蛋白提取:切取hcc组织(癌肿边缘),称取100mghcc加入遇冷500μl细胞裂解液,冰上玻璃匀浆器碾磨消冰上裂解30min,4℃12000rpm离心15min,上清液移入ep管,蛋白定量后蛋白上样缓冲液稀释,煮3min,分后置-70℃备用。③westernblot检测pml蛋白表达:配置10%分离胶和4%积层胶。上样量为每泳道90μg,体积25~30μl。电泳,积层胶电压80v,分离胶电压100~120v,电泳2~3h。切胶后padv膜向正极,胶在负极,将滤纸、pvdf膜及凝胶整齐重叠后放在湿转槽、电流150ma转移90min。取下pvdf膜,5%脱脂奶粉pbs封闭,室温震摇1~2h。将封闭的膜滴加一抗按1:100(3%bsa),4℃湿盒内过夜,次日pbs漂洗15min×1,5min×4,二抗按1:2500(3%bsa),25℃震摇1h,pbs漂洗15min×1,5min×4。混合等体积a液和b液(各500ul,共1ml),将显色剂滴加到pvdf膜正面,开始显色记录图像。④抗体:oct4(ab18976,abcam),sox2(2748s,cellsignalingtechnology,danvers,ma,usa),c-myc(sc-764,santacruzbiotechnology),和klf4(gtx101508,genetex,irvine,ca,usa)。【实验结果】:0.5μg/mlas2o3处理huh7和hcc组织分选cd133+cd13+lcscs5~7d,oct4、sox2和klf4mrna表达(图2a)和蛋白表达明显下调(图2b)。【实验结论】:as2o3处理后cd133+cd13+lcscs数量减少和干细胞关键基因表达变化,提示lcscs凋亡或被诱导分化成hcc细胞。(2)砒霜抑制cd133+cd13+lcscs生成肿瘤球:【实验目的】:观察0.5μg/mlas2o3处理后cd133+cd13+lcscs自我更新能力变化。【实验方法】:lcscs以无血清dmem/f12(1∶1)基础培养基,加入egf(10ng/ml)、bfgf(20μg/ml)、n2、b27等制成标准培养基,加入as2o3配制成终浓度0.5μg/mlas2o3培养液,于超低黏附的6孔板加入1ml标准培养基和5.0×103个cd13+cd133+lcscs细胞,在37℃、5%co2、饱和湿度的培养箱中孵育,每天半量换新鲜培养基,观察细胞球情况,肿瘤球培养10~15d在倒置显微镜下拍照。【实验结果】:huh7(图3a)和hcc组织(图3b)分选cd133+cd13+lcscs进行肿瘤球培养,经过0.5μg/mlas2o3处理10~15d,肿瘤球生成减少(图3c,3d),显示cd133+cd13+lcscs数量的减少,表明as2o3抑制lcscs形成球。【实验结论】:as2o3抑制lcscs形成肿瘤球,可能as2o3诱导lcscs分化成hcc细胞或诱导lcscs凋亡,导致肿瘤球生成少。(3)砒霜抑制cd133+cd13+lcscs移植瘤形成:【实验目的】:观察cd133+cd13+lcscs异体移植成瘤,分化成普通肝癌细胞,形成肿瘤转移结节能力。【实验方法】:lcscs细胞按2.0×106个细胞4组,每组20只,用pbs配成100μl细胞悬液,注射到(清洁级)裸鼠背部皮下。细胞移植后隔日皮下注射3~5μgas2o3,连续用7次。每周观察成瘤情况,移植部位长出肿瘤结节即可,观察28d,记录用药组对照组有移植肿瘤的裸鼠数目。【实验结果】:cd133+cd13+lcscs移植裸鼠后同时用as2o3处理,抑制了裸鼠形成移植瘤(表1),提示cd133+cd13+lcscs数量减少或失去功能,不能形成移植肿瘤。【实验结论】:as2o3对cd133+cd13+lcscs可能有清除作用,如表1显示为as2o3处理肝癌干细胞异体移植成瘤的效果。表1:细胞来源裸鼠数量成瘤数(对照组)成瘤数(处理组)lcscs(huh7)40191lcscs(肝癌组织)40160隔日裸鼠腹腔注射3~5μgas2o3,连续7次。(4)砒霜通过pml蛋白作用于cd133+cd13+lcscs:【实验目的】:为了确定as2o3对lcscs功能抑制和基因表达调节作用是否与pml蛋白有关,用sipml干扰pml蛋白表达,观察pml下游关键基因表达情况。【实验方法】:pml-sirna购自于qiagen公司,sirnas通过hiperfect(301704,qiagen)导入lcscs72h,接着收集细胞进行总蛋白提取。lcscs经过终浓度0.5μg/mlas2o3处理7d,收集细胞提取总蛋白。两组样品进行westernblot分析pml及oct4蛋白表达(同前面)。【实验结果】:发现as2o3处理和sipml干扰都下调oct4蛋白表达(图4)。【实验结论】:砒霜(as2o3)可能通过pml蛋白作用于cd133+cd13+lcscs,下调lcscs表达oct4蛋白表达。(5)砒霜促进cd133+cd13+lcscs分化和肝细胞成熟:【实验目的】:观察经过as2o3处理cd133+cd13+lcscs后其肝细胞标志是否增强,分析lcscs向肝细胞方向分化。【实验方法】:①as2o3处理lcscs:cd133+cd13+lcscs在10%fbs的dmem培养液,37℃、5%co2、饱和湿度的培养箱孵育,细胞汇合度达到70~80%时0.25%胰酶消化,收集细胞提取细胞rna和总蛋白。处理组将dmem培养液配成终浓度为含0.5μg/mlas2o3继续培养,细胞汇合度达到70~80%时0.25%胰酶消化,继续培养72h~96h,0.25%胰酶消化,收集细胞提取细胞总蛋白和rna。②实时定量pcr分析:0.5μg/mlas2o3处理7d后检测肝细胞相关标志蛋白基因水平的表达情况。试剂盒提取出各组细胞的总rna,并逆转录成cdna。使用primer3程序设计相关基因的引物。cdna样品稀释10倍后进行real-timepcr扩增:72℃3min;94℃3min;94℃10s,55℃20s,72℃20s,共40个循环;溶解曲线65℃~95℃,每5s增加0.5℃,读板。所有样本通过gapdh的表达水平进行标准化。③westernblot分析afp,alb和ck18蛋白表达:提取细胞总蛋白,bca法测定蛋白浓度。12%sds-page50v电泳30min+100v电泳1h,pvdf膜100v转膜,5%脱脂牛奶室温封闭1h,一抗gapdh(1∶200)、alb(1∶200)、afp(1∶200)、ck18(1∶200)、置于4℃孵育过夜,对应二抗室温孵育1h。ecl发光显影,image-j软件分析westernblot条带灰度值。④pas染色:0.5μg/mlas2o3诱导cd133+cd13+lcscs7d后,室温下pbs洗3次,4%多聚甲醛固定10min,pbs再洗3次,0.5%高碘酸液处理5min,流水冲洗5min,滴加schiff染液染色15min,流水清洗5min,置于显微镜下观察,每组选取大于10个非重复视野拍照。⑤icg摄取释放实验:0.5ug/mlas2o3处理lcscs9d,移除培养基后pbs洗3次,加入1mg/mlicg染液200μl,放回含5%co2的37℃恒温箱1h,pbs洗3次,显微镜下观察,每组选取大于10个非重复视野拍照。随后移除孔内pbs,换回原来的培养基,置于含5%co2的37℃恒温箱孵育6h,显微镜下观察细胞icg释放情况。【实验结果】:0.5μg/mlas2o3处理7~10d,afp基因和蛋白在cd133+cd13+lcscs表达下调(图5a,5b),肝细胞标志alb,ck18,tat和apob基因表达增强(图5a),alb和ck18蛋白表达上调(图5b)。cd133+cd13+lcscs摄取icg增加(图5c),cd133+cd13+lcsc内pas染色增强(图5d)。显示经as2o3处理cd133+cd13+lcscs表达肝癌细胞和成熟肝细胞标志。【实验结论】:提示as2o3诱导cd133+cd13+lcscs向肝癌细胞或肝细胞方向分化,0.5μg/mlas2o3具有诱导cd133+cd13+lcscs分化的作用。上述系列实验结果表明,砒霜处理不仅下调lcscs表达pml蛋白,而且抑制lcscs维持干性的关键基因表达,抑制cd133+cd13+lcsc肿瘤球和异体移植瘤形成、诱导cd133+cd13+lcscs分化或凋亡。砒霜通过靶向lcscs的pml蛋白,降解pml蛋白诱导lcscs分化,清除肝癌切除后残留lcscs,预防和治疗hcc切除术后复发和转移。实施例3:atra下调lcscspml蛋白表达:【实验目的】:既然atra可以诱导包括肿瘤干细胞在内的干细胞及乳腺癌细胞在内的多种实体瘤肿瘤细胞分化,需确定其实通过什么分子途径诱导细胞分化或抑制肝癌细胞增殖,是否与砒霜有共同的靶分子pml蛋白。【实验方法】:(1)cd133+cd13+lcscs分选:肝癌细胞在10%fbs的dmem培养液,37℃、5%co2、饱和湿度的培养箱孵育,待细胞汇合度达到70~80%时0.25%胰酶消化细胞制成单细胞悬液,进行细胞计数,pbs洗1遍,分别装入1.5mlep管中,设置空白对照管、cd13、cd133、cd13-cd133双抗体四组,每管中加入5μl抗体,4℃避光孵育30min,700r/min离心5min,弃上清,pbs洗3遍,300μlpbs重悬细胞,进行流式细胞仪(bdfacsariaii和bdfacscalibur)检测cd13、cd133标志表达和lcscs分选。(2)westernblot分析0.75μg/mlatra处理5d后lcscspml蛋白表达:选自huh7和hcc组织的lcscs,收集经0.75μg/mlatra处理前和处理5d后的细胞,进行下面步骤:①细胞总蛋白提取:hcc细胞常规胰酶消化制成细胞悬液,细胞数1.0×106细胞,1500rpm,5min,移入1.5mlep管,pbs洗2次。细胞悬液离心吸尽上清液,加入蛋白酶抑制剂的裂解液200μl,冰上裂解30min,4℃12000rpm离心15min,上清液移入ep管,蛋白定量后蛋白上样缓冲液稀释,煮3min,分后置-70℃备用。②hcc组织总蛋白提取:切取hcc组织(癌肿边缘),称取100mghcc加入遇冷500μl细胞裂解液,冰上玻璃匀浆器碾磨消冰上裂解30min,4℃12000rpm离心15min,上清液移入ep管,蛋白定量后蛋白上样缓冲液稀释,煮3min,分后置-70℃备用。③westernblot检测pml蛋白表达:配置10%分离胶和4%积层胶。上样量为每泳道90μg,体积25~30μl。电泳,积层胶电压80v,分离胶电压100~120v,电泳2~3h。切胶后padv膜向正极,胶在负极,将滤纸、pvdf膜及凝胶整齐重叠后放在湿转槽、电流150ma转移90min。取下pvdf膜,5%脱脂奶粉pbs封闭,室温震摇1~2h。将封闭的膜滴加一抗按1:100(3%bsa),4℃湿盒内过夜,次日pbs漂洗15min×1,5min×4,二抗按1:2500(3%bsa),25℃震摇1h,pbs漂洗15min×1,5min×4。混合等体积a液和b液(各500μl,共1ml),将显色剂滴加到pvdf膜正面,开始显色记录图像。(3)westernblot分析0.75μg/mlatra处理12~96h小时lcscspml蛋白表达:选自huh7的lcscs,收集经0.75μg/mltra处理12h,24h,48h,72h和96h后的细胞,提取蛋白,进行westernblot分析(具体过程同上)。【实验结果】:westernblotting分析发现自huh7和hcc组织分选的lcscs经0.75μg/mlatra处理5d后pml蛋白明显减少(图6a)。自huh7分选的lcscs经0.75μg/mlatra处理5dpml蛋白表达逐渐减少,最后消失(图6b)。【实验结论】:低浓度atra可以下调lcscspml蛋白表达,与砒霜有相似的靶分子pml蛋白。实施例4:as2o3和atra协同诱导lcscs分化:⑴as2o3和atra分别诱导lcscs分化:前述实验发现as2o3可以诱导cd133+cd13+lcscs分化。朱新锋博士研究结果证实全反式维甲酸诱导epcam+肝癌干细胞分化。这些结果提示as2o3和atra分别诱导lcscs分化,有协同作用的基础。⑵as2o3和atra均抑制靶分子pml蛋白表达:前述发现as2o3可以下调cd133+cd13+lcscs表达pml蛋白。还发现atra可以下调cd133+cd13+lcscs表达pml蛋白。结果提示as2o3和atra都作用于靶分子pml蛋白,具有共同的分子基础。⑶as2o3或atra通过pml蛋白控制lcscs下游关键基因oct4表达:【实验目的】:为了证实as2o3或atra都通过pml蛋白诱导lcscs分化,用sipml,as2o3,atra处理lcscs,利用rnai敲除pml,观察pml下游干细胞关键基因oct4表达情况。【实验方法】:①cd133+cd13+lcscs分选:huh7细胞在10%fbs的dmem培养液,37℃、5%co2、饱和湿度的培养箱孵育,待细胞汇合度达到70~80%时0.25%胰酶消化细胞制成单细胞悬液,进行细胞计数,pbs洗1遍,分别装入1.5mlep管中,设置空白对照管、cd13、cd133、cd13-cd133双抗体四组,每管中加入5μl抗体,4℃避光孵育30min,700r/min离心5min,弃上清,pbs洗3遍,300μlpbs重悬细胞,进行流式细胞仪(bdfacsariaii和bdfacscalibur)检测cd13、cd133标志表达和lcscs分选。②as2o3和atra处理huh7分选cd133+cd13+lcscs:自huh7细胞系分选的lcscs,用dmem培养液配成终浓度为含0.25μg/mlas2o3或0.75μg/mlatra继续培养5~7d,细胞汇合度达到70~80%时0.25%胰酶消化,继续培养72h~96h,0.25%胰酶消化,收集细胞提取细胞总蛋白。③as2o3或atra通过pml下调oct4蛋白表达:pml-sirna购自于qiagen公司,sirnas通过hiperfect(301704,qiagen)导入lcscs72h,接着收集细胞进行总蛋白提取。lcscs经过终浓度0.5μg/mlas2o3或0.75μg/mlatra处理7d,收集细胞提取总蛋白。两组样品进行westernblot分析pml及oct4蛋白表达(同前面),结果如图7所示。【实验结果】:发现as2o3和atra处理和sipml干扰都下调oct4蛋白表达,as2o3和atra都通过pml调节lcscs的oct4蛋白表达。【实验结论】:as2o3或atra通过pml下调oct4蛋白表达,在诱导lcscs分化方面具有共同的作用,联合应用理论上可能有增强lcscs诱导分化作用。⑷as2o3和atra组合协同增强lcscs抑制pml蛋白及其下游基因oct4表达:【实验目的】:为了观察as2o3和atra组合对lcscs诱导分化是否有协同作用,首先分析组合物对pml和oct4蛋白表达抑制有无协同作用。【实验方法】:①cd133+cd13+lcscs分选:huh7细胞在10%fbs的dmem培养液,37℃、5%co2、饱和湿度的培养箱孵育,待细胞汇合度达到70~80%时0.25%胰酶消化细胞制成单细胞悬液,进行细胞计数,pbs洗1遍,分别装入1.5mlep管中,设置空白对照管、cd13、cd133、cd13-cd133双抗体四组,每管中加入5μl抗体,4℃避光孵育30min,700r/min离心5min,弃上清,pbs洗3遍,300μlpbs重悬细胞,进行流式细胞仪(bdfacsariaii和bdfacscalibur)检测cd13、cd133标志表达和lcscs分选。②as2o3和atra处理自huh7分选cd133+cd13+lcscs:自huh7细胞系分选的lcscs,用dmem培养液配成终浓度为含:a:0.25μg/mlas2o3;b:0.75μg/mlatra;c:0.5μg/mlas2o3;d:1.0μg/mlatra;e:0.25μg/mlas2o3+0.75μg/mlatra;f:对照组,继续培养7d,细胞汇合度达到70~80%时0.25%胰酶消化,继续培养72h~96h,0.25%胰酶消化,收集细胞提取细胞总蛋白。③westernblot分析atra和as2o3处理7d后蛋白表达:提取蛋白,进行westernblot分析。【实验结果】:图8显示,0.25μg/mlas2o3和0.75μg/mlatra处理lcscs7d,pml和oct4蛋白表达稍有下调。0.5μg/mlas2o3和1.0μg/mlatra可使pml蛋白表达减少,但0.5μg/mlatra下调oct4蛋白不明显,0.5μg/mlas2o3明显下调oct4蛋白表达。0.25μg/mlas2o3+0.75μg/mlatra使pml及oct4蛋白表达消失。【实验结论】:atra和as2o3组合协同抑制lcscs表达pml和oct4蛋白。⑸as2o3和atra处理lcscs后抑制肿瘤球生成:【实验目的】:肿瘤球是分析lcscs自我更新能力,间接观察lcscs分化情况,如果lcscs分化成肝癌细胞,肝癌细胞凋亡凋亡,肿瘤球生成少,甚至形成不了肿瘤球,间接反映lcscs数目减少或消失。【实验方法】:①肿瘤球培养:lcscs以无血清dmem/f12(1∶1)基础培养基,加入egf(10ng/ml)、bfgf(20μg/ml)、n2、b27等制成标准培养基,加入as2o3或atra,配制成终浓度0.25μg/mlas2o3和0.75μg/mlatra培养液,于超低黏附的6孔板加入1ml标准培养基和5.0×103个cd13+cd133+lcscs细胞,在37℃、5%co2、饱和湿度的培养箱中孵育,每天半量换新鲜培养基,观察细胞球情况,肿瘤球培养10~15d在倒置显微镜下拍照。②atra和as2o3处理:lcscs按:a.对照组;b.0.5μg/mlas2o3组;c.1.0μg/mlatra组;d.0.25μg/mlas2o3+0.75μg/mlatra。【实验结果】:atra和as2o3单独或组合均有抑制肿瘤球生成作用,0.25μg/mlas2o3联合0.75μg/mlatra作用更强。【实验结论】:atra和as2o3组合有协同诱导lcscs分化的作用,同时减少as2o3用量。现有结果和上述实验结果表明,①as2o3或atra分别具有诱导lcscs分化的作用(相近的诱导分化作用功能);②as2o3或atra都作用于lcscs的pml蛋白(有共同的靶蛋白pml之分子基础);③as2o3或atra均可以下调pml及oct4蛋白表达;④在lcscs关键基因oct4蛋白表达方面有协同作用,可以减少单独as2o3或atra用量,减少其毒副作用,因为as2o3毒副作用具有剂量依赖性;⑤as2o3和atra协同诱导lcscs分化。as2o3和atra通过靶向pml蛋白,抑制pml蛋白表达及增强下调lcscs维持干性的关键基因oct4表达,抑制lcscs肿瘤球形成、协同诱导lcscs分化,可能达到逐步清除残肝内lcscs,防治hcc切除术后复发和转移;而且增强诱导分化效果和减少as2o3用量和毒副作用。图10显示为肝癌的两种治疗模式:针对lcscs的靶向治疗,对克服肝癌化疗耐药至关重要。其中,a.传统治疗模式:因lcscs具有耐药性,可在传统治疗结束后幸存下来,再次分化增殖为恶性程度更高的肿瘤。b.结合lcscs靶向治疗模式:结合针对lcscs的靶向治疗,可在第一周期清除lcscs,避免其再次分化增殖。再辅以传统化疗清除已分化的肿瘤细胞和前体细胞(由lcscs分化或转化而来),可更加彻底的消灭肿瘤。最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1