试剂在制备药物中的用途、干涉片段、抑制肝癌肿瘤干细胞自我更新方法和治疗肝癌药物与流程
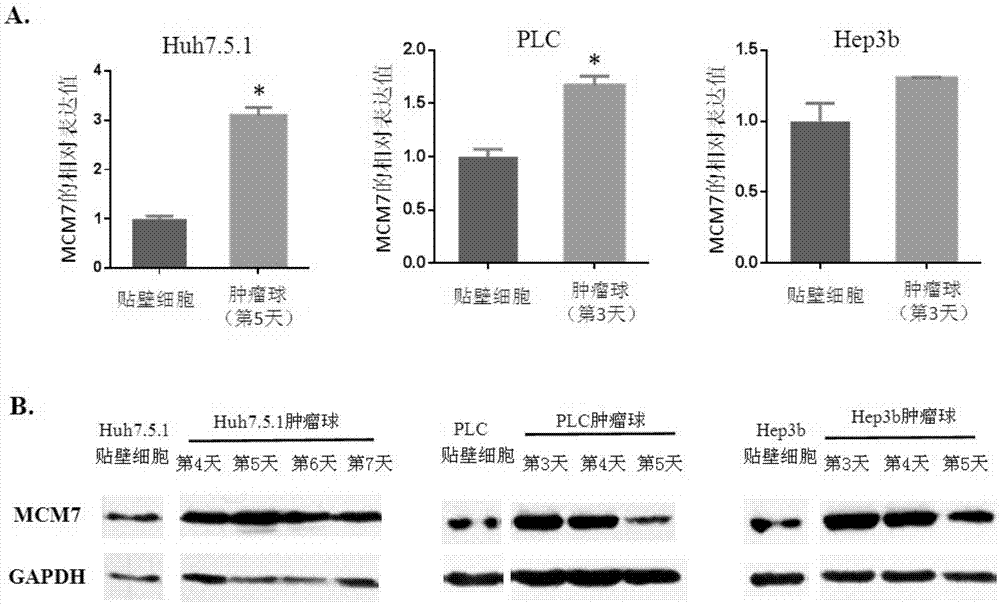
本发明涉及生物医药领域。具体地,本发明涉及试剂在制备药物中的用途、干涉片段、抑制肝癌肿瘤干细胞自我更新方法和治疗肝癌药物。更具体地,本发明涉及试剂在制备药物中的用途、干涉片段、构建体、抑制肝癌肿瘤干细胞自我更新的方法和治疗肝癌的药物。
背景技术:
:肝细胞癌,是世界第五大癌症,癌症相关死亡率位居恶性肿瘤第三位,这与其高达60%的转移率及术后复发率密不可分。肿瘤复发与转移的共同关键步骤是肿瘤组织的重建。由于手术或放、化疗等治疗手段已经消灭了大部分肿瘤细胞,因此肿瘤组织的重建是由原位残存的或转移至远端的一小群具有高度自我更新能力的干细胞样细胞完成的,这群细胞被定义为肿瘤干细胞(cancerstemcells,csc)。肿瘤干细胞与正常干细胞的基本特征十分相似,其高度的自我更新和多向分化能力可以启动肿瘤发生,是导致肿瘤复发和转移的元凶。包括肝细胞癌在内,目前已在白血病、乳腺癌、结肠癌、前列腺癌等多种实体瘤中证实了肿瘤干细胞的存在。研究者们希望通过清除肿瘤干细胞来摧毁肿瘤的基石,从而寻找攻克复发性、转移性肿瘤的新希望。然而,靶向肿瘤干细胞的关键是找到肿瘤干细胞的关键调控分子。目前对于肝癌肿瘤干细胞的调控机制尚不明确,靶向肝癌肿瘤干细胞的策略非常有限。技术实现要素:本发明旨在至少在一定程度上解决现有技术中存在的技术问题至少之一。需要说明的是,本发明是基于发明人的下列发现而完成的:微小染色体维持蛋白7(minichromosomemaintenanceprotein7,mcm7)是mcm家族的一员,参与dna复制起始复合物的形成,启动dna复制并发挥解螺旋酶的作用。dna复制过程的严格调控是保证遗传物质稳定传递的关键,任何差错都可能导致基因组的不稳定而诱发或促进肿瘤。因此作为dna复制的关键调控分子之一,mcm7分子的表达或功能异常都与肿瘤的发生发展有着密切的联系。在研究肝癌肿瘤干细胞的技术手段中,发明人通过肝癌肿瘤干细胞球形成实验(tumorsphereassay)富集肝癌肿瘤干细胞,以形成的肝癌肿瘤干细胞球的数目和大小来反映肿瘤干细胞在体外自我更新的能力。发明人发现,mcm7蛋白在肝癌肿瘤干细胞球中的表达明显高于贴壁生长的肝癌细胞,提示mcm7蛋白在肝癌肿瘤干细胞的自我更新过程中发挥了重要作用。此外,通过对mcm7的转录调控分子进行生物信息学预测,发明人在mcm7启动子序列上预测到多个血清应答因子(serumresponseelement,srf)的结合位点,并通过进一步实验验证,证实了srf蛋白参与了mcm7的表达调控。有鉴于此,发明人分别针对mcm7基因和srf基因设计了rna干涉片段,抑制mcm7蛋白和srf蛋白的合成,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。为此,在本发明的一个方面,本发明提出了试剂在制备药物中的用途。根据本发明的实施例,所述药物用于治疗肝癌,所述试剂用于抑制mcm7蛋白的表达。发明人发现,mcm7蛋白参与肝癌肿瘤干细胞自我更新的调控,通过抑制mcm7蛋白的表达,可以抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。根据本发明的实施例,所述试剂在制备药物中的用途还可以具有下列附加技术特征:根据本发明的实施例,所述试剂为干涉片段,所述干涉片段由正义链和反义链组成,其中,所述正义链具有seqidno:1所示的核苷酸序列,所述反义链具有seqidno:2所示的核苷酸序列。根据本发明的实施例,所述试剂用于抑制肝癌肿瘤干细胞的自我更新。根据本发明的实施例,通过抑制srf蛋白的表达可抑制mcm7蛋白的表达。根据本发明的实施例,所述试剂为干涉片段,所述干涉片段由正义链和反义链组成,其中,所述正义链具有seqidno:3所示的核苷酸序列,所述反义链具有seqidno:4所示的核苷酸序列。在本发明的又一方面,本发明提出了一种干涉片段。根据本发明的实施例,所述干涉片段可抑制肝癌肿瘤干细胞的自我更新,由正义链和反义链组成,其中,所述正义链具有seqidno:1所示的核苷酸序列,所述反义链具有seqidno:2所示的核苷酸序列;或者所述正义链具有seqidno:3所示的核苷酸序列,所述反义链具有seqidno:4所示的核苷酸序列。发明人根据mcm7基因和srf基因设计了干涉片段,抑制mcm7蛋白和srf蛋白的合成,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。在本发明的又一方面,本发明提出了一种构建体。根据本发明的实施例,所述构建体包括前面所述的干涉片段。利用本发明构建体上的干涉片段在肿瘤干细胞中进行表达,可以有效地抑制mcm7蛋白和srf蛋白的合成,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。在本发明的又一方面,本发明提出了一种抑制肝癌肿瘤干细胞自我更新的方法。根据本发明的实施例,所述方法包括:将前面所述干涉片段或者前面所述构建体转入肝癌肿瘤干细胞中。通过将干涉片段转入肝癌肿瘤干细胞中,可以有效地抑制mcm7蛋白和/或srf蛋白的合成,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。根据本发明的实施例,利用慢病毒载体系统将所述构建体转入肝癌肿瘤干细胞中。在本发明的又一方面,本发明提出了一种治疗肝癌的药物。根据本发明的实施例,所述药物包括前面所述的干涉片段。利用本发明的干涉片段可以有效地抑制mcm7蛋白和/或srf蛋白的合成,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。附图说明本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:图1显示了根据本发明一个实施例的人肝癌肿瘤干细胞球(tumorsphere)中mcm7的表达分析,其中,a为实时定量pcr检测mcm7mrna在贴壁培养的肝癌细胞及悬浮培养的tumorsphere中表达情况的结果;b为westernblot检测mcm7蛋白在贴壁培养的肝癌细胞及悬浮培养的tumorsphere中表达水平的结果;图2显示了根据本发明一个实施例的mcm7敲低表达对人tumorsphere的影响分析,其中,a为构建体病毒载体感染肝癌细胞后分选得到的gfp阳性细胞的细胞形态及绿色荧光表达情况;b为mcm7蛋白在mcm7敲低表达的肝癌细胞中蛋白表达下调的westernblot验证结果;c为敲低肝癌细胞mcm7的表达后,tumorsphere的变化;d为以形成的所有肝癌肿瘤干细胞球的面积总和评价肝癌肿瘤干细胞球大小及数量的统计结果;图3显示了根据本发明一个实施例的mcm7敲低对人肝癌肿瘤干细胞在体内启动肿瘤发生能力的影响分析,其中,a为1×106个hcclm3-psicor-gfp-shmcm7及对照scramble细胞分别在nod/scid小鼠皮下两侧成瘤的结果及对肿瘤重量的统计学结果;b为1×105个hcclm3-psicor-gfp-shmcm7及对照scramble细胞在nod/scid小鼠皮下两侧成瘤的结果及对肿瘤重量的统计学结果;c为两组不同梯度的hcclm3-psicor-gfp-scramble/shmcm7细胞皮下成瘤的成瘤率结果;图4显示了根据本发明一个实施例的srf敲低对人肝癌细胞mcm7表达水平及人肝癌tumorsphere的影响分析,其中,a为生物信息学网站预测的可能与mcm7启动子区结合的转录因子及其结合位点;b为srf及mcm7蛋白在psicor-gfp-scramble/shsrf稳定转染肝癌细胞中下调表达的westernblot结果;c为干扰肝癌细胞srf的表达后,tumorsphere的变化;d为以形成的所有肝癌肿瘤干细胞球的面积总和评价肝癌肿瘤干细胞球大小及数量的统计结果。具体实施方式下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。本发明提出了试剂在制备药物中的用途、干涉片段、构建体、抑制肝癌肿瘤干细胞自我更新的方法和治疗肝癌的药物,下面将分别对其进行详细描述。试剂在制备药物中的用途在本发明的一个方面,本发明提出了一种试剂在制备药物中的用途。根据本发明的实施例,该药物用于治疗肝癌,试剂用于抑制mcm7蛋白的表达。发明人发现,mcm7蛋白参与肝癌肿瘤干细胞自我更新的调控,通过抑制mcm7蛋白的表达,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。根据本发明的实施例,试剂为干涉片段,干涉片段由正义链和反义链组成,其中,正义链具有seqidno:1所示的核苷酸序列,反义链具有seqidno:2所示的核苷酸序列。发明人根据mcm7基因序列设计了双链干涉片段:正义链:5’-t(n19)ttcaagaga(19n)ttttttc-3’(seqidno:11),反义链:5’-tcgagaaaaaa(n19)tctcttgaa(19n)a-3’(seqidno:12);其中n19为干涉序列,19n与干涉序列反向互补,转录后可形成具有发夹结构的rna。正义链和反义链退火后将产生一个平末端和一个xhoⅰ酶切末端,用于和载体相连接。在此基础上,发明人进一步设计了n19序列,从而获得了seqidno:1和2所示的核苷酸序列。小发卡或短发卡rna(shrna)是一段具有紧密发卡环的rna序列,常被用于rna干扰沉默靶基因的表达。发明人针对mcm7mrna序列特异性的设计了shrna,然后利用慢病毒载体把shrna导入细胞,这种装载了shrna载体可被传递到子代细胞中去,从而使基因的沉默被遗传。shrna的发卡结构在细胞内会自动被切割成sirna,然后sirna结合到rna诱导沉默复合物上(rna-inducedsilencingcomplex,risc),该复合物能够结合到mcm7mrnas并将其降解,从而降低了mcm7蛋白的翻译水平,使得肝癌细胞内的mcm7蛋白显著降低。5’-tggctaatggagatgtcaaattcaagagatttgacatctccattagccttttttc-3’(seqidno:1)5’-tcgagaaaaaaggctaatggagatgtcaaatctcttgaatttgacatctccattagcca-3’(seqidno:2)根据本发明的实施例,试剂用于抑制肝癌肿瘤干细胞的自我更新。发明人发现,mcm7蛋白参与肝癌肿瘤干细胞自我更新的调控,通过抑制mcm7蛋白表达可以抑制肝癌肿瘤干细胞体内、体外自我更新能力。需要说明的是,本发明所使用的术语“自我更新”是指干细胞通过对称或者不对称分裂产生至少一个保留干细胞特性的子细胞的过程,自我更新能够维持干细胞具有多分化的潜能,对于组织特异性干细胞而言,自我更新是维持其终生具有分化潜能的基础。国际公认的肿瘤干细胞体外检测的金标准方法为:肿瘤球形成实验(tumorsphere),肿瘤干细胞体内检测的金标准方法为:梯度稀释皮下成瘤实验(limitingdilutingassays),具体操作如下:(1)肿瘤干细胞球形成的体外实验(invitrotumorsphereformationassays):使用低吸附孔板,在无血清培养基中添加一定浓度促进细胞分裂的生长因子,使具有干细胞性质的细胞在该培养条件下持续增殖分裂,形成多细胞球状结构,即肿瘤干细胞球;由于大部分肿瘤细胞因缺乏体外生长所必需的血清而不能存活,每个肿瘤球实际上是由单个肿瘤干/祖细胞增殖、分裂而来,因此肿瘤球的数量和大小可用于评估细胞群体中肿瘤干细胞的频率及其在体外的增殖能力。(2)梯度稀释成瘤实验(limitingdilutingassays):取肿瘤细胞单细胞悬液,计数活细胞数,将不同稀释密度的细胞(如106/105/104)移植到免疫功能低下的小鼠皮下,每种稀释密度移植5~10只小鼠。移植后一定时间,确定形成肿瘤和未形成肿瘤的动物数,并测量形成肿瘤的重量,得到成瘤率和成瘤大小的数据。由于肿瘤组织的发生和重建是肿瘤干细胞所特有的性质,因此成瘤率与成瘤大小可反映肿瘤干细胞在体内自我更新、启动肿瘤发生的能力。根据本发明的实施例,通过抑制srf蛋白的表达可抑制mcm7蛋白的表达。发明人在mcm7启动子序列上预测到多个血清应答因子srf的结合位点,并通过进一步实验验证,证实了srf蛋白参与mcm7基因的表达调控。由此,通过抑制srf蛋白的表达,起到抑制mcm7蛋白表达的作用,从而有效地抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。根据本发明的实施例,试剂为干涉片段,干涉片段由正义链和反义链组成,其中,正义链具有seqidno:3所示的核苷酸序列,反义链具有seqidno:4所示的核苷酸序列。发明人基于srf基因序列设计了干涉片段,其可以特异、有效地抑制srf蛋白的表达。5’-tgtgagacaggccatgtgtatattcaagagatatacacatggcctgtctcacttttttc-3’(seqidno:3)5’-tcgagaaaaaagtgagacaggccatgtgtatatctcttgaatatacacatggcctgtctcaca-3’(seqidno:4)干涉片段在本发明的又一方面,本发明提出了一种干涉片段。根据本发明的实施例,干涉片段可抑制肝癌肿瘤干细胞的自我更新,干涉片段由正义链和反义链组成,其中,正义链具有seqidno:1所示的核苷酸序列,反义链具有seqidno:2所示的核苷酸序列;或者正义链具有seqidno:3所示的核苷酸序列,反义链具有seqidno:4所示的核苷酸序列。发明人根据mcm7基因和srf基因设计了干涉片段,抑制mcm7蛋白和srf蛋白的合成,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。构建体在本发明的又一方面,本发明提出了一种构建体。根据本发明的实施例,构建体包括前面所述的干涉片段。利用本发明构建体上的干涉片段在肿瘤干细胞内进行表达,可以有效地抑制mcm7蛋白和srf蛋白的合成,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。需要说明的是,本发明的构建体中既可以仅有针对mcm7蛋白的干涉片段(即仅有seqidno:1和2所示的核苷酸序列),也可以仅有针对srf蛋白的干涉片段(即仅有seqidno:3和4所示的核苷酸序列),还可以同时有针对这两种蛋白的干涉片段(即同时有seqidno:1~4所示的核苷酸序列)。根据本发明的实施例,构建体进一步含有gfp基因。由此,起到示踪作用。根据本发明的实施例,构建体进一步含有无义scramble片段。该片段是针对目的干扰片段的对照,本身是无功能的,作为对照组检验目标干扰片段可能产生的抑制功能。具体地,无义scramble片段由下述正义链和反义链组成:5’-tttctccgaacgtgtcacgtttcaagagaacgtgacacgttcggagaattttttc-3’(seqidno:5)5’-tcgagaaaaaattctccgaacgtgtcacgttctcttgaaacgtgacacgttcggagaaa-3’(seqidno:6)本领域技术人员能够理解的是,前面针对干涉片段所描述的特征和优点,同样适用于该构建体,在此不再赘述。抑制肝癌肿瘤干细胞自我更新的方法在本发明的又一方面,本发明提出了一种抑制肝癌肿瘤干细胞自我更新的方法。根据本发明的实施例,该方法包括:将前面所述干涉片段或者前面所述构建体转入肝癌肿瘤干细胞中。通过将干涉片段转入肝癌细胞中,可以有效地抑制mcm7蛋白和/或srf蛋白的合成,从而抑制肝癌细胞中肿瘤干细胞的自我更新,起到治疗肝癌的目的。根据本发明的实施例,利用慢病毒载体系统将构建体转入肝癌肿瘤干细胞中。发明人发现,采用慢病毒载体系统转染能够显著提高细胞的感染效率,并使构建体上的干涉片段稳定遗传到子代细胞中。本领域技术人员能够理解的是,前面针对干涉片段和构建体所描述的特征和优点,同样适用于该抑制肝癌肿瘤干细胞自我更新的方法,在此不再赘述。治疗肝癌的药物在本发明的又一方面,本发明提出了一种治疗肝癌的药物。根据本发明的实施例,该药物包括前面所述的干涉片段。利用本发明的干涉片段可以有效地抑制mcm7蛋白和/或srf蛋白的合成,从而抑制肝癌肿瘤干细胞的自我更新,起到治疗肝癌的目的。需要说明的是,本发明所使用的术语“治疗”用于指获得期望的药理学和/或生理学效果。所述效果就完全或部分预防疾病或其症状而言可以是预防性的,和/或就部分或完全治愈疾病和/或疾病导致的不良作用而言可以是治疗性的。本文使用的“治疗”涵盖哺乳动物、特别是人的疾病,包括:(a)在容易患病但是尚未确诊得病的个体中预防疾病(例如预防肝癌)或病症发生;(b)抑制疾病,例如阻滞疾病发展;或(c)缓解疾病,例如减轻与疾病相关的症状。本文使用的“治疗”涵盖将药物或化合物给予个体以治疗、治愈、缓解、改善、减轻或抑制个体的疾病的任何用药,包括但不限于将本文的药物给予有需要的个体。本领域技术人员能够理解的是,前面针对干涉片段所描述的特征和优点,同样适用于该治疗肝癌的药物,在此不再赘述。下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例1人肝癌肿瘤干细胞球(tumorsphere)中mcm7的表达情况在该实施例中,以检测人tumorsphere中mcm7的表达情况:一、肝癌细胞肿瘤干细胞球培养1、细胞准备:肝癌细胞消化、离心后,用无血清dmem培养基重悬,反复吹打成单细胞悬液,计数待用;2、成球培养基准备:dmem培养基与dmem/f-12培养基按照1:1体积混合,添加b27(1:100)、n2(1:50)、10ng/mlegf、5ng/mlbfgf、4μg/ml肝素、100u/ml青霉素及100ng/ml链霉素,配好的培养基可在4℃保存7天。3、将成球培养基加入低吸附六孔板,以3000个细胞/孔的密度接种细胞,置于细胞培养箱中静置培养。二、人肝癌肿瘤干细胞球中mcm7mrna的荧光定量实时pcr检测1、总rna的提取(1)分别收集成球培养第3~7天的肿瘤干细胞球至15ml离心管,800rpm离心3min,可见管底肿瘤干细胞球沉淀。用枪头小心吸弃上清,加入1mlpbs洗涤一次并转移至1.5ml的ep管中;(2)再次离心800rpm,3min,用枪头小心吸弃上清,在确保不吸到肿瘤干细胞球沉淀的同时尽量吸尽上清。加入0.5mltrizol,反复吹打使肿瘤干细胞球破碎溶解,室温静置5~10min;(3)加入0.2ml氯仿/mltrizol,剧烈振荡混匀15s,室温静置10min;(4)12000rpm,4℃,离心15min;(5)离心后液体分为三层,从下至上依次为酚/氯仿层、中间蛋白层、上层无色水相,rna存于上层水相中;(6)吸取上层水相至新的ep管中,注意避免将中间蛋白吸出;(7)加入预冷的异丙醇0.5ml/mltrizol,颠倒混匀,室温静置10min;(8)12000rpm,4℃,离心10min;(9)弃上清,rna沉淀用75%乙醇(750μl无水乙醇,250μldepc水现配)洗涤,12,000rpm,4℃,离心5min;(10)弃上清,超净台中鼓风干燥3分钟左右,rna呈半透明状;(11)加入15~20μl1‰depc水溶解rna沉淀,紫外分光光度计测定浓度及od值,-70℃保存或直接用于反转录反应。注意:操作过程中戴口罩、手套并注意更换,以防止rna被rna酶降解。2、rna反转录成cdna提取的总rna于65℃预变性5min,冰上急冷。使用revertraace反转录试剂盒进行反转录,反应体系(20μl)构成及反应条件如下:表1反应体系混匀后置于pcr仪中,反应条件:37℃15min,50℃5min,98℃5min,4℃保持。合成的cdna可立即用于下游实验或-20℃冰箱保存。3、荧光定量实时pcr检测将反转录的cdna样品以适当比例稀释后,使用thunderbridsybrqpcrmix配置如下pcr反应体系:表2反应体系上表中的上、下游引物序列如下:mcm7上游引物序列:5’-cctaccagccgatccagtct-3’(seqidno:7)mcm7下游引物序列:5’-cctcctgagcggttggttt-3’(seqidno:8)内参gapdh上游引物序列:5’-gagtcaacggatttggtcgt-3’(seqidno:9)内参gapdh下游引物序列:5’-ttgattttggagggatctcg-3’(seqidno:10)将8联管内容物离心混匀后放置于bioradiq5pcr仪中运行。pcr反应条件:95℃2min,(95℃15s,58℃20s,72℃20s)×40个循环,72℃5min,10℃保持。每个标本设3个平行管。数据分析:以gapdh作为内参标定mcm7的表达量,计算方法为2-△△ct相对定量方法。三、人肝癌肿瘤干细胞球中mcm7蛋白表达水平的westernblot检测1、分别收集成球培养第3~7天的肿瘤干细胞球至15ml离心管,800rpm离心3min,可见管底肿瘤干细胞球沉淀。用枪头小心吸弃上清,加入1mlpbs洗涤一次并转移至1.5ml的ep管中;2、再次离心800rpm,3min,用枪头小心吸弃上清后,加入适量混合了蛋白酶抑制剂的ripa裂解液,4℃旋转过夜;3、12000rpm,4℃,离心15min;取适量上清与4×loadingbuffer按照3:1混合,沸水中煮5min;4、将煮沸变性的样品进行聚丙烯酰胺凝胶电泳、western印迹,之后用5%脱脂牛奶对pvdf膜室温封闭1小时;5、选用合适的一抗,以适当的稀释比例,与pvdf膜4℃孵育过夜;6、次日,tbst洗3遍,每遍5min;7、选用与一抗宿主种属相对应的hrp标记的二抗,以适当的稀释比例,与pvdf膜室温孵育1小时;8、tbst洗3遍,每遍5min;9、ecl液显影,检测mcm7蛋白在肝癌细胞肿瘤干细胞球中的表达情况。四、结果图1显示了mcm7在人肝癌肿瘤干细胞球中表达情况的检测结果。可知,mcm7在人肝癌肿瘤干细胞球中的表达高于贴壁培养的肝癌细胞,说明mcm7参与了肝癌肿瘤干细胞体外增殖过程的调控。实施例2mcm7敲低对人肝癌肿瘤干细胞球(tumorsphere)成球能力的影响一、psicor-shmcm7-gfp载体的构建1、psicor-gfp载体酶切回收:psicor-gfp载体用hpaⅰ/xhoⅰ双酶切,酶切体系如表3所示:表3酶切体系psicor-gfp1μghpaⅰ1μlxhoⅰ1μl10×cutsmartbuffer2μlh2o补至20μl37℃酶切4小时,使用胶回收试剂盒回收dna片段。2、干涉序列退火及磷酸化:2.1干涉序列:下述senseoligo的核苷酸序列为seqidno:1所示的核苷酸序列,anitsenseoligo的核苷酸序列为seqidno:2所示的核苷酸序列,序列由上海生工公司合成,配制为浓度100μm的溶液;2.2退火:表4退火体系10×pcrbuffer5μlsenseoligo1μlantisenseoligo1μlh2o43μl退火步骤如下:(1)95℃孵育4min;(2)70℃孵育10min;(3)缓慢冷却,存储于-20℃;2.3磷酸化:由于体外合成的序列5’端没有磷酸化,为了提高载体和片段的连接效率,发明人采用t4pnk激酶进行磷酸化反应;表5磷酸化体系10×pnkbuffer2μlannealedoligos5μlt4pnkkinase0.5μldatp(100μm)0.5μlh2o12μl37℃孵育30min后,70℃孵育10min,灭活pnk激酶;2.4连接:取8μl磷酸化产物和2μl回收的psicor-gfp载体,添加1μlneb快速连接酶和10μl2×快速连接缓冲液,室温连接5min后置于冰上;2.5连接产物转化、克隆扩大培养;2.6质粒提取;2.7质粒酶切鉴定及测序鉴定:以没有连入任何片段的psicor-gfp质粒作为阴性对照。psicor-gfp质粒经xhoⅰ/xbaⅰ双酶切后产生一个大小约350bp的片段,而连接了干涉片段的质粒经xhoⅰ/xbaⅰ双酶切后产生一个约400bp的片段。酶切正确的质粒送上海生工公司进行测序鉴定,以保证连入的片段序列准确无误。二、psicor-scrambled-gfp载体的构建psicor-scrambled-gfp载体的构建方法同上述psicor-shmcm7-gfp载体。psicor-scrambled-gfp载体为无义的对照载体。其正义链的核苷酸序列如seqidno:5所示,反义链的核苷酸序列如seqidno:6所示。三、慢病毒包装及稳定低表达mcm7的肝癌细胞株建立1.慢病毒包装及浓缩1.1准备质粒:第三代慢病毒载体系统包含骨架载体psicor-shmcm7-gfp、psicor-scramble-gfp、包装质粒plp1和plp2、包膜质粒plp/vsvg四个质粒。要求质粒dna的od260/od280比值为1.80左右,浓度为0.1~3μg/μl;1.2培养293ft细胞;1.3制备dna-lipofectamine2000复合物:在一个无菌的15ml管中,加入1.5ml无血清opti-mem培养基,依次加入4.2μgplp1、2μgplp2、2.8μgplp/vsvg和5μgpsicor-shmcm7-gfp质粒(或psicor-scramble-gfp),轻轻混匀。在另一个无菌的15ml管中,将42μllipofectamine2000稀释于1.5ml无血清opti-mem培养基中,轻轻混匀,室温放置5min。室温孵育20min以形成dna-lipofectamine2000复合物;1.4在dna-lipofectamine2000复合物形成过程中,胰蛋白酶消化293ft细胞,计数,将细胞重悬于含血清的生长培养基中,使其密度为1.2×106个/ml;1.5将dna-lipofectamine2000复合物加入到含有5ml生长培养基的10cm细胞培养皿中;1.6将5ml293ft细胞悬液加入到含有dna-lipofectamine2000复合物和生长培养基的10cm细胞培养皿中,轻轻地前后移动培养皿混匀。将细胞置于37℃、5%co2细胞培养箱中培养过夜;1.7次日,用10ml含血清的生长培养基更换含有dna-lipofectamine复合物的培养基;1.8转染48~72小时后收集上清于15ml无菌离心管中;1.94℃,3000rpm离心15min去除细胞碎片,并用0.45μm滤膜过滤;1.10以毒液:40%peg=3:1的体积比加入peg,4℃摇转5~6小时后,4000rpm离心30分钟,弃上清,用1~2ml完全培养基重悬病毒沉淀,获得浓缩的毒液。2病毒感染肝癌细胞建立稳定转染细胞株在肝癌细胞培养基中加入含mcm7干涉片段的慢病毒毒液或scramble对照的慢病毒毒液及终浓度为8μg/ml的polybrene,置于37℃,5%co2的细胞培养箱中培养过夜。次日,去除毒液,添加完全培养液,待细胞生长至80%~90%汇合时,按1:3传代。流式细胞术分选表达绿色荧光蛋白的细胞,由此构建mcm7稳定敲低的肝癌细胞株。其中感染psicor-gfp-scramble载体的细胞为对照组细胞,感染psicor-gfp-shmcm7的细胞为mcm7敲低组细胞。3.westernblot检测干涉效果westernblot操作步骤同实施例1所示。四、psicor-gfp-shmcm7稳定转染的肝癌细胞tumorsphere形成能力检测肿瘤干细胞球培养方法同实施例1所示。五、结果图2显示了mcm7下调表达对人肝癌细胞tumorsphere形成能力的影响的实验结果,可知mcm7在肝癌细胞中的下调表达可以显著削弱肝癌细胞的成球能力,证明mcm7在肝癌肿瘤干细胞的体外自我更新过程中发挥了重要的调控作用。实施例3mcm7敲低对人肝癌肿瘤干细胞在体内启动肿瘤发生能力的影响一、nod/scid小鼠皮下荷瘤模型的建立1、取指数生长期的psicor-gfp-scramble/shmcm7质粒稳定转染的hcclm3肝癌细胞,消化离心后,用pbs洗一遍以消除胎牛血清对小鼠的刺激;2、使用活细胞计数仪计数细胞。每组分别取106、105个细胞至1.5mlep管,每组细胞的每个数量级各取8管;3、1200rpm,离心5min,弃上清,用matrigel:无血清培养基=1:3的液体将细胞重悬,重悬的体积约30~50μl/管,由于matrigel在室温会迅速凝固,因此该步骤尽量在冰上进行,使用的枪头宜预冷;4、将nod/scid小鼠随机分为106组和105组,每组7只小鼠。1%戊巴比妥腹腔注射麻醉后,对小鼠背部的左、右两侧分别进行相应数量级的psicor-gfp-scramble/shmcm7稳转hcclm3细胞皮下注射。荷瘤小鼠饲养于清洁级动物房,定期观察小鼠背部肿瘤是否形成。二、皮下肿瘤的剥离及称重待皮下肿瘤长到可被触及时,处死小鼠,剥取左、右背部的皮下肿瘤,拍照、称重。三、结果图3显示了mcm7下调表达对人肝癌干细胞体内成瘤能力的影响。mcm7在肝癌细胞中的下调表达可以显著削弱肝癌细胞在nod/scid小鼠皮下的成瘤能力,证明mcm7在肝癌肿瘤干细胞启动体内肿瘤发生的过程发挥了重要的调控作用。实施例4srf敲低对人肝癌细胞mcm7表达水平及人肝癌肿瘤干细胞球(tumorsphere)形成能力的影响一、生物信息学预测结果提示srf可能与mcm7启动子区结合为了探究mcm7分子的转录调控机制,对mcm7启动子区域的序列进行生物信息学预测分析,寻找可能与之结合的转录因子(http://www.sabiosciences.com/chipqpcrsearch.php?app=tfbs)。预测结果显示ppar-γ、n-myc、serumresponsefactor(srf)和c-myc均在mcm7的启动子区有潜在结合位点,其中srf为全新的mcm7调控分子,此前未见报道。二、psicor-shsrf-gfp载体的构建psicor-shsrf-gfp载体构建方法同实施例2中psicor-shmcm7-gfp载体的构建。其中正义链的核苷酸序列为seqidno:3所示,反义链的核苷酸序列为seqidno:4所示。三、慢病毒包装及稳定低表达srf的肝癌细胞株建立慢病毒包装及建立srf稳定低表达肝癌细胞株的操作步骤同实施例2,获得的感染psicor-gfp-shsrf的细胞为srf敲低组细胞。四、westernblot检测干涉效果westernblot操作步骤同实施例1所示,检测srf及mcm7蛋白在psicor-gfp-scramble/shsrf稳定转染肝癌细胞中的表达情况。五、psicor-gfp-shsrf稳定转染肝癌细胞成球能力检测肿瘤干细胞球培养方法同实施例1所示。六、结果图4显示了srf敲低对人肝癌细胞mcm7表达水平及tumorsphere成球能力的影响。结果证实在肝癌细胞中敲低srf表达后,mcm7蛋白的表达水平随之下降,tumorsphere的成球能力被明显削弱。该结果提示srf蛋白参与mcm7蛋白的表达调控,并可能通过mcm7在肝癌肿瘤干细胞的自我更新过程中发挥调控作用。在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。sequencelisting<110>中国人民解放军军事科学院军事医学研究院<120>试剂在制备药物中的用途、干涉片段、抑制肝癌肿瘤干细胞自我更新方法和治疗肝癌药物<130>pidc3183821<160>12<170>patentinversion3.5<210>1<211>55<212>dna<213>artificialsequence<220><223>1<400>1tggctaatggagatgtcaaattcaagagatttgacatctccattagccttttttc55<210>2<211>59<212>dna<213>artificialsequence<220><223>2<400>2tcgagaaaaaaggctaatggagatgtcaaatctcttgaatttgacatctccattagcca59<210>3<211>58<212>dna<213>artificialsequence<220><223>3<400>3gtgagacaggccatgtgtatattcaagagatatacacatggcctgtctcacttttttc58<210>4<211>63<212>dna<213>artificialsequence<220><223>4<400>4tcgagaaaaaagtgagacaggccatgtgtatatctcttgaatatacacatggcctgtctc60aca63<210>5<211>55<212>dna<213>artificialsequence<220><223>5<400>5tttctccgaacgtgtcacgtttcaagagaacgtgacacgttcggagaattttttc55<210>6<211>59<212>dna<213>artificialsequence<220><223>6<400>6tcgagaaaaaattctccgaacgtgtcacgttctcttgaaacgtgacacgttcggagaaa59<210>7<211>20<212>dna<213>artificialsequence<220><223>7<400>7cctaccagccgatccagtct20<210>8<211>19<212>dna<213>artificialsequence<220><223>8<400>8cctcctgagcggttggttt19<210>9<211>20<212>dna<213>artificialsequence<220><223>9<400>9gagtcaacggatttggtcgt20<210>10<211>20<212>dna<213>artificialsequence<220><223>10<400>10ttgattttggagggatctcg20<210>11<211>17<212>dna<213>artificialsequence<220><223>11<220><221>misc_feature<222>(1)..(2)<223>存在n19干涉片段<220><221>misc_feature<222>(10)..(11)<223>存在19n干涉片段<400>11tttcaagagattttttc17<210>12<211>21<212>dna<213>artificialsequence<220><223>12<220><221>misc_feature<222>(11)..(12)<223>存在n19干涉片段<220><221>misc_feature<222>(20)..(21)<223>存在19n干涉片段<400>12tcgagaaaaaatctcttgaaa21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1