前列腺素E1甲酯在制备扩张血管药物中的应用的制作方法
本发明涉及医药领域,具体的说,本发明涉及前列腺素e1甲酯在制备扩张血管药物中的应用。
背景技术:
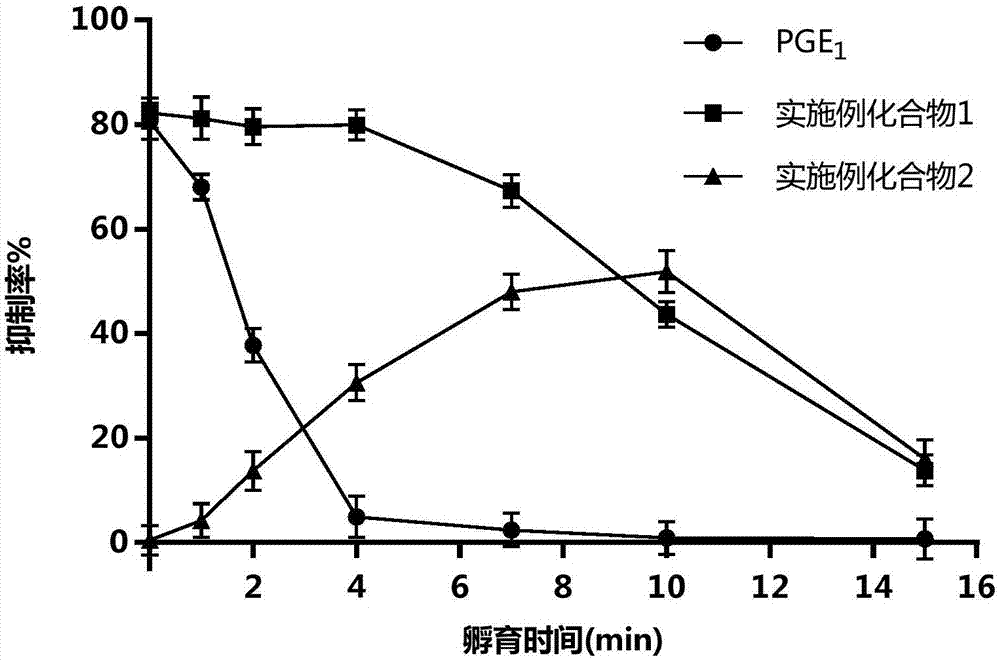
:前列腺素e1(前列腺素e1)为天然内源性血管舒张药,人体细胞均能合成,是调节细胞功能的重要物质,在体内不积累,不产生耐受性,且无毒、无损害性副作用,治疗效果确切,优于外源性药物。前列腺素e1生理活性极强,具有广泛的药理活性,临床上可应用于心脑血管疾病、糖尿病并发症、呼吸系统疾病、肺动脉高压、肝肾综合征(hrs)、肝衰竭、肾病等,研究发现前列腺素e1不仅有扩张血管、减轻心脏负荷的作用,同时有排钠、利尿、强心、改善冠状循环、保护心肌、改善微循环等功效。前列腺素e1烷酯目前被认为是前列腺素e1的前药。例如美国专利us5681850公开了前列腺素e1烷酯(c1-4)用于治疗阳痿,专利中认为前列腺素e1烷酯通过增强脂溶性可以更好地透过皮肤被吸收,随后被水解酶分解成前列腺素e1起效,属于前药;美国专利us6673841公开了前列腺素e1烷酯(c1-5)外用制剂,制剂包含作为前药的前列腺素e1烷酯,油性载体,皮肤渗透增强剂以及抗炎剂。然而本发明人在研究中意外发现,前列腺素e1甲酯本身具有很强的生物活性,从而进一步发现其扩血管相关的医药应用。技术实现要素:本发明目的在于提供前列腺素e1甲酯在制备扩张血管药物中的应用。为达上述目的,本发明提供了前列腺素e1甲酯在制备扩张血管药物中的应用,所述前列腺素e1甲酯结构如式(i)所示:根据本发明一些具体实施方案,其中,所述扩张血管药物是用于治疗如下疾病的药物:微循环障碍、冠心病、心绞痛、心力衰竭、肺心病、脑梗死、羊水栓塞、或硬皮病。根据本发明一些具体实施方案,其中,所述扩张血管药物是通过扩张血管来实现对如下疾病的治疗:微循环障碍、冠心病、心绞痛、心力衰竭、肺心病、脑梗死、羊水栓塞、或硬皮病。根据本发明一些具体实施方案,其中,所述微循环障碍是由以下病症引起:血栓闭塞性脉管炎、闭塞性动脉硬化症、糖尿病、冻伤、烧伤或褥疮。根据本发明一些具体实施方案,其中,所述扩张血管药物是用于治疗硬皮病的药物,所述扩张血管药物是通过改善硬皮病动物的皮肤厚度和/或胶原蛋白沉积来实现对硬皮病的治疗。根据本发明一些具体实施方案,其中,所述扩张血管药物是用于治疗硬皮病的药物,所述扩张血管药物是通过改善硬皮病动物的皮肤厚度和/或胶原蛋白沉积来实现对硬皮病的治疗。根据本发明一些具体实施方案,其中,所述动物为哺乳动物。根据本发明一些具体实施方案,其中,所述动物为人。综上所述,本发明提供了前列腺素e1甲酯在制备扩张血管药物中的应用。发明人在研究中意外发现,前列腺素e1甲酯本身具有较强的药物活性,可直接与dp1受体亲和,激活dp1受体可以抑制血小板聚集和扩张血管,而非作为前药需要水解后延时起效,并且在具体实验例中前列腺素e1甲酯表现出了比前列腺素e1更优的药物活性和治疗效果,组织分布试验也显示前列腺素e1甲酯更容易分布于皮肤组织中。附图说明图1为实验例2的抑制率随孵育时间的变化曲线图;图2为实验例3的前列腺素e1甲酯浓度对家兔离体血管的舒张效能影响曲线图。具体实施方式以下通过具体实施例详细说明本发明的实施过程和产生的有益效果,旨在帮助阅读者更好地理解本发明的实质和特点,不作为对本案可实施范围的限定。实施例1本发明前列腺素e1甲酯([(1r,2r,3r)-3-羟基-2-(s,e)-3-羟基-1-烯基)-5-氧代环戊基]庚酸甲酯)的合成原料前列腺素e1(63mg,0.18mmol)加入三口烧瓶中,然后加入配置好的1m的干燥thf/et2o溶液溶液搅拌溶解,冰浴条件下,向反应液中缓慢中滴加mei(26mg,1m)溶液,滴加完后加入koh(10mg,0.18mmol)和bu4nbr(6mg,0.018mmol)。反应搅拌1h后,加热至室温,tlc监控至反应结束。加水20ml猝灭反应,用etoac(10ml×3)萃取,合并有机相,用无水na2so4干燥并过滤。滤液减压浓缩,用柱层析纯化(洗脱液正己烷/ea=1/1),得到白色固体产物(24.8mg,38%收率)。lcms(msfound:391.3[m+na]+.1hnmr(400mhz,dmso)(ppm):5.46(s,2h),5.01(s,1h),4.57(s,1h),3.88(s,2h),3.57(s,3h),1.9-2.3(m,5h)1.2-1.48(m,19h),0.85(s,3h)。实施例2化合物2([(1r,2r,3r)-3-羟基-2-(s,e)-3-羟基-1-烯基)-5-氧代环戊基]庚酸乙酯)的合成原料前列腺素e1(63mg,0.18mmol)加入三口烧瓶中,然后加入配置好的1m的干燥thf/et2o溶液溶液搅拌溶解,冰浴条件下,向反应液中缓慢中滴加etbr(20mg,1m)溶液,滴加完后加入koh(10mg,0.18mmol)和bu4nbr(6mg,0.018mmol)。反应搅拌1h后,加热至室温,tlc监控至反应结束。加水20ml猝灭反应,用etoac(10ml×3)萃取,合并有机相,用无水na2so4干燥并过滤。滤液减压浓缩,用柱层析纯化(洗脱液正己烷/ea=1/1),得到白色固体产物(20.5mg,29.8%收率)。lcms(msfound:405[m+na]+.1hnmr(400mhz,dmso)(ppm):5.46(s,2h),5.01(s,1h),4.57(s,1h),3.88(s,2h),3.57(s,3h),1.9-2.3(m,7h)1.2-1.48(m,19h),0.85(s,3h)。实验例1体外dp受体靶点亲和力试验。采用放射性配体([3h]prostaglandind2(pgd2))受体竞争结合试验,评价待测化合物与dp受体的亲和力,结果如下表1所示。表1结果表明:前列腺素e1甲酯与dp受体有较高的亲和力。实验例2本发明前列腺素e1甲酯在体外抗血小板凝集试验中的作用。健康成年sd大鼠腹腔注射10%水合氯醛麻醉后,腹主动脉采集大鼠新鲜全血加入使用3.8%枸橼酸钠溶液抗凝的离心管中,900转离心10min取上层富含血小板的血浆(prp)备用。取出prp的试管继续4000转离心10分钟,取上层澄清血浆(ppp)备用。实验选用泰利康信lby-nj4型4通道血小板聚集仪测定各化合物的抗凝效能。含有300μlprp样品杯中先加入2μl100μm的前列腺素e1、实施例1前列腺素e1甲酯、实施例2化合物2和甲醇(溶剂),孵育不同的时间(0、1、2、4、7、10、15min)后加入聚集诱导剂180μmadp溶液20μl,测定各样品的聚集率,并计算化合物对adp诱导血小板聚集的抑制率。抑制率%=(溶剂聚集率-化合物聚集率)/溶剂聚集率×100%由结果(图1)可知,prp中加入前列腺素e1与实施例前列腺素e1甲酯后立即生效,抑制率相当,随孵育时间延长,实施例化合物抗凝效能缓慢降低,10分钟后抑制率仍为43.66%,前列腺素e1孵育4分钟后抑制率仅为4.93%。实施例2化合物2加入后并未立即生效,随时间延长效能逐渐加强,孵育10分钟后达到最大抑制率51.86%。故实施例1前列腺素e1甲酯为具有活性的非前药化合物,其抗凝作用时长超过前列腺素e12倍,而实施例化合物2为典型的前药型化合物。实验例3本发明前列腺素e1甲酯在体外血管条扩张试验中的作用实验选用家兔制备离体主动脉环标本:新西兰大白兔,雄性,体重(2.5±0.3)kg。用钝器击昏兔子,固定于兔解剖台,迅速分离出胸主动脉,放入盛有37℃饱和的kerbs液(每1000ml中含nacl6.9g,kcl0.35g,mgso4·7h2o0.29g,kh2po40.16g,nahco32.1g,cacl20.28g,葡萄糖2g)并持续通入通混合气体(95%o2,5%co2)的培养皿中,将血管内的残存血液挤出,并小心剥去外围的脂肪及结缔组织,剪成0.5cm长的动脉环数段备用。血管环用两根不锈钢l型挂钩贯穿血管管腔,横向悬挂在20ml浴管内,下方固定,上方以一细钢丝连于张力换能器,先调解静息张力为0.00g,稳定20min后,再给予3.00g张力,不断调整张力水平,使之维持在3.00g左右,稳定2h(每15min沿浴槽壁换kerbs液一次)。使用bl-420s生物机能实验系统(成都泰盟科技)记录血管环张力变化。待血管环收缩达到稳定后,累积加入前列腺素e1和实施例化合物,使浴管中的前列腺素e1终质量浓度依次递增为0.05、0.1、0.2、0.4、0.8、1.6、3.2、6.4、12.8、25.6nm,记录血管环的舒张效能。结果(图2)显示在本实验条件下实施例1的前列腺素e1甲酯对家兔离体血管的舒张效能(ec50=1.090nm)明显强于前列腺素e1(ec50=9.767nm)。实验例4复苏冷冻的人脐静脉内皮细胞(huvec),置于加入10%(v/v)fbs的低糖dmem培养基,加入100u/l青霉素和0.1g/l链霉素在环境为为5%co2,95%空气,温度37℃的条件下进行人工培养,每三天更换新鲜培养基,细胞密度70-80%时,使用消化液(0.25%胰酶/0.02edta)收获细胞。细胞重悬后,接种于96孔板中,密度5×103每孔。培养1天后加入1-100nm前列甲酯孵育培养24小时,进行mtt检测。对比未加药孔细胞,前列甲酯具有明显促血管内皮细胞增值的作用,该作用可促进血管新生,改善血管功能,临床可用于治疗微循环障碍疾病。实验例5前列腺素e1甲酯在小鼠硬皮病模型中的治疗作用硬皮病是一种以皮肤、血管和内脏器官的纤维化,体内产生大量破坏各种细胞成分的自身抗体为特征的结缔组织病,发病有3个基本过程,即纤维化、炎症和血管功能障碍。该病的病因及发病机制至今尚不完全清楚,尚无理想的治疗药物和方法。本实验采用56只balb/c小鼠,体重22~25g,随机分为7组,分别为正常组、模型组、溶媒组、前列腺素e1高、低剂量组和前列腺素e1甲酯高、低剂量组。模型制备:剃去小鼠背部中央区的被毛,正常组背部皮下注射0.1mlpbs,其余各组皮下注射0.1ml0.2mg/ml博来霉素,每天一次,注射三周。给药方式:采用加拿大alzet公司的渗透给药泵osmoticpumps,型号1004,内含100ul含药dmso溶液,药物匀速释放,释药周期28天。前列腺素e1高、低剂量组分别载药28ug、14ug;前列腺素e1甲酯高、低剂量组同样分别载药28ug、14ug;溶剂组不载药,将渗透泵埋入小鼠腹腔插管下腔静脉给药。造模同时开始给药。指标检测:给药结束后,处死动物,制作注射部分皮肤和肺切片,he染色。观察组织学改变,测量皮肤(真皮)厚度;并采用光电比色法测定皮肤中羟脯氨酸和蛋白的含量来推断胶原含量。结果显示,模型组注射部位真皮层明显增厚,胶原纤维增粗,数量增多,纤维间隙变窄,毛囊萎缩,血管壁增厚,管腔内狭窄,伴有炎性细胞浸润。各给药组小鼠局部皮肤有不同程度增厚,但均轻于模型组,胶原纤维排列较松散,毛囊出现炎性细胞浸润较少,前列腺素e1组和前列腺素e1甲酯组皮肤厚度均呈剂量相关性,同一药物高剂量组优于低剂量组,且前列腺素e1甲酯组明显优于前列腺素e1组;肺组织出现肺泡间隔增厚伴大量单核细胞浸润,间隙有成纤维细胞增生,小血管壁增厚。与模型组相比,给药各剂量组肺泡间隔增厚程度均有所减轻,炎症细胞浸润略有缓解,前列腺素e1甲酯组略好于前列腺素e1组。胶原过度沉积于皮肤和相应的内脏组织在硬皮病发展过程中起着重要作用,结果显示,模型组皮肤胶原蛋白含量显著升高,而各给药组胶原蛋白含量平均值相比模型组有所降低,但前列腺素e1两个剂量组无显著性差异,而前列腺素e1甲酯两个剂量组蛋白含量相较模型组以及前列腺素e1两个剂量组均有显著性较低。各组小鼠皮肤厚度和皮肤胶原含量见下表2。表2.各组小鼠皮肤厚度和皮肤胶原含量比较*与模型组比较p<0.05;#与前列腺素e1高剂量组比较p<0.05上述结果表明,前列腺素e1甲酯对小鼠硬皮病模型具有良好的改善效果,且优于前列腺素e1。实验例6前列腺素e1甲酯在大鼠皮肤组织中的分布本实验采用12只sd雄性大鼠,体重250~280g,随机分为两组(n=6):前列腺素e1组和前列腺素e1甲酯组。采用加拿大alzet公司的渗透给药泵osmoticpumps,型号1003d,内含100ul含药dmso溶液,药物匀速释放,释药周期3天,分别载药[3h]前列腺e1和[3h]前列腺素e1甲酯200ug,将渗透泵埋入大鼠腹腔插管下腔静脉给药。给药结束后,处死动物,取皮肤组织(每只动物取同一位置),称量,检测总辐射值。结果如下表3。表3分组皮肤组织浓度ng(辐射值当量)/g前列腺素e1组45.1±7.5前列腺素e1甲酯组139.3±18.6**:p<0.05结果显示,相同给药剂量下,前列腺素e1甲酯的皮肤组织浓度明显高于前列腺素e1。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1