一种脂质体修饰的阿霉素及含阿霉素的纳米粒子的制作方法
本发明涉及药物修饰领域,具体涉及一种阿霉素的修饰及阿霉素纳米粒的制备,更具体涉及一种脂质体修饰的阿霉素、以及包含脂质体修饰阿霉素的纳米粒子等。
背景技术:
中国2015年估计有4,292,000例癌症新发病例,2,814,000例癌症死亡。在过去的几十年中,人们已经做出了很大的努力来治疗这些严重的疾病。在各种疗法中,化疗手段是目前临床上治疗癌症最有效的方式之一。虽然多种抗癌药物被开发出并应用于化疗,但常常会引起患者的不良副作用,导致身体和精神上的疼痛,且治疗效率很低。目前临床上常用的化疗药物包括阿霉素、紫杉醇、10-羟基喜树碱、伊立替康等。
阿霉素(doxorubicin,dox)是一种抗肿瘤抗生素,可抑制rna和dna的合成,对rna的抑制作用最强,抗瘤谱较广,被广泛用于各种肿瘤的化疗。临床上用于治疗急性淋巴细胞白血病、急性粒细胞性白血病、霍奇金和非霍奇金淋巴瘤、乳腺癌、肺癌、卵巢癌、软组织肉瘤、成骨肉瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、膀胱瘤、甲状腺瘤、绒毛膜上皮癌、前列腺癌、睾丸癌、胃癌、肝癌等。然而由于阿霉素自身两方面的因素限制了其临床应用,一方面由于其骨髓抑制、心肌损伤和心肌毒性等毒副作用;另一方面,阿霉素的耐药性是一个重要因素。
由于大多数化疗药物是通过干扰癌细胞dna的合成过程达到抗肿瘤的作用,因而它们往往存在骨髓抑制等副作用,并且目前对这些伴随的副作用缺乏有效的预防措施,限制了对肿瘤治疗的应用。因此寻找一种既能提升化疗药物的敏感性,同时增强对肿瘤细胞的抑制作用,又能降低其毒副作用及耐药性的抗肿瘤相关药物,成为亟待解决的问题,也一直是现代肿瘤学者研究的热点。
技术实现要素:
为解决上述问题,纳米载药递送策略受到了很多关注。在体内,载药纳米粒可作为异物而被巨噬细胞吞噬,到达网状内皮系统分布集中的肝、脾等靶部位和连接有配基、抗体、酶底物所在的靶部位。纳米颗粒高度分散,表面积巨大,这有利于增加药物与吸收部位生物膜接触面积。纳米颗粒特殊的表面性能,使其在小肠中的滞留时间大大延长,并且纳米粒对装载的药物还具有保护作用,这些综合作用能明显提高药物的吸收和生物利用度。与一般药物的跨膜转运机制不同的是,纳米粒通过内吞等机制进入细胞,因此可以增加药物对生物膜的透过性,有利于药物透皮吸收与细胞内药效发挥。低分子量化疗药物通过非特异性扩散穿过健康和肿瘤组织的毛细血管壁,但通过纳米粒担载的药物只能渗入具有高渗透性肿瘤毛细血管床。载药纳米粒的靶向性在增加局部药物浓度的同时降低了全身其它部位的浓度,从而大大降低了药物的全身性毒性。为了提高纳米粒的疗效且更有效的到达肿瘤部位,在纳米粒的表面修饰上具有靶向作用的三苯基膦(tpp)、叶酸、rgd、lhrh多肽、转铁蛋白、适配体等其它常用靶向基元。同时,在药物分子中引入具有酸敏感的基团,且通过羧酸和氨基缩合变成酯后,其毒副作用往往会减低,使药物进入细胞内能够还原成原药,从而提高药效。
具体而言,本发明提供了一种脂质体修饰的阿霉素、包含脂质体修饰阿霉素的纳米粒子及其制备方法。通过酸酐或者二元有机酸将阿霉素和脂质体连接制备脂质体修饰的阿霉素,进一步用高分子mpeg-dspe对其进行包裹组装成纳米药物。本发明所述纳米药物具有包载率高、肿瘤局部药物浓度高、全身性毒性小、药效高、进入细胞后释放出原药等优点,提高了药物对癌细胞的抑制作用、减轻了药物对正常细胞的毒副作用。
第一方面,本发明提供一种脂质体修饰的药物,其特征在于包括依次共价连接的脂质体分子、接头分子、以及具有治疗活性的药物,所述脂质体分子和药物具有亲核基团,优选所述亲核基团为氨基;所述接头分子具有双亲电基团。
本发明所述脂质体修饰的药物,其中所述脂质体分子包括谷氨酸单元和长链胺单元,优选所述脂质体分子为n,n’-二-长链烷基-l-谷氨酸二酰胺(lg)。
本发明所述脂质体修饰的药物,其中所述的接头分子为酸酐或二元羧酸,优选所述接头分子为顺式乌头酸酐。
本发明所述脂质体修饰的药物,其中所述具有治疗活性的药物为具有伯氨基的化疗药,优选所述化疗药选自阿霉素(doxorubicin)、氨柔比星(amrubicin)、盐酸尼莫司汀(nimustinehydrochloride)、吡柔比星(pirarubicin)、甲氨蝶呤(methotrexate)、丝裂霉素(mitomycin)、长春地辛(vindesine)。
第二方面,本发明还提供所述脂质体修饰药物的制备方法,包括:
(1)用酸酐修饰原药;
(2)使酸酐修饰的原药(car)与脂质体分子发生缩合反应;
(3)洗涤、重结晶、冻干获得脂质体修饰的药物。
本发明所述脂质体修饰药物的制备方法,包括:
(1)通过原药r和顺式乌头酸酐ca之间的开环反应,以三乙胺为催化剂制备顺式乌头酸酐修饰的原药car:具体包括将原药r和ca溶解于无水dmf中,加入三乙胺,室温、避光、氮气下搅拌24小时;加入冷乙酸乙酯混合,洗涤;将有机层用无水硫酸钠干燥12小时,过滤、干燥得car;
(2)将car用二氯甲烷溶解,以edc和nhs活化,加入带有氨基的脂质体分子进行酰胺缩合反应;
(3)反应48小时后,经过洗涤、重结晶,冻干得到脂质体修饰药物。
第三方面,本发明提供一种包含所述脂质体修饰药物的纳米粒子,其特征在于通过使用药学上可接受的高分子包载脂质体修饰的药物组装形成含药物的纳米粒子。
本发明所述纳米粒子,其特征在于所述药学上可接受的高分子mpeg-dspe经过修饰上具有靶向基团。
第四方面,本发明提供所述纳米粒子的制备方法,包括:将mpeg-dspe和脂质体修饰的药物混合,溶解于无水dmf中,磁力搅拌并缓慢滴加二次水,透析过夜,离心取上清液即得包含脂质体修饰的药物的纳米粒子。
可选的,mpeg-dspe和脂质体修饰的药物混合过程中还加入了-靶向分子修饰的mpeg-dspe,优选的所述靶向分子选自由三苯基膦(tpp)、叶酸、rgd、lhrh多肽、转铁蛋白、适配体组成的组。
第五方面,本发明提供所述脂质体修饰的药物、所述纳米粒子在以下方面的用途:
(1)制备治疗癌症的药物;
(2)制备细胞内靶向药物;
(3)制备毒副作用降低的前体药物。
与现有技术相比,本发明的技术方案具有以下优点:
(1)引入脂质体分子n,n’-二-长链烷基-l-谷氨酸二酰胺(lg),提高了药物分子的包载率,提高药物的生物利用度。
(2)采用三苯基膦(tpp)修饰nh2-mpeg-dspe,并与mpeg-dspe混合制备了具有线粒体靶向的纳米药物,提高了药物的抗癌效果。增加局部药物浓度的同时降低了全身其它部位的浓度,从而大大降低了药物的全身性毒性。
(3)在药物分子中引入具有酸敏感的基团,且通过羧酸和氨基缩合变成酯后,其毒副作用往往会减低,使药物进入细胞内能够还原成原药,从而提高药效。
附图说明
通过阅读下文优选实施方式的详细描述,各种其他的优点和益处对于本领域普通技术人员将变得清楚明了。附图仅用于示出优选实施方式的目的,而并不认为是对本发明的限制。而且在整个附图中,用相同的参考符号表示相同的部件。在附图中:
图1:脂质体n,n'-二-十二烷基-l-谷氨酸二酰胺(lgc12)的核磁表征
图2:脂质体lgc12的maldi-tof-ms质谱表征;
a:boc保护的lgc12质谱图;b:boc脱保护的lgc12质谱图
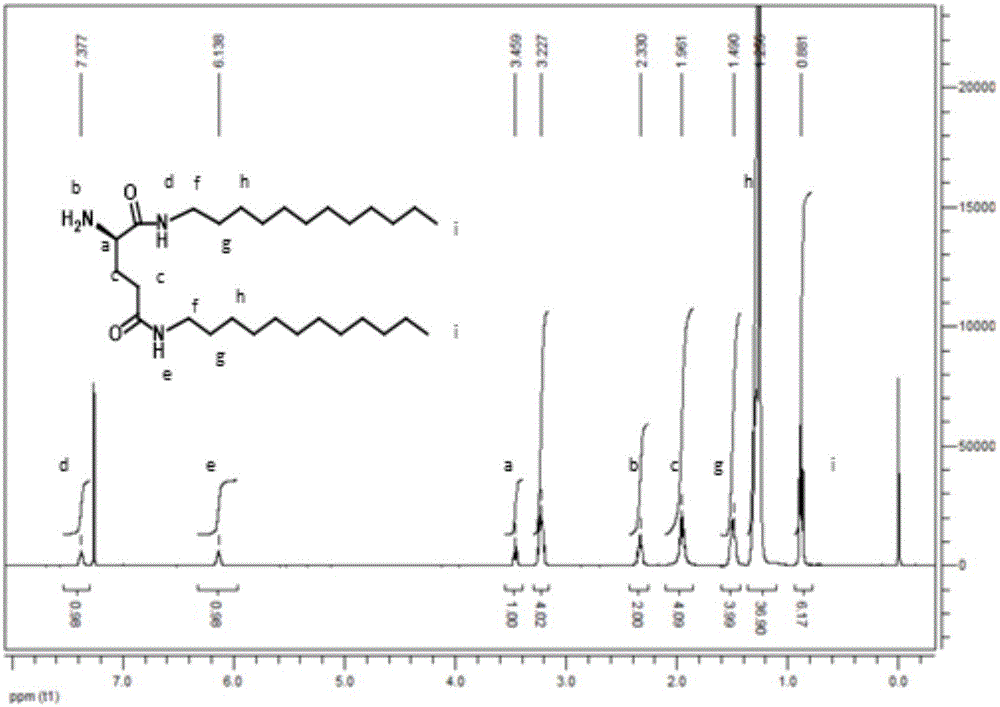
图3:lgc12修饰的阿霉素(dox-lgc12)的核磁表征
图4:dox-lgc12的maldi-tof-ms质谱表征;
图5:含dox-lgc12的纳米粒制备条件优化
x轴为dox-lgc12与mpeg-dspe的质量比;y轴为直径(nm)/pdi
图6a:含dox-lgc12纳米粒的直径分布
图6b:含dox-lgc12-tpp纳米粒的直径分布;
图7:含dox-lgc12纳米粒的tem扫描电镜图
图8:含dox-lgc12纳米粒中dox的质量浓度和紫外吸收关系曲线
图9:含dox-lgc12、dox-lgc12-tpp纳米粒的细胞毒性试验
具体实施方式
下面将参照附图更详细地描述本公开的示例性实施方式。虽然附图中显示了本公开的示例性实施方式,然而应当理解,可以以各种形式实现本公开而不应被这里阐述的实施方式所限制。相反,提供这些实施方式是为了能够更透彻地理解本公开,并且能够将本公开的范围完整的传达给本领域的技术人员。
本发明提供一种脂质体修饰的阿霉素、包含脂质体修饰阿霉素的纳米粒子及其制备方法。通过酸酐或者二元有机酸将阿霉素和脂质体连接制备脂质体修饰的阿霉素,进一步用高分子mpeg-dspe对其进行包裹组装成纳米药物。本发明所述纳米药物具有包载率高、肿瘤局部药物浓度高、全身性毒性小、药效高、进入细胞后释放出原药等优点。
实施例1:脂质体n,n’-二-长链烷-l-谷氨酸二酰胺(lg)的制备和表征
将boc-谷氨酸和两倍当量的长链胺(八、十二、十八胺)加入到反应瓶中,加入二氯甲烷溶解,再加入1.1倍当量的edc和hobt发生酰胺缩合,然后经过过滤、洗涤、重结晶得到n,n’-二-长链烷基-l-boc-谷氨酸二酰胺,再用三氟乙酸脱boc保护,洗涤干燥得到白色粉末n,n’-二-长链烷基-l-谷氨酸二酰胺(lg)。反应步骤如下所示:
对制备的lgc12,进行核磁氢谱表征,结果如图1所示。核磁氢谱中的峰,全都成功归属,表明lgc12的成功合成。
对制备的lgc12,通过maldi-tof-ms进行表征,结果如图2所示。图2a是boc保护的lgc12的质谱图,其中604.1为boc-lgc12+na+,620.1为boc-lgc12+k+;图2b是boc脱保护的质谱图,其中481.5为lgc12,503.6为lgc12+na+,全都成功归属,maldi-tof-ms质谱分析结果也表明成功合成了lgc12。
实施例2:lgc12修饰阿霉素(doxorubicin)的制备方法
①用顺式乌头酸酐(ca)修饰原药r(r=阿霉素dox),以下称为car,通过r和ca之间的开环反应,使用三乙胺作为催化剂合成。将原药r(0.4mmol)和ca(0.44mmol)溶解在完全干燥的烧瓶中的20.0ml无水dmf中,然后加入67.0μl三乙胺。室温下,将混合物置于在黑暗中,并在氮气(n2)气氛下搅拌24小时。接下来,将溶液与200.0ml冷乙酸乙酯混合,先用ph2-3的饱和氯化钠溶液洗涤,然后用ph7.4的饱和溶液洗涤。将得到的有机层用无水硫酸钠干燥12小时。最后,通过过滤分离固体car,并在室温下真空干燥,得到产物。
②将药物car(r=阿霉素(dox))加入反应瓶中,加入二氯甲烷溶解,再加入2-3倍当量的edc和nhs活化2-4小时,并加入1倍当量的n,n’-二-十二烷基-l-谷氨酸二酰胺(lgc12)发生酰胺缩合反应,反应48小时,然后经过洗涤、重结晶,冻干得到lg修饰药物(car-lgc12)。反应步骤如下:
其中所述的r为dox,其结构式如下:
实施例3:lgc12修饰dox的结构表征
1、核磁共振波谱(nmr)
以四甲基硅烷(tms)为内标,对实施例2制备的n,n’-二-十二烷基-谷氨酸二酰胺(lgc12)修饰的药物r进行表征,以氘代氯仿(cdcl3)为溶剂,采用400mhz核磁共振仪器对其1hnmr进行扫描。
dox-lgc12的核磁氢谱如图3所示,dox-lgc12的核磁氢谱中的峰,全都成功归属。
2、基质辅助激光解吸电离飞行时间质谱(maldi-tof-ms)
为了进一步确认实施例2所合成的car-lg(dox-lgc12),通过maldi-tof-ms,基质选择龙胆酸(dhb)测试了其质谱图。
dox-lgc12的maldi-tof-ms质谱图分别如图4所示。图4中1141.6为dox-lgc12+na+。
核磁氢谱和质谱的实验结果证实,成功合成了lgc12修饰药物dox-lgc12。
实施例4:含dox-lgc12的纳米粒的制备及表征
用高分子包载实施例2制备的dox-lgc12,制备纳米粒。选用mpeg-dspe或以线粒体靶向基团三苯基膦(tpp)修饰的mpeg-dspe作为包载分子,dox-lgc12和高分子按质量比为1:1,1:2,1:3,1:4,1:5,1:6,溶于1ml无水dmf中,磁力搅拌并缓慢滴加5ml二次水,半小时后进行透析过夜(截留分子量3500),离心取上清液即得到纳米粒子。通过动态光散射(dls)来观测其粒径及zeta电位的变化。dox-lgc12形成纳米粒子的条件优化结果如图5所示。
根据图5,dox-lgc12:mpeg-dspe的最优比为1:3
根据上述选取的最优条件(lgc12修饰药物和高分子的最优比)制备相应的纳米粒子,检测其粒径分布、进行tem形貌观测。
最优条件下形成的dox-lgc12纳米粒的粒径分布图如图6所示,其中图6a是以mpeg-dspe作为包载分子制备的dox-lgc12纳米粒,图6b是以tpp修饰的mpeg-dspe作为包载分子制备的dox-lgc12-tpp纳米粒;电镜图片如图7所示。上述结果表明,本申请制备的纳米粒结构稳定、大小均匀。
实施例5:含dox-lgc12纳米粒中原药含量、担载率、包裹效率
1、方法
检测实施例4制备的纳米粒中dox的含量。通过紫外可见光谱(uv-vis)测定,测定溶液在480nm(dox)处的紫外吸光度值,然后计算dox含量与紫外吸光度值的线性关系。取纳米药物溶液测定在特征紫外吸收处的紫外吸光度值而计算得到药物dox的含量;
药物r的担载率及包裹效率通过如下公式计算:
担载率(%)=[纳米粒中药物r的含量/总纳米粒的质量]×100
包裹效率(%)=[纳米粒中药物r含量/投入的药物r的质量]×100
2、结果
dox-lgc12纳米粒中阿霉素的质量浓度和紫外吸收关系曲线,如图8所示。计算公式为y=8.959×x+0.03118;r2=0.9996。测定在480nm处的紫外吸光度值而计算得到药物含量为388μm;担载率=7.5%;包裹效率=22.5%
实施例6:含lgc12修饰药物的纳米粒的细胞毒性
检测实施例4制备的含dox-lgc12纳米粒对癌细胞的毒性。
1、方法
选取a549(人肺癌细胞),a549ddp(人肺癌耐铂药细胞),mcf7(人源乳腺癌细胞),4t1(鼠源乳腺癌细胞)用于研究药物的毒性问题。四种细胞均用dmem(gibco)培养基培养。dmem培养基中含有10%胎牛血清及1%青霉素链霉素混合液(100×)。
细胞毒性通过mtt法检测,具体步骤如下:
(1)待a549、a549ddp、mcf7和4t1细胞培养至对数期,用胰酶进行消化并计数。将细胞溶液稀释至5×104cells/ml;
(2)将预稀释的细胞接种到96孔板中,每孔100μl,然后放置培养箱中培养过夜;
(3)将dox、np、np-tpp分别按照一定得倍数稀释,加入到96孔板中,每孔加入10μl,使药物的最终dox浓度依次为100,50,25,12.5,1.25,0.125,0.0125μm。每个浓度设置四个复孔,培养时间为72h;
(4)将预配置好的10%mtt溶液用无酚红培养基稀释10倍加入到不同培养时间的96孔板中,每孔加入100μl,继续置于培养箱中培养4h,之后,每孔加入100μlsds溶液,避光,在恒温培养箱中37℃放置12h;
(5)用酶标仪测定96孔板各孔在570nm处的吸光度od值,选择背景波长为650nm,将三个复孔的od值平均值作为目标样品的od值,并计算细胞存活率:
cellviability=样品od/空白对照组od
2、结果
2.1含阿霉素dox纳米粒的细胞毒性试验
采用mtt法测试nps(dox-lgc12),nps-tpp(dox-lgc12-tpp)及dox的细胞毒性,考察时间为72h,结果如图9所示,ic50值列于表2中。
表2:nps(dox-lgc12)、nps(dox-lgc12)-tpp、dox对四种细胞的ic50(μm)
根据上述三种药物nps(dox-lgc12),nps-tpp(dox-lgc12-tpp),dox对四种细胞系的毒性作用,可知细胞毒性由强到弱依次为nps-tpp(dox-lgc12-tpp)>nps(dox-lgc12)>dox,说明高分子作为载体,可以增强细胞对药物的内吞,且具有线粒体靶向的纳米粒能够提高药物对癌细胞的毒性作用。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!