利用脂肪组织直接制备脱细胞肥大软骨基质的方法与流程
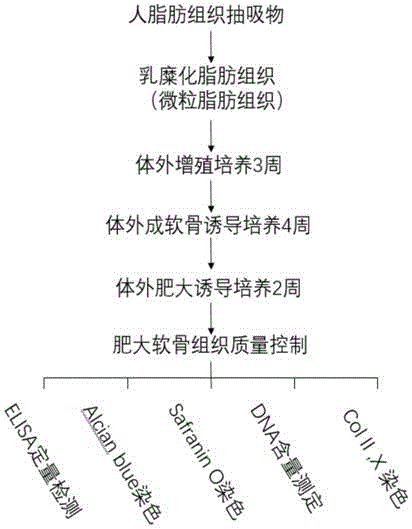
本发明涉及骨组织再生技术领域,特别是指一种利用脂肪组织直接制备脱细胞肥大软骨基质的方法。
背景技术:
目前,基于干细胞的组织工程骨构建方法是将新鲜获取的干细胞,在体外经过多次传代、扩增后,接种于生物材料,再经过一段时间的体内、外培育后,再生出可用于修复骨缺损的骨移植物。但是目前的方法存在以下几个问题:1)干细胞经过长时间体外传代、增殖后,逐渐丧失了多向的分化潜能,包括骨再生能力;2)传统的骨膜内成骨的诱导分化方案骨再生和血管化能力不足;3)单一干细胞构建的骨移植物缺乏成血管能力。脂肪组织在人体内有存量大、获取方便、对身体损伤小等特点,且脂肪组织中包含丰富的间充质干细胞,即脂肪来源干细胞(adipose-derivedstemcell,asc)。asc具有可分化为多种细胞的能力。研究表明,asc在不同的体外诱导条件下可分化成骨细胞和软骨细胞,从而达到治疗骨缺损的目的。
技术实现要素:
本发明提出一种利用脂肪组织直接制备脱细胞肥大软骨基质的方法,解决了现有技术中脱细胞同种异体骨移植材料骨诱导性能低,体内成骨效率低的问题。
本发明的技术方案是这样实现的:
一种利用脂肪组织直接制备脱细胞肥大软骨基质的方法,包括:
(1)微粒脂肪组织的体外增殖培养;
微粒脂肪组织经过体外增殖培养后,形成富含丰富asc并仍具有多向分化潜能的组织块;
(2)肥大软骨组织的体外构建;
取步骤(1)体外增殖培养后的样本,经过体外软骨内成骨诱导培养,直接分化成肥大软骨组织;
其中,所述体外软骨内成骨诱导培养包括成软骨诱导培养和肥大诱导培养两个阶段;先使用成软骨诱导培养基诱导培养,然后使用肥大诱导培养基诱导培养;
(3)将上述肥大软骨组织脱细胞,即得脱细胞肥大软骨基质。
作为优选的技术方案,所述体外增殖培养基为:
α-mem+10%fbs+1%psg+1%hepes+地塞米松(10-7mol/l)+抗坏血酸(10-5mol/l)+fgf-2(2.5-10ng/ml)+pdgf(5-20ng/ml)。
其中α-mem与fbs、psg、hepes为体积比。
作为优选的技术方案,所述成软骨诱导培养基诱导培养3-5周;肥大诱导培养基诱导培养2-3周;所述诱导培养基每周换2-3次。
作为优选的技术方案,所述脂肪组织为人脂肪组织。
作为优选的技术方案,所述步骤(2)中的样本,是经过pbs漂洗的微粒脂肪组织的小团块。
作为优选的技术方案,其中成软骨诱导阶段所用培养基为:sfm+bmp-6(5-20ng/ml)+tgf-β3(5-20ng/ml)+地塞米松(10-7mol/l)+抗坏血酸(10-5mol/l);
肥大诱导阶段所用培养基为:sfm+β-甘油磷酸二钠盐(10-2mol/l)+地塞米松(10-8mol/l)+抗坏血酸(10-5mol/l)。
其中sfm为:dmem培养液+1%hsa+1%psg+1%hepes+(0.5-2)%its+(0.3-1.2)%亚油酸。
作为优选的技术方案,所述肥大软骨组织脱细胞,包括:
(a)冲洗所述肥大软骨组织,移除液体;
(b)之后将冲洗后的肥大软骨组织放入液氮中;从液氮中取出,再放入水浴中;如此反复3-5次;
(c)经过步骤(b)处理后,再使用蒸馏水冲洗,即得。
作为优选的技术方案,所述步骤(a)使用的冲洗液为pbs。
作为优选的技术方案,所述步骤(b)在液氮中的时间每次为8-15分钟;在水浴中的时间每次为8-15分钟。
作为优选的技术方案,所述水浴的温度为35-40℃。
有益效果
(1)本发明制得的脱细胞后的肥大软骨基质免疫原性大大降低,可用于同种异体移植。
(2)本发明利用软骨内成骨诱导方案构建的脱细胞肥大软骨基质在体内有强大的骨再生能力,骨再生效率优于骨膜内成骨诱导方案构建的骨移植物。
(3)脂肪组织中的干细胞巢在脂肪组织ecm的保护下,可诱导细胞具备更高的分化潜能。
(4)本发明将获取的微粒脂肪组织直接种植于培养基上进行培养,而非采用传统的经过传代培养的svf细胞,此方法保留了细胞间的ecm,为asc的分化提供了有利的“干细胞巢”,保留了干细胞多向分化与成血管潜能。
(5)本发明的微粒脂肪组织经历3周的外增殖培养后,仍具有与新鲜制备的asc类似的细胞表型和多向分化潜能,在体外成软骨诱导条件下可成功分化成肥大软骨组织。
附图说明
为了更清楚地说明本发明实施方案或现有技术中的技术方案,下面将对实施方案或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施方案,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为验证实施例1的流程图。
图2为验证实施例1得到的肥大软骨组织图。
图3为对照实施1例得到的肥大软骨组织图。
图4为验证实施例1利用脂肪组织构建的软骨组织和肥大软骨组织分别表达ii型胶原和x型胶原的扫描图。
图5验证实施例1nanofat与对照实实施例svf/ultrafoam构建的肥大软骨的在细胞培养基中gag释放量,**p<0.01。
图6验证实施例1nanofat与对照实实施例svf/ultrafoam构建的肥大软骨的组织样本中gag总量,**p<0.01。
图7验证实施例1nanofat与对照实实施例svf/ultrafoam构建的肥大软骨组织在裸鼠皮下异位植入8周后,骨和骨髓再生的扫描图。
其中:nanofat:微粒脂肪组织;svf:脂肪组织来源间质血管组份;ultrafoam:胶原海绵支架材料。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
一种利用脂肪组织直接制备脱细胞肥大软骨基质的方法,包括以下几个步骤:
(1)微粒脂肪组织的制备;
关于微粒脂肪组织的制备属于本领域成熟的技术,本实施例中的步骤如下:
(a)从抽脂手术获取的人脂肪组织,经过生理盐水多次漂洗后,收集上层脂肪组织;
(b)将上述上层脂肪组织用剪刀剪碎,1000-2000g离心3-5min,去除上层油脂和下层肿胀液部分,收集中间脂肪层于20ml注射器内;
(c)使用一个三通管将两个20ml注射器连接起来,来回推注两个注射器30次,获取微粒脂肪组织;
(d)微粒脂肪组织经1000-2000g离心3-5min,去除上层的油脂层,下层为微粒脂肪组织混合物。
(2)微粒脂肪组织的体外增殖培养;
(a)使用1%琼脂糖凝胶包被6孔板,将上述制备的微粒脂肪组织接种于6孔板,每孔1.5ml;
(b)每孔加增殖培养基3-5ml,置于co2细胞培养箱中培养2-4周,每周换液2-3次;本实施例中培养了3周。
其中,增殖培养基为:α-mem+10%fbs+1%psg+1%hepes+fgf-2(5ng/ml)+pdgf(10ng/ml)+地塞米松(10-7mol/l)+抗坏血酸(10-5mol/l)。
(c)微粒脂肪组织经过体外增殖培养后,微粒脂肪组织内干细胞大量增殖,松散的微粒脂肪组织组织逐渐聚集,形成一块富含丰富asc并仍具有多向分化潜能的组织块。
(3)肥大软骨组织的体外构建;
(a)步骤(2)的体外增殖培养结束后,以pbs漂洗微粒脂肪组织2次,使用直径4mm的活检钻孔器在经过增殖培养的微粒脂肪组织上钻取直径4mm的小团块样本,用于下一步实验;
(b)获取的微粒脂肪组织团块小样本转移至12孔板内,每孔1颗,先加入成软骨诱导培养基2ml,成软骨诱导培养4周;然后加入肥大诱导培养基,肥大诱导培养2周。每周换液2-3次。
本实施例中的培养基为:
成软骨阶段的培养基包括:
sfm+地塞米松(10-7mol/l)+抗坏血酸(10-5mol/l)+bmp-6(10ng/ml)+tgf-β3(10ng/ml);
肥大诱导阶段的培养基包括:
sfm+β-甘油磷酸二钠盐(10-2mol/l)+地塞米松(10-8mol/l)+抗坏血酸(10-5mol/l)。
其中无血清基础培养基(sfm):dmem培养液+1%hsa+1%psg+1%hepes+1%its+0.56%亚油酸。
(4)将上述肥大软骨组织脱细胞;
(a)将肥大软骨组织放入15ml离心管中,pbs冲洗两次,移除所有液体;
(b)离心管放入液氮罐中10min;
(c)将离心管拿出,放置于37℃水浴中10min,步骤(2)和步骤(3)交替重复3次;
(d)用ddh2o在此冲洗组织。
上述步骤(b)在液氮中的时间每次可以在8-15分钟内选择;在水浴中的时间每次可以在8-15分钟内选择。上述水浴的温度可在35-40℃内选择。
(5)肥大软骨基质的的质量控制
(a)肥大软骨基质经4%多聚甲醛固,石蜡包埋、切片;
(b)safranino染色,检测肥大软骨组织内gag的含量;
(c)he染色和活死细胞染色,检测脱细胞的程度。
实施例2
本实施列中使用的培养基组成如下:
无血清基础培养基(sfm):
dmem培养液+1%hsa+1%psg+1%hepes+2%its+1.2%亚油酸;
肥大诱导培养基:
sfm+β-甘油磷酸二钠盐(10-2mol/l)+地塞米松(10-8mol/l)+抗坏血酸(10-5mol/l)。
成软骨诱导培养基:sfm+地塞米松(10-7mol/l)+抗坏血酸(10-5mol/l)+bmp-6(20ng/ml)+tgf-β3(5ng/ml);
将上述培养基应用于实施例1中的方法中,同样满足要求。
实施例3
本实施列中使用的培养基组成如下:
成软骨诱导培养基:
sfm+bmp-6(5ng/ml)+tgf-β3(20ng/ml)+地塞米松(10-7mol/l)+抗坏血酸(10-5mol/l);
肥大诱导培养基:
sfm+β-甘油磷酸二钠盐(10-2mol/l)+地塞米松(10-8mol/l)+抗坏血酸(10-5mol/l)。
无血清基础培养基(sfm):
dmem培养液+1%hsa+1%psg+1%hepes+0.5%its+0.3%亚油酸;
将上述培养基应用于实施例1中的方法中,同样满足要求。
我们研究发现,脂肪组织中的asc在细胞外基质(extracellularmatrix,ecm)的保护下,可以以干细胞巢(stemcellniche)的形式存在,在其保护中的asc可以通过软骨内成骨的方式,直接诱导分化成肥大软骨组织。且此肥大软骨组织即使在裸大鼠的皮下亦可异位成骨,再生出富含骨髓的骨组织。ecm可以为干细胞提供三维生存空间,调节各类生物信号分子进入干细胞巢,对干细胞的生物功能和分化命运起到了重要的调节作用。ecm是细胞分泌的分布于细胞外空间的大分子物质,是干细胞巢(stemcellniche)的重要组成部分。而脱细胞的ecm既具有上述优点且可用于异体移植而避免免疫排斥反应。为提高骨缺损修复效率、简化骨组织再生程序,我们研发了利用脂肪组织直接制备脱细胞肥大软骨基质的方法。
下面通过实验证明:脂肪组织中的asc在细胞外基质(extracellularmatrix,ecm)的保护下,可以以干细胞巢(stemcellniche)的形式存在,在其保护中的asc可以通过软骨内成骨的方式,直接诱导分化成肥大软骨组织。
验证实施例1
实验步骤:见图1。
(1)微粒脂肪组织的制备;
(a)从抽脂手术获取的人脂肪组织,经过生理盐水多次漂洗后,收集上层脂肪组织;
(b)将上述上层脂肪组织用剪刀剪碎,1000-2000g离心3-5min,去除上层油脂和下层肿胀液部分,收集中间脂肪层于20ml注射器内;
(c)使用一个三通管将两个20ml注射器连接起来,来回推注两个注射器20-40次,获取微粒脂肪组织;
(d)微粒脂肪组织经1000-2000g离心3-5min,去除上层的油脂层,下层为微粒脂肪组织混合物。
(2)微粒脂肪组织的体外增殖培养;
(a)使用1%琼脂糖凝胶包被6孔板,将上述制备的微粒脂肪组织接种于6孔板,每孔1.5ml;
(b)每孔加增殖培养基3-5ml,置于co2细胞培养箱中培养2-4周,每周换液2-3次;本实施例中培养了3周。
其中,增殖培养基为:α-mem+10%fbs+1%psg+1%hepes+地塞米松(10-7mol/l)+抗坏血酸(10-5mol/l)+fgf-2(5ng/ml)+pdgf(10ng/ml)。
(c)微粒脂肪组织经过体外增殖培养后,微粒脂肪组织内干细胞大量增殖,松散的微粒脂肪组织组织逐渐聚集,形成一块富含丰富asc并仍具有多向分化潜能的组织块。
(3)肥大软骨组织的体外构建;
(a)步骤(2)的体外增殖培养结束后,以pbs漂洗微粒脂肪组织2次,使用直径4mm的活检钻孔器在经过增殖培养的微粒脂肪组织上钻取直径4mm的小团块样本,用于下一步实验;
(b)获取的微粒脂肪组织团块小样本转移至12孔板内,每孔1颗,先加入成软骨诱导培养基2ml,成软骨诱导培养4周;然后加入肥大诱导培养基,肥大诱导培养2周。每周换液2-3次。
本实施例中的培养基可以如下:
成软骨阶段的培养基包括;
sfm+地塞米松(10-7mol/l)+抗坏血酸(10-5mol/l)+bmp-6(10ng/ml)+tgf-β3(10ng/ml);
肥大诱导阶段的培养基包括:
sfm+β-甘油磷酸二钠盐(10-2mol/l)+地塞米松(10-8mol/l)+抗坏血酸(10-5mol/l);
sfm:dmem培养液+1%hsa+1%psg+1%hepes+1%its+0.56%亚油酸。
(4)肥大软骨组织的质量控制;
(a)肥大诱导培养结束后,经4%多聚甲醛固,石蜡包埋、切片;
(b)safranino染色,检测成软骨诱导阶段和肥大诱导阶段的样本的软骨基质内gag的表达(见图2:利用微粒脂肪组织,经过3周的扩增培养、4周的成软骨诱导培养(chondrogenicinduction)和2周的肥大诱导培养(hypertrophicinduction)后,形成的肥大软骨组织);
(c)使用elisa法,检测成软骨诱导和肥大诱导培养结束前最后一次的培养基内和肥大软骨组织标本内gag的含量(分别见图5,6);
图5:通过elisa方法分别检测微粒脂肪组织和对照组(svf+ultrafoam)成软骨诱导及成软骨诱导后再经肥大诱导的标本内gag含量。可见四周成软骨诱导培养后微粒脂肪组织组所检测出的gag含量较对照组(svf+ultrafoam)明显增多;两周的肥大诱导后微粒脂肪组织组的gag含量较对照组仍明显增多。
图6:通过elisa方法分别检测微粒脂肪组织组和对照组(svf+ultrafoam)成软骨诱导及成软骨诱导后再经肥大诱导的标本内gag/dna含量。可见四周成软骨诱导培养后微粒脂肪组织组所检测出的gag/dna含量较对照组(svf+ultrafoam)明显增多;两周的肥大诱导后微粒脂肪组织组的gag/dna含量较对照组仍明显增多。
(d)使用免疫组织化学方法,分别检测软骨诱导阶段和肥大诱导阶段的样本内软骨基质特异蛋白ii型胶原和肥大软骨基质内特异蛋白x型胶原,评估成软骨分化水平和软骨基质肥大诱导水平(见图4)。
图4:通过免疫组织化学方法,分别检测软骨诱导阶段和肥大诱导阶段的样本内软骨基质特异蛋白ii型胶原和肥大软骨基质内特异蛋白x型胶原。可见软骨诱导阶段ii型胶原表达强阳性,x型胶原弱阳性,证明已成功诱导至软骨阶段;肥大软骨诱导阶段,ii型胶原阳性,x型胶原阳性,证明成功诱导为肥大软骨。
(e)所构建的肥大软骨组织,异位植入裸鼠皮下,8周后取出,safranino或者he染色,观察标本内骨和骨髓再生水平(见图7)。
图7:将植入裸鼠皮下的肥大软骨组织8周后取出,进行microct扫描及safranino和masson染色。microct可见微粒脂肪组织组骨形成量明显多于对照组(svf+ultrafoam),且微粒脂肪组织组骨重建明显,外层均质光滑,内部可见骨小梁结构;safranino染色可见微粒脂肪组织组骨髓生成量及骨形成量与对照组(svf+ultrafoam)比明显增多;masson染色也证实微粒脂肪组织组骨形成量较对照组(svf+ultrafoam)明显增多。
对照实施例1
本实施例采用利用svf细胞和ultrafoam材料(i型胶原海绵)构建的肥大软骨组织作为对照,除svf/ultrafoam复合载体的构建存在技术差异外,复合载体的体外软骨内骨化诱导方案、时长,检测手段均与利用脂肪组织构建肥大软骨组织的方案一致。
svf/ultrafoam复合载体的构建:
(1)新鲜获取的脂肪组织,经生理盐水漂洗后,1000-2000g离心3-5min,去除上层油脂和下层液体,获取中间脂肪层,用于胶原酶消化获取svf细胞;
(2)脂肪组织与1.5%浓度额的ii型胶原酶等比例混合,置于37℃恒温摇床中消化1小时。1小时后获取的乳糜化脂肪组织经1000-2000g离心3-5min,去除上层未消化的脂肪组织和油脂层,下层的残存组织和细胞的混合物经40um的细胞滤网形成单细胞悬液。单细胞悬液经1000-2000g离心3-5min,去除液体部分,细胞部分重悬于红细胞裂解液,裂解细胞悬液中的红细胞。最终所获取的细胞为svf。
(3)计数1×106个svf细胞,接种于直径4mm、厚2mm的i型(ultrafoam),采用相同的软骨内成骨诱导培养方案,作为微粒脂肪组织小组织团块的对照组。得到的肥大软骨组织参见图3。
对照结果参见图5、图6和图7。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!