中脑星形胶质细胞来源神经营养因子的药用用途的制作方法
本发明涉及生物医药领域中的中脑星形胶质细胞来源神经营养因子的药用用途。
背景技术:
急性肺损伤(acutelunginjury,ali)是过度激活的炎症反应导致的肺泡实质急性弥漫性损伤,是多种炎症介质及效应细胞共同参与的呈现级联放大炎性反应的结果。ali是临床上常见的呼吸系统急、危重症,发病机制错综复杂,致病因素较多,其病死率一直居高不下。多种肺内外因素,包括感染、创伤、休克等,均可导致ali。其中,革兰阴性细菌感染是临床上引起ali最主要的原因。炎性反应是机体应对感染、创伤等各种组织损伤时产生的生理性反应,而过度的、失控的炎性反应可导致ali的发生。因此,抑制过度的炎症反应是缓解急性肺损伤的关键。
中脑星形胶质细胞来源神经营养因子(mesencephalicastrocyte-derivedneurotrophicfactor,manf),在早期又被称为armet,是一个可被内质网应激所诱导的,分子量约为20kd的分泌性蛋白。manf基因是沈玉先等通过微阵列技术从30000个基因中筛选出来的对内质网应激最敏感的基因。该基因最初发现时被认为与肿瘤的发生有关,但后来的研究发现,manf基因的这种突变属于正常基因的多态性,而非肿瘤所特有。研究发现manf蛋白广泛存在于哺乳动物组织内,正常情况下组织细胞内manf含量很低,当细胞遭受应激刺激时,细胞内manf表达显著升高。
技术实现要素:
本发明所要解决的一个技术问题是如何治疗和/或预防和/或缓解和/或改善急性肺损伤。
为了解决以上技术问题,本发明提供了manf在制备治疗和/或预防和/或缓解和/或改善急性肺损伤的产品(如药物、疫苗、保健品和/或食品)中的应用。
上述应用中,所述manf可为人manf。所述人manf可为重组人manf。
上述应用中,所述重组人manf可为r1)、r2)或r3)的蛋白质:
r1)氨基酸序列是seqidno.2的蛋白质,
r2)氨基酸序列是seqidno.2的第3-160位的蛋白质,
r3)将r1)或r2)所示的蛋白质经过一个以上氨基酸残基的取代和/或缺失和/或添加得到的与r1)或r2)所示的蛋白质具有90%以上的同一性且具有缓解急性肺损伤活性的蛋白质。
上述应用中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gapexistencecost,perresiduegapcost和lambdaratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
上述应用中,所述90%以上的同一性可为至少91%、92%、95%、96%、98%、99%或100%的同一性。
上述应用中,seqidno.2由168个氨基酸残基组成,seqidno.2的第3-160位为人manf片段。
上述应用中,所述治疗和/或预防和/或缓解和/或改善急性肺损伤的产品可含有所述manf。
为了解决以上技术问题,本发明提供了与manf相关的生物材料在制备治疗和/或预防和/或缓解和/或改善急性肺损伤的产品(如药物、疫苗、保健品和/或食品)中的应用;所述生物材料可为下述任一种:
b1)编码所述manf的核酸分子,
b2)含有b1)所述核酸分子的表达盒,
b3)含有b1)所述核酸分子的重组载体、或含有b2)所述表达盒的重组载体,
b4)含有b1)所述核酸分子的重组微生物、或含有b2)所述表达盒的重组微生物、或含有b3)所述重组载体的重组微生物,
b5)含有b1)所述核酸分子的转基因动物细胞系、含有b2)所述表达盒的转基因动物细胞系或含有b3)所述重组载体的转基因动物细胞系,
b6)含有b1)所述核酸分子的转基因植物细胞系、含有b2)所述表达盒的转基因植物细胞系或含有b3)所述重组载体的转基因植物细胞系。
上述应用中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
上述应用中,b2)所述的表达盒,是指能够在宿主细胞中表达所述manf的dna,该dna不但可包括启动所述manf基因转录的启动子,还可包括终止所述manf基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。
上述应用中,所述微生物可为细菌、酵母、藻或真菌。
上述应用中,所述细菌可为大肠杆菌,如bl21(de3)。
上述应用中,b1)所述核酸分子可为b11)或b12):
b11)编码序列为seqidno.1所示的dna分子。
b12)核苷酸序列是seqidno.1第9-482位所示的dna分子。
其中,seqidno.1由509个核苷酸组成,其编码序列是seqidno.1的第3-509位核苷酸,编码seqidno.2所示的蛋白质。
上述应用中,所述治疗和/或预防和/或缓解和/或改善急性肺损伤的产品可含有所述生物材料。
为了解决以上技术问题,本发明提供了治疗和/或预防和/或缓解和/或改善急性肺损伤的药物。
本发明所提供的治疗和/或预防和/或缓解和/或改善急性肺损伤的药物由所述manf和药用辅料组成。
上述药物中,所述药用辅料可为水、乙醇、聚乙二醇、1,3-丙二醇、乙氧基化的异硬脂醇、多氧化的异硬脂醇、聚氧乙烯山梨醇脂肪酸酯、氯化钠、葡萄糖或甘油、助溶剂、缓冲剂或ph调节剂。
上述药物中,所述药物的剂型可为注射给药剂型、呼吸道给药剂型、粘膜给药剂型、皮肤给药剂型、粘膜给药剂型或腔道给药剂型。
上述药物中,所述注射给药剂型可包括静脉注射注射剂、肌内注射注射剂、皮下注射注射剂、皮内注射注射剂或腔内注射注射剂。所述呼吸道给药剂型可包括喷雾剂、气雾剂或粉雾剂等。所述皮肤给药剂型可包括外用溶液剂、洗剂、搽剂、软膏剂、硬膏剂、糊剂或贴剂等。所述粘膜给药剂型可包括滴眼剂、滴鼻剂、眼用软膏剂、含漱剂、舌下片剂、粘贴片或贴膜剂等。所述腔道给药剂型可包括栓剂、气雾剂、泡腾片、滴剂或滴丸剂等。
为了解决以上技术问题,本发明提供了治疗和/或预防和/或缓解和/或改善急性肺损伤的方法。
本发明所提供的治疗和/或预防和/或缓解和/或改善急性肺损伤的方法,包括给受体动物施用所述manf或/和所述生物材料,进行治疗和/或预防和/或缓解和/或改善急性肺损伤。
上文中,所述治疗和/或预防和/或缓解和/或改善急性肺损伤可体现为缓解肺水肿,降低肺组织炎性渗出,降低肺组织炎症细胞浸润和/或改善肺泡间隔断裂。
上文中,所述动物可为哺乳动物,如小鼠。
上述重组人manf或与所述重组人manf相关的生物材料也属于本发明的保护范围。
本发明研究发现manf在人肺炎患者肺泡灌洗液中的含量增加,manf在急性肺损伤小鼠和过敏性气道炎症小鼠的肺组织中表达上调,说明manf在炎症性肺组织中的表达增加。本发明通过动物实验证明,manf能缓解急性肺损伤导致的肺水肿,降低急性肺损伤导致的肺组织炎性渗出,降低急性肺损伤导致的肺组织炎症细胞浸润和/或改善急性肺损伤导致的肺泡间隔断裂。manf可用于治疗和/或预防和/或缓解和/或改善急性肺损伤。
附图说明
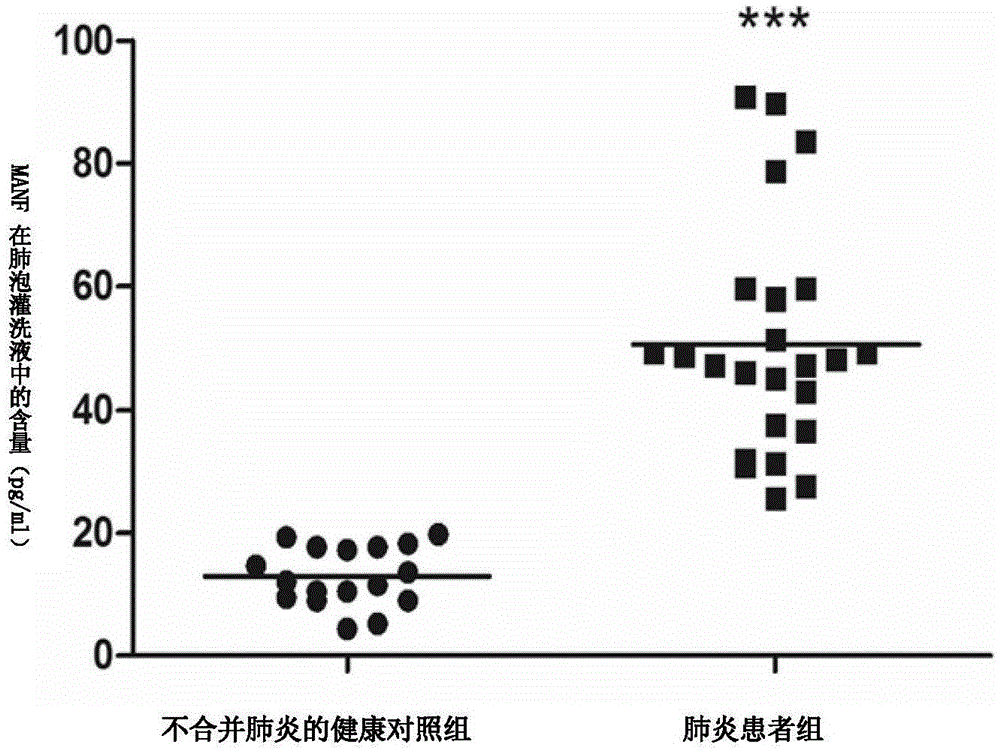
图1为manf在人肺炎患者肺泡灌洗液中的含量增加。
图中,“***”表示与不合并肺炎的健康对照组比较,具有统计学差异,p<0.001。
图2为manf在lps诱导的ali小鼠肺组织中的表达上调。
图中,a为免疫组化方法检测manf在小鼠肺组织中的表达;b为qpcr方法检测manf在小鼠肺组织中的表达;c为免疫印迹法检测manf在小鼠肺组织中的表达;d为c中结果的定量分析;“*”表示与对照组比较具有统计学差异,p<0.05;**”表示与对照组比较具有统计学差异,p<0.01;对照组为下述lps诱导ali小鼠的造模方法中的对照组,急性肺损伤组为下述lps诱导ali小鼠的造模方法中的模型组。
图3为manf在ova诱导的过敏性气道炎症小鼠肺组织中的表达上调。
图中,a为免疫组化方法检测manf在小鼠肺组织中的表达;b为免疫印迹法检测manf在小鼠肺组织中的表达;c为b中结果的定量分析(manf表达量/gapdh表达量)。“**”表示与正常小鼠比较具有统计学差异,p<0.01;正常小鼠为下述ova诱导的过敏性气道炎症小鼠的造模方法中的对照组小鼠,过敏性气道炎症小鼠为下述ova诱导的过敏性气道炎症小鼠的造模方法中的模型组。
图4为manf降低lps诱导ali小鼠肺组织湿干比。图中“*”代表p<0.05,“**”表示p<0.01,“***”表示p<0.001,以上均表示有统计学差异。
图5为manf剂量依赖性的降低lps诱导的ali小鼠肺泡灌洗液中炎性细胞数量。图中是每只小鼠的肺泡灌洗液中炎性细胞的总数量,图中,(a)、(b)和(c)的纵坐标单位均为“×105个/只”。
图中,a为肺泡灌洗液中炎性细胞总数;b为肺泡灌洗液中性粒细胞数量;c为肺泡灌洗液中巨噬细胞数量;两组相比,“*”代表p<0.05,“**”表示p<0.01,“***”表示p<0.001,以上均表示有统计学差异。
图6为manf降低lps诱导ali小鼠肺泡灌洗液中的总蛋白含量。图中,两组相比,“**”表示p<0.01,“***”表示p<0.001,以上均表示有统计学差异。
图7为manf改善ali小鼠肺组织损伤。
图8.manf降低lps诱导肺组织损失病理学评分。
图中,两组相比,“**”表示p<0.01,“***”表示p<0.001,以上均表示有统计学差异。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、人manf治疗急性肺损伤
现有的研究表明,给予外源性的重组人manf能够抑制兔的免疫性关节炎。但是,manf在ali中的作用未见报道。本发明人的实验室一直从事manf的功能研究,现将重组人manf对ali的影响总结如下。
1.manf在炎症性肺组织中的表达增加
1.1manf在人肺炎患者肺泡灌洗液中的含量增加
收集来自人肺部炎症患者及非肺部炎症患者(即不合并肺炎的健康人)的肺泡灌洗液,elisa方法检测发现,manf在肺炎患者(26例)肺泡灌洗液中的含量较非肺部炎症患者(19例)肺泡灌洗液中的含量明显升高(图1)。
其中,elisa检测manf的试剂盒购于武汉优尔生(货号:sec300hu),严格按照商家给出的操作步骤进行检测。
1.2manf在急性肺损伤小鼠和过敏性气道炎症小鼠的肺组织中表达上调
通过qpcr、免疫印迹和免疫组织化学方法对正常小鼠(对照组小鼠)、过敏性气道炎症小鼠(模型组小鼠)及急性肺损伤小鼠(模型组小鼠)肺组织中的manf表达和蛋白含量进行检测,发现manf在正常小鼠的肺组织中有表达,且在上述两种肺部炎症小鼠肺组织中的mrna和蛋白含量均较正常小鼠明显增加(图2、3)。
其中,急性肺损伤小鼠(ali小鼠)均为脂多糖(lps)诱导的急性肺损伤小鼠模型,lps诱导ali小鼠的造模方法如下:6-8周龄spf级balb/c小鼠,每只体重20-23g,小鼠禁食8小时,随机分为两组:模型组和对照组。模型组每只小鼠气管内滴注lps10微克(用生理盐水稀释至50微升),对照组每只小鼠气管内滴入生理盐水50微升。通过测定肺组织湿干重比值(w/d)、肺部炎症细胞浸润、炎症因子水平和he染色观察肺组织病理学变化,以此来证明急性肺损伤小鼠模型是否建立成功。结果表明脂多糖刺激显著提高了小鼠肺组织的湿干比,说明脂多糖导致了肺水肿;脂多糖刺激显著提高了小鼠肺泡灌洗液中炎症细胞总数、中性粒细胞和巨噬细胞的数量,说明脂多糖显著促进了小鼠肺组织炎症细胞浸润;脂多糖刺激显著提高了小鼠肺泡灌洗液中总蛋白含量,说明脂多糖导致了肺组织炎性渗出。肺组织进行he染色的结果表明脂多糖刺激导致了小鼠的肺组织炎症细胞浸润、肺水肿、肺泡间隔断裂等,同时显著提高了小鼠的肺组织损伤病理学评分。这些结果表明,利用脂多糖成功建立了急性肺损伤小鼠模型。
过敏性气道炎症小鼠均为ova诱导的过敏性气道炎症小鼠模型,ova诱导的过敏性气道炎症小鼠的造模方法如下:6-8周龄spf级balb/c小鼠,每只体重20-23g,随机分为两组:模型组和对照组。在造模开始第1天,模型组小鼠每只腹腔注射含1毫克kalso4和10微克ova的生理盐水溶液0.5毫升(溶质是kalso4和ova,溶剂是生理盐水),对照组小鼠每只腹腔注射含1毫克kalso4的生理盐水溶液0.5毫升(溶质是kalso4,溶剂是生理盐水)。造模第14天开始进行超声雾化激发,每天一次,连续7天。模型组雾化溶液为0.1%ova生理盐水溶液300毫升(溶质是ova,溶剂是生理盐水);对照组雾化溶液为生理盐水300毫升。最后一次激发后24小时取材。按照如下文献的方法检测造模成功(shen,qi-ying,fang,lei,etal.repeatedinhalationofsevofluraneinhibitsairwayinflammationinanova-inducedmousemodelofallergicairwayinflammation.,respirology,2015.2,20(2):258-263)。
其中,免疫组化方法检测manf在小鼠肺组织中的表达方法如下:组织切片,福尔马林固定,石蜡包埋,然后分别与抗manf抗体(抗manf抗体即为armet的单克隆抗体,按照如下文献的方法制备:王法财、王海萍、李琪、方圣云、沈玉先.armet的原核表达及其单克隆抗体的制备.安徽医科大学学报,2009,44(6):665-669)在4℃过夜。使用中杉金桥abc试剂盒(sp-9000)可视化免疫反应性。在每个实验中均设阴性对照,通过省略第一抗体获得阴性对照。
免疫印迹法(western-blotassay)检测manf在小鼠肺组织中的表达方法如下:
1)蛋白样品的制备步骤:
①取20毫克肺组织,尽量剪碎,放入ep管中,用研磨棒充分研磨(或使用组织匀浆器打碎)。
②按1:25的比例,加入相应量的ripa(强)裂解液,充分混匀。
③按24:1的比例,加入相应量的蛋白酶抑制剂(根据实验情况加入磷酸酶抑制剂)。
④按ripa及磷酸酶抑制剂体积之和的1/4,加入5×缓冲液。
⑤将ep管口用封口膜封紧,沸水浴煮10分钟,2000转×3分钟,缓慢吸取上清,分装为2管备用。
2)蛋白样品电泳前的处理:
在蛋白裂解液中加入1/4体积的4×sds-page蛋白上样缓冲液,100℃煮沸5~10min,冷却至室温后上样。
3)制备12%sds-page凝胶,加样、电泳、转膜、孵一抗和二抗、曝光成像。其中,一抗为兔抗manf的多克隆抗体(美国abcam公司,ab23621),二抗为鼠二抗(proteinten公司产品)。以抗gapdh抗体(abcam公司产品)作为上样量的对照。
qpcr方法检测manf在小鼠肺组织中的表达中,根据takarasybr反应酶的说明书配制pcr体系,采用实时定量pcr仪检测反应体系。manf引物序列(f):
5’-tcacattytcaccagccact-3’;manf引物序列(r):
5’-atctggctgtcyttcttcttma-3’。
2.重组人manf治疗lps诱导的小鼠急性肺损伤
为了探索manf在炎症性肺组织中是否具有抗炎和器官细胞保护作用,以lps诱导的小鼠ali模型为研究对象,lps给予后2小时观察气管内滴注重组人manf蛋白对ali的影响。结果表明,气管内给予外源性重组人manf蛋白可以抑制lps诱导的小鼠肺损伤相关的多项指标。说明manf可用于治疗急性肺损伤。具体如下:
2.1人重组manf蛋白的诱导表达与纯化
(1)用seqidno.1的第1-488位所示的人manf基因替换pet-28a(+)的ncoi和xhoi识别位点间的片段(包括ncoi识别位点和xhoi识别位点在内的小片段),保持pet-28a(+)其他序列不变,得到重组表达载体,将其命名为pet28a-manf。pet28a-manf含有seqidno.1所示的人重组manf蛋白—his标签融合蛋白hmanf-his编码基因,hmanf-his编码基因编码的蛋白质hmanf-his的氨基酸序列如seqidno.2所示。
(2)将pet28a-manf质粒转化至bl21感受态细胞,利用卡那霉素抗性筛选阳性克隆筛选培养,挑取单克隆,提取质粒进行测序,将测序结果表明含有pet28a-manf的重组大肠杆菌命名为bl21/pet28a-manf。
(3)挑取bl21/pet28a-manf菌株,接种于含100μg/ml卡那霉素的lb培养基(在lb培养基中加入卡那霉素至卡那霉素的浓度为100μg/ml得到的培养基)中,37℃恒温摇床培养,250rpm,过夜(13-16小时)。第二天上午以1:100的比例,将培养过夜的菌液再次接种于含100μg/ml卡那霉素的lb培养基中,置恒温摇床37℃振荡250rpm,扩大培养2-3h左右。待菌液od600为0.6-0.8时,加入iptg至终浓度为0.5mmol/l诱导表达2.5h左右。将菌液4℃离心,7000rpm,5min,弃上清,收集菌体,并加裂解液裂解,超声破碎(400w,间歇3s,超声3s)20min。
(4)将超声后的菌液离心,4℃,12000rpm,取上清,加入到已预装好的ni-beads柱中,封闭柱口,固定于静音混合器上,4℃下结合2h左右。取下蛋白层析柱,于4℃冰箱垂直悬挂,打开盖让柱中液体垂直流出,控制滴速在每30sec一滴,接取蛋白流出液,保存用于后续蛋白分析。
(5)向柱中加入4-5ml去杂质缓冲液(溶质为:50mmol/lnah2po4,300mmol/lnacl、50mmol/l咪唑,溶剂为水,ph8.0),封闭柱口,重新固定于静音混合器,混合1h左右之后让液体流出,并收集流出液。该步骤重复两次以便洗去柱中与ni-beads非特异结合的蛋白。
(6)向层析柱内添加洗脱缓冲液(溶质为:50mmol/lnah2po4、300mmol/lnacl、250mmol/l咪唑,溶剂为水,ph8.0)1ml洗脱目的蛋白。该步骤重复两次,并收集含目的蛋白的洗脱液(约3ml)。
(7)将纯化后的蛋白洗脱液转移至超滤管中浓缩,超滤管中事先添加预冷的ph值为7.4的pbs7ml左右,离心(4℃,7500g,20min),重复3-4次,将其中的咪唑缓冲液置换成ph值为7.4的pbs缓冲液,得到浓缩后的重组人manf蛋白溶液。
其中,ph值为7.4的pbs缓冲液的配制:8.5gnacl、0.2gkcl、2.9gna2hpo4·12h2o、0.59gnah2po4·2h2o,1l去离子水。
(8)浓缩后的重组人manf蛋白溶液,分装保存在-80℃冰箱,备用。该浓缩后的重组人manf蛋白溶液中重组人manf蛋白的含量为1mg/ml。
2.2重组人manf治疗lps诱导的小鼠急性肺损伤
将2.1的浓缩后的重组人manf蛋白溶液用ph值为7.4的pbs缓冲液稀释,得到重组人manf蛋白滴注液。
将50只10周龄体重为20-22g/只的健康雄性c57bl/6小鼠,禁食8小时,随机分成2组,一组10只,作为正常对照组(control);另一组40只,作为模型组。模型组每只小鼠气管内滴注lps10微克(用生理盐水稀释至50微升),得到40只急性肺损伤小鼠,正常对照组每只小鼠气管内滴入生理盐水50微升。
将该40只急性肺损伤小鼠随机分成4组,每组10只:急性肺损伤小鼠组(lps)、低剂量治疗组(lps/manf(5μg))、中剂量治疗组(lps/manf(10μg))和高剂量治疗组(lps/manf(20μg))。
正常对照组、急性肺损伤小鼠组、低剂量治疗组、中剂量治疗组和高剂量治疗组除了气管内滴注的液体不同外,其它操作均相同。lps给予后2小时,正常对照组的每只小鼠气管内一次性滴注50μlph值为7.4的pbs缓冲液;急性肺损伤小鼠组的每只小鼠气管内一次性滴注50μlph值为7.4的pbs缓冲液;低剂量治疗组的每只小鼠气管内一次性滴注50μl重组人manf蛋白滴注液,使每只小鼠的给药剂量以重组人manf蛋白计为5μg;中剂量治疗组的每只小鼠气管内一次性滴注50μl重组人manf蛋白滴注液,使每只小鼠的给药剂量以重组人manf蛋白计为10μg;高剂量治疗组的每只小鼠气管内一次性滴注50μl重组人manf蛋白滴注液,使每只小鼠的给药剂量以重组人manf蛋白计为20μg。给药24小时后处死小鼠,分别按照下述方法测定小鼠肺组织的湿干比、收集肺泡灌洗液测定肺泡灌洗液中炎性细胞数量和总蛋白含量、取出肺组织进行固定进行he染色,并对肺组织进行评分。
通过测定肺组织湿干重比值(w/d)、肺部炎症细胞浸润、炎症因子水平和he染色观察肺组织病理学变化,以此证明急性肺损伤小鼠模型是否建立成功。结果如图4-8所示,脂多糖刺激显著提高了小鼠肺组织的湿干比,说明脂多糖导致了肺水肿(参见图4中的control和lps);脂多糖刺激显著提高了小鼠肺泡灌洗液中炎症细胞总数、中性粒细胞和巨噬细胞的数量,说明脂多糖显著促进了小鼠肺组织炎症细胞浸润(参见图5中的control和lps);脂多糖刺激显著提高了小鼠肺泡灌洗液中总蛋白含量,脂多糖导致了肺组织炎性渗出(参见图6中的control和lps)。肺组织进行he染色的结果表明脂多糖刺激导致了小鼠的肺组织炎症细胞浸润、肺水肿、肺泡间隔断裂等(参见图7中的control和lps),同时显著提高了小鼠的肺组织损伤病理学评分(参见图8中的control和lps)。这些结果表明,利用脂多糖成功建立了急性肺损伤小鼠模型。图4-8中的lps表示急性肺损伤小鼠(ali小鼠),control表示对正常照组小鼠。
2.2.1重组人manf降低ali小鼠肺组织湿干比,缓解肺水肿
肺组织的湿干比是反映肺组织是否水肿的常用指标。按照如下方法测定小鼠肺组织的湿干比:小鼠肺泡灌洗取材结束后,将小鼠肺组织一叶完整取出,滤纸吸干表面水分,称量湿重并记录后将组织放入65℃烘箱,每隔2-4h称量一次,达到恒重(约18-22h)后记录数值为干重,计算湿重与干重的比值即为湿干比(w/d)。
结果表明,manf能够剂量依赖性地降低lps诱导的ali小鼠肺组织的湿干比,高剂量治疗组(20μgmanf/只小鼠)的小鼠肺组织的湿干比与正常对照组小鼠肺组织的湿干比无显著差异,说明manf能显著缓解肺水肿(图4)。
2.2.2manf减少ali小鼠肺组织炎症细胞浸润
按照如下方法收集肺泡灌洗液(支气管肺泡灌洗液(balf))并测定肺泡灌洗液中炎性细胞数量:麻醉小鼠,暴露主气管后7号针头主气管内置管并结扎,暴露胸腔后结扎右侧主支气管,300ulpbs行左侧单肺灌洗术,重复3次,每只鼠的灌洗液4度800转离心后移去并测量灌洗液含量,1毫升pbs重悬ep管底细胞,采用血细胞分析仪((希森美康公司,日本))计数灌洗液中的炎症细胞总数和中性粒细胞及单核巨噬细胞分类计数。
结果表明,manf能够剂量依赖性地显著降低lps诱导的ali小鼠肺泡灌洗液中炎症细胞总数、中性粒细胞和巨噬细胞的数量,说明manf能显著减少ali小鼠肺组织炎症细胞浸润(图5)。
2.2.3manf降低ali小鼠肺泡灌洗液中总蛋白含量
肺组织渗出增加是ali早期的重要病理学变化,肺泡灌洗液中的蛋白含量增加是反映肺组织炎性渗出的常用指标。
采用bca蛋白浓度检测法(bicinchoninicacidproteinassays,bca)测定肺泡灌洗液中总蛋白的含量。结果表明,manf能够剂量依赖性地显著降低lps诱导的ali小鼠肺泡灌洗液中总蛋白含量。说明manf能显著降低肺组织炎性渗出(图6)。
2.2.4manf改善ali小鼠肺组织损伤
肺组织进行he染色的结果表明manf能够剂量依赖性地减少lps诱导的ali小鼠的肺组织炎症细胞浸润、减轻肺水肿、改善肺泡间隔断裂等(图7),同时降低lps诱导的ali小鼠的肺组织损伤病理学评分(图8)。说明manf能治疗和/或预防和/或缓解和/或改善和/或改善ali小鼠肺组织损伤。
其中,小鼠的肺组织损伤病理学评分标准如表1。病理评分用均数±标准差表示,每只小鼠的评分来自6个不同视野的平均值,每组的样本数是10只。组间比较采用的是单因素方差分析。
表1.小鼠的肺组织损伤病理学评分标准
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
序列表
<110>安徽医科大学
<120>中脑星形胶质细胞来源神经营养因子的药用用途
<130>gncfh190232
<160>2
<170>patentinversion3.5
<210>1
<211>509
<212>dna
<213>人工序列(artificialsequence)
<400>1
ccatggggctgcggccgggcgactgcgaagtttgtatttcttatctgggaagattttacc60
aggacctcaaagacagagatgtcacattctcaccagccactattgaaaacgaacttataa120
agttctgccgggaagcaagaggcaaagagaatcggttgtgctactatatcggggccacag180
atgatgcagccaccaaaatcatcaatgaggtatcaaagcctctggcccaccacatccctg240
tggagaagatctgtgagaagcttaagaagaaggacagccagatatgtgagcttaagtatg300
acaagcagatcgacctgagcacagtggacctgaagaagctccgagttaaagagctgaaga360
agattctggatgactggggggagacatgcaaaggctgtgcagaaaagtctgactacatcc420
ggaagataaatgaactgatgcctaaatatgcccccaaggcagccagtgcacggaccgatt480
tgctcgagcaccaccaccaccaccactga509
<210>2
<211>168
<212>prt
<213>人工序列(artificialsequence)
<400>2
metglyleuargproglyaspcysgluvalcysilesertyrleugly
151015
argphetyrglnaspleulysaspargaspvalthrpheserproala
202530
thrilegluasngluleuilelysphecysargglualaargglylys
354045
gluasnargleucystyrtyrileglyalathraspaspalaalathr
505560
lysileileasngluvalserlysproleualahishisileproval
65707580
glulysilecysglulysleulyslyslysaspserglnilecysglu
859095
leulystyrasplysglnileaspleuserthrvalaspleulyslys
100105110
leuargvallysgluleulyslysileleuaspasptrpglygluthr
115120125
cyslysglycysalaglulysserasptyrilearglysileasnglu
130135140
leumetprolystyralaprolysalaalaseralaargthraspleu
145150155160
leugluhishishishishishis
165
- 还没有人留言评论。精彩留言会获得点赞!