ApoD在制备帕金森病药物中的应用、ApoD制剂及其制备方法与流程
本发明涉及载脂蛋白d的药物研究领域,尤其涉及apod在制备帕金森病药物中的应用、apod制剂及其制备方法。
背景技术:
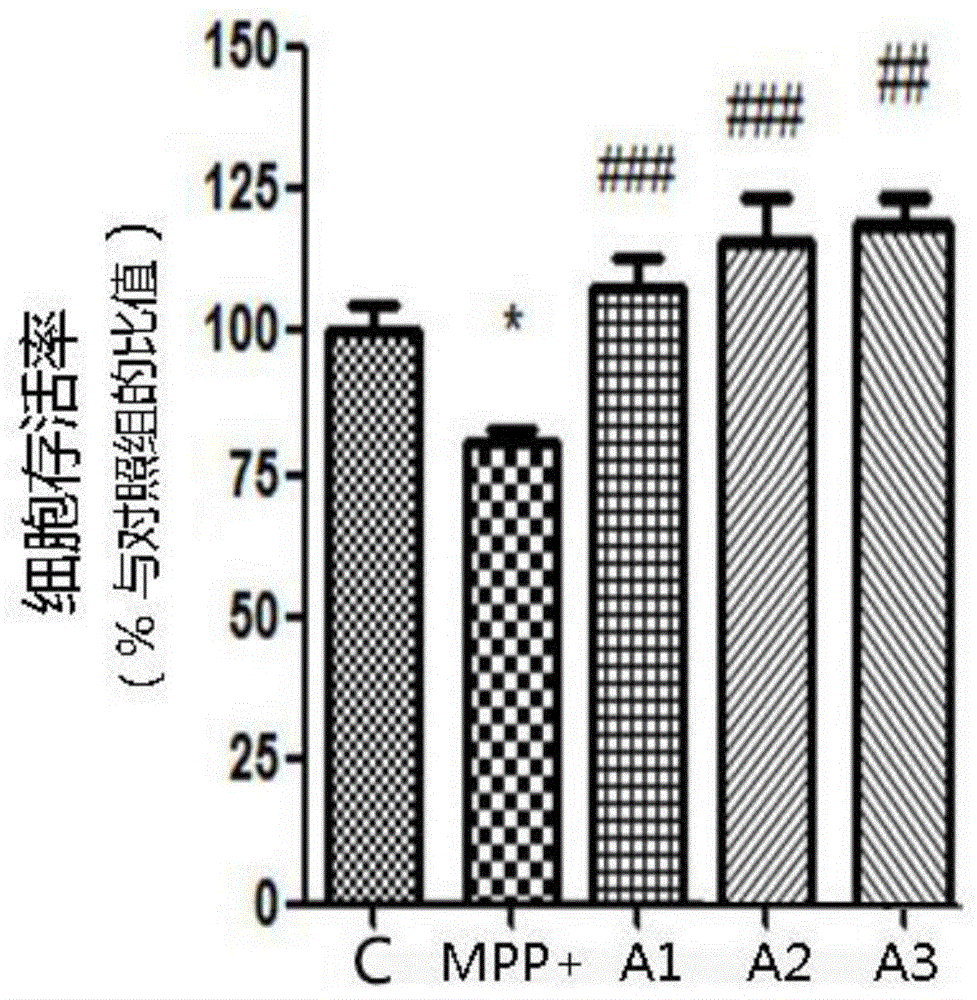
:帕金森病和帕金森综合征(parkinson,pd)是临床常见病,是一种老年退行性脑病,是以进行性运动功能障碍为主要临床表现的中枢神经系统退行性病变,震颤、僵直及运动减少是其最主要的临床表现。而该病的患病率呈迅速增高的趋势,但是其治愈率低。而目前市面的apod的药种类多,或疗效不佳,或具有一定的不良反应,人们急切地需要开发更好的治疗药物。apod,即载脂蛋白d,在结构上与其他类型的载脂蛋白存在很大的差异,被归入脂肪促成素家族。其研究已有20多年的历史,以其结构、表达以及调控、功能等方面的基础研究为主,人们不断开发载脂蛋白d的作用机制和应用价值,目前已利用apod的免疫反应进行心血管疾病、癌症的早期预测和诊断。但是目前,apod的药物开发尚少,其药用价值并未被充分利用。目前尚无任何研究发现apod作为活性成分在帕金森病领域的应用,而apod在制备帕金森病药物的应用是开拓性的发现,应用前景广阔。技术实现要素:针对apod的药用价值并未被充分开发和利用,本发明提供了apod在制备帕金森病药物中的应用,并进一步地提供了一种治疗帕金森病的apod口服制剂及其制备方法,这种apod口服制剂的药用价值高、对治疗部位的靶向效果好、不易被降解,药效持续时间长。为解决上述技术问题,本发明提供了以下技术方案:本发明提供apod在制备帕金森病药物中的应用。本发明还提供了一种用于治疗帕金森病的apod口服制剂的制备方法,其包括以下步骤:s1、内层脂质体制备:将脂质体原料进行混合,进行旋转减压蒸发吹干;加入apod、辅料、乙醚溶液,进行超声搅拌8-15min,温度为10-20℃,得到脂质体i。形成的球形脂质体将apod和辅料进行包埋,避免apod经过肠胃时就被胃蛋白酶和胰蛋白酶所降解,降低药效,并且脂质体层能帮助apod进行跨膜运动,提高apod向靶位点的运输效率。s2、内层脂质体的免疫修饰:将转铁蛋白受体抗体ox26进行巯基化处理,向脂质体i中加入巯基化的ox26,室温下进行10-14h的偶联反应,将ox26抗体连接至脂质体i上,得到脂质体ii,通过层析对脂质体ii进行分离纯化。脑血屏障的脑毛血管内皮细胞上表达大量的转帖蛋白受体,内层脂质体上结合的转铁蛋白受体抗体ox26,基于特异性地免疫结合,可靶向性地运输至脑血屏障并进入脑内,并将脂质体转运至病变的目标脑细胞内,并向其释放apod,起到靶向治疗的作用。s3、复合脂质体的制备:制备质量体积百分比为1-5%的壳聚糖的溶液,并向其加入0.1%(v/v)的乳化剂tween-80后混匀得到混合液,用注射器将脂质体ii溶液快速打入到混合液中,旋涡震荡后的悬浊液在氮气环境下,10-20℃条件下,进行旋转蒸发20-30min,得到复合脂质体iii,得到apod口服制剂。通过上述方法,对脂质体ii的外层结合保护性的壳聚糖层,增加其抗胰蛋白酶降解的性能。进一步提高脂质体制剂的稳定性和水溶形。优选地,所述apod口服制剂的制备方法中,脂质体原料包括:30-50mmol·l-1的卵磷脂和30-50mmol·l-1的胆固醇。优选地,s1步骤中,脂质体进行peg修饰。上述经peg修饰的脂质体原料制备的脂质体,相较于未修饰的脂质体原料,其结构更稳定,半衰期长,提高apod口服制剂的缓释效果,延长药物作用时间。所述apod口服制剂的制备方法中,所述辅料为蛋白酶抑制剂pmsf。与apod一起被包埋于脂质体内的蛋白酶抑制剂pmsf,作为最后一道防线,避免apod进入靶细胞后,被细胞靶内的蛋白酶所降解。所述apod口服制剂的制备方法中,s3步骤后,将得到的脂质体iii采用0.22um的微孔滤膜进行除菌处理。这种除菌操作方法简单,效率高,耗时短,并且不破坏脂质体结构。本发明还提供一种用于治疗帕金森病的apod口服制剂,该制剂以apod为活性成分,为双层脂质体剂型,采用上述的制备方法制备而成。该制剂为口服制剂。本发明具有以下有益效果:1、首次公开了apod在制备帕金森病药物中的应用:首次发现apod对帕金森病的治疗疗效,开拓了apod在帕金森病药物领域的应用价值,提供了一种全新的帕金森病药物类型,为帕金森病新药的研发开辟新方向,奠定坚实基础。2、提供了一种治疗帕金森病的apod口服制剂及其制备方法,通过脂质体法对活性成分apod进行包埋处理,提高了制剂的脂溶性和跨膜运输能力,对apod起到保护作用,避免其受到胃肠道蛋白酶的分解,并提高进入脑血屏障能力;脂质体的peg修饰进一步地提高脂质体的结构稳定性,延长其在体内循环时间,提高缓释性能;脂质体上结合的转铁蛋白受体抗体ox26,能特异性地结合脑血脑血屏障的脑毛血管内皮细胞,提高apod口服制剂的脑组织靶向性,提高其靶向治疗效果。3、通过pd细胞模型的药理实验,证明:apod和apod口服制剂能显著提高mpp+诱导的c6细胞存活率,可能是通过拮抗mpp+诱导的c6细胞线粒体膜电位的降低、拮抗mpp+诱导的c6细胞活性氧ros的升高,从而改善由线粒体功能障碍导致的氧化应激反应,缓解神经细胞损伤。而pd转基因模型小鼠的行为学实验,进一步地验证:apod和apod口服制剂能明显改善pd小鼠运动协调性,缩短爬杆时间,增强小鼠悬挂和自主活动能力,改善帕金森病的症状,对其具有治疗效果。附图说明图1为本发明实施例中apod制剂提高mpp+诱导的c6细胞存活率的实验结果;图2为本发明实施例中apod制剂拮抗mpp+诱导的c6细胞线粒体膜电位(δψm)的降低的实验结果;图3为本发明实施例中apod口服制剂拮抗mpp+诱导的c6细胞活性氧ros升高的实验结果;其中,c组和control组为对照组,mpp+组为仅经过mpp+处理24h的模型组,a1组:施加apod,再加mpp+共孵育;a2组和a3组分别施加低剂量和高剂量apod制剂后,再加mpp+共孵育24hrs;测试结果与模型组相比,#标记代表p<0.05,##代表p<0.01,###代表p<0.001。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。除非另有定义,本说明书所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本说明书中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是用于限制本发明。本说明书所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。此外,下面所描述的本发明不同实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互结合。实验材料apod:biovendor公司的apolipoproteindhumanhek293。转铁受体抗体(ox26,abcam公司)、2-亚氨氢氯化硫醇traut’s试剂盒(pierce公司)。apod口服制剂的制备实施例1本实施例提供一种用于治疗帕金森病的apod口服制剂的制备方法,其步骤如下:1、内层脂质体制备:取30mmol·l-1卵磷脂、45mmol·l-1的胆固醇的乙醇溶液,旋转减压蒸发,在容器内表面形成磷脂双分子层薄膜,再加入apod、蛋白酶抑制剂pmsf、乙醚溶液,进行超声搅拌12min,温度为16℃,得到脂质体溶液;apod的用量为10-500mg/ml。蛋白酶抑制剂pmsf的浓度为1-100ug/ml。接着,向脂质体溶液中一边搅拌一边用注射器缓慢注入peg水溶液,注入速度为1ml/min,最终得到脂质体i,进行冻干处理得到脂质体i冻干粉。2、内层脂质体的免疫修饰:将转铁蛋白受体抗体ox26进行巯基化处理,方法具体参照traut’s试剂盒的使用说明书。将脂质体i冻干粉以1ml蒸馏水重悬,加入巯基化的ox26,室温下进行12h的偶联反应,将抗体连接至脂质体上,得到脂质体ii。通过凝胶过滤层析柱对成功连接的目标脂质体进行纯化。3、复合脂质体的制备:壳聚糖用1%(v/v)的醋酸溶解得到3%(w/v)的壳聚糖溶液,并向其加入0.1%(v/v)的乳化剂tween-80后混匀得到混合液,一遍搅拌一边用注射器将脂质体ii缓慢注入混合液中,混合液在10℃条件下,进行水浴孵化25min,得到复合脂质体iii。将得到的脂质体iii和空白脂质体通过0.22um的微孔滤膜,得到apod口服制剂悬液。采用超速离心法测定得到:该实施例的复合脂质体iii的包封率为73.8%。实施例2本实施例提供一种用于治疗帕金森病的apod口服制剂的制备方法,实验步骤如下:1、内层脂质体制备:将等体积的35mmol·l-1卵磷脂、40mmol·l-1胆固醇的乙醇溶液,旋转减压蒸发,在容器内表面形成磷脂双分子层薄膜,再加入适量apod、蛋白酶抑制剂pmsf、乙醚溶液,进行超声搅拌15min,温度为10℃,得到脂质体溶液。接着,向脂质体溶液中一边搅拌一边用注射器缓慢注入peg水溶液,注入速度为1.5ml/min,最终得到脂质体i,进行冻干处理得到脂质体i冻干粉。2、内层脂质体的免疫修饰:将转铁蛋白受体抗体ox26进行巯基化处理,方法具体参照traut’s试剂盒的使用说明书。将脂质体冻干粉以1ml蒸馏水重悬,加入巯基化的ox26,室温下进行10h的偶联反应,将抗体连接至脂质体上,得到脂质体ii。通过凝胶过滤层析柱对成功连接的目标脂质体进行纯化。3、复合脂质体的制备:壳聚糖用1%(v/v)的醋酸溶解得到5%(w/v)的壳聚糖溶液,并向其加入0.1%(v/v)的乳化剂tween-80后混匀得到混合液,用注射器将脂质体ii溶液快速打入到混合液中,旋涡震荡后的悬浊液在氮气环境下,10℃条件下,进行旋转蒸发30min,得到复合脂质体iii。将得到的脂质体iii和空白脂质体通过0.22um的微孔滤膜,得到apod口服制剂悬液。实验测定得到:该实施例的复合脂质体iii的包封率为71.5%。实施例3本实施例提供一种用于治疗帕金森病的apod口服制剂的制备方法,其步骤如下:1、内层脂质体制备:取50mmol·l-1卵磷脂、30mmol·l-1的胆固醇的乙醇溶液,旋转减压蒸发,在容器内表面形成磷脂双分子层薄膜;加入apod、蛋白酶抑制剂pmsf、乙醚溶液,进行超声搅拌10min,温度为20℃,得到脂质体溶液;接着,向脂质体溶液中一边搅拌一边用注射器缓慢注入peg水溶液,注入速度为2ml/min,最终得到脂质体i,进行冻干处理得到脂质体i冻干粉。其他条件与实施例1相同。2、内层脂质体的免疫修饰:将转铁蛋白受体抗体ox26进行巯基化处理,方法具体参照traut’s试剂盒的使用说明书。将脂质体冻干粉以1ml蒸馏水重悬,加入巯基化的ox26,室温下进行14h的偶联反应,将抗体连接至脂质体上,得到脂质体ii。通过凝胶过滤层析柱对成功连接的目标脂质体进行纯化。3、复合脂质体的制备:壳聚糖用1%(v/v)的醋酸溶解得到3%(w/v)的壳聚糖溶液,并向其加入0.1%(v/v)的乳化剂tween-80后混匀得到混合液,用注射器将脂质体ii溶液快速打入到混合液中,旋涡震荡后的悬浊液在氮气环境下,120℃条件下,进行旋转蒸发20min,得到复合脂质体iii。将得到的脂质体iii和空白脂质体通过0.22um的微孔滤膜,得到apod口服制剂悬液。实验测定得到:该实施例的复合脂质体的包封率为69.3%。测试实验例1apod制剂对mpp+诱导的c6细胞存活率1.1pd细胞模型的构建本实验采用mpp+诱导c6细胞建pd细胞模型,c6细胞是用n-亚硝基甲脲诱导的大鼠神经胶质瘤细胞。取对数生长期的c6细胞悬液,每孔100μl接种于铺有多聚-l-赖氨酸的96孔板,即每孔细胞数量为1×104个,置于37℃、5%co2培养箱中培养24hrs后。通过对各孔中细胞施加mpp+(200μmol/l)处理24hrs进行模型构建。1.2apod制剂可拮抗mpp+诱导的c6细胞存活率的降低1.2.1细胞存活率测定方法采用mtt方法测定细胞存活率,测定原理为:mtt(噻唑蓝)是一种四甲基偶氮唑盐,在活细胞线粒体琥珀酸脱氢酶的作用下,被还原成蓝色甲瓒颗粒,形成量与活细胞数和琥珀酸脱氢酶活性呈正相关,所以mtt与细胞共孵育后,形成蓝色甲瓒颗粒的量可以反应细胞存活率。测定方法为:将待测培养液注入多孔板的各孔中,每孔加入用0.01mol/lpbs配置的5mg/ml的mtt溶液20μl,37℃培养箱中培养4hrs,弃上清后每孔加入dmso100μl,自动酶标读数仪比色(主波长494nm,次波长630nm),测定其吸光度值。并计算各组c6细胞的存活率。细胞存活率=实验组吸光度均值/阴性对照组吸光度均值×100%。1.2.2apod制剂处理对mpp+诱导的c6细胞存活率的影响设置模型组(即只施加mpp+)、空白对照组(即o组)和实验组a1、a2、a3。其中,实验组a1:施加8nmol/lapod,再加mpp+共孵育24hrs;实验组a2和a3分别施加0.1μmol/l和1μmol/l的apod制剂后,再加mpp+共孵育24hrs。再通过上述mtt方法测定各组的细胞存活率。上述apod制剂采用实施例1制备产物。实验结果:如图1所示,相对于空白对照组,模型组的细胞存活率显著降低至78%,而经过apod和apod制剂处理后的a1-a3组的细胞存活率有所增高,可拮抗200μmol/lmpp+引起的细胞存活率的降低,细胞存活率分别为空白对照组的105.775%、112.34%、119.25%。实验结果说明:apod制剂可拮抗mpp+诱导的c6细胞存活率的降低,显著提高c6细胞存活率。1.3apod制剂可拮抗mpp+诱导的c6细胞线粒体膜电位(δψm)的降低。细胞凋亡是pd发生的病理机制之一,氧化应激引起的线粒体功能障碍是细胞凋亡的重要机制,而线粒体跨膜电位差是反映线粒体功能的重要指标。为了进一步确定apod对c6细胞的保护作用是否与其对线粒体功能的保护有关,本发明利用流式细胞术检测apod能否拮抗mpp+引起的△ψm下降。1.3.1实验设置:将2×104个细胞/ml的c6细胞悬液接种6孔板中,每孔1.5ml。24hrs后分组处理细胞,每组4个孔,具体如下:正常对照组(o组):无血清培养液处理48hrs。mpp+组:无血清培养液处理24hrs,mpp+(200μmol/l)处理24hrs。实验组a1:施加8nmol/lapod,再加mpp+共孵育24hrs;实验组a2和a3分别施加0.1μmol/l和1μmol/l的apod制剂后,再加mpp+共孵育24hrs;上述处理均置于37℃、5%co2培养箱中培养。1.3.2细胞线粒体跨膜电位差(△ψm)的检测方法每个样品取1×106个细胞;每个样品中加入rh123(即罗丹明123,sigma公司,终浓度为5μmol/l)溶液1ml,细胞中浓度为1×106个/ml,37℃避光负载30min;用hbs缓冲液洗3次后;每样本加入hbs1ml,重悬成单细胞悬液,300目钢丝网过滤;将样品加入流式细胞仪(bdbiosciences,美国)的样品室,以激发波长488nm,发射波长523nm测定;fcs/ssc设门,收集门内10000个细胞,cellquestpro分析系统分析每组细胞r123的荧光强度。1.3.3实验结果:采用上述检测方法测定各组的细胞线粒体跨膜电位差,结果如图2所示:相较于对照组,mpp+孵育c6细胞24hrs后,细胞△ψm出现大幅度地下降,下降了21.57%,与对照组相比,差别具有统计学意义(p<0.01),而实验组a1中:apod(8nmol/l)预处理后,可拮抗mpp+造成的△ψm的下降明显,降幅减少,仅下降15.41%;而实验组a2和a3中,apod制剂处理对mpp+造成的△ψm的下降的拮抗效果更好,实验组a3的△ψm下降12.5%。结果表明,apod和apod制剂可拮抗200μmol/lmpp+诱导的c6细胞氧化损伤,减少线粒体膜电位(δψm)的降低。1.4apod制剂可拮抗mpp+诱导的c6细胞的活性氧ros的升高mpp+可以损伤线粒体功能,造成线粒体跨膜电位差的降低,而线粒体功能受损又可以使活性氧ros生成增加,本发明应用流式细胞仪检测apod口服制剂是否对细胞内ros的产生起作用。1.4.1实验设置:各实验组和对照组的设置,与测定细胞线粒体膜电位步骤相同。1.4.2细胞ros检测方法每个样本取1×106个细胞;每个样本加入荧光探针h2dcf-da(终浓度为5μmol/l)1ml,细胞中浓度为1×106个/ml,37℃避光负载30min;用hbs缓冲液洗3次后;每样本加入hbs缓冲液1ml,重悬成单细胞悬液,300目钢丝网过滤;将样品加入流式细胞仪(bdbiosciences)的样品室,以激发波长488nm,发射波长523nm测定;fcs/ssc设门,收集门内10000个细胞,cellquestpro分析系统分析每组细胞的荧光强度。1.4.3实验结果:采用上述检测方法测定各组的活性氧ros变化,结果如图3所示:与对照组相比,mpp+孵育c6细胞24hrs后,mpp+组细胞内ros出现升高了150.20%,差别具有统计学意义(p<0.001);而实验组a1中,apod(8nmol/l)预处理可拮抗mpp+造成的ros升高,该组ros仅升高127.28%,与mpp+组相比,差别具有统计学意义(p<0.05);而实验组a2和a3中,低剂量和高剂量的apod制剂的预处理,对mpp+造成的ros升高的拮抗效果更好,a3组ros仅升高108.36%。上述细胞实验的结果表明,apod及apod制剂可拮抗mpp+诱导的c6细胞的氧化应激,拮抗ros的升高,显著提高mpp+诱导的c6细胞的存活率,从而改善帕金森症状。测试实验例2apod制剂对a53t转基因pd小鼠保护作用2.1施药处理以30只四月龄的a53t转基因小鼠随机分为3组,每组10只,分别为:模型组、apod制剂低剂量组(30mg/kg)、apod制剂高剂量组(100mg/kg);以10只野生型小鼠作为空白对照组。apod制剂低剂量组、apod制剂高剂量组分别按照0.1ml/10g体重的剂量灌胃给药,1次/d,连续30d;模型组和对照组灌胃等量的生理盐水。2.2小鼠爬杆实验:实验采用长70cm、直径1cm(其上用胶布缠绕)的不锈钢杆,顶端固定一直径20cm木质圆球。将被测小鼠放到小球上,记录以下几个时间:小鼠从小球上下来所需要的时间;小鼠爬完杆子的上半部分所用的时间;小鼠爬完杆子下半部分所用的时间。然后按以下标准记分:3秒内完成上述某一动作的记3分;6秒内完成的记2分;超过6秒的记1分。记录每组小鼠的总得分,并进行统计学分析。测试结果如下:表一小鼠爬杆能力检测组别小鼠数量总得分模型组1025.2±3.5对照组1035.7±2.6药物低剂量组1029.6±2.3药物高剂量组1032.5±1.5p<0.05,差异显著,具有统计学意义。结果表明:模型组小鼠爬杆时间比对照组延长,得分最低,而药物低剂量组和高剂量组的小鼠的爬杆时间都得到缩短,高剂量组的效果更好,这说明本发明的apod口服制剂能明显改善小鼠爬杆能力。2.3悬挂实验对每组小鼠进行悬挂实验:将小鼠悬挂于一水平电线上,如小鼠用两后爪抓住电线则记3分,如用一后爪抓住电线则记2分。如果小鼠两后爪均抓不住电线则记1分,最后记录每只小鼠得分情况,并作统计学分析。结果如下:表二小鼠悬挂能力检测组别小鼠数量总得分模型组108.4±2.68对照组1016.2±3.5药物低剂量组1013.5±2.3药物高剂量组1014.8±1.5p<0.05,差异显著,具有统计学意义。结果表明:模型组小鼠后退抓握能力比对照组弱,得分最低,而药物低剂量组和高剂量组的小鼠的后退抓握能力(即爬杆能力)得到提高,高剂量组的效果更好,这说明本发明的apod口服制剂能明显改善小鼠悬挂能力。2.4、小鼠自发活动记数测定:应用cs-2型小鼠自主活动程序仪测定小鼠自发活动次数,当计算机进入测定程序后,将小鼠放入活动箱中(高:15cm,直径:25cm),每次同时测定4只小鼠,每个活动箱中一只,由计算机自动记录小鼠活动情况,测定每只鼠5分钟内的活动次数,进行统计学处理。测试结果如表三:表三小鼠自发活动能力测试组别小鼠数量活动次数模型组1082±35对照组10153±46药物低剂量组10115±42药物高剂量组10136±53p<0.05,差异显著,具有统计学意义。结果表明:模型组小鼠的自发活动能力比对照组弱,而药物低剂量组和高剂量组的小鼠的自发活动能力得到提高,高剂量组的效果更好,这说明本发明的apod口服制剂能明显改善小鼠自发活动能力。上述小鼠行为学实验结果,说明本发明的apod口服制剂能明显改善小鼠运动协调性,缩短爬杆时间,增强小鼠悬挂和自主活动能力,改善帕金森病的症状,对其具有治疗效果。可以理解的是,对本领域普通技术人员来说,可以根据本发明的技术方案及本发明构思加以等同替换或改变,而所有这些改变或替换都应属于本发明所附的权利要求的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1