紫铆因在制备靶向恢复突变p53构象药物中的应用的制作方法
本发明属于医药领域,涉及紫铆因在恢复突变p53构象药物中的应用。
背景技术:
p53作为已有大量的研究证实突变p53可以作为药物的靶点,主要的方案包括诱导突变型p53蛋白的降解或在肿瘤细胞中重新激活野生型p53,使突变p53恢复野生型p53抑癌功能,靶向突变p53的另一策略是开发能在肿瘤细胞内重建p53蛋白功能的小分子化合物,使突变蛋白改变构象,恢复其转录激活功能,从而恢复其抑癌功能。
一些天然产物被发现具有靶向突变p53的作用,紫铆因(butein)又称紫铆花素,其化学名称为2,3,4,4’-四羟基查尔酮(2,3,4,4’-tetrahydroxychaleo),是一个查尔酮类化合物,属于植物多酚类物质,为腰果树(semecarpusanacardium)的茎皮、黄檀属(dalbergiaodorifera)的心皮、传统中草药本草锦鸡属(caraganajubata)以及漆树(rhusverniciflua)的茎的主要活性成分。目前,有研究表明:紫铆因可以抑制糖尿病综合征和降血压;可以减少抗体相关的肾小球炎的发生;可以抑制由四氯化碳诱导的肝纤维化;可以改善由顺铂诱导的急性肾功能衰竭,提高肾的浓缩功能。在体内外试验中报道:紫铆因能够抑制多种人类肿瘤细胞的增殖,包括乳腺癌,肺癌,淋巴癌,骨肉瘤和黑色素瘤等,具有广泛的生物学活性。如:通过自噬途径促进骨肉瘤细胞发生凋亡;通过激活ampk/foxo3a信号通路抑制食管癌ec109细胞的增殖、迁移能力,激活氧化应激,促进细胞凋亡;通过抑制vegf受体2(vegfr2)介导的akt-mtor-s6信号通路和fak、erk1/2等蛋白的磷酸化修饰而抑制血管新生,进而抑制肿瘤生长。目前,紫铆因在靶向突变p53的作用尚未见报道。
技术实现要素:
为了拓展查尔酮类化合物应用的新领域,本发明的目的在于开发查尔酮类化合物紫铆因作为一种靶向恢复突变p53的天然药物,其作用主要是:1)将突变p53恢复转变为野生型构象,从而恢复其抑癌功能;2)通过降解突变p53从而抑制肿瘤细胞生长进程。
本发明目的是提供一种药物组合物,含有有效量的查尔酮类化合物紫铆因和药学上可接受的载体。
本发明另一目的是将紫铆因应用在制备靶向抗肿瘤药物中。
本发明化合物可以通过口服或注射的形式施用于需要治疗的患者;用于口服时,可将其制成片剂、缓释片、控释片、锭剂、硬或软胶囊、滴丸、微丸、水性或油混悬剂、乳剂、可分散的散剂或颗粒剂、口服溶液、糖浆剂或酏剂;用于注射时,可制成灭菌的水性或油性溶液、无菌粉末、脂质体、乳剂、微乳剂、纳米乳剂或微囊。
本发明是将查尔酮类化合物紫铆因作为有效活性成分,可进一步制成口服或注射制剂,其中可添加一种或多种药物上可接受的辅料以改善衍生产品的吸收效果或便于服用,所述的辅料包括药学领域常规的填充剂、稀释剂、粘合剂、赋形剂、吸收促进剂、表面活性剂和稳定剂等,必要时还可加入香味剂、色素和甜味剂等。
本发明靶向筛选体系通过dna重组技术基础,将puma启动子序列插入双报告基因载体pezx-ga01的gluc报告基因上游,并经脂质体转染法得到稳定表达puma启动子荧光素酶报告基因系统的h1299p53r175h/p53r273h细胞,通过检测化合物对该细胞中报告基因的表达影响,可以表征转录因子p53与靶基因puma启动子的结合情况,进而作为mutp53重激活剂初筛的依据,从而用于肿瘤药物的高通量、快速靶向筛选;初步发现紫铆因(butein)与prima-1(已经被证实可以恢复突变p53的野生型功能)作用类似,可以增加其puma启动子的相对荧光素酶活;随后,我们通过westernblotting,证实,butein可以降低p53的蛋白表达,采用免疫荧光和免疫沉淀试验,分别用pab1620(识别野生型p53)和pab240(识别突变型p53),实验结果显示:在药物处理后,突变p53降低,而野生型p53增加;从以上结果显示:提示butein可以恢复突变p53构象以及降解突变p53,这为天然产物肿瘤治疗提供新的作用靶点,也为肿瘤治疗提供了新的策略。
附图说明
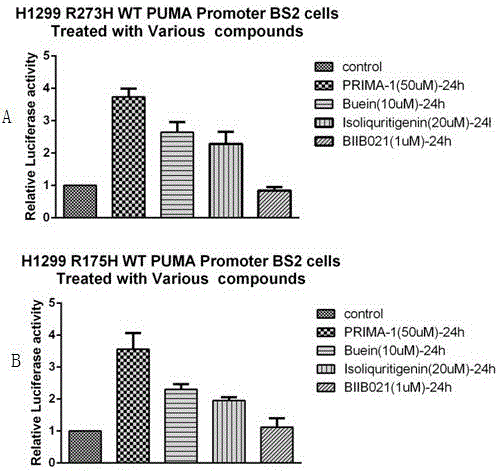
图1是化合物butein处理h1299p53r175h/p53r273h-pumapromoterbs2细胞24小时后相对荧光素酶活表达结果;其中a图为h1299p53r175h-pumapromoterbs2细胞,b图为h1299p53r273h-pumapromoterbs2细胞;
图2是化合物butein处理ht29、sk-br-3细胞12、24、48小时后p53以及下游靶基因的蛋白表达结果;其中a图为ht29,b图为sk-br-3细胞;
图3是化合物butein处理ht29、sk-br-3细胞48小时后,野生型p53与突变型p53的表达结果。图是免疫沉淀试验结果;其中上图为ht29,下图为sk-br-3细胞;
图4是化合物butein处理ht29、sk-br-3细胞48小时后,野生型p53与突变型p53的表达结果。图是免疫荧光试验结果,其中a图为ht29,b图为sk-br-3细胞。
具体实施方式
下面通过实施例对本发明作进一步详细说明,但本发明的保护范围不局限于所述内容,实施例中方法如无特殊说明均采用常规方法,使用试剂如无特殊说明,均为常规市售试剂或采用常规方法配置的试剂。
实施例1:mutp53重激活剂筛选
1、取生长良好,汇合度80-90%的h1299p53r175h/p53r273h-pumapromoterbs2细胞(稳定表达puma启动子荧光素酶报告基因),按1.5×105个细胞/孔接种至6孔板中,晃匀,放入37℃培养箱孵育24h至细胞贴璧完全;
2、将贴璧完全的h1299p53r175h/p53r273h-pumapromoterbs2细胞从培养箱取出,吸掉旧培养基,加入2ml含相应工作浓度化合物的新鲜rpmi1640培养基,晃匀,放入37℃培养箱孵育15h;
3、gluc、seap都属于分泌型的蛋白,因此化合物处理完毕后,可轻轻收集细胞培养上清,立即检测gluc、seap的活性;
a、检测gluc的活性
(1)收集化合物处理完毕的100μl细胞培养上清至1.5ml离心管,然后置于室温;
(2)将10×的gl-s缓冲液取出并在常温下解冻,充分混匀后取适量10×的gl-s缓冲液用超纯水稀释为1×gl-s缓冲液。1×gl-s缓冲液用量为100μl/反应;
(3)避光环境下,往1×gl-s缓冲液加入1/100总体积的substrategl(100×),充分混匀,配得gluc工作液;
(4)将待检测上清及gluc工作液分别移入25℃杂交炉中温育25分钟;
(5)取一个干净的不透光96孔酶标板,将温育完毕的上清及工作液取出分别移取10,100μl至孔中,用移液枪混和均匀;
(6)混匀完毕后,96孔板放入25℃杂交炉孵育1分钟,然后将酶标仪的读板模式设置为“化学发光”,检测96孔板中gluc氧化荧光素所发生的生物萤光。(室温孵育后应争取在5分钟内读板)
b、检测seap的活性
(1)吸取50μl细胞培养上清至新的1.5ml离心管,然后在65℃杂交炉中加热15min,取下置于冰浴备用;
(2)将10×的ap缓冲液取出并在常温下自然解冻,充分混匀后取适量的10×的ap缓冲液用超纯水稀释为1×ap缓冲液。1×gl-s缓冲液的用量为100μl/反应;
(3)避光环境下,往1×ap缓冲液加入1/100总体积的substrateap(100×),充分混匀,配得seap工作液;
(4)将待检测上清及seap工作液分别移入25℃杂交炉中温育10分钟;
(5)取一个干净的不透光96孔酶标板,将温育完毕的上清及seap工作液取出分别移取10、100μl至孔中,用移液枪温和混匀;
(6)混匀完毕后,96孔板放入25℃杂交炉孵育10分钟,然后通过酶标仪检测96孔板中seap与底物反应的发光强度。
结果见图1,从图中1中可以看出butien处理后,可以puma报告基因的表达增加,即可以增加其相对荧光素酶活。
实施例2:免疫印迹实验
(1)取对数生长期的ht29、sk-br-3细胞,采用紫铆因化合物(20/10μm)处理12h、24h、48h,用细胞刮将细胞刮下,4℃离心,用1×pbs清洗一遍,移至1.5ml离心管中得到细胞沉淀;
(2)加入适宜的细胞裂解液,对细胞沉淀进行超声处理,条件25-30hz,超10s停5s,共10次,如果沉淀未被完全超声彻底可以适当增加超声次数。提取出的蛋白利用考蓝或bca方法进行定量;
(3)配置蛋白上样体系:15μl、20μg,蛋白上样体系中加溴酚蓝(已加β-巯基乙醇)终浓度为1×上样体系;体系配好后,沸水煮7min左右,冷却离心;
(4)跑胶:配置12%的分离胶和4.5%的浓缩胶,配置1×的runningbuffer(含1%的sds),准备上样;
(5)转膜:配置转膜液,200ml甲醇+100ml的10×runningbuffer纯水定容到1l,pvdf膜用之前要用甲醇活化;按照板子黑面-海绵-三层滤纸-胶-pvdf膜-三层滤纸-海绵-板子白面顺序制备转膜装置。转膜条件:180ma、300v、2h30min或是3h;
(6)5%牛奶封闭,先用1×pbst清洗pvdf膜上的转膜液,然后用5%的牛奶37℃封闭2h或是4℃摇床封闭过夜;
(7)标一抗:用1×pbst清洗封闭牛奶,然后用配好的p53(do-1)(1:500)、puma(1:100)、p21(1:1000)、noxa(1:500)抗体4℃摇床过夜;
p53(do-1)(sc-126,santa),puma(7467,cst),
p21(556430,bd),noxa(sc-30209,santa)1:10000比例稀释,进行二抗封闭,室温2h;
(8)显影:按照1:1比例配置显影液,进行显影;
结果见图2:从图中2中可以看出butien处理后随着时间的增加butien使突变p53的表达降低,同时诱导p53下游靶基因puma、p21、noxa的蛋白表达上调。
实施例3:免疫沉淀试验
(1)细胞接种:取生长良好,汇合度80-90%的ht29、sk-br-3细胞,按2×106个细胞/皿接种至10cm培养皿(大皿),晃匀,放入37℃培养箱孵育24h至细胞贴璧完全;
(2)化合物处理:将贴璧完全的ht29、sk-br-3细胞从培养箱取出,吸净旧培养基,加入10ml新鲜1640培养基(含10μm、20μm的butein),晃匀,放入37℃培养箱孵育至相应时间点;
(3)收集细胞:用细胞刮收集细胞并将细胞悬液移入15ml的离心管中,4℃、1000g离心5mins,弃去上清,以1ml预冷1×pbs重悬细胞后将悬液转至1.5ml的离心管,4℃,以1000g离心5mins,弃掉上清并将所留沉淀存于-80℃待用;
(4)蛋白提取:以适量ripa裂解液重悬细胞沉淀后,在冰浴中对样品进行超声破碎,功率设为25%,超声10s,间隔6s,超声10次;然后,样品置于4℃的360°静音混匀器裂解2-3h。4℃、10000g离心30mins,小心转移上清至新的1.5ml离心管;
(5)预洗:取20μlproteina+g琼脂糖凝胶珠子至新1.5mlep管并以1ml1×pbs重悬清洗琼脂糖珠后,4℃,8000rpm离心1min,弃上清,重复两次,将(2)蛋白样品及1μg的igg抗体移入ep管中置于360°静音混匀仪4℃预洗2h从而去除与珠子非特异性结合的蛋白,4℃下,5000rpm,离心30mins后,将上清转入新的已预冷1.5mlep管备用;
(6)免疫沉淀反应:根据蛋白浓度测定结果,取100-500μg的蛋白样品至新的1.5mlep管,加入1μg目的抗体(或igg),移至4℃的360°静音混匀仪中免疫反应过夜,次日,将免疫反应样品完全转移到20μl已用pbs充分清洗的proteina+g琼脂糖珠中,补加600μl预冷1×pbs,在4℃的360°静音混匀仪继续孵育过夜;
(7)清洗:样品从4℃中取出,冰浴静置2mins后,6000g、4℃,离心1min,弃上清;沿壁加入1ml预冷1×pbs,轻轻清洗珠子后,4℃、6000g,离心1min,弃上清,清洗8-10次;
(8)变性及蛋白质印迹:往已清洗样品管中加入16μl1×pbs及4μl5×loadingdye,短暂低速离心后,放入沸水浴煮沸7-10mins使结合于琼脂糖珠的免疫复合物完全解离;已变性样品冷凝后,离心并进行sds-page电泳;
本实验所需试剂配制
(1)0.5medta(ph7.4)溶液的配制:
(2)ripa裂解液的配制:
(3)抗体的配制:
结果见图3:从图中3中可以看出butein处理后,butein使突变p53的表达降低,同时野生型p53的表达增加。
实施例4:免疫荧光试验
(1)细胞接种:取生长良好,汇合度80-90%的ht29、sk-br-3细胞,按2×105个细胞/皿接种至放有已灭菌的玻片的6cm培养皿(中皿),晃匀,放入37℃培养箱孵育24h至细胞贴璧完全;
(2)化合物处理:将贴璧完全的ht29、sk-br-3细胞从培养箱取出,吸掉旧培养基,加入2ml新鲜1640培养基(含10μm、20μm的butein),晃匀,放入37℃培养箱孵育至相应时间点;
(3)细胞清洗:化合物处理结束后,将爬片的六孔板取出,吸掉旧培养基,使用1×pbs清洗并静置2min,重复三次;
(4)固定细胞:于每孔加入1ml固定液,27℃固定10min。固定完成后,吸掉固定液,使用1×pbs清洗并静置2min,重复三次;
(5)细胞打孔:于每孔加入800μl,1%np-40处理5min,可提高细胞膜的通透性,
利于抗体的进入,打孔完成后,吸净np-40,使用1×pbs清洗并静置2min,重复三次;
(6)封闭:于每孔加入1ml,5%bsa封闭2h,可提高目的抗体的特异性结合。封闭完成后,吸净bsa,使用1×pbs清洗并静置2min,重复三次。需要特别注意的是,后续实验需要避光进行;
(7)标记一抗:根据实验要求按比例加入抗体(使用2%bsa配制),每孔100μl,4℃层析柜孵育过夜,孵育完成后,吸净抗体,使用1×pbs清洗并静置2min,重复三次;
(8)标记二抗:根据一抗选择相应的荧光二抗,按比例稀释(使用2%bsa配制),每孔100μl,27℃孵育2h。孵育完成后,吸净抗体,使用1×pbs清洗并静置5min,重复三次;
(9)细胞核染色:采用dapi进行核染。按比例稀释(使用2%bsa配制),每孔100μl,27℃孵育30min。孵育完成后,吸净dapi,使用1×pbs清洗并静置5min,重复三次;
(10)制片:预先准备载玻片并做好标记,于载玻片上滴加适量的防淬灭剂,然后将盖玻片轻轻置于载玻片上(有细胞的一面朝下封于防淬灭剂中),避免气泡的产生。制片完成后将成片置于暗盒中可进行荧光显微镜拍照或4℃保存;需要特别注意的是,在实验过程中加入液体进入孔板时,动作要轻缓,避免直接冲击盖破片上的细胞,以免造成细胞脱落;
本实验所需试剂配制
(1)20%蔗糖溶液配制:称取10g蔗糖粉末溶于适量的1×pbs中,混匀溶解,定容到50ml,室温储存备用;
(2)5%多聚甲醛溶液配制:称取2.5g多聚甲醛粉末溶于适量的1×pbs中,混匀溶解,定容到50ml,室储存备用;
(3)1%np-40溶液配制:取0.5mlnp-40溶于适量的1×pbs中,混匀溶解,定容到50ml,室储存备用;
(4)固定液配制:
结果见图4:从图中4中可以看出butien处理后,butien使突变p53的表达降低,同时野生型p53的表达增加。
- 还没有人留言评论。精彩留言会获得点赞!