用于制备纤维蛋白基质的方法和试剂盒与流程
本发明涉及用于制备具有融合肽的纤维蛋白基质的方法和试剂盒,并且涉及具有融合肽的纤维蛋白基质。
纤维蛋白封闭剂,例如artiss或
纤维蛋白基质是其中纤维蛋白原被凝血酶裂解并且得到的纤维蛋白聚合物在钙源和凝血因子xiiia的存在下交联以形成三维网络的过程的产物。
已知某些生物活性因子可促进骨修复。甲状旁腺激素(pth)是由甲状旁腺产生和分泌的84个氨基酸的肽。这种激素通过作用于各种组织,特别是骨,在控制血清钙水平方面起主要作用。这使得pth在治疗骨疾病方面特别令人关注。
已经采取方法使纤维蛋白封闭剂artiss或
令人惊讶地发现,在室温下,在纤维蛋白原溶液中的包含pth的融合肽在相对短的时间段内降解(实施例1)。这尤其令人惊讶,因为artiss和
因此,这是本发明的目的。因此,本发明的目的是克服现有技术的缺点。更特别地,本发明的目的是提供用于制备作为封闭剂的纤维蛋白基质的方法,该方法更具再现性和一致性。
这些目的已经通过如下所述的用于制备纤维蛋白基质的方法和试剂盒得以解决。
本文描述了用于制备包含融合肽的纤维蛋白基质的方法。在一些实施方案中,该方法包括提供三种不同的组分,包括包含纤维蛋白原或纤维蛋白原前体和任选的转谷氨酰胺酶或转谷氨酰胺酶前体的第一组分,包含凝血酶或凝血酶前体的第二组分,和包含融合肽的第三组分。在这些实施方案中,第一组分和第二组分均不包含融合肽。在一些实施方案中,将第一或第二组分与第三组分预混合。混合第一、第二和第三组分以形成包含共价连接的融合肽的纤维蛋白基质。混合在不超过5天的时间范围内进行。本文还描述了用于制备包含共价连接的融合肽的纤维蛋白基质的试剂盒。
i.用于制备纤维蛋白基质的方法
公开了用于制备包含融合肽的纤维蛋白基质的方法。该方法包括第一步骤(i):提供包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶如凝血因子xiiia或转谷氨酰胺酶前体如凝血因子xiii的第一组分,和第二步骤(ii):提供包含凝血酶或凝血酶前体的第二组分。第一组分和第二组分均不包含融合肽,所述融合肽包含第一结构域和在第二结构域中的可共价交联的转谷氨酰胺酶底物结构域。该方法进一步包括第三步骤(iii):提供第三组分,该第三组分包含融合肽,所述融合肽包含第一结构域和在第二结构域中的可共价交联的转谷氨酰胺酶底物结构域。第三组分不包含纤维蛋白原或纤维蛋白原前体,也不包含凝血酶或凝血酶前体。在该方法的另外的第四步骤(iv)中,通过混合第一、第二和第三组分形成包含共价连接的融合肽的纤维蛋白基质。三种组分的混合在不超过5天,优选地2至3天,最优选地1天的时间范围内进行。任选地,在甚至少于1天,例如在10小时、5小时、4小时、3小时或2小时之内;在少于60分钟内,例如在30分钟、20分钟、10分钟或5分钟之内;或甚至在少于60秒内,例如在40秒、30秒、20秒、10秒或5秒之内的时间范围内,将三种组分混合在一起。
任选地,在不超过5天,优选地不超过2天,最优选地不超过1天的时间范围内,将第二组分加入到第一组分和第三组分的混合物中,或者将第一组分加入到第二组分和第三组分的混合物中。例如,可以将第一组分(如包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体)和第三组分(包含融合肽)混合在一起,然后储存最多5天,优选地最多2至3天,和最优选地最多1天,然后与第二组分(包含凝血酶或凝血酶前体)混合。同样地,可以将第二组分(包含凝血酶或凝血酶前体)和第三组分(包含融合肽)混合在一起,然后储存最多5天,优选地最多2至3天,和最优选地最多1天,然后与第一组分(如包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体)混合。
在其中在步骤(iv)中将第一和第二组分混合在一起的实施方案中,优选地在混合第一和第二组分时或在混合第一和第二组分后不超过一天,优选地在1小时内,优选地在5分钟内,优选地在1分钟内,最优选地在30秒内的时间范围内将第三组分加入到混合物中。在该实施方案中,取决于给药方法,在混合三种组分开始的五天内将三种组分的混合物给予患者。
在一些实施方案中,使用连接装置混合组分。通过在连接装置中混合或者允许通过连接装置将两种或多种组分转移到单个容器中,可以使用连接装置来实现两种或三种组分的混合。
在一些实施方案中,纤维蛋白基质在身体内或身体上原位形成。在其他实施方案中,基质可以在身体外部形成,然后以预成形的形状施加。在这两种情况下,将基质施加或植入到需要治疗的部位。
两种预混合的组分可以在双隔室装置的一个隔室中,而其余的组分可以在该装置的第二隔室中,优选地,这些隔室通过连接装置附接。包含两个或更多个隔室的装置可以用与该装置中隔室数量相同数量的单独的容器替换,并可以与本文所述的多隔室装置相同的方式使用。
两种组分可以位于双隔室装置(或两个容器)中,并且其余组分可以位于第三隔室(或第三容器)中。双隔室装置的两种组分通过连接装置混合,所述连接装置然后连接第三隔室,从而导致三种组分的混合。优选地,双隔室和第三隔室通过连接装置连接。连接装置可以是单独的装置,或者可以是双隔室装置的部分或第三隔室的部分。任选地,可以通过将第三隔室附接到第四隔室并且在第三和第四隔室之间来回转移混合物来进一步混合这三种组分。第三隔室和第四隔室可以通过连接装置附接(例如,参见图2e)。
这三种组分可以位于单独的隔室中,并且可以通过附接到三通连接装置同时混合,也可以在三隔室注射器中混合。优选地,三个隔室连接到连接装置(例如,参见图2a-2d和4b-4c),或者具有作为三个单独隔室之一的部分的连接装置,或者具有作为三隔室注射器的部分的连接装置。
供选择地,这三种组分在三个独立的隔室中。在第一步中,将三种组分中的两种混合,并且在第二步中,将该混合物与剩余的组分混合(参见例如图3a-3d和图5a-5e)。各个隔室可以与连接装置连接,并且通过将混合物在隔室之间来回转移来实现混合。
凝血酶前体可以是凝血酶原。凝血酶原被包含凝血因子va和凝血因子xa的复合物激活。
组分的混合可以在环境温度下,例如在15℃至40℃之间,优选地在20℃至37℃之间进行。
混合后,两种组分的混合物,例如包含组分3和组分2的混合物或包含组分3和组分1的混合物,可以在2以到30在下储存最多五天。
优选地,在混合组分之前,初始纤维蛋白原浓度为10至200毫克每毫升组分溶液,更优选地为30至150毫克每毫升组分溶液,最优选地为72至110毫克每毫升组分溶液;并且初始凝血酶为0.1至1500iu每毫升组分溶液,更优选地为0.5至500iu每毫升组分溶液,最优选地为2至7iu每毫升组分溶液。在最终混合物中,纤维蛋白原浓度为8至160毫克每毫升纤维蛋白基质,更优选地为25至100毫克每毫升纤维蛋白基质,最优选地为30至60毫克每毫升纤维蛋白基质。最终混合物中的凝血酶浓度为0.05至100iu每毫升纤维蛋白基质,更优选地为0.2至20iu每毫升纤维蛋白基质,最优选地为1至4iu每毫升纤维蛋白基质。i.u.代表凝血酶的一个国际单位,定义为包含于0.0853mg的第一国际标准的人类凝血酶中的活性。
另外,钙源通常存在于至少一种组分中。提供钙源是凝血酶激活凝血因子xiii所必需的。第一组分、第二组分或第三组分可进一步包含钙源。优选地,钙源是氯化钙,最优选为水合形式(cacl2*2h2o)。优选地,氯化钙浓度为0.5至5毫克每毫升纤维蛋白基质,更优选地为1.5至3.5毫克每毫升,最优选地为2.5至3毫克每毫升。在组分溶液之一中的钙离子源的浓度通常在1至10毫克每毫升组分溶液的范围内,甚至更优选地在3至7毫克每毫升组分溶液的范围内,最优选地在5至6mg每毫升组分溶液的范围内。
在第一组分溶液中,转谷氨酰胺酶(例如,凝血因子xiiia)或转谷氨酰胺酶前体(例如,凝血因子xiii)优选地以以下浓度范围存在:对于转谷氨酰胺酶为0.1至100i.u.每毫升组分溶液或如果被激活将产生在该活性范围内的转谷氨酰胺酶的转谷氨酰胺酶前体的浓度,更优选地为对于转谷氨酰胺酶为0.5至60i.u.每毫升组分溶液或如果被激活将产生在该活性范围内的转谷氨酰胺酶的转谷氨酰胺酶前体的浓度,最优选地为对于转谷氨酰胺酶为1至10i.u.每毫升组分溶液或如果被激活将产生在该活性范围内的转谷氨酰胺酶的转谷氨酰胺酶前体的浓度。
在最多5天的时间范围内混合组分具有避免各组分降解,特别是融合肽降解的优点。同时,与预混合程序相比,在融合肽与纤维蛋白基质的结合中观察到相同的功效(实施例2)。
i.apth融合肽
pth融合肽包含至少两个结构域,其中第一结构域包含pth,第二结构域包含可交联的底物结构域。可以在改善的骨组织的再生中发现在融合肽的第一结构域中使用pth的优点。pth调节骨重塑,因此可以增加骨密度。
可交联的底物结构域优选地在其形成期间或之后可共价交联到纤维蛋白基质。可交联的底物结构域优选地是用于酶的结构域,优选地为用于转谷氨酰胺酶的底物结构域(“转谷氨酰胺酶底物结构域”)。pth融合肽可以重组制备或通过化学合成制备。pth融合肽优选地通过化学合成制备。pth融合肽的氨基酸序列还可包含酶或水解切割位点,使得pth可以在对其一级结构几乎没有或没有修饰的情况下被释放。
i.a.1pth
pth融合肽的第一个结构域中的pth可以是pth1-84、pth1-38、pth1-34、pth1-31或pth1-25,或显示骨形成特性的pth的任何修饰形式或等位基因形式。pth1-84是指人序列,较低的编号说明pth的截短、修饰和等位基因形式,它们显示骨形成特性并触发骨组织的再生。
pth的优选的截短形式是pth1-38、pth1-34、pth1-31或pth1-25。最优选的是pth1-34。优选地,pth为人pth,但是来自其他来源的pth如牛pth可以是合适的。
i.a.2转谷氨酰胺酶底物结构域
转谷氨酰胺酶催化蛋白质结合的谷氨酰胺酰残基的γ基羧酰胺基与赖氨酸残基的ε酰氨基之间的酰基转移反应,导致n-ε-(γ-谷氨酰基)赖氨酸异肽侧链桥的形成。优选地,转谷氨酰胺酶底物结构域是用于组织转谷氨酰胺酶的底物(“组织转谷氨酰胺酶底物结构域”)。在优选的实施方案中,底物结构域是用于凝血因子xiiia的底物结构域(“凝血因子xiiia底物结构域”)。
优选地,转谷氨酰胺酶前体是凝血因子xiii。一旦与凝血酶混合,凝血因子xiii将被凝血酶蛋白水解激活为凝血因子xiiia。凝血酶通过将纤维蛋白原裂解为纤维蛋白进一步引发反应。然后,凝血因子xiiia使纤维蛋白共价交联以形成纤维蛋白基质。
转谷氨酰胺酶底物结构域,特别是凝血因子xiiia底物结构域,适合在基质形成过程中将pth融合肽连接到纤维蛋白基质。在第二结构域中包含可共价交联的转谷氨酰胺酶底物结构域的pth融合肽也可通过转谷氨酰胺酶凝血因子xiiia共价交联到纤维蛋白。
在wo03/052091(序列表)中已经详细描述了适用于制备本文所述的pth融合肽的转谷氨酰胺酶底物结构域,包括其氨基酸序列,其内容通过引用并入本文。
可交联的底物结构域可以包括gakdv(seqidno:1),kkkk(seqidno:2),yrgdtigegqqhhlgg(seqidno:3)或nqeqvspl(seqidno:4)。
优选的凝血因子xiiia底物结构域具有nqeqvspl(seqidno:4)的氨基酸序列(在本文中称为“tg”)。
i.a.3融合肽的切割位点
融合肽还可以在第一和第二结构域之间包含切割(或降解)位点,优选地酶切割(或降解)位点。切割位点允许释放pth,而对一级肽序列几乎没有或没有修饰。
酶切割位点可以包含被相应酶识别的某种氨基酸序列。结构域中的序列是用于参与细胞迁移的酶的底物(例如,用于诸如胶原酶、纤溶酶、基质金属蛋白酶或弹性蛋白酶的酶的底物),但是合适的结构域不限于这些序列。优选地,酶切割位点是纤溶酶切割位点。纤溶酶原,即纤溶酶的酶原,可能与纤维蛋白原相关。任选地,包含纤维蛋白原或纤维蛋白原前体的组分(在本文中称为“第一组分”)还包含纤溶酶原。
i.酶切割位点
合适的蛋白水解切割位点包括用于胶原酶、纤溶酶、弹性蛋白酶、溶基质蛋白酶或纤溶酶原激活剂的底物。在下面列出示例性底物。n1-n5表示从发生蛋白水解的位点朝向蛋白质的氨基末端的1-5位氨基酸。n1′-n4′表示从发生蛋白水解的位点朝向蛋白质的羧基末端的1-4位氨基酸。
表1:用于蛋白酶的样品底物序列
参考:1.takagi和doolittle,biochem.,14:5149-5156(1975);
2.smith等,j.biol.chem.,270:6440-6449(1995);
3.besson等,analyticalbiochemistry,237:216-223(1996);
4.netzel-arnett等,j.biol.chem.,266:6747-6755(1991);
5.coombs等,j.biol.chem.,273:4323-4328(1998).
可以用于蛋白水解降解的酶很多。优选地,切割位点可被酶如纤溶酶和基质金属蛋白酶切割。
在一个优选的实施方案中,序列yknr(seqidno:13)存在于第一结构域和第二结构域之间。该序列是纤溶酶可降解的。
优选的pth融合肽是tgp1pth1-34:
nqeqvsplyknrsvseiqlmhnlgkhlnsmervewlrkklqdvhnf(seqidno:14)。
另一种优选的pth融合肽是tg-pth1-34,其包含天然pth的氨基酸1-34以及tg(转谷氨酰胺酶)底物结构域,但没有降解位点
nqeqvsplsvseiqlmhnlgkhlnsmervewlrkklqdvhnf(seqidno:15)。
ii.水解降解位点
合适的非酶降解底物包括通过酸或碱催化的机理进行水解的任何键。这些底物包括低聚酯,例如乳酸或乙醇酸的低聚物。这些材料的降解速率可以通过选择低聚物来控制。优选地,融合肽以0.01至2mg/ml纤维蛋白基质,任选地0.01至1mg/ml纤维蛋白基质或0.2至0.7mg/ml纤维蛋白基质的浓度范围包含在最终混合物中。该方法通常在无菌条件下进行。优选地,组分以无菌方式预先包装和混合。因此,避免了由于污染的产品引起的任何感染。
ii.试剂盒
还公开了用于根据前述方法制备纤维蛋白基质的部件的试剂盒(kitofparts)。该试剂盒包括包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体的第一组分,包含凝血酶或凝血酶前体的第二组分,和包含融合肽的第三组分,所述融合肽包含第一结构域和在第二结构域中的可共价交联的转谷氨酰胺酶底物。该试剂盒还可以包括至少一个用于混合第一组分、第二组分和第三组分的连接装置。这样的连接装置可以是单独的装置,或者可以是包含这些组分之一的容器的部分。第三组分与第一组分和第二组分分开提供。
通过将第三组分与第一组分和第二组分分开提供,避免了组分之间的任何不希望的接触,这些接触可能导致与化合物的不相容性有关的降解。该试剂盒还允许在使用前直接混合组分。
优选地,第三组分在直接地或间接地可连接或直接地或间接地连接到连接装置的容器中提供。包含第三组分的容器可以是无菌包装或灭菌的。优选地,连接装置也无菌提供。
容器可以是由本领域已知的材料制成的注射器、瓶、药筒或袋。
在不使容器和连接装置的内容物暴露于环境的情况下,确保组分的混合,从而降低了污染的风险。
第一组分和第二组分可以在可连接到连接装置的单独的容器中提供。连接装置可以被构造成使得具有第一组分的容器、具有第二组分的容器和具有第三组分的容器可以同时可直接或间接地连接到连接装置。这种连接装置可以是单独的装置,或者可以是包含组分中的一种或多种的容器的部分。
该连接装置包含足够数量的开口以容纳多个容器和/或另外的连接装置,它们是充分混合组分所需的。优选地,连接装置包括至少一个槽,优选地一个、两个或三个槽。槽是可以设置在连接装置的一侧上或在连接装置的相对侧上的开口。槽被构造成使得容器可以直接或间接地偶联到连接装置。直接连接或偶联是指容器通过槽之一附接到连接装置。间接连接是指通过另外的连接装置如适配器、软管,将容器连接到连接装置。另外的连接装置可以被附接到连接装置的槽之一。连接装置也可以是容器之一的部分,例如位于容器开口处,所述容器具有合适的结构,该结构用于通过连接装置将第二容器连接到该容器。
适配器是一类连接装置,其通常是中空的,并且通常在适配器的相对侧上包含两个开口,其中每个开口都具有合适的构造,用于附接到容器的开口或另一个连接装置的开口。当开口不具有直接附接到容器中的开口的合适构造时,适配器通常用于将容器间接地连接到连接装置的开口。例如,如果开口呈喷嘴形状,则可将适配器附接到该端部以将容器间接地连接到连接装置的喷嘴。适配器也可以用于将两个容器相互连接,其中一个容器附接到适配器的一侧,另一个容器附接到相对侧。一些适配器包括用于打开或关闭适配器的阀。
连接装置通常是中空的并且包含开口。至少第一开口适合于附接到装置的第一容器或第二连接装置,并且至少第二开口适合于附接到第二容器或第三连接装置。任选地,连接装置具有用于最多达四个容器的开口,以直接或间接地连接到连接装置。任选地,连接装置具有开口,纤维蛋白基质通过该开口离开连接装置并被施加到患者的表面。任选地,连接装置包括用于打开和关闭开口中的一个或两个的阀或机构。任选地,连接装置包括静态混合器以促进组分的混合。任选地,连接装置是容纳一种或多种组分的容器的部分。在该实施方案中,连接装置的一端直接附接到容器,例如,连接装置的一端可以与容器成一体并充当其开口。
通过在单独的容器中(或在同一容器的单独的隔室中或在附接到连接装置的单独的隔室中)提供组分,避免组分的任何污染或不希望的预混合。
供选择地,可以在连接装置的单独的隔室中或在连接到连接装置的单独的容器中提供第一和第二组分。可以另外提供允许第一和第二组分混合的柱塞。连接装置还可以包括用于连接包含第三组分的容器的槽。
通过已经在连接装置的单独的隔室中或在连接到连接装置的单独的容器中提供第一和第二组分,需要较少的包装材料,并且避免由于连接装置的错误填充而可能发生的任何污染。
优选地,每种组分处于单独的内包装(primarypackage)中,并且第一组分的内包装、第二组分的内包装、第三组分的内包装和连接装置是无菌的并且是无菌包装的。内包装是与组分直接接触的容器或隔室。
还公开了一种含有融合肽的纤维蛋白基质,其可通过前述方法获得,用于生成骨或愈合骨折。
如前所述,融合肽可以包含pth生物活性因子。这种纤维蛋白基质的优点可见于增强的骨愈合能力,以释放触发骨形成的生物活性因子。
优选地,先前描述的包含融合肽的纤维蛋白基质可以用于治疗骨折、骨囊肿或低骨密度状态。任选地,纤维蛋白基质用于治疗骨质疏松症患者的骨。低骨密度状态可以通过将个体的特定骨类型(例如,脊柱、髋等)的骨矿物质密度与健康的30岁成人的正常值进行比较来表征。具有骨密度低于健康30岁成年人平均值超过1个标准偏差的骨的个体被认为具有低骨密度。使用相同的测试,如果任何骨的骨密度低于健康30岁成年人的平均值超过2.5个标准差,则该个体被认为患有骨质疏松症。
如前所述的含有融合肽的纤维蛋白基质还可以用于融合患者的两个或多个骨的方法,例如融合经历脊柱融合术的患者的脊柱节段,或融合经历踝关节融合术的患者的踝骨。
在附图中示出了示例性实施方案,如下所示:
图1a、1b和1c是本文所述的三种示例性方法的步骤的流程图。
图2a、2b、2c、2d和2e是在根据本发明的方法中使用的根据本发明的用于本文所述的方法的包含四个容器(一个包含三种组分中的每种,一个用于最终混合物)、连接装置和适配器的部件的试剂盒的示例性实施方案的示意图。
图3a、3b、3c和3d是用于本文所述的方法的包含三个容器(一个包含三种组分中的每种)和适配器的部件的试剂盒的示例性实施方案的示意图。
图4a、4b、4c和4d是用于本文所述的方法的包含三个容器(一个包含三种组分中的每种)和连接装置的部件的试剂盒的示例性实施方案的示意图。任选地,该试剂盒还包含一个或两个空容器和第二连接装置(任选地为适配器),用于进一步混合这三种组分。
图5a、5b、5c、5d、5e、5f和5g是包含第一容器和第二容器的部件的试剂盒的示例性实施方案的示意图,所述第一容器包含第一和第三组分或第二和第三组分的混合物,所述第二容器仅包含第一组分或仅包含第二组分。试剂盒还包含用于本文所述方法的连接装置和任选的第二连接装置,例如适配器。任选地,该试剂盒还包含一个或两个空容器(16和17)和第二连接装置(例如适配器),用于进一步混合这三种组分。
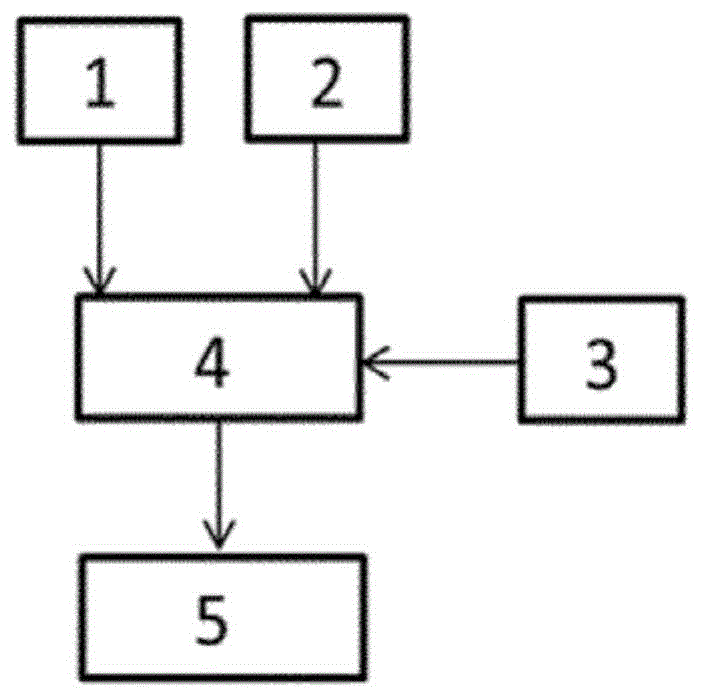
图1显示了用于制备本文所述的纤维蛋白基质的三种混合选项。在图1a中,提供了第一组分1和第二组分2。第一组分1包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体。第二组分包含凝血酶或凝血酶前体。将第一组分1和第二组分2混合在一起以获得混合物4。向混合物4中添加包含具有第一结构域和在第二结构域中的可共价交联的转谷氨酰胺酶底物结构域的融合肽的第三组分3,以形成纤维蛋白基质5。
在图1b和1c中,提供了混合组分的两种顺序。在图1b中,将第一组分1与第三组分3混合,得到混合物4′。向混合物4′中添加第二组分2,以形成纤维蛋白基质5。在图1c中,将第二组分2和第三组分3混合以获得混合物4″。向混合物4″中添加第一组分1,以形成纤维蛋白基质5。
与混合第一组分1、第二组分2和第三组分3的顺序无关,图1a、1b和1c中所有三种组分的混合时间不超过5天。
在图2a、2b、2c、2d和2e中,示出了部件的试剂盒及其在本文所述的方法中的用途。该试剂盒在图2a中示出并且包括包含第一组分的第一容器(11)和包含第二组分的第二容器(12)。还提供了包含第三组分的第三容器(13)。第一组分包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体。第二组分包含凝血酶或凝血酶前体。第三组分包含pth融合肽,例如tgp1pth1-34,其中pth1-34是截短形式的pth的活性因子,p1是纤溶酶切割位点,tg是在第二结构域中的可共价交联的转谷氨酰胺酶底物。试剂盒还包括具有三个槽14′、14″和14″′的连接装置14,三个容器11、12和13可以连接到该槽,如图2b-2d中进一步所述。另外,可以提供空容器16和第二连接装置,如适配器15。
在图2b中,提供了连接容器的第一方式。容器11和12通过相应的槽14′和14″直接地连接到连接装置14。容器13借助诸如适配器15的第二连接装置连接到连接装置的槽14″′。通过同时将容器11和12的内容物推入连接装置14并通过适配器15,将第一和第二组分的混合物转移到包含在容器13中的第三组分中。
在图2c中,提供了连接容器的第二种方式。容器11和13通过相应的槽14′和14″直接地连接到连接装置14。容器12借助诸如适配器15的第二连接装置连接到连接装置的槽14″′。通过同时将容器11和13的内容物推入连接装置14并通过适配器15,将第一组分和第三组分的混合物转移到包含在容器12中的第二组分中。
在图2d中,提供了连接容器的第三种方式。容器12和13通过相应的槽14′和14″直接地连接到连接装置14。容器11借助诸如适配器15的第二连接装置连接到连接装置的槽14″′。通过同时将容器12和13的内容物推入连接装置14并通过适配器15,将第二组分和第三组分的混合物转移到包含在容器11中的第一组分中。
应当理解,图2b中的容器11和12、图2c中的容器11和13以及图2d中的容器12和13可以在单独装置中以两个隔室的形式提供,例如以双筒注射器的形式。图2b-2d中所示的各个容器可以通过第二连接装置,例如图2b-2d中所示的适配器15,间接地连接到槽14″′。供选择地,连接装置14的槽14″′可以包含第二连接装置,例如适配器,以允许其直接与相应的容器连接。而且,图2b-2d中所示的设置可以部分地或完全地预组装在试剂盒中提供。
图2e描绘了进一步混合三种组分的方法。可以需要或可以不需要这种进一步的混合。图2e中描绘的方法描绘了一种但不是唯一的进一步混合的方法。在该方法中,将连接装置14替换为空容器16并通过向包含三种组分的混合物的容器(在图2b中描述的用于混合方法的容器13、在图2c中描述的用于混合方法的容器12和在图2d中描述的用于混合方法的容器11)施加压力,其内容物被压入容器16中以允许所有组分更好地混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高三种组分的混合物的均匀性。
最后,将包含用于形成纤维蛋白基质的最终混合物的容器(即容器11、12、13或16,取决于所使用的方法)从适配器15移出,并将其内容物原位施加在身体内或身体上或身体外部。
在图2b-2e中,可以使用柱塞或用于将内容物推出容器的任何其他合适的机构来排出容器的内容物。
在图3a、3b、3c和3d中示出了部件的试剂盒及其在本文所述的方法中的用途。图3a示出的试剂盒包括包含第一组分的第一容器(11)和包含第二组分的第二容器(12)。还提供了包含第三组分的第三容器(13)。第一组分包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体。第二组分包含凝血酶或凝血酶前体。第三组分包含pth融合肽,例如tgp1pth1-34,其中pth1-34是截短形式的pth的活性因子,p1是纤溶酶的切割位点,tg是在第二结构域中的可共价交联的转谷氨酰胺酶底物。该试剂盒进一步包括连接装置,例如适配器15。
在图3b中,提供了用于混合容器的内容物的第一方法。容器11和13与诸如适配器15的连接装置连接。容器11的内容物被转移到容器13(反之亦然),导致两个容器的内容物混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高两种组分的混合物的均匀性。然后,将包含第一和第三组分的混合物的容器(即容器11或容器13)用适配器15连接到容器12,并将第一和第三组分的混合物与第二组分混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高三种组分的混合物的均匀性。最后,将包含用于形成纤维蛋白基质的最终混合物的容器从适配器15移出,并将其内容物原位施加在身体内或身体上或身体外部。
在图3c中,提供了用于混合容器的内容物的第二种方法。容器11和12与诸如适配器15的连接装置连接。容器11的内容物被转移到容器12中(反之亦然),导致两个容器的内容物混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高两种组分的混合物的均匀性。然后,将包含第一和第二组分的混合物的容器(即容器11或容器12)用适配器15连接到容器13,并将第一和第二组分的混合物与第三组分混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高三种组分的混合物的均匀性。最后,将包含用于形成纤维蛋白基质的最终混合物的容器从适配器15移出,并且将其内容物原位施加在身体内或身体上或身体外部。
在图3d中,提供了用于混合容器的内容物的第三种方法。容器12和13与诸如适配器15的连接装置连接。容器12的内容物被转移到容器13中(反之亦然),导致两个容器中的内容物混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高两种组分的混合物的均匀性。然后,将包含第二和第三组分的混合物的容器(即容器11或容器13)用适配器15连接到容器11,并将第二和第三组分的混合物与第一组分混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高三种组分的混合物的均匀性。最后,将包含用于形成纤维蛋白基质的最终混合物的容器从适配器15移出,并且将其内容物原位施加在身体内或身体上或身体外部。
在图3b-3d中,可以使用柱塞或用于排放容器的任何其他合适的机构来排出容器的内容物。应当理解,图3b-3d所示的设置可以部分地或完全地预组装在试剂盒中提供。
在图4a、4b、4c和4d中示出了部件的试剂盒及其在本文所述的方法中的用途。图4a示出的试剂盒包括包含第一组分的第一容器(11)、包含第二组分的第二容器(12)和包含第三组分的第三容器(13)。第一组分包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体。第二组分包含凝血酶或凝血酶前体。第三种组分包含pth融合肽,例如tgp1pth1-34,其中pth1-34是截短形式的pth的活性因子,pl是纤溶酶的切割位点,tg是在第二结构域中的可共价交联的转谷氨酰胺酶底物。
该试剂盒还包括具有三个槽(14′、14″和14″′)和第四槽14″″的连接装置14,三个容器11、12和13可以连接到所述三个槽,而空容器可以直接或间接地连接到第四槽14″″,或者第四槽可以用来释放三种组分的混合物,如图4b所描绘的。此外,可以提供一个或两个空容器16和/或17以及第二连接装置,例如适配器15,用于进一步混合这三种组分。
在图4b中,提供了用于混合容器的内容物的方法。容器11、12和13通过相应的槽14′、14″和14″′直接连接到连接装置14。通过同时将容器11、12和13的内容物推入连接装置14中,混合第一、第二和第三组分。用于形成纤维蛋白基质的最终混合物可以通过槽14″″原位施加在身体内或身体上或身体外部。可以使用柱塞或用于将内容物推出容器的任何其他合适的机构来排出容器的内容物。
图4c描绘了用于进一步混合三种组分的方法。可以需要或可以不需要这种进一步的混合,并且图4c中描绘的方法描绘了一种但不是唯一的进一步混合的方法。在该方法中,使用第二连接装置,例如适配器15,将空容器16连接到槽14″″,并且通过对容器11、12和13施加压力,将它们的内容物通过连接装置14转移到容器16。可以将包含三种组分的混合物的容器16从连接装置中移出,并用于施加最终的混合物以形成纤维蛋白基质。用于形成纤维蛋白基质的最终混合物可以通过容器16中的开口原位施加在身体内或身体上或身体外部。可以使用柱塞或用于将内容物推出容器的任何其他合适的机构来排出容器的内容物。
任选地,如图4d所示,将连接装置从适配器移出,然后将空容器17与适配器15连接。因此,容器16附接到适配器15的一端,而容器17附接到适配器15的相对端。如箭头所示,通过在两个连接容器之间来回推动混合物,可以提高三种组分的混合物的均匀性。最后,将包含用于形成纤维蛋白基质的最终混合物的容器(容器16或容器17)从适配器15移出,并将其内容物原位施加在身体内或身体上或身体外部。
应当理解,图4a和4b中的容器11、12和13可以作为三筒注射器提供。如图4c所示,空容器16可以通过适配器15间接地连接到14″″,或者连接装置14的槽14″″本身可以被适当地配置成将容器16直接地连接到接连装置的槽14″′。此外,图4b所示的设置可以部分地或全部地预组装在试剂盒中提供。
在图5a、5b、5c、5d、5e、5f和5g中示出了部件的试剂盒及其在本文所述的方法中的用途。在图5a和5b中示出了试剂盒的不同形式。5a示出了第一试剂盒,其包括第一容器18和第二容器19,该第一容器18包含第一和第三组分(1/3)的混合物,该第二容器19包括第二组分(2)。第一组分包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体。第二组分包含凝血酶或凝血酶前体。第三组分包含pth融合肽,例如tgplpth1-34,其中pth1-34是截短形式的pth的活性因子,p1是纤溶酶的切割位点,tg是在第二结构域中的可共价交联的转谷氨酰胺酶底物。该试剂盒还可以包括具有三个槽(14′、14″和14″′)的连接装置14,其中两个容器18和19可以连接到其中两个槽(14′、14″),并且空容器16可以直接或间接地连接到第三槽14″′,或者第三槽14″′可以用于释放三种组分的混合物,如图5c进一步所述。另外,可以提供一个或两个空容器16和17以及第二连接装置,例如适配器15,以用于混合或进一步混合组分,如图5d和5g所概述的。
图5b示出了第二试剂盒,其包括包含第一组分(1)的第一容器19和包含第二组分和第三组分(2/3)的混合物的第二容器18。第一组分包含纤维蛋白原或纤维蛋白原前体和转谷氨酰胺酶或转谷氨酰胺酶前体。第二组分包含凝血酶或凝血酶前体。第三组分包含pth融合肽,例如tgplpth1-34,其中pth1-34是截短形式的pth的活性因子,p1是纤溶酶的切割位点,tg是在第二结构域中的可共价交联的转谷氨酰胺酶底物。该试剂盒还可以包括具有三个槽(14′、14″和14″′)的连接装置14,其中两个容器18和19可以连接到其中两个槽(14′、14″),并且空容器可以直接或间接地连接到第三槽14″′,或者第三槽14″′可以用来释放三种组分的混合物,如图5c和5e进一步所述。另外,可以提供一个或两个空容器16和17以及第二连接装置,例如适配器15,以用于混合或进一步混合组分,如图5f和5g所示。
在图5c中,提供了用于混合图5a中示出的试剂盒的容器的内容物的第一方法。包含混合物(1/3)的容器18和包含第二组分(2)的容器19通过相应的槽14′和14″直接地连接到连接装置14。通过同时将容器18和19的内容物推入装置第一连接装置14中,混合第一、第二和第三组分。用于形成纤维蛋白基质的最终混合物可以通过槽14″′在身体内或身体上或身体外部原位施加。供选择地,可以如图5g中所述在施加之前进一步混合这三种组分。
在图5d中,提供了用于混合图5a中所示的试剂盒的容器的内容物的第二种方法。使用诸如适配器15的连接装置将包含混合物(1/3)的容器18和包含第二组分(2)的容器19彼此直接连接。将容器18的内容物转移到容器19(或反之亦然),导致两个容器的内容物的混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高三种组分的混合物的均匀性。最后,将包含用于形成纤维蛋白基质的最终混合物的容器从适配器15移出,并且将其内容物原位施加在身体内或身体上或身体外部。
在图5e中,提供了用于混合图5b中所示的试剂盒的容器的内容物的第一方法。包含混合物(2/3)的容器18和包含第一组分(1)的容器19通过相应的槽14′和14″直接连接到连接装置14。通过同时将容器18和19的内容物推入连接装置14中,混合第一、第二和第三组分。用于形成纤维蛋白基质的最终混合物可以通过槽14″′原位施加在身体内或身体上或身体外部。供选择地,在施加之前可以进一步混合这三种组分,如图5g中所述。
在图5f中,提供了用于混合图5b所示的试剂盒的容器的内容物的第二种方法。使用诸如适配器15的连接装置将包含混合物(2/3)的容器18和包含第一组分(1)的容器19彼此直接连接。容器18的内容物被转移到容器19(或反之亦然),导致两个容器的内容物混合。如箭头所示,可以通过在两个连接的容器之间来回推动混合物来提高三种组分的混合物的均匀性。最后,将包含用于形成纤维蛋白基质的最终混合物的容器从适配器15移出,并且将其内容物原位施加在身体内或身体上或身体外部。
图5g描绘了用于进一步混合使用图5c和5e所示的方法产生的三种组分的方法。可以需要或可以不需要这种进一步的混合,并且图5g中描绘的方法描绘了一种但不是唯一的进一步混合的方法。在该方法中,使用第二连接装置,例如适配器15,将空容器16连接到槽14″′,并且通过对用于图5c所示的方法或用于图5e所示的方法的容器118和19施加压力,将它们的内容物通过第一连接装置14转移到容器16。然后,将第一连接装置14从适配器15移出,并将空容器17在其原位连接到适配器15。因此,包含三种组分的混合物的容器16的一端连接到第二连接装置,例如适配器15,并且第二连接装置(例如适配器15)在其相对端连接到空容器17。如箭头所示,通过在两个连接的容器之间来回推动混合物,可以提高三种组分的混合物的均匀性。最后,将包含用于形成纤维蛋白基质的最终混合物的容器从适配器15移出,并将其内容物原位施加在身体内或身体上或身体外部。
应当理解,图5a和5b中的容器18和19可以作为双筒注射器提供。空容器16可以用第二连接装置(例如适配器15)间接地连接到14″′,如图5g所示,或者供选择地,连接装置14的槽14″′本身可以适当地被配置成将容器16直接连接到槽14″′。此外,图5c-5g中所示的设置可以部分地或完全地预组装在试剂盒中提供。
可以使用柱塞或用于将内容物推出容器的机构的任何其他合适的机构来排出容器的内容物。
实施例
实施例1:室温下储存的纤维蛋白原中tgplpth1-34随时间的稳定性
为了评估纤维蛋白原组分中tgplpth1-34随时间的稳定性,将tgplpth1-34与纤维蛋白原溶液混合并在室温下储存。
将tgplpth1-34以266μg/ml的浓度加入到纤维蛋白原溶液中,并在室温下孵育最多34天。在指定的时间点取样并通过hplc测定tgplpth1-34浓度。简而言之,使用hplc-uv方法,使用zorbaxagilentrp18色谱柱(4.6x150mmm,5μm,300a)对tgplpth1-34进行定量,以分离相关物质。使用洗脱剂a:0.1%tfa,1%acn的水溶液,和洗脱剂b:在0.1%tfa的acn溶液。梯度为0分钟26%b;15分钟38%b;18分钟90%b;22分钟26%b;24分钟26%b。进样量为20μl,流速为1ml/min。柱温为35℃。使用参考标准用于校准曲线。
表2显示了在室温(20-25℃)下储存最多34天的纤维蛋白原中tgplpth1-34稳定性分析的结果。
表2
如表2所示,当在室温下暴露于纤维蛋白原溶液时,tgplpth1-34迅速降解。在制备纤维蛋白封闭剂所需的时间范围(3-5天)内,已经有4.3%-7.8%的产品降解。5天后,降解产品的量达到最终产品应用可接受范围之外的水平。在用于制备纤维蛋白封闭剂的过程中,tgplpth1-34不能与纤维蛋白原混合并在混合后超过5天使用。
实施例2:使用不同的制备方法,tgplpth1-34共价结合到纤维蛋白的比较
使用间接分析测定在用两种不同方法制备的纤维蛋白基质中测定共价结合到纤维蛋白基质的tgplpth1-34的百分比。通过该分析,测定可以从基质中洗去的非共价结合的tgplpth1-34。在第一种方法(预混合)中,将纤维蛋白封闭剂
在第二种方法中,将两种纤维蛋白封闭剂组分与溶解在水中的tgplpth1-34直接混合,以达到1mg/ml的最终浓度(见图1a)。
为了评估用两种方法共价结合到纤维蛋白基质的tgplpth1-34的量,对通过两种方法中的任一种制备的样品进行保留分析。将50μl等分试样加入到1.5mleppendorf管中。然后将纤维蛋白基质在37℃下孵育1小时。通过添加补充了蛋白酶抑制剂(rochecat#11836153001completetm,miniproteaseinhibitorco)的1.5ml的提取缓冲液(50mmtrisph9.4,1mnacl,0.1%tween20)并在持续振摇下孵育,从纤维蛋白基质中提取未结合的tgplpth1-34。3小时后,收集上清液,并将1.5ml新鲜的提取缓冲液加入到纤维蛋白基质中。在6、24、30和48小时后重复该提取步骤。将收集的上清液储存在-20℃下直至进一步处理。
为了测定未结合的tgplpth1-34的量,将5份收集的上清液解冻并合并。遵循制造商的建议,使用商业pth1-34elisa试剂盒(immutopics,cat*60-3900)通过elisa测定合并物中的tgplpth1-34。两种制备方法均进行了两个独立的实验(每种纤维蛋白基质和实验三份样品),并测定了未结合到纤维蛋白基质的tgplpth1-34的量。这些实验的结果示出于表3中。
表3:在使用不同的方法制备的纤维蛋白基质中未结合的tgplpth1-34%
如表3所示,令人惊讶地发现,使用两种方法都有非常相似的量未结合到纤维蛋白基质上。因此,两种混合方法均导致tgplpth1-34与纤维蛋白基质的相似结合。
序列表
<110>库罗斯生物外科股份公司
<120>用于制备纤维蛋白基质的方法和试剂盒
<130>fic20210055p
<150>u.s.s.n.62/640,814
<151>2018-03-09
<160>15
<170>siposequencelisting1.0
<210>1
<211>5
<212>prt
<213>homosapiens
<400>1
glyalalysaspval
15
<210>2
<211>4
<212>prt
<213>homosapiens
<400>2
lyslyslyslys
1
<210>3
<211>16
<212>prt
<213>homosapiens
<400>3
tyrargglyaspthrileglygluglyglnglnhishisleuglygly
151015
<210>4
<211>8
<212>prt
<213>homosapiens
<400>4
asnglngluglnvalserproleu
15
<210>5
<211>6
<212>prt
<213>homosapiens
<400>5
leuilelysmetlyspro
15
<210>6
<211>6
<212>prt
<213>homosapiens
<400>6
asnphelysserglnleu
15
<210>7
<211>8
<212>prt
<213>homosapiens
<220>
<221>mod_res
<222>(1)..(1)
<223>乙酰化
<400>7
glyproleualaleuthralaleu
15
<210>8
<211>6
<212>prt
<213>homosapiens
<220>
<221>mod_res
<222>(1)..(1)
<223>乙酰化
<220>
<221>mod_res
<222>(6)..(6)
<223>胺化
<400>8
prophegluleuargala
15
<210>9
<211>5
<212>prt
<213>homosapiens
<220>
<221>mod_res
<222>(4)..(4)
<223>胺化
<400>9
glxalaalapheala
15
<210>10
<211>8
<212>prt
<213>homosapiens
<400>10
glyproleuglyilealaglypro
15
<210>11
<211>8
<212>prt
<213>homosapiens
<400>11
prohistyrglyargserglygly
15
<210>12
<211>9
<212>prt
<213>homosapiens
<400>12
proglyserglyargseralasergly
15
<210>13
<211>4
<212>prt
<213>homosapiens
<400>13
tyrlysasnarg
1
<210>14
<211>46
<212>prt
<213>artificialsequence
<220>
<221>similar
<222>(1)..(46)
<223>合成融合蛋白
<400>14
asnglngluglnvalserproleutyrlysasnargservalserglu
151015
ileglnleumethisasnleuglylyshisleuasnsermetgluarg
202530
valglutrpleuarglyslysleuglnaspvalhisasnphe
354045
<210>15
<211>42
<212>prt
<213>artificialsequence
<220>
<221>similar
<222>(1)..(42)
<223>合成融合蛋白
<400>15
asnglngluglnvalserproleuservalsergluileglnleumet
151015
hisasnleuglylyshisleuasnsermetgluargvalglutrpleu
202530
arglyslysleuglnaspvalhisasnphe
3540
- 还没有人留言评论。精彩留言会获得点赞!