线粒体基因组的遗传修饰
线粒体基因组的遗传修饰
相关申请的交叉引用
1.本申请要求2018年3月21日提交的美国临时申请号62/646,156的权益,将其披露内容通过引用以其整体特此并入。
技术领域
2.本公开文本涉及基因组工程化,尤其是线粒体基因组(mtdna)的靶向修饰的领域。
背景技术:
3.线粒体疾病是遗传上多种多样的一类遗传性多系统障碍(经常影响需要最大量的能量的器官,诸如心脏、大脑、肌肉和肺),其大部分通过线粒体dna(mtdna)的突变传播,影响大约1/5,000的成年人。参见例如,gorman等人(2015)ann neurol 77:753
‑
759。到目前为止已经表征了至少250个致病性mtdna突变(tuppen等人(2010)biochem biophys acta 1797:113
‑
128),并且这些突变似乎在若干种类型的人类疾病中发挥作用。人mtdna是小的双链多拷贝基因组,以约100
‑
10,000个拷贝/细胞存在。在疾病状态中,突变的mtdna经常与野生型mtdna在被称为“异质性”的现象(由多个线粒体通过卵细胞的母系遗传导致)中共存。因为突变体mtdna通常在功能上是隐性的,所以突变的mtdna的存在通过野生型基因组促进,并且由异质性mtdna突变导致的病症的疾病严重性与突变负荷相关。参见例如,gorman等人(2016)nat rev dis primers 2:16080。阈值效应(其中必须在症状显现之前超过>60%的突变体mtdna负荷)是异质性mtdna疾病的明确特征,并且将异质性比率偏移至低于此阈值的尝试驱动了关于治疗这些不可治愈且基本上不可治疗的障碍的许多研究。
4.一个这种方法依赖于使用线粒体靶向锌指核酸酶(mtzfn)以及其他基因组工程化工具进行的mtdna的定向核溶解。参见例如,srivastava等人(2001)hum mol genet 10:3093
‑
3099(2001);bacman等人(2013)nat med 19:1111
‑
1113;gammage等人(2014)embo mol med 6:458
‑
466;reddy等人(2015)cell 161:459
‑
469;gammage等人(2016)nucleic acids res 44:7804
‑
7816;gammage等人(2018)trends gene 34(2):101)。因为哺乳动物线粒体缺乏有效的dna双链断裂(dsb)修复途径,所以将dsb选择性引入到突变体mtdna中导致这些分子通过不完全表征的机制而快速降解。因为mtdna拷贝数维持在细胞类型特定的稳态水平下,所以选择性消除突变体mtdna刺激剩余的mtdna池的复制,从而引起异质性比率的偏移。已经显示用于将zfn递送到培养细胞中的线粒体的方法能够产生较大的异质性偏移,其导致患者来源的细胞培养物的表型救援。参见例如,minczuk等人(2006)proc natl acad sci u s a 103:19689
‑
19694(2006);minczuk等人(2010)nat protoc 5:342
‑
356;minczuk等人,(2008)nucleic acids res 36:3926
‑
3938;gaude等人(2018)mol cell 69:581
‑
593;美国专利号9,139,628。
5.虽然初始描述了与20世纪80年代后期出现的人类疾病相关的mtdna突变(参见例如,holt等人(1988)nature 331:717
‑
719;wallace等人(1988)science 242:1427
‑
1430;wallace等人(1988)cell 55:601
‑
610),但是在其间的数十年中对于异质性线粒体疾病的
有效治疗一直未出现。通过线粒体替代疗法预防mtdna突变的传递已经受到关注(参见例如,craven等人(2010)nature 465:82
‑
85;tachibana等人(2013)nature 493:627
‑
631;hyslop等人(2016)nature 534:383
‑
386;kang等人(2016)nature 540:270
‑
275),但是鉴于mtdna瓶颈的性质(floros等人(2018)nat cell biol 20:144
‑
151)、异质性线粒体疾病呈现(vafai等人(2012)nature 491:374
‑
383)以及大部分新病例中线粒体疾病的家族史的后续缺失,线粒体替代可能仅具有有限的用途。另外,用于治疗线粒体疾病的分子途径未提供针对异质性线粒体疾病的临床相关疗法。参见例如,viscomi等人(2015)biochim biophy acta 1 847:544
‑
557;pfeffer等人(2013)nat rev neurol 9:474
‑
481。
6.因此,仍然需要用于mtdna基因修饰,尤其是mtdna的异质性偏移的另外的方法和组合物以提供通过减少突变体线粒体序列的量治疗多种遗传来源的线粒体疾病的通用治疗剂。
技术实现要素:
7.本发明描述了用于基因疗法和基因组工程化的组合物和方法。具体地,所述的方法和组合物涉及内源线粒体基因组(突变体或野生型)的核酸酶介导的基因组修饰(例如,一个或多个插入和/或缺失)。所述线粒体基因组可以针对致病突变的靶向校正,包括通过以下方式来改变:在患有线粒体疾病的受试者中,包括在一个或多个特定组织和/或器官中(例如在心脏组织中)的突变体与野生型mtdna的比率的核酸酶介导的偏移,所述核酸酶介导的偏移导致靶向组织的表型逆转为野生型(例如,分子和生物化学表型)。此逆转通过异质性偏移发生,其中通过以下方式改变突变体与野生型mtdna的比率:切割所述突变体序列,使得在不存在有效dna修复机制的情况下(如在线粒体中),疾病相关的所述突变体mtdna在通过靶向核酸酶进行的选择性切割之后降解。
8.因此,所述一种或多种基因组修饰(例如,异质性偏移)可以包括切割,接着是降解所切割的mtdna序列,并且这些遗传修饰和/或包含这些修饰的细胞可以在离体或体内方法中使用。
9.因此,本文描述了包含左锌指核酸酶和右锌指核酸酶(zfn)的锌指核酸酶用于治疗有需要的受试者的线粒体障碍的用途(或包含所述锌指核酸酶的药物组合物),其中一个zfn配偶体包含切割结构域和与突变体线粒体dna(突变体mtdna)中的靶位点结合的锌指蛋白(zfp),并且另一个zfn配偶体包含切割结构域和与野生型线粒体dna(mtdna)或突变体mtdna(突变体mtdna)中的靶位点结合的锌指蛋白(zfp),使得所述受试者中的突变体mtdna减少或消除(例如,使野生型与突变体mtdna的异质性比率偏移)。在一些实施方案中,所述右zfp和左zfp两者均与突变体mtdna中的靶标结合,而在其他实施方案中,一个zfn配偶体与野生型mtdna结合并且另一个zfn配偶体与突变体mtdna结合。在其他实施方案中,与所述野生型mtdna结合的zfn是所述左zfn,而所述右zfn与所述突变体mtdna结合,或者所述右zfn与所述野生型mtdna结合,而所述左zfn与所述突变体mtdna结合。还描述了通过在有需要的受试者中表达本文所述的zfn来治疗所述受试者的线粒体障碍的方法。在本文所述的用途或方法中的任一种中,所述突变体mtdna包含以下突变中的一种或多种:5024c>t、1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c
和/或14709c。在某些实施方案中,所述锌指核酸酶由一种或多种多核苷酸(例如,编码所述左zfn和右zfn的单独多核苷酸或编码左zfn和右zfn两者的同一多核苷酸)编码,所述一种或多种多核苷酸包括但不限于由一种或多种aav载体携带的一种或多种多核苷酸。所述受试者可以是人受试者,并且所述mtdna可以在所述受试者的任何组织中。在一些实施方案中,所述mtdna可以在所述受试者的大脑、肺和/或肌肉中。所述zfn和/或多核苷酸可以通过任何合适的手段(包括静脉内注射)来给予。在其中所述突变体mtdna包含5024c>t突变的实施方案中,所述左zfp可以与seq id no:33内的靶位点结合,并且所述右zfp可以与seq id no:34内的靶位点结合,包括但不限于这样的zfn,其中所述左zfn包含被命名为wtm1/48960的zfp,并且所述右zfn包含被命名为mtm62/48962、mtm24/51024、mtm25/51025、mtm26/51026、mtm27/51027、mtm28/51028、mtm29/51029、mtm30/51030、mtm32/51032、mtm33/51033、mtm36/51036、mtm37/51037、mtm39/51039、mtm42/51042、mtm43/51043或mtm45/51045的zfp。
10.还描述了一种包含左锌指核酸酶和右锌指核酸酶(zfn)的锌指核酸酶,其中所述左zfn包含切割结构域和与seq id no:33内的野生型线粒体dna中的靶位点结合的锌指蛋白(zfp),并且所述右zfn包含切割结构域和与seq id no:34或seq id no:35内的突变体线粒体dna中的靶位点结合的zfp。在某些实施方案中,所述zfn由一种或多种多核苷酸(例如,由aav载体携带)编码。还描述了包含如本文列出的核酸酶和/或多核苷酸的细胞(例如,心脏、大脑、肺和/或肌肉细胞),包括这样的细胞,其中所述细胞中位置5024处的突变体mtdna减少或消除,以及由这些细胞演变而来的细胞、细胞系和部分或完全分化的细胞(可能不包含zfn或编码zfn的多核苷酸)。还提供了包含一种或多种锌指核酸酶;一种或多种多核苷酸和/或如本文所述的细胞的药物组合物。
11.在一方面,本文公开了用于使用一种或多种核酸酶进行mtdna基因的靶向修饰的方法和组合物。核酸酶(例如工程化大范围核酸酶、锌指核酸酶(zfn)(术语“zfn”包含zfn对)、tale
‑
核酸酶(包含tale效应子结构域与来自限制性核酸内切酶和/或来自大范围核酸酶的核酸酶结构域的融合物的talen(诸如大范围tale和紧密型talen)(术语“talen”包含talen对)))、ttago系统和/或crispr/cas核酸酶系统用于切割线粒体基因组,通常是突变体线粒体基因组处的dna,使得异质性(如野生型与突变体线粒体基因组之间的异质性)偏移并且突变体mtdna的量减少。靶标(例如,突变体mtdna)可以在切割之后失活,因为mtdna中的双修复途径是无效的,并且因此突变体mtdna(其中野生型mtdna未被切割)的选择性切割导致突变体mtdna的快速降解以及野生型与突变体mtdna的异质性比率的相应偏移。本文所述的核酸酶可以诱导所述靶dna中的双链断裂(dsb)或单链断裂(切口)。在一些实施方案中,使用两种切口酶通过引入两个切口来产生dsb。在一些情况下,所述切口酶是zfn,而在其他情况下,所述切口酶是talen或crispr/cas切口酶。本文所述的任何核酸酶(例如,zfn、talen、crispr/cas等)可以特异性地靶向靶突变体mtdna,包括例如表2所示的靶序列,包括例如包含所述野生型或突变体序列的9至20个或更多个(9、10、11、12、13、14、15、16、17、18、19、20个或更多个)连续或非连续核苷酸的靶位点。任何突变体可以被所述dna结合结构域靶向,所述突变体包括但不限于m.5024c>t。例如,与mtdna突变相关的人类疾病的非限制性组包括kearns
‑
sayre综合征(kss;进行性肌病、眼肌麻痹、心肌病);cpeo:慢性进行性眼外肌麻痹;以及皮尔逊综合症(pearson syndrome)(全血细胞减少症、乳酸酸中毒),其中全部
三种疾病与所述线粒体基因组中单个大缺失(大约5kb)相关。其他与突变体线粒体相关的人类疾病是melas(肌病、脑病、乳酸酸中毒和中风样发作),其与trnl1基因中的3243a>g突变(在本文中也被称为a3243g或3243g)和/或3271t>c突变(在本文中也被称为t3271c或3271c)或nd1和nd5中的偶发突变相关;merrf(伴随破碎红纤维的肌阵挛性癫痫、肌病),其与trnk基因中的8344a>g和/或8356t>c突变(在本文中被称为a8344g或8344g/t8356c或8356c)相关;narp(神经病、共济失调、视网膜色素变性),其与atp6基因中的8993t>g突变(在本文中被称为t8993g或8993g)相关;mils(进行性脑干病,也被称为母系遗传的leigh综合征),其也与atp6中的8993t>g/c突变(在本文中被称为t8993g、t8993c、8993g、8993c)和/或9176t>g/c突变(在本文中被称为t9176g、t9176c、9176g、9176c)相关;midd(糖尿病、耳聋),其与trnl1基因中的3243a>g突变(在本文中被称为a3243g或3243g)相关;lhon(视神经病变),其与nd1中的3460g>a突变(在本文中被称为g3460a或3460a)、nd4中的11778g>a突变(在本文中被称为g11778a或11778a)和/或nd6基因中的14484t>c突变(在本文中被称为t14484c或14484c)相关;肌病和糖尿病,其与trne基因中的14709t>c突变(在本文中被称为t14709c或14709c)相关;感音神经性聋和耳聋,其与rnr1基因中的1555a>g突变(在本文中被称为a1555g或1555g)和trns1基因中的偶发突变相关;运动耐受不良,其与cyb基因中的偶发突变相关;以及致死性婴儿脑病leigh/leigh样综合征,其与nd3基因中的10158t>c突变(被称为t10158c或10158c)和/或10191t>c突变(被称为t10191c或10191c)和/或10197g>a突变(被称为g10197a或10197a)相关。mtdna中的其他突变包括nd6基因中的14709t>c突变(被称为t14709c或14709c);nd6基因中的14459g>a和/或14487t>c突变(在本文中被称为g14459a或14459a和t14487c或14487c)和/或nd4基因中的11777c>a突变(被称为c11777a或11777a)和/或与leigh综合征相关的1624c>t突变(被称为c1624t或1624t);nd5基因中的13513g>a突变(被称为g13513a或13513a);7445a>g突变(被称为a7445g或7445g)和/或与耳聋和肌病相关的在7472处的插入;与多系统障碍相关的5545c>t突变(被称为c5545t或5545t)以及与心肌病相关的4300a>g突变(被称为a4300g或4300g)。参见例如,greaves和taylor(2006)iubmb life 58(3):143
‑
151;taylor和turnbull(2005)nat rev genet 6(5):389
‑
402;以及tuppen等人(2010)同上)。所有的突变相对于野生型序列进行编号。
12.在一方面,本文描述了与mtdna基因组中的靶位点结合的非天然存在的锌指蛋白(zfp),其中所述zfp包含一个或多个工程化锌指结合结构域。在一个实施方案中,所述zfp是切割目的靶基因组区域的锌指核酸酶(zfn),其中所述zfn包含一个或多个工程化锌指结合结构域和核酸酶切割结构域或切割半结构域。切割结构域和切割半结构域可以例如从各种限制性核酸内切酶和/或归巢核酸内切酶获得,并且可以是野生型或工程化的(突变体)。在一个实施方案中,所述切割半结构域源自iis型限制性核酸内切酶(例如,foki)。在某些实施方案中,所述锌指结构域包含具有如表1的单行所示进行排序的识别螺旋结构域的锌指蛋白。包含这些锌指蛋白的核酸酶可以包括任何接头序列(例如,将其与切割结构域连接)和任何切割结构域(例如,二聚化突变体,例如eld突变体;在416、422、447、448和/或525中一个或多个处具有突变的foki结构域;和/或导致切口酶功能的催化结构域突变体)。参见例如,美国专利号8,703,489;9,200,266;8,623,618;和7,914,796;以及美国专利公开号20180087072。在某些实施方案中,所述zfn的zfp与表2所示序列内的9至18个或更多个核苷酸的靶位点结合。在某些实施方案中,所述zfn与突变体mtdna(与野生型mtdna相比)选择性
地结合,使得所述zfn选择性地切割突变体mtdna(与野生型mtdna的切割相比)。在其他实施方案中,所述zfn与包含以下突变中的一种或多种的突变体mtdna中的靶位点选择性地结合:相对于野生型序列进行编号的1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c或14709c,其中所述位置之后的核苷酸指示突变体序列。本文所述的任何zfn可以包含zfn对(例如,左和右),其中所述对中的一个成员与突变体mtdna序列结合,并且所述对中的另一个成员与野生型mtdna结合。可替代地,本文所述的zfn可以包含zfn对(左和右),其中两个zfn均与野生型mtdna结合,或两个zfn均与突变体mtdna结合。
13.在另一方面,本文描述了结合靶位点(例如,在mtdna中的包含表2所示的靶序列中的至少9或12个(例如,9至20个或更多个)核苷酸的靶位点)的转录激活因子样效应子(tale)蛋白,其中所述tale包含一个或多个工程化的tale结合结构域。在一个实施方案中,所述tale是切割目的靶基因组区域的核酸酶(talen),其中所述talen包含一个或多个工程化tale dna结合结构域和核酸酶切割结构域或切割半结构域。切割结构域和切割半结构域可以例如从各种限制性核酸内切酶和/或归巢核酸内切酶(大范围核酸酶)获得。在一个实施方案中,所述切割半结构域源自iis型限制性核酸内切酶(例如,foki)。在其他实施方案中,所述切割结构域源自大范围核酸酶,所述大范围核酸酶结构域也可以展现dna结合功能。在某些实施方案中,所述talen与突变体mtdna(与野生型mtdna相比)选择性地结合,使得所述talen选择性地切割突变体mtdna(与野生型mtdna的切割相比)。在其他实施方案中,所述talen与包含以下突变的靶位点选择性地结合:相对于野生型序列进行编号的1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c或14709c,其中所述位置之后的核苷酸指示突变体序列。本文所述的任何talen可以包含talen对(例如,左和右),其中所述对中的一个成员与突变体mtdna序列结合,并且所述对中的另一个成员与野生型mtdna结合。可替代地,如本文所述的talen可以包括talen对(左和右),其中两个talen均与野生型mtdna结合或两个talen均与突变体mtdna结合。
14.另一方面,本文描述了与mtdna中的靶位点结合的crispr/cas系统,其中所述crispr/cas系统包含一种或多种工程化单一指导rna或功能等同物以及cas9核酸酶。在某些实施方案中,所述单一指导rna(sgrna)与包含如表2示的靶位点的9个、12个或更多个连续核苷酸的序列结合。在某些实施方案中,所述sgrna与突变体mtdna(与野生型mtdna相比)选择性地结合,使得所述crispr/cas核酸酶选择性地切割突变体mtdna(与野生型mtdna的切割相比)。在其他实施方案中,所述crispr/cas系统与包含以下突变的靶位点选择性地结合:相对于野生型序列进行编号的1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c或14709c,其中所述位置之后的核苷酸指示突变体序列。本文所述的任何sgrna均可以与突变体或可替代地野生型mtdna选择性地结合。在使用sgrna对的情况下,一个或两个成员可以于野生型或突变体mtdna结合。
15.如本文所述的核酸酶(例如,zfn、crispr/cas系统、ttago和/或talen)可以结合至和/或切割mtdna的编码区或非编码区中的目的区域(例如像前导序列、尾随序列或内含子)
或在所述编码区的上游或下游的非转录区内的目的区域。所述靶位点的长度可以是9
‑
18个或更多个核苷酸,包括如表2所示的靶位点或在mtdna中涵盖1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c或14709c的靶位点。在某些实施方案中,所述核酸酶的dna结合结构域(zfp、tale、sgrna等)与突变体mtdna(与野生型mtdna的切割相比)选择性地结合。在一些实施方案中,所述一种或多种核酸酶的dna结合结构域与trnl1、nd1、nd5、trnk、atp6、nd4、nd6、trne、rnr1、trns、cyb、cytb、12srrna和/或nd3线粒体基因中的所选位置结合。
16.在另一方面,本文描述了编码一种或多种核酸酶(例如,本文所述的zfn、crispr/cas系统、ttago和/或talen)的一种或多种多核苷酸。在某些实施方案中,同一多核苷酸编码一种核酸酶(例如,成对核酸酶的左单体和右单体两者或crispr/cas系统的所有组分),而在其他实施方案中,单独多核苷酸用于所述核酸酶的组分(例如,第一多核苷酸编码成对核酸酶的一个成员(例如,左成员/单体)并且第二多核苷酸编码成对核酸酶的另一成员(例如,右单体/成员))。所述多核苷酸可以在病毒或非病毒载体中配制,所述载体包括但不限于aav、ad、逆转录病毒载体等,以及在mrna、质粒、微环dna等中配制。在某些实施方案中,所述载体被靶向至特定组织或器官,例如,aav载体被靶向至心脏(心脏组织)。在某些实施方案中,所述核酸酶是包含左zfn和右zfn的zfn,单独配制为aav载体组合物并且同时给予(例如,配制为包含两种aav载体的单一药物组合物)。
17.在另一方面,本文描述了一种zfn、crispr/cas系统、ttago和/或talen表达载体,其包含编码如本文所述的一种或多种核酸酶(例如,zfn、crispr/cas系统、ttago和/或talen)的与启动子可操作连接的多核苷酸。在一个实施方案中,所述表达载体是病毒载体(例如,aav载体)。在一方面,所述病毒载体展现出组织特异性嗜性。
18.在另一方面,本文描述了一种包含一种或多种核酸酶(例如,zfn、crispr/cas系统、ttago和/或talen)表达载体的宿主细胞。
19.在另一方面,提供了包含如本文所述的表达载体(例如,包含一种或多种核酸酶的一种或多种组分)的药物组合物。在一些实施方案中,所述药物组合物可以包含多于一种表达载体。在一些实施方案中,所述药物组合物包含具有第一多核苷酸的第一表达载体和具有第二多核苷酸的第二表达载体。在一些实施方案中,所述第一多核苷酸和所述第二多核苷酸是不同的。在一些实施方案中,所述第一多核苷酸和所述第二多核苷酸是基本上相同的。在某些实施方案中,所述药物组合物包含编码zfn对的左单体的第一aav载体和/或编码所述zfn对的右单体的第二aav载体。在某些实施方案中,所述药物组合物(例如,包含多核苷酸(诸如包含一个或两个单体的aav载体)的药物)的浓度在1x10
10
至1x10
14
(或其间的任一值)个载体基因组(vg)/细胞或受试者之间。在一些实施方案中,所述药物组合物的浓度是1x10
12
、5x10
12
或1x10
13
个vg/细胞或受试者(例如,通过尾静脉注射)。所述药物组合物适于向受试者递送,包括但不限于系统性、腹膜内、静脉内、肌内、粘膜或局部递送方法或其组合。所述药物组合物还可以包含供体序列(例如,编码在疾病或障碍诸如线粒体障碍中缺少或缺乏的蛋白质的转基因)。在一些实施方案中,所述供体序列与表达载体缔和。
20.在一些实施方案中,提供了包含dna结合结构域(例如,锌指蛋白或tale或sgrna或大范围核酸酶)和野生型或工程化切割结构域或切割半结构域的融合蛋白。
21.在另一方面,本文描述了包含一种或多种本文所述的核酸酶(例如,zfn、talen、ttago和/或crispr/cas系统)的组合物,所述核酸酶包括包含dna结合分子(例如,zfp、tale、sgrna等)和核酸酶(切割)结构域的核酸酶。在某些实施方案中,所述组合物包含与药学上可接受的赋形剂组合的一种或多种核酸酶。在一些实施方案中,所述组合物包含两组或更多组(对)核酸酶,每组具有不同的特异性。在其他方面,所述组合物包含不同类型的核酸酶。在一些实施方案中,所述组合物包含编码mtdna特异性核酸酶的多核苷酸,而在其他实施方案中,所述组合物包含mtdna特异性核酸酶蛋白。在某些实施方案中,所述组合物适于向受试者递送,包括经由系统性递送。
22.在另一方面,本文描述了一种编码本文所述的一种或多种核酸酶或核酸酶组分(例如,zfn、talen、ttago或crispr/cas系统的核酸酶结构域)的多核苷酸。所述多核苷酸可以是例如mrna或dna。在一些方面,所述mrna可以进行化学修饰(参见例如,kormann等人,(2011)nature biotechnology 29(2):154
‑
157)。在其他方面,所述mrna可以包含arca帽(参见美国专利号7,074,596;和8,153,773)。在另外的实施方案中,所述mrna可以包含未经修饰和经修饰的核苷酸的混合物(参见美国专利公开号2012/0195936)。在另一方面,本文描述了一种核酸酶表达载体,其包含编码本文所述的一种或多种zfn、talen、ttago或crispr/cas系统的与启动子可操作连接的多核苷酸。在一个实施方案中,所述表达载体是病毒载体,例如aav载体。
23.在另一方面,本文描述了一种包含如本文所述的一种或多种核酸酶、一种或多种核酸酶表达载体的宿主细胞。在某些实施方案中,所述宿主细胞包含其中突变体mtdna的量减少或消除,从而使所述细胞中的mtdna的异质性比率偏移(与野生型细胞相比)。在某些实施方案中,所述异质性比率朝向野生型(非突变体mtdna)偏移至少5%或更多,优选地至少10%或更多,并且甚至更优选地至少20%或更多。所述宿主细胞可以用一种或多种核酸酶表达载体稳定转化或瞬时转染或其任何组合。在其他实施方案中,所述一种或多种核酸酶表达载体在所述宿主细胞中表达一种或多种核酸酶。在另一个实施方案中,所述宿主细胞还可以包含外源多核苷酸供体序列。在本文所述的任何实施方案中,所述宿主细胞可以包括胚胎细胞,例如一种或多种小鼠、大鼠、兔或其他哺乳动物细胞胚胎(例如,非人灵长类动物)。在一些实施方案中,所述宿主细胞包括组织。还描述了由本文所述的细胞产生或演变而来的细胞或细胞系,包括包含mtdna的修饰(例如,mtdna的异质性比率)的多能、全能、多潜能或分化细胞。在某些实施方案中,本文描述了包含如本文所述的修饰的如本文所述的分化细胞,所述分化细胞由如本文所述的干细胞演变而来。在某些实施方案中,所述宿主细胞是心脏细胞或干细胞,例如造血干细胞或诱导型多能干细胞。
24.在另一方面,本文描述了一种用于在细胞中切割mtdna基因的方法,所述方法包括:(a)在使靶向mtdna的一种或多种核酸酶表达并切割所述mtdna的条件下,将编码所述一种或多种核酸酶的一种或多种多核苷酸引入所述细胞中。在某些实施方案中,与野生型mtdna相比,选择性地切割突变体mtdna。这导致突变体mtdna:野生型mtdna的异质性比率的偏移。任选地,所述方法还包括向所述细胞给予供体(例如,治疗性蛋白质),所述供体可以被整合到细胞的基因组中或mtdna中。一种或多种供体核酸酶的整合经由同源定向修复(hdr)或通过非同源末端接合(nhej)相关的修复发生。此外,可以使用递送系统中的任一种或组合(例如,非病毒载体、lnp或病毒载体)将所述一种或多种核酸酶编码多核苷酸和/或
供体引入所述细胞中。在某些实施方案中,使用对于某些细胞、组织和/或器官类型具有特异性的载体,例如对于心脏组织、脑组织、肺组织、肌肉组织等具有特异性的aav载体。在某些实施方案中,突变体mtdna的切割使异质性朝着野生型(例如,包括部分或完全恢复到野生型序列)序列偏移,从而治疗和/或预防有需要的受试者的线粒体疾病。在某些实施方案中,被切割并恢复为野生型的突变体mtdna包含点突变(例如,5024c>t)。
25.在本文所述的任何组合物或方法中,所述一种或多种多核苷酸可以按提供所需效应的任何浓度(剂量)来提供和/或递送。在优选实施方案中,所述一种或多种多核苷酸是使用腺相关病毒(aav)载体以10,000
‑
1x10
14
个或更多个载体基因组/细胞或受试者(或其间的任一值)来递送。在某些实施方案中,所述一种或多种多核苷酸是使用慢病毒载体以250与1,000之间(或其间的任一值)的moi来递送。在其他实施方案中,所述一种或多种多核苷酸是使用质粒载体以150
‑
1,500ng/100,000个细胞(或其间的任一值)来递送。在其他实施方案中,所述一种或多种多核苷酸是作为mrna以150
‑
1,500ng/100,000个细胞(或其间的任一值)来递送。在递送两个或更多个多核苷酸时,所述载体可以是相同的或不同的载体,并且相同的载体可以以任何比率,包括但不限于1:1比率递送。在某些实施方案中,使用两个aav载体以任何浓度/单体,包括但不限于1x10
10
至1x10
14
(或其间的任何值),任选地以5x10
12
个vg/单体递送成对核酸酶(例如,包含mtm25单体和wtm1单体的zfn)的组分。在某些实施方案中,单独单体的剂量或可替代地总剂量(两个单体)是1x10
12
、5x10
12
或1x10
13
个vg/细胞或受试者(例如,通过尾静脉注射)。在一些实施方案中,所述zfn以如下剂量给予:5e12个vg/kg的总aav剂量(例如,每个aav
‑
zfn单体的2.5e12个vg/kg);1e13个vg/kg的总aav剂量(例如,每个aav
‑
zfn单体的0.5e13个vg/kg);5e13个vg/kg的总aav剂量(例如,每个aav
‑
zfn单体的2.5e13个vg/kg);1e14个vg/kg的总aav剂量(例如,每个aav
‑
zfn单体的0.5e14个vg/kg);5e14个vg/kg的总aav剂量(例如,每个aav
‑
zfn单体的2.5e14个vg/kg);或1e15个vg/kg的总aav剂量(例如,每个aav
‑
zfn单体的0.5e15个vg/kg)。在某些实施方案中,所述aav通过静脉内注射来给予。
26.在又另一方面,本文提供了一种包含经遗传修饰的mtdna的细胞,例如通过减少和/或消除细胞中的突变体mtdna来改变野生型与突变体mtdna的异质性比率的细胞。在某些实施方案中,与来自患有线粒体障碍的受试者的细胞相比,所述细胞异质性比率降低。通过由对于mtdna的突变体形式具有特异性的核酸酶(例如,这样的核酸酶,其靶向至如表2所示或涵盖以下突变中的一种或多种的9
‑
20个或更多个碱基对的序列:1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c或14709c)切割突变体mtdna之后的降解,从所述细胞减少和/或消除所述突变体mtdna。促成降解的切割可以在所述一个或多个靶位点和/或一个或多个切割位点内和/或在所述靶序列的9
‑
18个或更多个碱基对的靶位点的边缘的1
‑
50个碱基对内。如本文所述的经修饰的细胞可以被分离或者可以在受试者,例如患有线粒体障碍的受试者内。
27.在本文所述的任何方法和组合物中,所述细胞可以是任何真核细胞。在某些实施方案中,所述细胞是分化细胞,例如心脏细胞、脑细胞、肝细胞、肾细胞、肌肉细胞、神经细胞、肠细胞、眼细胞和/或耳细胞等。在其他实施方案中,所述细胞是干细胞。在其他实施方案中,所述细胞是患者来源的,例如自体cd34+(造血)干细胞(例如,经由粒细胞集落刺激因
子(gcsf)给予在患者中从骨髓动员至外周血中)。可以收获、纯化、培养cd34+细胞,并且通过任何合适的方法将核酸酶引入细胞中。
28.在另一方面,本发明的方法和组合物提供如本文所述的组合物(核酸酶、药物组合物、多核苷酸、表达载体、细胞、细胞系和/或动物诸如转基因动物)例如用于治疗和/或预防线粒体疾病的用途。在某些实施方案中,这些组合物用于筛选用于治疗线粒体障碍的药物文库和/或其他治疗组合物(即,抗体、结构rna等)。此类筛选可以在细胞水平上从操纵的细胞系或原代细胞开始,并且可以进行到整个动物(例如,兽医或人类疗法)的治疗水平。因此,在某些方面,本文描述了一种治疗和/或预防有需要的受试者的线粒体疾病的方法,所述方法包括向所述受试者给予如本文所述的一种或多种核酸酶、多核苷酸和/或细胞。所述方法可以是离体或在体内的。在某些实施方案中,向所述受试者给予如本文所述的细胞。在本文所述的任何方法中,所述细胞可以是源自所述受试者的干细胞(患者来源的干细胞)。
29.在本文所述的任何组合物和方法中,将所述核酸酶以mrna形式和/或使用一种或多种非病毒、lnp或病毒载体引入。在某些实施方案中,将所述一种或多种核酸酶以mrna形式引入。在其他实施方案中,将所述一种或多种核酸酶使用病毒载体引入,所述病毒载体例如腺相关载体(aav)(包括aav1、aav3、aav4、aav5、aav6、aav8、aav 8.2、aav9、aav rh10、aav2/8、aav2/5和aav2/6)或经由慢病毒或整合缺陷慢病毒载体。
30.一旦递送到所述细胞,就转录和/或翻译所述一种或多种核酸酶,并且所述核酸酶蛋白被所述线粒体吸收。因此,在一些实施方案中,所述一种或多种核酸酶包含线粒体靶向肽(参见例如,美国专利号9,139,628;omuta(1998)j.biochem 123(6):1010
‑
6)。在某些实施方案中,使用组织或细胞特异性载体,例如对于心脏(心脏组织)具有特异性的载体。
31.可以使用本发明的组合物和方法来修饰任何细胞,包括但不限于原核细胞或真核细胞,诸如细胞、昆虫、酵母、鱼、哺乳动物(包括非人哺乳动物)和植物细胞。在某些实施方案中,所述细胞是心脏细胞、脑细胞、肝细胞、脾细胞、肠细胞或免疫细胞,例如t细胞(例如,cd4+、cd3+、cd8+等)、树突细胞、b细胞等。在其他实施方案中,所述细胞是多能、全能或多潜能细胞,例如诱导型多能干细胞(ipsc)、造血干细胞(例如,cd34+)、胚胎干细胞等。可以用于本发明的方法和组合物的特定干细胞类型包括胚胎干细胞(esc)、诱导型多能干细胞(ipsc)和造血干细胞(例如,cd34+细胞)。所述ipsc可以源自患者样品和/或正常对照,其中患者来源的ipsc可以在目的基因处突变为正常或野生型基因序列,或者可以将正常细胞在目的基因处改变为已知疾病等位基因。类似地,造血干细胞可以从患者或从供体分离。
32.因此,本文描述了用于改变mtdna基因组的方法和组合物,包括但不限于选择性切割突变体mtdna以改变细胞、器官和/或组织(例如,有需要的受试者的细胞、器官和/或组织)中的突变体与野生型mtdna的异质性比率,从而治疗和/或预防线粒体疾病。所述组合物和方法可以在体外、体内或离体使用,并且包括给予人工转录因子或包含靶向至mtdna的dna结合结构域的核酸酶。
33.还提供了试剂盒,其包含本发明的核酸、核酸酶和/或细胞。所述试剂盒可以包含编码所述核酸酶的核酸(例如,合适表达载体中所包含的编码rna分子或zfn、talen、ttago或crispr/cas系统的基因)、或所述核酸酶蛋白质的等分试样、供体分子、合适的干性调节剂、细胞、用于进行本发明方法的说明书等。
34.从整体而言鉴于本公开文本,这些和其他方面对于技术人员来说都是易于清楚
的。
附图说明
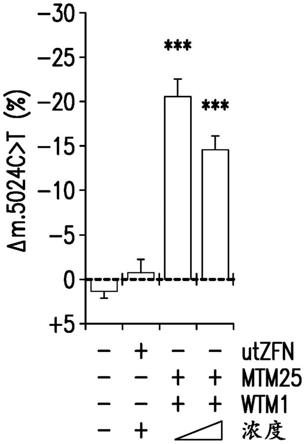
35.图1a至图1g描绘了靶向至线粒体dna的核酸酶和体内mtdna异质性修饰的设计。图1a是示出了与野生型和突变体基因组中m.5024上游的序列(seq id no:1)结合的单体“wtm1”和由于靶位点中的c>t突变(由*指示)而优先与突变位点(seq id no:2)结合的突变体特异性单体“mtm25”的示意图。强制性异二聚体foki结构域的二聚化产生dna双链断裂,从而导致突变体mtdan的特异性缺失。图1b描绘了用于筛选靶向至小鼠mtdna的核酸酶的文库(左图)和筛选测定(右图)的示意图。对于筛选,将mtm(n)mtzfn文库(标记为“mtm(n)”)克隆到含有核糖体口吃t2a位点(“2a”)、wtm1 mtzfn(“wtm1”)和锤头状核酶(“hhr”)的骨架中,使得所述骨架也共表达来自单独启动子(sv40)的mcherry。将这些构建体转染到具有m.5024c>t的小鼠胚胎成纤维细胞(mef)中,在24小时通过荧光激活细胞分选(facs)分选转染子;通过焦磷酸测序测定提取的dna和转染的成纤维细胞中的异质性偏移。图1c示出了在不同浓度下通过四环素敏感性hhr 7促进的来自用对照或mtm25/wtm1转染的mef的m.5024c>t异质性的焦磷酸测序分析的结果。根据不同的测试条件对m.5024c>t异质性的变化(“δm.5024c>t(%)”)进行作图。“utzfn”是在小鼠mtdna 7中不具有靶位点的mtzfn。n=4
‑
8。误差条指示sd。进行的统计分析:双尾学生t检验***p<0.01。图1d是描绘体内实验的示意图。在单独的aav基因组中编码mtm25和wtm1,将所述基因组包裹在aav9.45中,然后同时系统性地(尾静脉)给予。在注射后65天将动物处死。图1e示出了来自注射mtm25和/或wtm1的动物的总心脏蛋白的蛋白质印迹分析。两种蛋白质均包括ha标签并且根据分子量区分。图1e示出了来自耳和心脏总dna的m.5024c>t异质性的焦磷酸测序分析。对这些之间的m.5024c>t变化(δ)进行作图。n=4
‑
20(表s1)。误差条指示sem。进行的统计分析:双尾学生t检验。***p<0.001。图1f示出了通过qpcr进行的mtdan拷贝数的分析。每个正方形指示一个动物。n=4
‑
8(表s1)。误差条指示sem。进行的统计分析:双尾学生t检验**p<0.01。
36.图2a至图2e描绘了m.5024c>t mtdna异质性的减少导致活受试者中的表型救援。图2a是由m.5024c>t突变编码的mt
‑
trna:ala的例示。圆圈指示由于5024c>t突变插入的突变体“a”的位置。鉴于此突变的性质和位置,含有突变错配的转录的trna分子不太可能正确地折叠或氨基酰化,从而导致在高水平的m.5024c>t异质性下mt
‑
trna:ala的稳态水平降低。图2b示出了总心脏rna提取物的northern印迹分析的量化。将mt
‑
trna丰度针对5s rrna归一化。n=4
‑
6。误差条指示sem。进行的统计分析:双尾学生t检验。***p<0.001。所述数据指示与未处理的细胞相比,在用wtm1/mtm25zfn对处理的细胞中,如针对mt trna:cys归一化的mt trna:ala的存在增加。图2c描绘了用于评估mt
‑
trna
ala
分子表型救援的生理作用的中间剂量(5e12个vg/动物)aav处理的小鼠和年龄/初始异质性匹配的(媒介物处理的)对照的代谢物组学数据的主成分分析(pca)图。每个正方形指示一个动物(参见实施例2)。图2d示出了通过lc/ms进行的来自中间剂量aav处理的小鼠(右条“+aav”)和年龄/初始异质性匹配的对照(左条“veh”)的小鼠心脏组织的总代谢物丰度(左图中的磷酸烯醇丙酮酸盐;中间图中的丙酮酸盐;右图中的乳酸盐)的测量值。上图中描绘了最终糖酵解代谢物的化学结构和连接这些代谢物的反应。误差条指示sem。进行的统计分析:单尾学生t检验。*p<0.05。图2e示出了来自小鼠心脏组织的初始反应物和糖酵解途径的产物的化学结构(上图)和体内
丰度。与对照(左条“veh”)相比,经处理的动物心脏中升高的葡萄糖水平(左图)结合降低的下游代谢物丰度(中间图中所示的葡萄糖
‑6‑
磷酸盐和右图中所示的果糖
‑6‑
磷酸盐)促成了在经处理的动物(右条“+aav”)中观察到线粒体代谢恢复和有氧糖酵解增强的谱。
具体实施方式
37.本文公开了用于mtdna的靶向修饰(包括选择性切割突变体mtdna)使得mtdna的异质性偏移并且实现分子和生物化学表型向野生型的逆转的组合物和方法。
38.本发明设想了对mtdna的遗传修饰,包括但不限于选择性切割mtdna以用于治疗和/或预防有需要的受试者中任何遗传来源的线粒体疾病。任何突变体mtdna可以被dna结合结构域靶向,所述突变体mtdna包括但不限于m.5024c>t、1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c和/或14709c。概述
39.除非另有指示,否则方法的实践以及本文所公开的组合物的制备和使用采用分子生物学、生物化学、染色质结构和分析、计算化学、细胞培养、重组dna和相关领域的常规技术,这些技术是本领域所熟知的。这些技术在文献中有充分解释。参见例如,sambrook等人,molecular cloning:a laboratory manual,第二版,cold spring harbor laboratory press,1989和第三版,2001;ausubel等人,current protocols in molecular biology,john wiley&sons,纽约,1987和定期更新;丛书methods in enzymology,academic press,圣地亚哥;wolffe,chromatin structure and function,第三版,academic press,圣地亚哥,1998;methods in enzymology,第304卷,“chromatin”(p.m.wassarman和a.p.wolffe编辑),academic press,圣地亚哥,1999;和methods in molecular biology,第119卷,“chromatin protocols”(p.b.becker编辑)humana press,托托瓦,1999。定义
40.术语“核酸”、“多核苷酸”和“寡核苷酸”可互换使用,并且是指呈线性或环状构象并且呈单链或双链形式的脱氧核糖核苷酸或核糖核苷酸聚合物。出于本公开文本的目的,不应将这些术语视为在聚合物的长度方面加以限制。这些术语可以涵盖天然核苷酸的已知类似物,以及在碱基、糖和/或磷酸部分(例如,硫代磷酸酯骨架)中被修饰的核苷酸。通常,特定核苷酸的类似物具有相同的碱基配对特异性;即,a的类似物将与t进行碱基配对。
41.术语“多肽”、“肽”和“蛋白质”可互换使用,是指氨基酸残基的聚合物。所述术语还适用于如下氨基酸聚合物,其中一个或多个氨基酸是对应天然存在的氨基酸的化学类似物或经修饰衍生物。
[0042]“结合”是指高分子之间(例如,蛋白质与核酸之间)的序列特异性非共价相互作用。并非结合相互作用的所有组分都需要是序列特异性的(例如,与dna骨架中的磷酸残基接触),只要所述相互作用作为整体是序列特异性的即可。此类相互作用的特征通常是解离常数(k
d
)为10
‑6m
‑1或更低。“亲和力”是指结合强度:增强的结合亲和力与较低的k
d
相关。
[0043]“结合结构域”是能够与另一分子非共价结合的分子。结合分子可以与例如dna分子(dna结合蛋白,诸如锌指蛋白或tal
‑
效应子结构域蛋白或单一指导rna)、rna分子(rna结合蛋白)和/或蛋白质分子(蛋白质结合蛋白)结合。在蛋白质结合分子的情况下,其可以与
自身结合(以形成同二聚体、同三聚体等),和/或其可以与一种或多种不同蛋白质的一个或多个分子结合。结合分子可以具有多于一种类型的结合活性。例如,锌指蛋白具有dna结合、rna结合和蛋白质结合活性。因此,dna结合分子(包括人工核酸酶和转录因子的dna结合组分)包括但不限于zfp、tale和sgrna。
[0044]“锌指dna结合蛋白”(或结合结构域)是蛋白质或较大蛋白质内的结构域,其以序列特异性方式通过一个或多个锌指结合dna,所述锌指是结合结构域内的氨基酸序列区域,所述结合结构域的结构通过锌离子的配位而稳定。术语锌指dna结合蛋白通常缩写为锌指蛋白或zfp。人工核酸酶和转录因子可以包含zfp dna结合结构域和功能结构域(zfn的核酸酶结构域或zfp
‑
tf的转录调节结构域)。术语“锌指核酸酶”包括一种zfn以及二聚化以切割靶基因的zfn对(包括第一zfn和第二zfn,也称为左zfn和右zfn)。
[0045]“tale dna结合结构域”或“tale”是包含一个或多个tale重复结构域/单元的多肽。重复结构域参与tale与其同源靶dna序列的结合。单个“重复单元”(也称为“重复”)的长度通常为33
‑
35个氨基酸,并且表现出与天然存在的tale蛋白中的其他tale重复序列具有至少一些序列同源性。参见例如,美国专利号8,586,526。人工核酸酶和转录因子可以包含tale dna结合结构域和功能结构域(talen的核酸酶结构域或talen
‑
tf的转录调节结构域)。术语“talen”包括一种talen以及二聚化以切割靶基因的talen对(包括第一talen和第二talen,也称为左talen和右talen)。
[0046]
锌指和tale结合结构域可以“被工程化”以与预先确定的核苷酸序列结合,例如通过工程化(改变一个或多个氨基酸)天然存在的锌指或tale蛋白的识别螺旋区。因此,工程化dna结合蛋白(锌指或tale)是非天然存在的蛋白质。工程化dna结合蛋白的方法的非限制性例子是设计和选择。设计的dna结合蛋白是在自然界中不存在的蛋白质,其设计/组成主要源自合理标准。设计的合理标准包括应用替换规则和计算机化算法,以用于处理存储现有zfp和/或tale设计和绑定数据的信息的数据库中的信息。参见,例如,美国专利号6,140,081;6,453,242;6,534,261;和8,585,526;还参见国际专利公开号wo 98/53058;wo 98/53059;wo 98/53060;wo 02/016536;和wo 03/016496。
[0047]“所选择的”锌指蛋白或tale是并非在自然界中发现的蛋白质,其产生主要源自经验过程,诸如噬菌体展示、相互作用陷阱或杂交体选择。参见例如,美国专利号5,789,538;5,925,523;6,007,988;6,013,453;6,200,759;8,586,526;以及国际专利公开号wo 95/19431;wo 96/06166;wo 98/53057;wo 98/54311;wo 00/27878;wo 01/60970;wo 01/88197;和wo 02/099084。
[0048]“ttago”是原核argonaute蛋白,被认为参与基因沉默。ttago源自细菌嗜热栖热菌(thermus thermophilus)。参见例如,swarts等人,同上,g.sheng等人,(2013)proc.natl.acad.sci.u.s.a.111,652)。“ttago系统”是所需的所有组分,包括例如用于通过ttago酶切割的指导dna。
[0049]“重组”是指两个多核苷酸之间交换遗传信息的过程,包括但不限于通过非同源末端接合(nhej)进行的供体捕捉以及同源重组。出于本公开文本的目的,“同源重组(hr)”是指这种交换的特化形式,其发生于例如细胞中的双链断裂通过同源定向修复机制修复期间。这个过程需要核苷酸序列同源性,使用“供体”分子模板修复“靶”分子(即,经历双链断裂的分子),并且因为其导致遗传信息从供体转移至靶标,被不同地称为“非交换型基因转
化”或“短束基因转化”。不希望受任何特定理论约束,这种转移可以涉及在断裂的靶标与供体之间形成的异源双链体dna的错配修正,和/或“合成依赖性链退火”(其中使用供体重合成将成为靶标的一部分的遗传信息),和/或相关过程。这种特化的hr通常导致靶分子序列的改变,使得供体多核苷酸的部分或全部序列掺入靶多核苷酸中。
[0050]
在本公开文本的方法中,如本文所述的一种或多种靶向核酸酶在预先确定的位点处在靶序列(例如,细胞染色质)中产生双链断裂(dsb)。dsb可以通过同源定向修复或通过非同源定向修复机制产生缺失和/或插入。缺失可以包括任何数量的碱基对。类似地,插入可以包括任何数量的碱基对,包括例如整合任选地与断裂区域中的核苷酸序列具有同源性的“供体”多核苷酸。供体序列可以是物理整合的,或可替代地,供体多核苷酸用作通过同源重组修复断裂的模板,导致将供体中的全部或部分核苷酸序列引入细胞染色质中。因此,可以改变细胞染色质中的第一序列,并且在某些实施方案中,可以将所述第一序列转换为供体多核苷酸中存在的序列。因此,术语“替代”(“replace”或“replacement”)的使用可以理解为代表一个核苷酸序列被另一个核苷酸序列替代(即,在信息意义上的序列替代),并且不一定需要将一个多核苷酸物理地或化学地被另一个多核苷酸替代。
[0051]
在本文描述的任何方法中,另外的锌指蛋白对、talen、ttago或crispr/cas系统可以用于细胞内另外的靶位点的另外的双链切割。
[0052]
本文所述的任何方法可以用于通过靶向整合供体序列(其破坏一个或多个目的基因表达)而插入任何大小的供体和/或使细胞中的一种或多种靶序列部分或完全失活。还提供了具有部分或完全失活的基因的细胞系。
[0053]
在本文所述的任何方法中,外源核苷酸序列(“供体序列”或“转基因”)可以包含与目的区域中的基因组序列同源但不相同的序列,从而刺激同源重组以在目的区域中插入不同序列。因此,在某些实施方案中,与目的区域中的序列同源的供体序列的部分相对于被替代的基因组序列展现出约80%至99%(或其间的任何整数)的序列同一性。在其他实施方案中,供体与基因组序列之间的同源性高于99%,例如,如果超过100个连续碱基对的供体和基因组序列之间只有1个核苷酸不同。在某些情况下,供体序列的非同源部分可以包含在目的区域中不存在的序列,从而将新序列引入目的区域中。在这些情况下,通常非同源序列的侧翼为与目的区域中的序列同源或相同的50
‑
1,000个碱基对(或其间的任何整数值)或大于1,000的任意数量的碱基对的序列。在其他实施方案中,供体序列与第一序列非同源,并通过非同源重组机制插入基因组中。
[0054]“切割”是指dna分子的共价骨架的断裂。切割可以通过各种方法进行,所述方法包括但不限于磷酸二酯键的酶促或化学水解。单链切割和双链切割都是可能的,并且作为两个不同的单链切割事件的结果,可以发生双链切割。dna切割可以使得产生平端或交错端。在某些实施方案中,融合多肽用于靶向双链dna切割。
[0055]“切割半结构域”是多肽序列,其结合第二多肽(相同的或不同的)形成具有切割活性(优选地双链切割活性)的复合物。术语“第一和第二切割半结构域”、“+和
‑
切割半结构域”和“左和右切割半结构域”可互换使用,以指二聚化的切割半结构域对。
[0056]“工程化切割半结构域”是已经被修饰以便与另一个切割半结构域(例如,另一个工程化切割半结构域)形成专性异二聚体的切割半结构域。还参见,美国专利号8,623,618;7,888,121;7,914,796;和8,034,598,其通过引用以其整体并入本文。
[0057]
术语“序列”是指任何长度的核苷酸序列,其可以是dna或rna;可以是线性、环状或分支的,并且可以是单链或双链的。术语“供体序列”是指被插入基因组中的核苷酸序列。供体序列可以具有任何长度,例如长度介于2与100,000,000个核苷酸之间(或其间或高于其的任何整数值),优选地长度介于约100与100,000个核苷酸之间(或其间的任何整数),更优选地长度介于约2000与20,000个核苷酸之间(或其间的任何值)并且甚至更优选地介于约5与15kb之间(或其间的任何值)。
[0058]“染色质”是包含细胞基因组的核蛋白结构。细胞染色质包含核酸(主要是dna)和蛋白质(包含组蛋白和非组蛋白染色体蛋白)。大多数的真核细胞染色质以核小体的形式存在,其中核小体核心包含约150个碱基对的dna,所述dna与八聚体相缔合,所述八聚体包含组蛋白h2a、h2b、h3和h4各两个,并且接头dna(长度可变,取决于生物体)在核小体核心之间延伸。组蛋白h1分子通常与接头dna相缔合。出于本公开文本的目的,术语“染色质”意为涵盖原核和真核的所有类型的细胞核蛋白。细胞染色质包含染色体和游离型染色质。
[0059]“染色体”是包含细胞基因组的全部或一部分的染色质复合物。细胞的基因组通常以其核型为特征,所述核型是包含所述细胞基因组的所有染色体的集合。细胞的基因组可以包含一条或多条染色体。
[0060]“附加体”是复制型核酸,核蛋白复合物或包含不属于细胞染色体核型的一部分的核酸的其他结构。附加体的例子包括质粒和某些病毒基因组。
[0061]“可接近区域”是细胞染色质中的位点,其中存在于核酸中的靶位点可以被识别所述靶位点的外源分子结合。不希望受任何具体理论的限制,据信可接近区域是未包装到核小体结构中的区域。可接近区域的不同结构可以经常通过其对于化学和酶促探针(例如核酸酶的)敏感性来检测。
[0062]“靶位点”或“靶序列”是定义核酸的一部分的核酸序列,结合分子将结合所述部分,前提是存在用于结合的充分条件。靶位点可以具有任何长度,例如9至20个或更多个核苷酸,并且长度和结合的核苷酸可以是连续的或非连续的。
[0063]“外源”分子是正常地在细胞中不存在但可以通过一种或多种遗传、生物化学或其他方法引入细胞中的分子。“在细胞中正常存在”是关于细胞的特定发育阶段和环境条件来确定。因此,例如,仅在肌肉的胚胎发育期间存在的分子是关于成体肌肉细胞的外源分子。类似地,通过热休克引入的分子是关于非热休克细胞的外源分子。外源分子可以包含例如功能失常的内源分子的功能形式或功能正常的内源分子的功能失常形式。
[0064]
外源分子尤其可以是小分子,如通过组合化学工艺产生的小分子,或高分子,如蛋白质、核酸、碳水化合物、脂质、糖蛋白、脂蛋白、多糖、上述分子的任何经修饰衍生物、或者包含一种或多种上述分子的任何复合物。核酸包括dna和rna,可以是单链或双链的;可以是线性、分支或环状的;并且可以是任何长度。核酸包括能够形成双螺旋的那些,以及形成三螺旋的核酸。参见,例如,美国专利号5,176,996和5,422,251。蛋白质包括但不限于dna结合蛋白、转录因子、染色质重构因子、甲基化的dna结合蛋白、聚合酶、甲基化酶、脱甲基酶、乙酰基酯酶、脱乙酰酶、激酶、磷酸酶、整合酶、重组酶、连接酶、拓扑异构酶、促旋酶和解螺旋酶。
[0065]
外源分子可以是与内源分子类型相同的分子,例如,外源蛋白质或核酸。例如,外源核酸可以包含引入细胞中的感染性病毒基因组、质粒或游离体,或正常地在细胞中不存
在的染色体。将外源分子引入细胞中的方法是本领域技术人员已知的,并且包括但不限于脂质介导的转移(即,脂质体,包括中性和阳离子型脂质)、电穿孔、直接注射、细胞融合、粒子轰击、磷酸钙共沉淀、deae
‑
葡聚糖介导的转移和病毒载体介导的转移。外源分子还可以是与内源分子类型相同,但源自与细胞来源不同的物种的分子。例如,可以将人类核酸序列引入最初源自小鼠或仓鼠的细胞系中。
[0066]
相比之下,“内源”分子是在特定发育阶段在特定环境条件下在特定细胞中正常存在的分子。例如,内源核酸可以包含染色体、线粒体、叶绿体或其他细胞器的基因组、或天然存在的游离型核酸。其他内源分子可以包括蛋白质,例如转录因子和酶。
[0067]
如本文所用,术语“外源核酸的产物”包括多核苷酸和多肽产物,例如转录产物(多核苷酸诸如rna)和翻译产物(多肽)。
[0068]“融合”分子是其中两个或更多个亚单元分子被连接(优选地共价连接)的分子。亚单元分子可以是相同化学类型的分子,或者可以是不同化学类型的分子。第一类型的融合分子的例子包括但不限于融合蛋白(例如,zfp或tale dna结合结构域与一个或多个激活结构域之间的融合物)和融合核酸(例如,编码上述融合蛋白的核酸)。第二类型的融合分子的例子包括但不限于形成三螺旋的核酸与多肽之间的融合物,以及小沟结合物与核酸之间的融合物。
[0069]
细胞中融合蛋白的表达可以源自将融合蛋白递送至细胞或通过将编码融合蛋白的多核苷酸递送至细胞来获得,其中多核苷酸发生转录,并且转录物发生翻译,以产生融合蛋白。反式剪接、多肽切割和多肽连接也可以参与蛋白质在细胞中的表达。将多核苷酸和多肽递送至细胞的方法呈现于本公开文本中的其他地方。
[0070]
出于本公开文本的目的,“基因”包括编码基因产物(参见下文)的dna区域,以及所有调节基因产物的产生的dna区域,不论此类调节序列是否与编码序列和/或所转录序列相邻。因此,基因包括但不必限于启动子序列、终止子、翻译调控序列(诸如核糖体结合位点和内部核糖体进入位点)、增强子、沉默子、绝缘子、边界元件、复制起点、基质附着位点和基因座控制区域。
[0071]“基因表达”是指将基因中包含的信息转化为基因产物。基因产物可以是基因的直接转录产物(例如,mrna、trna、rrna、反义rna、核糖酶、结构rna或任何其他类型的rna)或mrna翻译产生的蛋白质。基因产物还包括通过诸如加帽、聚腺苷酸化、甲基化和编辑等方法修饰的rna,以及通过例如甲基化、乙酰化、磷酸化、泛素化、adp核糖基化、豆蔻酰化(myristilation)和糖基化修饰的蛋白质。
[0072]
对基因表达的“调节”是指基因活性的变化。对表达的调节可以包括但不限于基因激活和基因阻遏。基因组编辑(例如,切割、改变、失活、随机突变)可以用于调节表达。基因失活是指如与不包括如本文所述的zfp、tale、ttago或crispr/cas系统的细胞相比,基因表达的任何减少。因此,基因失活可以是部分失活或完全失活。
[0073]“目的区域”是细胞染色质的任何区域,例如像基因或者基因内或与基因相邻的非编码序列,其中可期望所述区域结合外源分子。结合可以用于所靶向dna切割和/或所靶向重组的目的。例如,目的区域可以存在于染色体、游离体、细胞器基因组(例如,线粒体、叶绿体)或感染性病毒基因组中。目的区域可以位于基因的编码区内,位于经转录非编码区内(例如前导序列、尾随序列或内含子),或位于在编码区上游或下游的非转录区内。目的区域
的长度可以小至单一核苷酸对或多达2,000个核苷酸对,或任何整数值的核苷酸对。
[0074]“真核”细胞包括但不限于真菌细胞(诸如酵母)、植物细胞、动物细胞、哺乳动物细胞和人类细胞(例如,t细胞),包括干细胞(多能和多潜能)。
[0075]
关于两个或更多个组分(诸如序列元件)的并列,术语“操作性连接”和“操作性地连接”(或“可操作连接”)可互换使用,其中所述组分经排列使得两个组分正常发挥功能并允许以下可能性:至少一个所述组分可以介导对至少一个其他组分发挥的功能。通过说明,如果转录调节序列响应一种或多种转录调节因子的存在或不存在控制编码序列的转录水平,那么转录调节序列(诸如启动子)与编码序列操作性连接。转录调节序列通常与编码序列顺式操作性连接,但无需与其直接相邻。例如,增强子是与编码序列操作性连接的转录调节序列,即使其不邻接。
[0076]
关于功能多肽,术语“操作性连接”可以指以下事实:每个组分在与另一组分连接时发挥的功能与其没有如此连接时发挥的功能相同。例如,关于其中zfp、tale、ttago或cas dna结合结构域与激活结构域融合的融合多肽,如果在功能多肽中,zfp、tale、ttago或cas dna结合结构域部分能结合其靶位点和/或其结合位点,同时激活结构域能上调基因表达,那么zfp、tale、ttago或cas dna结合结构域和激活结构域呈操作性连接。在融合多肽中的zfp、tale、ttago或cas dna结合结构域与切割结构域融合时,如果在融合多肽中,zfp、tale、ttago或cas dna结合结构域部分能结合其靶位点和/或其结合位点,同时切割结构域能切割靶位点附近的dna,那么zfp、tale、ttago或cas dna结合结构域和切割结构域呈操作性连接。
[0077]
蛋白质、多肽或核酸的“功能性片段”是蛋白质、多肽或核酸,其序列与全长蛋白质、多肽或核酸不同,但保留与全长蛋白质、多肽或核酸相同的功能。功能性片段可以具有与相应的天然分子相比较多、较少或相同的残基数,和/或可以含有一个或多个氨基酸或核苷酸取代。确定核酸功能(例如,编码功能、与另一核酸杂交的能力)的方法是本领域所熟知的。类似地,确定蛋白质功能的方法是熟知的。例如,多肽的dna结合功能可以例如通过滤膜结合、电泳迁移率变动或免疫沉淀测定来确定。dna切割可以通过凝胶电泳来测定。参见ausubel等人,同上。蛋白质与另一蛋白质相互作用的能力可以例如通过免疫共沉淀、双杂交测定或互补(遗传和生物化学二者)来确定。参见例如,fields等人(1989)nature 340:245
‑
246;美国专利号5,585,245和国际专利公开号wo 98/44350。
[0078]“载体”能将基因序列转移至靶细胞。典型地,“载体构建体”、“表达载体”和“基因转移载体”意指能引导所关注基因表达并且可以将基因序列转移至靶细胞的任何核酸构建体。因此,所述术语包括克隆和表达运载体,以及整合载体。
[0079]
术语“受试者”和“患者”可互换使用,并且是指哺乳动物诸如人患者和非人灵长类动物,以及实验动物诸如兔、狗、猫、大鼠、小鼠和其他动物。因此,如本文所用的术语“受试者”或“患者”意指可以向其给予本发明的核酸酶、供体和/或经遗传修饰的细胞的任何哺乳动物患者或受试者。本发明的受试者包括患有障碍的受试者。
[0080]“干性”是指任何细胞以类似干细胞的方式发挥作用的相对能力,即全能性、多能性或寡能性和任何特定干细胞可以具有的扩大的或无限的自我更新的程度。“actr”是抗体偶合的t细胞受体,即能够与外源供应的抗体结合的工程化t细胞组分。抗体与actr组分的结合使t细胞能够与抗体识别的抗原相互作用,并且当遇到此抗原
时,包含t细胞的actr被触发而与抗原相互作用(参见美国专利公开号2015/0139943)。融合分子
[0081]
本文描述了可用于切割细胞中mtdna的所选靶基因的组合物,例如核酸酶。
[0082]
包含来自锌指蛋白(“zfp”)的dna结合结构域或tal效应子结构域(“tale”)的重组转录因子和包含锌指核酸酶(“zfn”)、talen、crispr/cas核酸酶系统的工程化核酸酶以及全部被设计以与靶dna位点结合的归巢核酸内切酶具有调控内源基因的基因表达的能力并且可用于基因组工程化、基因疗法和线粒体障碍的治疗。参见例如,美国专利号9,394,545;9,150,847;9,206,404;9,045,763;9,005,973;8,956,828;8,936,936;8,945,868;8,871,905;8,586,526;8,563,314;8,329,986;8,399,218;6,534,261;6,599,692;6,503,717;6,689,558;7,067,317;7,262,054;7,888,121;7,972,854;7,914,796;7,951,925;8,110,379;8,409,861;美国专利公开号2003/0232410;2005/0208489;2005/0026157;2005/0064474;2006/0063231;2008/0159996;2010/0218264;2012/0017290;2011/0265198;2013/0137104;2013/0122591;2013/0177983;2013/0177960;和2015/0056705,其披露内容出于所有目的通过引用以其整体并入。此外,正在开发基于argonaute系统(例如,来自嗜热栖热菌,称为“ttago”,参见swarts等人(2014)nature 507(7491):258
‑
261)的靶向核酸酶,所述靶向核酸酶也可能具有用于基因组编辑和基因疗法的潜力。
[0083]
核酸酶介导的基因疗法可以用于对细胞进行基因工程化以具有一种或多种失活基因和/或致使此细胞表达在此细胞中先前未产生的产物(例如,经由转基因插入和/或经由内源序列的校正)。转基因插入的用途的例子包括插入编码一种或多种新颖治疗性蛋白质的一种或多种基因、插入编码在细胞中或在个体中缺乏的蛋白质的编码序列、在含有突变基因序列的细胞中插入野生型基因和/或插入编码结构核酸(如shrna或sirna)的序列。内源基因序列的“校正”的可用应用的例子包括疾病相关的基因突变的改变、异质性偏移、编码剪接位点的序列的改变、调控序列的改变和编码蛋白质的结构特征的序列的靶向改变。转基因构建体可以通过同源定向修复(hdr)或通过非同源末端接合(nhej)驱动的过程期间的末端捕获来插入。参见例如,美国专利号9,045,763;9,005,973;7,888,121;和8,703,489。
[0084]
使用这些工程化转录因子和核酸酶的临床试验已经显示,这些分子能够治疗各种病症,包括癌症、hiv和/或血液障碍(诸如血红蛋白病和/或血友病)。参见例如,yu等人,(2006)faseb j.20:479
‑
481;tebas等人,(2014)new eng j med 370(10):901。因此,这些方法可以用于治疗疾病。
[0085]
在某些实施方案中,融合分子(例如,核酸酶)的一种或多种组分是天然存在的。在其他实施方案中,融合分子(例如,核酸酶)的一种或多种组分是非天然存在的,即在dna结合分子和/或一个或多个切割结构域中工程化。例如,天然存在的核酸酶的dna结合部分可以被改变以与所选的靶位点结合(例如,crispr/cas系统或大范围核酸酶的单一指导rna,其已被工程化以与不同于同源结合位点的位点结合)。在其他实施方案中,所述核酸酶包含异源dna结合结构域和切割结构域(例如,锌指核酸酶;tal效应子结构域dna结合蛋白;大范围核酸酶dna结合结构域与异源切割结构域)。因此,任何核酸酶可以用于实践本发明,包括但不限于至少一种zfn、talen、大范围核酸酶、crispr/cas核酸酶等,所述核酸酶切割靶基因,所述切割产生靶基因的基因组修饰(例如,切割的基因中的插入和/或缺失)。
[0086]
本文还描述了通过核酸酶复合物的工程化切割半结构域配偶体的独立滴定增加切割活性的特异性。在一些实施方案中,两种配偶体(半切割结构域)的比率以1:2、1:3、1:4、1:5、1:6、1:8、1:9、1:10或1:20比率或其间的任何值给出。在其他实施方案中,两种配偶体的比率大于1:30。在其他实施方案中,两种配偶体以选择成与1:1不同的比率部署。在单独使用或组合使用时,本发明的方法和组合物经由降低脱靶切割活性来提供靶向特异性的意外的且出乎意料的增加。这些实施方案中使用的核酸酶可以包括zfn、talen、crispr/cas、crispr/dcas和ttago或其任何组合。a.dna结合分子
[0087]
本文所述的融合分子可以包括任何dna结合分子(也被称为dna结合结构域),包括蛋白质结构域和/或多核苷酸dna结合结构域。在某些实施方案中,dna结合结构域与9
‑
18个或更多个核苷酸的靶位点结合,其中所述靶位点包含一个或多个突变体mtdna序列。所述突变可以是点突变,例如包含m.5024c>t突变的靶位点。
[0088]
在某些实施方案中,本文所述的组合物和方法采用用于与供体分子结合和/或与细胞的基因组中的目的区域结合的大范围核酸酶(归巢核酸内切酶)dna结合结构域。天然存在的大范围核酸酶识别15
‑
40个碱基对的切割位点,并且通常分为四个家族:laglidadg家族、giy
‑
yig家族、his
‑
cyst盒家族和hnh家族。示例性归巢核酸内切酶包括i
‑
scei、i
‑
ceui、pi
‑
pspi、pi
‑
sce、i
‑
sceiv、i
‑
csmi、i
‑
pani、i
‑
sceii、i
‑
ppoi、i
‑
sceiii、i
‑
crei、i
‑
tevi、i
‑
tevii和i
‑
teviii。上述示例性归巢核酸内切酶的识别序列是已知的。还参见美国专利号5,420,032和6,833,252;belfort等人,(1997)nucleic acids res.25:3379
‑
3388;dujon等人,(1989)gene 82:115
‑
118;perler等人,(1994)nucleic acids res.22,1125
‑
1127;jasin(1996)trends genet.12:224
–
228;gimble等人,(1996)j.mol.biol.263:163
‑
180;argast等人,(1998)j.mol.biol.280:345
‑
353和new england biolabs目录。另外,可以对归巢核酸内切酶和大范围核酸酶的dna结合特异性进行工程化以结合非天然靶位点。参见例如,chevalier等人,(2002)molec.cell 10:895
‑
905;epinat等人(2003)nucleic acids res.31:2952
‑
2962;ashworth等人,(2006)nature 441:656
‑
659;paques等人,(2007)current gene therapy 7:49
‑
66;以及美国专利公开号2007/0117128。归巢核酸内切酶和大范围核酸酶的dna结合结构域可以在核酸酶的环境下作为整体而改变(即,使得核酸酶包含同源切割结构域)或者可以与异源切割结构域融合。
[0089]
在其他实施方案中,本文所述的方法和组合物中使用的一种或多种核酸酶的dna结合结构域包含天然存在的或工程化的(非天然存在的)tal效应子dna结合结构域。参见例如,美国专利号8,586,526,其通过引用以其整体并入本文。已知黄单胞菌属(xanthomonas)的植物病原性细菌会在重要的作物植物中引起许多种疾病。黄单胞菌属的致病性取决于保守的iii型分泌(t3s)系统,其将多于25种不同的效应子蛋白注入植物细胞中。在所注入的这些蛋白质中有转录激活因子样(tal)效应子,其模拟植物转录激活因子并操纵植物转录组(参见kay等人,(2007)science 318:648
‑
651)。这些蛋白质含有dna结合结构域和转录激活结构域。最充分表征的tal效应子之一是来自油菜黄单胞菌疱斑致病变种(xanthomonas campestgris pv.vesicatoria)的avrbs3(参见bonas等人,(1989)mol gen genet 218:127
‑
136和国际专利公开号wo 2010/079430)。tal效应子含有串联重复序列的中心化结构域,每个重复序列含有约34个氨基酸,所述重复序列是这些蛋白质的dna结合特异性的关
键。另外,其含有核定位序列和酸性转录激活结构域(综述参见schornack等人(2006)j plant physiol 163(3):256
‑
272)。另外,在植物致病性细菌青枯雷尔氏菌(ralstonia solanacearum)中,已经发现在青枯雷尔氏菌生物变型1菌株gmi1000和生物变型4菌株rs1000中,名为brg11和hpx17的两种基因与黄单胞菌属的avrbs3家族是同源的(参见heuer等人(2007)appl and envir micro 73(13):4379
‑
4384)。这些基因的核苷酸序列彼此98.9%一致,但不同之处在于hpx17的重复结构域中1,575bp的缺失。然而,两种基因产物与黄单胞菌属的avrbs3家族蛋白具有小于40%序列同一性。参见例如,美国专利号8,586,526,其通过引用以其整体并入本文。
[0090]
这些tal效应子的特异性取决于在串联重复序列中发现的序列。重复序列包含大约102bp,并且所述重复序列通常彼此91%
‑
100%同源(bonas等人,同上)。重复序列的多态性通常位于位置12和13处,并且在位置12和13的高变双残基(rvd)的身份与tal效应子的靶序列中连续核苷酸的身份之间显现存在一一对应关系(参见moscou和bogdanove,(2009)science 326:1501以及boch等人,(2009)science 326:1509
‑
1512)。在实验中,已经确定这些tal效应子的dna识别天然代码,使得位置12和13的hd序列导致与胞嘧啶(c)结合,ng与t结合,ni与a、c、g或t结合,nn与a或g结合,并且ing与t结合。这些dna结合重复序列已经与新组合和数目的重复序列组装为蛋白质,以制造能与新序列相互作用的人工转录因子,并激活非内源报告基因在植物细胞中的表达(boch等人,同上)。工程化tal蛋白已与foki切割半结构域相连,以产生tal效应子结构域核酸酶融合物(talen)。参见例如,美国专利号8,586,526;christian等人(2010)genetics epub 10.1534/genetics.110.120717)。在某些实施方案中,tale结构域包含n帽和/或c帽,如美国专利号中8,586,526所述。
[0091]
在某些实施方案中,用于体内切割和/或靶向切割细胞的基因组的一种或多种核酸酶的dna结合结构域包括锌指蛋白。优选地,锌指蛋白是非天然存在的,其被工程化为与所选的靶位点结合。参见例如,参见例如,beerli等人(2002)nature biotechnol.20:135
‑
141;pabo等人(2001)ann.rev.biochem.70:313
‑
340;isalan等人(2001)nature biotechnol.19:656
‑
660;segal等人,(2001)curr.opin.biotechnol.12:632
‑
637;choo等人(2000)curr.opin.struct.biol.10:411
‑
416;美国专利号6,453,242;6,534,261;6,599,692;6,503,717;6,689,558;7,030,215;6,794,136;7,067,317;7,262,054;7,070,934;7,361,635;7,253,273;以及美国专利公开号2005/0064474;2007/0218528;2005/0267061,全部通过引用以其整体并入本文。
[0092]
与天然存在的锌指蛋白相比,工程化的锌指结合结构域可以具有新颖的结合特异性。工程化方法包括但不限于合理设计和各种类型的选择。合理设计包括例如使用数据库,所述数据库包含三联体(或四联体)核苷酸序列和个别锌指氨基酸序列,其中每个三联体或四联体核苷酸序列与结合特定三联体或四联体序列的锌指的一个或多个氨基酸序列缔合。参见,例如,共同拥有的美国专利号6,453,242和6,534,261,其通过引用以其整体并入本文中。
[0093]
示例性选择方法,包括噬菌体展示和双杂交系统,披露于美国专利号5,789,538;5,925,523;6,007,988;6,013,453;6,410,248;6,140,466;6,200,759;和6,242,568;以及国际专利公开号wo 98/37186;wo 98/53057;wo 00/27878;wo 01/88197;以及gb专利号2,338,237。另外,例如在共有的国际专利公开号wo 02/077227中已经描述了对锌指结合结构
域的结合特异性的增强。
[0094]
另外,如这些和其他参考文献中所披露,锌指结构域和/或多指锌指蛋白可以使用任何适宜的接头序列(包括例如,长度为5个或更多个氨基酸的接头)连接在一起。对于长度为6个或更多个氨基酸的示例性接头序列,还参见美国专利号6,479,626;6,903,185;和7,153,949。本文所述蛋白质可以包括蛋白质的个别锌指之间的适宜接头的任一组合。
[0095]
zfp可以与一个或多个核酸酶(切割)结构域可操作地缔合(连接)以形成zfn。术语“zfn”包含二聚化以切割靶基因的zfn对。方法和组合物还可以用于相对于其他非预期的切割位点(称为脱靶位点)提高zfn(包括核酸酶对)对其预期靶标的特异性(参见美国专利公开号20180087072)。因此,本文描述的核酸酶可以包含在其一个或多个dna结合结构域骨架区中的突变和/或在其核酸酶切割结构域中的一种或多种突变。这些核酸酶可以包括对zfp dna结合结构域(“zfp骨架”)内可以与dna骨架上的磷酸非特异性相互作用的氨基酸的突变,但其不包含dna识别螺旋中的变化。因此,本发明包括zfp骨架中是核苷酸靶标特异性不需要的阳离子型氨基酸残基的突变。在一些实施方案中,zfp骨架中的这些突变包含使阳离子型氨基酸残基突变为中心或阴离子型氨基酸残基。在一些实施方案中,zfp骨架中的这些突变包含使极性氨基酸残基突变至中性或非极性氨基酸残基。在优选实施方案中,突变是在相对于dna结合螺旋的位置(
‑
5)、(
‑
9)和/或位置(
‑
14)进行。在一些实施方案中,锌指可以包含在(
‑
5)、(
‑
9)和/或(
‑
14)的一种或多种突变。在另外的实施方案中,多指锌指蛋白中的一个或多个锌指可以包含(
‑
5)、(
‑
9)和/或(
‑
14)中的突变。在一些实施方案中,在(
‑
5)、(
‑
9)和/或(
‑
14)的氨基酸(例如精氨酸(r)或赖氨酸(k))突变为丙氨酸(a)、亮氨酸(l)、ser(s)、asp(n)、glu(e)、tyr(y)和/或谷氨酰胺(q)。
[0096]
在一些方面,与野生型相比,dna结合结构域(例如,zfp、tale、sgrna等)优先靶向突变体mtdna。在成对的核酸酶中,一个dna结合结构域可以靶向野生型序列,并且另一个dna结合结构域可以靶向突变体序列。可替代地,两个dna结合结构域可以靶向野生型或突变体序列。在某些实施方案中,dna结合结构域靶向突变体mtdna(例如,m.5024c>t)中的位点(9至18个或更多个核苷酸),如表2所示。在其他实施方案中,dna结合结构域靶向包含以下突变中的一种或多种的突变体mtdna中的序列:1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c或14709c。
[0097]
靶位点的选择;用于设计和构建融合蛋白(和编码所述融合蛋白的多核苷酸)的zfp和方法是本领域技术人员已知的并且详细描述于以下文献中:美国专利号6,140,081;5,789,538;6,453,242;6,534,261;5,925,523;6,007,988;6,013,453;6,200,759;和国际专利公开号wo 95/19431;wo 96/06166;wo 98/53057;wo 98/54311;wo 00/27878;wo 01/60970;wo 01/88197;wo 02/099084;wo 98/53058;wo 98/53059;wo 98/53060;wo 02/016536;和wo 03/016496。
[0098]
另外,如这些和其他参考文献中所披露,锌指结构域和/或多指锌指蛋白可以使用任何适宜的接头序列(包括例如,长度为5个或更多个氨基酸的接头)连接在一起。对于长度为6个或更多个氨基酸的示例性接头序列,还参见美国专利号6,479,626;6,903,185;和7,153,949。本文所述蛋白质可以包括蛋白质的个别锌指之间的适宜接头的任一组合。
[0099]
在某些实施方案中,dna结合分子是crispr/cas核酸酶系统的一部分。参见例如,
美国专利号8,697,359和美国专利公开号2015/0056705。crispr(规律成簇的间隔短回文重复序列)基因座(其编码所述系统的rna组分)和cas(crispr相关)基因座(其编码蛋白质)(jansen等人(2002)mol.microbiol.43:1565
‑
1575;makarova等人(2002)nucleic acids res.30:482
‑
496;makarova等人(2006)biol.direct 1:7;haft等人(2005)plos comput.biol.1:e60)构成crispr/cas核酸酶系统的基因序列。微生物宿主中的crispr基因座含有crispr相关(cas)基因以及能将crispr介导的核酸切割的特异性程序化的非编码rna元件的组合。
[0100]
ii型crispr是最充分表征的系统之一,并在四个连续步骤中进行靶向dna双链断裂。首先,从crispr基因座转录两个非编码rna,即前crrna阵列和tracrrna。第二步,tracrrna杂交到前
‑
crrna的重复区上,并且介导将前
‑
crrna加工成包含单独的间隔子序列的成熟crrna。第三步,成熟的crrna:tracrrna复合物通过crrna上的间隔子与靶dna上的原型间隔子之间的watson
‑
crick碱基配对将cas9引导至靶dna,靶dna靠近原型间隔子邻近基序(pam)是靶标识别的附加要求。最后,cas9介导靶dna的切割以在原间隔区内产生双链断裂。crispr/cas系统的活性包括三个步骤:(i)在称为“适应”的过程中将外来dna序列插入crispr阵列中以防止后来的攻击,(ii)表达相关蛋白质,以及表达并加工所述阵列,之后(iii)rna介导干扰外来核酸。因此,在细菌细胞中,若干种所谓的“cas”蛋白与crispr/cas系统的天然功能有关,并在诸如插入外源dna等功能中发挥作用。
[0101]
在某些实施方案中,cas蛋白可以是天然存在的cas蛋白的“功能衍生物”。天然序列多肽的“功能衍生物”是具有与天然序列多肽共同的定性生物特性的化合物。“功能衍生物”包括但不限于天然序列的片段和天然序列多肽和其片段的衍生物,前提是其具有与相应的天然序列多肽共同的生物活性。本文所预期的生物活性是功能衍生物将dna底物水解为片段的能力。术语“衍生物”涵盖多肽的氨基酸序列变体、共价修饰物和其融合物。合适的cas多肽或其片段的衍生物包括但不限于cas蛋白或其片段的突变体、融合物、共价修饰。cas蛋白,包括cas蛋白或其片段,以及cas蛋白或其片段的衍生物,可以从细胞中获得或化学合成或通过这两种程序的组合获得。细胞可以是天然地产生cas蛋白的细胞,或天然地产生cas蛋白并且进行遗传工程化从而以较高表达水平产生内源cas蛋白或从外源引入核酸产生cas蛋白的细胞,所述外源引入核酸编码与内源cas相同或不同的cas。在一些情形中,细胞并非天然地产生cas蛋白,并且进行遗传工程化以产生cas蛋白。在一些实施方案中,cas蛋白是一种小的cas9直向同源物,经由aav载体进行递送(ran,等人(2015)nature 510,第186页)。
[0102]
在一些实施方案中,dna结合分子是ttago系统的一部分(参见swarts等人,同上;sheng等人,同上)。在真核生物中,基因沉默是由蛋白质的argonaute(ago)家族介导的。在此范式中,ago与小(19
‑
31nt)rna结合。此蛋白质
‑
rna沉默复合物通过所述小rna与靶标之间的watson
‑
crick碱基配对来识别靶rna,并且以核酸内切方式切割靶rna(vogel(2014)science 344:972
‑
973)。相比之下,原核ago蛋白与小单链dna片段结合,并且可能作用来检测并去除外源(经常是病毒)dna(yuan等人(2005)mol.cell 19,405;olovnikov等人(2013)mol.cell 51,594;swarts等人,同上)。示例性的原核ago蛋白包括来自风产液菌(aquifex aeolicus)、类球红细菌(rhodobacter sphaeroides)、和嗜热栖热菌(thermus thermophilus)的那些。
[0103]
最充分表征的原核ago蛋白之一是来自嗜热栖热菌(t.thermophilus)的蛋白(ttago;swarts等人,同上)。ttago与具有5’磷酸基团的15nt或13
‑
25nt单链dna片段缔和。ttago结合的这种“指导dna”用于引导蛋白质
‑
dna复合物结合第三方dna分子中的watson
‑
crick互补dna序列。一旦这些指导dna中的序列信息允许鉴定靶dna,ttago
‑
指导dna复合物就会切割靶dna。ttago
‑
指导dna复合物与其靶dna结合时的结构也支持这种机制(g.sheng等人,同上)。来自类球红细菌(rsago)的ago具有相似的特性(olovnikov等人,同上)。
[0104]
可以将任意dna序列的外源指导dna加载到ttago蛋白上(swarts等人,同上)。由于ttago切割的特异性是由指导dna引导的,因此,由外源的由研究者指定的指导dna形成的ttago
‑
dna复合物将ttago靶dna切割引导至互补的由研究者指定的靶dna。以此方式,可以在dna中产生靶向双链断裂。使用ttago
‑
指导dna系统(或来自其他生物的直系同源ago
‑
指导dna系统)允许在细胞内靶向切割基因组dna。这种切割可以是单链或双链。为了切割哺乳动物基因组dna,优选使用为在哺乳动物细胞中表达而优化的ttago密码子形式。此外,可能优选的是用体外形成的ttago
‑
dna复合物处理细胞,其中ttago蛋白与细胞穿透肽融合。另外,可能优选的是使用已经通过诱变改变以使其在37℃时具有改进活性的ttago蛋白形式。使用本领域中利用dna断裂的标准技术,可以使用ago
‑
rna介导的dna切割来影响结果的全景图(包括基因敲除、靶向基因添加、基因校正、靶向基因缺失)。
[0105]
因此,核酸酶包含与任何基因中的靶位点特异性结合的dna结合分子,期望将供体(转基因)插入所述靶位点中。b.切割结构域
[0106]
任何合适的切割结构域可以与dna结合结构域操作性地连接以形成核酸酶。例如,zfp dna结合结构域已与核酸酶结构域融合形成zfn,这是功能实体,所述功能实体能够通过其工程化(zfp)dna结合结构域识别其预期核酸靶标,并导致dna通过核酸酶活性在zfp结合位点附近被切割,包括用于各种生物体中的基因组修饰。参见例如,美国专利号7,888,121;8,623,618;7,888,121;7,914,796和8,034,598;以及美国专利公开号2011/0201055。同样,tale dna结合结构域已与核酸酶结构域融合以产生talen。参见例如,美国专利号8,586,526。
[0107]
如上所述,切割结构域可以与dna结合结构域异源,例如锌指dna结合结构域和来自核酸酶或talen dna结合结构域的切割结构域和切割结构域、或大范围核酸酶dna结合结构域和来自不同核酸酶的切割结构域。异源切割结构域可以从任何核酸内切酶或核酸外切酶获得。可以衍生切割结构域的示例性核酸内切酶,包括但不限于限制性核酸内切酶和归巢核酸内切酶。切割dna的另外的酶是已知的(例如,s1核酸酶;绿豆核酸酶;胰腺dnase i;微球菌核酸酶;酵母ho核酸内切酶)。这些酶(或其功能片段)中的一种或多种可以用作切割结构域和切割半结构域的来源。
[0108]
类似地,切割半结构域可以源自如上列出的任何核酸酶或其部分,其需要二聚化来产切割活性。通常,如果融合蛋白包含切割半结构域,那么切割需要两个融合蛋白。可替代地,可以使用包含两个切割半结构域的单一蛋白质。两个切割半结构域可以源自相同核酸内切酶(或其功能性片段),或者每个切割半结构域可以源自不同核酸内切酶(或其功能性片段)。另外,两个融合蛋白的靶位点优选地关于彼此来布置,使得两个融合蛋白与其各自的靶位点的结合将切割半结构域置于针对彼此的空间定向中,此允许切割半结构域例如
通过二聚化形成功能性切割结构域。因此,在某些实施方案中,靶位点的近边缘被5
‑
8个核苷酸或15
‑
18个核苷酸隔开。但是,任何整数个核苷酸或核苷酸对(例如2至50个核苷酸对或更多)都可以插入两个靶位点之间。通常,切割位点位于靶位点之间。
[0109]
限制性核酸内切酶(限制酶)存在于许多物种中,并且能够与dna(在识别位点)进行序列特异性结合,并能够在结合位点或结合位点附近切割dna。某些限制酶(例如,iis型)在远离识别位点的位点处切割dna,并且具有可分离的结合结构域和切割结构域。例如,iis型foki酶催化dna的双链切割,在一条链上距其识别位点9个核苷酸处,并且在另一条链上距其识别位点13个核苷酸处进行切割。参见例如,美国专利号5,356,802;5,436,150;和5,487,994;以及li等人(1992)proc.natl.acad.sci.usa 89:4275
‑
4279;li等人(1993)proc.natl.acad.sci.usa 90:2764
‑
2768;kim等人(1994a)proc.natl.acad.sci.usa 91:883
‑
887;kim等人(1994b)j.biol.chem.269:31,978
‑
31,982。因此,在一个实施方案中,融合蛋白包含来自至少一种iis型限制酶的切割结构域(或切割半结构域)和一个或多个锌指结合结构域(其可以工程化或可以不经工程化)。
[0110]
其切割结构域可与结合结构域分离的示例性iis型限制酶是foki。此特定酶作为二聚体是活性的。bitinaite等人,(1998)proc.natl.acad.sci.usa 95:10,570
‑
10,575。因此,出于本公开文本的目的,在公开的融合蛋白中使用的foki酶的部分被认为是切割半结构域。因此,对于使用锌指
‑
foki融合物的靶向双链切割和/或靶向替代细胞序列,可以使用各自包含foki切割半结构域的两种融合蛋白来重构有催化活性的切割结构域。可替代地,也可以使用包含锌指结合结构域和两个foki切割半结构域的单一多肽分子。在本公开文本的其他地方提供了使用锌指
‑
foki融合物进行靶向切割和靶向序列改变的参数。
[0111]
切割结构域或切割半结构域可以是蛋白质的任一部分,其保留切割活性,或者保留多聚化(例如,二聚化)以形成功能性切割结构域的能力。
[0112]
示例性的iis型限制酶描述于以其整体并入本文的国际公开wo 07/014275中。另外的限制酶也包含可分离的结合结构域和切割结构域,并且本公开文本考虑了这些。参见例如,roberts等人,(2003)nucleic acids res.31:418
‑
420。
[0113]
在某些实施方案中,所述切割结构域包含最小化或防止同二聚化的一个或多个工程化切割半结构域(也称为二聚化结构域突变体),例如如在美国专利号8,623,618;7,888,121;7,914,796;和8,034,598;以及美国专利公开号2011/0201055中所述,其全部披露内容通过引用以其整体并入本文。在foki的位置446、447、479、483、484、486、487、490、491、496、498、499、500、531、534、537和538处的氨基酸残基都是影响foki切割半结构域二聚化的靶标。
[0114]
在某些实施方案中,工程化的切割半结构域源自foki,并且在相对于如下所示的野生型foki切割半结构域(全长foki的残基394至579)编号的氨基酸残基416、422、447、448和/或525(参见例如,美国专利公开号20180087072)中的一个或多个中包含一种或多种突变:野生型foki切割半结构域(seq id no:1)qlvkseleekkselrhklkyvpheyielieiarnstqdrilemkvmeffmkvygyrgkhlggsrkpdgaiytvgspidygvivdtkaysggynlpigqademqryveenqtrnkhinpnewwkvypssvtefkflfvsghfkgnykaqltrlnhitncngavlsveelliggemikagtltleevrrkfnngeinf
[0115]
这些突变减少foki结构域与dna分子之间的非特异性相互作用。在其他实施方案中,源自foki的切割半结构域在氨基酸残基414
‑
426、443
‑
450、467
‑
488、501
‑
502和/或521
‑
531中的一个或多个中包含突变。所述突变可以包括与foki同源的天然限制性酶中存在的残基的突变。在某些实施方案中,所述突变是取代,例如野生型残基被不同的氨基酸,例如丝氨酸(s),例如r416s或k525s取代。在优选实施方案中,在位置416、422、447、448和/或525处的突变包括带正电的氨基酸被不带电或带负电的氨基酸替代。在另一个实施方案中,除一个或多个氨基酸残基416、422、447、448或525中的突变之外,工程化的切割半结构域在氨基酸残基499、496和486中包含突变。在优选实施方案中,本发明提供了融合蛋白,其中工程化的切割半结构域包含多肽,其中除在位置416、422、447、448或525处的一种或多种突变之外,位置486处的野生型gln(q)残基被glu(e)残基替代,位置499处的野生型ile(i)残基被leu(l)替代,并且位置496处的野生型asn(n)残基被asp(d)或glu(e)残基(“eld”或“ele”)替代。
[0116]
可以使用具有多于一个突变的切割结构域,例如在一个切割半结构域中位置490(e
→
k)和538(i
→
k)处的突变,以产生被命名为“e490k:i538k”的工程化的切割半结构域,并且通过使在另一个切割半结构域中的位置486(q
→
e)和499(i
→
l)突变以产生被命名为“q486e:i499l”的工程化的切割半结构域;使位置486处的野生型gln(q)残基被glu(e)残基替代,使位置499处的野生型iso(i)残基被leu(l)残基替代并且使残基496处的野生型asn(n)残基被asp(d)或glu(e)残基(分别也被称为“eld”和“ele”结构域)替代的突变;工程化的切割半结构域包含在位置490、538和537(相对于野生型foki编号)处的突变,例如使位置490处的野生型glu(e)残基被lys(k)残基替代,使位置538处的野生型iso(i)残基被lys(k)残基替代并且使位置537处的野生型his(h)残基被lys(k)残基或arg(r)残基(分别也被称为“kkk”和“kkr”结构域)替代的突变;并且/或者工程化的切割半结构域包含在位置490和537(相对于野生型foki编号)处的突变,例如使位置490处的野生型glu(e)残基被lys(k)残基替代并且使位置537处的野生型his(h)残基被lys(k)残基或arg(r)残基(分别也被称为“kik”和“kir”结构域)替代的突变。参见例如,美国专利号7,914,796;8,034,598;和8,623,618;其披露内容出于所有目的通过引用以其整体并入。在其他实施方案中,工程化的切割半结构域包含“sharkey”和/或“sharkey”突变(参见guo等人,(2010)j.mol.biol.400(1):96
‑
107)。
[0117]
可替代地,核酸酶可以使用所谓的“分裂酶”技术在体内组装于核酸靶位点处(参见例如,美国专利公开号2009/0068164)。此类分裂酶的组分可以在单独的表达构建体上表达,或者可以连接于一个开放式阅读框中,其中个别组分例如由自裂解的2a肽或ires序列隔开。组分可以是个别锌指结合结构域或大范围核酸酶核酸结合结构域的结构域。
[0118]
可以在使用前例如在基于酵母的染色体系统中针对活性来筛选核酸酶,如美国专利号8,563,314中所述。
[0119]
cas9相关的crispr/cas系统包含两个rna非编码组分:含有被相同的直接重复序列(dr)间隔的核酸酶指导序列(间隔子)的tracrrna和前
‑
crrna阵列。为了使用crispr/cas系统来实现基因组工程化,必须存在这些rna的两种功能(参见cong等人(2013)sciencexpress 1/10.1126/science 1231143)。在一些实施方案中,tracrrna和前
‑
crrna经由单独的表达构建体或作为单独的rna供应。在其他实施方案中,构建嵌合rna,其中将工
程化的成熟crrna(赋予靶特异性)与tracrrna(供应与cas9的相互作用)融合以产生嵌合cr
‑
rna
‑
tracrrna杂交物(也被称为单一指导rna)。(参见jinek等人(2012)science 337:816
‑
821;jinek等人(2013)elife 2:e00471.doi:10.7554/elife.00471和cong,同上)。
[0120]
在一些实施方案中,使用crispr
‑
cpf1系统。在弗朗西斯氏菌属物种(francisella spp)中鉴定出的crispr
‑
cpf1系统是一种2类crispr
‑
cas系统,其可在人细胞中介导稳健的dna干扰。尽管cpf1和cas9在功能上是保守的,但它们在许多方面(包括在cpf1和cas9的指导rna和底物特异性方面)都存在差异(参见fagerlund等人(2015)genom bio 16:251)。cas9与cpf1蛋白之间的主要区别是cpf1不利用tracrrna,并且因此仅需要crrna。fncpf1 crrna的长度为42
‑
44个核苷酸(19
‑
核苷酸重复序列和23
‑
25
‑
核苷酸间隔子),并且包含单个茎
‑
环,可以耐受保留二级结构的序列变化。此外,cpf1 crrna明显短于cas9所需的约100个核苷酸的工程化sgrna,并且对于fncpfl的pam要求是在置换链上的5'
‑
ttn
‑
3'和5'
‑
cta
‑
3'。尽管cas9和cpf1都在靶dna中产生双链断裂,但是cas9使用其ruvc和hnh样结构域以在指导rna的种子序列内进行平末端切割,而cpf1使用ruvc样结构域以在种子序列外产生交错切割。由于cpf1远离关键种子区域进行交错切割,因此nhej不会破坏靶位点,因此确保cpf1可以继续切割同一位点,直到发生所需的hdr重组事件为止。因此,在本文描述的方法和组合物中,应理解术语“cas”包括cas9和cpf1蛋白二者。因此,如本文所用,“crispr/cas系统”是指crispr/cas和/或crispr/cpf1系统,包括核酸酶和/或转录因子系统二者。靶位点
[0121]
如上所述,dna结合结构域可以被工程化为与选择的任何序列结合。与天然存在的dna结合结构域相比,工程化dna结合结构域可以具有新颖的结合特异性。
[0122]
在某些实施方案中,所述一种或多种核酸酶可以靶向任何野生型或突变体mtdna序列,所述核酸酶选择性地靶向突变体mtdna,例如涵盖诸如以下项的突变体mtdna序列的9
‑
25个或更多个核苷酸(连续或非连续)的靶位点:1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c或14709c或如表2所示的靶位点。
[0123]
遵循本说明书的教导,此类表达盒的构建利用分子生物学领域熟知的方法(参见例如,ausubel或maniatis)。在使用表达盒来生成转基因动物之前,表达盒对于与所选的控制元件缔和的应激诱导子的反应性可以通过将表达盒引入合适的细胞系(例如,原代细胞、转化细胞或永生化细胞系)中来测试。
[0124]
此外,尽管对于表达不是必需的,但外源序列也可以是转录或翻译调控序列,例如启动子、增强子、绝缘子、内部核糖体进入位点、编码2a肽的序列、锤头状核酶、靶向肽和/或聚腺苷酸化信号。此外,目的基因的控制元件可以与报告基因可操作地连接以产生嵌合基因(例如,报告物表达盒)。
[0125]
还可以实现非编码核酸序列的靶向插入。编码反义rna、rnai、shrna和微rna(mirna)的序列也可以用于靶向插入。
[0126]
在另外的实施方案中,供体核酸可以包含非编码序列,所述非编码序列是针对另外的核酸酶设计的特异性靶位点。随后,另外的核酸酶可以在细胞中表达,使得通过插入另一个目的供体分子来切割和修饰原始供体分子。以这种方式,可以产生供体分子的重复整合,从而允许在特定目的基因座处或在安全港基因座处的特性堆积(trait stacking)。
细胞
[0127]
因此,本文提供了包含经遗传修饰的mtdna基因的经遗传修饰的细胞。在某些实施方案中,所述修饰包括切割突变体mtdna,使得改变mtdna的异质性比率。在某些实施方案中,在患有一种或多种线粒体障碍的患者中切割突变体mtdna,使得治疗和/或预防所述障碍或其相关的症状。核酸酶可以差异地结合并切割任何突变体mtdna,包括但不限于在点突变(诸如m.5024c>t)处结合。
[0128]
与随机切割不同,靶向切割确保例如在设计核酸酶,使得dna结合结构域与突变的序列结合并且展现出对于突变体形式的特异性时,与野生型相比,mtdna的突变体形式优先被切割。
[0129]
任何细胞类型可以如本文所述进行遗传修饰,所述细胞类型包括但不限于细胞和细胞系。含有经修饰的mtdna的细胞的其他非限制性例子包括心脏细胞、脑细胞、肺细胞、肝细胞、t细胞(例如,cd4+、cd3+、cd8+等);树突细胞;b细胞;自体(例如,患者来源的)或异源多能、全能或多潜能干细胞(例如,cd34+细胞,包括多能干细胞(ipsc)、胚胎干细胞等)。在某些实施方案中,如本文所述的细胞是源自患者的cd34+细胞。
[0130]
如本文所述的细胞可用于例如通过体内或离体疗法治疗和/或预防患有所述障碍的受试者的线粒体疾病。对于离体疗法,可以使用标准技术扩增核酸酶修饰的细胞,并且然后再引入到患者中。参见例如,tebas等人,(2014)new eng j med 370(10):901。在干细胞的情况下,在输注到受试者中之后,与野生型(患病)细胞相比,这些前体以改变的异质性比率分化成表达mtdna的细胞。还提供包含如本文所述的细胞的药物组合物。另外,在向患者给予之前,所述细胞可以低温保存。
[0131]
如本文所述的细胞和离体方法提供对于受试者(例如,哺乳动物受试者)的障碍(例如,线粒体障碍)的治疗和/或预防,并且消除对于连续预防性药物给予或有风险的程序(诸如异基因骨髓移植或γ逆转录病毒递送)的需要。由此,本文所述的本发明提供了一种更安全、成本有效且节省时间的治疗和/或预防线粒体障碍的方式。递送
[0132]
本文所述的核酸酶、编码这些核酸酶的多核苷酸、供体多核苷酸和包含本文所述的蛋白质和/或多核苷酸的组合物可以通过任何合适的手段递送。在某些实施方案中,核酸酶和/或供体在体内递送。在其他实施方案中,将核酸酶和/或供体递送到分离的细胞(例如,自体或异源干细胞),以提供可用于向患者离体递送的经修饰的细胞。
[0133]
递送如本文描述的核酸酶的方法描述于例如以下文献中:美国专利号6,453,242;6,503,717;6,534,261;6,599,692;6,607,882;6,689,558;6,824,978;6,933,113;6,979,539;7,013,219;和7,163,824,其全部披露内容通过引用以其整体并入本文。
[0134]
如本文所述的核酸酶和/或供体构建体还可以使用任何核酸递送机制(包括裸dna和/或rna(例如,mrna)和含有编码一种或多种组分的序列的载体)递送。可以使用任何载体系统,包括但不限于质粒载体、dna微环、逆转录病毒载体、慢病毒载体、腺病毒载体、痘病毒载体;疱疹病毒载体和腺相关病毒载体等及其组合。还参见美国专利号6,534,261;6,607,882;6,824,978;6,933,113;6,979,539;7,013,219;和7,163,824;以及美国专利公开号2014/0335063,其通过引用以其整体并入本文。此外,清楚的是,这些系统中的任一种可以包含处理所需的一种或多种序列。因此,当将一种或多种核酸酶和供体构建体引入细胞中
时,可以将核酸酶和/或供体多核苷酸携带在相同递送系统上或不同递送机制上。当使用多种系统时,每种递送机制可以包含编码一种或多种核酸酶的序列和/或供体构建体(例如,编码一种或多种核酸酶的mrna和/或携带一种或多种供体构建体的mrna或aav)。
[0135]
可使用常规的基于病毒和非病毒的基因转移方法在细胞(例如哺乳动物细胞)和靶组织中引入编码核酸酶和供体构建体的核酸。非病毒载体递送系统包括dna质粒、dna微环、裸核酸和与递送运载体(诸如脂质体或泊洛沙姆(poloxamer))复合的核酸。病毒载体递送系统包括dna和rna病毒,其在递送至细胞之后具有附加型或整合的基因组。对于基因疗法程序的综述,参见anderson,science 256:808
‑
813(1992);nabel和felgner,tibtech 11:211
‑
217(1993);mitani和caskey,tibtech 11:162
‑
166(1993);dillon,tibtech 11:167
‑
175(1993);miller,nature 357:455
‑
460(1992);van brunt,biotechnology 6(10):1149
‑
1154(1988);vigne,restorative neurology and neuroscience 8:35
‑
36(1995);kremer和perricaudet,british medical bulletin 51(1):31
‑
44(1995);haddada等人,current topics in microbiology and immunology doerfler和(编)(1995);以及yu等人,gene therapy 1:13
‑
26(1994)。
[0136]
核酸的非病毒递送方法包括电穿孔、脂转染、显微注射、生物弹道学、病毒体、脂质体、免疫脂质体、多聚阳离子或脂质:核酸缀合物、脂质纳米颗粒(lnp)、裸dna、裸rna、加帽的rna、人工病毒粒子和试剂增强的dna摄取。还可以使用采用例如sonitron 2000系统(rich
‑
mar)的声致穿孔(sonoporation)来递送核酸。
[0137]
其他示例性核酸递送系统包括由以下项提供的那些:amaxa biosystems(cologne,德国)、maxcyte,inc.(rockville,马里兰)、btx分子递送系统(holliston,ma)和copernicus therapeutics inc.(参见例如美国专利号6,008,336)。脂质转染描述于例如美国专利号5,049,386;4,946,787;和4,897,355中,并且脂质转染试剂在市场上有售(例如,transfectam
tm
和lipofectin
tm
)。适合于多核苷酸的有效受体识别脂转染的阳离子型和中性脂质包括felgner,国际专利公开号wo 91/17424、wo 91/16024的那些。在一些方面,核酸酶作为mrna递送,并且转基因经由其他形式(诸如病毒载体、微环dna、质粒dna、单链dna、线性dna、脂质体、纳米颗粒等)递送。
[0138]
脂质:核酸复合物(包括靶向的脂质体诸如免疫脂质复合物)的制备是本领域技术人员熟知的(参见例如,crystal,science 270:404
‑
410(1995);blaese等人,cancer gene ther.2:291
‑
297(1995);behr等人,bioconjugate chem.5:382
‑
389(1994);remy等人,bioconjugate chem.5:647
‑
654(1994);gao等人,gene therapy 2:710
‑
722(1995);ahmad等人,cancer res.52:4817
‑
4820(1992);美国专利号4,186,183;4,217,344;4,235,871;4,261,975;4,485,054;4,501,728;4,774,085;4,837,028;和4,946,787)。
[0139]
其他递送方法包括使用将要递送的核酸包装至engeneic递送运载体(edv)中。这些edv被使用双特异性抗体特异性地递送至靶组织中,其中所述抗体的一个臂对所述靶组织具有特异性,并且另一个臂对edv具有特异性。抗体将edv负载至靶细胞表面,之后edv通过胞吞作用被引入细胞中。进入细胞后,内容物被释放(参见macdiarmid等人,(2009)nature biotechnology 27(7):643)。
[0140]
使用基于rna或dna病毒的系统递送编码工程化的crispr/cas系统的核酸利用高度演进的方法将病毒靶向体内的特定细胞并将病毒有效负载运输至细胞核中。可以将病毒
(1998),kearns等人,gene ther.9:748
‑
55(1996))。根据本发明,也可以使用其他aav血清型,包括aav1、aav3、aav4、aav5、aav6、aav8、aav8.2、aav9、aav9.45和aavrh10以及假型化aav,诸如aav2/8、aav2/5和aav2/6。在一些实施方案中,使用靶向心脏、肺、大脑和/或肌肉的aav血清型,包括但不限于使用能够跨血脑屏障的aav血清型。
[0146]
复制缺陷型重组腺病毒载体(ad)可以以高滴度产生,并且易于感染多种不同的细胞类型。对大多数腺病毒载体进行工程化,使得转基因替代ad e1a、e1b和/或e3基因;随后使复制缺陷性载体在反式供应所缺失的基因功能的人类293细胞中增殖。ad载体可以在体内转导多种类型的组织,包括非分裂的已分化细胞,诸如在肝、肾和肌肉中发现的那些。常规ad载体具有较大运载能力。ad载体在临床试验中的使用的例子涉及使用肌内注射的用于抗肿瘤免疫的多核苷酸疗法(sterman等人,hum.gene ther.7:1083
‑
9(1998))。腺病毒载体用于临床试验中的基因转移的用途的额外例子包括rosenecker等人,infection 24:1 5
‑
10(1996);sterman等人,hum.gene ther.9:71083
‑
1089(1998);welsh等人,hum.gene ther.2:205
‑
18(1995);alvarez等人,hum.gene ther.5:597
‑
613(1997);topf等人,gene ther.5:507
‑
513(1998);sterman等人,hum.gene ther.7:1083
‑
1089(1998)。
[0147]
包装细胞用于形成能感染宿主细胞的病毒粒子。此类细胞包括包装腺病毒的293细胞以及包装逆转录病毒的ψ2细胞或pa317细胞。用于基因疗法中的病毒载体通常是由将核酸载体包装至病毒粒子中的生产细胞系产生。载体典型地含有包装和随后整合至宿主中(如果适用)所需的最小病毒序列,其他病毒序列由编码要表达的蛋白质的表达盒替代。失去的病毒功能由包装细胞系反式供应。例如,用于基因疗法中的aav载体典型地仅具有来自aav基因组的反相末端重复(itr)序列,所述序列是包装和整合至宿主基因组中所需的。将病毒dna包装于细胞系中,所述细胞系含有编码其他aav基因(即,rep和cap)但缺少itr序列的辅助质粒。所述细胞系还被作为辅助者的腺病毒感染。辅助病毒促进aav载体的复制和来自辅助质粒的aav基因的表达。由于缺少itr序列,辅助质粒并未被大量包装。腺病毒的污染可以通过例如热处理来减少,腺病毒对所述热处理比aav更敏感。
[0148]
在许多基因疗法应用中,可期望以高度特异性将基因疗法载体递送至特定组织类型。因此,可以修饰病毒载体,以通过将配体表达为与病毒外表面上的病毒外壳蛋白的融合蛋白而具有对给定细胞类型的特异性。配体被选择以具有对已知存在于目标细胞类型上的受体的亲和力。例如,han等人,proc.natl.acad.sci.usa 92:9747
‑
9751(1995)报道,莫洛尼(moloney)鼠白血病病毒可以被修饰以表达与gp70融合的人类神经生长因子,并且重组病毒感染某些表达人类表皮生长因子受体的人类乳腺癌细胞。这个原则可以扩展至其他病毒
‑
靶细胞对,其中靶细胞表达受体并且病毒表达包含针对细胞表面受体的配体的融合蛋白。例如,丝状噬菌体可以被工程化以展示对实际上任何所选细胞受体具有特定结合亲和力的抗体片段(例如,fab或fv)。虽然上述说明主要适用于病毒载体,但是相同原则可以适用于非病毒载体。此类载体可以被工程化以含有特定摄取序列,所述摄取序列有利于被特定靶细胞摄取。
[0149]
基因疗法载体可以通常通过如下所述的系统性给予(例如,静脉内、腹膜内、肌内、皮下、舌下或颅内输注)局部施加或经由肺吸入在体内给予至个体受试者来递送。可替代地,可以将载体离体递送至细胞中,例如从个别患者外植的细胞(例如,淋巴细胞、骨髓抽取物、组织活检)或全适供血者造血干细胞,之后将所述细胞再植入患者体内,通常在选择已
经掺入所述载体的细胞后再植入。
[0150]
也可以将含有核酸酶和/或供体构建体的载体(例如,逆转录病毒、腺病毒、脂质体等)直接给予至生物体以在体内转导细胞。可替代地,可以给予裸dna。通过通常用于引入分子以与血液或组织细胞最终接触的任何途径给予,所述途径包括但不限于注射、输注、局部施加、吸入和电穿孔。使用此类核酸的适宜方法是本领域技术人员可获得的并且所熟知的,并且虽然可以使用多于一种途径来给予特定组合物,但是特定途径通常可以提供比另一途径更直接并且更有效的反应。
[0151]
适用于引入本文所述的多核苷酸的载体包括非整合慢病毒载体(idlv)。参见例如,ory等人(1996)proc.natl.acad.sci.usa 93:11382
‑
11388;dull等人(1998)j.virol.72:8463
‑
8471;zuffery等人(1998)j.virol.72:9873
‑
9880;follenzi等人(2000)nature genetics 25:217
‑
222;美国专利号8,936,936。
[0152]
药学上可接受的载体部分取决于所给予的特定组合物,以及取决于用于给予所述组合物的特定方法。因此,存在众多种可使用的药物组合物的适宜制剂,如下文所述(参见例如,remington's pharmaceutical sciences,第17版,1989)。
[0153]
清楚的是,可以使用相同或不同的系统递送核酸酶编码序列和供体构建体。例如,供体多核苷酸可以由aav携带,而一种或多种核酸酶可以由mrna携带。此外,可以通过相同或不同的途径给予(肌内注射、尾静脉注射、其他静脉注射、腹膜内给予和/或肌内注射)不同的系统。可以同时或以任何顺序递送多种载体。
[0154]
用于离体和体内给予的制剂包括在液体或乳化液体中的悬浮液。活性成分经常与药学上可接受的且与活性成分相容的赋形剂混合。合适的赋形剂包括例如水、盐水、右旋糖、甘油、乙醇等及其组合。另外,所述组合物可以含有少量辅助物质,诸如润湿剂或乳化剂、ph缓冲剂、稳定剂或增强药物组合物的有效性的其他试剂。
[0155]
用于修饰mtdna,包括用于治疗和/或预防线粒体障碍所给予的有效量将在受试者之间并且根据给予模式和给予部位而变化。因此,有效量最佳由给予组合物的人来决定,并且本领域普通技术人员可以容易地决定适当剂量。在某些实施方案,在允许足够时间进行表达(例如,通常2
‑
15天或更多)之后,分析mtdna修饰的血清或其他组织水平以及与给予之前相比较将确定所给予的量是否过低、在适当范围内或者过高。用于初始和后续给予的适宜方案也是可变的,但是如果需要,以初始给予随后为后续给予为代表。后续给予可以按可变间隔来给予,介于每天至每年至每隔若干年的范围内。在某些实施方案中,在使用病毒载体诸如aav时,给予的总剂量或组分剂量可以在1x10
10
与5x10
15
个vg/ml之间(或其间的任何值),甚至更优选地在1x10
11
与1x10
14
个vg/ml之间(或其间的任何值),甚至更优选地在1x10
12
与1x10
13
个vg/ml之间(或其间的任何值)。在一些实施方案中,总剂量可以静脉内给予并且可以在5e12个vg/kg与1e15个vg/kg之间(或其间的任何值),甚至更优选地在5e13个vg/kg与5e14个vg/kg之间(或其间的任何值),甚至更优选地在5e13个vg/kg与1e14个vg/kg之间(或其间的任何值)。应用
[0156]
本文公开的方法和组合物用于例如通过改变突变体mtdna与野生型dna的异质性比率,使得线粒体疾病或障碍得以治疗和/或预防来为所述疾病和障碍提供疗法。所述细胞可以体内修饰或者可以离体修饰,并且随后向受试者给予。因此,所述方法和组合物提供对
于线粒体障碍的治疗和/或预防。
[0157]
可以使用本文所述的方法和组合物治疗和/或预防的线粒体障碍的非限制性例子包括:lhon(leber遗传性视神经病变)、mm(线粒体肌病)、ad(阿尔茨海默氏病)、limm(致死性婴儿线粒体肌病)、adpd(阿尔茨海默氏病和帕金森氏病)、mmc(母系肌病和心肌病)、narp(神经源性肌肉软弱、共济失调和视网膜色素变性;被报告为leigh病的在此基因座处的交替表型)、ficp(致死性婴儿心肌病加melas相关心肌病)、melas(线粒体脑肌病、乳酸酸中毒和中风样发作)、ldyt(leber遗传性视神经病变和肌张力障碍)、merrf(肌阵挛性癫痫和破碎样红肌肉纤维)、mhcm(母系遗传的肥厚性心肌病)、cpeo(慢性进行性眼外肌麻痹)、kss(kearns sayre综合征)、dm(糖尿病)、dmdf(糖尿病+耳聋)、cipo(伴随肌病和眼肌麻痹的慢性假性肠梗阻)、deaf(母系遗传的耳聋或氨基糖苷诱导的耳聋)、pem(进行性脑病)、snhl(感音神经性聋)、老化、脑肌病、fbsn(家族性双侧纹状体坏死)、peo和sne(亚急性坏死性脑病)。
[0158]
核酸酶介导的切割可以用于校正与疾病相关的mtdna序列(例如,点突变、取代突变等)。校正可以经由例如在有效的dna修复机制不存在的情况下切割的mtdna序列的降解进行,通常在线粒体中是这种情况。可以被靶向的特定突变体人mtdna包括1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c和14709c。
[0159]
以非限制性例子的方式,本文所述的方法和组合物可以用于治疗和/或预防线粒体障碍,包括但不限于线粒体肌病;糖尿病和耳聋(dad);leber病;leber遗传性视神经病变(lhon),其特征在于由于视神经和视网膜的变性而导致中央视觉的进行性丧失,在芬兰影响50,000分之1的人;leigh综合征;母系遗传的leigh综合征;leigh样综合征;神经病、共济失调、视网膜色素变性和上睑下垂(narp);肌神经源性胃肠脑病(mngie);伴随破碎样红纤维的肌阵挛性癫痫(merrf);线粒体肌病、脑肌病、乳酸酸中毒、中风样发作(melas);mtdna缺失线粒体神经胃肠脑肌病(mngie)、心肌病、耳聋、其他障碍。
[0160]
以下实施例涉及本公开文本的示例性实施方案,其中核酸酶包含锌指核酸酶(zfn)。应理解,这仅是出于示例的目的并且可以使用其他核酸酶,例如talen、ttago和crispr/cas系统、具有工程化dna结合结构域的归巢核酸内切酶(大范围核酸酶)和/或天然存在的工程化的归巢核酸内切酶(大范围核酸酶)dna结合结构域与异源切割结构域的融合物和/或大范围核酸酶与tale蛋白的融合物。例如,另外的核酸酶可以被设计成与包含本文公开的序列的9至12个连续核苷酸的序列(例如,表2)结合。另外,以下实施例涉及这样的核酸酶,其中dna结合结构域(zfp、tal效应子结构域、sgrna等)与具有5024c>t突变(如表2所示)的mtdna选择性地结合。应清楚的是,这仅是出于示例的目的并且设想与其他突变体mtdna序列结合的核酸酶,包括但不限于以下位置中的一个或多个处的一种或多种突变:1555g、1624t、3243g、3460a、3271c、4300g、5545t、7445g、7472随机插入、8344g、8356c 8993g、9176g/c、10158c、10191c、10197a、11777a、11778a、13513a、14459a、14484c、14487c和/或14709c。实施例实施例1:mtdna核酸酶
[0161]
基本上如以下文献中所述来设计靶向至mtdna的锌指蛋白并且将其掺入mrna、质
粒、aav或腺病毒载体中:gammage等人(2014)embo mol med.6:458
‑
466;gammage等人(2016)methods in mol.biol.1351:145
‑
162;美国专利号6,534,261和9,139,628。
[0162]
具体地,生成具有对于突变体mtdna(m5024c>t)的单核苷酸结合特异性的zfp对。参见图1。因为小鼠mtdna中的此位点对于zfp是具有挑战性的,所以采用具有不同数量的锌指基序、间隔区长度和另外的接头的靶向策略的选择。候选zfp的组装产生被称为突变体特异性单体(mtm)的靶向m.5024c>t位点的24个独特zfp;和被称为野生型特异性单体1(wtm1)的靶向相对链上的相邻序列的单一配偶体zfp的文库(图1a)。
[0163]
通过在5’ecori与3’bamhi限制位点之间的foki(+)的上游插入mtm zfp结构域来克隆mtm(n)_t2a_wtm1 m.5024c>t候选文库。然后对此产物进行pcr扩增,以包括5’apai位点并去除3’终止密码子,同时还掺入t2a序列和3’xhoi位点。然后使用apai/xhoi位点将此片段克隆到pcmcherry(addgene 62803)中。使用5’ecori和3’bamhi位点在掺入3’锤头状核酶(hhr)的pcmcherry_3k19载体(addgene 104499)中foki(
‑
)的上游单独克隆wtm1 zfp,并且对所得产物进行pcr扩增,以包括5’xhoi和3’aflii位点,从而允许在mtm(n)变体的下游克隆。
[0164]
还将mtm25(+)和wtm1(
‑
)单体克隆到单独的pcmcherry和ptracer载体中,如先前在gammage等人(2016)methods in mol.biol.1351:145
‑
162中所述。通过mtm25(+)_hhr和wtm1(
‑
)_hhr转基因的pcr扩增掺入5’eagi和3’bglii位点来实现预期用于aav产生的mtzfn的载体构建。
[0165]
然后将这些产物克隆到raav2
‑
cmv中的5’eagi与3’bamhi位点之间。通过pcr用血凝素(ha)标签替代wtm1(
‑
)的flag表位。使用所得质粒在unc基因疗法中心的载体核心实验室(unc gene therapy center,vector core facility,教堂山,北卡罗来纳州)生成重组aav2/9.45
‑
cmv
‑
mtm25和aav2/9.45
‑
cmv
‑
wtm1病毒颗粒。将3k19锤头状核酶(hhr)序列(beilstein等人(2015)acs synth biol 4:526
‑
534)掺入mtzfn
‑
aav9.45构建体中,以允许来自cmv的转基因的普遍表达,同时限制表达水平,从而允许给予在不诱导大mtdna拷贝数缺失的情况下确保靶向组织中细胞的有效共转导所需的高病毒滴度。
[0166]
表1示出了示例性mtdna zfp dna结合结构域的dna结合结构域内的识别螺旋和这些zfp的靶位点(dna靶位点用大写字母表示;非接触核苷酸用小写字母表示)。由zfp识别螺旋接触的靶位点中的核苷酸用大写字母表示;非接触核苷酸用小写字母表示。还遵循本领域已知的方法将talen和/或sgrna设计成表2中所示的序列(例如,包含表2中所示的靶位点的9至20个或更多个(包括9、10、11、12、13、14、15、16、17、18、19、20、21个或更多个)核苷酸(连续或非连续的核苷酸)的靶位点)。参见例如,美国专利号8,586,526(使用talen的经典或非经典rvd)和美国专利公开号2015/0056705。表1:mtdna锌指蛋白识别螺旋设计
表2:锌指蛋白的靶位点mtm#sbs#靶位点wtm148960aagttaaacttgtgtgttttcttagggc(seq id no:33)mtm6248962tgataaggattgtaagacttcatcctac(seq id no:34)mtm2451024tgataaggattgtaagacttcatcctac(seq id no:34)mtm2551025tgataaggattgtaagacttcatcctac(seq id no:34)mtm2651026tgataaggattgtaagacttcatcctac(seq id no:34)mtm2751027tgataaggattgtaagacttcatcctac(seq id no:34)mtm2851028tgataaggattgtaagacttcatcctac(seq id no:34)mtm2951029tgataaggattgtaagacttcatcctac(seq id no:34)mtm3051030tgataaggattgtaagacttcatcctac(seq id no:34)mtm3251032tgataaggattgtaagacttcatcctac(seq id no:34)mtm3351033tgataaggattgtaagacttcatcctac(seq id no:34)mtm3651036tgataaggattgtaagacttcatcctac(seq id no:34)mtm3751037tgataaggattgtaagacttcatcctac(seq id no:34)mtm3951039tgataaggattgtaagacttcatcctac(seq id no:34)mtm4251042tgataaggattgtaagacttcatcctac(seq id no:34)mtm4351043tgataaggattgtaagacttcatcctac(seq id no:34)mtm4551045tgataaggattgtaagacttcatcctac(seq id no:34)mtm6548965gataaggattgtaagacttcatcctaca(seq id no:35)mtm6648966gataaggattgtaagacttcatcctaca(seq id no:35)mtm4851048gataaggattgtaagacttcatcctaca(seq id no:35)mtm4951049gataaggattgtaagacttcatcctaca(seq id no:35)mtm5051050gataaggattgtaagacttcatcctaca(seq id no:35)mtm5251052gataaggattgtaagacttcatcctaca(seq id no:35)mtm5551055gataaggattgtaagacttcatcctaca(seq id no:35)mtm5651056gataaggattgtaagacttcatcctaca(seq id no:35)
[0167]
测试所有zfn成对组合的切割活性。将野生型和m.5024c>t小鼠胚胎成纤维细胞(mef)细胞系在含有2mm l
‑
谷氨酰胺、110mg/l丙酮酸钠(life technologies)和10%fcs(paa laboratories)的dulbecco改进的eagle培养基(dmem)中培养。使用mef1试剂盒和t20程序,使用nucleofector ii设备(lonza)通过电穿孔转染细胞。如gammage等人(2016)methods mol biol 1352:145
‑
162中所述进行荧光激活细胞分选(facs)。通过将四环素滴定到培养基中,控制hhr自催化的速率来实现mtzfn表达的控制,如先前在gammage等人
(2016)nucleic acids res 44:7804中所述,其还描述如何进行总细胞蛋白提取。通过在sds
‑
page 4%
‑
12%bis
‑
tris bolt凝胶上拆分20
‑
100μg提取的蛋白质来实现通过蛋白质印迹检测蛋白质。使用iblot 2转移池(life technologies)将这些转移到硝基纤维素。此工作中用于蛋白质印迹的抗体:大鼠抗ha(roche,1:500)、山羊抗大鼠hrp(santa cruz,1:1000)。使用考马斯亮蓝(life technologies)对凝胶进行染色以用于负载。发现所有的对是活性的。
[0168]
还在携带约65%m.5024c>t的小鼠胚胎成纤维细胞(mef)中使构建体经受若干轮的筛选以评估异质性偏移活性。如图1所示,这些筛选鉴定成对mtm25/wtm1的一致的特异性活性,其在mef细胞系中产生从65%至45%m.5024c>t的约20%偏移,如通过焦磷酸测序所测定的。简而言之,通过焦磷酸测序进行m.5024c>t mtdna异质性的评估。使用具有以下引物的100ng模板dna,使用kod dna聚合酶(takara)准备40个周期的用于焦磷酸测序的pcr反应:m.4,962
–
4,986正向5’atactagtccgcgagccttcaaag 3’(seq id no:36)m.5,360
–
m.5,383反向5’[btn]gagggttccgatatctttgtgatt 3’(seq id no:37)m.5003
–
m.5022测序引物5’aagtttaacttctgataagg 3’(seq id no:38)
[0169]
另外,如minczuk等人(2010)methods mol biol 649:257
‑
270中所述通过固定mef细胞中的免疫荧光确认线粒体定位。mtm25和wtm1唯一地定位在线粒体中,并且选择此对用于进一步的体内实验。
[0170]
应清楚的是,这些设计可以包括在任何指分子之间和/或在zfp与切割结构域之间的任何接头,包括但不限于如美国专利号9,394,531中所述的经典和/或非经典接头(在指之间)和/或zfp与切割结构域之间的接头。还参见,美国专利号8,772,453和美国专利公开号2015/0064789。
[0171]
此外,可以设计除zfn以外的核酸酶(包括crispr/cas核酸酶、talen等)以靶向9
‑
18个或更多个如以上所示的核苷酸的位点。核酸酶(zfn、crispr/cas系统和talen)中的任一种可以包含工程化切割结构域(例如美国专利号8,623,618中披露的异二聚体(例如,eld和kkr工程化切割结构域))和/或如美国专利公开号20180087072中所述的在位置416、422、447、448和/或525中具有一种或多种突变的切割结构域。这些突变体与本文所述的示例性zfp dna结合结构域结合使用。实施例2:体内核酸酶活性
[0172]
还在小鼠体内测试核酸酶活性。将此研究中使用的c57bl/6j
‑
t rna
ala
小鼠以每个笼子一至四只圈养在温度受控(21℃)的房间中,其中明亮
‑
黑暗周期为12h并且相对湿度为60%。
[0173]
在单独的病毒基因组中编码mtm25和wtm1 mtzfn单体并且将其包裹在心脏靶向性的工程化aav9.45血清型中(图1d)。参见pulicheria等人(2011)mol ther 19:1070
‑
1078。通过在sds
‑
page 4%
‑
12%bis
‑
tris bolt凝胶上拆分20
‑
100μg提取的蛋白质来实现通过蛋白质印迹检测蛋白质。使用iblot 2转移池(life technologies)将这些转移到硝基纤维
素。此工作中用于蛋白质印迹的抗体:大鼠抗ha(roche,11867431001,1:500)、山羊抗大鼠hrp(santa cruz,sc2065,1:1000)。使用考马斯亮蓝(life technologies)对凝胶进行染色以用于负载。
[0174]
如图1e所示,在系统性(尾静脉)给予5x10
12
个病毒基因组(vg)/单体/小鼠之后,通过蛋白质印迹检测总小鼠心脏组织中mtm25和wtm1的稳健表达。
[0175]
如下进行进一步的体内实验。如下所示在组中处理具有44%
‑
81%m.5024c>t异质性(20个媒介物,7个单一单体,4/mtzfn
‑
aav9.45剂量)的2至8个月大的雌性小鼠:
[0176]
通过尾静脉注射系统性地给予媒介物(1x pbs,350mm nacl,5%w/v d
‑
山梨醇)和aav的处理。
[0177]
对于小鼠心脏组织,将其50mg使用gentlemacs解离器(miltenyi)在ripa缓冲液(150mm nacl,50mm tris(ph 8),1%(v/v)triton x
‑
100,0.5%(v/v)脱氧胆酸盐,0.1%(v/v)sds)中匀浆化。将所得匀浆以10,000x g在4℃下离心10分钟,然后回收上清液并且将其以10,000x g在4℃下离心10分钟。通过bca测定(pierce)测定细胞和组织蛋白提取物的浓度。
[0178]
进行通过焦磷酸测序进行的mtdna异质性的评估,并且将其表示为两周大时(实验干预之前)确定的耳洞基因型与死后心脏基因型之间的变化(δ)。简而言之,根据制造商的方案(applied biosystems),使用powerup sybr green主混合物通过qpcr测定小鼠心脏样品的线粒体dna拷贝数。使用7900ht快速实时pcr系统(thermo fisher)分析样品。使用以下引物:mt
‑
coi正向
5’tgctagccgcaggcattact 3’(seq id no:39)mt
‑
coi反向5’cgggatcaaagaaagttgtgttt 3’(seq id no:40)rnasep正向5’gcctacactggagtccgtgctact 3’(seq id no:41)rnasep反向5’ctgaccacacacgagctggtagaa3’(seq id no:42)
[0179]
分别针对c57bl/6j小鼠核和线粒体基因组,使用ncbi参考序列grcm38.p6和nc_005089.1设计焦磷酸测序和qpcr的所有引物。
[0180]
如图1f和图1g所示,在注射后65天注射的动物揭示了mtzfn处理的小鼠中m.5024c>t突变体mtdna的消除,但在媒介物或单一单体注射的对照中没有消除。通过mtzfn处理改变异质性的程度遵循双相aav剂量依赖性趋势,其中中间剂量(5x10
12
个vg)在消除m.5024c>t突变体mtdna中是最有效的。最低的(1x10
12
个vg)剂量没有导致异质性偏移,这可能是由于mtzfn的浓度不足和/或aav导致靶向组织的镶嵌转导。最高的剂量(1x10
13
个vg)展现出与中间剂量(5x10
12
个vg)相比减弱的异质性偏移活性,这可能是由于导致部分mtdna拷贝数缺失的脱靶作用,当给予较低剂量时未观察到这种现象(图1g)。后一种结果与我们过去的观察一致,从而强调了微调线粒体中mtzfn水平对于有效的mtdna异质性修饰的重要性。
[0181]
已经定义了体内实现m.5024c>t异质性的稳健偏移的条件,我们接下来解决线粒体疾病的动物模型中疾病相关的表型校正(参见kauppila等人(2016)cell rep 16:2980
‑
2990。在trnaala小鼠模型中重现的线粒体疾病中mt
‑
trna的共同特征是与突变体负载成比例的mt
‑
trna分子的不稳定性。参见图2a;yarham等人(2010)wiley inderdiscip rev rna 1:304
‑
324。
[0182]
为了评估mtzfn处理对于用跨剂量范围的mtzfn处理的动物的心脏中mt
‑
trnaala的稳定性的影响,基本上如pearce等人(2017)elife 6,doi:10
‑
7554/elife.27596中所述进行northern印迹。简而言之,通过使用gentlemacs解离器(miltenyi)的匀浆化,使用trizol(ambion)从25mg的小鼠心脏组织提取总rna。具体地,在含有8m脲的10%聚丙烯酰胺凝胶上拆分5ug的总rna。将凝胶干燥地印迹到带正电的尼龙膜(hybond
‑
n+)上,其中所得的膜通过暴露于254nm uv光,120mj/cm2进行交联。对于trna探针,将交联的膜与由对应于小鼠mtdna的适当区域的pcr片段转录的放射活性标记的rna探针t7杂交。用互补α[32p]
‑
末端标记的dna寡聚物探测5srrna。将膜暴露于储存磷光质屏并且使用typhoon磷光成像系统(ge healthcare)进行扫描。使用fiji软件定量信号。寡聚物序列如下:mt
‑
ta正向5’taatacgactcactatagggagactaaggactgtaagacttcatc 3’(seq id no:43)mt
‑
ta反向(seq id no:44)5’gaggtcttagcttaattaaag 3’mt
‑
tc正向(seq id no:45)5’taatacgactcactatagggagacaagtcttagtagagatttctc3’mt
‑
tc反向(seq id no:46)
5’ggtcttaaggtgatattcatg 35s rrna寡聚物:5’aagcctacagcacccggtattcccaggcggtctcccatccaagtactaacca 3’(seq id no:47)
[0183]
分别针对c57bl/6j小鼠核和线粒体基因组,使用ncbi参考序列grcm38.p6和nc_005089.1设计northern印迹和qpcr的所有引物。
[0184]
如图2b所示,存在mt
‑
trnaala稳态水平的显著增加,其与这些小鼠中检测到的异质性偏移成比例(图1f)。与给予高病毒剂量相关的mtdna拷贝数的缺失(图1g)未显现出影响异质性偏移之后mt
‑
trnaala稳态水平的恢复,这与先前公布的数据一致,即甚至严重的mtdna缺失也不显示出线粒体rna稳态水平的成比例变化。参见jazayeri等人(2003)j.biol.chem 278:9823
‑
9830。
[0185]
进行进一步的实验以评估mt
‑
trnaala分子表型救援的生理作用。具体地,评估来自用中间病毒滴度(5x10
12
个vg)处理的小鼠的心脏组织中的稳态代谢物丰度。简而言之,切割冷冻的组织样本并且称重到预填充陶瓷珠(stretton scientific ltd.,德比郡,英国)的precellys管中。添加准确体积的提取溶液(30%乙腈,50%甲醇和20%水)以获得40mg样本/ml提取溶液。使用precellys 24均化器(stretton scientific ltd.,德比郡,英国)裂解组织样品。将悬浮液混合并且在热混合器(eppendorf,德国)中在4℃下孵育15分钟,接着进行离心(16,000g,在4℃下15分钟)。采集上清液并且转移到自动采样器玻璃小瓶中,将其在
‑
80℃下储存,直至进一步分析。将样品随机化,以便避免由于机器沉降导致的偏差并且进行盲处理。使用qexactive orbitrap质谱仪结合dionex u3000 uhplc系统(thermo)进行lc
‑
ms分析。将液相色谱系统装配来自merck millipore(德国)的zic
‑
philic柱(150mm
×
2.1mm)和保护柱(20mm
×
2.1mm),并且将温度维持在40℃。流动相由20mm碳酸铵和在水(溶剂a)中的0.1%氢氧化铵和乙腈(溶剂b)构成。将流速设定在200μl/min,其中梯度如先前在mackay等人(2015)methods enzymol 561:171
‑
196中所述。以全ms和极性转换模式操作质谱仪。使用xcalibur qual browser和xcalibur quan browser软件(thermo scientific)分析获取的谱。
[0186]
如图2c至图2e所示,此分析揭示了mtzfn处理的小鼠中改变的代谢特征(图2c),从而证明了与对照相比升高的磷酸烯醇丙酮酸盐和丙酮酸盐水平以及较低的乳酸盐水平(图2d)。另外,经处理的动物展现出更高的葡萄糖水平,但是更低的葡萄糖
‑6‑
磷酸盐和果糖
‑6‑
磷酸盐水平(图2e)。
[0187]
因此,实现了使用核酸酶进行的m.5024c>t异质性偏移后的线粒体功能的恢复。
[0188]
总而言之,数据证明了靶向突变体线粒体dna序列的核酸酶可以在体外和体内用于操纵小鼠mtdna中的异质性突变,从而产生心脏组织中疾病表型的分子和生理救援。
[0189]
本文提及的所有专利、专利申请和出版物均通过引用以其整体特此并入。
[0190]
虽然已经出于清晰理解的目的通过说明和实施例详细提供了公开文本,但是本领域技术人员将了解,可以在不背离本公开文本的精神或范围的情况下进行各种改变和修改。因此,前述说明和实施例不应视为限制性的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1