口服剂量的化学治疗药物悬浮液的制作方法
口服剂量的化学治疗药物悬浮液
1.本申请要求于2018年8月18日提交的标题为“口服剂量的化学治疗药物悬浮液”的印度临时申请号in201821030975的优先权,并且将其通过引用并入本文。
技术领域
2.本公开涉及口服递送的悬浮液形式的药物组合物。特别地,除了活性药物成分,悬浮液还包括悬浮剂、缓冲剂和水。
背景技术:
3.一些商购化学治疗剂对于吞咽困难的患者可溶解于水、苹果汁或苹果酱中,但在任何治疗中,重要的考虑事项是确保患者接受正确剂量的药品。而片剂以通过溶解的这种方式施用不可能每次施用正确并且剂量一致。另外,许多化学治疗剂具有苦味,并且以苹果汁的施用可遮蔽其味道并且可增加可口性和患者依从性。然而,当将药物施用至患者时,苹果汁不可能一直可用。因此,期望具有液体形式的剂量,该液体形式还包含甜味剂和风味剂,该甜味剂和风味剂使得此类剂量形式为可口的并且更加的患者依从性。另外,液体剂量形式提供了在施用至患者时的剂量均匀性的保证并且消除了施用的困难。液体剂量形式还可以向医生提供设计患者的剂量方案的更大灵活性。此类液体剂量形式对于儿童患者、老年患者和不能进行口服治疗的患者是有利的。
4.许多活性药物成分是不溶的,并且仅以固体剂量形式是可用的。这使得其对于一些患者(例如儿童患者或老年患者)而言难以服用这些药品。将此类成分配制成液体形式通常是挑战性的,特别当维持剂量要求、稳定性和其它注意事项时。
5.悬浮液是一种重要类别的药物剂量形式。悬浮液剂量形式的优点包括疏水药物的有效分配;避免共溶剂的使用;遮蔽某些成分令人不愉快的味道;提供对药物由于水解、氧化或微生物活动而降解的抵抗;对于年轻或年老患者易于吞咽;和高效的肌肉内贮存疗法。此外,当相比于溶液剂量形式时,相对较高浓度的药物可包含在悬浮液产品中。迄今为止,已介绍了20多种理论,并且成功地用于解释悬浮液制剂的独特行为。
6.抗癌药物代表其中的一种极其重要治疗类别。已知抗癌试剂具有苦味,并且因此对于一些患者人群是不可接受的。另外,在许多情况下,癌症患者的外科手术是必需的。对于已经历外科手术的此类患者而言,极其困难的是数天或数周吞咽口服药品。在此类情况下,药品可利用管来施用。因此,如果最终的剂量形式为液体,那么相比于任何其它类型的剂量形式,其将更易于施用剂量。
7.许多化学治疗剂为疏水的,并且难以分散,这产生了处置的问题。化学治疗剂的处置也给药房或复方药剂师带来一些潜在的安全问题。如本文所设想的稳定液体组合物使处置和由此的安全问题最少化。
8.虽然抗癌药物的液体药物组合物是有利的,并且需求较大,但剂型科学家对其没有过多的探索。因此,现有技术中存在对于此类活性物的液体口服形式的制备的需求。
技术实现要素:
9.一些实施方式提供了口服递送的悬浮液形式的药物组合物,该药物组合物包含抗癌活性药物成分;水;悬浮剂;缓冲剂;和润湿剂和粘结剂/填料中的一种或多种。
10.在一些实施方式中,润湿剂选自乙醇、甘油、丙二醇、聚乙二醇、矿物油、苯扎氯铵、苄索氯铵、氯化十六烷基吡啶(cetylpyridinium chloride)、多库酯钠(docusate sodium)、壬苯醇醚9、辛苯聚醇、泊洛沙姆(poloxamer)、泊洛沙姆124、泊洛沙姆188、237、338、407,聚氧35蓖麻油、聚氧40氢化蓖麻油、聚氧10油基醚、聚氧20鲸蜡基硬脂醚(cetylstearyl ether)、聚氧40硬脂酸酯、聚山梨酯20、聚山梨酯40、聚山梨酯25 60、聚山梨酯80、月桂醇硫酸钠、山梨醇单月桂酸酯、山梨醇单油酸酯、山梨醇单棕榈酸酯、山梨醇单硬脂酸酯、泰洛沙泊(tyloxapol),和它们的组合。在一些实施方式中,润湿剂为甘油。
11.在一些实施方式中,粘结剂/填料选自一种或多种粘结剂或填料,该粘结剂或填料选自阿拉伯胶、琼脂、海藻酸、羧甲基纤维素钠、糊精、硅酸镁铝或胶白、结冷胶、海藻酸钠、羟丙基淀粉、麦芽糊精、改性淀粉、果胶、海藻酸钾、聚乙烯吡咯烷酮、羧甲基纤维素或其碱金属盐、微晶纤维素、膨润土、胶体二氧化硅、微晶纤维素/羧甲基纤维素钠,和它们的任何组合。在一些实施方式中,粘结剂/填料为微晶纤维素/羧甲基纤维素钠。
12.一些实施方式提供了口服递送的悬浮液形式的药物组合物,该药物组合物包含活性药物成分;水;悬浮剂;缓冲剂;和润湿剂和粘结剂/填料中的一种或多种。在一些实例中,缓冲剂存在以得到约3至约8的ph。在一些实施方式中,活性药物成分为抗癌药物。在一些实施方式中,抗癌药物选自伊布替尼(ibmtinib)、尼洛替尼(nilotinib)、达沙替尼(dasatinib)、舒尼替尼(sunitinib)、索拉非尼(sorafenib)、厄洛替尼(eriotinib)和卡培他滨(capecitabine)。
13.在一些实施方式中,悬浮剂选自明胶、交联聚丙烯酸、聚甲基丙烯酸、聚羟乙基甲基丙烯酸、羟丙基甲基纤维素、聚乙二醇、羧甲基纤维素钠、透明质酸、壳聚糖、聚卡波非、果胶、葡聚糖的共聚物、聚丙烯酰胺、阿拉伯胶、己内酯和环氧乙烷的共聚物、卡波姆934、黄蓍胶、丙烯酸树脂、聚乙烯吡咯烷酮、聚丙烯酸酯和聚丙烯酸酯共聚物树脂、纤维素和纤维素衍生物,例如甲基、乙基和丙基纤维素、羟烷基纤维素、羟丙基纤维素、羟丙基烷基纤维素等等,包括黄原胶、聚乙烯树脂、聚乙二醇、聚环氧乙烷、山梨醇、蔗糖、木糖醇、葡萄糖、果糖、麦芽糖醇、糖、海藻酸钠,或它们的组合。
14.一些实施方式还包括一种或多种粘结剂或填料,该粘结剂或填料选自阿拉伯胶、琼脂、海藻酸、羧甲基纤维素钠、糊精、硅酸镁铝或胶白、结冷胶、海藻酸钠、羟丙基淀粉、麦芽糊精、改性淀粉、果胶、海藻酸钾、聚乙烯吡咯烷酮、羧甲基纤维素或其碱金属盐、微晶纤维素、膨润土、胶体二氧化硅、微晶纤维素/羧甲基纤维素钠,和它们的任何组合。
15.在一些实施方式中,缓冲剂为乙酸盐、氨基酸、硫酸铵、苯甲酸盐、碳酸氢盐、硼酸盐、柠檬酸盐、柠檬酸一水合物、磷酸氢二钠、谷氨酸盐、乳酸盐、葡甲胺、柠檬酸钾、乙酸钠、柠檬酸钠、磷酸钠、硫酸盐、酒石酸盐、三乙醇胺、tris、脱水柠檬酸三钠,和它们的任何组合。
16.一些实施方式提供了口服递送的悬浮液形式的药物组合物,该药物组合物包含抗癌活性药物成分,该抗癌活性药物成分具有较差的润湿性并且log p>2.5;水;悬浮剂;缓冲剂,该缓冲剂的量足以使组合物的ph为约4至约8;和300mg/ml至400mg/ml的润湿剂。
17.在一些实施方式中,润湿剂选自乙醇、甘油、pg、矿物油、苯扎氯铵、苄索氯铵、氯化十六烷基吡啶、多库酯钠、壬苯醇醚9、辛苯聚醇、泊洛沙姆、泊洛沙姆124、泊洛沙姆188、237、338、407,聚氧35蓖麻油、聚氧40氢化蓖麻油、聚氧10油基醚、聚氧20鲸蜡基硬脂醚、聚氧40硬脂酸酯、聚山梨酯20、聚山梨酯40、聚山梨酯25 60、聚山梨酯80、月桂醇硫酸钠、山梨醇单月桂酸酯、山梨醇单油酸酯、山梨醇单棕榈酸酯、山梨醇单硬脂酸酯、泰洛沙泊,和它们的组合。在一些实施方式中,润湿剂为甘油。
18.在一些实施例中,粘结剂/填料选自一种或多种粘结剂或填料,该粘结剂或填料选自阿拉伯胶、琼脂、海藻酸、羧甲基纤维素钠、糊精、硅酸镁铝或胶白、结冷胶、海藻酸钠、羟丙基淀粉、麦芽糊精、改性淀粉、果胶、海藻酸钾、聚乙烯吡咯烷酮、羧甲基纤维素或其碱金属盐、微晶纤维素、膨润土、胶体二氧化硅、微晶纤维素/羧甲基纤维素钠,和它们的任何组合。在一些实施方案中,粘结剂/填料为微晶纤维素/羧甲基纤维素钠。
19.一些实施方式提供了口服递送的悬浮液形式的药物组合物,该药物组合物包含活性药物成分,该活性药物成分具有较差的润湿性并且log p>2.5;水;悬浮剂;缓冲剂,该缓冲剂的量足以使组合物的ph为约4至约8;和300mg/ml至400mg/ml的润湿剂。在一些实施方案中,活性药物成分选自伊布替尼、尼洛替尼、达沙替尼、舒尼替尼、索拉非尼和厄洛替尼。尽管可使用任何合适的悬浮剂,但是在一些实施方式中,悬浮剂为分别约2mg/ml至约6mg/ml和约10mg/ml的黄原胶和hpmc。尽管可使用任何合适的缓冲剂,但是在一些实施方式中,缓冲剂为柠檬酸一水合物或磷酸氢二钠。一些实施方式还包括微晶纤维素/羧甲基纤维素钠。
20.在一些实施方式中,活性药物成分选自达沙替尼、舒尼替尼、索拉非尼和厄洛替尼;悬浮剂为约2mg/ml至约10mg/ml的黄原胶;缓冲剂为柠檬酸一水合物或磷酸氢二钠。
21.一些实施方式提供了口服递送的悬浮液形式的药物组合物,该药物组合物包含活性药物成分;该活性药物成分具有中等的(moderate)润湿性并且log p为约2至约2.5;水;悬浮剂;缓冲剂,该缓冲剂的量足以使组合物的ph为约3.5至约7;和约100mg/ml的甘油。在一些实施方式中,活性药物成分选自。尽管可使用任何合适的悬浮剂,但是在一些实施方式中,悬浮剂为约2mg/ml至约3.5mg/ml的黄原胶。尽管可采用任何合适的缓冲剂,但是在一些实施方式中,缓冲剂为柠檬酸一水合物或磷酸氢二钠。在一些实施方式中,悬浮液还包含微晶纤维素/羧甲基纤维素钠。
22.在一些实施方式中,活性药物成分为合适的化学治疗剂;悬浮剂为约2mg/ml至约3.5mg/ml的黄原胶;并且缓冲剂为柠檬酸一水合物或磷酸氢二钠。
23.一些实施方式提供了口服递送的悬浮液形式的药物组合物,该药物组合物包含抗癌活性药物成分,该活性药物成分具有良好的润湿性并且log p小于约2;水;悬浮剂;和缓冲剂,该缓冲剂的量足以使组合物的ph为约3至约8。
24.在一些实施方式中,悬浮剂选自明胶、交联聚丙烯酸、聚甲基丙烯酸、聚羟乙基甲基丙烯酸、羟丙基甲基纤维素、聚乙二醇、羧甲基纤维素钠、透明质酸、壳聚糖、聚卡波非、果胶、葡聚糖的共聚物、聚丙烯酰胺、阿拉伯胶、己内酯和环氧乙烷的共聚物、卡波姆934、黄蓍胶、丙烯酸树脂、聚乙烯吡咯烷酮、聚丙烯酸酯和聚丙烯酸酯共聚物树脂、纤维素和纤维素衍生物,例如甲基、乙基和丙基纤维素、羟烷基纤维素、羟丙基纤维素、羟丙基烷基纤维素等等,包括黄原胶、聚乙烯树脂、聚乙二醇、聚环氧乙烷、山梨醇、蔗糖、木糖醇、葡萄糖、果糖、
麦芽糖醇、糖、海藻酸钠,或它们的组合。
25.一些实施方式提供了口服递送的悬浮液形式的药物组合物,该药物组合物包含活性药物成分,该活性药物成分具有良好的润湿性并且log p小于约2;水;悬浮剂;和缓冲剂,该缓冲剂的量足以使组合物的ph为约3至约6。在一些实施方式中,悬浮剂为约3mg/ml至约3.5mg/ml的黄原胶,但还可使用任何合适的悬浮剂。在一些实施方式中,缓冲剂为柠檬酸一水合物或磷酸氢二钠。一些实施方式还包括微晶纤维素/羧甲基纤维素钠。根据活性药物成分,一些实施方式可包括至多25mg/ml的甘油。
26.在一些实施方式中,悬浮液包含活性药物成分,该活性药物成分为化学治疗剂;悬浮剂,该悬浮剂为约2mg/ml至约3.5mg/ml的黄原胶;缓冲剂,该缓冲剂为柠檬酸一水合物或磷酸氢二钠;0至25mg/ml的甘油;和微晶纤维素/羧甲基纤维素钠。
27.一些实施方式提供了口服递送的悬浮液形式的药物组合物,该药物组合物包含活性药物成分;水;悬浮剂;稳定量的甘油;和缓冲剂,该缓冲剂的量足以使组合物的ph为约5至约7。在一些实施方式中,悬浮剂为约2mg/ml的黄原胶。在一些实施方式中,缓冲剂为柠檬酸一水合物或磷酸氢二钠。在一些实施方式中,悬浮液还包含微晶纤维素/羧甲基纤维素钠。在一些实施方式中,活性药物成分为卡培他滨。
28.在一些实施方式中,悬浮液包含悬浮剂,该悬浮剂为约2mg/ml的黄原胶;缓冲剂,该缓冲剂为柠檬酸一水合物或磷酸氢二钠;0至25mg/ml的甘油;和微晶纤维素/羧甲基纤维素钠。
29.在不脱离本公开的范围和精神的情况下,根据本说明书,其它实施方式将是显而易见的。
具体实施方式
30.一般来讲,本文公开了口服递送的悬浮液形式的药物组合物。特别地,除了活性药物成分,悬浮液还包括悬浮剂、缓冲剂和水。还可以使用额外的赋形剂。根据活性药物成分的润湿性并且其log p值,使用甘油作为润湿剂。在一些实例中,甘油以稳定的量使用,致使活性药物成分的润湿性并且log p或多或少是无关紧要的。对于活性物具有较差的润湿性并且log p>2.5,润湿剂(例如,甘油)的量一般为约300mg/ml至约400mg/ml;对于活性物具有中等的润湿性并且log p在约2和约2.5之间,一般为约100mg/ml;并且对于活性物具有良好的润湿性,一般为至多约25mg/ml。
31.由于其液体特性,液体剂量形式表示患者的理想剂量形式,该患者吞咽片剂或胶囊有困难。这种因素对于药物于儿童和老年患者的施用是特别重要的。本文所公开的液体剂量形式可用于施用至儿童和老年患者。
32.悬浮液相比于其它剂量形式具有某些优点。一些药物不溶于所有可接受介质中,并且因此必须作为片剂、胶囊或悬浮液来施用。此外,令人讨厌的味道可通过药物的悬浮液或药物的衍生物来遮蔽。药物在悬浮液中相比于在溶液中在化学上更为稳定。
33.本文所描述的悬浮液提供了即用的悬浮液剂量形式。各种实施方式描述了口服悬浮液形式的即用的液体剂量形式,以与多种活性药物成分一起使用。在其它方面的其中之一,本发明的液体剂量形式为可口的口服即用剂型(即,不需要稀释、与其它溶剂混合、或组合物的进一步处理)。可理解,多种活性物已用于肠外和固体口服医药产品,但先前尚未用
于口服液体制剂,该口服液体制剂是长期稳定的并且可以如本文所设想的以即用形式从包装取出。
34.该悬浮液是室温稳定的,不需要重新构建(reconstitution),并且在一些实施方案中,可以甚至不需要在使用前摇晃或混合,而这通常是悬浮液所需要的。
35.不溶药物的悬浮液还可以在外部使用,通常作为保护剂。药物在悬浮液中相比于在溶液中在化学上更为稳定。这对于其中通常要求药剂师在制剂的分配之前制备此类悬浮液的某些药物是特别重要的。
36.本公开不限于所描述的特定系统、装置和方法,因为它们可以改变。说明书所用的术语仅出于描述特定型式或实施方式的目的,并且不旨在限制范围。
37.如本文所用,单数形式“一个(a)”、“一种(an)”和“该(the)”包括复数的参考物,除非上下文另行清楚地指出。除非另有定义,本文所用的所有技术和科学术语具有与本领域普通技术人员通常所理解相同的意义。本公开的任何内容不应解释为承认本公开所述的实施方式无权凭借先前的发明而使此类公开提前。如本文所用,术语“包含”意指“包括但不限于”。
38.出于本申请的目的,下述术语应具有下文所阐述的相应意义。
[0039]“任选”或“任选地”是指,随后描述的事件或情况可发生或不可发生,并且说明书包括其中事件发生的实例和其中事件未发生的实例。
[0040]
关于本文的基本上任何复数和/或单数术语的使用,本领域的技术人员可从复数译为单数和/或从单数译为复数,如对于语境和/或应用是适当的。出于清楚的目的,各种单数/复数置换可在本文明确地阐述。
[0041]
如本领域技术人员将理解,出于任何和所有目的,例如就提供书面描述而言,本文所公开的所有范围还涵盖任何和所有可能子范围和其子范围的组合。任何列出的范围可以容易地识别为充分地描述并允许相同范围分解成至少等同的二分之一、三分之一、四分之一、五分之一、十分之一,等等。作为非限制性实例,本文所讨论的每个范围可容易地分解成下三分之一、中三分之一和上三分之一,等等。如本领域的技术人员还将理解,所有语言(例如“至多”、“至少”等)包括所列举的数字,并且指的是可随后分解成如上文所讨论的子范围的范围。最后,如本领域的技术人员将理解,范围包括每个独立成员。
[0042]
本申请公开了一种口服递送的悬浮液形式的药物组合物,该药物组合物包含活性药物成分;水;悬浮剂;缓冲剂;以及甘油和微晶纤维素/羧甲基纤维素钠中的一种或多种。一般来讲,缓冲剂将以足以实现约3至约8的ph的量存在。
[0043]
活性物。通常,用于本文所公开悬浮液的活性药物成分为不溶的,并且因此不太适于其它液体剂量形式。
[0044]
可使用任何合适的抗癌或化学治疗活性药物成分。活性药物成分可以为抗癌治疗物,例如伊布替尼、尼洛替尼、达沙替尼、舒尼替尼、索拉非尼、厄洛替尼和卡培他滨。参考的活性药物成分还指的是所有形式的活性物,包括其盐、其酯、其游离酸形式、其游离碱形式、其溶剂化物、其氚代衍生物、其水合物、其n
‑
氧化物、其笼形包合物、其前药、其多晶型体、其立体异构体、其对映体、其非对映体、其外消旋体、其立体异构体的混合物,和它们的组合。
[0045]
如本文所用,术语“约”是指正使用数字的加或减10%的数值。因此,约50%是指在45%至55%的范围。
[0046]
当结合治疗剂使用,“施用”是指将治疗剂直接地施用至目标组织之中或之上,或将治疗剂施用至患者,由此治疗剂积极地影响其所靶向的组织。因此,如本文所用,当结合jak/stat调制化合物(modulating compound)使用时,术语“施用”可包括但不限于将jak/stat调制化合物提供至目标组织之中或之上;通过例如静脉注射将jak/stat调制化合物系统地提供至患者,由此治疗剂到达目标组织;将jak/stat调制化合物以其编码序列形式提供至目标组织(例如,通过所谓基因疗法技术)。“施用”组合物可通过注射、局部施用、口服,或通过结合其它已知技术的方法来实现。
[0047]
如本文所用,术语“受试者”包括但不限于人和非人脊椎动物,例如野生、家养和农场动物。在某些实施方式中,本文所描述的受试者为动物。在某些实施方式中,受试者为哺乳动物。在某些实施方式中,受试者为人。在某些实施方案中,受试者为非人动物。在某些实施方式中,受试者为非人哺乳动物。在某些实施方案中,受试者为家养动物,例如狗、猫、牛、猪、马、绵羊或山羊。在某些实施方式中,受试者为伴侣动物,例如狗或猫。在某些实施方式中,受试者为牲畜动物,例如牛、猪、马、绵羊或山羊。在某些实施方式中,受试者为动物园动物。在另一实施方式中,受试者为研究动物,例如啮齿类动物、狗或非人灵长类动物。在某些实施方式中,受试者为非人转基因动物,例如转基因鼠或转基因猪。
[0048]
术语“改善”用于表达本文实施方式的化合物改变了其所提供、应用或施用的组织的外观、形式、特性和/或物理属性。形式的变化可通过以下项的任一项单独地或组合地展示:皮肤的外观增强;至少部分缓解,例如现存的脱色区域的色素再生;皮肤颜色的均匀性;白色斑块中的黑色素生成增加;皮肤的色素再生;和/或新的脱色区域的发生率降低。
[0049]
术语“抑制”包括本文实施方式的化合物的施用以防止症状的发病,减轻症状,或消除疾病、病症或紊乱。
[0050]
关于“药学上可接受的”,其是指载体、稀释剂或赋形剂必须与局部剂型的其它成分兼容并且对其接受者无害。
[0051]
如本文所用,术语“治疗剂”是指用以治疗、抗击、抑制、改良、防止或改善患者的不希望病症或疾病的试剂。在一定程度上,本文实施方式的实施方式涉及白癜风的治疗。
[0052]
组合物的“治疗有效量”或“有效量”是用以实现所期望的效果,即诱导有利的免疫应答所计算的预确定量。
[0053]
抗癌药物(例如达沙替尼、舒尼替尼、索拉非尼、厄洛替尼、卡培他滨以及其他)特别良好地适用于本文所描述的悬浮液。这些活性物具有低溶解度并且通常为不好的口味,该低溶解度和不好的口味均使其适用于本文所公开的悬浮液。
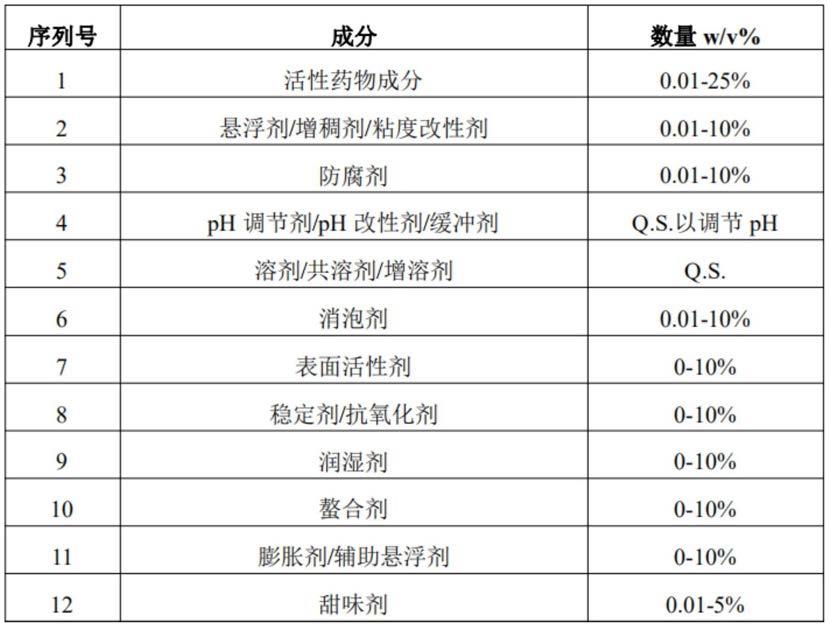
[0054]
润湿剂。如本文所用,润湿剂常规上用于药物剂型,特别地以液体剂量形式用于产生固体颗粒在液体媒介物中的均匀分散。本过程可以由于颗粒表面上的吸附空气层而是挑战性的。因此,甚至具有高密度的颗粒可漂浮于液体的表面上,直至空气相完全地消失。润湿剂的使用在短时间内允许吸附空气的去除和液体媒介物至颗粒的孔隙中的容易渗透。对于水性媒介物,经常使用乙醇、甘油和pg以有利于从颗粒表面去除吸附空气。然而,对于非水性液体媒介物,矿物油通常用作润湿剂。润湿剂的额外非限制性实例为苯扎氯铵、苄索氯铵、氯化十六烷基吡啶、多库酯钠、壬苯醇醚9、辛苯聚醇、泊洛沙姆、泊洛沙姆124、泊洛沙姆188、237、338、407,聚氧35蓖麻油、聚氧40氢化蓖麻油、聚氧10油基醚、聚氧20鲸蜡基硬脂醚、聚氧40硬脂酸酯、聚山梨酯20、聚山梨酯40、聚山梨酯25 60、聚山梨酯80、月桂醇硫酸
钠、山梨醇单月桂酸酯、山梨醇单油酸酯、山梨醇单棕榈酸酯、山梨醇单硬脂酸酯、泰洛沙泊,等等。
[0055]
悬浮剂。悬浮液的粘度可通过利用适于药物用途的一种或多种悬浮剂/增稠剂(或粘度改性剂)进行控制。这些试剂确保了所移除的单独剂量具有恒定的活性成分含量。悬浮剂可选自明胶、交联聚丙烯酸、聚甲基丙烯酸、聚羟乙基甲基丙烯酸、羟丙基甲基纤维素、聚乙二醇、羧甲基纤维素钠、透明质酸、壳聚糖、聚卡波非、果胶、葡聚糖的共聚物、聚丙烯酰胺、阿拉伯胶、己内酯和环氧乙烷的共聚物、卡波姆934、黄蓍胶、丙烯酸树脂、聚乙烯吡咯烷酮、聚丙烯酸酯和聚丙烯酸酯共聚物树脂、纤维素和纤维素衍生物,例如甲基、乙基和丙基纤维素、羟烷基纤维素、羟丙基纤维素、羟丙基烷基纤维素等等,包括黄原胶、聚乙烯树脂、聚乙二醇、聚环氧乙烷、山梨醇、蔗糖、木糖醇、葡萄糖、果糖、麦芽糖醇、糖、海藻酸钠,或它们的组合。
[0056]
在一些实施例中,悬浮剂以以下量存在:约2mg/ml至约20mg/ml、约2mg/ml至约15mg/ml、约2mg/ml至约10mg/ml、约2mg/ml至约8mg/ml、约2mg/ml至约6mg/ml、约4mg/ml至约20mg/ml、约4mg/ml至约15mg/ml、约4mg/ml至约10mg/ml、约4mg/ml至约8mg/ml、约6mg/ml至约20mg/ml、约6mg/ml至约15mg/ml、约8mg/ml至约20mg/ml、约8mg/ml至约15mg/ml,和前述范围内的任何值。
[0057]
粘结剂/填料。一种或多种粘结剂/填料可用于本文所描述的悬浮液。粘结剂或填料可选自阿拉伯胶、琼脂、海藻酸、羧甲基纤维素钠、糊精、硅酸镁铝或胶白、结冷胶、海藻酸钠、羟丙基淀粉、麦芽糊精、改性淀粉、果胶、海藻酸钾、聚乙烯吡咯烷酮、羧甲基纤维素、微晶纤维素/羧甲基纤维素钠或其碱金属盐、微晶纤维素、膨润土、胶体二氧化硅、微晶纤维素/羧甲基纤维素钠,和它们的任何组合。
[0058]
在一些实施方式中,粘结剂/填料以约10mg/ml至约25mg/ml存在,并且在一些实施方式中以15mg/ml至20mg/ml存在。
[0059]
微晶纤维素/羧甲基纤维素钠的组合可通常以15mg/ml至20mg/ml的量用作悬浮剂或分散剂。
[0060]
缓冲剂。根据所期望的活性药物成分,一种或多种缓冲剂可以足以实现所期望的ph的量来使用。合适的缓冲剂包括乙酸盐、氨基酸、硫酸铵、苯甲酸盐、碳酸氢盐、硼酸盐、柠檬酸盐、柠檬酸一水合物、磷酸氢二钠、谷氨酸盐、乳酸盐、葡甲胺、柠檬酸钾、乙酸钠、柠檬酸钠、磷酸钠、硫酸盐、酒石酸、三乙醇胺、tris、脱水柠檬酸三钠,和它们的任何组合。
[0061]
如上所述,适用于本文所公开的悬浮液的活性物通过其润湿性和log p进行分组,或其中甘油用作稳定剂。
[0062]
在一些实施方式中,缓冲剂以足以实现所期望的ph的量存在。
[0063]
关于具有较差的润湿性并且log p>2.5的活性药物成分,口服递送的悬浮液形式的药物组合物包含水;悬浮剂;缓冲剂,该缓冲剂的量足以使组合物的ph为约4至约8;和300mg/ml至400mg/ml的甘油。尽管可使用任何合悬浮剂,但是在一些实施方式中,悬浮剂为分别以约2mg/ml至约6mg/ml和约10mg/ml存在的黄原胶和hpmc。在一些实施方式中,缓冲剂为柠檬酸一水合物或磷酸氢二钠。此外,一些实施方式还包括通常为约20mg/ml的微晶纤维素。
[0064]
因此,在一些实施方式中,悬浮液包含活性药物成分;约2mg/ml至约6mg/ml的黄原
胶和约10mg/ml的hpmc;选自柠檬酸一水合物或磷酸氢二钠的缓冲剂;和(任选地)微晶纤维素/羧甲基纤维素钠。
[0065]
关于具有中等的润湿性并且log p约2至约2.5的活性药物成分,口服递送的悬浮液形式的药物组合物包含水;悬浮剂;缓冲剂,该缓冲剂的量足以使组合物的ph为约3.5至约7;和约100mg/ml的甘油。
[0066]
在特定实施方式中,悬浮剂为通常以约2mg/ml至约3.5mg/ml存在的黄原胶。在一些实施方式中,缓冲剂为柠檬酸一水合物或磷酸氢二钠。微晶纤维素/羧甲基纤维素钠还可以以约15mg/ml存在。
[0067]
因此,一些实施方式提供了悬浮液,该悬浮液包含化学治疗活性药物成分;约2mg/ml至约3.5mg/ml的黄原胶;柠檬酸一水合物或磷酸氢二钠;和任选地,微晶纤维素/羧甲基纤维素钠。
[0068]
关于具有良好润湿性并且log p小于约2的活性药物成分,口服递送的悬浮液形式的药物组合物包含水;悬浮剂;和缓冲剂,该缓冲剂的量足以使组合物的ph为约3至约6。
[0069]
在一些实施方式中,悬浮剂为通常约3mg/ml至约3.5mg/ml的黄原胶。在一些实施方式中,缓冲剂为柠檬酸一水合物或磷酸氢二钠。如同其它悬浮液,约20mg/ml的微晶纤维素/羧甲基纤维素钠可存在。由于本组中活性物的良好润湿性,需要最少量的润湿剂。在甘油的情况下,根据活性物,可使用至多25mg/ml。例如,活性唑尼沙胺不需要任何甘油,而扑米酮剂型则使用25mg/ml。
[0070]
因此,一些实施方式提供了悬浮液,该悬浮液包含化学治疗活性药物成分;约2mg/ml至约3.5mg/ml的黄原胶,作为悬浮剂;柠檬酸一水合物或磷酸氢二钠,作为缓冲剂;0至25mg/ml的甘油;和任选地,微晶纤维素/羧甲基纤维素钠。
[0071]
一些实施方式采用稳定量的润湿剂以适应多种活性物。口服递送的悬浮液形式的此类药物组合物包含活性药物成分;水;悬浮剂;稳定量的甘油;和缓冲剂,该缓冲剂的量足以使组合物的ph为约5至约7。在一些实例中,悬浮剂为约2mg/ml的黄原胶。在一些实例中,缓冲剂为柠檬酸一水合物或磷酸氢二钠。
[0072]
因此,一些实施方式提供了悬浮液,该悬浮液包含约2mg/ml的黄原胶,作为悬浮剂;柠檬酸一水合物或磷酸氢二钠,作为缓冲剂;和0至25mg/ml的甘油。
[0073]
活性药物成分可以为抗癌药物卡培他滨。悬浮剂为约2mg/ml的黄原胶,并且缓冲剂足以得到约5至约7的ph。
[0074]
其它赋形剂。悬浮液可包括额外的赋形剂以用于各种目的,例如风味剂、甜味剂等。
[0075]
调味剂的非限制性实例为合成风味油、调味芳族化合物、和/或天然油,来自植物叶、花、果实等的提取物等等,或它们的任何组合。这些可包括肉桂油、冬青油、薄荷油、丁香油、月桂油、茴香油、桉树油、百里香油、雪松叶油、肉豆蔻油、鼠尾草油、苦杏仁油和桂皮油等,或它们的任何组合。还可用作风味剂的是香草、柑橘油(包括柠檬、橙子、葡萄、青柠和柚子),和水果香精(包括苹果、香蕉、梨、桃子、草莓、覆盆子、樱桃、李子、菠萝、杏等)等等,或它们的任何组合。固体形式(例如调味剂的喷雾干燥形式)也可用于本文所公开的液体剂量形式。
[0076]
分类为甜味剂的一些材料为糖醇(还已知为多羟基醇、多元醇和氢化糖)。一些通
常使用的甜味剂是离子型的,并且具有与悬浮液的其它组分相互作用的可能性。一些甜味剂相比于水性溶液中的其它组分是更稳定的。这些在甜味剂的最终选择中将是重要因素。甜味剂的非限制性实例为葡萄糖、三氯蔗糖、三卤糖、果糖、木糖、右旋糖、半乳糖、塔格糖、麦芽糖、蔗糖、甘油、半乳糖醇、甘露醇、乳糖醇、山梨糖醇、木糖醇、糖精或对应的钠盐、钾盐或钙盐、环磺酸盐或对应的钠盐或钙盐、阿斯巴甜、或安赛蜜或其钾盐、甘素或甘草酸铵、阿力甜、菊粉、异麦芽糖、新橙皮苷二氢查尔酮、奇异果甜蛋白等,或它们的任何组合。
[0077]
其它已知药物赋形剂可以以普通量用于其正常目的,只要它们没有不利地影响悬浮液的效果或稳定性。额外的赋形剂的实例对于本领域的技术人员将为周知的,例如但不限于填料/媒介物、溶剂/共溶剂、防腐剂/抗氧化剂、悬浮剂、表面活性剂、消泡剂、缓冲剂、螯合剂、甜味剂、调味剂、甜度/风味增强剂,或它们的组合。
[0078]
治疗的方法。本文所公开的悬浮液与多种活性药物成分一起可用于治疗多种病症、疾病、紊乱或其它病痛。在一些实施方式中,悬浮液是指模仿其固体形式对应物,以相同剂量提供相同效果。在每种情况下,治疗病症、疾病、紊乱或其它病痛的方法包括将悬浮液施用至需要此类治疗的患者以提供所期望的或治疗上可接受剂量的活性药物成分。
[0079]
所公开的方法用于疾病或病症的治疗,该疾病或病症可通过悬浮液中的活性药物成分进行治疗。该方法包括向患者(例如人)施用有效剂量的量的液体药物组合物,该液体药物组合物包含活性药物成分和一种或多种药学上可接受的、如本文所公开和描述的赋形剂或添加剂。
[0080]
如本文所用,对于例如本发明的液体药物组合物,“有效剂量的量”应是指这样的剂量:该剂量提供了对于在需要此类治疗的大量受试者中所施用的活性药物成分的具体药理应答。应强调,在特定实例中施用至特定受试者的“有效剂量的量
””
对于治疗本文所描述的疾病将不总是有效的,即使此类剂量由本领域的技术人员视为“有效剂量的量”。
[0081]
建议本发明的液体药物组合物具有意外地显著溶解的概况。所施用的活性试剂的快速溶解是优选的,因为较快溶解一般导致较大的生物利用率和较快的起效时间。为改善活性药物成分的溶解概况和生物利用率,将可用的是增加所用活性物的溶解度,使得其可以达到接近于药物物质的100%溶解度的水平。
[0082]
相比于相同活性药物成分或其盐或其衍生物的市售或已知的组合物,包含活性药物成分或其盐或其衍生物的本发明的液体药物组合物表现出改善或相当的药代动力学概况(profile)。例如,本文所公开液体药物组合物的cmax和/或auc可大于或基本上等于以相同剂量所施用的已知或市售的组合物(例如,固体剂型)的cmax和/或auc。此外,本发明的液体组合物的tmax可低于或基本上等于以相同剂量所施用的已知或市售的组合物所获得的tmax。此外,相比于已知或市售的组合物,改善或相当的cmax、auc和tmax概况的组合可通过本发明的液体组合物来表现。在其它方面,当在相比于空腹条件的进食条件下施用时,本发明的液体组合物可导致最小的不同吸收水平。
[0083]
液体组合物在与市售或已知的剂型(以相同剂量施用)相当的药代动力学测试中表现出tmax,该tmax不大于约90%、不大于约80%、不大于约70%、不大于约60%、不大于约50%、不大于约30%、不大于约25%、不大于约20%、不大于约15%、不大于约10%或不大于约5%的由市售或已知的剂型所表现的tmax。
[0084]
在一些实施方式中,液体组合物在与市售或已知的剂型(以相同剂量施用)相当的
药代动力学测试中表现出cmax,该cmax大于由市售或已知的剂型所表现的cmax至少约50%、至少约100%、至少约200%、至少约300%、至少约400%、至少约500%、至少约600%、至少约700%、至少约800%、至少约900%、至少约1000%、至少约1100%、至少约1200%、至少约1300%、至少约1400%、至少约1500%、至少约1600%、至少约1700%、至少约1800%或至少约1900%。
[0085]
在其它方面的其中之一,本发明的液体组合物在与市售或已知的剂型(以相同剂量施用)相当的药代动力学测试中表现出auc,该auc大于由市售或已知的剂型所表现的auc至少约25%、至少约50%、至少约75%、至少约100%、至少约125%、至少约150%、至少约175%、至少约200%、至少约225%、至少约250%、至少约275%、至少约300%、至少约350%、至少约400%、至少约450%、至少约500%、至少约550%、至少约600%、至少5约750%、至少约700%、至少约750%、至少约800%、至少约850%、至少约900%、至少约950%、至少约1000%、至少约1050%、至少约1100%、至少约1150%或至少约1200%。
[0086]
在一些实施方式中,当在哺乳动物受试者的血浆中测定时,用于根据本发明的液体组合物的制备的有效药物成分或其盐的tmax小于约6小时至约8小时。在本发明的其它方面,在施用之后,活性药物成分或其盐的tmax小于约6小时、小于约5小时、小于约4小时、小于约3小时、小于约2小时、小于约1小时,或小于约30分钟。
[0087]
在一些方面,相比于已知或市售的组合物,液体组合物表现出改善或相当的生物利用率。
[0088]
本发明的液体药物组合物适用于工业中。
[0089]
实施例
[0090]
实施例1:较差的润湿性,log p>2.5
[0091]
口服递送的悬浮液形式的药物组合物包含活性药物成分,该活性药物成分具有较差的润湿性并且log p>2.5;水;悬浮剂;缓冲剂,该缓冲剂的量足以使组合物的ph为约4至约8;和300mg/ml至400mg/ml的甘油。示例性的组合物在下文描述:
[0092]
一般液体组合物
[0093][0094][0095]
本领域的技术人员将理解,一种或多种上文所述的赋形剂可从用于制备溶液的液体组合物省略,例如悬浮剂、膨胀剂、消泡剂等。在本文提供上述内容仅用于说明目的,并且不应解释为本发明的精确或仅有范围。
[0096]
特定示例性的剂型在下文进一步阐述:
[0097][0098]
舒尼替尼口服悬浮液
[0099]
一些实施方式提供一种液体组合物,该液体组合物包含舒尼替尼或其药学上可接受的盐和化学衍生物,例如多晶型物、溶剂化物、水合物、无水形式、前药、螯合剂和其复合物,和一种或多种药学上可接受的赋形剂,该一种或多种药学上可接受的赋形剂选自包括以下项的组,媒介物、溶剂或共溶剂或增溶剂、悬浮剂或增稠剂或粘度改性剂、消泡剂、稳定剂、抗氧化剂、ph调节剂或ph改性剂或缓冲剂、润湿剂、膨胀剂或辅助悬浮剂、螯合剂、表面活性剂、防腐剂、甜味剂、着色剂、调味剂,或它们的组合。示例性的组合物在下文示出:
[0100][0101]
索拉非尼口服悬浮液
[0102]
在其它方面中的之一,本发明提供了一种液体组合物,该液体组合物包含索拉非尼或其药学上可接受盐和化学衍生物,诸如多晶型物、溶剂化物、水合物、无水形式、前药、螯合剂和其复合物,和一种或多种药学上可接受的赋形剂,该一种或多种药学上可接受的赋形剂选自包括以下项的组,媒介物、溶剂或共溶剂或增溶剂、悬浮剂或增稠剂或粘度改性剂、消泡剂、稳定剂、抗氧化剂、ph调节剂或ph改性剂或缓冲剂、润湿剂、膨胀剂或辅助悬浮剂、螯合剂、表面活性剂、防腐剂、甜味剂、着色剂、调味剂,或它们的组合。以下为示例性的组合物:
[0103][0104]
厄洛替尼口服悬浮液20mg/ml
[0105]
在多个方面的其中之一,本发明提供了一种液体组合物,该液体组合物包含厄洛替尼或其药学上可接受的盐和化学衍生物,诸如多晶型物、溶剂化物、水合物、无水形式、前药、螯合剂和其复合物,和一种或多种药学上可接受的赋形剂,该一种或多种药学上可接受的赋形剂选自包括以下项的组,媒介物、溶剂或共溶剂或增溶剂、悬浮剂或增稠剂或粘度改性剂、消泡剂、稳定剂、抗氧化剂、ph调节剂或ph改性剂或缓冲剂、润湿剂、膨胀剂或辅助悬浮剂、螯合剂、表面活性剂、防腐剂、甜味剂、着色剂、调味剂,或它们的组合。以下为示例性的组合物:
[0106]
[0107][0108]
本领域的技术人员将理解,如本文所描述的不同类型的液体药物组合物可通过利用本领域已知的合适赋形剂或添加剂来制备。因此,表1所提供的赋形剂或添加剂的名称和其成比例的范围在本文仅提供用于说明目的,并且不应解释为本发明的精确或仅有范围。本发明的液体药物组合物可利用任何合适量的合适赋形剂或添加剂来制备。
[0109]
实施例2:甘油作为稳定剂
[0110]
卡培他滨口服悬浮液
[0111]
在多个方面的其中之一,本发明提供了一种液体组合物,该液体组合物包含卡培他滨或其药学上可接受的盐和化学衍生物,诸如多晶型物、溶剂化物、水合物、无水形式、前药、螯合剂和其复合物,和一种或多种药学上可接受的赋形剂,该一种或多种药学上可接受的赋形剂选自包括以下项的组,媒介物、溶剂或共溶剂或增溶剂、悬浮剂或增稠剂或粘度改性剂、消泡剂、稳定剂、抗氧化剂、ph调节剂或ph改性剂或缓冲剂、润湿剂、膨胀剂或辅助悬浮剂、螯合剂、表面活性剂、防腐剂、甜味剂、着色剂、调味剂,或它们的组合。
[0112][0113]
杂质概况
[0114]
对如下表所概述的每一种悬浮液执行稳定性测试。在每个实例中,发现悬浮液是稳定的。根据上述实施例所制备的液体剂量形式在不同存储条件下对其存储稳定性进行评估。惊讶地发现,当在不同存储条件下测试时,液体剂量形式是长期稳定的。所执行的稳定性研究的结果在下表中进行汇总。这些结果还示出,由于其长期稳定性,本发明的液体剂量形式可以为市售的固体形式药物的可用替代。
[0115]
达沙替尼
[0116]
[0117][0118]
舒尼替尼
[0119]
测试参数初始3m 25/403m 40/25描述淡黄橙色悬浮液淡黄橙色悬浮液淡黄橙色悬浮液舒尼替尼的测定97.5%98.2%100.00%对羟基苯甲酸甲酯的测定85.6%84.6%57.00%对羟基苯甲酸乙酯的测定91.8%92.0%81.90%ph7.287.247.03相关物质
ꢀꢀꢀ
吲哚
‑2‑
酮(rrt:
‑
0.72)0.01%0.01%0.01%脱乙基杂质(rrt:0.94)0.05%0.06%0.07%酰胺未检测到未检测到未检测到单种最大未知杂质0.07%0.07%0.07%总杂质0.14%0.16%0.21%
[0120]
索拉非尼
[0121]
测试初始40/256m25/406m描述灰白色悬浮液灰白色悬浮液灰白色悬浮液ph4.84.64.6索拉非尼的测定96.096.00%96.40%苯甲酸钠的含量97.999.40%96.90%通过hplc的相关物质
ꢀꢀꢀ
杂质a未检测到未检测到未检测到杂质b未检测到未检测到未检测到杂质c未检测到未检测到未检测到单种最大未知杂质0.01%0.01%0.01%
总杂质0.01%0.02%0.02%
[0122]
厄洛替尼
[0123][0124]
卡培他滨
[0125][0126]
多种上文所公开和其它特征和功能或其替代物可组合成许多其它不同的系统或应用。各种目前未预料或未预期的其替代物、修改、变型或改善可随后由本领域的技术人员来做出,其各自还旨在由所公开的实施方式来涵盖。
[0127]
尽管本发明已参考其某些优选实施方式来相当详细地描述,但是其它型式是可能的。因此,附属权利要求书的精神和范围不应限制于本说明书内所包括的描述和优选型式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1