USP2和HSP90抑制剂联合使用抑制ErbB2阳性乳腺癌生长的应用的制作方法
本发明涉及医药技术领域,具体涉及一种usp2和hsp90抑制剂联合使用作为治疗erbb2阳性乳腺癌的药物的新应用。
背景技术:
乳腺癌是一种发生在乳腺上皮组织的具有高发病率和高死亡率的恶性肿瘤。全球乳腺癌发病率自20世纪70年代末开始一直呈上升趋势,已成为当前社会的重大公共卫生问题。
根据酪氨酸激酶受体erbb2(her2)、雌激素受体(er)和孕酮受体(pr)的表达差异,乳腺癌通常被分为erbb2阳性、er阳性和三阴性乳腺癌。其中erbb2阳性乳腺癌占20-30%,并且普遍预后相对较差(1)。erbb2的过度表达能够促进其二聚体的形成和激酶功能的活化,过度激活下游一系列与细胞周期和增殖相关的信号通路,促进肿瘤的发生发展。erbb2是乳腺癌治疗的重要靶点(2)。
鉴于erbb2高表达的乳腺癌分型常表现出不良预后,目前靶向erbb2的治疗药物在一定程度上能够改善患者的不良预后。在乳腺癌临床治疗中,针对erbb2过表达的靶向药物已经有多种获得美国食品与药品监督管理局(fda)的批准。靶向erbb2的治疗药物分为单克隆抗体、小分子酪氨酸激酶抑制剂和hsp90抑制剂三类(3,4)。抗体包括单克隆曲妥珠单抗和帕妥珠单抗,以及抗体化疗偶联药物t-dm1,其中赫赛汀是单克隆抗体药物的典型代表。酪氨酸激酶抑制剂主要包括拉帕替尼和来那替尼等,该类药物通过抑制erbb2及其下游信号通路从而抑制细胞增殖以达到治疗乳腺癌的目的。但是,乳腺癌中的erbb2存在一些原发性或继发性突变,包括t733i、k753e、l755s等,从而表现出对erbb2靶向药产生耐药性。erbb2突变会导致细胞耐药性的产生从而大大减弱治疗效果,erbb2耐药性突变使肿瘤再度扩增和转移,导致乳腺癌患者死亡(5-7)。
针对这一问题,一个新的靶向erbb2的治疗思路是通过药物促进其降解来减少肿瘤中erbb2的蛋白表达来达到治疗效果,这样可以同时抑制野生型和突变型erbb2从而提高临床治疗效果。据此,靶向治疗思路的多种小分子抑制剂的临床试验也正在逐步展开,也展示了积极的治疗效果(8)。但是,乳腺癌中erbb2泛素化和降解的调控机制还不明确。
erbb2在细胞膜上的稳定性依赖于热休克蛋白hsp90,通过抑制hsp90可以有效诱导erbb2泛素化和细胞内降解(9,10)。hsp90抑制剂能够促进erbb2降解,可作为一种替代性的erbb2靶向治疗方案。虽然有十多种hsp90抑制剂已进入临床试验,但是hsp90抑制剂的临床评价结果并不理想,目前仍没有获得fda的正式批准,可见该领域的研究仍然在不断探索中。在重要的降解机制方面,hsp90抑制剂诱导erbb2细胞内降解的通路还未明确,现有研究报道仅限于hsp90抑制剂引起erbb2泛素化而促进其通过蛋白酶体或溶酶体途径降解,分子伴侣蛋白依赖的泛素连接酶e3chip能够增加erbb2泛素化,促进其降解,但是调控hsp90抑制剂作用下erbb2的去泛素化酶还未见报道(11-14)。此外,已有报道酪氨酸激酶抑制剂ci-1033与hsp90抑制剂格尔德霉素(geldanamycin)联合使用能够促进erbb2降解,抑制肿瘤生长(13);拉帕替尼与hsp90抑制剂fw-04-806联合使用可以促进erbb2降解,抑制下游信号通路,从而抑制erbb2阳性乳腺癌细胞生长(15)。但是联合用药过程中调控erbb2泛素化和降解的机制并不明确。因此,对乳腺癌中泛素化erbb2的具体降解通路和其动态泛素化调控的进一步研究会为靶向erbb2的治疗提供必要的理论和实验数据,在临床进行精准医学治疗中对病例的敏感性及耐药性提供评估依据。
技术实现要素:
【技术问题】
本发明所要解决的技术问题是寻找治疗erbb2阳性乳腺癌的新的治疗方案。
【问题的解决方案】
发明人通过研究发现,hsp90抑制剂17-aag能够诱导erbb2被内吞到早期内体,然后运输到溶酶体内发生降解;去泛素化酶usp2通过抑制erbb2的内吞降解稳定erbb2的蛋白水平并可以调控hsp90抑制剂作用下erbb2动态泛素化。usp2抑制剂ml364能够促进erbb2泛素化,增强hsp90抑制剂诱导的erbb2降解,增加erbb2阳性乳腺癌细胞对多种hsp90抑制剂的敏感性。将usp2和hsp90抑制剂联合使用,能够显著抑制erbb2阳性乳腺癌细胞的生长。
具体而言,发明人发现:
(1)通过分别敲低内体-溶酶体途径上四个已知的去泛素化酶(amsh、amshlp、usp2、usp8),发现只有在usp2敲低的乳腺癌细胞中17-agg诱导erbb2降解的能力显著增强,从而证明了usp2是调控erbb2泛素化的去泛素化酶。
(2)乳腺癌细胞中过表达usp2会抑制17-aag引起的erbb2的内吞,这说明usp2通过抑制erbb2的内吞降解稳定erbb2的蛋白水平。
(3)usp2抑制剂ml364能够增加erbb2泛素化;usp2抑制剂ml364与hsp90抑制剂联合使用能够显著促进hsp90抑制剂诱导的erbb2降解。
(4)细胞水平的克隆形成实验以及小鼠体内移植瘤实验共同说明,usp2抑制剂ml364与hsp90抑制剂联合使用能够增强erbb2阳性乳腺癌细胞对hsp90抑制剂的敏感性,从而显著抑制细胞生长。
发明人已经根据以上意外的发现而完成了本发明,并提出了针对erbb2阳性乳腺癌的新的治疗方案。具体地,本发明包括以下方面:
1.用于预防或治疗erbb2阳性乳腺癌或抑制erbb2阳性乳腺癌细胞增殖的药物组合物,其包含:(1)作为活性成分的usp2抑制剂与hsp90抑制剂;和(2)药学上可接受的载体。
2.根据方面1所述的药物组合物,其中所述usp2抑制剂是ml364。
3.根据方面1所述的药物组合物,其中所述hsp90抑制剂是17-aag、ganetespib、pu-h71、格尔德霉素、fw-04-806中的一种或多种。
4.根据方面1-3中任一项所述的药物组合物,其中所述usp2抑制剂是ml364,且所述hsp90抑制剂是17-aag、ganetespib或pu-h71。
5.usp2抑制剂与hsp90抑制剂在制备用于预防或治疗erbb2阳性乳腺癌或抑制erbb2阳性乳腺癌细胞增殖的药物中的用途。
6.根据方面5所述的用途,其中所述usp2抑制剂是ml364。
7.根据方面5所述的用途,其中所述hsp90抑制剂是17-aag、ganetespib、pu-h71、格尔德霉素、fw-04-806中的一种或多种。
8.根据方面5-7中任一项所述的用途,其中所述usp2抑制剂是ml364,且所述hsp90抑制剂是17-aag、ganetespib或pu-h71。
【发明的有益效果】
本发明的有益效果如下:
(1)针对erbb2突变产生耐药性而影响erbb2靶向药物的疗效,促进erbb2降解作为erbb2靶向治疗的一个新方向,但是关于erbb2泛素化和降解的分子机制并不明确。本发明筛选到了调控erbb2动态泛素化的去泛素化酶usp2。usp2通过抑制erbb2内吞降解而稳定其蛋白水平。
(2)针对诱导erbb2降解的hsp90抑制剂的临床评估效果不理想的情况,本发明证明了usp2抑制剂ml364能够增强多种hsp90抑制剂诱导的erbb2的降解。细胞和动物水平的实验结果均表明,ml364能够增加乳腺癌细胞对hsp90抑制剂的敏感性,usp2和hsp90的抑制剂联合使用能够显著抑制erbb2阳性乳腺癌细胞生长,为设计通过促进erbb2降解的抗肿瘤治疗策略提供实验及理论依据。
【发明详述】
本发明中使用的技术术语具有以下含义:
“erbb2”即表皮生长因子受体2,是酪氨酸激酶受体(erbb)家族成员。
“usp2”即泛素特异性蛋白酶2(ubiquitinspecificprotease2),为去泛素化酶。
“hsp90”即热休克蛋白90(heatshockprotein90),为一种分子伴侣蛋白。
“ml364”是一种有效的已知usp2抑制剂,其结构式如下:
“17-aag”即坦螺旋霉素(tanespimycin),是一种有效的已知hsp90抑制剂,其结构式如下:
“ganetespib”即3-(2,4-二羟基-5-异丙基苯基)-4-(1-甲基吲哚-5-基)-5-羟基-4h-1,2,4-三唑,是一种有效的已知hsp90抑制剂,其结构式如下:
“pu-h71”是一种有效的已知hsp90抑制剂,其结构式如下:
“格尔德霉素”是一种有效的已知hsp90抑制剂,其结构式如下:
“fw-04-806”是从一株来源于土壤链霉菌streptomycessp.fim-04-806发酵液中提取出来的具有抗肿瘤活性的双噁唑环大环内酯化合物,其结构分析参见“fw-04-806的结构分析及其抗肿瘤活性研究”,《中国抗生素杂志》,第36卷第7期,第502-506页,2011年7月。
“药学上可接受的载体”是指适用于与活性成分一起配制成施用给对象且不会给对象造成不可接受的毒性的药物组合物的载体。为了制备药物组合物,可以采用本领域内通常使用的任何药学上可接受的载体。例如,为了制备口服给药的固体剂型,可以使用本领域已知的固体载体。固体载体的实例有填充剂如葡萄糖、微晶纤维素、乳糖、淀粉、糖粉、糊精、甘露醇等;粘合剂如甲基纤维素、羟丙甲纤维素、羧甲基纤维素、微晶纤维素、聚维酮、淀粉浆、胶浆等;崩解剂如交联羧甲基纤维素钠、羧甲基淀粉纳、交联聚维酮、羟丙基淀粉等;润滑剂如硬脂酸镁、硬脂酸钙、滑石粉等。另外,还可以使用着色剂、芳香剂、甜味剂、防腐剂等物质,只要它们和已使用的成分相容即可。采用上述固体载体,可以将本发明的药物组合物制备成例如片剂、胶囊剂、散剂、颗粒剂、丸剂等形式。
“预防”表示防止有患病风险的对象中的erbb2阳性乳腺癌的出现或者已消失的erbb2阳性乳腺癌的复发。“治疗”表示减轻或缓解erbb2阳性乳腺癌的病理学进展和延长患病对象的存活期。“抑制erbb2阳性乳腺癌细胞增殖”是指防止或减缓erbb2阳性乳腺癌细胞的增殖。
为了使本发明的实质和精神得到进一步理解,下面结合具体实施例对本发明的优选实施方案及其效果进行描述。但是,应当理解,这些描述只是用于进一步说明本发明的特征和优点,而绝非对本发明的权利要求构成任何限制。
附图说明
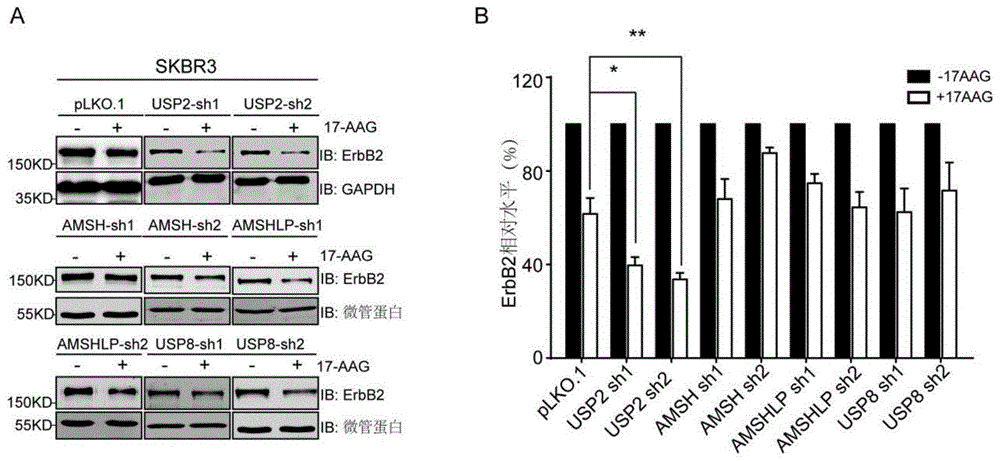
图1显示了内体系统去泛素化酶筛选鉴定usp2可以调节erbb2降解。a.使用慢病毒包装体系空载plko.1、amshlp、amsh、usp8和usp2感染skbr3细胞,构建相应去泛素化酶敲低的稳转细胞系。用80nm17-agg分别处理不同细胞系12h,以及用免疫印迹实验检测erbb2蛋白水平。b.各组细胞系中对照组和加药组erbb2蛋白水平的定量分析。
图2显示了usp2与erbb2相互作用,抑制erbb2的降解。a.用17-agg处理乳腺癌细胞skbr32h和4h后裂解细胞获取蛋白样品,免疫沉淀erbb2并通过免疫印迹方法检测usp2是否与erbb2发生免疫共沉淀。b.乳腺癌细胞skbr3中瞬时转染表达egfp、egfp-usp2、egfp-usp2c276a、egfp-usp8、egfp-amsh和egfp-amshlp的质粒,用500nm17-agg处理4h,并用免疫荧光实验检测erbb2的内吞情况。
图3显示了usp2抑制剂ml364增加erbb2泛素化,促使其降解。a.采用10μmml364处理au565细胞0、4、8、12h,免疫沉淀富集erbb2后利用免疫印迹检测erbb2泛素化水平。b.采用ml364和17-aag单独处理以及二者联合处理au565细胞,免疫共沉富集erbb2后检测其泛素化水平。c-e.skbr3、au565和hcc1954细胞分别经17-aag、ml364单独处理以及二者联合处理12h后,用免疫印迹实验检测erbb2的蛋白水平。f-h.skbr3、au565和hcc1954细胞分别经ganetespib和pu-h71、ml364单独处理以及ml364分别与这两种抑制剂联合处理12h后,用免疫印迹实验检测erbb2的蛋白水平。
图4显示了usp2抑制或敲低能够显著抑制细胞生长。a.17-aag单独处理以及与ml364联合处理skbr3和hcc1954细胞的克隆形成结果。b.柱形图对克隆数量的量化结果。c.au565细胞与usp2稳定敲低细胞中加入17-aag处理0、4、8、12h后检测erbb2的蛋白水平。d.对au565、au565-usp2kd和au565-usp2kd-oeccnd1细胞进行克隆形成实验及量化柱形图。
图5显示了联合用药能够显著抑制小鼠乳腺癌移植瘤生长。a-b.空白组、ml364处理组(5mg/kg)、17-aag(50mg/kg)处理组和联合用药组小鼠肿瘤体积(a)和重量(b)变化。c.肿瘤组织免疫组化检测erbb2、ki67和细胞周期蛋白d1的蛋白水平。
具体实施方式
实施例1去泛素化酶筛选实验
本实验的目的是筛选能够调控17-aag诱导的erbb2泛素化的去泛素化酶。
已知的是蛋白质的泛素化修饰是动态可逆的。在本实验中,使用shrna敲低实验筛选了内吞-溶酶体通路上已知的四个去泛素化酶(amsh、amshlp、usp2、usp8)。具体方法为:在验证敲低的细胞株中加入低浓度的17-aag(80nm)处理12小时,并通过免疫印迹实验检测erbb2的蛋白水平。实验结果参见【图1】。由【图1】中可见,只有在usp2敲降的乳腺癌细胞中观察到17-agg诱导erbb2降解的能力显著增强。在plko.1空载、amsh、amshlp和usp8敲低的细胞系中,17-agg处理后erbb2蛋白水平降到70-80%,而在usp2敲低的细胞系中17-agg处理组的erbb2水平降到35-40%。该结果表明usp2对于17-aag促进erbb2降解起到负向调控作用。
通过去泛素化酶筛选实验,推测usp2可能通过去泛素化内吞到细胞内的erbb2从而抑制其溶酶体降解,所以usp2敲低增强了17-agg促进erbb2降解的作用。
实施例2erbb2和usp2的相互作用情况的检测
在本实施例中,首先利用免疫共沉淀实验检测erbb2和usp2的相互作用情况,结果参见【图2】。实验结果表明,17-agg处理2h和4h后能够促进二者的结合,【图2a】进一步支持了usp2直接作用于泛素化的erbb2的观点。
然后,进一步构建四个内体系统去泛素化酶的过表达载体。通过使用gfp和去泛素化酶融合蛋白,可以便利地观察它们的表达水平和细胞定位。同时,构建了usp2去泛素化酶酶活位点突变体(usp2c276a),通过与野生型比较可以评估usp2酶活的功能。参见【图2b】,乳腺癌细胞瞬时转染实验的免疫荧光结果表明只有usp2野生型过表达可以拮抗17-agg的促进erbb2降解作用,酶活位点突变体不能发挥同样作用,这说明usp2拮抗17-agg诱导erbb2内吞降解的作用是酶活性依赖的。
实施例3usp2的抑制对erbb2泛素化的影响
在本实施例中,利用ml364(一种usp2抑制剂)研究usp2被ml364抑制后对erbb2泛素化的影响。
简言之,用ml364处理乳腺癌au565细胞。分别于4h、8h和12h后收集细胞,用免疫沉淀方法富集erbb2后检测erbb2泛素化水平。实验结果参见【图3】。结果表明,随着处理时间的延长,erbb2泛素化水平逐渐升高。【图3a】显示相较于17-aag单独处理,ml364和17-aag联合用药能够显著增强erbb2的泛素化水平。【图3b】表明usp2对17-aag诱导的erbb2泛素化发挥负调控作用,这进一步证明了usp2通过去泛素化作用抑制erbb2内吞降解。
为了证明不同类型hsp90抑制剂促进erbb2降解的作用以及usp2对hsp90抑制剂作用下erbb2泛素化的调控作用的广谱性,进一步选取了三种hsp90抑制剂17-aag、ganetespib和pu-h71进行后续验证。如【图3c-e】所示,通过分别加入单独的17-aag、ml364以及二者的联合处理乳腺癌细胞skbr3、au565和hcc1954细胞,免疫印迹结果表明ml364的加入能够显著增强17-aag单独处理时引起的erbb2蛋白水平的降低。如【图3f-h】所示,与该实验结果相一致的是,ml364分别与另外两种hsp90抑制剂ganetespib和pu-h71联合处理也明显增强了erbb2的降解。综上所述,usp2抑制剂ml364与hsp90抑制剂联合处理通过增强erbb2泛素化加速erbb2的降解。
实施例4usp2抑制或敲低对细胞生长的影响
在明确了usp2抑制剂对17-aag诱导的erbb2降解的强化作用后,进一步研究了usp2抑制剂ml364与17-aag联合用药对细胞生长的作用。
在本实施例中,采用17-aag单独处理以及17-aag与ml364联合处理skbr3和hcc1954细胞,并采用克隆形成实验检测不同处理条件对细胞生长的影响。实验结果参见【图4】。结果表明,ml364与17-aag联合使用能够显著抑制细胞生长(参见【图4a-b】)。
然后,利用crispr-cas9基因编辑技术构建了稳定敲低usp2的细胞系au565-usp2kd,加入17-aag处理0、4、8、12h,并采用免疫印迹检测au565和au565-usp2kd细胞中erbb2蛋白水平。结果表明,usp2稳定敲低的细胞系中erbb2降解的更快且更多(参见【图4c】)。
有研究报道,usp2能够与细胞周期蛋白(cyclin)d1相互作用并稳定细胞周期蛋白d1水平,敲低usp2能够抑制细胞周期。在au565-usp2kd细胞系中利用慢病毒包装体系稳定过表达细胞周期蛋白d1(au565-usp2kd-oeccnd1),克隆形成结果表明usp2敲低的au565-usp2kd细胞克隆数量明显少于正常的au565细胞,而au565-usp2kd-oeccnd1细胞克隆数量虽然有明显上升,但与正常au565细胞相比仍明显减少(参见【图4d】)。这说明了usp2敲低会erbb2阳性乳腺癌细胞生长的抑制作用不是由细胞周期蛋白d1引起的,而是usp2自身功能所致。
实施例5usp2抑制剂ml364与hsp90抑制剂17-aag联合使用对肿瘤生长的影响
在本实施例中,通过体内抗肿瘤实验进一步验证了usp2抑制剂ml364与hsp90抑制剂17-aag联合使用对小鼠体内肿瘤生长的影响。
选取6周龄balb/c雌性裸鼠,在小鼠右侧腋下皮下注射两百万个乳腺癌hcc1954细胞。注射一周后,将小鼠随机分为四组(空白组、ml364处理组(5mg/kg)、17-aag(50mg/kg)处理组以及ml364和17-aag联合用药组),每组5只,进行给药处理。给药每隔一天进行。给药三周后取出小鼠移植瘤。移植瘤的体积和重量统计结果参见【图5】。
移植瘤体积和重量统计结果均表明,相较于单独用药,ml364和17-aag联合使用能够显著抑制肿瘤的生长(参见【图5a-b】)。肿瘤组织免疫组化结果表明,联合用药能够显著降低erbb2蛋白水平,同时降低了细胞增殖性抗原ki67和周期蛋白细胞周期蛋白d1的表达(参见【图5c】)。
参考文献:
1.segovia-mendoza,m.,gonzalez-gonzalez,m.e.,barrera,d.,diaz,l.,andgarcia-becerra,r.(2015)efficacyandmechanismofactionofthetyrosinekinaseinhibitorsgefitinib,lapatinibandneratinibinthetreatmentofher2-positivebreastcancer:preclinicalandclinicalevidence.americanjournalofcancerresearch5,2531-2561
2.kumler,i.,tuxen,m.k.,andnielsen,d.l.(2014)asystematicreviewofdualtargetinginher2-positivebreastcancer.cancertreatmentreviews40,259-270
3.rimawi,m.f.,schiff,r.,andosborne,c.k.(2015)targetingher2forthetreatmentofbreastcancer.annualreviewofmedicine66,111-128
4.singh,h.,walker,a.j.,amiri-kordestani,l.,cheng,j.,tang,s.,balcazar,p.,barnett-ringgold,k.,palmby,t.r.,cao,x.,zheng,n.,liu,q.,yu,j.,pierce,w.f.,daniels,s.r.,sridhara,r.,ibrahim,a.,kluetz,p.g.,blumenthal,g.m.,beaver,j.a.,andpazdur,r.(2018)u.s.foodanddrugadministrationapproval:neratinibfortheextendedadjuvanttreatmentofearly-stageher2-positivebreastcancer.clinicalcancerresearch:anofficialjournaloftheamericanassociationforcancerresearch24,3486-3491
5.sun,z.,shi,y.,shen,y.,cao,l.,zhang,w.,andguan,x.(2015)analysisofdifferenther-2mutationsinbreastcancerprogressionanddrugresistance.journalofcellularandmolecularmedicine19,2691-2701
6.zuo,w.j.,jiang,y.z.,wang,y.j.,xu,x.e.,hu,x.,liu,g.y.,wu,j.,di,g.h.,yu,k.d.,andshao,z.m.(2016)dualcharacteristicsofnovelher2kinasedomainmutationsinresponsetoher2-targetedtherapiesinhumanbreastcancer.clinicalcancerresearch:anofficialjournaloftheamericanassociationforcancerresearch22,4859-4869
7.kancha,r.k.,vonbubnoff,n.,bartosch,n.,peschel,c.,engh,r.a.,andduyster,j.(2011)differentialsensitivityoferbb2kinasedomainmutationstowardslapatinib.plosone6,e26760
8.jhaveri,k.,ochiana,s.o.,dunphy,m.p.,gerecitano,j.f.,corben,a.d.,peter,r.i.,janjigian,y.y.,gomes-dagama,e.m.,koren,j.,3rd,modi,s.,andchiosis,g.(2014)heatshockprotein90inhibitorsinthetreatmentofcancer:currentstatusandfuturedirections.expertopiniononinvestigationaldrugs23,611-628
9.mcdonough,h.,andpatterson,c.(2003)chip:alinkbetweenthechaperoneandproteasomesystems.cellstress&chaperones8,303-308
10.neckers,l.,andworkman,p.(2012)hsp90molecularchaperoneinhibitors:arewethereyet?clinicalcancerresearch:anofficialjournaloftheamericanassociationforcancerresearch18,64-76
11.pedersen,n.m.,madshus,i.h.,haslekas,c.,andstang,e.(2008)geldanamycin-induceddown-regulationoferbb2fromtheplasmamembraneisclathrindependentbutproteasomalactivityindependent.molecularcancerresearch:mcr6,491-500
12.xu,w.,marcu,m.,yuan,x.,mimnaugh,e.,patterson,c.,andneckers,l.(2002)chaperone-dependente3ubiquitinligasechipmediatesadegradativepathwayforc-erbb2/neu.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica99,12847-12852
13.citri,a.,alroy,i.,lavi,s.,rubin,c.,xu,w.,grammatikakis,n.,patterson,c.,neckers,l.,fry,d.w.,andyarden,y.(2002)drug-inducedubiquitylationanddegradationoferbbreceptortyrosinekinases:implicationsforcancertherapy.theembojournal21,2407-2417
14.marx,c.,held,j.m.,gibson,b.w.,andbenz,c.c.(2010)erbb2traffickinganddegradationassociatedwithk48andk63polyubiquitination.cancerresearch70,3709-3717
15.huang,w.,wu,q.d.,zhang,m.,kong,y.l.,cao,p.r.,zheng,w.,xu,j.h.,andye,m.(2015)novelhsp90inhibitorfw-04-806displayspotentantitumoreffectsinher2-positivebreastcancercellsasasingleagentorincombinationwithlapatinib.cancerletters356,862-871。
- 还没有人留言评论。精彩留言会获得点赞!
- SPNP‑I在制备Nav1.7通道工具试剂中的应用的制造方法与工艺
- SPNP‑I在制备Nav1.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.2通道工具试剂中的应用的制造方法与工艺
- SPNP‑IX在制备Kv4.3通道工具试剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.5通道抑制剂中的应用的制造方法与工艺
- SPNP‑27在制备Nav1.3通道抑制剂中的应用的制造方法与工艺
- 一种多肽在制备Nav1.3钠通道工具试剂中的应用的制造方法与工艺
- SPKP‑XI在制备Kv4.2通道抑制剂中的应用的制造方法与工艺
- SGLT‑2糖尿病抑制剂及其中间体的制备方法与流程