抑制Htr3a及其胞内信号通路的化合物在制备治疗和/或预防AD药物中的应用的制作方法
本发明涉及治疗或预防阿尔茨海默病的药物研究技术领域,尤其是涉及一种抑制htr3a及其胞内信号通路的化合物在制备治疗和/或预防ad药物中的应用。
背景技术:
阿尔茨海默病(alzheimer'sdisease)起病隐匿,是以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性疾病。《2015年世界阿尔茨海默报告》指出,全球约有4680万阿尔茨海默病患者,平均每3秒钟就有1例新发患者,预计2050年全球患者将突破1亿3150万人。我国目前阿尔茨海默病患者已经超过800万。阿尔茨海默病在65岁以上的年龄段的人群中患病率为5%;超过85岁患病率增加至25%,95岁以上的老人则高达60%。由于人口老龄化,ad患者给家庭和社会带来巨大的精神负担和经济负担。
目前,针对阿尔茨海默病,临床使用的药物主要有乙酰胆碱脂酶抑制剂和谷氨酸nmda受体抑制剂。迄今为止,阿尔茨海默病患者没有特异性的有效药物阻止疾病的发展。因此,研发针对ad的病理过程、减少aβ淀粉样蛋白的产生、以及由此神经炎症引起的神经损伤,延缓、阻止病变的发展,有极大的应用前景和社会价值。
关于ad的发病机制有两大假说。一是以aβ淀粉样蛋白聚集形成的淀粉样斑(又称老年斑)以及由此引发的神经炎症、胶质细胞活化、突触传递功能障碍、突触与神经元丢失的β淀粉样蛋白瀑布假说;另外是tau蛋白学说,tau过度磷酸化导致神经原纤维缠结,破坏神经元和突触的正常功能、引起神经元死亡。
然而,目前关于如何阻止ad的进程,减缓ad的发展还没有很好的办法。
技术实现要素:
本发明的目的就是为了提供抑制htr3a及其下游胞内信号通路的药物在制备治疗和/或预防阿尔茨海默病的药物中的应用。
本发明可以为阿尔茨海默病的治疗提供新的治疗靶点,并有利于阿尔茨海默病的新药开发。
本发明的目的可以通过以下技术方案来实现:
本发明提供抑制htr3a及其下游胞内信号通路ca2+-can-nfat的化合物在制备治疗和/或预防阿尔茨海默病的药物中的应用。
本领域知晓5-羟色胺受体有7种亚型,本申请中,htr3a是5-羟色胺受体第3种亚型α亚单位,5-hydroxytryptaminereceptor3αsubunit,也称之为5-羟色胺受体3a,其结构是已知的。
htr3是一种离子型通道受体,由3个α亚单位和2个β亚单位构成。受体激活时,允许na+和ca2+流入,α亚单位是其功能单位。
htr3a的阻断剂目前有:tropisetron(托烷司琼),ondansetron(昂丹司琼)等,用于放疗、化疗后的防呕吐。
进一步地,本发明提供抑制htr3a及其下游胞内信号通路ca2+-can-nfat的化合物在制备降低aβ-淀粉样蛋白产生的药物中的应用。
进一步地,本发明提供抑制htr3a及其下游胞内信号通路ca2+-can-nfat的化合物在制备降低钙调神经磷酸酶(can)活性的药物中的应用。
进一步地,本发明提供抑制htr3a及其下游胞内信号通路ca2+-can-nfat的化合物在制备降低转录因子nfat活性的药物中的应用。
本发明还提供抑制钙调神经磷酸酶(can)的化合物在制备治疗和/或预防阿尔茨海默病的药物中的应用。
本发明还提供抑制转录因子nfat的化合物在制备治疗和/或预防阿尔茨海默病的药物中的应用。
本发明还提供治疗和/或预防阿尔茨海默病的药物,以抑制htr3a及其下游胞内信号通路can-nfat的化合物或抑制钙调神经磷酸酶的化合物或抑制转录因子nfat的化合物为药效成分。
本发明还提供治疗和/或预防阿尔茨海默病的药物开发的方法,设计、筛选针对htr3a及其下游胞内信号通路关键位点化合物,有作为治疗和/或预防阿尔茨海默病的新药物的可能性。
进一步地,抑制htr3a或其下游胞内信号通路功能的药物,能够降低aβ-淀粉样蛋白产生的产生,逆转胞内信号通路ca2+-can-nfat的改变,有作为治疗和/或预防阿尔茨海默病的新药物的可能性。
本发明还提供htr3a及下游胞内信号通路关键位点的应用,所述htr3a及下游胞内信号通路关键位点作为设计、筛选治疗和/或预防阿尔茨海默病的新药物的应用。
在实验中我们偶然发现成年app/ps1ad模型(ad)小鼠,其htr3a受体表达较同窝的野生型(wildtype,wt)小鼠显著增加。本发明人进一步用westernblot方法观察1至12月年龄的小鼠,结果发现1-12月的ad小鼠的htr3a表达水平较同龄wt小鼠显著增加,这个结果提示htr3a可能在ad的发病中起作用。
为深入探讨这个问题,本发明人用htr3ashrna-aav病毒脑内显微注射沉默htr3a,动物存活一个月后观察。用蛋白杂交实验显示htr3ashrna-aav病毒注射组,ad小鼠htr3a蛋白表达较给予空病毒ad小鼠显著降低,证明ad小鼠的htr3a沉默成功;免疫荧光染色和硫黄素染色观察aβ淀粉样斑,结果显示htr3a沉默ad小鼠较给予空病毒ad小鼠的aβ淀粉样斑显著降低。这些研究结果首次证实htr3a在app/ps1ad转基因动物中高表达,抑制htr3a的表达减少了aβ淀粉样斑,结果提示htr3a阳性的中间能神经元在aβ淀粉样蛋白的产生中起重要的作用。
为了验证在ad小鼠所观察到的结果是否在ad患者也存在相同的情况,本发明人进一步在ad患者的皮质和海马观察htr3a的表达变化。令人欣喜的是,在ad患者的额叶皮质和海马,用westernblot方法,观察到ad患者的htr3a表达水平较同龄的老年人显著增加。
本发明人进一步研究了htr3a所引起的胞内信号改变。非常重要的是,在ad患者和app/ps1ad小鼠,都发现htr3a受体的胞内信号钙调神经磷酸酶can和t细胞核转录因子nfat较正常对照组显著升高。在ad小鼠,沉默htr3a的功能,能逆转钙调神经磷酸酶can活性和转录因子nfat活性。
本发明人这一系列的研究结果,首次发现htr3a在ad患者和ad小鼠显著升高,降低htr3a的功能,能够减少aβ淀粉样斑的产生。在ad患者和ad的小鼠,htr3a有相似的胞内信号改变即can-nfat信号通路改变。这些结果提示,显著上调的htr3a及其胞内信号在ad的aβ淀粉样斑的产生中起重要作用;调控这一通路的药物研发很可能为ad治疗找到新药。
本发明根据htr3a的研究结果,进一步对htr3a下游胞内信号通路关键位点的研究,阐明了其在ad发病机制中的作用;本发明研究表明调控htr3a及其下游胞内信号通路可以显著降低ad的aβ淀粉样蛋白斑,减缓ad的病程。因此,通过本发明的研究,设计、筛选针对htr3a及其下游胞内信号通路关键位点化合物,有可能为ad治疗找到新的药物。
与现有技术相比,本发明首次在实验中发现阿尔茨海默病(alzheimer'sdisease,ad)转基因动物和ad病人的htr3a表达显著增加,其细胞内信号的关键蛋白钙调神经磷酸酶和转录因子nfat显著升高。在ad的转基因动物小鼠,用htr3ashrna-aav病毒脑立体定位注射,抑制htr3a的功能,均显著降低了aβ-淀粉样蛋白的产生,逆转了胞内信号通路的can和转录因子nfat的改变。
本发明认为htr3a受体及其胞内信号通路在ad的aβ-淀粉样蛋白产生中起重要作用,调控这一通路可以影响ad的进程、阻止ad的进行性发展。因此针对这一通路的化合物能阻止ad的进程,减缓ad的发展,在ad的治疗方面有极大的研究与应用前景。
附图说明
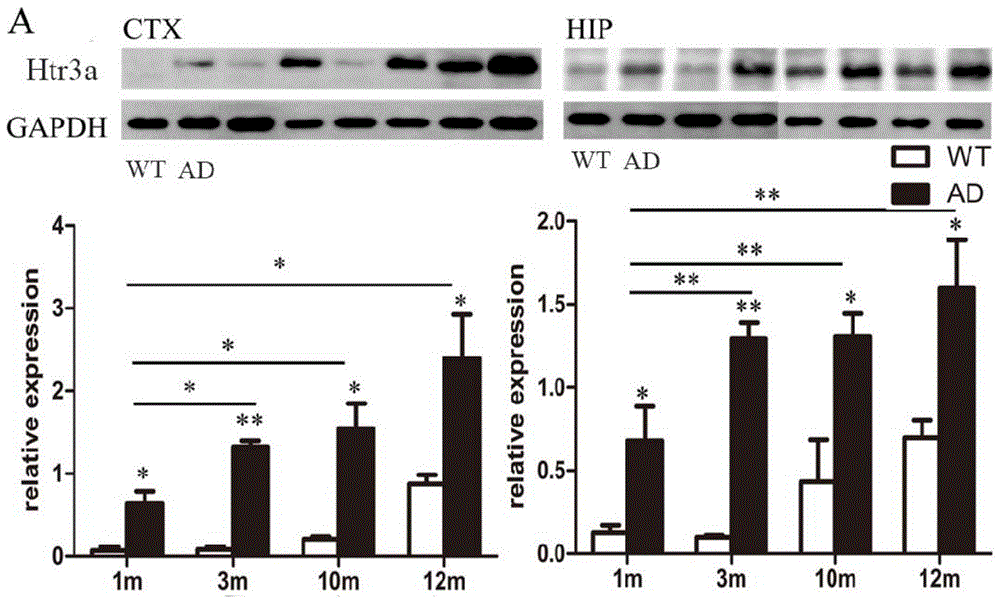
图1:实施例1中不同年龄ad小鼠htr3a的westernblot分析结果;
图1显示1,3,10,12月龄的app/ps1ad小鼠的皮质(ctx)和海马(hip)htr3a受体比野生型wt小鼠显著增加。
图2:实施例1中ad小鼠htr3a免疫荧光化学染色实验结果;
图2显示,10月龄(10m)的app/ps1ad小鼠htr3a受体阳性细胞(箭头所指)比wt小鼠显著增加;gc:齿状回颗粒细胞层(granularcell,gc)。
图3:实施例2中htr3a沉默的ad小鼠htr3awesternblot分析结果;
图3分析显示htr3a沉默的ad小鼠(ad-htr3ashrna-aav)htr3a的表达比ad组(ad-con-avv)的显著降低,而ad空病毒组的htr3a表达显著高于wt组(wt-con-aav)小鼠。
图4:实施例2中htr3a沉默的ad小鼠htr3a免疫荧光化学染色实验结果;
图4显示htr3a沉默的ad小鼠(ad-htr3ashrna-aav)的皮质的htr3a阳性细胞(箭头所指)数比ad-组(ad-con-aav)的显著减少;而ad组(ad-con-avv)的htr3a阳性细胞数量比wt(wt-con-aav)组的显著升高。
图5:实施例3中htr3a沉默的ad小鼠aβ淀粉样蛋白(用6e10抗体)免疫荧光染色结果;
图5显示免疫免疫荧光染色htr3a沉默的ad小鼠(ad-htr3ashrna-aav)海马aβ淀粉样蛋白(6e10抗体)比ad组(ad-con-aav)的显著降低,gfp转染细胞。
图6:实施例3中htr3a沉默的ad小鼠aβ淀粉样蛋白westernblot分析结果;
图6westernblot分析显示htr3a沉默的ad小鼠(ad-htr3ashrna-aav)海马aβ淀粉样蛋白比ad组(ad-con-aav)的显著降低。
图7免疫荧光染色分析显示htr3a沉默的ad小鼠(ad-htr3ashrna-aav)海马aβ淀粉样蛋白比ad组(ad-con-aav)的显著降低,而皮质(ctx)没有差异。
图8:实施例3中htr3a沉默的ad小鼠硫黄素s(thioflvines))染色观察aβ淀粉样蛋白;
图8显示htr3a沉默的ad小鼠(ad-htr3ashrna-aav)的海马(hip)硫黄素s染色显示aβ淀粉样蛋白比ad组(ad-con-aav)的显著降低。
图9:实施例4中htr3a沉默的ad小鼠iba免疫荧光染色显示结果;
图9免疫荧光染色显示htr3a沉默的ad小鼠(ad-htr3ashrna-aav)的海马(hip)iba阳性的小胶质细胞数量比ad组(ad-con-avv)的显著降低;而ad组(ad-con-avv)的iba阳性的小胶质细胞数量比wt(wt-con-aav)组的显著升高。
图10htr3a沉默的ad小鼠钙指示剂fluo-4am显示htr3a沉默的ad小鼠(ad-htr3ashrna-aav)的海马细胞内钙(ica2+)比ad组(ad-con-avv)的显著降低,而ad组(ad-con-avv)的细胞内钙(ica2+)比wt(wt-con-aav)组的显著升高。
图11:htr3a沉默的ad小鼠fluo-4am与htr3a双染色观察细胞内钙显著升高的htr3a阳性中间能神经元;
图11fluo-4am与htr3a双染色观察显示,细胞内钙显著升高的htr3a阳性中间能神经元(htr3a/ica2+):htr3a沉默的ad小鼠(ad-htr3ashrna-aav)的海马细胞内钙显著升高的htr3a阳性中间能神经元(htr3a/ica2+)数量比ad组(ad-con-avv)的显著降低,而ad组(ad-con-avv)的htr3a/ica2+数量比wt(wt-con-aav)组的显著升高。
图12:实施例5中westernblot分析ad小鼠can和活性can(△can)表达变化;
图12westernblot分析显示ad小鼠海马△can的含量比wt小鼠的显著增加。
图13:htr3a沉默的ad小鼠nfat免疫荧光染;
图13:htr3a沉默的ad小鼠海马nfat的免疫荧光染色显示,htr3a沉默的ad小鼠(ad-htr3ashrna-aav)的海马nfat免疫阳性数量比ad组(ad-con-avv)的显著降低,而ad组(ad-con-avv)的nfat免疫阳性数量比wt-组(wt-con-aav)的显著升高。
图14:实施例6中ad患者额叶aβ和磷酸化tau蛋白的组织化学染色结果;
图14ad患者额叶aβ和磷酸化tau蛋白的组织化学染色显示ad患者皮层有一些β淀粉样斑和磷酸化的tau蛋白。
图15:实施例6中ad患者皮质aβ淀粉样蛋白westernblot分析结果;
图15westernblot分析显示ad患者皮质aβ淀粉样蛋白比正常组显著增加。
图16:实施例6中westernblot方法ad患者htr3a蛋白表达;
图16westernblot分析ad患者皮层(ctx)和海马(hip)的htr3a表达较正常组的(cn)显著升高。
图17:实施例6中用免疫组织化学染色观察ad患者htr3a阳性细胞;
图17免疫组织化学染色显示ad患者脑海马区域有一些htr3a阳性细胞,正常组未观察到阳性细胞。
图18:实施例6中用westernblot分析ad患者钙调神经磷酸酶can和活性can(△can)和t细胞核转录因子nfat的含量;
图18westernblot分析ad患者皮层(ctx)总的can、有活性can(△can)和nfat较正常组显著升高。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例1
本实验采用的app/ps1转基因ad小鼠(从南方大学模式动物中心购买),是广泛使用的ad模型小鼠。
首先,通过westernblot分析,发现1-12月的app/ps1转基因ad小鼠的皮层和海马的htr3a表达较野生型(wt)小鼠显著增加(图1);其次,用免疫荧光染色,结果分析显示10个月app/ps1转基因ad小鼠皮层的有明显增加htr3a阳性细胞,而在wt小鼠几乎检测不到htr3a阳性细胞(图2)。
由此可见,1-12月的app/ps1转基因ad小鼠其htr3a的表达水平较同龄野生型小鼠显著增加。
其中,本实施例中,westernblot分析的具体方法如下:
同窝出生的app/ps1ad小鼠,wt(野生型)小鼠在同一饲养环境下分别饲养1个月、3个月,10个月和12个月。在各时间点,过量麻醉小鼠、断头取出海马和大脑皮质,用ripa裂解液(p0013b,beyotime)提取蛋白,bca蛋白浓度测定试剂盒(p0010,beyotime)测得蛋白浓度。按照每孔10μg的蛋白总量,12%sds-page电泳分离蛋白后,将凝胶转至pvdf膜。根据蛋白分子量切膜,剪好后的膜用1×tbst室温下于慢速摇床上漂洗5min,随后将膜于5%bsa中室温下封闭1h。膜封闭后于一抗中4℃下孵育16h,用鼠来源的5ht3ar抗体(1∶500)和小鼠抗gapdh抗体(1∶1000;ag019,beyotime)抗体。一抗孵育完成后,用1×tbst室温下于快速摇床上,荡洗10min,共3次。将膜浸入相应辣根过氧化物酶标记抗鼠(1∶1000;a0181,beyo-time)二抗中,室温下于慢速摇床上孵育2h后,用1×tbst室温下于快速摇床上,荡洗10min,共3次。用ecl化学发光试剂盒(p0018a,beyotime)显影,采用imagequantlas4000mini化学发光成像分析仪(28955813,gehealthcarelifesciences)观察结果。用imagej软件分析,以gapdh为内参,计算出5-ht3ar相对表达量。
本实施例中,免疫荧光染色的具体方法如下:
wt小鼠和app/ps1ad小鼠各3只,用于免疫荧光染色。小鼠用适量10%水合氯醛麻醉后开胸暴露心脏,经左心室用生理盐水灌注至肝脏变白,经含4%多聚甲醛的磷酸缓冲液(pb)灌注预固定后,取出全脑,4℃下在上述相同固定液中后固定24h。后固定完成后,将全脑于4℃下在含20%蔗糖的pb溶液中沉底24h,随后移入含30%蔗糖的pb溶液,4℃下放置24h完全沉底。将组织用冰冻切片机进行冠状切片,厚度为10μm。选取脑片,于pbs中室温下在慢速摇床上漂洗三次,每次10min,随后用5%bsa室温下封闭2h。封闭后,脑片浸入htr3a抗体(1∶100)中,4℃下孵育18h。脑片于pbs中室温下在慢速摇床上漂洗三次,每次10min。将脑片浸入cy3标记的相应二抗(1∶500;beyotime)中,室温下避光孵育2h后,慢速摇床上漂洗三次,每次10min。用dapi(1∶300;beyo-time)染色5min,室温下于慢速摇床上漂洗三次,每次10min后,封片。正置显微镜下观察拍照,用im-agej软件对每张脑片5-ht3ar阳性细胞进行计数。
实施例2
沉默app/ps1ad小鼠的htr3a,降低htr3a观察对app/ps1ad小鼠淀粉样斑的影响。
制备了aav-htr3ashrna-gfp病毒,aav-egfp空病毒做对照。6个半月龄的wt小鼠和app/ps1ad小鼠,双侧海马内注射。实验分三组:(1)wt小鼠给予同体积的aav-egfp(con-aav);(2)app/ps1ad小鼠给予aav-egfp(con-aav,滴度2.19×109v.g/每侧;(3)app/ps1ad小鼠给予aav-htr3ashrna-gfp病毒(滴度:2.19×109v.g/每侧)。注射后动物饲养4周,过量麻醉、取脑组织,进行westernblot蛋白杂交实验和免疫荧光染色,westernblot蛋白杂交实验和免疫荧光染色的方法参考实施例1。
蛋白杂交实验显示htr3ashrna-aav病毒注射组,ad小鼠htr3a蛋白表达较对照组ad小鼠降低(图3)。此外,上述病毒注射的脑组织,荧光免疫染色观察htr3a阳性细胞数。免疫染色统计结果显示,ad空病毒组htr3a阳性细胞数显著多于wt空病毒组,而adhtr3ashrna组,htr3a阳性细胞数比ad空病毒组显著降低(图4)。这些结果证明app/ps1ad小鼠的htr3a沉默成功,降低了ad小鼠htr3a的表达。
实施例3
降低app/ps1ad小鼠htr3a的表达对aβ淀粉样蛋白是否有影响的研究
为了研究降低app/ps1ad小鼠htr3a的表达对aβ淀粉样蛋白是否有影响,本实施例中用针对aβ淀粉样蛋白的免疫荧光染色(图5)和westernblot(图6)分析以及aβ淀粉样蛋白的硫黄素染色(图7),对aβ淀粉样斑进行分析。
结果显示沉默app/ps1ad小鼠的htr3a,aβ淀粉样斑较ad小鼠(给予空病毒)显著降低。
实施例4
沉默htr3a,减少aβ淀粉样斑,是否由此减轻小胶质细胞活化与神经炎症的研究
本发明人进一步观察沉默htr3a,减少aβ淀粉样斑,是否由此减轻小胶质细胞活化与神经炎症。用免疫荧光染色分析显示,htr3ashrna-aav病毒注射组的ad小鼠海马iba阳性的小胶质细胞数量比ad小鼠的显著降低(图8);并且神经炎症因子白介素1β(interleukin1β,il-1β)也比ad小鼠的显著降低(图9)。
这些研究结果首次证实htr3a在app/ps1ad小鼠高表达,用htr3ashrna降低app/ps1ad小鼠的htr3a表达,抑制htr3a的功能,减少了aβ淀粉样斑,减轻了小胶质细胞活化和神经炎症反应。这些重要的研究发现提示htr3a在aβ淀粉样斑的产生中起重要的作用,调控htr3a的功能可能影响ad的进程,为ad的新药物开发提供了潜在的可能。
实施例5
htr3a的细胞内信号通路的研究
本发明人进一步研究了htr3a的细胞内信号通路。htr3a是离子通道型受体,允许细胞外的钙离子通过。因此,htr3a的高表达可能导致细胞内钙增加。而钙调神经磷酸酶(calcineurinphosphatase,can)是细胞内钙的下游靶分子,t-细胞核转录因子((nuclearfactorofactivatedt-cells,nfat)是can的底物。发明人进一步用westernblot方法观察了wt小鼠和app/ps1ad小鼠细胞内钙和钙调神经磷酸酶(calcineurinphosphatase,can)和nfat的变化。
首先,用钙指示剂(fluo-4am)染色观察wt小鼠和app/ps1ad小鼠海马细胞内钙变化(图10)。对细胞内钙信号强度分析,结果显示ad-con空病毒组的细胞内钙信号强度显著高于wt-con空病毒组;htr3ashrna-aav病毒注射组的ad小鼠(ad-htr3ashrna-aav)的细胞内钙信号强度显著低于ad-con空病毒组,这些实验结果首次发现沉默htr3a可以降低app/ps1ad小鼠细胞内钙。
本实验进一步用htr3a抗体免疫染色和fluo-4am染色双标记,结果显示在app/ps1ad小鼠的htr3a阳性的中间能神经元细胞内钙信号较wt小鼠显著增强;而沉默htr3a的ad小鼠(ad-htr3ashrna-aav)htr3a阳性的中间能神经元细胞内钙信号显著低于ad小鼠(ad-con-aav)(图11)。
最后,对8月龄wt小鼠和app/ps1ad小鼠的钙调神经磷酸酶can和下游的核转录因子nfat的变化进行了观察。westernblot分析显示,app/ps1ad小鼠海马的钙调神经磷酸酶can活性显著增加,表现为△can的含量显著增加(图12)。
本实施例还用免疫荧光染色,观察了转录因子nfat的变化。结果显示ad-con空病毒组的nfat阳性产物比wt-con组显著增加;而htr3ashrna-aav病毒注射组的ad小鼠(ad-htr3ashrna-aav)的nfat阳性产物比d-con空病毒组显著降低(图13)。这些结果首次发现沉默app/ps1ad小鼠htr3a,能降低ad小鼠增高的nfat的表达。
实施例6
为了验证在ad小鼠所观察到的结果是否在ad患者也存在相同的情况,本实施例进一步在ad患者的皮质和海马观察htr3a的表达变化。
本实验在中南大学湘雅医学院神经科研究中心进行。通过湘雅医学院的遗体捐献计划,利用美国国家卫生研究院建立的标准化操作规程(sop),从脑捐献志愿者的颅骨中取出脑,沿矢状缝分成左右大脑半脑,一般左侧脑放入磷酸缓冲液配制成的4%多聚甲醛中后固定,固定2-4周后,沿冠状面切成厚度1cm的脑片,拍摄照片存档,福尔马林固定的这部分脑组织用于免疫组织化学的研究;右脑沿冠状位从从额叶至枕叶切成厚度为1cm的脑片,用简易塑封袋分装标记好后,放入负80摄氏度超低温冰箱中冷冻保存,用于westernblot蛋白分析。westernblot和组织化学染色的程序与上面相同。
首先用组织化学染色(图14)和westernblot(图15)分析检测ad患者和正常老人(w)皮层和海马的aβ淀粉样蛋白和磷酸化tau-蛋白(p-tau),以证实确实为ad患者。
上述实验结果证实,本发明的确获得了正常老人和ad患者的脑组织样本。在此基础上,我们用westernblot方法观察正常组和ad患者脑组织的htr3a的蛋白表达,结果发现ad患者的皮层和海马有显著增加的htr3a的表达(图16)。此外,对脑组织的免疫染色,正常脑组织(w)没有检测到htr3a阳性细胞;而ad患者皮层和海马可见一些htr3a阳性细胞(图17)。
本发明进一步研究了ad患者htr3a所引起的胞内信号改变。在ad患者的额叶皮质和海马,本实验用westernblot分析发现钙调神经磷酸酶can和t细胞核转录因子nfat较正常组显著升高(图18)。
本发明这一系列的研究结果,首次发现htr3a在ad患者和ad模型小鼠显著升高,抑制htr3a的功能,能够减少aβ的产生、促进认知功能的恢复。在ad患者和ad的小鼠有相似的胞内信号改变。这些结果提示,显著上调的htr3a及其胞内信号在ad的aβ淀粉样斑的产生中起重要作用;调控这一通路的药物研发很可能为ad治疗提供新药物。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!