电穿孔系统
电穿孔系统
1.本申请是申请日为2015年5月12日、申请号为201580025135.6、发明名称为“使用脉冲电场选择性调节细胞的胞内影响”的申请的分案申请。
2.相关申请的交叉参考
3.本申请依赖于在2104年5月12日提交的美国临时申请第61/992,023号的公开内容并且要求其申请日的优先权和权益,本申请的公开内容以全文引用的方式并入本文中。
技术领域
4.本发明涉及包括施用电治疗能的医学疗法。本发明的实施例涉及一种产生两个治疗区的系统和方法:围绕电极的第一区和围绕第一区的第二选择性治疗区,在所述第一区内细胞被非选择性地杀死,在所述第二选择性治疗区内细胞被选择性地杀死,如异常细胞。在具体实施例中,提供了用于通过施用电脉冲列选择性治疗细胞(如癌细胞)的系统和方法,其中优化脉冲长度和连续脉冲之间的延迟以对胞内膜电位产生影响。通过本发明的系统和方法,可有效地治疗设置在肿瘤边缘内的浸润性肿瘤细胞同时避开在肿瘤边缘内的健康组织。
背景技术:
5.病灶消融技术通常通过破坏在明确界定区域内的癌细胞攻击肿瘤。通常,这些技术破坏在治疗体积内的所有细胞和组织结构,而不仅仅是癌细胞。病灶消融技术的主要挑战是通常存在围绕肿瘤的含有健康细胞和一些浸润性癌细胞的区域。如果未治疗这些浸润性癌细胞,那么其可导致肿瘤的复发。在传统的手术切除和病灶消融中,溶液用于在肿瘤边缘以外治疗以试图还去除这些浸润性癌细胞。这对通常出现近临界结构如血管和神经的肿瘤来说是主要挑战。因此,在本领域中需要克服这些局限性的新的电穿孔方法。
技术实现要素:
6.本发明提供一种治疗在肿瘤边缘中的浸润性癌细胞的系统和方法。此双峰增强型消融机制(beam)平台使用高频电场的脉冲串,所述高频电场的脉冲串经特定优化以增强脉冲的胞内影响同时最小化对健康组织的影响。在实施例中,最优脉冲串含有组成型脉冲,其中持续时间约等于细胞膜的充电时间加上核被膜的放电时间。脉冲之间的最优断开时间约等于细胞膜的充电时间。
7.在实施例中,可基于某些细胞(恶性)细胞的生物物理亚细胞结构对其进行优先靶向。具有较大细胞核与细胞质比率的细胞(其为细胞恶性肿瘤的指示)更易受这些脉冲的影响。影响细胞的机制与破坏其细胞核有关。虽然细胞大小为用于确定细胞在用于典型的ire的施加场下何时死亡的主要参数,但是相比之下,根据本发明的实施例,细胞大小并不起主导作用。
8.具体实施例提供一种选择性治疗细胞的方法,所述方法包含:向组织施加多个具有在连续脉冲之间延迟的电脉冲,其中每个脉冲的长度和连续脉冲之间的延迟经优化以产
生第一治疗区和第二治疗区;其中在第一治疗区中,靶细胞(如癌细胞)和非靶细胞(如非癌细胞)被杀死,而在第二治疗区中,靶细胞被杀死或抑制而非靶细胞被避开。在此类方法中,施加可在体外、体内或离体执行。
9.根据实施例,在第二治疗区内,以减缓或停滞细胞分裂的方式来抑制靶细胞,如癌细胞,或者以减缓或停滞迁移的方式来抑制靶细胞(例如,癌细胞),或者以减少血液和养分的传输的方式来抑制靶细胞(例如,癌细胞),或者通过细胞凋亡来杀死靶细胞 (例如,癌细胞),或者在第二治疗区中杀死或抑制一些靶细胞(例如,癌细胞),并且在第二治疗区中避开一些非靶细胞(例如,非癌细胞)。在实施例中,第二治疗区围绕肿瘤并且靶癌细胞为来源于肿瘤的浸润性细胞。组织可为大脑组织和/或肿瘤胶质母细胞瘤。在本发明的任何实施例中,靶细胞可为任何类型的细胞,包括例如癌细胞、浸润性细胞或任何非所需的细胞。非靶细胞也可为任何类型的细胞并且通常为健康细胞、正常细胞或非癌细胞。
10.根据实施例,在第一治疗区内靶细胞和非靶细胞(例如,癌细胞和非癌细胞)通过坏死而被杀死,或者一些癌细胞和一些非癌细胞在第一治疗区中被杀死。
11.同样地,根据实施例,由于靶细胞和非靶细胞两者(例如,癌细胞和非癌细胞)的跨膜电位增加到致死阈值,所以其可在第一治疗区内被杀死。
12.在实施例中,由于癌细胞的核跨膜电位增加到致死阈值,所以其在第二治疗区内被杀死。
13.在实施例中,连续脉冲之间的延迟可大于每个脉冲的长度,或者连续脉冲之间的延迟可为每个脉冲长度的几分之一,或者每个脉冲的长度可等于癌细胞的细胞膜的充电时间加上癌细胞的核膜的放电时间,而连续脉冲之间的延迟等于癌细胞的细胞膜的充电时间。同样地,癌细胞的细胞膜的充电时间和癌细胞的核膜的放电时间可通过数字建模测定。
14.在实施例中,脉冲串包含为矩形脉冲、线性变化、指数衰减或正弦波的电场波形。在实施例中,电场波形为单极或双极的,或者可为包含第一频率谐波和第二频率谐波的叠加双峰信号,其中第二频率谐波具有高于第一频率谐波频率的频率。
15.在实施例中,电场波形包含连续交替的微秒量级脉冲与纳秒量级脉冲。同样地,电场波形可为对称或不对称的。在实施例中,电场波形可具有在100khz到10mhz范围内的载波频率。波形的载波频率或脉冲持续时间可基于癌细胞的交越频率。
16.在实施例中,每个脉冲的长度和连续脉冲之间的延迟基于癌细胞的物理细胞核与细胞质大小比率而被优化。
17.本发明的实施例包括一种治疗患者体内的癌症的方法,包含识别患者体内的实体肿瘤,将至少一个电极插入到实体肿瘤中或与实体肿瘤相邻并且施加包含具有连续脉冲之间的延迟的多个电脉冲的脉冲串。此类方法还适用于治疗不一定为癌性的非所期望细胞或靶细胞。在实施例中,优化每个脉冲的长度和连续脉冲之间的延迟以产生在至少一个电极半径内的第一治疗区和在电极的第一半径与第二半径内之间的第二治疗区,所述第二治疗区位于第一治疗区外部。在第一治疗区中,癌细胞和健康细胞被非选择性杀死,而在第二治疗区中,癌细胞被选择性杀死或抑制,健康细胞被避开。治疗患者体内癌症的方法可在体内、离体或体外执行。
18.在本发明的实施例中,在第二治疗区中选择性抑制癌细胞包含减缓或停滞细胞分裂。可替代地或此外,在第二治疗区中选择性抑制癌细胞包含减缓或停滞移动。可替代地或
此外,在第二治疗区中选择性抑制癌细胞包含减少血液和养分的传输。
19.在本发明的实施例中,癌细胞和健康细胞通过坏死而在第一治疗区内被杀死。可替代地或此外,癌细胞通过细胞凋亡而在第二治疗区内被杀死。
20.在本发明的实施例中,由于癌细胞和健康细胞的跨膜电位增加到致死阈值,所以其在第一治疗区内被杀死。可替代地或此外,由于癌细胞的核跨膜电位增加到致死阈值,所以其在第二治疗区内被杀死。
21.本发明的优选实施例可以靶向细胞核的跨膜电位,以使得跨膜电位由于本发明的优化脉冲而达到致死阈值。然而,其它实施例可以靶向任何膜结合胞内细胞器,不管通过对跨膜电位还是任何其它机制的影响,所述膜结合胞内细胞器包括(但不限于)线粒体、光面内质网、粗面内质网、高尔基体、内体、溶酶体、过氧化物酶体、存储囊泡以及传输囊泡。
22.在本发明的实施例中,连续脉冲之间的延迟大于每个脉冲的长度。可替代地,连续脉冲之间的延迟为每个脉冲的长度的几分之一。
23.在本发明的实施例中,每个脉冲的长度等于细胞膜的充电时间加上核膜的放电时间,而连续脉冲之间的延迟等于细胞膜的充电时间。同样地,实施例可包含此类时序的整倍数或甚至此类时序的几分之一。细胞膜的充电时间和核膜的放电时间可通过数字建模测定。在本发明的实施例中,脉冲串包含为矩形脉冲、线性变化、衰减指数或正弦波的电场波形。电场波形可为单极或双极的。电场波形可为包含第一频率谐波(如低频谐波)和第二频率谐波(如高频谐波)的叠加双峰信号。电场波形可包含与连续地微秒量级脉冲交替的纳秒量级脉冲。电场波形可为不对称的。电场波形可具有在100khz到10 mhz范围内的载波频率。波形的载波频率或脉冲持续时间可基于癌细胞、非所期望的细胞或另外称为靶细胞的交越频率。
24.在实施例中,每个脉冲的长度和连续脉冲之间的延迟基于癌细胞的物理细胞核与细胞质大小比率而被优化。
25.在本发明的实施例中,脉冲为双极方波并且每个脉冲的长度在250纳秒与50微秒之间。
26.本发明的实施例包括一种治疗患者体内的癌症的方法,包含识别患者体内的实体肿瘤,将至少一个电极插入到实体肿瘤中或与实体肿瘤相邻并且施加包含多个电脉冲的脉冲串,其中脉冲为双极方波并且每个脉冲的长度在250纳秒与50微秒之间。
27.本发明的实施例包括治疗患者体内的癌症的方法,包含识别患者体内的实体肿瘤,将至少一个电极插入到实体肿瘤中或与实体肿瘤相邻以及施加包含多个电脉冲的脉冲串,其中脉冲串具有为包含第一频率谐波和第二频率谐波(如低频谐波和高频谐波)的叠加双峰信号的电场波形。
28.本发明的实施例包括一种用于治疗受试者体内癌症的系统,包含至少一个电极和电压脉冲发生器,所述电压脉冲发生器可操作地耦合到电极并且经配置以施加包含多个电脉冲的脉冲串,其中脉冲串具有为包含低频谐波和高频谐波的叠加双峰信号的电场波形。电压脉冲发生器可包含以多电平中性点箝位型或级联的h桥拓扑结构布置的固态开关器件。
29.还包括一种选择性治疗细胞的方法,包含:将作为治疗的多个电脉冲施加到含有细胞的物质,其中脉冲为双极方波并且每个脉冲的长度在250纳秒与50微秒之间,其中脉冲
之间的延迟在250纳秒与50微秒之间;其中通过多个电脉冲,一种类型细胞被治疗而另一类型细胞未被治疗。在实施例中,经治疗的细胞被杀死而未经治疗的细胞未被杀死。含有细胞的物质例如可为组织、无生命对象、溶液、身体部位或有生命或无生命患者、人、动物或组织。
30.在实施例中,提供了一种选择性治疗细胞的方法,包含:将包含多个电脉冲的脉冲串施加到含有细胞的物质,其中脉冲串具有为包含第一频率谐波和第二频率谐波的叠加双峰信号的电场波形,所述第二频率谐波具有高于第一频率谐波的频率的频率。在实施例中,脉冲串选择性杀死所选择类型的细胞并且避开另一类型的细胞。
31.本发明的系统包括经配置以实施本发明的一种或多种方法的任何系统。本文包括一种用于选择性治疗细胞的系统,包含:至少一个电极和电压脉冲发生器,所述电压脉冲发生器耦合到电极并且经配置以施加包含多个电脉冲的脉冲串,其中脉冲串具有为包含第一频率谐波和第二频率谐波的叠加双峰信号的电场波形,其中第二频率谐波具有高于第一频率谐波的频率的频率。
32.在实施例中,电压脉冲发生器经配置以选择双峰信号以使得脉冲串选择性杀死所选择类型的细胞并且避开另一类型的细胞,或者电压脉冲发生器包含以多电平中性点箝位型或级联h桥拓扑结构布置的固态开关器件。
33.另外的方法包括一种选择性治疗细胞的方法,该方法包含:将电脉冲以足以仅杀死具有所选择的生物物理亚细胞结构的细胞的方式传送到含有细胞的物质。在实施例中,具有所选择生物物理亚细胞结构的细胞具有细胞核并且细胞通过破坏细胞的细胞核而被杀死。具有所选择生物物理亚细胞结构的细胞可具有所选择的细胞核与细胞质面积比。
34.一种选择性治疗细胞的方法也包括在本发明的范围内,所述方法包含:将多个电脉冲施加到含有细胞的物质,其中多个电脉冲具有经选择以治疗一种类型细胞的靶细胞并避开另一类型细胞的非靶细胞的频率、幅值和脉冲波形。本发明的此类方法可为选择性方法,其中癌细胞被治疗并且正常细胞被避开。此类方法可为缓解性方法,其中更恶性类型的癌细胞被治疗并且较低侵袭性类型的癌细胞被避开。
35.本发明的方法可进一步包含确定靶细胞的细胞核与细胞质比率;以及基于靶细胞的细胞核与细胞质比率来选择频率、幅值和脉冲波形。在实施例中,从取自含有细胞的物质的活组织检查的细胞测量或以其它方式测定细胞核与细胞质比率。
36.一种选择性消融恶性细胞的方法包括于本发明中,该方法包含:确定存在于组织区域中的恶性细胞的第一死亡阈值;确定存在于组织区域中的非恶性细胞的第二死亡阈值;在处于或高于第一死亡阈值并且低于第二死亡阈值处将电脉冲施用到组织区域以杀死恶性细胞。在本发明的方法的实施例中,非恶性细胞不被杀死。在实施例中,恶性细胞各自包含细胞核并且通过以足以破坏细胞核的方式施用电脉冲而被杀死。
37.一种增强材料传输到细胞器中的方法包括于实施例中,所述方法包含:将多个电脉冲施加到含有细胞的物质,其中多个电脉冲具有经选择以优化分子传输到细胞器中的频率、幅值和脉冲波形。
38.根据实施例,多个电脉冲包括具有不同脉冲宽度的正脉冲和负脉冲,或者多个电脉冲包括具有不同幅值的正脉冲和负脉冲。在实施例中,细胞器为细胞核、线粒体、内质网、液泡、溶酶体或叶绿体。
附图说明
39.附图示出了本发明的实施例的某些方面并且不应用于限制本发明。与书面说明书一起,附图用于阐明本发明的某些原理。
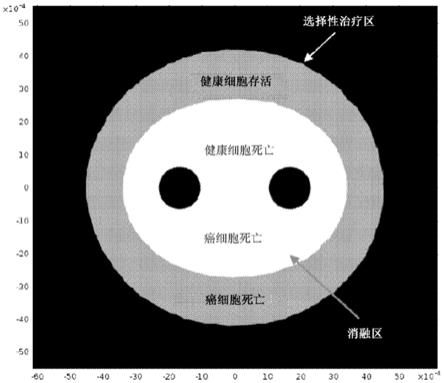
40.图1为示出根据本发明的消融区和选择性治疗区的示意图,其中x
‑
轴和y
‑
轴示出以米为单位的距离。
41.图2为示出优化的脉冲长度和脉冲延迟对核跨膜电位的影响的图形。
42.图3为示出在健康细胞和癌细胞中次优脉冲对核跨膜电位的影响的图形。
43.图4为示出借助不对称脉冲的增强的基因电泳转移的示意图和重叠图形。
44.图5a为用作图5b至图5g的图例的具有两个不同大小核的细胞的示意图。
45.图5b为示出低频双极正弦形信号的图形。
46.图5c为示出高频双极正弦形信号的图形。
47.图5d为示出包含图5b的低频谐波和图5c的高频谐波的双峰正弦形信号的图形。
48.图5e为示出作为图5b的低频双极正弦形信号结果的具有两个不同大小核的细胞的核跨膜电位的图形。
49.图5f为示出作为图5c的高频双极正弦形信号结果的具有两个不同大小核的细胞的核跨膜电位的图形。
50.图5g为示出作为图5d的双峰正弦形信号结果的具有两个不同大小核的细胞的核跨膜电位的图形。
51.图6为本发明的代表性系统的示意图。
52.图7为用于实施本发明治疗的代表性控制计算机的示意图。
53.图8为示出在图6的系统中所示出的发生器的细节的图示,所述发生器包括用于检测过电流条件和/或低电流的元件。
54.图9为示出在1000v/cm脉冲电场的影响下,悬浮于1.0s/m溶液的细胞的跨膜电位 (tmp)的数字模拟结果的图形。
55.图10为示出在关于跨膜电位(tmp)的参数研究中使用的参数值的表。
56.图11为示出在400v/cm电场下mda
‑
mb
‑
231细胞的稳定状态最大跨膜电位(tmp) 与频率的图形。红色垂直线表示在0.01s/m的导电介质中mda
‑
mb
‑
231细胞的第一交越频率。
57.图12a和图12b为示出在100khz(图12a)和1mhz(图12b)下响应于1000v/cm 电场的跨膜电位(tmp)的图形。
58.图13为示出细胞脂质双层对1000v/cm电场的瞬态响应的图形。
59.图14为细胞对1000v/cm电场的瞬态响应的图形。
60.图15为示出具有0.5:1的细胞核与细胞质比率的细胞的跨膜电位(tmp)和核跨膜电位(ntmp)的图形。
61.图16为示出当脉冲之间的断开时间保持在500纳秒时脉冲时间对核跨膜电位 (ntmp)的影响的图形。
62.图17为示出脉冲延迟对核跨膜电位(ntmp)的影响的图形。
63.图18a和图18b为示出脉冲几何形状可经优化以将核跨膜电位(ntmp)增加到高于单脉冲最大值的图形,其中图18a示出作为500纳秒接通
‑
500纳秒断开脉冲方案的结果的ntmp并且图18b示出作为4微秒接通
‑
500纳秒断开脉冲方案的结果的ntmp。
64.图19为示出细胞核大小对核跨膜电位的影响的图形。
65.图20为示出对于正弦形信号可实现的稳定状态最大膜电位的图形。
66.图21a为用作图21b和图21c的图例的具有两个不同大小核的细胞的示意图。
67.图21b为示出作为施加具有4000v/cm电场强度的双峰正弦形信号结果的两个不同大小核的细胞的核跨膜电位的图形。
68.图21c为示出作为施加具有5000v/cm电场强度的双峰正弦形信号结果的两个不同大小核的细胞的核跨膜电位的图形。
69.图22为示出核电穿孔的选择性区的图形。所示电场等高线为4000v/cm(实线)和 5000v/cm(虚线)。
70.图23a为示出单亚微秒脉冲波形的图形。
71.图23b为示出重复200次图23a的单亚微秒脉冲波形以产生不可逆电穿孔脉冲串的图形。
72.图23c为对于在治疗后1小时和16小时,1000v/cm、2000v/cm以及4000v/cm 脉冲的图23b的脉冲串对细胞存活率的影响的图形。
73.图24为示出经1500v/cm脉冲处理的细胞的存活率随脉冲长度而变化的图形。
74.图25为示出经3000v/cm脉冲处理的细胞的存活率随脉冲长度而变化的图形。
75.图26为示出经4000v/cm脉冲处理的细胞的存活率随脉冲长度而变化的图形。
76.图27a和图27b为示出由于选择性靶向的消融增强的图式,其中x
‑
轴和y
‑
轴示出以米为单位的距离以及其中消融区以白色示出并且选择性靶向增强区以橙色示出(灰色,在黑白图中)。图27a示出作为使用体外值的1000v脉冲结果的这些区。图27b示出作为使用等效体内阈值的1000v脉冲结果的这些区。
77.图28为示出在数值分析中使用的参数的表。
78.图29a为在实例2中使用的实验装置的示意图。将100μl细胞悬浮液添加到2mm 电穿孔比色杯中。插图表示用于模拟细胞膜和核被膜的网状物。
79.图29b为表示用于实例2中所有实验的方法的含有正极性和负极性脉冲循环的实验脉冲串的示意图。
80.图30a至图30c为示出使用实例2中实验的不同长度脉冲的例示性波形的图形,所述图形绘制施加电压(u/kv)随时间(t/μs)而变化的图形。每个脉冲串具有100μs的总接通时间,其中在每个极性中通电50μs。代表性片段来自具有250ns(图30a)和 1μs(图30b)以及5μs(图30c)组成型脉冲的脉冲串。
81.图31a至图31c为示出有限元模拟的结果的图形。施加电场(e/(kv/cm))、跨细胞膜的电压降(um/v)以及跨核被膜的电压降(un/v)表示为随时间(t/μs)而变化。图31a示出具有50ns上升时间和下降时间双极性方波用于模拟(图31b)细胞膜的最大跨膜电位(um)和(图31c)核被膜的最大跨膜电位(un)。
82.图32a至图32c为示出关于细胞膜电位的参数分析的结果的图形。跨细胞膜的电压降(um/v)和跨核被膜的电压降(un/v)表示为随时间(t/μs)而变化。示出了改变 (图32a)脉冲宽度、(图32b)介质电电导率、(图32c)脉冲与脉冲延迟时间的影响。虚线表示细胞膜的跨膜电位(um)并且实线表示核被膜的跨膜电位(un)。应注意对于 um和un的轴线具有不同的刻度。
83.图33a至图33e为示出细胞特性参数分析的图形。跨细胞膜的电压降(um/v)和跨核被膜的电压降(un/v)表示为随时间(t/μs)而变化。示出了改变(图33a)细胞核
‑
细胞质比率、(图33b)细胞质电电导率以及(图33c)细胞膜介电常数的影响。在图33d和图33e中示出了良性细胞和癌细胞的跨细胞膜的电压降(um/v)和跨核被膜的电压降(un/v)。应注意对于um和un的轴线具有不同的刻度。
84.图34a至图34d为示出由于250ns和1μs实验脉冲的膜电位的模拟的图形。施加电场(e/(kv/cm))、跨细胞膜的电压降(u
m
/v)以及跨核被膜的电压降(u
n
/v)表示为随时间(t/μs)而变化。图34a示出1.5kv/cm 250ns脉冲并且图34b示出细胞膜的所得跨膜电位(u
m
)和核被膜的所得跨膜电位(u
n
)。图34c示出1.5kv/cm 1μs脉冲并且图34d示出细胞膜的所得跨膜电位(u
m
)和核被膜的所得跨膜电位(u
n
)。虚线表示细胞膜的跨膜电位(u
m
)并且实线表示核被膜的跨膜电位(u
n
)。
85.图35为示出在暴露于4000v/cm期间介质温度改变的图形。温度改变(δt/k)表示为随时间(t/s)而变化。具有50us和250ns组成型脉冲的脉冲串产生类似的温度上升。δt=t
‑
t
ref
,其中t
ref
=20℃。
86.图36a至图36c为示出由于立即和延迟机制出现细胞死亡的图形。相对存活率(r
存活率
) 表示为脉冲宽度(δt
p
/μs)的函数。在暴露于(图36a)1500v/cm、(图36b)3000v/cm、 (图36c)4000v/cm脉冲串1小时和24小时之后,细胞的相对存活率r
存活率
=n
存活
/n
总
归一化为对照,其中n为细胞数。在所有实验中,细胞被暴露于80个脉冲串,每个脉冲串具有 100μs的通电时间。误差棒表示经过三次(n=3)随机实验的最小值的标准差。星号(*) 指示1小时与24小时时间点之间的统计显著性(α≤0.1)。
87.图37a至图37l为示出脉冲串具有对时间累积左右的图形,膜电位高于临界阈值:其中细胞膜或核被膜大于临界阈值的时间(t/μs)表示为脉冲宽度(δt
p
/μs)的函数。图 37a、图37b、图37e、图37f、图37i和图37j表示其中细胞膜具有大于1v的电位降(um)的时间。图37c、图37d、图37g、图37h、图37k以及图37l表示其中核被膜具有大于0.5v、0.75v或0.9v的电位降(u
n
)的时间。
88.图38a至图38b为示出传统单极ire脉冲(图38a)和高频双极脉冲串(图38b) 的示意图。
89.图38c为示出具有电极插入到中3d组织模拟物的实验装置的相片。
90.图38d至图38g为在用含有(图38d)2个、(图38e)24个以及(图38f)50个双极2μs脉冲其中交替脉冲之间有2μs延迟的80个脉冲串治疗之后,组织模拟物的活的[绿色]和死的[红色]区域的图像。图38g示出具有交替脉冲之间的20ms的50个双极 2μs脉冲的扩散治疗。比例尺表示2mm。
[0091]
图39为示出组织模拟物实验参数的表。
[0092]
图40a为示出在对于2200v2s剂量的组织模拟物中ppt细胞的致死电场阈值的图形。图40b为示出在用1500v/cm处理后的介质悬浮液中ppt细胞的相对存活率的图形。图40b中的数据来自2014年sano等人以及图40a和图40b中标记为的数据来自2012 年arena等人。图40c为示出如实验上测量和数值预测的在组织模拟物中心处温度分布的图形。
[0093]
图41a至图41d为示出用于以下处理的致死电场阈值的图形。图41a:每个脉冲串有540v和100us通电时间,其中每次处理有8或80个脉冲串。2μs和50μs组含有双极脉冲,100μs
组具有单极脉冲。图41b:在250v、540v以及650v下的2μs组每个脉冲串具有等效的能量。图41c:在540v下的2μs组每个脉冲串通电4μs、48μs或 100μs。图41d:在540v下的2μs组,其中脉冲串间延迟为1s[脉冲串]或20ms[扩散]。图41b至图41d:接收80秒的80个脉冲串治疗的治疗组[扩散组]。标记为的数据来自2012年arena等人.
[0094]
图42a至图42d为示出肿瘤体积随对于(图42a)假治疗组、(图42b)1μs组、 (图42c)2μs组以及(图42d)5μs组治疗后的天数而变化的图形。图42e为示出通过每个治疗组的所有小鼠平均的肿瘤体积的图形。
[0095]
图43a为示出脉冲通过插入到肿瘤中的针而传送的相片。
[0096]
图43b为示出立即肿瘤白化的相片并且图43c为示出在大部分治疗后观察到的24 小时后痂形成的相片
[0097]
图43d和图43f为示出来自假治疗组的代表性终点图像的相片。图43e和图43g 为示出来自5μs组的代表性终点图像的相片。相片示出在治疗后30天皮下肿瘤的存在和不存在。在皮肤表面上写入的数量用于在组织学制备期间的组织取向。
[0098]
图43h为示出假鼠表面皮肤(图像的顶部)和底层肿瘤(图像的底部)的微观图像。比例尺表示250μm。
[0099]
图43i为示出治疗的鼠表面皮肤(图像的顶部)和底层肌肉组织(图像的底部)的微观图像。比例尺表示250μm。
[0100]
图44为示出对于鼠肿瘤消融的治疗基质的表。
[0101]
图45a至图45c示出使用两个脉冲波形的有限元建模的图形,所述有限元建模预测ire与细胞大小有关而beam与细胞大小无关。图45a:模拟的单极100μs ire波形和双极1μs beam波形。图45b:对于暴露于施加500v/cm的ire波形的两个不同细胞大小的计算的细胞tmp响应示出tmp大小相关性。图45c:beam脉冲波形响应示出在500v/cm下无tmp细胞大小相关性。
[0102]
图46a至图46f为示出用于预测在水凝胶平台内的电场和热分布的有限元模型的图式。图46a:通过将细胞接种的胶原蛋白(0.2%或2%w/w)添加到控制几何形状的pdms 孔中来制备工程化的3d胶原蛋白水凝胶。胶原蛋白在养分由培养基供应的细胞培养物条件下被保持在孔板中。图46b:用于计算在组织模拟物内电场分布的网状物示出用于治疗测试的实验装置。图46d至图46e:模拟在450v(图46c)和700v(图46d) 脉冲时电场(v/cm)等高线。图46e:治疗后(50个700v的脉冲)即刻的温度等高线示出高于室温的12℃的最大温度上升。图46f:治疗后一分钟的温度等高线确认细胞未暴露于由于ire或beam脉冲的任何长期热效应。
[0103]
图47a至图47c为示出ecm调谐的水凝胶的图像和图形,所述图像和图形揭示与细胞大小相关的ire病变和与细胞大小无关的beam病变。图47a:由于水凝胶基质的密度从0.2%改变到2.0%胶原蛋白引起的变化的细胞形态和总体细胞大小(n=25,比例尺20μm)。图47b:对以0.2%胶原蛋白的用于较大细胞的ire治疗的比较揭示比以 2%胶原蛋白的用于较小细胞更大的病变以及因此更低的死亡阈值(n=20,p<0.001)(比例尺1mm)。图47c:对以0.2%和2%胶原蛋白的beam治疗的比较揭示均一的病变以及因此相等的死亡阈值(尽管细胞大小有差异)(n=20,p≥0.1)(比例尺1mm)(p≤0.0005 (***)和p≤0.0001(****))。
[0104]
图48a至图48c为示出恒定细胞形态的图像和图形,其中改变刚度导致ire和 beam
具有相等的致死阈值。图48a:由于缺乏细胞
‑
ecm结合位点,改变海藻酸盐的密度并不改变细胞形态,使得孤立刚度对治疗的影响(n=25)。图48b:遍及相等细胞形态的刚度差异,ire病变和致死阈值是相等的(n=20,p≥0.1)(比例尺1mm)。图48c:遍及海藻酸盐刚度差异,beam病变和致死阈值是相等的(n=20,p≥0.1)(比例尺1mm)。
[0105]
图49a至图49f为示出用ire消融的正常和瘤性犬类动物大脑组织的组织形态的显微图像。a)内囊的正常、未经治疗的大脑皮层灰质(图49a)和白质(图49c)。ire 消融导致神经元(图49b)和神经胶质死亡(图49b和图49d)以及空泡形成和轴突丧失(图49d)。在ire消融之前(图49e)和之后(图49f)的多形性胶质母细胞瘤的活组织检查。ire治疗导致肿瘤和基质细胞结构的破坏以及肿瘤细胞死亡。所有切片用苏木精和伊红染色。
[0106]
图50a为示出由ire脉冲产生的电场的数字建模预测电场达到细胞内部的细胞质仅历时脉冲时间的较短持续时间同时大部分电场保留在聚集在细胞膜周围的介质中的图形。
[0107]
图50b为示出电场分布的数字建模预测由beam脉冲产生的电场穿过质膜进入细胞质中历时脉冲接通时间的整个持续时间的图形。
[0108]
图50c分别为u
‑
87、nha、c6以及d1tnc1细胞的一系列荧光图像,所述荧光图像分别允许测定用于建模并且使实验病变结果相关联的形状因子。
[0109]
图50d为示出u
‑
87、nha、c6以及d1tnc1细胞在整个细胞区域中显示出没有显著差异(p≥0.1)的图形(n=20)。
[0110]
图50e为示出恶性神经胶质瘤细胞(u
‑
87和c6)的核区域大于非恶性星形胶质细胞(nha和d1tnc1)的核区域的图形(n=20,p≤0.05(*)和p≤0.005(**))。
[0111]
图51a为一系列示出ire病变大小在不同细胞类型间没有显著差异的图像(n=10, p≥0.1)。
[0112]
图51b为一系列示出对于恶性神经胶质瘤细胞(u
‑
87和c6)的beam病变大小大于对非恶性星形胶质细胞(nha和d1tnc1)的beam病变大小的图像(n=10)。
[0113]
图51c为示出将病变大小与死亡阈值有关的comsol建模显示出在不同细胞类型的ire阈值之间没有显著差异的图形(n=10,p≥0.1),从而确认ire阈值主要取决于细胞大小的假定。
[0114]
图51d为示出借助beam治疗,恶性细胞的死亡阈值小于正常细胞的死亡阈值的图形,这提供了一系列电场值将杀死恶性细胞而不会杀死健康细胞(n=10,p≤0.0001 (****))。
[0115]
图52a为示出暴露于ire治疗的细胞示出在5
‑
分钟时间过程内来自在3d水凝胶中培养的细胞的染色微管蛋白的扩散的一系列图像,这表明外部细胞膜的破坏是由于的脉冲引起的。
[0116]
图52b为示出暴露于beam治疗的细胞示出细胞核急剧破裂的一系列图像,并且虽然微管蛋白染色变暗,但是如在ire情况中其并未明显地扩散到最初细胞膜区域的外部。这表明在ire和beam之间对细胞核和细胞两者的不同的影响。
[0117]
图52c为示出未暴露于任何脉冲的细胞用作一种控制以确保在5分钟时间过程内没有来自成像的光致漂白影响的一系列图像。
[0118]
图53a至图53b为示出对用于建模神经胶质瘤和星形胶质细胞的beam实验致死阈
值的预测tmp和ntmp响应表明ntmp影响的图形。fig53a:具有暴露于用于给定细胞类型的模拟beam实验致死电场阈值的神经胶质瘤细胞和星形胶质细胞的实验几何结构的建模细胞示出响应tmp增加的差异。图53b:具有暴露于用于给定细胞类型的模拟beam实验致死电场阈值的神经胶质瘤细胞和星形胶质细胞的实验几何结构的建模细胞示出类似的响应ntmp增加,这表明ntmp的数值增加将导致细胞死亡。
[0119]
图54a至图54d为示出用于beam治疗的施加电场和tmp(图54a至图54b) 和用于ire治疗的施加电场和tmp(图54c至图54d)的图形。在tmp曲线中,虚线表示直径为15μm的细胞并且实线表示直径为10μm的细胞。跨外膜的最大tmp在 beam期间比在ire期间更少依赖于细胞大小。
具体实施方式
[0120]
现在将详细参考本发明的各种示例性实施例。在说明书中描述和在附图中示出的实施例仅是说明性的并且不旨在限制本发明的范围。本领域的普通技术人员将认识到,可以对本说明书和附图中描述的具体实施例做出改变,并且这些改变在本发明的范围和精神内。
[0121]
在整个本教导内容中,如本领域中普通技术人员所理解,本文中明确或暗含地公开或提出的任何和所有特征和/或组分无论何时何地都可以任何组合方式实践和/或实施。本文公开的各种特征和/或组分都是用于说明下面的概念,并因此对其实际描述是没有限制的。用于实现大体上相同功能的任何方法被认为是可预见的替代方案和等效物,并因此完全描述在书写中并且完全实现。本文所述的各种实例、说明和实施例决不以任何方式、任何程度或范围限制本文中呈现所要求保护的本发明的最宽范围或在要求本申请的优先权的任何将来申请中。
[0122]
本发明人已经出人意料发现,可以操控高频脉冲电场并经优化以靶向胞内膜。更具体地说,施用高频脉冲电场的具体方案可以用于增加在细胞器(如细胞核)中细胞的胞内膜电位。通过靶向胞内膜电位,癌细胞相对于健康组织可以被选择性靶向。在一个实施例中,将高频脉冲电场施用到肿瘤,以产生两个治疗区:消融区和选择性治疗区。在消融区中,健康细胞和癌细胞由于坏死细胞死亡而死亡。在消融区外,由于胞内细胞器的膜电位变化,仅癌细胞因程序性细胞死亡而死亡,同时避开健康细胞。因此,细胞膜不是治疗的主要靶标;共振添加剂影响靶向胞内成分,如细胞核、线粒体以及其它关键膜结合细胞器。在实施例中,通过优化脉冲长度和延迟时间两者来实现这些影响。在一个示例性实施例中,脉冲长度被优化为约等于细胞膜的充电时间加上核被膜的放电时间,同时延迟时间被优化为约等于细胞膜的充电时间。在实施例中,延迟时间为脉冲长度的几分之一。
[0123]
本发明的实施例包括经设计以产生一系列在肿瘤边缘以外导致异常细胞的细胞死亡同时保留健康细胞的场强度的脉冲。在肿瘤边缘内,场强度足以杀死所有细胞类型。另外,本发明的实施例包括经设计以产生一系列在肿瘤边缘以外导致异常细胞的核渗透性增强同时不影响健康细胞的场强度的脉冲。在肿瘤边缘内,场强度足以增强所有细胞类型的核渗透性。另外,本发明的实施例包括经设计以产生一系列在肿瘤边缘以外减缓或抑制异常细胞的分裂同时不影响健康细胞的场强度的脉冲。在肿瘤边缘内,场强度足以减缓所有细胞类型的生长速率。另外,本发明的实施例包括经设计以产生一系列在肿瘤边缘以外停
止异常细胞的移动以阻止癌转移同时不影响健康细胞的场强度的脉冲。在肿瘤边缘内,场强度足以停止所有细胞类型的移动。另外,本发明的实施例包括经设计以产生一系列在肿瘤边缘以外阻止血液和养分传输到异常细胞的场强度的脉冲。在肿瘤边缘内,血液和养分被阻止传输到所有细胞类型。
[0124]
在实施例中,在肿瘤边缘内所产生的场强度对异常细胞有选择性同时保留健康细胞。电场波形可以是矩形脉冲、线性变化、衰减指数或正弦波并且可以是单极或双极的。在实施例中,电场波形可以是由低频分量/谐波和高频分量/谐波组成的叠加双峰信号。在实施例中,电场波形可由连续交替的短持续时间纳秒量级脉冲与长持续时间微秒量级脉冲组成。
[0125]
在实施例中,波形为不对称的以电泳驱动外源试剂、化学试剂、dna分子或通过渗透膜的纳米粒子。波形的载波频率可以在100khz到10mhz范围内。在实施例中,基于细胞群的交越频率选择波形的载波频率或脉冲持续时间。在其它实施例中,脉冲基于在治疗的靶向区内的细胞群的介电特性而被优化以能够实现选择性。在其它实施例中,脉冲基于在治疗的靶向区内的细胞群的物理细胞核与细胞质大小比率而被优化以能够实现选择性。在其它实施例中,脉冲经设计以在选择的细胞群内产生电融合。
[0126]
在其它实施例中,脉冲经设计以产生对核膜和外膜跨膜电位的同时调节。所期望的调节效果可触发核和外膜两者的可逆电穿孔。可替代地,所期望的调节效果可触发外膜的可逆电穿孔和核膜的的不可逆电穿孔。可替代地,所期望的调节效果可触发坏死和细胞凋亡。可替代地,所期望的调节效果减缓或抑制细胞分裂。可替代地,所期望的调节效果将阻止浸润性细胞的癌转移。
[0127]
可以使用外部器件在持续低于1hr的单个会话中施加治疗。可以使用外部或可植入器件施加治疗超过多日。在脉冲之间的停留时间可以作为优化程序的一部分而变化以选择异常细胞。脉冲可以重复方式传送以降低所需要的有效场强度并且使得能够使用固态开关器件。
[0128]
在实施例中,所需要的有效场强度为约100v/cm到10,000v/cm。固态开关器件可以布置成多电平中性点箝位型或级联的h桥拓扑结构。
[0129]
本发明的实施例包括经设计以产生一系列在异常细胞生长区域以外导致细胞死亡、减缓细胞的生长速率、停止细胞的移动或阻止血液和养分传输到异常细胞同时保留健康细胞的场强度的电脉冲,并且在异常细胞生长区域内,场强度足以杀死所有细胞类型、减缓所有细胞类型的生长速率、停止所有细胞类型的移动或阻止血液和养分传输到所有细胞类型。在肿瘤边缘内,场强度足以增强所有细胞类型的核渗透性。
[0130]
本发明的实施例包括一种治疗患有异常细胞生长的受试者的系统,其包含:至少一个电极,其经配置引入到受试者体内的异常细胞生长区域中或与异常细胞生长相邻;电压脉冲发生器,其耦合到电极并且经配置以施加多个电脉冲以在生长区域内产生具有选择性杀死异常细胞、减缓异常细胞的生长速率、停止异常细胞的移动或阻止血液和养分传输到异常细胞同时保留健康细胞的场强度的电场。
[0131]
本发明的实施例包括一种治疗患有异常细胞生长的受试者的方法,其包含:将电极植入到受试者体内的异常生长区域中或与异常生长区域相邻,以及使得多个电脉冲由电极发射到异常细胞生长区域中以产生电场,其中在异常细胞生长区域内产生的电场强度选
择性杀死异常细胞、减缓异常细胞的生长速率、停止异常细胞的移动或阻止血液和养分传输到异常细胞同时保留健康细胞。在该方法的实施例中,电场具有矩形脉冲、线性变化、衰减指数或正弦波的单极或双极波形。多个电脉冲可呈由低频分量和高频分量组成的叠加双峰信号的形式。可替代地,多个电脉冲可由连续交替的短持续时间纳秒量级脉冲与长持续时间微秒量级脉冲组成。在该方法的实施例中,多个电脉冲的频率可以在 100khz到10mhz范围内。在该方法的实施例中,脉冲为不对称的以电泳驱动外源试剂、化学试剂、dna分子或通过渗透膜的纳米粒子。
[0132]
在该方法的实施例中,所需要的有效场强度为约100v/cm到10,000v/cm。可以基于细胞群的交越频率选择脉冲的载波频率或脉冲持续时间。可替代地或另外,脉冲可以基于治疗的靶向区内的细胞群的介电特性或物理细胞核与细胞质大小比率被优化以能够实现选择性。在该方法的实施例中,脉冲经设计以在选择的细胞群内产生电融合。在该方法的实施例中,脉冲经设计以产生对核膜和外膜跨膜电位的同时调制。在实施例中,所期望的调节效果可触发外膜的可逆电穿孔和核膜的不可逆或可逆电穿孔。可替代地或此外,所期望的调节效果可触发坏死和细胞凋亡两者。
[0133]
在该方法的实施例中,可使用外部器件或可植入器件通过至少一个会话施加治疗。在脉冲之间的停留时间可以作为优化程序的一部分而变化以选择异常细胞。在实施例中,脉冲以重复方式传送以降低所需要的有效场强度并且使得能够使用固态开关器件。固态开关器件可以布置成多电平中性点箝位型或级联的h桥拓扑结构。
[0134]
在实施例中,本发明的脉冲、系统以及方法可在生物医学癌症或肿瘤治疗中具有应用。
[0135]
以下附图进一步说明本发明。图1示出本发明的示例性双治疗区。围绕两个黑色圆的白色内部部分表示围绕一对电极的消融区。在消融区中,健康细胞和癌细胞两者经历坏死。在消融区边界之外的橙色区(灰色区,在黑白图中)表示其中癌细胞死亡并且健康细胞被避开的选择性治疗区。双治疗区由本发明的优化脉冲参数产生,其靶向如核被膜的胞内膜的膜电位。
[0136]
图2示出优化脉冲参数对核跨膜电位的影响。如图可以看出,双极脉冲之间的短延迟时间(其为脉冲长度的几分之一)导致核跨膜电位增加(优化的脉冲最大值),超过单脉冲的核跨膜电位(单脉冲最大值)。
[0137]
图3示出对次优脉冲作出不同响应的癌细胞和健康细胞的核跨膜电位(ntmp)。如图中所示,癌细胞的核跨膜电位达到致死阈值,而健康细胞的核跨膜电位仅为癌细胞的核跨膜电位的几分之一。在不希望受理论束缚的情况下,这些差异可部分归因于癌细胞中细胞核的较大尺寸。在实施例中,对于介质域、细胞质域和核质域的变量分别被定义为v
介质
、v
细胞质
、v
核质
。然后,限定变量以将细胞膜(tmp)计算为(v
介质
‑
v
细胞质
)并且核膜(ntmp)计算为(v
细胞质
‑
v
核质
)。
[0138]
在实施例中,优化的脉冲方法可以用于增加细胞质和胞内细胞器之间的分子传输。例如,本发明的优化脉冲方法可增强电
‑
基因治疗和电
‑
化学治疗。另外,不对称脉冲可增强电泳转移。图4中示意性地示出此情形。
[0139]
在实施例中,双峰正弦形信号可以用于实现放大效果。实际上,可以使用具有两个或更多个不同频率分量的任何信号,如具有二、三、四、五或六个频率分量的信号。例如,图
5d示出包含两个不同频率分量(第一频率分量(图5b)和较高的第二频率分量 (图5c))的双峰正弦形信号;其对核跨膜电位的相应影响示出在图5e至图5g中。图 5a为图5e至图5g的图例,其示出如何绘制具有不同核大小的两个不同细胞的跨膜电位,其中虚线表示8微米直径细胞并且实线表示6微米直径细胞。
[0140]
另外,本发明的实施例可包括一个或多个能够执行方法的一个或多个步骤的系统。本发明的一个实施例示出在图6和图7中。可以与本发明一起使用的代表性组分可包括图6中示出的那些中的一种或多种。例如,在实施例中,一个或多个探头22可以用于传送治疗能量并且通过电压脉冲发生器10供电,所述电压脉冲发生器产生高压脉冲作为治疗能量,如能够不可逆地电穿孔靶组织的组织细胞的脉冲。在示出的实施例中,电压脉冲发生器10包括用于接收高达六个单独的适于插入到相应插孔中的探头22的六个单独的插孔。插孔各自标记有连续顺序的数字。在其它实施例中,电压脉冲发生器可具有用于接收大于或小于六个探头的任何数目的插孔。
[0141]
例如,根据本发明的治疗方法可包括多个电极中的一个或多个。根据所期望的治疗模式,多个电极可以设置在相对于彼此的各种位置中。在具体实例中,多个电极可以设置在相对环形的模式中,其中单个电极设置在环的内部中,如在大约中心处。电极的任何配置都是可能的,并且布置不必是环形的但是可以根据待治疗的区域使用任何形状周边,包括任何规则或不规则的多边形,包括凸面或凹面的多边形。单个位于中央的电极可以是接地电极,而在多个电极中的其它电极可以通电。在多个电极中可以任何数目的电极可以是多个,如约1到20个。实际上,甚至3个电极可形成多个电极,其中一个接地电极设置在两个能够通电的电极之间,或者4个电极可以以提供两个电极对的方式设置(每个电极对包含一个接地电极和一个能够通电的电极)。在治疗期间,治疗的方法可涉及以任何顺序对电极通电,如同时对一个或多个电极通电,并且/或以具体顺序(如依次地、以交替模式、以跳跃模式)对一个或多个电极通电,和/或例如同时对多个电极但小于所有电极通电。
[0142]
在示出的实施例中,每个探头22包括单极电极或具有通过绝缘套管分隔开的两个电极的双极电极。在一个实施例中,如果探头包括单极电极,那么可以通过相对于电极缩回或推进绝缘套管来调节电极的有效部分暴露量。参见,例如美国专利第7,344,533 号,该专利以全文引用的方式并入本文中。脉冲发生器10连接到治疗控制计算机40,所述治疗控制计算机具有如键盘12和指向装置14的输入装置和如显示装置11的输出装置,所述显示装置用于查看靶向治疗区域(如由安全边缘301包围的病变300)的图像。治疗能量传送装置22用于治疗患者15体内的病变300。成像装置30包括用于实时查看患者15体内的病变300的监测器31。成像装置30的实例包括如本领域中已知的超声波、ct、mri以及荧光检查装置。
[0143]
本发明包括帮助用户计划、执行以及检查如下文将更详细论述的药物治疗程序的结果的计算机软件(治疗计划模块54)。例如,治疗计划模块54通过使得用户能够更准确定位治疗能量传送装置20的探头22中每个探头相对于病变300的位置,以将产生最有效治疗区的方式帮助用户计划药物治疗程序。治疗计划模块54可基于探头的位置和治疗参数显示预期的治疗区。另外,治疗计划模块54可具有允许用户输入一个或多个用于ire的参数的用户界面。
[0144]
治疗计划模块54可实时显示治疗的进程并且可在治疗程序完成之后显示治疗程序的结果。此信息可以以某一方式显示,以使得其可以例如通过治疗医师确定治疗是否成
功和/或是否需要或希望对患者重新治疗来使用。
[0145]
出于本申请的目的,术语“代码”、“软件”、“程序”、“应用”“软件代码”、“计算机可读代码”、“软件模块”、“模块”、以及“软件程序”可互换使用以意指可由处理器执行的软件指令。“用户”可以是任何人,包括例如医生或其它医学专业人员。由处理器执行的治疗计划模块54将包括文字和图形数据的各种数据输出到与发生器10相关联的监测器11。
[0146]
现参考图7,本发明的治疗控制计算机40管理对患者的治疗计划。计算机40通过 i/o接口42如usb(通用串行总线)接口连接到通信链路52,所述i/o接口接收来自通信链路52的信息并且将信息通过通信链路52发送到电压发生器10。计算机40包括存储器存储装置44如ram、处理器(cpu)46、程序存储装置48如rom或eeprom 以及数据存储装置50如硬盘,所有装置通常通过总线53彼此连接。除其它之外,程序存储装置48存储包括在计划、执行和检查治疗结果中与用户相互作用的用户界面模块的治疗计划模块54。在程序存储装置48中的软件程序模块和来自数据存储装置50的数据中的任一项可以根据需要转移到存储器44并且由cpu 46执行。
[0147]
在实施例中,用户界面可以是可以用于结合计算机可读代码的图形用户界面。在设定对ire的治疗方法中,用户界面可允许用户进入或输入一个或多个待由治疗计划模块 54使用的参数。用户界面可允许通过使用文本域、复选框、下拉框、滑动条、命令按钮等进行此类输入。基于此输入端54,治疗计划模块54可计算靶组织ire的阈值电场和用于以足以产生此阈值电场的方式施用ire的治疗方法的一个或多个参数。
[0148]
在实施例中,治疗计划模块54提供数字建模能力,如在实例中描述的那些。模型可以用于模拟在治疗之前各种脉冲参数的核与细胞跨膜电位。用户界面可允许图10中的表中中列出的参数中的一个或多个参数以及脉冲长度值、脉冲间延迟值、电场强度值等的输入,并由此可以绘制核与细胞跨膜电位的图形表示。另外,治疗计划模块可基于参数中一个或多个参数的输入允许在显示装置11上观测消融区和周围选择治疗区。
[0149]
在一个实施例中,计算机40内置于电压发生器10中。在另一实施例中,计算机40 为通过通信链路52连接到电压发生器的单独单元。在一个优选实施例中,通信链路52 为usb链路。在一个实施例中,成像装置30为未连接到计算机40的独立装置。在如图6所示的实施例中,计算机40通过通信链路53连接到成像装置30。如图所示,通信链路53为usb链路。在此实施例中,计算机可通过分析如从成像装置30接收的图像数据的数据测定病变300的大小和取向,并且计算机40可在监测器11上显示此信息。在此实施例中,由成像装置30产生的病变图像可以在运行治疗计划模块54的计算机的显示装置(监测器)11的网格(未示出)上直接显示。此实施例将在网格上提供病变图像的准确表示,并且可消除手动输入病变尺寸的步骤以便在网格上产生病变图像。如果病变具有不规则形状,那么此实施例还将用于提供病变图像的准确表示。
[0150]
应注意软件可以独立于脉冲发生器10使用。如将在以下解释,用户可在不同计算机上计划治疗,并且然后将治疗参数保存到外部存储器装置,如usb闪速驱动器(未示出)。任何非暂时性计算机可读介质可以用于存储软件和/或用于特定治疗方法的软件的输出。然后,来自存储器装置的与治疗参数相关的数据可被下载到计算机40上,以待与用于治疗的发生器10配合使用。另外,出于对用户传送电能的治疗的训练目的,软件可以用于消融区、温度阈值或截止值以及电场阈值或截止值的假设说明。例如,数据可以通过人来评估以
确定或估计用于特定患者的有利治疗方法而不是编程到用于实施特定方法的装置中。治疗方法可以经设计以产生用于引发由治疗计划模块54计算的 ire的最小电场阈值。
[0151]
图8示出检测施加脉冲中异常,如高电流、低电流、高压或低压情形的电路的一个实施例。此电路位于发生器10内(参见图6)。usb连接52将来自用户计算机40的指令载送到控制器71。控制器可以是类似于如图2所示的计算机40的计算机。控制器71 可包括处理器、asic(专用集成电路)、微控制器或布线逻辑。控制器71然后将指令发送到脉冲发生电路72。脉冲发生电路72产生脉冲并且将电能发送到探头。为了清晰起见,仅示出一对探头/电极。然而,发生器10可容纳任何数目的探头/电极(例如,1至 10个,如6个探头)并且同时对多个电极通电用以定制消融区的形状。在示出的实施例中,脉冲同时施加于一对电极,并然后切换到另一对。脉冲发生电路72包括开关,优选电子开关,所述开关基于从计算机40接收的指令开关探头。传感器73如传感器可实时感测每对探头之间的电流或电压并且将此类信息传达到控制器71,继而将信息传达到计算机40。如果传感器73在治疗期间检测到不正常情形,如高电流、低电流情形,那么其将与控制器71和计算机40进行通信,这可引起控制器将信号发送到脉冲发生电路 72以中断用于特定对探头的脉冲。治疗计划模块54可进一步包括跟踪治疗进程并且向用户提供自动再处理低或丢失脉冲或过电流脉冲的选择的特征(参见以下论述)。另外,如果发生器由于任何原因提前停止,那么治疗计划模块54可在其中发生器终止的相同点重新启动,并且施用丢失治疗脉冲作为相同治疗的一部分。在其它实施例中,治疗计划模块54在治疗期间能够检测某些错误,其包括(但不限于)“电荷故障”、“硬件故障”、“高电流故障”以及“低电流故障”。
[0152]
用于通过电穿孔的损坏(消融)不期望组织的一般治疗方法是已知的。一般治疗方法涉及将电穿孔电极插入(引入)到不期望组织的附近并与组织有良好电接触,以及在贯穿不期望组织的区域或在整个不期望组织的区域中引起细胞的不可逆电穿孔的电脉冲的应用。其膜为不可逆渗透的细胞可以被去除或原位留下(未被去除)并因此可以通过身体的免疫系统被逐渐去除。细胞死亡通过在不期望区域中引发不可逆电穿孔的电参数产生。
[0153]
电穿孔方法涉及在组织中电场的产生并且受电脉冲的焦耳热影响。当设计组织电穿孔方法时,重要的是确定将最大化组织渗透而不会引发有害的热效应的适当电参数。已经示出组织的显著体积可以用可逆电穿孔进行电穿孔而不会引发对细胞的损坏热效应,并且这些体积已经被定量(davalos,r.v.,b rubinsky,和l.m.mir,在体内组织电穿孔期间的热效应的理论分析(theoretical analysis of the thermal effects during in vivo tissueelectroporation),生物电化学(bioelectrochemistry),2003年第61卷(1
‑
2):第99
‑
107 页)。
[0154]
用于引发组织中不可逆电穿孔的电脉冲通常在来自用于可逆电穿孔所需要的电脉冲的幅值和持续时间上较大。另外,用于不可逆电穿孔的脉冲的持续时间和强度不同于使用如对于胞内电操作或热消融的电脉冲的其它方法。甚至当胞内(纳秒)电操作用于引起细胞死亡,例如消融肿瘤组织时,或当热效应对细胞产生损伤导致细胞死亡时,方法是非常不同的。
[0155]
用于不可逆电穿孔的脉冲长度的典型值在约5微秒到约62,000毫秒或约75微秒到约20,000毫秒或约100微秒
±
10微秒范围内。这显著长于一般用于胞内(纳秒)电操作中的脉冲长度(其为1微秒或更小)
‑
参见美国公布专利申请第2002/0010491号。
[0156]
脉冲通常在一定电压下施用以使得用于不可逆电穿孔的组织所经受的局部电场为约100v/cm到7,000v/cm或200v/cm到2000v/cm或300v/cm到1000v/cm约600 v/cm。这大体上低于胞内电操作使用的(其为约10,000v/cm)
‑
参见美国公布专利申请第2002/0010491号。
[0157]
以上表达的电压为电压梯度(电压/厘米)。电极可以是不同形状和大小并可以在彼此相距不同距离处定位。形状可以是环形、卵形、方形、矩形或不规则形状等。一个电极到另一个电极的距离可以例如在约0.5cm到10cm、1cm到5cm或2cm至3cm范围内。电极的表面积可为例如0.1sq.cm至5sq.cm或1sq.cm至2sq.cm。
[0158]
电极的大小、形状和距离可变化并且因此可改变所使用的电压和脉冲持续时间。本领域的技术人员将根据本公开调节参数以获得期望的电穿孔程度并且避免对周围细胞的热损伤。
[0159]
确定电穿孔程序效果的主要因素为组织曝露于其的电场。然而,ire方法具有还可影响治疗的毒性的多个电脉冲参数。除电场以外,这些包括脉冲波形、脉冲数、脉冲长度和重复率。在脉冲期间的ire治疗的热效应为组织的电导率和组织曝露于其的电压的直接功能。因此,可以通过找出杀死组织中细胞的最小所需要的电场以及因此施加电压来最小化特定组织类型的热效应。
[0160]
为此目的,根据本发明的实施例的脉冲参数和电极配置可包括以下中任一项的任何组合:在约1μs到1ms范围内的脉冲长度;1到10,000范围内的脉冲数;用于每个导电线对和/或在治疗区中约5v/cm至5,000v/cm范围内的电场分布;通过每个导电线对和/或在治疗区中传送的约0.1mc到约500mc的总电荷;约0.001hz至100hz范围内的脉冲应用频率;约0mhz至100mhz范围内的脉冲信号频率;为方形、指数衰减、锯齿形、正弦形或交替极性的脉冲形状,尽管当前有利脉冲形状为两相dc脉冲;正电荷脉冲、负电荷脉冲以及中性电荷脉冲(改变脉冲内的极性);在治疗组织中约0到约 100安培范围内的所得电流;1至20个电极和/或导电线;约0.1mm到约5cm范围内的电极和/或导电线分隔距离;和用于单次治疗的多组脉冲/电极参数,包括改变在相同治疗内的以上参数中的任一者,如移出电极并且在组织内不同位置中替换它们或改变电极数以指定/定制结果。
[0161]
在实施例中,治疗方法可采用在约250ns和50μs范围内的脉冲长度,其中脉冲之间的延迟在所述量级上。约1μs到1ms范围内的脉冲长度也是可能的,如约5μs到约 0.5ms、或约10μs到约0.1ms或约15μs到约95μs。20μs、25μs、30μs、35μs、40μs、 45μs、50μs、55μs、60μs、65μs、70μs、75μs、80μs、85μs、90μs、110μs、150 μs或200μs等的脉冲长度也是可接受的。在一些实施例中,基于电穿孔治疗的脉冲持续时间可超过100μs。在根据本发明的实施例中可以施予任何长度脉冲或脉冲串。例如,可以使用约1皮秒到100秒的脉冲长度,如10皮秒到约10秒,或例如约100皮秒到约 1秒,或1纳秒到100毫秒、或约10纳秒到约10毫秒、或约100纳秒到约1毫秒、或约1微秒或10微秒到约100微秒。一些实施例可具有约100微秒到约1秒范围内的脉冲长度,如约110、或120、或130、或140、或150、或200、或300、或350、或400、或500、或600、或700、或800或900微秒,或约1、2、3、4、5、6、7、8、9或10 毫秒,或甚至15、20、30、40、50、60、70、80、90或100毫秒,或甚至例如从约200、 300、400、500、600、700、800或900毫秒等的脉冲长度。
[0162]
在示例性实施例中,脉冲为单极或双极的并且脉冲长度可在约0.25微秒到约100
微秒范围内,包括0.5、1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80 以及90μs或这些值之间的任何范围。
[0163]
在示例性实施例中,不论是单极或双极的连续脉冲可具有约0.1微秒到约200微秒之间的脉冲间延迟,包括0.2微秒、0.3微秒、0.4微秒、0.5微秒、0.6微秒、0.7微秒、 0.8微秒、0.9微秒、1微秒、1.5微秒、2微秒、2.5微秒、3微秒、3.5微秒、4微秒、 4.5微秒、5微秒、5.5微秒、6微秒、6.5微秒、7微秒、7.5微秒、8微秒、8.5微秒、9 微秒、9.5微秒、10微秒、20微秒、30微秒、40微秒、50微秒、60微秒、70微秒、80 微秒、90微秒、100微秒、120微秒、140微秒、160微秒以及180微秒或这些值之间的任何范围。
[0164]
在示例性实施例中,脉冲间延迟为脉冲长度的一部分,包括脉冲长度的1%、2%、 3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、 65%、70%、75%、80%、85%、90%以及95%或这些值之间的任何范围。在示例性实施例中,脉冲间延迟超过脉冲长度,包括1.1x、1.2x、1.3x、1.4x、1.5x、1.6x、1.7x、1.8x、 1.9x、2.0x、2.2x、2.4x、2.6x、2.8x、3.0x、3.2x、3.4x、3.6x、3.8x、4.0x、4.2x、4.4x、4.6x、4.8x、5.0x、5.5x、6.0x、6.5x、7.0x、7.5x、8.5x、9.0x、9.5x以及10.0x的脉冲长度或这些值之间的任何范围。
[0165]
脉冲数的范围可为例如5到5,000、或约10到2,000、或约20到1,000、或约30到 500、或约50到200、或约75到150、或约90到120、或约95到110或约100个脉冲。根据其它实施例,脉冲数的范围可在约5到约400个脉冲,如约10到约350个脉冲、或例如约15到约300个脉冲,包括约20到约250个脉冲、或约25到约200个脉冲,如约30到约150个脉冲,例如约50到约125个脉冲,如约75到约175个脉冲或约90 到110个脉冲,如约100个脉冲。
[0166]
通常,使用例如1500v/cm到4,000v/cm之间范围的电压执行每个导电线对和/或在用于ire的治疗区的电场分布,包括1500v/cm到2000v/cm、2000v/cm到3000v/cm、 3000v/cm到4000v/cm、2000v/cm到4000v/cm、2500v/cm到4000v/cm等。还可以使用低得多功率的电压,包括使用小于约1500v/cm。可以使用约500v/cm到1000 v/cm或甚至约10v/cm到约750v/cm,如约50v/cm到约200v/cm的施加场,或约75 v/cm到约100v/cm的电场分布。例如,在大脑肿瘤的治疗中,通常可以使用小于1000 v/cm的施加场。可以使用的电脉冲发生器包括能够传送0到约5,000v的那些电脉冲发生器,如例如可传送0至3,000v的的系统。
[0167]
在另一实施例中,基于电穿孔治疗的脉冲的幅值超过2000v/cm,包括约2200v/cm、或2500v/cm、如约3000v/cm、或3500v/cm、或约4000v/cm、如4500v/cm、或约 5000v/cm、如约5500v/cm、或约6000v/cm、或约6500v/cm、如约7000v/cm、或约 7500v/cm、如8000v/cm、或约8500v/cm、包括9000v/cm、或约9500v/cm、如约 10,000v/cm等的幅值。在本说明书的上下文中,幅值是指使用电脉冲施加的电能的幅值并且脉冲可以是正极性或负极性。
[0168]
根据本发明的方法,脉冲的循环时间被设定为一般约1hz。此外,已发现相邻电极的交替极性最小化电荷积聚并且提供更均一的治疗区。更具体来说,在由本发明人执行的实验中,使用(纽约昆斯伯里的angiodynamics(angiodynamics, queensbury,n.y.))发生器钝端双极电极(angiodynamics,no.204002xx)通过传送在组之间具有交替极性的10个50μs脉冲中的9组(电压与距离比率2000v/cm)以阻止电荷在不锈钢电极表面上堆积,在颞叶的颅骨侧(外薛氏回)中产生表面病灶性消融ire 病变。这些参数由对犬类动物
大脑的离体实验测定并且它们确保在程序期间传送的电荷低于在电休克治疗(fda审批通过的用于严重抑郁症的治疗)期间传送到人大脑的电荷。传送到大脑的过量电荷可引发记忆丧失,并因此优选避免。
[0169]
特定的方法实施例可采用施用使用约1hz到20ghz脉冲率的基于电穿孔治疗,所述脉冲率如例如约10hz到20ghz、或约50hz到500hz、或100hz到1khz、或10khz 到100khz、或250khz到10mhz、或500khz到1mhz,如900khz到2mhz或约 100mhz到约10ghz,包括约200mhz到约15ghz等。在示例性实施例中,脉冲率在 100khz和10mhz之间。
[0170]
在优选实施例中,可以使用通过每个导电线对和/或在处理区中传送的约0.5mc到约25mc的总电荷,如约1mc到约20mc、或约1.5mc到约15mc、或约2mc到约 10mc、或约5mc到约8mc等。类似地,在优选实施例中,在治疗组织中的所得电流范围可为例如约1a到约8a、或约2a到约6a、或约3a到约5a,如4a。实际上,对于某些应用,所传送的总电荷范围可为约0.5mc到约500mc,如约10mc到约200 mc、或约15mc到约150mc、或约20mc到约100mc、或约50mc到约80mc等。在治疗组织中的所得电流范围可为例如约1a到约80a、或约20a到约60a、或约30 a到约50a,如40a。对于用于ire治疗的电流达到或超过40安培和50安培是很常见的,并且进一步可实行的是对于在甚至更高的电流下用在此类条件下还能够操作的脉冲发生器操作。在某些应用中电流被预期为高的,尤其当在其中组织或介质高度导电的区域中工作时,如有血液存在于血管中。在组织中的脉冲宽度、脉冲形状、脉冲数以及所得电流可以经调节以实现用于限制总电荷的特定目标,并且本说明书中所公开的特定值中的任一项可以用于计算目标预期电荷。
[0171]
还可以使用任何数目的导电电线或电极。然而,在优选实施例中,使用3到约18 个电极,如3到16个、或约3到15个、或4到12个、或5到10个、或6到8个。可以选择性对电极/电线中的任何一个或多个通电以实现特定的治疗结果。另外,导电表面如导电电线和/或电极之间的分隔距离可在约0.2mm到约4mm,如约0.3mm到约3mm、或约0.4mm到约2mm、或约0.5mm到约1mm、或约0.8mm到约4cm,如约0.9mm 到约3cm、或约1.2cm到约2cm、或约1.5cm到约1.8cm等范围内。
[0172]
可以用于本发明的实施例中的方法的另外参数提供于美国公布专利申请第us2007/0043345号、第us 2009/0269317号、第us 2011/0106221号、第us 2012/0109122 号、第us 2013/0184702号、第us 2013/0345697号、第us 2014/0039489号和第us2015/0088120号中以及美国专利第8,926,606号、第8,992,517号、第8,814,860号、第 8,465,484号中,其中的每个的公开内容均通过引用其全文的方式并入本文中。
[0173]
实例
[0174]
以下实例用于进一步说明本发明。
[0175]
实例1呈现使用高频电场的一个或多个脉冲串的双峰增强消融机制(beam)平台,所述的电场已经经特定优化以调制癌细胞中的胞内影响同时避开健康组织。最优脉冲串含有组成型脉冲,其中持续时间约等于细胞膜的充电时间加上核被膜的放电时间。以下部分将进一步展开描述此新颖概念并且在不需要外部标记的情况下对靶向特定癌症类型具有意义,但是对于药类化合物具有类似的特异性。
[0176]
实例2呈现高频双极性脉冲串的体外影响。在脉冲串内的单独脉冲通过2μs分隔开并且顺序脉冲极性交替。脉冲串在80秒内每秒重复一次并且每个脉冲串将细胞暴露于施加
电压100μs。为了展现这些脉冲对细胞膜和胞内细胞器的影响,本发明人呈现了包括核被膜的细胞的有限元模型。响应于250ns和50μs之间的脉冲,评估脂质双层和核被膜的充电行为。对胞内电导率和胞外电导率、细胞核与细胞质比率以及脉冲到脉冲延迟时间进行参数分析。呈现体外实验以确认方法的非热学性质并且展现在此中间物脉冲宽度范围内的不可逆电穿孔。
[0177]
在实例3中,本发明人使用3d肿瘤模拟物探索在250ns和100μs之间的脉冲
‑
持续时间间隔并且计算用于特定双峰增强消融机制(beam)方法的致死电场强度。本发明人发现用于含有0.25μs、0.5μs、1μs、2μs、5μs、10μs以及50μs脉冲的脉冲串的标称致死阈值分别为2022v/cm、1687v/cm、1070v/cm、755、v/cm、640v/cm、629 v/cm以及531v/cm。鼠肿瘤模型用于研究体内beam的效果。肿瘤暴露于200个脉冲串,每个脉冲串通电100μs,含有1μs、2μs或5μs持续时间的单独脉冲。相对于对照组,在所有的治疗组中平均肿瘤生长基本上被抑制。在治疗30天后,14个治疗鼠中的 6个没有可测量的肿瘤迹象,并且所有的方法都能够实现完全的消退。此工作示出用于 beam的电位以待用作病灶性治疗并且有益于其在较大临床前模型中的研究。
[0178]
在实例4中,本发明人报导了一种基于细胞的电破坏的物理治疗方法,所述方法的作用强烈地取决于细胞形态。有趣的是,数字建模表明虽然对于较大细胞由长脉冲(~100 μs)引发的外脂质双层破坏被增强,但是短脉冲(~1μs)在细胞内部内优先产生高场,所述高场幅值上与细胞核大小成比例。因为扩大的核表示恶性肿瘤的可靠指示符,所以这呈现一种用于优先靶向恶性细胞的方法。虽然本发明人展现使用脉冲电场(pef)杀死正常细胞和恶性细胞两者以治疗自发性犬类动物gbm,但是基于核大小可以使用适当调整的pef以提供靶向消融。使用正常和恶性大脑组织的3d水凝胶模型(其在治疗测试期间允许高分辨率讯问),本发明人确认pef可经调整以优先杀死癌细胞。最后,本发明人估计由pef引起的细胞死亡所需要的核被膜电位破坏。结果可以用于安全地靶向引起gbm肿瘤复发的耐治疗细胞生态位。
[0179]
实例1
[0180]
细胞在悬浮液中的数字模型产生于comsol 4.2a中。两个方案用于将细胞建模为膜覆盖的球体。在第一模型中,产生了表示样本流体(外部到细胞)、细胞膜以及细胞质 (内部到细胞)的单独域。表示细胞膜的5nm厚的球形壳体域需要对默认的网格参数的明显修改并且产生许多的四面体元件。简言之,整个几何形状被指定为具有
‘
极其粗糙 (extremely course)’的预定义密度的单一网格。然后,对于最小元件大小(0.00025)、最大元件生长速率(1.2)、曲率分辨率(0.04)以及窄区域的分辨率(0.0001)改变默认参数的值以成功地使几何形状与817,184四面体元件啮合。具有四内核3.0ghz处理器和8gb ram的计算机需要15小时的计算时间以解决具有1,092,902自由度的14μs暂态模型(结果示出在图9中)。此模型可能为最准确的方法并且用于计算用于电导率在0.01 s/m和10s/m之间的tmp的频率、正弦形以及脉冲响应。然而,其在计算上是昂贵的并且限制了对外细胞膜的跨膜电位的分析。
[0181]
对于模型,双极方波的脉冲串的影响和对核膜的影响,使用了更有效的阻抗边界条件模型。在此方法中,立方域表示实验介质并且两个球体分别表示细胞质和核质的域。对于每个域,使用了单独的电流物理学模块并且对于介质域、细胞质域以及核质域的相关电压变量分别被定义为v
介质
、v
细胞质
、v
核质
。然后,定义变量以将细胞膜(tmp)和核膜(ntmp)分别计
算为(v
介质
‑
v
细胞质
)和(v
细胞质
‑
v
核质
)。在电流模块中,表示膜的边界被定义为具有规定为在相邻域中电压的参考电压的阻抗边界条件。在介质域中,表示细胞膜的边界被定义为具有v
细胞质
参考电压的阻抗边界。层规格被定义为
‘
薄层’并且使用图10中的表中呈现的值来定义导电率、相对介电常数以及表面厚度。
[0182]
在阻抗边界条件模型中,网格被定义为具有产生17,825个四面体元件的
‘
标准’尺寸元件的单一自由四面体群。在此模型的初步研究中,还进行了另外的网格改进步骤(改进数=2)。在改进的情况下,相同14μs模拟的此计算在27分钟内完成。在没有改进的情况下,计算时间被进一步减小到14分钟。当相比于物理边界模型时,两个阻抗边界配置充分地再现了类似的结果。未经改进的阻抗边界条件模型用于进行剩余参数研究。
[0183]
分析建模
[0184]
为了研究双峰正弦波对电穿孔的影响,在对于具有同心细胞核的球形细胞的频域中实施了求解拉普拉斯(laplace)方程的分析模型(yao,c.g.等人,对由脉冲式电场模型和模拟引发的内膜和外膜的跨膜电位的研究(study of transmembrane potentials of innerand outer membranes induced by pulsed
‑
electric
‑
field model and simulation)ieee等离子体期刊(ieee trans plasma sci),2007.35(5):第1541
‑
1549页。每个细胞区域由介电常数和电导率两者表征,确保与频率的tmp和ntmp计算精确性为mhz范围。简言之,解决方案通过以下方法获得:在时域中合并低频(250khz)和高频(1mhz)电场,通过采用拉普拉斯变换将信号转换成频域,将信号乘以表示细胞的几何特性和介电特性的传递函数(kotnik,t.和d.miklavcic,对在暴露于电场的生物细胞的内部膜上的电压引导的理论评估(theoretical evaluation of voltage inducement on internal membranes ofbiological cells exposed to electric fields).生物物理学杂志(biophysical journal),2006. 90(2):第480至491页))以及通过采用相反的拉普拉斯变换将结果转换回时域。为了说明优化脉冲串的临床益处,根据标准技术对无限制组织域中两个针头电极() 求解拉普拉斯方程。电极被间隔开0.1cm并且施加电压设定为20kv。
[0185]
细胞制备和实验
[0186]
将mda
‑
mb
‑
231人的乳癌细胞悬浮于以2.5
×
106个细胞/毫升的浓度电导率为0.1 s/m的缓冲液中。能够在每个极性中传送1000v
峰
的常规脉冲发生系统用于在1mm或2 mm电穿孔比色杯中在细胞悬浮液中产生约1000v/cm、2000v/cm以及4000v/cm的电场强度。将mda
‑
mb
‑
231细胞暴露于在图14中(顶部和中间)示出以1hz重复率的由200个由1.8μs停滞时间分隔开的双极方波脉冲700ns宽组成的90脉冲串。使用vi 细胞细胞存活率分析仪(贝克曼库尔特公司(beckman coulter))评估治疗后1小时和 16的细胞存活率。在16小时之后的总存活率被定量为活的治疗细胞与活的未经治疗(假对照)细胞的比率。
[0187]
用以5
×
106个细胞/毫升浓度悬浮于缓冲液中介质电导率为0.2s/m的的ppt8182鼠原发性胰腺肿瘤细胞进行另外的实验。将100μl细胞悬浮液添加到2mm间隔比色杯中并且在每个极性中施加具有50微秒接通时间的80个脉冲串(100μs总共)。在每个脉冲串内,单独的脉冲具有250ns、500ns、1μs、2μs、5μs、10μs或50μs的接通时间并且在脉冲终止与以相反极性的下一个脉冲开始之间具有2μs延迟。细胞暴露于幅值为 1500v/cm、3000v/cm和4000v/cm的电场中。
[0188]
数字建模(外膜)
[0189]
图11示出在频率在1hz和100mhz之间的400v/cm电场中的mda
‑
mb
‑
231细胞的最大tmp。由于平均通电时间比细胞膜的充电时间长得多,所以dc和低频正弦形电压在增加细胞膜的tmp方面非常有效。因此,对于400v/cm的低频正弦形电压,tmp 被提高并且保持在大于独立于介质电导率的电穿孔阈值的数值。在低电导率溶液中,细胞膜充电更为缓慢。由于频率增加到高于1khz,电压未接通足够长时间以在0.01s/m 缓冲液中对细胞膜完全充电。结果显示在没有显著更改细胞的细胞膜的情况下用于与细胞相互作用的最优频率范围出现在高于1khz。当高于100khz运行时,可以使用非常大幅值的电场而不需要显著增加tmp。
[0190]
有趣的是,先前实验观察结果(sano,m.,j.caldwell和r.davalos,用于粒子分离和富集的低频非接触式介电泳平台(a low frequency contactless dielectrophoresisplatform for particle isolation and enrichment),2011:usa;sano,m.b.j.l.caldwell 和r.v.davalos,以从稀释全血样本中分选癌细胞的低频非接触式介电泳(cdep)平台的建模和显影(modeling and development of a low frequency contactlessdielectrophoresis(cdep)platform to sort cancer cells from dilute whole blood samples),生物传感器与生物电子学(biosensors&bioelectronics)2011;以及sano,m.b等人,非接触式介电泳光谱分析:检查血液中所发现的细胞的介电特性(contactlessdielectrophoretic spectroscopy:examination of the dielectric properties of cells found inblood),电泳(electrophoresis),2011.doi 10.1002/elps.2201100351)显示一定程度的细胞电穿孔低于其克劳修斯
‑
莫索(clausius
‑
mossotti)因数的第一交越频率,但是最小电穿孔高于此频率(即细胞被电穿孔同时经历负dep,但是当经历正dep时受影响最小)。对图11中示出的结果的分析显示交越频率与tmp曲线上
‑
3db点并置。这指示在交越频率下,细胞吸收在较低频率下吸收的最大能量的一半并且显示出膜电特性对dep 和电穿孔影响的强相关性。
[0191]
由于介质的电导率增加,细胞膜的充电时间降低直到介质电导率达到1.0s/m。高于此阈值,介质电导率的增加对tmp充电时间的影响可忽视。在0.1s/m下,不会达到
‑
3 db频率直到约100khz。在1.0s/m和10.0s/m下,此频率被偏移更高,到约300khz。如果在体外实验中使用更高电导率的缓冲液,那么还应该使频率范围偏移以避免损坏细胞膜。
[0192]
图12a和图12b示出分别在100khz和1mhz频率下,对于1000v/cm电场与时间相关的tmp的充电。在100khz下,最大tmp受介质电导率的影响可忽视。在0.01 s/m下,存在所实现最大值的略微的相移和降低。在1mhz下,tmp显著受介质电导率影响。对于0.01s/m和0.1s/m电导率介质,相移和降低是明显的。这再次指示低电导率介质为细胞提供抵抗脂质双层电穿孔的一些保护措施。在电导率高于生理学标准 (1.0s/m)的介质中,tmp随着施加信号显著增加(并且同相)。
[0193]
图13和图14示出分别对具有1000v/cm幅值的2μs和20μs脉冲电场的tmp响应。如由具有正弦形信号的结果所预期,tmp增加的速率高度取决于介质电导率。对于最低介质电导率(0.01s/m),其对于tmp需要长于20μs以达到其最大值。对于1.0s/m 或更大的电导率,此充电时间减少到约2μs。这些结果显示由脉冲电场引起的tmp呈指数增加和降低。关于生理学电导率的更短的充电时间是由于电流优选流动通过细胞而非在其周围。这突显了优化脉冲参数的能力从而优先地影响胞内组分。
[0194]
数字建模(核膜)
[0195]
当细胞暴露于脉冲电场时,当细胞充满电时细胞膜的电容性质阻碍电流流动通过细胞。然而,膜不能即刻充电并且当离子和分子重排时存在短暂的时间并且电流流动通过细胞的细胞质。此位移电流增加了围绕细胞核和细胞器的膜的跨膜电位。这些细胞组分比细胞小得多并且在相同电场内其理论最大tmp随着其有效半径线性降低。另外,由于充满电的细胞膜阻碍电流流动通过细胞质,这些内部膜可充电一段小于tmp充电时间的时段。
[0196]
图15示出了对于4μs接通时间和2μs断开时间的双极脉冲,细胞膜和核膜的充电特性。对于第一个500ns,电流流动通过细胞质并且核跨膜电位(ntmp)增加。在500 ns之后,细胞膜开始阻碍电流的流动并且ntmp开始衰减回到零。当正向脉冲关闭时,在细胞膜上的电荷开始消散并且离子重新分布引起电流以相反方向流动,以相反极性对核膜充电。当脉冲切换极性时,此方法重复。每一双极性脉冲导致具有模式++
‑‑
++的 ntmp增加四倍。在相同极性中,连续的ntmp增加的此模式表明存在最优的脉冲配置以增加可实现的最大ntmp值。
[0197]
图16示出当脉冲断开时间保持恒定在500ns时,脉冲接通时间对ntmp的影响。在第一正脉冲的起始时,在其开始衰减之前ntmp充电高达第一个500ns中的约0.35v 的最大值。在第一脉冲结束时,在细胞质内的位移电流强制ntmp为负的。负极性脉冲的起始进一步增加在负方向上ntmp的幅值。这种附加作用导致负ntmp值的幅值大于第一正ntmp的幅值。
[0198]
对于非常短的接通时间脉冲,核膜在正脉冲归零之前还没有完全放电。这减小了可实现的最大负ntmp。对于500ns接通时间脉冲,第一正ntmp达到0.35v而第一负 ntmp达到
‑
0.47v。如果在正脉冲断开之前给予正ntmp充足时间以衰减回到零,那么此效果被进一步增强。当脉冲长度增加到3.5μs和4μs时,ntmp达到0.62v的最大幅值,几乎是单一单极性脉冲实现的值的双倍。图16示出核跨膜电位可以被加倍而不需通过仔细调整脉冲参数来增加施加场的幅值。
[0199]
图17示出了脉冲之间的延迟时间的影响。在第一正脉冲结束时,ntmp衰减并且在约250ns之后变成负的。在第一正脉冲结束之后约500ns在衰减回到零之前,ntmp达到其最大负值。如果在ntmp可衰减回到零之前引发负脉冲,那么所得ntmp增加大于通过单一单极性脉冲实现的ntmp增加。当脉冲之间的延迟为500ns时,实现最大的 ntmp值。此最优时间是由于促进细胞膜和核膜的rc时间常数的因子的组合。图16和图17中示出的结果显示脉冲特性可以经优化以增加对于高频双极脉冲可实现的最大 ntmp。
[0200]
看起来为了最大化ntmp,最优脉冲接通时间等于细胞膜的充电时间加上核膜的放电时间。这允许ntmp充电,然后其在脉冲的下降沿处强制为负的之前归零。类似地,最优断开时间约等于细胞膜的充电时间。正如引发第二脉冲,这允许ntmp增加到其最大的相反极性值而不会衰减。
[0201]
图18a和图18b示出在该优化方案后的作用。在大多数情况下,使用双极脉冲串将增加ntmp高于单一脉冲最大值。对于具有500ns断开时间的500ns脉冲(图18a),第一脉冲ntmp为约0.33v。使用脉冲的脉冲串,此值增加到0.44v。使用具有4μs接通时间和500ns断开时间的优化脉冲(图18b)将最大ntmp增加到几乎为0.7v。这一优化的脉冲配置加倍了电场对核膜的影响而不需要增加施加到系统的电压。
[0202]
图19示出细胞核大小对ntmp的影响。这对于优化脉冲方法的选择具有暗示。通常,随着细胞发展(正常
→
良性
→
恶性
→
转移性),细胞核与细胞质比率增加。因此,细胞对优化的双极脉冲方法更敏感。这可以通过峰值ntmp随着细胞核与细胞质比率的增加而增加而看
24至图26)。在1500v/cm(图24)、3000v/cm(图25)以及4000v/cm(图26)的场强度下,传送由宽度在250ns和50μs之间的脉冲组成的总接通时间为100μs的八十个脉冲串。在1500v/cm下,2μs或更大的脉冲宽度在24小时之后能够将总存活率减少到小于50%。对于5微秒或更大的脉冲,在24小时之后存活率显著减少,这指示细胞经历某一形式的细胞凋亡或延迟的细胞死亡。在3000v/cm下,在24小时之后,1μs 或更大的脉冲减少细胞存活率低于50%,其中2μs和更大的脉冲几乎完全排除细胞代谢活动的迹象。在4000v/cm下,在1小时之后500纳秒脉冲呈现引发细胞立即死亡(60%存活率)并且在24小时之后引发延迟的细胞死亡(30%存活率)。大于此的脉冲在一小时处引发立即细胞死亡(<30%存活率)并且在24小时处进一步引发延迟的细胞死亡 (<10%存活率)。对于所有场强度,细胞存活率受到250ns脉冲宽度的影响可忽视。
[0211]
对图24至图26的分析显示,对于具有长于2μs脉冲的脉冲串,在1小时处和3000 v/cm下的存活率等于在24小时处和1500v/cm下的存活率。对于1μs和2μs脉冲,在 1小时处和4000v/cm下的存活率等于在24小时处和3000v/cm下的存活率。当体内施加时,这将导致选择性靶向增强区,其中浸润性癌细胞将被选择性靶向。图27a示出基于体外实验中建立的阈值的预期消融和增强。选择性区扫过其比消融区的高度和宽度大约2cm的卵形,这指示在1cm边缘内的浸润性细胞将被治疗。当场阈值经调节补偿体内所观察到的场阈值~3x降低时,实现较大体积但类似的增强区(图27b)。
[0212]
结论
[0213]
本发明人显示施加场的频率和悬浮介质的电导率在tmp的累积中起了重要作用。在其中不期望电穿孔的情况下,应该使用最低电导率生理上合适的缓冲液。甚至在0.01 s/m下,如果在dc和约10khz之间施加连续正弦波电压,那么tmp将增加。如果场强度保持恒定,那么电穿孔(可逆的和不可逆两者)的程度显著减小高于此频率。这允许显著优化施加电场的时间特性以最大化对胞内组分的影响。
[0214]
如果电穿孔是期望的,那么当在组织消融的情况下时,在充分导电介质内运行是有利的。对细胞膜的充电时间的数值分析指示1.0s/m为临界电导率。高于此值,充电时间并不显著增加,而低于此值,细胞不可达到其短脉冲的最大tmp。然而,生理学组织的电导率通常在0.1s/m与0.7s/m之间。结果是短持续时间脉冲对细胞膜具有缓和的影响而对胞内组分具有增强的影响。理论上,具有500ns断开时间的4μs脉冲的脉冲串将产生对核跨膜电位最大的影响并且可有助于进一步增加高频脉冲的致命性。
[0215]
细胞形成具有围绕细胞的流体/介质的复杂电阻器
‑
电容器(rc)网络。细胞膜(c) 的电容性质与胞外材料(r)的电阻耦合,这限制细胞膜将充电到其理论最大电位的速率。一般来说,较小细胞具有较小的净电容。这继而允许它们比较大细胞更迅速地充电。这一充电行为阻碍了电流流动通过胞内细胞质。在组织体积中的最小细胞将经历任何脉冲场的最小胞内影响。已经显示出由于细胞膜形态的改变,甚至当相比于相同大小的非癌性细胞时,高度转移性细胞具有更高的膜电容。此生物物理学改变的结果为浸润性癌细胞将展现出比周围健康细胞更大的净电容。这继而导致与对浸润性细胞的细胞膜充电相关联的更长的时间常量。细胞膜充电的这种滞后导致在胞内组分上电荷累积的增加,从而导致对细胞核和细胞器的放大电穿孔影响。
[0216]
这样的结果为治疗电场可以施加到含有健康细胞和癌细胞的组织体积以使得仅
组织中的癌细胞将接收治疗效果。这可以是对用于药物、基因或蛋白质传送或细胞凋亡级联的特定触发的胞内组分的选择性电穿孔。这些脉冲还可以经设计以使得组织的特定体积经历不可逆电穿孔并且另外的外部体积将经历引发剂量的仅有靶向癌症细胞凋亡。这一后种情况允许选择性靶向浸润性细胞,如嵌入于围绕肿瘤的健康组织中的显微镜观察疾病。
[0217]
实例2
[0218]
方法:
[0219]
数字建模
[0220]
细胞在悬浮液中的数字模型使用阻抗边界条件方案在comsol 4.2中产生 (g.pucihar,t.kotnik,对在不规则形状细胞上引发的跨膜电压的数字测定(numerical determination of transmembrane voltage induced on irregularly shaped cells),生物医学工程分析(annals of biomedical engineering)34(2006)642
‑
652)。方案域由边缘长度为0.1mm的三维立方体组成。在此域的中心处,产生了表示细胞质和核质的两个球体。在方案域内,电流模块用于求解以下方程:
[0221][0222][0223][0224]
其中u为电位,e为电场,j为电流密度以及q为电流源。一个边界被指定为与电位相关的时间
[0225]
u=u(t)/v
ꢀꢀꢀ
[4]
[0226]
相对边界被指定为相对接地
[0227]
u=0/v
ꢀꢀꢀ
[5]
[0228]
剩余边界被定义为电绝缘
[0229]
n
·
j=0/(a/m)
ꢀꢀꢀ
[6]
[0230]
其中n为相对于表面的法向量,j为电流。
[0231]
对于每个域(介质、细胞质、核质),使用了单独的电流物理学模块并且分别定义了对于介质域、细胞质域和核质域的相关电位变量u
介质
、u
细胞质
、u
核质
。然后定义这些变量以计算跨细胞膜的电压(u
m
)和跨核被膜的电压(u
n
)。
[0232]
u
m
=u
media
‑
u
cyto
/v
ꢀꢀꢀ
[7]
[0233]
u
n
=u
cyto
‑
u
nuc
/v
ꢀꢀꢀ
[8]
[0234]
media介质cyto细胞质nuc核质
[0235]
在每个电流模块中,表示膜的边界被定义为具有规定为相邻(u
ref
)域中电位的参考电压的阻抗边界条件。
[0236][0237]
其中σ为电导率,ε为介电常数以及d为细胞膜或核被膜的厚度。例如,在介质域中,表示细胞膜的边界被定义为参考电位为u
细胞质
的阻抗边界。在细胞质域中,表示细胞膜的相同边界被定义为参考电位为u
介质
的阻抗边界。边界被定义为
‘
薄层’,并且电导率、相对介电
gene expression and knockdown in vivo by using avian retroviral vectors),美国国家科学院院刊(proceedings of the national academy of sciences),105(2008)10137
‑
10142; d.saur,b.seidler,g.schneider,h.alg
ü
l,r.beck,r.senekowitsch
‑
schmidtke, m.schwaiger,r.m.schmid,cxcr4表达增加在鼠的胰脏癌模型中肝和肺癌转移(cxcr4expression increases liver and lung metastasis in a mouse model of pancreatic cancer),胃肠病学(gastroenterology),129(2005)1237
‑
1250;以及m.j.paszek,n.zahir,k.r.johnson, j.n.lakins,g.i.rozenberg,a.gefen,c.a.reinhart
‑
king,s.s.margulies,m.dembo, d.boettiger,张力平衡和恶性表型(tensional homeostasis and the malignant phenotype),癌细胞(cancer cell),8(2005)241
‑
254)。
[0242]
在37℃下、在5%co2中、在潮湿大气压下,在含有10%胎牛血清(密苏里州圣路易斯西格玛阿尔德里奇(sigma aldrich,st.louis,mo))和1%青霉素/链霉素的储备溶液(加利福尼亚州卡尔斯巴德的英杰公司(invitrogen,carlsbad,ca))的dmem(弗吉尼亚州马纳萨斯atcc(atcc,manassas,va),补充有l
‑
谷酰胺)中培养细胞。在80%融合处,通过胰蛋白酶化作用收集所有细胞用于实验。悬浮液经离心两次并且再悬浮于以5
×
106个细胞/毫升浓度的实验缓冲液中。将100μl细胞悬浮液立即注入到2mm间隙比色杯(型号620,马萨诸塞州霍利斯顿哈佛设备(model 620,harvard apparatus, holliston,ma))中,之后立即进行脉冲传送。实验装置的示意图示出在图29a中。
[0243]
对于所有实验,方法使用呈现在图29b中的波形。示意图描绘含有单独脉冲的重复序列的实例脉冲串。脉冲串以正极性脉冲开始,接着2μs暂停,然后负极性脉冲,接着另一个2μs暂停。紧接着重复此循环,直到已经传送电压总共100μs(在每个极性中 50μs)。以1hz频率传送八十个脉冲串。在每个脉冲串内,单独脉冲具有250ns、500ns、 1μs、2μs、5μs、10μs或50μs的单一持续时间并因此脉冲串分别含有400个、200个、 100个、50个、20个、10个或2个脉冲以产生相等的通电时间。2μs延迟时间被编程在顺序相反的极性脉冲之间以保护电子设备免于由于环形效应引起的过电压。脉冲串的代表性实例示出在图30a至图30c中。细胞暴露于电压与距离比率(e)为1500v/cm、 3000v/cm以及4000v/cm的电位中。使用直接插入到细胞悬浮液中的光纤温度探头(加利福尼亚州圣克拉拉lumasense科技luxtron fot实验室试剂盒(luxtron fot lab kit, lumasense technologies,santa clara,ca))测量由于脉冲引起的细胞悬浮液中的温度改变。
[0244]
对于体外研究,治疗组中的每个组重复最少三次(n=3),在至少不同的两天中进行每个组的添加实验。对于每个治疗,包括假暴露的不同实验参数以随机顺序交替。在治疗之后,将样品拆分成两个相等的50μl样品,以待在1小时和24小时时间点处评估。将样品在室温下保持约20至30分钟,之后放置在冰上(1小时组)或移动到培育箱(24 小时组),同时完成剩余的实验组。暴露后约一小时,使用台盼蓝排除分析评估存活率。已经进行不可逆电穿孔的细胞不能够排除染料并且被染成蓝色。使用血细胞计目测计数细胞并且百分比存活率被测定为
[0245]
[0246][0247]
在1小时时间组中,假对照样本的平均存活率大于85%。将在24小时处分析的样本放入含有总共1ml培养基的12孔板中的单独孔中并且在室温下保持,直到孔板充满 (约30分钟)。此时,将孔板放入在37℃和5%co2的培育箱中,维持24小时。然后使用alamar蓝代谢分析(纽约格兰德岛生命技术公司((life technologies,grand island, ny))使用制造商推荐的程序评估存活率。简言之,将100μl/ml储备alamar蓝溶液添加到每个孔中。在4小时之后,使用在570/600nm波长处的分光光度计读取样本。对于每个样本,测量在三个单独孔中的吸光度并且进行平均。对样本介质而不是细胞以及对未暴露于电场的对照细胞样本进行另外的测量。百分比存活率被测定为
[0248][0249]
其中i为来自分光光度计的相对强度测量。一般来说,台盼蓝分析和代谢分析彼此非常好地互补。ibey等人先前示出代谢分析反映在纳秒脉冲电场暴露之后由台盼蓝分析的那些结果(b.l.ibey,a.g.pakhomov,b.w.gregory,v.a.khorokhorina,c.c.roth, m.a.rassokhin,j.a.bernhard,g.j.wilmink,o.n.pakhomova,高强度纳秒持续时间电脉冲在哺乳动物细胞中的选择性细胞毒性(selective cytotoxicity of intensenanosecond
‑
duration electric pulses in mammalian cells),生物化学与生物物理学报
‑
一般学科(biochimica et biophysica acta
‑
general subjects),1800(2010)1210
‑
1219)。在本研究中使用的alamar蓝分析被很好地建立用于测量在哺乳动物细胞中的细胞毒性 (j.o'brien,i.wilson,t.orton,f.pognan,对alamar蓝(刃天青)荧光染料用于估计哺乳动物细胞细胞毒性的研究(investigation of the alamar blue(resazurin)fluorescent dyefor the assessment of mammalian cell cytotoxicity),欧洲生物化学杂志(european journal ofbiochemistry),267(2000)5421
‑
5426)。测量接种浓度在2.5
×
103与2
×
106个细胞/毫升之间的细胞的减少速率以确保假群并未完全减少alamar蓝溶液(结果未示出)并且用 2.5
×
105个细胞/毫升的4小时培养时间被测定为最优的。将1小时组和24小时组两者的存活率数据归一化为假对照组。使用jmp pro v.10.0(北卡罗来纳州凯里sas研究公司 (sas institute inc.,cary,nc))完成数据的统计分析。
[0250]
电子设备
[0251]
使用任意功能发生器(afg3021c,俄勒冈州比弗顿泰克公司(tektronix inc., beaverton,oregon))产生波形,所述波形通过可容纳通过高阻抗负载(美国亚利桑那州图森应用能量(applied energetics,tucson,az,usa))的+/
‑
1000v输出的定制的高压脉冲发生器放大。在使用50mhz 1000x高压探头(p5210a,俄勒冈州比弗顿泰克公司) 减弱电压之后,使用示波器(dpo2002b,俄勒冈州比弗顿泰克公司)观测输出波形并且使用在50mhz电流探头(tcp305,俄勒冈州比弗顿泰克公司)上的有源箝位测量电流。在输出端上的短路保护电阻器将通过2mm比色管的最大输出电压限制为约800v (4000v/cm)。
[0252]
结果及论述
[0253]
数字建模
[0254]
如图31a至图31c中所示,在1500v/cm电场(图31a)的影响下,跨细胞膜的电位降
(u
m
)(图31b)和核被膜的电位降(u
n
)(图31c)分别达到1.47v和0.28v的最大值。u
m
在0.34μs达到最大值的50%,在1.11μs达到70.7%最大值以及在7.92μs 达到99.99%最大值。u
n
在145ns达到99.99%最大值并且在约0.94μs下降回低于70mv。核被膜的短暂充电和放电是由于当细胞膜充电时在细胞质内流动的电流。此瞬变电流增加了跨围绕细胞核和细胞器的膜的电位。这些胞内组分小于细胞并且其暴露于电流是短暂的,导致较小电位增加。
[0255]
当正极性脉冲下降时,细胞膜开始放电,导致第二电流在相比于上升脉冲边缘的相反方向上在细胞质内流动。这导致跨核被膜的负电位的形成。此负电位达到
‑
0.28v的最小值并且同样在0.94μs下降低于
‑
70mv。负极性脉冲的上升沿产生u
n
的类似降低,在核被膜的膜电位中产生了感兴趣的双峰。此第二峰值达到数值
‑
0.29v。尽管此峰值仅为不同于通过初始脉冲实现的最大值10mv,但是这表明脉冲长度和脉冲之间的延迟时间的优化可导致对胞内膜的影响增加。
[0256]
在该实例中,本发明人选择忽略电穿孔对细胞膜的影响以简化其分析。然而,在电穿孔的情况下,电流将被允许流动通过细胞质并且持续电位将被诱导通过胞内膜。
[0257]
分析实验参数
[0258]
图32a至图32c呈现对可以实验上控制的变量的参数分析。图32a中示出的脉冲持续时间直接影响所实现的最大u
m
以及提高u
m
高于1v临界阈值的持续时间。短于1μs 的脉冲不会提高u
m
高于此阈值。当脉冲持续时间增加超过1μs时,u
m
饱和到最大值 1.47v。相比之下,因为u
n
相比于u
m
快速上升,所以对核被膜的影响受脉冲持续时间影响最小。与脉冲宽度无关,u
n
在145ns内达到最大值。对于1μs或更小的脉冲,在使负u
n
响应减弱的正脉冲的下降沿之前u
n
并不完全归零。
[0259]
已经观察到,在提高u
m
高于1v之后,在1μs内出现孔隙形成特性,猝熄进一步增加电位(k.kinosita,i.ashikawa,n.saita,h.yoshimura,h.itoh,k.nagayama,a. ikegami,在脉冲
‑
激光荧光显微镜下观测细胞膜的电穿孔(electroporation of cellmembrane visualized under a pulsed
‑
laser fluorescence microscope),生物物理学杂志,53 (1988)1015
‑
1019),在其之后,新孔隙形成受到限制并且孔隙膨胀取代作为主导现象(k. kinosita,t.y.tsong,在人红细胞膜中控制大小的孔隙的形成和重新密封(formation andresealing of pores of controlled sizes in human erythrocyte membrane),(1977);k.kinosita, t.y.tsong,电压引发的孔隙形成和人红细胞的溶血(voltage
‑
induced pore formation andhemolysis of human erythrocytes),生物化学与生物物理学报(bba)
‑
生物膜,471(1977) 227
‑
242)。在本文中呈现的场强度处,持续时间为1μs和更短的脉冲不可有效地在细胞膜内产生孔隙膨胀(o.m.nesin,o.n.pakhomova,s.xiao,a.g.pakhomov,在用60ns 和600ns电脉冲的单细胞渗透之后对细胞体积和膜孔隙比较的操作(manipulation of cellvolume and membrane pore comparison following single cell permeabilization with 60
‑
and600
‑
ns electric pulses),生物化学与生物物理学报(bba)
‑
生物膜,1808(2011)792
‑
801)。
[0260]
样本介质的电导率(图32b)显著有助于细胞膜和核被膜的充电
‑
放电特性。在低介质电导率(0.01s/m)处,介质呈现出对电流流动的显著阻力并且细胞膜充电缓慢。此低电导率介质最小化可流经细胞质的电流,使实现的最大u
n
减弱。当介质电导率增加时,细胞膜充电更迅速,当电导率增加高于1s/m时饱和。基于这些模拟,0.2s/m的介质电导率实验上为在
膜充电时间与脉冲发生器所需要的电流输出之间的折衷。增加介质电导率可已导致稍微更快的膜充电时间。
[0261]
正极性脉冲和负极性脉冲之间的延迟(图32c)对跨膜电位(u
m
)的影响可忽略;尽管,该延迟对核被膜(u
n
)具有显著的影响。正脉冲的下降沿导致负电位在核被膜上积聚。u
n
在每个脉冲的下降沿之后约100ns达到相对最大值。对于脉冲之间的长延迟,此电位衰减回到零。相比之下,当延迟缩短时,u
n
由负极性脉冲的上升沿而复杂化。最终,当延迟降低到0.1μs时,实现u
n
的有效加倍。基于这些模拟,具有在脉冲极性改变之间的100ns延迟的脉冲串将实现跨核被膜的最大电位。违反直觉地,包括零脉冲间延迟导致u
n
低于100ns情况(结果未示出)。为实现u
n
加倍,跨核被膜的电位必须允许在施加电压断开之前衰减回到零。在此情境下,持续时间为0.94μs或更长的所有脉冲导致u
n
相对于单一脉冲最大值增加约2x。
[0262]
dna损伤在pef细胞凋亡级联中的作用尚不完全清楚,细胞核通常不是pef治疗的靶标。然而,内部和外部凋亡细胞死亡过程与对线粒体和内质网的场强度依赖影响相关联。如果波形优化可以用于加倍增加这些细胞器的跨膜电位(如图32c中所示),那么将需要较低幅值电场以引发相关联的细胞凋亡级联。可替代地,通过精细地调整脉冲宽度和脉冲间延迟,有可能增强dna损伤过程,从而允许在pef细胞凋亡级联中对此机制的进一步研究。令人遗憾的是,对良好控制的100ns至500ns脉冲间延迟情形的实验研究受到本发明人的电流系统的输出电压的振铃抑制并且留作为将来工作的目标。
[0263]
分析细胞电特性
[0264]
对于细胞膜、核被膜、细胞质和核质的电特性可容易地在文献中获得(b.alberts, d.bray,j.lewis,m.raff,k.roberts,j.d.waston,《细胞分子生物学(molecular biologyof the cell)》,第3版,garland science,纽约,1994;p.r.gascoyne,r.pethig,j.p.burt, f.f.becker,膜伴随通过介电泳研究的friend鼠红白血病细胞的诱导分化而改变 (membrane changes accompanying the induced differentiation of friend murineerythroleukemia cells studied by dielectrophoresis),生物化学与生物物理学报(bba)
‑ꢀ
生物膜,1149(1993)119
‑
126;j.yang,y.huang,x.j.wang,x.b.wang,f.f.becker, p.r.c.gascoyne,根据细胞分离准则通过电转测定的人白细胞亚群的介电特性(dielectricproperties of human leukocyte subpopulations determined by electrorotation as a cellseparation criterion),生物物理学杂志,76(1999)3307
‑
3314;i.ermolina,y.polevaya, y.feldman,b.
‑
z.ginzburg,m.schlesinger,通过时域介电谱对正常和恶性白细胞的研究 (study of normal and malignant white blood cells by time domain dielectric spectroscopy), dielectrics and electrical insulation,ieee transactions on,8(2001)253
‑
261;j.gimsa, t.m
ü
ller,t.schnelle,g.fuhr,在生理学离子强度下单个人红细胞的介电谱:细胞质的分散(dielectric spectroscopy of single human erythrocytes at physiological ionic strength: dispersion of the cytoplasm),生物物理学杂志,71(1996)495
‑
506;以及k.asami,y. takahashi,s.takashima,鼠淋巴细胞和红细胞的介电特性(dielectric properties of mouselymphocytes and erythrocytes),生物化学与生物物理学报(bba)
‑
分子细胞研究 (molecular cell research),1010(1989)49
‑
55)。subuncu等人报导了在0.3s/m与0.6s/m 之间的细胞质电导率(a.c.sabuncu,j.a.liu,s.j.beebe,a.beskok,鼠黑素瘤克隆的介电
泳分离(dielectrophoretic separation of mouse melanoma clones),生物微流体(biomicrofluidics),4(2010)021101)。labeed等人报导了当细胞开始经历细胞凋亡时电导率从0.28s/m增加到0.45s/m(f.h.labeed,h.m.coley,m.p.hughes,使用介电泳揭示的细胞凋亡细胞的膜和细胞质的生物物理学特性的差异(differences in thebiophysical properties of membrane and cytoplasm of apoptotic cells revealed usingdielectrophoresis),生物化学与生物物理学报(bba)
‑
一般学科,1760(2006)922
‑
929)。 ron等人报导了前成骨细胞和正常犬类动物肾细胞的电导率分别为0.724s/m和0.93 s/m(a.ron,r.r.singh,n.fishelson,i.,r.socher,d.benayahu,y.shacham
‑
diamand,使用介电谱基于细胞的筛选膜和细胞质标记(cell
‑
based screening for membranal and cytoplasmatic markers using dielectric spectroscopy),生物物理化学,135(2008)59
‑
68)。 mulhall等人发现对于正常角化细胞、不正常角化细胞、两种不同恶性角化细胞的细胞质电导率分别为0.71s/m、0.42s/m、0.26s/m以及0.25s/m(h.mulhall,f.labeed, b.kazmi,d.costea,m.hughes,m.lewis,通过介电泳区分的癌症、癌前和正常口腔细胞(cancer,pre
‑
cancer and normal oral cells distinguished by dielectrophoresis),分析和生物分析化学(analytical and bioanalytical chemistry),401(2011)2455
‑
2463)。另外, chen等人示出抗药细胞比非抗药细胞具有更低的细胞质电导率(j.chen,y.zheng,q. tan,e.shojaei
‑
baghini,y.l.zhang,j.li,p.prasad,l.you,x.y.wu,y.sun,使用用于在单细胞上的机械和电测量的微流体装置对细胞类型分类(classification of celltypes using a microfluidic device for mechanical and electrical measurement on singlecells),芯片实验室(lab on a chip),11(2011)3174
‑
3181)。这些结果提供了当细胞从良性转变到恶性时降低细胞质电导率的证据。
[0265]
yuan等人示出当癌细胞获得抗药性时,细胞核与细胞质(ncr)比率从0.45增加到0.49以及从0.40增加到0.49。类似地,helczynska等人组织学上示出,ncr随着肿瘤等级的变化从0.3增加到0.8,其中ncr越高,恶性癌症越严重(k.helczynska, kronblad,a.e.nilsson,s.beckman,g.landberg,s.在原位导管乳癌中低氧促进去分化表型(hypoxia promotes a dedifferentiated phenotype in ductal breastcarcinoma in situ),癌症研究(cancer research),63(2003)1441
‑
1444)。salmanzadeh 等人示出当细胞连续变得更恶性时,同系细胞系的特定膜电容从15.39mf/m2增加到 26.42mf/m2(a.salmanzadeh,m.b.sano,r.c.gallo
‑
villanueva,p.c.roberts,e.m. schmelz,r.v.davalos,研究不同阶段的同系鼠卵巢癌细胞的介电特性(investigatingdielectric properties of different stages of syngeneic murine ovarian cancer cells),生物微流体,7(2013)011809)。这转化成相对膜介电常数从8.70增加到14.92。
[0266]
使用细胞质电导率值为0.7s/m、0.475s/m以及0.25s/m,ncr为0.3、0.55以及 0.8以及膜介电常数为9、12以及15分别进行参数分析以表示从良性到中间到转移性的这一转变。本发明人建模细胞质电导率为0.7s/m、ncr为0.3以及膜介电常数为8.7的
‘
良性’细胞的响应。
‘
转移’细胞被建模为细胞质电导率为0.25s/m、ncr为0.8以及膜介电常数为15。所有其它值(表1)均保持恒定。
[0267]
细胞核与细胞质比率(ncr)(图33a)对u
m
具有可忽略的影响并且对u
n
具有可测量的影响。正如由电磁理论(p.marszalek,d.liu,t.y.tsong,schwan方程和由交替电场引发的
跨膜电位(schwan equation and transmembrane potential induced by alternating electric field),生物物理学杂志,58(1990)1053
‑
1058)所预期,跨核被膜的电位与以下方程有关
[0268]
δu=1.5recosθ/v
ꢀꢀꢀ
[13]
[0269]
其中r为细胞核的半径并且e为细胞暴露于其的电场。然而,细胞核的其它介电特性可影响膜充电时间(t.kotnik,d.对在暴露于电场的生物细胞的内膜上的电压引导的理论评估(theoretical evaluation of voltage inducement on internal membranesof biological cells exposed to electric fields),生物物理学杂志,90(2006)480
‑
491;k.h. schoenbach,s.j.beebe,e.s.buescher,超短电脉冲的胞内影响(intracellular effect ofultrashort electrical pulses),生物电磁学(bioelectromagnetics),22(2001)440
‑
448)。当在图33a中ncr增加时,u
n
也增加。细胞质电导率(图33b)对u
m
和u
n
的最大幅值的影响可忽略,然而较低的电导率值导致稍微较高的u
n
值。细胞膜的介电常数(图 33c)影响细胞膜和核被膜的充电和放电。较高的介电常数使得u
m
增加比较低介电常数细胞稍慢。这种细胞膜的较慢充电时间导致核被膜达到稍微更高的跨膜电位。
[0270]
实验脉冲的数字模拟
[0271]
图31a至图33c的模拟结果表示对具有10ns上升时间和下降时间的完美方波的理想化响应。如图34a和图34c中所示,波形展现出对上升沿和下降沿后的振铃影响。图 34b和图34d分别示出由实验250ns和1μs脉冲引起的跨膜电位(u
m
)和跨核膜电位 (u
n
)。如在理想情况下,脉冲的下降沿导致u
n
在相反极性中增加。在输出波形中的振铃导致u
n
另外微小的增加。在1500v/cm下,250ns脉冲的第一上升沿产生0.21v的 u
n
幅值最大值。相同脉冲的下降沿和振铃产生0.25v的最大u
n
幅值,增加19%。
[0272]
对于1μs实验脉冲,|u
m
|达到最大值1.24v而|u
n
|达到最大值0.32v。对于此实验脉冲的u
m
的幅值约等于图32a中预测的理想值(1.21v)。然而,对于此实验脉冲的 u
n
的幅值(0.32v)大于图32a中预测的值(0.29v)。这是由于振铃出现在实验脉冲下降回到零之后。
[0273]
当脉冲长度增加时,初始u
n
响应被允许朝零下降返回。结果是,对于较长的脉冲,负向边缘和随后振铃增加了影响。对于类似的场强度,5μs脉冲导致了从0.24v到0.36 v的u
n
幅值改变,增加50%(未示出)。对于这些情况,振铃的峰值幅值为脉冲幅值的 46%至52%并且持续小于200ns。
[0274]
实验结果
[0275]
用温度在22℃与25℃之间的初始样品进行实验。在4000v/cm下,所有实验组产生小于3.5℃的温度升高。对于50μs和250ns组成型脉冲的实验的代表性温度示出在图35中。对于具有250ns脉冲的脉冲串的温度增加类似于对于较长持续时间脉冲的增加。这可能是由于每个脉冲串中传送相等量的能量而与组成型脉冲的持续时间无关。实验的起始温度确保温度决不升高到高于37℃,从而降低温度成为影响细胞存活率的干扰因素的可能性。
[0276]
图36a至图36c示出在(图36a)1500v/cm、(图36b)3000v/cm以及(图36c) 4000v/cm的场强度下治疗后1小时和24小时的样本的存活率。在组成型脉冲长度和存活率之间存在明晰的反比关系,其中对于1小时和24小时存活率研究,较长持续时间脉冲导致较低的存活率。
[0277]
具体地说,在1500v/cm下,含有50μs脉冲(2x)的脉冲串产生31%的治疗后1 小时存活率,该31%的存活率在24小时之后减少到3%。含有250ns(400x)与10μs (10x)之间脉冲的1500v/cm脉冲串产生高于50%的1小时存活率,但是值得注意的是, 2μs(5x)和较短的脉冲具有类似于假治疗的85%或更大的存活率。在1小时与24小时时间点之间,对于在所有组成型脉冲上暴露于1500v/cm的细胞,存活率下降了平均 20%。对于此场强度,在24小时后,含有10μs脉冲的脉冲串具有最大的存活率改变, 49%,而250ns脉冲和500ns脉冲相比于对照组的存活率改变可忽略。对于具有2μs 和更长脉冲的脉冲串,显著的存活率改变发生在1小时与24小时时间点之间。然而有趣的是,10μs和50μs脉冲导致延迟的细胞死亡,作用机制尚不明确。
[0278]
当脉冲持续时间为1μs或较长时,细胞存活率对于3000v/cm与1500v/cm脉冲串显著较低。在24小时之后,在3000v/cm下,对于2μs到50μs的脉冲存活率减少到小于5%。在3000v/cm与4000v/cm之间,对于500ns脉冲出现了对存活率的最显著影响。对于所有场强度,250ns脉冲对于细胞存活率的影响最小。
[0279]
对于含有250ns脉冲的脉冲串,在1500v/cm、3000v/cm以及4000v/cm治疗之后存活率的差异在统计学上不显著(α≤0.1)。在每个时间点处,所有其它脉冲宽度在1500 v/cm与3000v/cm治疗之间具有在统计学上显著差异(α≤0.06)。在3000v/cm与4000 v/cm治疗之间,5μs(1小时)、500ns(1小时)和500ns(24小时)组具有在统计学上不同的存活率(α≤0.03)。
[0280]
有趣的是,本研究示出了存活率不与传送的能量剂量直接相关。这符合由不同脉冲宽度的单极性脉冲的电渗透(a.d.体外细胞电渗透到小分子:通过脉冲参数控制(cell electropermeabilization to small molecules in vitro:control bypulse parameters),放射学和肿瘤学(radiology and oncology),35(2001)))和致死性(b.l.ibey,a.g.pakhomov,b.w.gregory,v.a.khorokhorina,c.c.roth,m.a.rassokhin, j.a.bernhard,g.j.wilmink,o.n.pakhomova,高强度纳秒持续时间电脉冲在哺乳动物细胞中的选择性细胞毒性(selective cytotoxicity of intense nanosecond
‑
duration electricpulses in mammalian cells),生物化学与生物物理学报
‑
一般学科,1800(2010)1210
‑
1219) 作用展现出不与单独传送的能量的质量相关的复杂关系的其它作用呈现的结果。脉冲长度和所呈现的毒性之间的逆相关可以与细胞膜充电时间相关,在本文中所述细胞膜充电时间计算为1.11μs与7.92μs之间。图37a至图37l示出了每个脉冲串内多个脉冲对其中u
m
和u
n
提高到高于临界阈值的时间的影响。1500v/cm 250ns脉冲的单循环(一正和一负)增加u
m
高于1v,总共仅持续200ns。然而,每个脉冲串(总共400个脉冲) 的200个循环的累积效应增加u
m
高于1v,持续约40μs。在1500v/cm(图37a至37b) 下,当组成型脉冲宽度(δt
p
)增加时,高于1v阈值的时间增加。对于具有50μs组成型脉冲宽度的脉冲串(其仅具有一个循环),此种方法达到约99.8μs的最大值。在3000 v/cm和4000v/cm下(图37e
‑
图37f、图37i至图37j),较短脉冲的脉冲串提高u
m
高于1v持续比具有较长脉冲持续时间的那些更长的持续时间,然而,这显得对细胞存活率的影响可忽略。尽管本文中未检测,但是通电时间小于膜充电时间的脉冲可导致限制的孔隙膨胀,从而最小化致死性影响。
[0281]
在1500v/cm下,没有脉冲持续时间提高u
n
高于0.5v、0.75v或0.9v的阈值(图 37c
experience focal therapy of prostate cancer),在:b rubinsky(出版.)不可逆电穿孔(irreversible electroporation),施普林格柏林海德堡, 2010,第235
‑
247页)、胰腺(r.c.martin ii,k.mcfarland,s.ellis,v.velanovich,在局部晚期胰腺癌中的不可逆电穿孔治疗(irreversible electroporation therapy in themanagement of locally advanced pancreatic adenocarcinoma),美国外科医生学会杂志 (journal of the american college of surgeons),215(2012)361
‑
369)以及肝(r.cannon, s.ellis,d.hayes,g.narayanan,r.c.martin,用于接近于活结构的肝肿瘤的不可逆电穿孔的安全性和早期功效(safety and early efficacy of irreversible electroporation forhepatic tumors in proximity to vital structures),外科肿瘤学杂志(journal of surgicaloncology),(2012))中的不可逆电穿孔的临床应用中的那些方法一致。由本文中呈现的双极性脉冲串方法引起的相当水平的毒性指示其在体内治疗中可以是有利的,其中由于较长持续时间单极性脉冲引起的肌肉收缩是不期望的。
[0288]
实例3
[0289]
材料和方法
[0290]
胶原蛋白水凝胶肿瘤模拟物
[0291]
示出根据组织结构、癌转移和遗传变化复制人胰脏癌的ppt8182鼠原发性胰腺肿瘤细胞(von burstin,2009)(von burstin,2009;seidler,b.等人,用于通过使用鸟类逆转录病毒载体的体内条件体基因表达和抑制表现的基于cre
‑
loxp的鼠模型(a cre
‑
loxp
‑
based mouse model for conditional somatic gene expression and knockdown in vivo by using avian retroviral vectors),美国国家科学院院刊,105,10137
‑
10142(2008);saur, d.等人,cxcr4表达增加在鼠的胰脏癌模型中肝和肺癌转移(cxcr4 expression increasesliver and lung metastasis in a mouse model of pancreatic cancer),胃肠病学,129,1237
‑
1250 (2005);以及paszek,m.j.等人,张力平衡和恶性表型(tensional homeostasis and the malignant phenotype),癌细胞,8,241
‑
254(2005)以及szot,c.s.,buchanan,c.f,freeman, j.w.和rylander,m.n.基于胶原蛋白i水凝胶的3d体外生物工程改造的肿瘤(3d in vitrobioengineered tumors based on collagen i hydrogels),生物材料(biomaterials),32, 7905
‑
7912(2011))用于3d肿瘤平台实验。在37℃下、在5%co2中、在潮湿大气压下,在补充有l
‑
谷酰胺(atcc,弗吉尼亚州马纳萨斯)的含有10%胎牛血清(fbs;密苏里州圣路易斯西格玛阿尔德里奇)和1%青霉素/链霉素(加利福尼亚州卡尔斯巴德的英杰公司)的达尔伯克氏改良伊格尔培养基(dmem)中培养细胞。在80%融合处,通过胰蛋白酶化作用收集所有细胞用于实验。
[0292]
图38a至图38b示出高频beam治疗用较高频率双极性脉冲的脉冲串(图38b) 替代单个单极脉冲(图38a)。如先前所描述产生示出在图38c中的胶原蛋白i水凝胶 (szot,c.s.,buchanan,c.f.,freeman,j.w.和rylander,m.n.基于胶原蛋白i水凝胶的3d 体外生物工程改造的肿瘤(3d in vitro bioengineered tumors based on collagen i hydrogels),生物材料,32,7905
‑
7912(2011))。简言之,史泊格多利(sprague dawley) 大鼠尾腱被切除并且在室温下搅拌过夜使其溶解在10mm hcl中。所得单体胶原蛋白悬浮液以22,500x g离心30min并且倾析上清液并且储存在4℃下直到后续使用。通过用含有10x浓缩dmem(补充有4.5g/l葡萄糖、l
‑
谷酰胺、丙酮酸钠以及碳酸氢钠;弗吉尼亚州马纳萨斯美的
泰克有限公司(mediatech inc.,manassas,va))的缓冲液、1n naoh以及去离子h2o中和在hcl中的胶原蛋白i以获得在ph 7.4下为8mg/ml最终浓度而形成胶原蛋白水凝胶。将ppt8182细胞以1
×
106个细胞/毫升的最终接种密度悬浮于中和缓冲液中,并且然后与胶原蛋白i溶液混合。在聚合之后,将胶原蛋白
‑
细胞悬浮液用移液管移取到10mm直径圆筒形模中以实现3mm的厚度。在37℃下在20min凝胶时期后,将水凝胶从模中移除并且在脉冲传送之前在完全培养基中培养18小时。
[0293]
电子设备和方法
[0294]
自定义脉冲发生系统用于传送具有组成型脉冲宽度为250ns、500ns、1μs、2μs、 5μs、10μs以及50μs的双极性脉冲的脉冲串。将500ω电阻器与负载并联放置以确保正确的脉冲成形并且防止向开路传送脉冲。常规电极由具有2.0mm边缘到边缘分离距离的中空的、1.27mm直径分配针(堪萨斯州埃尔多拉多霍华德电子仪器有限公司 (howard electronic instruments inc.,el dorado,ks))制得。
[0295]
在540v
峰
和用于所有脉冲宽度的100μs的总通电时间下进行试点研究。此方法使用400个、200个、100个、50个、20个、5个或2个脉冲以分别包含具有单独脉冲持续时间为250ns、500ns、1μs、2μs、5μs、10μs或50μs的脉冲串。在540v
峰
下,对于含有1μs或更小脉冲的脉冲串的消融区未很好地形成围绕电极的卵形。反而,死细胞占据扩展但并未连接在两个电极之间的小三角形区。电场强度在此区中快速改变,导致电场阈值计算的大变化。为了避免这种情况,较高电压650v用于250ns、500ns、1 μs以及2μs组。为了有助于组之间的比较,使用简化的电剂量公式。
[0296]
剂量=v2*t
p
*n*n[v2s]
ꢀꢀꢀ
[14]
[0297]
其中v为施加电压,t
p
为脉冲宽度,n为每个脉冲串的脉冲数并且n为每次治疗的脉冲串数,其保持为恒量80。540v
峰
组具有约2300v2s的剂量。在650v
峰
处,256个、128个、64个以及32个脉冲分别用于250ns、500ns、1μs以及2μs组。这产生约2200 v2s的剂量。在250v
峰
具有216个脉冲下的另外2μs组,还进行了约2000v2s的剂量以比较能量和致死性电场阈值的影响。
[0298]
为探究脉冲串通电时间的影响,在540v下用含有2μs脉冲的80个脉冲串进行了一系列实验。具有2μs脉冲间延迟的每个脉冲串的脉冲被重复2次、24次或50次。为了比较脉冲的
‘
扩散’和
‘
脉冲串’传送,测试了每秒50个脉冲的另外组。在此组中,每20ms传送了具有2μs脉冲间延迟的一个正脉冲和一个负脉冲,总共80秒。其中不使用1秒脉冲串间延迟是所呈现的唯一组。
[0299]
为探究治疗时间的影响,用八个脉冲串进行了一系列实验。这些组具有2μs、50μs 以及100μs脉冲,每个脉冲串的这些脉冲分别被重复50次、2次以及1次。实验参数概括在图39的表中。所有参数被重复最少三次(n=3)。
[0300]
样品处理
[0301]
在治疗后的24小时处,正常培养基用2.5ml补充有4μm钙黄绿素am(活的染色剂,λ
em
=515nm,俄勒冈州尤金英杰公司(invitrogen,eugene,or))的培养基替换并且在37℃下孵育30分钟。在观测之前五分钟,培养基用75μl的1.5mm碘化丙锭(pi;死的染色剂,λ
em
=617nm,俄勒冈州尤金英杰公司)补充5分钟。最后,用pbs冲洗水凝胶以冲掉任何未被吸收的染料并且增加信噪比。具有20x物镜的徕卡(leica)dmi 6000荧光显微镜(伊利诺斯州布法
罗格罗夫徕卡显微系统有限公司(leica microsystemsinc.,buffalo grove,il))用于平铺一系列图像并且仅在表面下重构治疗架构的整个平面。
[0302]
在组织模拟物中分析电场阈值
[0303]
有限元模型产生在comsol multiphysics(版本4.2a,马萨诸塞州伯林顿comsol 有限公司(version 4.2a,comsol inc.,burlington,ma))中。胶原蛋白水凝胶被建模为具有5mm半径和1.2s/m电导率的3mm厚圆柱体。表示1.27mm外径电极的圆柱体是偏移的以使得其边缘到边缘距离等于2mm。在溶液域内,电流模块用于求解以下方程:
[0304][0305][0306][0307]
其中u为电位,e为电场,j为电流密度,q为电流源,σ为电导率,ε
r
为相对介电常数并且ε0为自由空间的介电常数。围绕一个电极的边界被指定为恒定电位。
[0308]
u=u[v]
ꢀꢀꢀ
[15]
[0309]
另一个电极的边界被指定为相对接地
[0310]
u=0/v
ꢀꢀꢀ
[5]
[0311]
剩余边界被定义为电绝缘
[0312]
n
·
j=0/(a/m)
ꢀꢀꢀ
[6]
[0313]
其中n为相对于表面的法向量,j为电流。
[0314]
对于540v和在80秒内100μs通电时间,使用修改后的工作循环方法(arena,c.b. 等人,用于在没有肌肉收缩情况下的非热消融的高频不可逆电穿孔(h
‑
fire) (high
‑
frequency irreversible electroporation(h
‑
fire)for non
‑
thermal ablation without muscle contraction),生物医学工程在线(biomed eng online)10(2011);neal,r.e.,第2,garcia,p.a.,robertson,j.l.和davalos,r.v.,在用于不可逆电穿孔治疗计划的脉冲电场期间组织电导率的实验表征和数字建模(experimental characterization and numerical modeling of tissue electrical conductivity during pulsed electric fields for irreversible electroporation treatment planning),ieee期刊
‑
生物医学工程(ieee trans biomed eng),59,1076
‑
1085(2012))计算由于焦耳加热引起的温度改变。通过暂时求解修正后的热传导方程来获得温度分布(t):
[0315][0316]
其中τ为脉冲持续时间,p为脉冲的周期,k为热导性,c为恒定压力下的比热并且ρ为密度。外部边界处理为对流冷却
[0317][0318]
其中外部温度(t
外部
)为22℃并且热传递系数(h)为25(w m
‑2k
‑1)。中间时间步骤用于确保每秒采用至少一个步骤。在540v下,模拟显示出热效应对电场分布产生的影响可忽
略并且在随后模型中忽略由于温度增加引起的电导率改变以最小化计算时间。由于在架构内的低细胞浓度,类似地忽略由于电穿孔引起的电导率的改变。为了复制实验上测量的值,在一个电极上的电压以10v的步长在470v至700v之间扫描并且另一个电极保持接地。
[0319]
使用imagej(版本1.43u,美国国家卫生研究院(national institutes of health,usa)) 检测接近水凝胶表面的平铺图像(图38d至图38g中的代表性实例)。测量已经吸收pi 的细胞区域(死区)的宽度和高度。然后,这些值与来自数字模拟的电场强度相关联以确定细胞死亡所需要的电场阈值(arena等人,2012)。使用置信水平为99%(α=0.01) 的jmp(版本10.0pro,北卡罗来纳州凯里sas有限公司)完成数据的统计分析。
[0320]
鼠肿瘤模型
[0321]
本研究由弗吉尼亚技术机构动物护理及使用委员会(virginia tech institutionalanimal care and use committee)批准。6至7周大hsd:无胸腺裸体
‑
foxn1
nu
雄鼠(弗吉尼亚州都柏林哈兰公司(harlan,dublin,va))在背外侧的侧面区域中用人胶质母细胞瘤细胞(dbtrg
‑
05mg)皮下接种同时通过吸入3%异氟醚(伊利诺斯州雅培公园雅培实验室(abbott laboratories,abbott park,il))麻醉。在无特定病原体条件下将鼠以五只为一组关养在独立通气笼具中并且允许获得灭菌水和食物。在接种之前,使用标准技术将细胞培育在含有10%fbs和1%青霉素/链霉素的dmem(补充有l
‑
谷酰胺的高葡萄糖;犹他州洛根赛默科技(thermo scientific,logan,ut))中。在达到80%融合之后,细胞以5
×
106个细胞/毫升的浓度悬浮在pbs和基质胶(加利福尼亚州圣何塞碧迪生物科学公司(bd biosciences,san jose,ca))的85/15混合物中。此最终悬浮液的200μl等分试样用于每次注射(总共1
×
106个细胞)。
[0322]
随着时间推移使用卡尺测量肿瘤生长并且根据修正的椭球公式(jensen,m.m., jorgensen,j.t.,binderup,t.和kjaer,a.,通过显微ct测量的皮下鼠异种移植中的肿瘤体积比通过18ffdg
‑
显微pet或外部卡尺测定的更精确和可再现性(tumor volume insubcutaneous mouse xenografts measured by microct is more accurate and reproduciblethan determined by 18ffdg
‑
micropet or external caliper),bmc医学成像(bmc medicalimaging),8,16(2008))计算体积(v)。
[0323][0324]
其中l为纵向直径的长度并且w为横向直径的宽度。当最大直径达到约5mm时,治疗肿瘤;治疗组示出在图44的表中。按照相同的异氟醚吸入的方法来麻醉鼠,并且在肿瘤上的皮肤用70%异丙醇备用。然后,使常规钢针电极()前进到肿瘤的中心中。0.4cm间距(中心到中心)用于所有治疗中。在所有治疗组中,设定脉冲发生系统以传送其最大值1000v峰输出。将每个脉冲串的通电时间固定到100μs并且以1hz 的重复率传送脉冲串2分钟。
[0325]
在治疗之后,将表面抗生素软膏施加到针插入创伤处。将鼠从麻醉中移出并且提供在1ml无菌生理盐水溶液中稀释的5mg/kg酮基布洛芬镇痛剂,用于恢复。如果肿瘤体积达到800mm3,那么出于人道原因在治疗后30天或更早将鼠安乐死。
[0326]
将任何呈现的肿瘤组织的样本切除并且切片用于处理。代表性组织保存在10%中
性缓冲的福尔马林中并且嵌入于石蜡中。福尔马林保存、石蜡嵌入的样本经切片且处理用于使用苏木精和伊红(h&e)染色的组织结构。用徕卡dmi 6000倒置显微镜获得所有的显微照片。
[0327]
结果
[0328]
beam治疗脉冲宽度、脉冲数以及总通电时间影响致死电场阈值
[0329]
典型的ire治疗涉及以1hz的重复率传送80个单极脉冲,每个单级脉冲具有100μs 的持续时间。使用ppt8182细胞系和相同的组织模拟物,arena等人(arena等人,2012) 发现用于此标准方法的致死阈值为501v/cm。图40a示出了当单极脉冲被相等电剂量的双极脉冲的脉冲串替换时的致死阈值。发现对于含有0.25μs、0.5μs、1μs、2μs、5μs、 10μs以及50μs脉冲的脉冲串,致死电场阈值分别为2022v/cm、1687v/cm、1070v/cm、 755v/cm、640v/cm、629v/cm以及531v/cm。
[0330]
所测量的温度曲线与数值上预测的那些很好地相关(图40c)。在传送80个脉冲之后,这些脉冲的模拟预测在组织模拟物的中心处温度增加约12℃。实验上,所有组的平均温度增加为14.4
±
2.2℃。在室温下进行实验并且实验上测量的最大温度为34.8℃。最大温度的最大变化(3.2℃)出现在2μs组与50μs组之间。
[0331]
对具有2μs和50μs脉冲的脉冲串进行用8个和80个脉冲串的治疗。作为对比,用持续时间为100μs的8个或80个单极脉冲进行治疗(图41a)。发现对于2μs、50μs 以及100μs组,8个脉冲的阈值分别为1675v/cm、1211v/cm以及820v/cm。发现80 个脉冲的对应阈值为756v/cm、531v/cm以及501v/cm。
[0332]
为探究发明人的相等剂量近似的局限性,以三种不同的电压:250v、540v以及 650v传送保持恒定的具有2μs脉冲的八十个脉冲串。对于这些情况,含有216个、50 个以及32个脉冲的每个脉冲串分别产生约2000v2s、2300v2s以及2200v2s的剂量。对于这些治疗的细胞死亡阈值为663v/cm、718v/cm以及822v/cm(图41b)。在99%置信水平(α=0.01)下,发现250v组和650v组在统计学上是不同的。
[0333]
对于具有2μs脉冲的脉冲串,当电压保持恒定在540v,但是每个脉冲串的通电时间从100μs降低到48μs或4μs时,发现电场阈值分别从718v/cm增加到855v/cm和1110v/cm(图41c)。100μs与48μs之间的差异在统计学上不显著。
[0334]
图41d示出了脉冲间延迟对致死电场阈值的影响。在540v下,2μs脉冲之间的脉冲间延迟从2μs增加到200μs。类似于
‘
脉冲串’,这种
‘
扩散’治疗每秒通电100μs 并且传送此波形80秒。脉冲间延迟的这种改变导致电场阈值从718v/cm增加到770 v/cm;这种差异在统计学上是显著不同的。
[0335]
beam治疗抑制体内肿瘤生长
[0336]
在治疗时,对于假治疗、5μs、2μs以及1μs组,肿瘤平均为91mm3、101mm3、 45mm3以及44mm
3。
治疗后三十天,这些平均值改变为332mm3、62mm3、16mm3以及44mm3(图42e)。在第30天,四个假肿瘤中的三个的大小增加多于两倍(图42a)。在研究结束时第四个的大小并未显著增加并且测量为92mm3。在1μs、2μs以及5μs 组(图42b至图42d)中,肿瘤在观察到消退之前的1至5天内,展现出变化的大小增加。在研究结束时,1μs组具有两个完全的消退。其它两个肿瘤在第30天测量为85mm3和91mm3。2μs组具有1个完全的消退并且另一个肿瘤在第30天上测量为32.9mm3(图 42c)。5μs组具有3个完全的消退。剩余肿瘤的体积为77mm3、77mm3、
97mm3、106 mm3以及144mm3。图42e示出了在30天试验内每个治疗组的平均肿瘤体积。
[0337]
体内治疗后,立即出现了肿瘤的白化。这与减少的血流和水肿的开始阶段相关联(图 43b)。基于电穿孔治疗的这种特征性抗血管影响已经在电化学疗法(ect)中被采用以治疗出血癌转移(jarm,t.,cemazar,m.,miklavcic,d.和sersa,g.,电化学治疗的抗血管影响:在治疗出血癌转移中的意义(antivascular effects of electrochemotherapy: implications in treatment of bleeding metastases),抗癌治疗专家评论(expert revanticancer ther),10,729
‑
746(2010))。由于使用未绝缘的电极,覆盖肿瘤的皮肤与肿瘤一起被杀死。这使得在治疗后1天内形成痂(图43c),所述痂通常在两周内消散。在组织采集之前和在组织采集之后立即拍摄的终点图像示出在beam治疗之后30天完全肿瘤消退的证据(图43d至图43g)。
[0338]
图43h至图43i示出来自假治疗组(图43h)和5μs治疗组(图43i)中鼠的研究终点的组织学切片。尽管在治疗的鼠中未观察到可测量肿瘤的事实,但是活的胶质母细胞瘤细胞的叶窝存在位于肌肉组织上方的血管周围。类似的特征见于假鼠中,其中在肌肉层下方添加活的肿瘤块。包括活的肿瘤的细胞显示由明确标记的细胞质和明确定义的细胞膜包围的大细胞核。另外,在肌肉与脂肪层之间的界面处,沿着肿瘤的边缘存在健康血管的证据。
[0339]
论述
[0340]
对于双极脉冲的脉冲串,引发细胞死亡所需要的电场阈值与组成型脉冲的持续时间成逆相关(图40a)。当脉冲持续时间从50μs降低到2μs时,致死阈值稍微增加。对于具有1μs脉冲的脉冲串,细胞死亡的阈值约为具有50μs脉冲的脉冲串的阈值的两倍,并且250ns脉冲具有比50μs治疗大约四倍的阈值。图40a中示出的治疗所有都接收80 个脉冲串中的相等剂量。
[0341]
图40b示出了由san等人(sano,m.b,arena,c.b.,dewitt,m.r.,saur,d.和davalos, r.v.,用于不可逆电穿孔治疗的体外双极纳秒和微秒电脉冲脉冲串(in
‑
vitro bipolar nano
‑ꢀ
and microsecond electro
‑
pulse bursts for irreversible electroporation therapies),生物电化学(bioelectrochemistry),100,69
‑
79(2014))和arena等人(arena等人,2012)对于悬浮于培养基中和在1500v/cm电压与距离比率下,暴露于80个单极100μs脉冲或 80个具有250ns与50μs之间脉冲的双极性脉冲串(每个脉冲串通电100μs)的ppt8182 细胞改编的数据。在悬浮液中,具有2μs或较短脉冲的脉冲串不会影响细胞存活率。相比之下,对于具有1μs或较长的脉冲的脉冲串,1500v/cm足以杀死组织模拟物中的所有细胞。
[0342]
当细胞在悬浮液中时,它们呈现更为球形的形态。相比之下,当在3d组织模拟物中生长时,它们开始伸展并且获得更自然的表型。在体内,通常在暴露于约500v/cm 至750v/cm(garcia,p.a.等人,颅内非热不可逆电穿孔:体内分析(intracranialnonthermal irreversible electroporation:in vivo analysis),膜生物学杂志(journal ofmembrane biology),236,127
‑
136(2010);d.,d.,mekid,h.和 mir,l.m.,在用于电热治疗和用于基因治疗的dna电转移的组织中体内电场分布的验证模型中观察到ire(a validated model of in vivo electric field distribution in tissues forelectrochemotherapy and for dna electrotransfer for gene therapy),生物化学与生物物理学报(bba)
‑
一般学科,1523,73
‑
83(2000);以及edd,j.f.,horowitz,l.,
davalos,r.v., mir,l.m.和rubinsky,b.,新病灶性组织消融技术的体内结果:不可逆电穿孔(in vivoresults of a new focal tissue ablation technique:irreversible electroporation),biomedicalengineering,ieee transactions on,53,1409
‑
1415(2006))并且在这些3d组织模拟物中预测的场强度更可能表示用于双极脉冲串的体内阈值。然而,仍需要大量的体内评估以确定如何比较这些阈值和消融复杂不均匀的组织所必需的那些阈值,所述复杂不均匀的组织如含有健康细胞和恶性细胞的胰腺肿瘤、血管、延性系统以及结缔组织。
[0343]
电基因(egt)和ect方法通常采用8个脉冲,其目标是渗透细胞膜而不诱发细胞死亡。图41a示出了在8个单极100μs脉冲与双极50μs脉冲串之间存在显著差异。这是感兴趣的,因为当脉冲串数增加到80个时这些组没有显著不同。增加脉冲数显著减少了所有组的致死电场阈值。在8个脉冲与80个脉冲之间,对于2μs双极组、50μs双极组以及100μs单极组,阈值分别下降了920v/cm(55%)、679v/cm(56%)以及319 v/cm(39%)。有趣的是,对于具有2μs脉冲的80个脉冲串的致死阈值与8个单极100 μs脉冲的致死阈值相同。尽管本文中未研究,但是使用双极性脉冲可允许研究者使用 egt或ect治疗较大的体积而没有有害的致死影响。
[0344]
当电压设定为540v并且每个脉冲串的通电时间为100μs时,具有1μs、500ns以及250ns的方法未能在组织模拟物中产生连接的病变。这使得难以准确地计算致死电场阈值。在本发明人的初始试点研究中,本发明人发现增加电压到650v同时传送具有100 μs通电时间的80个脉冲导致胶原蛋白基质的热变性。arena等人(arena等人,2012) 使在ire期间的胶原蛋白变性与大于45℃的温度相关联。在650v下,使通电时间减少到64μs,与540v和100μs类似的剂量对于所有组产生形成很好的卵形病变。本发明人使用此较高电压、相等剂量方法用于具有1μs脉冲和更短脉冲的所有组。
[0345]
在图41b中,本发明人使用具有2μs脉冲的脉冲串研究此相等剂量假设的有效性,其在测试的最低电压250v下形成连接的病变。在99%置信水平(α=0.01)下,在650v 与540v下相等剂量方法之间与在540v与250v方法之间都没有统计学差异,并且在 95%置信水平(α=0.05)下,三个组之间没有统计学差异。这指示在3d肿瘤模拟物模型中,相等剂量近似足以用于比较方法。
[0346]
尚不明确在此范围(250v至650v)之外多远相等剂量假设是有效的。然而,临床 ire系统目前限于2700v的输出。在此电压下,通电4μs的脉冲串将具有相等剂量和约750v/cm的致死阈值(来自图41b的值的平均值)。图41c示出了当脉冲串通电100 μs与4μs时,致死阈值减少35%。如果这两个影响具有相加性,那么预期具有2μs脉冲的80个脉冲串(每个脉冲串通电100μs(剂量≈58,000v2s))的方法具有约460v/cm 的致死阈值。这指示beam治疗应该能够根据目前采用的临床系统来产生类似的消融体积。然而,将需要大量的体内测试和消融体积的测量以验证这种情况。
[0347]
在鼠肿瘤模型上的先前体内ire实验需要施加具有1000v
峰
幅值或更大的脉冲以获得类似尺寸肿瘤的完全消退。当通过具有2.3mm电极间距的双极性探头施加100个单极脉冲(每个单极脉冲具有100μs的持续时间和1300v
峰
(5600v/cm))时,neal等人 (neal ii,r.e.等人,通过使用新颖微创单个针头电极施加不可逆电穿孔治疗乳癌 (treatment of breast cancer through the application of irreversible electroporation using a
novel minimally invasive single needle electrode),乳癌研究和治疗(breast cancer research and treatment),123,295
‑
301(2010))在7只鼠的5只中实现完全消退。当80个脉冲 (每个脉冲具有100μs的持续时间和1000v
峰
(2500v/cm))施加在间隔开4mm的板电极之间时,al
‑
sakere等人(al
‑
sakere,b.等人,用不可逆电穿孔的肿瘤消融(tumorablation with irreversible electroporation),公共科学图书馆
·
综合(plos one),2,e1135 (2007))在13只鼠的12只中实现完全消退。
[0348]
为模拟临床方法,在本研究中通过两个针头电极施加治疗。0.4mm的间距用于最大化肿瘤的覆盖度同时解释对发明人脉冲发生系统的1000v
峰
限制。在这些体内实验中使用的0.4mm直径电极显著小于临床上使用的1mm直径电极和肿瘤模拟物中使用的1.27 mm电极。电极直径与电场分布紧密相关并且较小电极将产生较小的消融区。为了解释这种情况,所传送的脉冲串数增加到120以提供最佳的可能结果同时避免大量的热加热效应。光泽和组织学检查并未指示任何来自热损伤的疤痕形成。
[0349]
在治疗组中,在治疗后的前1天至5天,所测量的肿瘤体积增加。伴随水肿出现的痂的形成可在短期疗效期间已导致对肿瘤体积的过高估计。在治疗传送之后的两周内,痂消退并且可观测到肿瘤消退的证据。
[0350]
此治疗方案抑制肿瘤生长。在研究结束时,治疗组中的平均肿瘤体积显著小于对照的体积。由于iacuc方法的有限时间跨度,尚不明确肿瘤是否将进入治疗后指数生长时期并且本发明人不能够获得卡普兰
‑
迈耶(kaplan
‑
meier)存活曲线。总共,在治疗之后 30天14只治疗鼠中的6只没有可测量的肿瘤迹象,并且所有的方法都能够实现一些完全的消退。将来的工作应该包括在动物的寿命内监测肿瘤消退的长期研究。
[0351]
一些治疗动物的组织学检查揭示真皮层中肌肉筋膜表面的赘生性细胞的叶窝,其指示在治疗情况下。可以通过使用具有较高施加电压、增加的脉冲串数和/或每个脉冲串的较高通电时间的方法获得更好地消退结果是可能的。应注意al
‑
sakere呈现的工作并没有获得100%消退率,然而,其方法已经成功地用于人类临床应用,结果很好。
[0352]
结论
[0353]
本研究示出了对于ire方法和beam方法的致死阈值的差异。尽管传送相等的剂量,但是具有较短组成型脉冲的脉冲串通常需要较高的电场强度用于消融。脉冲串数、每个脉冲串的通电时间以及脉冲持续时间是影响致死阈值的所有显著因素。使用80个脉冲串,本发明人发现1μs、2μs以及5μs脉冲的电场阈值为1070v/cm、755v/cm以及640v/cm。当在体内传送200个脉冲串时,这些脉冲对肿瘤体积具有类似的影响。当相比于未经治疗对照时,经beam对照的所有鼠很好地耐受治疗并且经历肿瘤体积的显著减少。每组达到至少一个完全消退。本研究提供了beam可以用于肿瘤消融的强有力证据并且保证了将来的研究。
[0354]
实例4
[0355]
方法
[0356]
细胞培养
[0357]
在37℃下、在5%co2中、在潮湿培育箱中,将u
‑
87mg原发性人胶质母细胞瘤细胞(attc)、d1tnc1鼠星形胶质细胞(attc)和c6鼠胶质母细胞瘤细胞(attc) 培养在含有10%胎牛血清(fbs)和1%青霉素/链霉素(ps)的达尔伯克氏改良伊格尔培养基(dmem)中。在37℃、在5%co2中、在湿润培育箱中,将正常人星形胶质(nha) 细胞(lonza)培养在星形胶质
细胞生长培养基(lonza)中。细胞以1
×
106个细胞/毫升的密度接种在水凝胶中。在37℃下、在5%co2中、在湿润培育箱中,将水凝胶浸没在对于细胞类型的适当生长培养基中并且在水凝胶内维持细胞存活力高达7天(图46a)。
[0358]
3d胶原蛋白架构的构造
[0359]
通过将鼠尾腱溶解在乙酸中,接着如先前所述冷冻和冻干来制备i型胶原蛋白的储备液(arena等人2012)。产生了胶原蛋白的两种不同的储备溶液浓度:4.5mg/ml和30 mg/ml。最终浓度为2mg/ml和20mg/ml的架构由浓缩的胶原蛋白储备液制备以产生 0.2%(w/w)和2%(w/w)的胶原蛋白凝胶。通过混合酸溶解的胶原蛋白与10x dmem (10%的总胶原蛋白溶液体积)以及充分体积的1n naoh,直到实现在7.0
‑
7.4范围内的 ph,产生中和的胶原蛋白溶液。将中和的胶原蛋白与悬浮于dmem的细胞混合以实现在最终胶原蛋白混合物中的1
×
106个细胞/毫升的细胞密度。小心地用刮刀混合溶液以确保在整个胶凝中均匀分布而不会损坏细胞。然后,将胶原蛋白溶液施配到具有10mm直径和1mm深度的切口的聚二甲基硅氧烷(pdms)模具中并且模塑平整以确保一致的架构几何形状。本发明人的关于氧气(o2)通过肿瘤细胞的消耗速率的先前数学建模和实验(verbridge,s.s.等人,氧气
‑
控制的三维培养物以分析肿瘤血管生成 (oxygen
‑
controlled three
‑
dimensional cultures to analyze tumor angiogenesis),组织工程.a部分(tissue engineering.part a),16,2133
‑
2141,doi:10.1089/ten.tea.2009.0670 (2010)(“verbridge等人,2010”))确认,在此细胞密度和架构厚度下,在整个架构深度中o2浓度是均一的。在37℃和5%co2下,使胶原蛋白聚合45分钟。
[0360]
3d海藻酸盐架构的构造
[0361]
使用与用于胶原蛋白相同的pdms模具产生海藻酸钙凝胶,产生直径10mm和厚度1mm的圆盘。使用粉末状海藻酸盐(protanal lf 10/60,fmc生物聚合物)制备两种海藻酸盐胶凝储备液浓度(0.4%和4.0%(w/v),所述粉末状海藻酸盐溶解于缓冲液中、渗析、冷冻和冻干,接着在无血清dmem中重新组成,如本发明人先前已经报导 (verbridge,s.s.等人,氧气
‑
控制的三维培养物以分析肿瘤血管生成(oxygen
‑
controlledthree
‑
dimensional cultures to analyze tumor angiogenesis),组织工程.a部分(tissueengineering.part a),16,2133
‑
2141,doi:10.1089/ten.tea.2009.0670(2010))。选择海藻酸盐浓度以在机械刚度中横跨宽范围,类似于所使用的胶原蛋白浓度。将海藻酸盐溶液与以1
×
106个细胞/毫升密度的细胞混合并且施配到pdms模具中并用多孔膜模塑平整。通过在施配在多孔膜覆盖层的0.1m cacl2下浸没45min使海藻酸盐水凝胶交联。然后,在在37℃、5%co2下,将海藻酸盐水凝胶培养在补充有10%fbs和1%ps的 dmem的24个孔板中。
[0362]
测定形状因子
[0363]
u
‑
87细胞、nha细胞、d1tnc1细胞以及c6细胞单独接种在先前所述的四个条件 (0.2%,2%胶原蛋白,0.4%,4%海藻酸盐)中一个的水凝胶中。在培养细胞24小时之后,水凝胶使用4%福尔马林固定并且使用40mg/ml牛血清白蛋白(bsa)和0.5% triton
‑
x阻碍和渗透。细胞肌动蛋白用alexa flour 568毒伞素(加利福尼亚州卡尔斯巴德生命技术公司(life technologies,carlsbad,ca))染色而细胞核用二氨基苯基吲哚 (dapi;密苏里州圣路易斯西格玛
‑
阿尔德里奇)染色。使用zeiss lsm510(纽约桑伍德 carl zeiss显微镜有限责任公司(carl zeiss microscopy llc,thornwood,ny))激光扫描共焦显微镜观测细胞。
染色的细胞然后用于测定对于在四个条件中每个中的细胞的细胞形状因子。在image j(马里兰州贝塞斯达美国国立卫生研究院(nih,bethesda,md)) 中完成图像分析以确定细胞的核面积、核周长、细胞质面积、细胞质周长以及最长和最短的直径。每个水凝胶测量至少四个细胞并且对于每个条件分析至少5个水凝胶。
[0364]
活体荧光成像
[0365]
u
‑
87细胞在正常培养条件下培养并且用以每个细胞10个粒子的浓度添加到培养基的celllight nucleus
‑
rfp,bacman 2.0(俄勒冈州尤金分子探针公司(molecular probes, eugene,or))和celllight tubulin
‑
gfp(俄勒冈州尤金分子探针公司)孵育16个小时。细胞然后传代并且以1
×
106个细胞/毫升的密度接种到最终浓度为0.2%胶原蛋白的水凝胶中。在细胞在胶原蛋白水凝胶中培养24小时之后,在zeiss观测器z1显微镜(纽约桑伍德carl zeiss显微镜有限责任公司)的载物台上执行水凝胶的电穿孔以允许在治疗期间成像。在启动脉冲治疗之前立即拍摄单个细胞的图像,并且然后在脉冲开始之后5 分钟,每30秒拍摄一次。细胞在暴露于ire治疗或beam治疗之后成像。还使未暴露于脉冲的细胞成像,作为对照。
[0366]
3d架构的电穿孔
[0367]
在具有恒定电特性的水凝胶中执行脉冲电穿孔实验。用电导率仪测量胶凝细胞混合物中每个的电导率以确保类似的电特性(0.98
±
0.04s/m)。使用ecm 830脉冲发生器(马萨诸塞州霍利斯顿哈佛仪器公司(harvard apparatus,holliston,ma))产生ire脉冲并且通过常规电极传送到组织。使用定制的脉冲发生系统(inspire 2.0,弗吉尼亚州布莱克斯堡voltmed有限公司(voltmed inc.,blacksburg,va))传送高频脉冲。具有直径为 0.87mm,边缘到边缘分离3.3mm的两个固体不锈钢圆柱体用作电极。
[0368]
传送总共50个方形脉冲(ire)或1μs脉冲(beam)的50个脉冲串来执行治疗。 ire方法以每秒1个脉冲的重复率传送100μs脉冲。在beam方法中,以每秒1个脉冲串的重复率传送由具有5μs脉冲间延迟的100x 1μs脉冲组成的脉冲串。对于ire治疗,脉冲幅值设定为450v
峰
,而对于beam治疗,700v
峰
用于产生与ire组大体相同体积的消融。
[0369]
水凝胶中的有限元分析
[0370]
使用comsol multiphysics(版本4.3,加利福尼亚州帕洛帕洛阿尔托comsol有限公司(comsol inc.,palo alto,ca))的有限元模型用于求解拉普拉斯方程以发现对于所用各不同电压的在水凝胶内的电场分布。comsol multiphysics还用于求解焦耳加热方程以计算水凝胶中的温度分布,作为各个治疗的结果。模拟几何形状被建模为10 mm直径和1mm厚的具有横跨水凝胶深度的两个钢电极圆柱体(d=0.87mm)的圆柱体。网格被细化直到连续改进之间的误差小于1%。最终网格含有47,438个成分并且在 pentium i3处理器上约3分钟发现溶液。
[0371]
单独细胞的有限元分析
[0372]
使用有限元模型以及阻抗边界条件方案建模跨细胞膜和核被膜的跨膜电位(sano, m.b.,arena,c.b.,dewitt,m.r.,saur,d.和davalos,r.v.,用于不可逆电穿孔治疗的体外双极纳秒和微秒电脉冲脉冲串(in
‑
vitro bipolar nano
‑
and microsecondelectro
‑
pulse bursts for irreversible electroporation therapies),生物电化学,100,69
‑
79, doi:doi 10.1016/j.bioelechem.2014.07.010(2014))。这些有限元模型用于
数值上研究代表性细胞几何结构对模拟ire和beam脉冲的响应。基于在imagej图像分析软件 (马里兰州贝塞斯达美国国立卫生研究院)中由共聚焦显微镜图像得到的平均测量值测定细胞几何形状。使用u
‑
87细胞在两种不同胶原蛋白密度(0.2%,2%)中的几何结构以及四种不同细胞类型(u
‑
87,nha,c6,d1tnc1)在0.2%胶原蛋白基质中的几何结构。使用comsol multiphysics中的2d
‑
轴对称平台求解所有模型。单独的电流物理学模块用于每个域(介质、细胞质、核质)。具有300μm侧边较大介质域用于避免任何显著的边界影响。细胞和细胞核被建模为半卵形,其中其长度和宽度根据来自共聚焦显微镜图像的测量值而变化。
[0373]
使用电流模块在时域中求解模拟。为解释由细胞膜和核被膜造成的电阻和电容,基于现有文献细胞核和细胞质的边界被指定为具有阻抗特性。
[0374]
致死阈值的测定
[0375]
通过在传送治疗之后24小时在水凝胶上首先执行活
‑
死染色来测定细胞死亡的阈值。活细胞用钙黄绿素am(加利福尼亚州哈沃德biotium公司(biotium,hayward,ca)) 染色并且发绿色荧光而死细胞用乙锭均二聚体iii(加利福尼亚州哈沃德biotium公司) 染色并且发红色荧光。使用imagej图像分析软件测量染红色的死区域的直径。将消融区的几何测量映射到有限元模型以计算在架构治疗期间的电场(图46c)。在活和死区域的边缘处的电场幅值被认为是对于给定细胞类型的细胞死亡的电场阈值。
[0376]
犬类动物体内治疗
[0377]
所有犬类动物体内研究均由机构动物护理及使用委员会批准(08
‑
218
‑
cvm)。根据先前描述的方法在麻醉的正常犬类动物受试者的大脑中和在具有自发性恶性神经胶质瘤的狗中执行ire治疗(edd,j.f.和davalos,r.v.,用于治疗计划的不可逆电穿孔的数学建模(mathematical modeling of irreversible electroporation for treatment planning),癌症研究和治疗技术(technology in cancer research&treatment),6,275
‑
286,doi: 10.1177/153303460700600403(2007)(“edd和davalos,2007”);garcia,p.a.等人,用于犬类动物患者中颅内恶性神经胶质瘤的非热不可逆电穿孔(n
‑
tire)和佐剂分馏放射性治疗多峰治疗(non
‑
thermal irreversible electroporation(n
‑
tire)and adjuvantfractionated radiotherapeutic multimodal therapy for intracranial malignant glioma in acanine patient),癌症研究和治疗技术,10,73
‑
83(2011);rossmeisl,j.h.,garcia,p.a., roberston,j.l.,ellis,t.l.和davalos,r.v.,非热不可逆电穿孔(n
‑
tire)引发的犬类动物大脑的消融(pathology of non
‑
thermal irreversible electroporation(n
‑
tire)
‑
inducedablation of the canine brain),兽医科学杂志(journal of veterinary science),14,433
‑
440, doi:10.4142/jvs.2013.14.4.433(2013)(“rossmeisl等人,2013”))。在携带肿瘤的狗中,在ire消融之前执行对大脑病变的活组织检查以允许对肿瘤的组织病理学诊断和分级,并且消融区域的另外活组织检查在ire的24小时内获得以表征ire治疗的影响。
[0378]
病理组织形态学染色
[0379]
将来自正常和经ire治疗的携带肿瘤的狗的存档、石蜡嵌入、横向定向的大脑切片取回,切割成5μm厚,安装在带正电载玻片上并且通常地用苏木精和伊红染色(edd 和davalos,2007;rossmeisl等人,2013)。用电荷耦合装置数码相机(尼康ds
‑
fi1c,日本尼康(nikon,japan))和市售的成像分析软件系统(nis元件ar,日本尼康)采集表示大脑皮层、皮
层下白质、对侧同源皮层和白质对照的ire消融区域以及ire治疗前和后的犬类动物gbm的所关注区域的数字显微照片。
[0380]
统计分析
[0381]
通过在prism统计软件(版本6,加利福尼亚州拉荷亚graphpad(graphpad,la jolla, ca))中执行的双尾t测试测定统计显著性。95%置信区间与被定义为p<0.05的显著性一起使用。所有数字结果报导为所有实验测量的平均值和标准差。不排除离群值。
[0382]
结果
[0383]
脉冲电场的细胞大小选择性
[0384]
用有限元建模模拟对电场脉冲的单细胞响应。响应于建模ire脉冲的模拟tmp改变(图45a)高度取决于细胞大小(图45b)。相比之下,这些模型中,暴露于beam 脉冲的细胞未显示出随着细胞大小有显著的tmp变化(图45c)。
[0385]
实验上探究细胞大小对细胞死亡的电场阈值的影响,本发明人使用三维gbm水凝胶肿瘤模型(图46a)来调整肿瘤微环境的机械和化学结构,以待然后用作治疗
‑
测试平台(图46b)。本发明人通过使用有限元建模(图46c和46d)在两个实验电压处模拟在脉冲暴露期间水凝胶内的电场来测定致死电场阈值。这些模拟揭示预期病变形状随电压变化而变化,当电场幅值增加时,从花生状演进到环形状。在水凝胶中治疗引发的温度分布的有限元建模表明,当细胞未暴露于高于生理学水平的温度时(图46e),细胞损伤不会通过热效应而出现,其中没有明显的长期温度增加(图46f)。
[0386]
在水凝胶架构内的细胞大小和形状为架构密度的函数;通过变化组织模型中的胶原蛋白密度,本发明人能够控制单细胞类型的细胞大小和外膜周长。相比于较低密度(0.2% w/w)胶原蛋白(1572
±
503μm2),u
‑
87mg人gbm细胞在较高密度(2%w/w)胶原蛋白(920
±
249μm2)中展现出显著较小的面积(p=0.005)(图47a)。使用此体外模型,本发明人然后测定这些细胞几何结构测定ire脉冲而非beam脉冲的致死阈值。如通过模型所预测,在0.2%胶原蛋白中的细胞的ire病变大于在2.0%胶原蛋白中的细胞的病变(图47b,p<0.0001)。较大的细胞被幅值超过428
±
47v/cm的ire脉冲杀死,而较小的细胞需要较大场用于细胞死亡(492
±
41v/cm)。相比之下,beam治疗不会导致病变大小在统计学上的显著差异,对应于与胶原蛋白密度无关的601
±
65v/cm的平均致死阈值(图47c)。对于两个架构的电导率在实验上是相当的,并且在两个条件中细胞密度是相同的。
[0387]
本发明人在海藻酸钙水凝胶中执行另外的实验,其中由于缺乏细胞
‑
ecm结合位点,对于不同架构密度而言细胞形态是相对恒定的(图48a)。在海藻酸盐水凝胶中,病变大小和致死阈值与对于ire(图48b)和beam(图48c)两者的聚合物浓度无关。
[0388]
ire的体内选择性
[0389]
本发明人先前使用ire29治疗具有天然存在恶性神经胶质瘤的犬类动物患者。来自这种治疗的组织结构提供本文中呈现的本发明人的3d体外消融结果与高度表示人gbm 表型的环境中的体内结果之间的重要比较点。当未经治疗的大脑皮层灰质(图49a)暴露于ire治疗时,在神经元和神经胶质细胞两者消融时出现非区分细胞死亡(图49b)。类似地,经ire治疗的内囊(图49c)的未经治疗白质除了产生空泡形成和轴突丧失以外,还产生神经胶质死亡。尽管恶性胶质母细胞瘤细胞(图49e)用ire治疗消融(图 49f),但是基质细胞结构也是如此。基于展现在犬类动物gbm中ire消融的相对非选择性性质的这些体内结果以及基
于细胞大小展现ire阈值在统计学上显著但小差异的本发明人的体外研究,本发明人接下来聚焦于脉冲电场的电位以发挥细胞特异性靶向。来自犬类动物患者的组织结构图像示出了相比于健康组织(图49a、图49c)由gbm细胞放大的核(图49e)表征的众所周知的肿瘤细胞表型,因此促成本发明人的假设,即治疗电场的胞内定位可能够由于核大小差异而实现肿瘤细胞靶向。
[0390]
脉冲电场的胞内影响
[0391]
为检查用于beam脉冲的电位以经由电场的胞内定位发挥其影响,本发明人在单个细胞上执行场分布的有限元建模。这种模型预测,对于施加100μs的具有500v/cm电场幅值的模拟ire脉冲,仅有14%的外电场穿越细胞膜并且存在于细胞质中(图50a)。相比之下,beam脉冲将其大部分能量传送到细胞的内部(图50b)。,细胞质在每个1μs beam脉冲的整个持续时间中充电超过400v/cm,而对于仅8%的每个100μs ire脉冲的持续时间也是如此。对于由beam产生的强胞内场的该预测,为测试对肿瘤细胞核的影响的意义,本发明人使用经选择包括多种恶性细胞与正常细胞比较的四种不同细胞类型(图50c)构建3d模型。这些3d培养细胞没有展现出关于细胞面积的显著差异(图 50d),但是展现出关于核面积的显著差异(图50e)。人恶性神经胶质瘤细胞系(u
‑
87) 显示出比正常人星形胶质细胞(nha)显著更大的核面积(p=0.0048),而当相比于正常鼠星形胶质细胞(d1tnc1)时,鼠胶质母细胞瘤系(c6)展现出增加的核面积 (p=0.0140)。
[0392]
与ire细胞大小相关和与核大小不相关的模型预测一致,四种细胞类型展现出类似的ire病变(图51a)。相比之下,在具有gbm细胞的组织模拟物中的beam病变显著大于具有正常星形胶质细胞的病变(图51b)。在细胞类型上的类似的致死ire阈值 (图51c)与所有四种细胞类型具有类似的外膜面积的事实一致。然而,beam实验结果揭示恶性细胞的较低致死阈值(图51d),所述恶性细胞具有与其正常细胞对应部分相比更大的核。对于对人类细胞的beam治疗,u87胶质母细胞瘤细胞在601+/
‑
71v/cm 的阈值下被杀死而nha在1006+/
‑
81v/cm的阈值下被杀死(p<0.0001)。对于鼠细胞系, c6细胞的致死阈值为752+/
‑
58v/cm而d1tnc1细胞的致死阈值位1107+/
‑
106v/cm (p<0.0001)。
[0393]
ire和beam的死亡机制
[0394]
为研究用ire和beam的死亡机制之间的差异,本发明人在暴露于每个治疗方案之后执行单细胞成像。细胞核和微管蛋白通过活荧光染色剂染色并且培养在3d胶原蛋白水凝胶中。在暴露于ire之前,在这些水凝胶内直接执行原位荧光成像,并且然后在暴露于ire之后的30秒间隔处,揭示在脉冲后的1分钟内染料从细胞膜向外扩散(图 52a)。在治疗之后5分钟,微管蛋白染料几乎全部扩散细胞以外,同时核染料显示出细胞核完整性的破坏。相比之下,暴露于beam的细胞显示出较强的细胞核向内破裂,接着在5分钟时间标度上微管蛋白染色的细胞质的破裂(图52b)。在相同时间过程上成像的未暴露于任一治疗的对照细胞确认治疗引发的改变与光致漂白不相关(图52c)。
[0395]
估计用于核破坏的致死阈值
[0396]
本发明人利用实验数据作为用于随后数学模型的输入来探索beam致死阈值和核大小之间的关系。基于此数据,看起来在与细胞类型无关的临界ntmp破坏处出现细胞死亡,然而对于此核破坏所需要的外部场与细胞核大小成反比。使用对于致死阈值、核几何结构以及用于神经胶质瘤细胞和星形胶质细胞的理想化细胞几何结构的实验发现,本发明人执
行对于每种细胞类型的最小致死电场的单细胞响应的有限元建模。模拟细胞暴露于这些致死性条件(对于nha细胞1006v/cm和对于u
‑
87细胞601v/cm),本发明人发现对于神经胶质瘤细胞的tmp增加大于星形胶质细胞的tmp增加(图53a),然而这些tmp显著低于对于ire的预期1v瞬时致死阈值。相比之下,ntmp响应的模拟预测对于两种细胞类型的ntmp增加类似,这指示在对于两种细胞的ntmp的共同值处、在~130mv破坏处出现细胞死亡(图53b)。
[0397]
论述
[0398]
整个目标是基于先前公布的方法(verbridge,s.s.等人,氧气
‑
控制的三维培养物以分析肿瘤血管生成(oxygen
‑
controlled three
‑
dimensional cultures to analyze tumor angiogenesis),组织工程.a部分,16,2133
‑
2141,doi:10.1089/ten.tea.2009.0670(2010)) 利用肿瘤与正常大脑微环境的组织经工程改造的模型以研究代表性细胞几何结构对ire 脉冲和beam脉冲的响应。这些平台关键地提供三维生理组织环境,其中探究3d细胞形态对响应于电场的影响,用2d实验是不可能,同时排除体内所见的其它混杂变量。水凝胶已经预先建立为相关平台以测试组织对ire脉冲的响应(arena等人,2012),同时此类模型相比于2d模型还展现出更好地再现人肿瘤生理和治疗响应(fischbach,c. 等人,具有3d架构的工程肿瘤(engineering tumors with 3d scaffolds),nat meth,4, 855
‑
860(2007);fong,e.l.s.等人,在体外建模具有3d架构的尤文氏肉瘤肿瘤(modelingewing sarcoma tumors in vitro with 3d scaffolds),美国国家科学院院刊(proceedings of thenational academy of sciences),110,6500
‑
6505,doi:10.1073/pnas.1221403110(2013))。借助易于调节靶向参数和微环境的能力,这些模型提供一种用于大致地测量细胞形态和组织物理学对治疗响应并且更具体来说对响应于治疗电场的影响的有价值的工具。
[0399]
值得注意的是,本发明人的工作通过他们在治疗犬类动物患者中自发性gbm中的经验通知并建立在此经验上。自发性、原发性大脑肿瘤仅在两个物种
‑
狗和人类中相对常见。人类和犬类动物大脑肿瘤共有许多特征,包括组织病理学和诊断成像特性,这允许应用世界卫生组织病理性分级和人类临床实践中使用的基于成像的治疗响应估计方案。犬类动物和人大脑肿瘤还表明具有生长因子受体、染色体缺失以及肿瘤抑制基因功能的损失的类似表达模式。由于在狗类中肿瘤发展相对于人类快5
‑
到7
‑
倍,所以具有自发性大脑肿瘤的狗类为用于真实且快速评估以及转换新颖大脑肿瘤疗法的具有吸引力的模型(rossmeisl,j.h.,用于狗和猫中大脑肿瘤的新治疗模式(new treatment modalities forbrain tumors in dogs and cats),北美州兽医诊所:小动物实践(veterinary clinics of northamerica:small animal practice),44,1013
‑
1038,doi:http://dx.doi.org/10.1016/ j.cvsm.2014.07.003(2014))。
[0400]
对于细胞悬浮液,先前已经报导了使用pef的大小选择性消融,基于大小的较大差异从血细胞中分化肿瘤(eppich,h.m.等人,用于选择造血细胞和清除肿瘤细胞污染物的脉冲电场(pulsed electric fields for selection of hematopoietic cells and depletion of tumorcell contaminants),自然
·
生物技术(nature biotechnology),18,882
‑
887,doi:http: //dx.doi.org/10.1038/78504(2000)(“eppich等人,2000”)),但是仍待对生理上相关组织中培养的细胞论证。本发明人的实验支持ire导致细胞大小
‑
选择性致死阈值到3d组织中的概念。细胞接种的水凝胶的体电阻特性并不随着胶原蛋白密度的变化而变化,并且因此本发明人认为所测量的差异为细胞形态而非变化的组织电特性的结
果。在海藻酸盐中执行的对照实验进一步支持这一假设,即在胶原蛋白中观察到的差异是由细胞大小变化而非另外因子如基质密度的直接感测引起的。尽管此发现并未消除结合配体密度的变化还可影响病变大小的可能性,但是此大小相关性与预先公布的关于在溶液中的细胞的数据一致(eppich等人,2000)。此外,阈值与细胞大小的这种相关对于beam是不存在的。本发明人假设这是由于beam场主要与细胞的内部细胞器相互作用。发明人的有限元建模确认这种假设,因为施加到单细胞模型的单beam脉冲串在细胞内部产生比模拟ire脉冲串高得多的场。beam治疗提供快速的超过100个这些1μs脉冲的脉冲串。这允许beam脉冲优先对胞内膜充电,本发明人所预期的将随细胞类型变化而而对细胞死亡具有深刻的影响。
[0401]
本发明人的体外3d模型结果展现出场阈值对细胞大小在统计学上有显著的相关性,然而体内观察到的细胞大小不均匀性可防止这种相关性用于靶向特异性。在本发明人的肿瘤和健康犬类动物大脑样本的h&e染色中更明显的细胞类型之间更显而易见的差异是相比于健康的大脑组织的放大的癌细胞的核。用作癌症的病理指示符,与其非恶性对应部分相比的放大核是肿瘤细胞的最可靠区别特性之一(zink,d.,fischer,a.h.和 nickerson,j.a.,癌细胞中的核结构(nuclear structure in cancer cells),自然评论:癌症 (nat rev cancer),4,677
‑
687(2004)),然而针对此特点的抗癌治疗的靶向尚未被证实过。
[0402]
细胞核通常是最大的连续胞内特征以及对于通过由beam产生的高的胞内场引起损伤的可能靶标。为实验上测试核面积对治疗的影响,本发明人选择不同的细胞类型,所述不同的细胞类型展现出核大小差异而质膜面积没有显著差异,排除由于细胞大小引起的混杂影响。数字模拟将增加的核大小标识为对于增加的ntmp的重要变量。ntmp 的增加可触发高于特定阈值的细胞死亡,并且因此相比于用ire(其将不展现出核选择性),恶性细胞应该具有比正常细胞更低的beam致死阈值。ire阈值的类似性与质膜面积没有显著差异的事实一致。beam病变大小的差异支持beam阈值差异与细胞核面积而非整个细胞面积有关,其中较低的致死阈值对应于较大的核。由beam产生的胞内场似乎以至少部分类似于ire影响质膜的方式影响细胞间核膜,由于暴露于大部分电场的较大膜比较小膜更容易影响。
[0403]
暴露于每种治疗的单细胞的时程图像示出beam与ire之间杀死机制的独特差异,这与不同细胞特性是两种治疗的重要变量的发现一致。在ire治疗之后细胞死亡的时程强烈地暗示细胞膜的立即破坏作为细胞死亡的原因,由于在暴露于ire之后,由细胞膜最初限制在细胞中的微管蛋白质开始扩散出细胞外。相比之下,暴露于beam的细胞没有显示出从外细胞膜扩散而是核破裂,而微管蛋白保留在最初细胞区域内。这些发现表明外膜在beam中细胞死亡的机制中并未起太重要的作用,而是主要对细胞核产生影响。
[0404]
给出本发明人的结果,看起来beam以使核面积变成关键变量的方式作用于细胞的生物物理结构。当在其相应的致死beam阈值处(601v/cm与1006v/cm)模拟神经胶质瘤细胞和星形胶质细胞时,本发明人发现类似的tmp和ntmp范围分别为约150mv 至250mv和100mv至130mv。这些模拟确实有趣地预测外tmp的较小差异随核大小而变化。然而,此tmp的幅值(约150mv)显著低于通过不可逆电穿孔对于细胞死亡的预期瞬时阈值(1v)。因此,看起来beam的主要死亡机制不是细胞tmp的增加而是与胞内影响有关。对于神经胶质瘤细胞和星形胶质细胞,130mv的最大的模拟ntmp 还远低于由外膜破坏引起的死亡的致死阈值,这表
明ntmp的较小破坏可显著地影响细胞存活。尚不明确细胞死亡的路径是独自由对核被膜的影响、与细胞膜破坏组合还是胞内影响的单级联控制。然而,在不同致死电场强度下,两种不同细胞类型之间的ntmp 值的相关性指示在beam治疗之后核面积影响细胞死亡过程。
[0405]
本发明人的数学模型确实具有局限性,因为将外细胞膜近似为椭圆,并且没有考虑生理细胞的不规则形状或单独细胞电特性的不均匀性。由于电穿孔作用引起的包括膜电导率改变预期增强本发明人模拟的精确性。虽然实验证据还表明外膜电穿孔出现在 beam期间(在图52a至图52c中那些时间点以外的时间点处,数据未示出),但是本发明人的实验结果和模型发现强烈地表明ntmp影响在beam作用机制中的积极作用。普遍认识到,在使用短脉冲的不可逆电穿孔中的死亡机制是复杂、了解不多的,并且可遵循多种不同的路径(weaver,j.c.,smith,k.c.,esser,a.t.,son,r.s.和gowrishankar, t.r.,对电穿孔脉冲强度
‑
持续时间间隔的简要概述:在预期另外的胞内作用处的区域(a brief overview of electroporation pulse strength
‑
duration space:a region where additionalintracellular effects are expected),生物电化学,87,236
‑
243,doi:http: //dx.doi.org/10.1016/j.bioelechem.2012.02.007(2012))。此外,核穿孔不仅可以通过增加的癌细胞核大小还可以通过细胞核的其它异常(如用于侵袭所需要的降低的细胞核刚度)帮助(dahl,k.n.,ribeiro,a.j.s和lammerding,j.,核形状、机制以及力传导(nuclearshape,mechanics,and mechanotransduction),循环研究(circulation research),102, 1307
‑
1318,doi:10.1161/circresaha.108.173989(2008))。另一可能性是由放大的细胞核周围的失真引起的施加到细胞质的电场的放大。这可导致其它内部细胞器如线粒体被beam脉冲破坏。本发明人的结果突出在ire和beam两者中tmp增加的重要性和在确定细胞死亡pef阈值中与beam特定相关联的ntmp增加的重要性。
[0406]
值得注意的是,ire和beam的死亡机制不是基于靶向由包括化学疗法和肿瘤治疗场的许多电流gbm治疗利用的高度增殖性表型(kirson,e.d.等人,在动物肿瘤模型和人类大脑肿瘤中交替的电场抑制细胞增殖(alternating electric fields arrest cellproliferation in animal tumor models and human brain tumors),美国国家科学院院刊,104, 10152
‑
10157,doi:10.1073/pnas.0702916104(2007))。虽然这些治疗留下可导致复发的静态肿瘤引发细胞,但是ire和beam将通过用于体肿瘤细胞和肿瘤引发细胞两者的膜破坏来诱发死亡响应。这种物理死亡机制将在短时间尺度上选择耐性亚群的出现是不大可能的,因为将可能需要许多遗传突变以使得细胞耐受电场引起的损伤。
[0407]
尽管beam的细胞杀死的精确机制还未已知,但是本发明人的建模和实验数据表明一种不同于靶向质膜的长ire脉冲机制以及不同于ire的机制在类似大小的细胞中为细胞类型相关性的。beam杀死机制为使得恶性细胞的生物物理结构允许使用对所研究的健康细胞没有引发损伤但是在恶性细胞中诱发死亡响应的一系列电场分布选择性靶向这些细胞。因为包含体肿瘤的恶性细胞具有比围绕肿瘤的正常星形胶质细胞(~930
‑
1200 v/cm)更低的死亡阈值(~530
‑
810v/cm),因此将这两个阈值之间电压传送到肿瘤边缘的治疗方案可导致肿瘤细胞的消融同时避开健康星形胶质细胞。在肿瘤的边缘处在此范围内的阈值可在更宽广地杀死使得对于gbm的手术为无效治疗的侵袭性胶质母细胞瘤细胞以及浸润性肿瘤时是有效的。
[0408]
实例5
[0409]
具有持续时间短于ire脉冲一到两个数量级的单独脉冲可以较少依赖于细胞外径的方式杀死细胞(假设类似大小的细胞核)。单独脉冲以交替的极性方式施加以减少肌肉收缩。另外,重复单独脉冲以形成高频脉冲串,并且多个脉冲串通常是引发细胞死亡所必需的。这类似于在ire治疗期间如何施加多个较长持续时间脉冲。这种形式的beam 治疗通常需要较高的电场阈值,但是对细胞大小的相关性较少。因此,治疗计划显著减少,由于不同的细胞类型(不考虑其形态)具有相同的电场阈值。
[0410]
在图54a至图54d中提供的理论实例中,假设细胞为球形,并且导电率λo和λi 设定为0.1s/m且λm设定为3e
‑
7s/m。图54a至图54d的曲线示出在直径为10μm的细胞(实线)和直径为15μm的细胞(虚线)的细胞极(θ=0)处的tmp。如图54a至图54b中所示,细胞暴露于具有在2000v/cm下施加的500ns长脉冲的beam。如图 54c至图54d中所示,细胞暴露于具有在1250v/cm下施加的5μs长脉冲的ire。由于 beam脉冲短于膜充电时间,所以在脉冲结束时峰值tmp达到几乎与两个细胞直径相同。在ire期间,外膜被完全充电并且tmp达到显著不同各自的平稳阶段。
[0411]
已经参考具有各种特征的特定实施例描述本发明。根据以上提供的本公开,对于本领域的技术人员将显而易见的是在不背离本发明的范围或精神的情况下,可以对本发明的实践作出各种修改和变化。本领域技术人员将认识到,所公开的特征可以单一地、以任何组合形式使用或基于给定应用或设计的要求和说明而被省略。当实施例是指“包含”某些特征时,应理解该实施例可替代地“由”特征中的任何一个或多个“组成”或“基本上由”特征中的任何一个或多个“组成”。根据对本说明书的考量和对本发明的实践,本发明的其它实施例对本领域的技术人员而言将是显而易见的。
[0412]
应注意的是,具体来说,在本说明书中提供一系列值的情况下,还特定公开了所述范围的上限和下限之间的每个数值。这些较小范围的上限和下限还可以独立地包括在范围内或被排除。除非上下文另外明确规定,否则单数形式“一(a/an)”以及“所述”包括多个指示物。希望本说明书和实例在本质上被视为示例性的并且在不背离本发明的实质的变化落入本发明的范围内。另外,本公开中列举的所有参考文献各自均以其全文引用的方式并入本文中并且因此旨在提供一种补充能够实现本发明公开内容的有效方法以及提供详述本领域中技术人员水平的背景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1