USP10在肝脏缺血再灌注损伤中的应用
本发明属于生物医药领域,具体涉及usp10在肝脏缺血再灌注损伤中的应用。
背景技术:
肝脏缺血再灌注(ischemia-reperfusioninjury,i/r)损伤是肝移植过程中常见的病理生理过程。i/r损伤常导致肝功能不全甚至不可逆性肝损伤,这也是肝移植急、慢性排斥反应的主要原因。由于边缘供肝对缺血损伤非常敏感,i/r损伤也限制了边缘供肝的使用。在肝脏缺血期间,危险相关分子模式(damp)激活库普弗细胞、中性粒细胞和其他免疫细胞,然后释放炎症细胞因子和趋化因子。一系列的炎症反应被激活,导致肝细胞进一步凋亡和坏死。因此,炎症反应和细胞凋亡是肝i/r损伤的关键步骤,寻找炎症反应和细胞凋亡的调控机制对防治i/r损伤具有重要意义。
泛素特异性蛋白酶10(usp10)是半胱氨酸蛋白酶泛素特异性蛋白酶家族的成员,具有从泛素结合蛋白底物中切割泛素的特性。usp10参与环境应激反应、肿瘤生长、炎症反应和细胞代谢等过程。在非酒精性脂肪肝(nafld)模型中,usp10通过与sirt6相互作用并抑制其泛素化和降解来抑制肝脏脂肪变性、胰岛素抵抗和炎症反应,抑制usp10还可取消mirt2(长非编码rna心肌梗死相关转录物2)过度表达诱导的肝细胞葡萄糖和脂肪生成的抑制。sirna介导的usp10敲除和usp10抑制剂的应用有效地减轻了姜黄素诱导的伴有线粒体和内质网扩张的程序性细胞死亡。另外,p53的稳定性和精确定位对肿瘤抑制功能至关重要,而usp10作为p53在dna损伤反应和肿瘤发生中的新的调控因子,可以调控包括肝细胞癌在内的多种肿瘤的发展。然而,usp10在肝脏缺血再灌注中的病理生理学作用尚未得到充分证实。
技术实现要素:
本发明的目的在于提供一种usp10在肝脏缺血再灌注损伤中的应用,确定usp10基因的表达与肝脏缺血再灌注损伤之间的关系,揭示usp10在肝脏缺血再灌注损伤中的新功能。
为实现上述目的,本发明采用以下技术方案:
本发明选择usp10基因敲除小鼠(usp10-hz)和c57bl/6野生型小鼠(wt)为实验对象,分别构建小鼠肝脏缺血再灌注损伤模型,然后进行原代肝细胞的分离培养和肝细胞体外缺氧/复氧(h/r)模型的构建;通过构建腺病毒介导的usp10高表达小鼠、腺病毒介导的usp10高表达原代肝细胞、显性阴性tak1腺病毒(dn-tak1)及原代肝细胞的感染,研究usp10在肝脏缺血再灌注损伤中的功能。
通过肝功能测定、he染色、tunel染色、免疫组化、免疫荧光、wb、qrt-pcr、统计分析等检测分析,结果显示:
1.与wt组相比,usp10-hz组的肝脏坏死面积显著增加,usp10基因敲除加重了肝脏缺血再灌注损伤和肝脏炎症反应,促进肝脏缺血再灌注损伤过程中的细胞凋亡。
2.usp10过表达可通过抑制炎症反应和细胞凋亡从而减轻肝脏缺血再灌注损伤,并从阳性和阴性两个方面抑制h/r处理后肝细胞的炎症和凋亡。
3.tak1介导了usp10在肝脏缺血再灌注损伤中的保护作用,tak1抑制可消除usp10敲低对炎症和肝细胞凋亡的影响。
本发明提供一种usp10在制备预防/治疗肝脏缺血再灌注损伤的药物中的应用。
按上述方案,所述药物为能够促进usp10表达的药物。
本发明的有益效果为:
本发明发现了usp10基因在肝脏缺血再灌注损伤中的新功能,usp10过表达可通过抑制炎症和细胞凋亡减轻肝脏缺血再灌注损伤,因此可将usp10应用于筛选或制备预防/治疗肝脏缺血再灌注损伤的药物中,为肝脏缺血再灌注损伤提供新的药物靶点。
附图说明
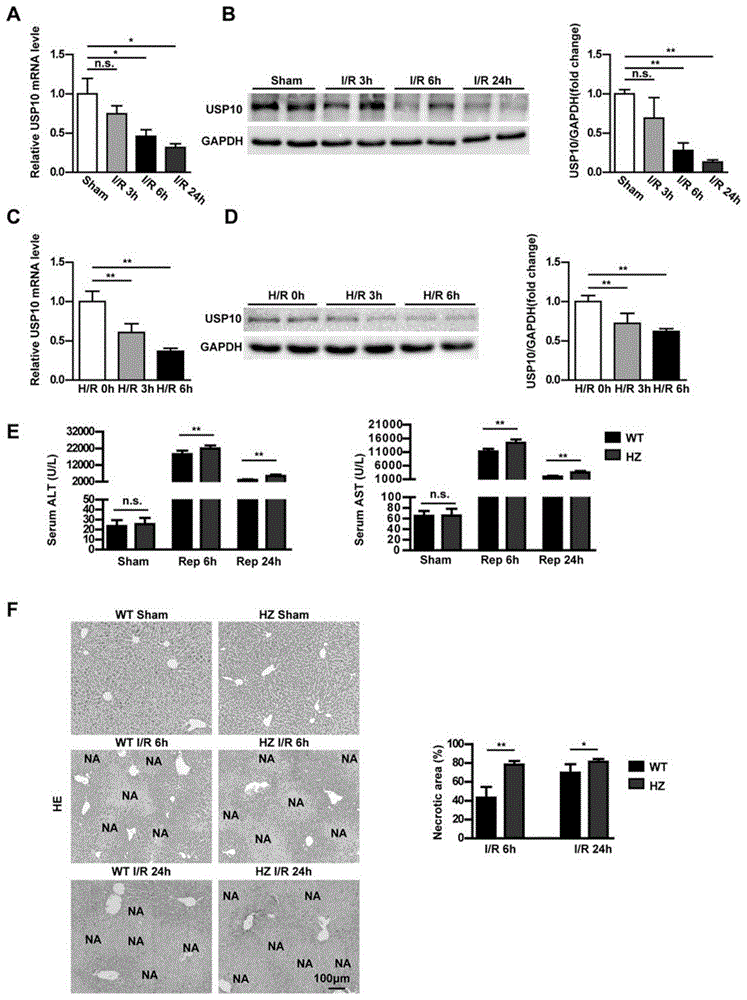
图1为在i/r模型中usp10基因敲除后wt小鼠肝脏中usp10表达结果图;其中:
(a)为肝i/r损伤后在固定时间点wt小鼠肝脏中usp10mrna表达结果图(每组n=6);
(b)为肝i/r损伤后在固定时间点wt小鼠肝脏中usp10蛋白表达结果图(每组n=3);
(c)和(d)分别为原代肝细胞在h/r后固定时间点的usp10mrna和蛋白质表达结果图;
(e)为i/r后的usp10-hz小鼠和wt小鼠以及假手术组(每组n=7)6小时和24小时的血清alt和ast水平;
(f)为来自i/r后usp10-hz小鼠和wt小鼠和假手术组小鼠(每组n=7)6小时和24小时假手术组小鼠(每组n=7)的缺血肝叶中h&e染色坏死区域的代表性图像;
所示结果代表了三个独立的实验,gapdh作为内参。对于统计分析,a-d采用单因素方差分析,e和f采用两独立样本t检验。n.s不显著,*p<0.05,**p<0.01。
图2为usp10基因敲除后肝脏i/r过程中的炎症反应结果图;其中:
(a)和(b)分别为i/r损伤后的usp10-hz小鼠和wt小鼠及假手术组(每组n=4)6小时(a)和24小时(b)促炎因子(tnf-α、il-6、il-1β和ccl2)的mrna水平结果图;
(c)为再灌注后6小时usp10-hz小鼠和wt小鼠肝脏及假手术组(每组n=3)的cd11b和ly6g免疫荧光染色图;
(d)为i/r损伤后6小时,usp10-hz小鼠和wt小鼠(每组n=3)肝脏中nf-κb信号成分的蛋白表达水平;
gapdh作为内参,对于统计分析,a采用单因素方差分析,b-d采用两独立样本t检验。n.s不显著,*p<0.05,**p<0.01。
图3为usp10基因敲除促进肝i/r细胞凋亡;其中:
(a)和(b)分别为usp10基因敲除后肝脏缺血再灌注后6小时(a)和24小时(b)的usp10-hz小鼠和wt小鼠及假手术组(每组n=4)肝脏中细胞死亡相关基因(bad、bax和bcl2)的mrna水平结果图;
(c)为再灌注后6小时,在usp10-hz小鼠和wt小鼠及假手术组(每组n=3)的肝叶中有代表性的tunel染色图;
(d)为再灌注后6小时,各组usp10-hz小鼠和wt小鼠(每组n=3)肝脏细胞死亡相关基因(bax和bcl2)的蛋白质水平图;
(e)为再灌注后6h,usp10-hz小鼠和wt小鼠(每组n=4)肝叶的典型免疫组织化学染色图;
(f)为再灌注后6小时,usp10-hz小鼠和wt小鼠(每组n=3)肝叶中c-caspase3蛋白水平图;
gapdh作为内参,统计采用了方差分析法(a-b)。n.s不显著,*p<0.05;**p<0.01。
图4为usp10过表达对i/r模型小鼠肝损伤的影响结果图;其中:
(a)为缺血后6小时ad-gfp小鼠和ad-usp10小鼠及假手术组小鼠(每组n=6)缺血肝叶h&e染色坏死区域的代表性图像;
(b)i/r后6小时ad-gfp和ad-usp10小鼠及假手术组(每组n=8)的血清alt和ast水平;
(c)i/r损伤后6小时ad-gfp和ad-usp10小鼠(每组n=4)检测促炎因子(tnf-α、il-6、il-1β和ccl2)的mrna水平;
(d)再灌注后6小时ad-gfp和ad-usp10小鼠(每组n=3)肝脏cd11b免疫荧光染色;
(e)急性i/r损伤后6h,ad-gfp和ad-usp10小鼠(每组n=6)肝脏nf-κb信号转导组分的蛋白表达水平;
(f)再灌注后6小时,ad-gfp和ad-usp10小鼠(每组n=3)肝叶的典型tunel染色;
(g)再灌注后6小时,ad-gfp和ad-usp10小鼠(每组n=4)肝脏中细胞死亡相关基因(bad、bax和bcl2)的mrna水平;
(h)再灌注后6小时,ad-gfp和ad-usp10小鼠肝脏中细胞死亡相关基因(bax、bcl2和c-caspase3)的蛋白水平;
gapdh作为内参。对于统计分析,(b)采用单因素方差分析,(a,c–h)采用两独立样本t检验。n.s不显著,*p<0.05;**p<0.01。
图5为usp10抑制h/r后肝细胞的炎症和凋亡;其中:
(a)从usp10-hz小鼠和wt小鼠分离的肝细胞中,促炎因子(tnf-α、il-6、il-1β和ccl2)的mrna水平;
(b)观察各组nf-κb信号成分的蛋白表达水平;
(c)死亡相关基因(bad、bax和bcl2)的mrna表达水平;
(d)各组死亡相关基因(bax和bcl2)的蛋白表达水平;
(e)在感染ad-gfp或ad-usp10的h/r处理肝细胞中,促炎因子(tnf-α、il-6、il-1β和ccl2)的mrna水平;
(f)观察各组nf-κb信号成分的蛋白表达水平;
(g)死亡相关基因(bad、bax和bcl2)的mrna表达水平;
(h)各组死亡相关基因(bax、bcl2和c-caspase3)的蛋白表达水平;
对于(b、d、f、h),结果代表三个独立的实验,gapdh作为内参。统计分析采用两独立样本t检验(a–h),n.s不显著,*p<0.05,**p<0.01。
图6为usp10在肝i/r过程中抑制了tak1-jnk/p38信号传导;其中:
(a)western印迹显示i/r后6小时,usp10-hz小鼠和wt小鼠肝脏中erk、jnk和p38的总表达和磷酸化水平(每组n=3);
(b)western印迹显示从usp10-hz小鼠和wt小鼠分离的经h/r处理的肝细胞中erk,jnk和p38的总表达水平和磷酸化水平(每组n=3);
(c)western印迹显示i/r损伤后6小时ad-gfp小鼠和ad-usp10小鼠肝脏中erk、jnk和p38的总表达和磷酸化水平(每组n=3);
(d)western印迹显示i/r损伤后6小时,usp10-hz小鼠和wt小鼠肝脏中tak1和ask1的总表达水平和磷酸化水平(每组n=3);
(e)western印迹显示从usp10-hz小鼠和wt小鼠分离的经h/r处理的肝细胞中tak1和ask1的总表达水平和磷酸化水平;
(f)western印迹显示i/r损伤后6小时,ad-gfp和ad-usp10小鼠肝脏中tak1和ask1的总表达水平和磷酸化水平(每组n=3)。显示的结果代表了三个独立的实验;
gapdh作为内参。为了进行统计分析,面板使用了两独立样本t检验(a-f)。n.s不显著,**p<0.01。
图7为tak1抑制剂治疗阻断了ups10敲低对h/r刺激的肝细胞的有害作用,其中:
(a)用安慰剂或tak1抑制剂处理并在h/r后6小时收获的usp10-hz小鼠和wt小鼠的肝细胞中usp10、总tak1、磷酸化tak1、jnk和p38的蛋白水平;
(b)来自所示组的肝细胞中促炎因子(tnf-α、il-6、il-1β和ccl2)的mrna水平;
(c)所示固定组肝细胞中nf-κb信号通路成分的蛋白水平;
(d)所示固定组肝细胞中与细胞死亡相关的基因(bad,bax和bcl2)的mrna水平;
(e)所示固定组肝细胞中与细胞死亡相关的基因(bax和bcl2)的蛋白质水平;
对于图(a,c,e),显示的结果代表了三种印迹,gapdh用作上样对照。对于面板(b,d),显示的结果代表了三个独立的实验。为了进行统计分析,将单向方差分析用于面板(a–e)。n.s不显著,**p<0.01。
图8为tak1显性阴性突变体腺病毒(dn-tak1)转导逆转了ups10基因敲除对h/r刺激的肝细胞的不利影响;其中:
(a)用安慰剂或tak1抑制剂处理并在h/r后6小时收获的usp10-hz小鼠和wt小鼠的肝细胞中usp10、总tak1、磷酸化tak1、jnk和p38的蛋白水平;
(b)固定组肝细胞中促炎因子(tnf-α、il-6、il-1β和ccl2)的mrna水平;
(c)各组肝细胞nf-κb信号通路组分的蛋白质水平;
(d)固定组细胞死亡相关基因(bad、bax和bcl2)的mrna水平;
(e)固定组肝细胞中细胞死亡相关基因(bax、bcl2和c-caspase3)的蛋白质水平;
于(a、c、e),所示结果代表三个独立的实验,gapdh作为内参。对于(b,d),显示的结果代表了三个独立的实验。对于统计分析,(a-e)采用单向方差分析。n.s不显著,*p<0.05,**p<0.01。
具体实施方式
下面结合具体实施例。进一步阐述本发明,应当理解,这些实施例仅用于说明本发明而不用于限制本发明要求保护的范围,下列实施例中未注明的具体实验条件和方法,通常按照常规条件如:美国国立卫生研究院的实验动物护理和使用指南;d.l.斯佩克特等,科学出版社,2001,细胞实验指南等书中所述的条件,或按照制造厂商所建议的条件。
1、动物模型和程序
从武汉大学动物实验中心获得usp10基因敲除小鼠(usp10-hz)和c57bl/6野生型小鼠(wt小鼠)(雄性,8周,体重:25-27g)。我们遵循美国国立卫生研究院的实验动物护理和使用指南进行实验。小鼠被保存在空气过滤、温度控制(22-24℃)、湿度控制(40%至70%)和光控室中,并被允许免费获得标准饮食。
2、小鼠肝脏i/r损伤模型
采用经典方法构建小鼠肝i/r损伤模型,手术前小鼠禁食12小时,可少量饮水。术前用3%戊巴比妥钠麻醉小鼠,四肢固定在水平位置,剔除腹部区域毛发。手术区用10%碘和75%乙醇消毒。
腹侧中线切口进入腹部,暴露肝脏左、中叶的肝蒂。用无创血管夹阻断肝中、左叶的门静脉和肝动脉,造成约70%的肝脏缺血,以防止严重的肠系膜静脉充血。过0.5min,与未闭锁的右叶相比,阻塞叶变白,说明血流阻塞成功。然后,开始缺血并维持60min。sham组小鼠无肝血流阻塞,缺血后去除血管夹,恢复肝血流。腹腔缝合后,将术后小鼠置于干净的笼子中,单独安置观察。
取样:小鼠在术后指定时间从sham手术组(sham组)和i/r组中取出,用3%戊巴比妥钠麻醉。然后从眼眶静脉丛取1ml的血,分离血清。同时收集肝中叶并冷冻于液氮中,肝左叶固定于10%福尔马林培养基中24小时,脱水,包埋,制备成石蜡切片。
3、原代肝细胞的分离培养
从usp10-hz小鼠和wt小鼠中分离出原代肝细胞,如前所述。麻醉后,打开小鼠腹腔,用0.5%ⅳ型胶原酶(目录号17104-019)穿刺门静脉。当肝脏完全消化后,将肝脏切除、切碎并通过70μm细胞过滤器过滤(目录号:352350;falcon,bdbiosciences)以获得原代肝细胞。细胞在dmem(目录号11965092;invitrogen)中培养,dmem在37℃、5%co2条件下,在鼠尾胶原包被培养皿中添加10%fbs。
4、肝细胞体外缺氧/复氧(h/r)
为了建立体外i/r模型,将原代肝细胞分为对照组和h/r组。对照组肝细胞在37℃°、5%co2的完全培养基中培养。对于h/r组的肝细胞,用5%co2和90%n2平衡的无血清dmem培养基代替培养基,并将培养基放入用相同气体混合物冲洗的模块化培养箱(美国纽约州拉科纳市biospherix)中。6小时后,将细胞在常氧条件下(空气/5%二氧化碳)培养一段指定时间。收集细胞进行进一步分析。
在从usp10-hz和wt小鼠分离的原代肝细胞缺氧/复氧(h/r)前30min,给予特异性tak1抑制剂(5z-7-ox;o9890-1mg;sigma,st.louis,mo,usa;2.5um)。给药量与对照组相同的二甲基亚砜(dmso)。
5、质粒构建
将usp10基因序列克隆到腺病毒载体pentr-cmv-atg-flag-t2a-gfp中,得到pentr-cmv-m-usp10-flag-t2a-gfp。引物序列如下:f:ggctagcgatatcggatccgccaccatggccctccacaacccacag;r:cgtccttgtaatcactagtcagcaggtccacgcggcggt。
6、腺病毒转导
将pentr-cmv-m-usp10-flag-t2a-gfp与腺病毒质粒pad/pl-dest重组,制备pad-cmv-m-usp10-flag-t2a-gfp(ad-usp10)。重组腺病毒载体adusp10经paci酶线性化,酚氯仿提取,转染293a细胞。用tcid50法测定病毒滴度。以不含usp10基因序列的ad-gfp颗粒作为对照腺病毒。
7、腺病毒介导的usp10高表达小鼠的构建方法
ad-usp10粒子(5*109每只小鼠pfu)经尾静脉注射到wt小鼠体内,上调小鼠肝脏组织中的usp10。对照组注射ad-gfp颗粒。注射2天后,按上述2中的方法建立小鼠肝脏i/r模型。
8、腺病毒介导的usp10高表达原代肝细胞的构建方法
从上述wt小鼠中分离出原代肝细胞,然后用ad-usp10感染6h。病毒感染后24小时,用4μg/ml普霉素选择感染细胞进行额外的24h细胞培养,然后用westernblot检测usp10的表达。
9、显性阴性tak1腺病毒(dn-tak1)的构建及原代肝细胞的感染
将tak1全cdna序列克隆到腺病毒质粒pntr-cmv-atg-flag-t2a-gfp中,用f:ggctagcatcggatcgccatcatcggatcgccatcagtccgcc;r:cgtcttgtaatcagtgtgtgcctctctgc,制备重组质粒,pntr-cmv-m-tak1-flag-t2a-gfp。
利用引物f:gatgtcgtctattacagagaagtg;r:cactttctatggttagcgacatc,在氨基酸63位点由k变为n,构建了n-cmv-m-tak1(dn)-flag-t2a-gfp突变载体pentr。将pentr-cmv-m-tak1(dn)-flag-t2a-gfp质粒与腺病毒质粒pad/pl-dest结合,获得小鼠tak1(dn)高表达腺病毒重组质粒pad-cmv-m-tak1(dn)-flag-t2a-gfp(dntak1重组病毒)。重组腺病毒质粒经paci酶线性化,酚氯仿提取,转染293a细胞。将dn-tak1腺病毒加入细胞培养基(对照组加入ad-gfp腺病毒)培养。感染6h后,更换新鲜培养基,继续培养。用tcid50法测定病毒滴度。
10、肝功能分析
用advia2400生化分析仪(美国纽约州塔里敦西门子公司)检测血清中的血清丙氨酸转氨酶(alt)和血清天冬氨酸转氨酶(ast)。
11、病理分析
1)he染色
肝脏切片(5μm)用h&e染色,用imageproplus软件分析坏死区域。每只小鼠在5个以上的区域中盲目量化组织切片总面积中坏死面积的百分比。一位不知道实验方案的病理学家提供了形态学评估。
2)tunel染色
为了检测缺血再灌注诱导的细胞凋亡,我们使用了原位凋亡检测试剂盒(
3)免疫组化
石蜡肝切片脱蜡水合,c-caspase-3免疫组化染色。首先用bsa封闭小鼠肝切片,用edta高温修复20min,然后将原抗体(cst,9664,usa)在4℃孵育过夜,37℃复温30min之后最小值用pbs洗涤,培养二级抗体(中山金桥,pv9001,中国)。
4)免疫荧光
应用cd11b或ly6g抗体,通过免疫荧光染色检测炎症细胞向肝脏切片的浸润。在4℃处与一次抗体孵育过夜后,肝脏切片与二次抗体孵育。用dapi标记细胞核。免疫荧光图像的捕获和分析使用imageproplus(版本6.0)。
5)蛋白免疫印迹
将相同质量的蛋白质样品加入负载缓冲液中,用10%sds-page电泳分离。电泳后,将蛋白转移到pvdf膜上。在室温下用5%脱脂奶粉封闭膜约1小时后,加入一级抗体在4℃孵育过夜。加入相应物种的二级抗体,在室温下孵育1h,用增强化学发光系统制备印迹,并将结果记录在感光成像胶片上。用凝胶成像系统(chemidoc-xrs+)采集信号。用image-j软件定量检测蛋白表达水平。
6)qrt-pcr
按照制造商的说明,用trizol切割组织或细胞,然后提取rna并用转录子第一链cdna合成法反转录成cdna套件。设计目标基因引物,以cdna为模板,进行qrt-pcr(real-time-polymerasechainreaction,qrt-pcr),以β-肌动蛋白为内参照物检测基因表达水平,对每个基因进行分析。反应条件设置如下:在95℃下孵育10min,然后40个周期95℃下孵育10s,60个℃下孵育1min。用2-δδct方法计算相对mrna表达水平,并根据β-肌动蛋白进行归一化。所使用的每个基因的引物列于表1。
7)统计分析
所有数据均以平均值±标准差表示。我们使用spss19.0软件进行所有的统计分析。使用单向方差分析比较2组以上的统计差异,然后进行bonferroni分析(用于满足方差齐性的数据)或tamhane的t2分析(用于显示异方差的数据)。将两组之间的统计差异与双尾学生的t检验进行比较。有统计学意义p<0.05。
12、结果分析
1)肝i/r过程中usp10表达降低,下调usp10表达加重小鼠i/r模型肝损伤。为了分析usp10是否参与i/r诱导的肝功能不全,我们首先测定了usp10在i/r小鼠肝脏和h/r刺激的原代肝细胞中的表达。在小鼠肝i/r模型中,usp10的mrna表达在再灌注后6小时下降(图1a)。同时,再灌注6小时后usp10蛋白表达下调(图1b)。一贯地,在h/r后6小时,原代肝细胞中usp10的表达也显著降低(图1c)。提示usp10参与了肝i/r损伤的发病机制。
为了探讨usp10在肝i/r损伤中的作用,我们构建了usp10杂合小鼠。通过westernblot分析证实usp10基因敲除表达(补充图1a)。用usp10基因杂合子(usp10-hz)和野生型(wt)小鼠建立肝i/r损伤模型。与wt缺血再灌注小鼠相比,usp10hz缺血再灌注小鼠的usp10mrna和蛋白质表达进一步降低(补充图1b-c)。hz假手术组与wt假手术组的alt、ast及坏死面积无明显差异。与wt缺血再灌注小鼠相比,usp10-hz组alt和ast水平在缺血再灌注后6h和24h显著升高(图一d)。根据he染色结果,在6小时和24小时,usp10-hz组的肝脏坏死面积显著增加(图一e)。这些结果表明usp10基因敲除加重了肝脏i/r损伤。
2)usp10基因敲除加重肝脏i/r损伤时的肝脏炎症
炎症反应是肝i/r损伤的关键机制。因此,我们检测了usp10-hz和wt小鼠在缺血再灌注后和相应的假小鼠中的炎症反应。在usp10-hz小鼠肝i/r损伤模型中,肝组织中炎性因子如tnf-α、il-6、il-1β和ccl2的mrna表达水平在损伤后6小时和24小时显著增加(图2a)。肝组织中性粒细胞(cd11b阳性细胞和ly6g阳性细胞)的浸润明显加重(图2b)。此外,westernblot显示,与野生型小鼠相比,usp10基因敲除可显著激活经典的促炎性nf-κb信号通路,其表现为p-ikkβ、p-p65和iκbα降解显著增加(图2c)。这些观察结果表明,usp10基因敲除可加重肝i/r损伤时的肝脏炎症。
3)usp10基因敲除促进肝i/r损伤时肝细胞凋亡
检测肝i/r损伤后usp10-hz和wt小鼠肝脏细胞凋亡。qrt-pcr检测凋亡信号通路因子的mrna表达。结果表明,usp10-hz组再灌注后6小时和24小时,促凋亡分子bax和bad的表达增加,抗凋亡分子bcl2的表达显著降低(图3a)。tunel染色显示usp10基因敲除显著增强i/r诱导的肝细胞凋亡(图3b)。此外,westernblot结果进一步证实了在肝i/r损伤后6h,与wt小鼠相比,usp10-hz小鼠肝脏中bcl-2的下调和bax的上调(图3c)。免疫组化和免疫印迹分析也显示usp10基因敲除促进了缺血再灌注诱导的c-caspase3表达的增加(图4d和e)。这些结果表明,usp10基因敲除可促进肝i/r损伤过程中的细胞凋亡。
4)usp10过表达通过抑制肝细胞炎症和凋亡减轻肝i/r损伤
为了进一步验证usp10在肝i/r损伤过程中的作用,构建高表达的usp10腺病毒并注射到小鼠体内,以上调usp10在肝组织中的表达(补充图1d),然后用同样的方法构建肝i/r模型。结果表明,usp10过表达显著降低了缺血再灌注刺激后6小时血清alt和ast水平,以及肝组织坏死面积(图4a和b)。用该方法检测ad-usp10小鼠的炎症反应和细胞凋亡。分泌性炎性细胞因子(tnf-α、il-6、il-1β和ccl2)和中性粒细胞(cd11b阳性细胞)的浸润被显著抑制(图4c和d)。与ad-gfp小鼠相比,经典的促炎性nf-κb信号通路被usp10过度表达显著抑制(图4e)。tunel试验显示,usp10过表达降低了肝组织中tunel阳性细胞的表达(图4f)。细胞凋亡实验显示,过表达usp10降低了bad和bax的mrna表达,上调了bcl2mrna的表达(图4g)。我们证实bax和c-caspase3蛋白表达下调,bcl2表达上调(图4h)。结果表明,usp10过表达可通过抑制炎症和细胞凋亡减轻肝i/r损伤。
5)usp10抑制h/r治疗后肝细胞的炎症和凋亡
为了验证usp10是否直接影响肝细胞的炎症和凋亡,我们检测了经h/r处理的usp10-hz和wt小鼠原代肝细胞的炎症和凋亡。原代肝细胞中usp10基因敲除显著促进炎症因子(tnf-α、il-6、il-1β、ccl2)的表达(图5a)。westernblot结果显示经典的促炎性nf-κb信号通路被usp10敲除显著促进,如p-ikkβ、p-p65和iκbα降解显著增加所示(图5b)。此外,hz小鼠和wt小鼠肝细胞qrt-pcr结果显示,促凋亡分子bad和bax的mrna上调,抗凋亡分子bcl-2下调(图5c)。westernblot结果进一步证实,与wt小鼠相比,在h/r刺激后6h,usp10-hz组肝细胞bcl-2表达下调,bax上调(图5d)。利用ad-usp10肝细胞h/r模型,我们还发现usp10过表达显著抑制炎性细胞因子分泌(tnf-α、il-6、il1β、ccl2)和nf-κb的激活(图5e和f)。此外,ad-gfp小鼠和ad-usp10小鼠肝细胞的qrtpcr结果显示,促凋亡分子(bad和bax)的mrna下调,抗凋亡分子bcl-2下调(图5g),westernblot结果进一步证实了在h/r刺激后6h,与ad-gfp小鼠相比,ad-usp10组肝细胞bcl-2上调,bax和c-caspase3下调(图5h)。综上所述,这些结果表明usp10从阳性和阴性两个方面抑制h/r处理后肝细胞的炎症和凋亡。
6)usp10抑制肝i/r损伤时tak1-jnk/p38的激活
探讨了usp10在肝缺血再灌注损伤中的作用机制。mapks在介导炎症反应和细胞死亡中起重要作用。许多研究表明,缺血再灌注手术或h/r损伤可激活mapk信号,这可以通过肝脏和原代肝细胞中jnk(p-jnk)、erk(p-erk)的磷酸化来证明。因此,我们研究了usp10缺乏是否以mapk依赖的方式促进肝脏缺血再灌注损伤。然而,在我们的实验中,我们发现usp10基因敲除仅增加i/r损伤后肝脏或h/r治疗后肝细胞中p-jnk和p-p38水平,而不是p-erk水平(图6a和b)。tak1(p-tak1)和ask1(p-ask1)的磷酸化在多种生理过程中调节mapks。因此,我们检测了p-ask1和p-tak1的激活,它们是jnk和p38信号通路的典型上游因子。我们还发现,在体内和体外,只有tak1激活而不是ask1激活对usp10表达变化有反应(图6d和e)。此外,我们在缺血再灌注刺激的ad-usp10转基因小鼠中验证了相关的tak1-jnk/p38信号通路。结果表明usp10过表达抑制i/r损伤后肝组织tak1-jnk/p38信号通路(图6c和f)。这些观察结果表明usp10抑制tak1-jnk/p38信号的激活在双侧肝缺血再灌注损伤时。
7)tak1介导usp10在肝i/r损伤中的有害作用
我们评估usp10调节肝细胞炎症和凋亡是否依赖于tak1。从usp10-hz和wt小鼠的肝脏中分离出原代肝细胞。tak1抑制剂5z-7-ox被用来阻断tak1及其下游信号通路分子p38和jnk的活性(图7a)。结果表明,在h/r治疗后,usp10基因敲除显著增加肝细胞炎症因子的分泌和nf-κb信号的激活;然而,这一作用被抑制tak1阻断(图7b,c);值得注意的是,tak1抑制对usp10敲除后加重的肝细胞凋亡具有显著的保护作用,表现为baxmrna和蛋白表达降低,bcl2mrna和蛋白表达升高(图7d和e)。为避免不特异性的tak1抑制剂效应,制备了tak1显性阴性突变腺病毒,完全抑制tak1功能(图8a)。结果显示,在h/r过程中,dn-tak1对肝细胞炎症和usp10敲除加重的凋亡具有保护作用(图8a-e)。
这些观察结果表明,tak1抑制消除了usp10敲低对炎症和肝细胞凋亡的影响,表明tak1介导了usp10在肝i/r损伤中的保护作用。
序列表
<110>武汉大学
<120>usp10在肝脏缺血再灌注损伤中的应用
<160>6
<170>siposequencelisting1.0
<210>1
<211>46
<212>dna
<213>人工序列(artificialsequence)
<400>1
ggctagcgatatcggatccgccaccatggccctccacaacccacag46
<210>2
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgtccttgtaatcactagtcagcaggtccacgcggcggt39
<210>3
<211>43
<212>dna
<213>人工序列(artificialsequence)
<400>3
ggctagcatcggatcgccatcatcggatcgccatcagtccgcc43
<210>4
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>4
cgtcttgtaatcagtgtgtgcctctctgc29
<210>5
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>5
gatgtcgtctattacagagaagtg24
<210>6
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>6
cactttctatggttagcgacatc23
- 还没有人留言评论。精彩留言会获得点赞!