X842的口服制剂的制作方法
x842的口服制剂
1.本发明涉及x842的立即释放口服制剂,其仅包含有限量的表面活性剂。本发明还涉及该口服制剂在治疗胃肠炎性疾病或胃酸相关疾病,特别是糜烂性胃食管反流病(egerd)中的用途。
背景技术:
2.化合物5-{2-[({8-[(2,6-二甲基苄基)氨基]-2,3-二甲基咪唑并[1,2-a]吡啶-6-基}羰基)-氨基]乙氧基}-5-氧代戊酸(x842;结构如下所示)公开于wo 2010/063876。它是一种钾竞争性酸阻滞剂(p-cab),竞争性抑制壁细胞中的胃氢钾泵(h
+
/k
+
atp酶)。因此,x842可用于控制胃中胃酸的分泌。
[0003][0004]
x842是利那拉生(linaprazan)的前药,利那拉生在wo 99/55706中公开,并且之前在i期和ii期研究中进行了研究。这些研究表明利那拉生具有良好的耐受性,起效快,首次给药时起效充分。然而,利那拉生很快从体内排出,酸抑制的持续时间太短。相比之下,与利那拉生相比,x842在体内的半衰期更长,对胃酸产生的完全控制时间更长。一项临床i期研究表明,施用单剂量x842可将胃内酸度维持在ph 4以上24小时。因此,x842专为患有严重糜烂性胃食管反流病(egerd)的患者量身定制。
[0005]
x842的溶解度很低。它在ph 6.8时几乎不溶于水,而在ph 1.0时在水中的溶解度已确定低至约0.113mg/ml。这种低溶解度对于固体口服制剂来说是有问题的,特别是对于活性成分应该仅在短时间内溶解的固体速释制剂。
[0006]
因此需要一种口服施用后在胃中快速溶解的x842制剂。这样的制剂应该适用于根除幽门螺杆菌和治疗胃酸反流病,特别是治疗严重的糜烂性胃食管反流病。如果这样的制剂允许每天施用一次,那将是希望的。
技术实现要素:
[0007]
已经发现,当x842的固体制剂包含有限量的药学上可接受的表面活性剂时,该制剂能够迅速溶解在水溶液中。因此,在第一方面,本发明涉及用于立即释放的x842口服制剂,其包含:
[0008]
a)治疗有效量的x842;和
[0009]
b)表面活性剂,其量相对于x842的量为约12.0%(w/w)或更少。
[0010]
表面活性剂可以是阳离子表面活性剂、阴离子表面活性剂或非离子表面活性剂。
阳离子表面活性剂的实例包括但不限于十六烷基三甲基溴化铵(西曲溴铵)和氯化十六烷基吡啶。阴离子表面活性剂的实例包括但不限于十二烷基硫酸钠(月桂基硫酸钠)和十二烷基硫酸铵(月桂基硫酸铵)。非离子表面活性剂的实例包括但不限于单油酸甘油酯、单硬脂酸甘油酯、聚氧基蓖麻油(cremophor el)、泊洛沙姆(例如泊洛沙姆407或188)、聚山梨醇酯80和脱水山梨糖醇酯(tween)。在一个优选的实施方案中,表面活性剂是阴离子表面活性剂。在进一步优选的实施方案中,阴离子表面活性剂是十二烷基硫酸钠。
[0011]
表面活性剂可以以相对于x842的量,从约1.0%(w/w)的量存在于制剂中,例如相对于x842的量,约2.0至约12.0%(w/w),例如约4.0至约12.0%(w/w),例如约6.0至约12.0%(w/w),例如约8.0至约12.0%(w/w),或例如约10.0至约12.0%(w/w)。制剂中表面活性剂的量优选尽可能低。因此,在另一个实施方案中,制剂包含相对于x842的量,约1.0至约11.0%(w/w),例如约1.0至约10.0%(w/w),例如约1.0至约9.0%(w/w),例如约1.0至约8.0%(w/w),或例如约1.0至约7.0%(w/w)的表面活性剂。在另一个实施方案中,制剂包含相对于x842的量,约2.0至约11.0%(w/w),例如约2.0至约10.0%(w/w),例如约2.0至约9.0%(w/w),例如约2.0至约8.0%(w/w),或例如约2.0至约7.0%(w/w)的表面活性剂。在又一个实施方案中,制剂包含相对于x842的量,约4.0至约11.0%(w/w),例如约4.0至约10.0%(w/w),例如约4.0至约9.0%(w/w),例如约4.0至约8.0%(w/w),或例如约4.0至约7.0%(w/w)的表面活性剂。
[0012]
在一些实施方案中,制剂包含相对于x842的量为约11.0%(w/w)或更少的表面活性剂。在一些实施方案中,制剂包含相对于x842的量为约10.0%(w/w)或更少的表面活性剂。在一些实施方案中,制剂包含相对于x842的量为约9.0%(w/w)或更少的表面活性剂。在一些实施方案中,制剂包含相对于x842的量为约8.0%(w/w)或更少的表面活性剂。
[0013]
口服制剂可以另外包含一种或多种药学上可接受的赋形剂,所述赋形剂选自填充剂、崩解剂和润滑剂。
[0014]
合适的填充剂的实例包括但不限于磷酸二钙二水合物、硫酸钙、乳糖(例如乳糖一水合物)、蔗糖、甘露醇、山梨糖醇、纤维素、微晶纤维素、干淀粉、水解淀粉和预胶化淀粉。在某些实施方案中,填充剂是乳糖,例如乳糖一水合物。
[0015]
合适的崩解剂的实例包括但不限于干淀粉、改性淀粉(例如(部分)预胶化淀粉、羟基乙酸淀粉钠和羧甲基淀粉钠)、海藻酸、纤维素衍生物(例如羧甲基纤维素钠、羟丙基纤维素和低取代羟丙基纤维素(l-hpc))和交联聚合物(如羧甲基纤维素、交联羧甲基纤维素钠、羧甲基纤维素钙和交联pvp(交联聚维酮))。在某些实施方案中,崩解剂是交联羧甲基纤维素钠。
[0016]
合适的润滑剂的实例包括但不限于滑石、硬脂酸镁、硬脂酸钙、硬脂富马酸钠、硬脂酸、山嵛酸甘油酯、胶态无水二氧化硅、二氧化硅水溶液、合成硅酸镁、细粒二氧化硅、淀粉、月桂基硫酸钠、硼酸、氧化镁、蜡(如巴西棕榈蜡)、氢化油、聚乙二醇、苯甲酸钠、聚乙二醇和矿物油。在某些实施方案中,润滑剂是硬脂富马酸钠。
[0017]
在另一个实施方案中,口服制剂包含:
[0018]
a)治疗有效量的x842;
[0019]
b)阴离子表面活性剂,其量相对于x842的量为约12.0%(w/w)或更少;和
[0020]
c)至少一种填充剂;
[0021]
d)至少一种崩解剂;和
[0022]
e)至少一种润滑剂。
[0023]
在另一个实施方案中,口服制剂包含:
[0024]
a)治疗有效量的x842;
[0025]
b)十二烷基硫酸钠,其量相对于x842的量为约12.0%(w/w)或更少;
[0026]
c)乳糖一水合物;
[0027]
d)交联羧甲基纤维素钠;和
[0028]
e)硬脂富马酸钠。
[0029]
在一个实施方案中,口服制剂另外包含助流剂。合适的助流剂的实例包括但不限于滑石、淀粉、硬脂酸镁、硬脂酸钙、胶态无水二氧化硅、合成硅酸镁、细粒氧化硅。在某些实施方案中,助流剂是胶态无水二氧化硅。
[0030]
在另一个实施方案中,制剂不包含微晶纤维素。
[0031]
优选将制剂的成分混合成均匀混合物,然后配制成片剂或胶囊剂。可以使用常规技术,例如旋转压片机将成分的均匀混合物压制成片剂。或者,可以通过添加液体如水和/或合适的有机溶剂(例如乙醇或异丙醇)来润湿混合物,然后造粒并干燥。然后可以使用常规技术将获得的颗粒压制成片剂。胶囊可包含成分的粉末混合物或小的多颗粒(例如颗粒剂、挤压丸剂或小片剂)。在一个优选的实施方案中,制剂是片剂的形式。
[0032]
x842的施用量根据接受治疗的患者将不同,并且可以从每天约0.5mg/kg至约5mg/kg体重变化,例如每天约1.0mg/kg,或每天约1.5mg/kg,或每天约2.0mg/kg,或每天约2.5mg/kg。x842的施用量取决于疾病的严重程度、患者的年龄和体重以及主治医师在确定患者的适当剂量水平时通常考虑的其他因素。
[0033]
在一个实施方案中,制剂的单位剂量包含约25至约250mg的x842,例如约50至约250mg的x842,例如约50至约200mg的x842,或例如约50至150mg的x842。例如,制剂的单位剂量可包含约30mg、约40mg、约50mg、约60mg、约70mg、约80mg、约90mg、约100mg、约110mg、约120mg、约130mg、约140mg、约150mg、约160mg、约170mg、约180mg、约190mg或约200mg的x842。日剂量可以作为单剂量施用或分成两个、三个或更多个单位剂量。
[0034]
口服制剂中存在少量表面活性剂(例如阴离子表面活性剂,例如十二烷基硫酸钠)允许活性成分(x842)快速溶解在水性环境中,例如胃内容物中。x842的溶出速率可以很容易地在体外使用基于欧洲药典9.0专论2.9.3,例如,如实验部分所述的方法进行测定。因此,在一个实施方案中,本文公开的制剂在30分钟内表现出至少70%的溶出度,如使用溶出仪2(桨式)欧洲药典2.9.3(dissolution apparatus 2(paddle)ph.eur 2.9.3)测量的。在一个更优选的实施方案中,制剂在10分钟内显示出至少85%的溶出度,如使用溶出仪2(桨式)欧洲药典2.9.3测量的。在另一个优选的实施方案中,制剂在15分钟内显示出至少95%的溶出度,如使用溶出仪2(桨式)欧洲药典2.9.3测量的。
[0035]
吸收入血流后,x842迅速代谢为x842的活性代谢物利那拉生。虽然x842的血浆浓度非常低且难以测定,但可以改为测定利那拉生的血浆浓度。i期研究表明,某些剂量的x842应该能够在施用后24小时内将胃内ph值维持在4以上。据估计,这需要22小时后至少约240nmol/l的利那拉生最小血浆浓度(c
min
)。在这样的剂量,每天一次施用制剂就足够了。因此,在另一个实施方案中,本发明涉及本文公开的制剂,其中在将口服制剂施用于人22小时
后,所述制剂在所述人中提供至少约240nmol/l的利那拉生c
min
。在一个优选的实施方案中,本发明涉及如本文所公开的制剂,其中在将口服制剂施用于人22小时后,所述制剂的单位剂量在所述人中提供至少约240nmol/l的利那拉生c
min
。
[0036]
在一个具体实施方案中,制剂具有以下组成:
[0037][0038]
如本文所用,术语“有效量”或“治疗有效量”是指x842的足够量,其在施用于受试者后将在一定程度上缓解所治疗疾病或病症的一种或多种症状。结果包括减少和/或减轻疾病的体征、症状或原因,或生物系统的任何其他所需改变。例如,用于治疗用途的“有效量”是提供临床上疾病症状显著减少所需的x842的量。在任何个体情况下,适当的“有效”量是使用任何合适的技术来确定的,例如剂量递增研究。
[0039]
如本文所用,术语“约”是指本文中的值或参数,其包括(并描述)针对该值或参数本身的实施方案。例如,提及“约20”的描述包括“20”的描述。数字范围包括定义范围的数字。一般而言,术语“约”是指变量的指示值以及在指示值的实验误差内(例如,在平均值的95%置信区间内)或指示值的10%内的变量的所有值,以范围较大者为准。
[0040]
本文公开的口服制剂可用于治疗预防其中必须或期望抑制胃酸分泌的疾病或病症,例如根除幽门螺杆菌。此类疾病和病症的实例包括胃肠炎性疾病和胃酸相关疾病,例如胃炎、胃食管反流病(gerd)、糜烂性胃食管反流病(egerd)、幽门螺杆菌感染、zollinger-ellison综合征、消化性溃疡病(包括胃溃疡和十二指肠溃疡)、胃溃疡出血、胃食管反流病的症状(包括胃灼热、反胃和恶心)、胃泌素瘤和急性上消化道出血。因此,一方面,本发明涉及本文公开的口服制剂,其用于治疗或预防胃肠炎性疾病或胃酸相关疾病。在另一方面,本发明涉及本文公开的口服制剂用于治疗或预防胃肠炎性疾病或胃酸相关疾病的用途。在又一方面,本发明涉及治疗或预防受试者例如人的胃肠道炎性疾病或胃酸相关疾病的方法,包括向需要此类治疗或预防的受试者施用治疗有效量的本文公开的口服制剂。在一个具体实施方案中,gerd的治疗是gerd的按需治疗。
[0041]
本发明通过以下实施例进一步说明,这些实施例在任何方面不限制本发明。
实施例
[0042]
实施例1
[0043]
制剂的制备
[0044]
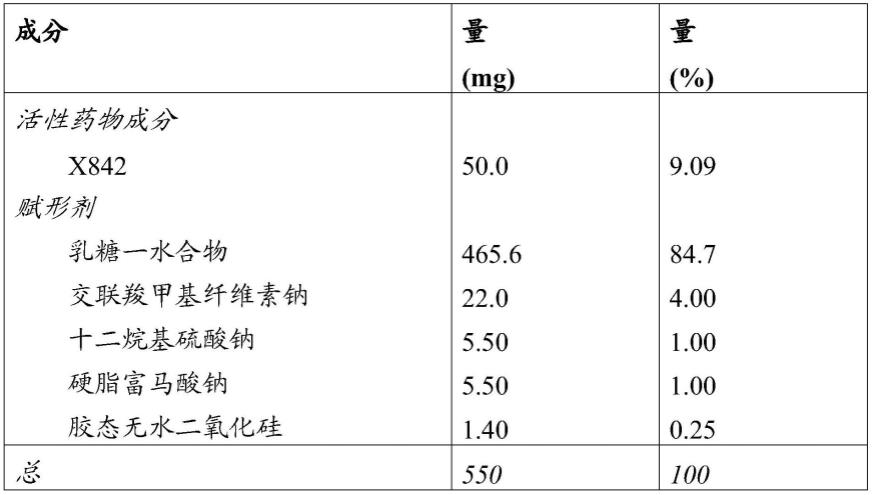
使用下表中所示的量,以2kg的规模制备包含50mg x842的片剂。
[0045][0046][0047]
将胶态无水二氧化硅和x842预混合并通过不锈钢筛网筛入混合容器中。将乳糖一水合物、交联羧甲基纤维素钠和十二烷基硫酸钠通过不锈钢网筛分并添加到混合容器中。在混合容器中进行混合约20分钟。
[0048]
将硬脂富马酸钠与一小部分粉末混合物预混合,通过不锈钢网并添加到混合容器中。在混合容器中进行混合约5分钟。
[0049]
然后将粉末混合物在旋转压片机中压制成圆形的550mg片剂。将压缩片剂装入塑料瓶中并贴上标签。
[0050]
实施例2
[0051]
溶出度测试
[0052]
使用如欧洲药典9.0专论2.9.3所述的溶出仪2(桨式)测定实施例1的片剂的溶出特性。将1片片剂加入装有900ml含有0.2%sds的醋酸缓冲溶液(ph 4.5)的容器中,并在37
±
0.5℃搅拌内容物。在不同的时间点取溶液样品,并使用紫外分光光度计在302nm处量化溶解的x842的量。每个实验重复6次,计算平均值。实施例1的片剂的溶出特性如下表所示。
[0053][0054]
实施例3
[0055]
稳定性测试
[0056]
多批x842片剂储存在25℃和60%相对湿度的开放hdpe瓶中,或储存在25℃和60%相对湿度(长期储存条件)或在40℃和75%相对湿度(加速条件)的带有ldpe/hdpe盖的封闭hdpe瓶中。x842、降解产物和水的量,以及溶出特性,将以选定的时间间隔测定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1