去泛素化酶在制备预防或治疗急性移植物抗宿主病和移植物抗白血病药物中的应用
1.本发明属于生物医药领域,具体涉及去泛素化酶brcc3在制备预防或治疗急性移植物抗宿主病和移植物抗白血病药物中的应用。
背景技术:
2.异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-hsct)是目前治疗恶性血液系统疾病、某些遗传性疾病及骨髓衰竭性疾病的重要手段(图1),主要通过供体来源的移植物介导抗白血病反应(graft-versus leukemia,gvl)发挥治疗恶性血液病和防止移植后复发的关键性作用。然而,这些移植物中供体来源的t细胞也可诱导移植物抗宿主病,尤其是急性移植物抗宿主病(acute graft-versushostdisease,agvhd)是目前制约allo-hsct最严重的并发症之一,也是导致移植后发病率和死亡率的主要原因,主要累及肤、肝脏和胃肠道,靶器官可以单独或与其他器官连同受累。具有明显临床表现的agvhd的发病率在10%~80%之间,因移植方式不同,平均发病率约为40%,特别是发生激素耐药的agvhd,严重影响患者的生存质量和预后。因此,寻找有效的防治agvhd手段极其重要。
3.泛素化属于蛋白质翻译后修饰的一种,调控蛋白质的性质或功能,参与细胞信号传导、转录调节、dna损伤修复、细胞周期等过程,由去泛素化酶进行可逆性精密调控,共同参与稳定机体内蛋白的稳定,维持细胞功能。人源去泛素化酶brcc36,其鼠源同源物brcc3,属于jamm蛋白酶家族,含zn
2+
结构域,是构成细胞核内brca1-a去泛素化酶复合物和细胞质内brisc去泛素化酶复合物的核心催化活性亚基,参与炎性小体活性、干扰素信号传导和dna损伤修复等过程。既往有关于brcc36调控干扰素信号通路,进而影响免疫应答的机制报道。i型干扰素ifnβ的包膜受体ifnar1受到e3泛素连接酶scf
β-trcp
的泛素化修饰调控。brisc去泛素化酶复合物可特异性裂解ifnar1的泛素链结合,抑制其降解过程,从而促进细胞对i型干扰素的反应,这都为brcc3制备药物预防癌症和自身免疫疾病提供新的治疗方法。
4.agvhd的发病机制复杂,治疗效果更差,激素耐药的agvhd患者预后差,且长期使用激素会带来糖尿病、感染、骨质疏松、精神状态异常等不良反应,影响患者生活质量,严重者危及患者生命,急需探寻出能防治agvhd的有效方法。且既往并没有brcc3在agvhd中进行防治的报道。
5.泛素化修饰,属于蛋白翻译后修饰的一种,类似甲基化、磷酸化、乙酰化等,参与细胞信号传导、转录调节、dna损伤修复、细胞周期、细胞凋亡、囊泡运输等生理过程。去泛素化酶能可逆调控泛素化过程,与泛素化系统共同组成一个覆盖几乎所有细胞功能的复杂网络。近年来,靶向作用于泛素化修饰过程的研究取得了一定的成果。人源去泛素化酶brcc36,其鼠源同源物brcc3,是一种含zn
2+
结构域的金属蛋白去泛素化酶,既往被报道通过调控干扰素信号通路,影响免疫应答,为癌症和自身免疫疾病提供新的治疗方法。然而其在agvhd中的作用至今尚未报道。
技术实现要素:
6.本发明通过动物实验研究探索一种去泛素化酶brcc3在制备预防和治疗移植物抗宿主病、移植物抗白血病药物中的应用。
7.本发明提供去泛素化酶brcc3在制备预防或治疗急性移植物抗宿主病及移植物抗白血病药物的应用。
8.优选的,所述药物用于抑制小鼠agvhd。
9.优选的,所述药物用于抑制靶器官中t细胞的活化。
10.优选的,所述药物用于抑制t细胞分泌ifnγ,抑制t细胞的功能。
11.优选的,所述药物用于抑制靶器官中巨噬细胞的产生。
12.优选的,所述药物用于上调e3泛素连接酶trim25的蛋白水平。
13.优选的,所述药物用于通过蛋白酶体途径,下调e3泛素连接酶trim25的泛素化,去除k48和k63位泛素水平。
14.优选的,所述药物用于促进ifnβ分泌。
15.优选的,所述药物用于在抑制agvhd的同时抑制体内白血病细胞的生长,保留gvl效应。
16.本发明还提供一种预防或治疗急性移植物抗宿主病及移植物抗白血病的药物,所述药物包括去泛素化酶brcc3。
17.进一步地,所述去泛素化酶brcc3的用药剂量为40-60μg/ml。
18.进一步地,所述药物的给药途径包括口服、腹腔注射、皮下注射、静脉注射和肌肉注射中的一种或多种。
19.本发明的技术方案相比现有技术具有以下优点:
20.本发明中brcc3具有抑制异基因造血干细胞移植后急性移植物抗宿主病的作用;能抑制供体t细胞活化和t细胞的功能,抑制巨噬细胞细胞的增殖;通过蛋白酶体途径,下调trim25的泛素化修饰,稳定trim25的蛋白水平,进而促进ifnβ的分泌,抑制agvhd的发生发展;同时还保留gvl效应。
附图说明
21.图1为gvhd模型小鼠移植后的生存曲线(a)、体重变化(b)、agvhd评分(c)图。
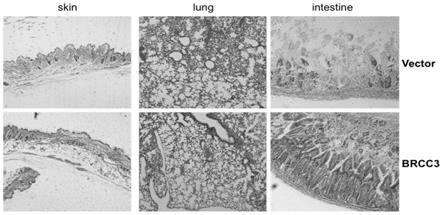
22.图2为vector组和brcc3组小鼠皮肤、肺部、肠道组织h&e染色图。
23.图3为brcc3对t细胞活化的抑制作用图。
24.图4为brcc3对t细胞功能的抑制作用图。
25.图5为brcc3对巨噬细胞的抑制图。
26.图6为brcc3对e3泛素连接酶trim25的蛋白水平的抑制作用图。
27.图7为brcc3对trim25蛋白的泛素化修饰水平的抑制作用图。
28.图8为brcc3通过蛋白酶体途径调控trim25的泛素化水平图。
29.图9为brcc3促进ifnβ的转录活性的作用图。
30.图10为敲减brcc3对巨噬细胞中ifnβ的表达的抑制作用图。
31.图11为brcc3对巨噬细胞中ifnβ的表达和炎症因子的分泌的作用图。
32.图12为brcc3在小鼠体内对ifnβ的表达的促进作用图。
33.图13为gvhd/gvl模型小鼠移植后的生存曲线(a)、体重变化(b)、agvhd评分(c)图。
34.图14为小鼠活体成像图及量化的白血病细胞统计图。
35.图15为小活体成像体内荧光值的量化图。
36.图中,*代表p<0.05,**代表p<0.01,***代表p<0.001。
具体实施方式
37.下面结合附图和具体实施例对本发明作进一步说明,以使本领域的技术人员可以更好地理解本发明并能予以实施,但所举实施例不作为对本发明的限定。
38.实施例1cacl2法制备dh5α感受态
39.在无菌超净台中进行制备200ml 0.1m cacl2各2瓶,高压灭菌后使用前冰上预冷;取-80℃保存的dh5α单克隆菌种,蘸取涂抹于无抗生素的灭菌后固态lb培养基,隔水式恒温培养箱37℃培养12-16h至形成菌落;挑选固态lb培养基上单个菌落,接种到5ml无抗生素灭菌后新鲜lb培养基,置于水平摇床37℃,250rpm振荡过夜(12-16h);取50μl上述菌液至100ml无抗生素灭菌后新鲜lb培养基中,置于水平摇床37℃,250rpm振荡3h;将上述菌液冰浴30min,倒入预冷的50ml无菌离心管中,冰浴10min,3500rpm,4℃离心15min;弃上清,用25ml(或原菌液1/3体积)冰预冷的0.1m cacl2重悬菌体,冰浴10min,3500rpm,4℃离心10min;弃上清,用50ml冰预冷的0.1m cacl2重悬,冰浴20min,3500rpm,4℃离心10min;弃上清,用5ml(或原菌液1/15体积)预冷的0.1m cacl2(含20%甘油)重悬沉淀;每100μl分装至无菌的1.5ml ep管,-80℃冰箱冻存备用。感受态检测:取感受态细菌涂于含a
+
/k
+
的lb培养基平板,隔水式恒温培养箱37℃培养12-16h,观察感受态细菌是否污染。
40.实施例2质粒的抽提
41.质粒的转化:取dh5α感受态细菌50μl,立刻置于冰上融化6-8min;吸取目标质粒1μl加入感受态细菌中,轻柔吹匀,冰浴15-30min;至于42℃水浴锅/金属浴中,热激90s,立刻置于冰上,静置2-3min;加入200μl灭菌后的新鲜lb培养基,置于水平摇床37℃,250rpm振荡30-45min;3000rpm离心10min,吸掉100μl上清,轻柔吹匀后涂于灭菌后a
+
固态lb培养基平板上;待菌液吸收后,将lb培养板置于恒温恒湿培养箱37℃培养过夜至形成菌落(12-16h)。
42.单克隆扩增:挑取转化的单个菌落加入3ml含有氨苄霉素的灭菌后的新鲜lb培养基中,37℃,250rpm振荡2-3h;取1ml扩增后的菌液利用axygen小抽试剂盒说明抽提质粒(可略);取1ml扩增后的菌液至400ml灭菌后含有100μg/ml a+的新鲜lb培养基中,置于水平摇床37℃,250rpm振荡过夜(12-16h);收菌:3400rpm,4℃离心30min,弃上清,得到沉淀即为所需菌体,-20℃冻存。
43.康为高纯度质粒抽提试剂:将rna酶全加入buffer p1中,4℃存储备用,buffer pw中加入乙醇,室温存放;将冻存后的菌体置于室温至其融化,加入buffer p115 ml重悬菌体,充分吹匀;加入buffer p215 ml,上下轻柔颠倒8~10次,使菌体充分裂解,室温静置3~5min(不超过5min),溶液变得清亮粘稠;加入buffer p315 ml,立即上下轻柔颠倒8~10次,出现白色絮状沉淀,静置5min,12000g,4℃高速离心10min;用200目尼龙膜过滤留取上清,弃去裂解后的菌体;将上清倒入除内毒素过滤器(fq)中,缓慢推动推柄过滤,收集在自备50ml离心管中;柱平衡:向已装入收集管中的吸附柱(dq)中加入buffer ps 2ml,12000g,4℃高速离心2min,倒弃收集管中的废液,吸附柱重新放回收集管中;过柱:将50ml离心管中
的过滤后的液体转移至吸附柱中,12000g,4℃离心2min,倒弃废液,多次过柱,每次加入吸附柱的体积不超过10ml;向吸附柱中加入buffer pw 10ml,12000g,4℃高速离心2min,倒弃废液;此步骤重复一次;将吸附柱重新放回收集管中,12000g,4℃高速离心5min,倒掉废液;放置于室温5min,彻底晾干残余的漂洗液,加入1ml烘箱预热65℃的灭菌双蒸水,室温静置5min,12000g,4℃高速离心5min;将收集管中的液体再次加入吸附柱膜中间,12000g,4℃高速离心5min;用分光光度仪检测质粒浓度,-20℃冻存;酶切鉴定正确后送测序验证质粒。
44.实施例3微环质粒的抽提
45.真核表达质粒经过转化诱导后可成微环质粒,可在体内稳定表达而不被降解,通过hgt方法注射到小鼠体内,致使小鼠体内稳定高表达目的基因,而且由于不含细菌的dna骨架,不会引起免疫原性反应,适用于体内实验构建过表达体系的小鼠模型。
46.3.1微环质粒的转化:取zycy10p3s2t e.coli感受态细菌50μl,立刻置于冰上融化6-8min;吸取微环质粒1μl加入感受态细菌中,轻柔吹匀,冰浴15-30min;置入42℃水浴锅/金属浴中,热激90s,立刻放冰上,静置2-3min;加入200μl灭菌后的新鲜lb培养基,置于水平摇床37℃,250rpm振荡30-45min;3000rpm离心10min,吸掉100μl上清,轻柔吹匀后涂于灭菌后k+固态lb培养基平板上;待菌液吸收后,将lb培养板置于恒温恒湿培养箱37℃培养过夜至形成菌落(12-16h)。
47.3.2微环质粒的诱导:制备30%l-arabinose溶液和5%naoh溶液,用0.22μm无菌过滤器过滤除菌;挑取转化的单个菌落加入2ml灭菌后含有100μg/ml k
+
的新鲜tb培养基中,37℃,250rpm振荡2-3h;吸取100μl活化的菌液至400ml灭菌后含有100μg/ml k
+
的新鲜tb培养基中,并加入40ml灭菌后的磷酸盐缓冲液,置于水平摇床37℃,250rpm振荡过夜(12-14h);加入400ml灭菌后含有100μg/ml k
+
的新鲜lb培养基和4ml 30%l-arabinose溶液;测量菌液ph,若ph《7,则继续加入4ml 5%naoh溶液,调至弱碱性,置于水平摇床37℃,250rpm振荡2h;继续加入4ml 30%l-arabinose,测菌液ph,若ph《7,则继续加入4ml 5%naoh溶液,调至弱碱性,置于水平摇床37℃,250rpm振荡2h;此步骤重复一次;收菌:3400rpm,4℃离心30min,弃上清,-20℃冻存菌体可提高抽提效。
48.3.3 invitrogen大抽试剂盒大抽质粒:将冻存后的菌体置于室温至其融化,加入solution i溶液120ml重悬菌体,充分吹匀,避免残留团块,溶解菌体;加入solution ii溶液120ml,轻柔混匀,使菌体充分裂解至澄清微粘稠状态;加入solution iii溶液120ml,轻柔混匀,出现白色絮状沉淀;12000g,4℃高速离心10min,用200目尼龙膜过滤,留取上清为裂解后所需的胞核内物;按照锥形瓶-口卡-平衡柱的顺序由下至上放置平衡柱系统,将30ml eq1溶液加入平衡柱中,逐滴滴完以平衡柱子;将离心过滤后所得的上清胞核内物缓慢倒入平衡柱中,逐滴滴完以吸附上清液中的胞核内物;将w8溶液60ml加入平衡柱中,逐滴滴完以润洗平衡柱;将平衡柱转移至干净的圆底管上,加入e4溶液15ml,收集圆底管中的洗脱液;加入异丙醇10.5ml至圆底管中,轻柔颠倒混匀,12000g,4℃高速离心30min,弃上清;加入无水乙醇5ml至圆底管中,12000g,4℃高速离心6min,小心弃去上清;放置于通风处室温彻底晾干,加入1ml烘箱预热65℃的灭菌双蒸水重悬沉淀,充分混匀;用分光光度仪检测质粒浓度,-20℃冻存;酶切跑琼脂糖电泳鉴定微环质粒成功构建。
49.实施例4目的基因的瞬时转染表达
50.(1)瞬转体系:
[0051][0052]
(2)根据孔板规格接种细胞,加入完全培养基,置于37℃,co2培养箱中培养至80%;
[0053]
(3)无菌状态下配置如下溶液:
[0054]
a溶液:用无血清培养基稀释待转染的质粒;
[0055]
b溶液:用无血清培养基稀释转染试剂(质粒:转染试剂为1:2);
[0056]
(4)将a和b溶液轻柔混匀,室温下静置10min;
[0057]
(5)弃去原细胞培养基,换用无血清培养基;
[0058]
(6)并混合后的ab溶液逐滴加入到每孔,轻摇混匀,置于37℃,co2培养箱中培养6-8h;弃去转染液,换为完全培养基继续培养,48-72h后收集结果,进一步检测。
[0059]
实施例5双荧光素酶报告实验
[0060]
按照说明书配制1
×
plb、lar ii和1
×
stop solution试剂;利用瞬时转染方法制备样品,弃去培养基,转移至ep管中;用1
×
pbs洗两遍,450g,4℃离心5min,弃上清;加入100μl 1
×
plb裂解液100μl,置于水平摇床上振荡裂解15min;取20μl裂解产物至96孔平底板,充分吹匀;室温避光条件下,加入50μl荧光底物液lar ii,用酶标仪检测luciferase荧光值;迅速加入50μl 1
×
stop solution,立即用酶标仪检测renila荧光值;利用两组荧光值比,比较各组间报告基因的表达量。
[0061]
实施例6转录水平测定目的基因的相对表达量
[0062]
6.1 rna提取(trizol)
[0063]
取移植后小鼠的脾、肝、肺和小肠组织至于无核酶ep管中,加入trizol试剂300μl,使用组织研磨枪充分研磨细胞;继续加入700μl trizol试剂,反复吹匀至不粘连,冰上静置5min;加入200μl三氯甲烷,涡旋仪剧烈振荡15s,室温静置5min;12000g,4℃离心15min,吸取上层清液至另准备的无核酶ep管中,加入等体积的异丙醇,上下颠倒混匀,室温静置10min;12000g,4℃离心10min,可见底部白色沉淀,弃上清;加入预冷的75%乙醇(depc水配制)1ml,点到混匀,8000rpm,4℃离心5min,,弃上清;此步骤重复一次;倒扣晾干,待乙醇挥发后加入20-50μl烘箱预热的depc水溶解沉淀;用分光光度仪检测质粒浓度,260/280值在1.8-2.0,260/230大于2.0表示纯度良好;-80℃冻存。
[0064]
6.2 rna逆转录成cdna(10μl体系)
[0065]
根据所得rna浓度配制工作液
①
(6μl):
[0066][0067]
置于pcr仪/水浴锅65℃中5min;
[0068]
配制工作液
②
(4μl):
[0069][0070]
置于pcr仪/水浴锅中42℃1h,70℃10min,-20℃冻存。
[0071]
6.3实时荧光定量pcr(realtime pcr)
[0072]
将逆转录的cdna进行pcr扩增,配制定量pcr体系(20μl):
[0073][0074]
定量pcr反应条件:95℃30s,(95℃5s,60℃30s)
×
40个循环;
[0075]
以gapdh/actin作为内参,使用δδct的方法分析目的基因的相对表达量。
[0076]
实施例7蛋白水平测定目的基因的相对表达量
[0077]
7.1蛋白样品的制备
[0078]
预冷台式冷冻离心机至4℃,金属浴加热至100℃备用;弃去原细胞培养基,用1
×
pbs溶液洗涤细胞两遍,450g,4℃离心5min,弃上清;制备蛋白裂解液:将pmsf蛋白酶抑制剂:ripa强裂解液按照1:100的比例配制,轻柔混匀,置于冰上备用;根据细胞量加入蛋白裂解液,置于冰上,利用超声波细胞粉碎机充分裂解蛋白;12000g,4℃离心15min,吸取上清转移至新ep管中;bradford蛋白定量试剂盒检测蛋白浓度;向蛋白样品加入6
×
loading buffer,吹匀或涡旋混匀,100℃金属浴煮蛋白10min;12000g瞬离后置于冰上冷却2-3min,-20℃冻存。
[0079]
7.2蛋白免疫印迹(western blot)
[0080]
根据蛋白质的分子量,配制相应浓度sds-page分离胶和浓缩胶,将胶板放入电泳槽中,加入稀释后的1
×
running buffer电泳液,分别加入蛋白marker和样品;电泳:浓缩胶内跑胶时,设定电泳条件为电压80v,20min,直至样品进入分离胶,调整电压为120v,90min,至溴酚蓝快到胶底时可停止电泳;转膜:将提前预冷配制的1
×
transfer buffer加入转膜槽中,准备与分离胶尺寸相应大小的pvdf(整板尺寸为8
×
6.5cm),置于无水甲醇中浸泡15s激活;将pvdf膜、滤纸、海绵垫一起放入transfer buffer中平衡15-20min,同时修剪多余浓缩胶,在transfer buffer中分离胶板和胶体;按照由阴极到阳极顺序(黑到白)在转膜板上依次放上海绵垫、滤纸、胶、pvdf膜、滤纸、海绵垫,依次赶走气泡,夹紧转膜板,放入转膜槽中,四周放入冰袋,设电流为200ma恒流转膜90min;封闭:转膜完成后,修剪pvdf膜,加入用1
×
tbst配制的封闭液(5%脱脂牛奶/bsa),置于摇床室温封闭1h或4℃摇床封闭过夜;一抗孵育:弃去封闭液,用1
×
tbst涮洗后弃去,加入用3%bsa稀释一抗溶液,4℃摇床孵育过夜(12-16h),避免气泡;洗膜:回收一抗溶液,用1
×
tbst洗膜3次,每次10min;二抗孵育:弃去tbst,加入用3%bsa稀释二抗溶液(1:10000),置于摇床室温孵育1h;洗膜:回收一抗溶液,用1
×
tbst洗膜3次,每次10min;显影:室温避光条件下,超敏ecl液的a液:b液按照1:1的比例配制显影液,均匀滴到膜上,利用clinx化学发光成像仪显影、曝光拍摄照片。
[0081]
实施例8免疫沉淀/免疫共沉淀(ip/co-ip)
[0082]
利用瞬时转染方法制备样品,弃去培养基,转移至ep管中;用1
×
pbs洗两遍,450g,4℃离心5min,弃上清;制备蛋白裂解液:将pmsf蛋白酶抑制剂:pi cocktail:ip裂解液按照1:1:100的比例配制,轻柔混匀,置于冰上备用;加入300μl裂解液冰浴,置于水平摇床上振荡裂解30min;12000g,4℃离心15min,将上层无色裂解产物转移至新的ep管中(无核酶ep管);按照1:100的比例加入ip抗体,取30μl留作input,封口膜密封,置于4℃翻转摇床孵育过夜;预冷1%np40 washing buffer和离心机,取proteina/g beads 40μl/样品,加入1ml washing buffer清洗beads,12000g,4℃离心2min,吸弃上清,重复洗2遍;按照原样品量等体积加入washing buffer重悬beads,充分混匀,取40μl迅速加入各样品中,封口膜密封,置于4℃翻转摇床孵育2h;12000g,4℃离心5min,吸弃上清,用washing buffer洗3遍,尽量吸弃上清;加入washing buffer 40μl和1
×
loading buffer 8μl,100℃金属浴10min;12000g瞬离后置于冰上冷却2-3min,-20℃冻存,留取进行western blot。
[0083]
实施例9小鼠各组织细胞的制备
[0084]
9.1小鼠骨髓细胞悬液的制备
[0085]
颈椎脱臼处死小鼠,浸泡于75%酒精溶液中消毒;取小鼠双下肢股、胫骨及脊柱,剔除多余肌肉组织,置于装有1640培养基的研钵中,用研磨杵轻柔挤压研磨,直至大部分细胞都研出;将研磨所得的细胞悬液经200目尼龙网过滤至干净的50ml离心管中,1300rpm,4℃离心8min,弃上清;按照5ml 1
×
rbc裂解液/只小鼠的比例加入后充分重悬,室温裂解7min,加入30-40ml 1640培养基终止裂解,1300rpm,4℃离心8min,弃上清;用适量1
×
pbs/1640培养基重悬细胞重悬细胞,经200目尼龙网过滤至干净的50ml离心管中,1300rpm,4℃离心8min,弃上清,以涮洗过滤死细胞团块;按照1ml 1
×
pbs溶液/只小鼠的比例加入后充分重悬细胞,计数板/计数仪计数后调节细胞悬液浓度,置于冰上待用。
[0086]
9.2小鼠脾细胞悬液的制备
[0087]
颈椎脱臼处死小鼠,浸泡于75%酒精溶液中消毒;取小鼠全脾,置于装有1640培养基的细胞培养皿中,,用载玻片轻柔挤压研磨,直至细胞都研出;将研磨所得的细胞悬液经200目尼龙网过滤至干净的50ml离心管中,1300rpm,4℃离心8min,弃上清;按照3ml 1
×
rbc裂解液/只小鼠的比例加入充分重悬,室温裂解5min,加入30-40ml 1640培养基终止裂解,1300rpm,4℃离心8min,弃上清;用适量1
×
pbs/1640培养基重悬细胞重悬细胞,经200目尼龙网过滤至干净的50ml离心管中,1300rpm,4℃离心8min,弃上清,以涮洗过滤死细胞团块;按照0.5-1ml 1
×
pbs或staining buffer溶液/只小鼠的比例加入后充分重悬细胞,计数板/计数仪计数后调节细胞悬液浓度,置于冰上待用。
[0088]
9.3小鼠肝脏淋巴细胞悬液的制备
[0089]
颈椎脱臼处死小鼠,浸泡于75%酒精溶液中消毒;逐层剪开小鼠胸腹腔、胸隔、右心耳,用10ml注射器吸取1
×
pbs,跟换细针头后用针尖插入左心室,缓慢注入pbs冲出肝脏中的血液至肝脏变白;取出小鼠肝脏,置于装有1640培养基的细胞培养皿中,用载玻片轻柔挤压研磨,直至细胞都研出;将研磨所得的细胞悬液经200目尼龙网过滤至干净的50ml离心管中,1300rpm,4℃离心6min,弃上清;用40%percoll淋巴细胞分离液5ml重悬细胞,2000rpm,室温离心20min,升速6降速0密度梯度离心,轻轻倒掉上面两层,仅保留最底层的肝脏淋巴细胞;按照5ml 1
×
rbc裂解液/只小鼠的比例加入后充分混匀,室温裂解5min,加入30-40ml 1640培养基终止裂解,1300rpm,4℃离心8min,弃上清;用4ml 1640培养基重悬
细胞,清洗一遍,1300rpm,4℃离心6min,弃上清;按照1ml staining buffer/只小鼠的比例加后重悬细胞,计数仪计数后待用。
[0090]
9.4小鼠肺脏淋巴细胞悬液的制备
[0091]
颈椎脱臼处死小鼠,浸泡于75%酒精溶液中消毒;逐层剪开小鼠胸腔、胸隔,取出小鼠肺脏,置于装有1640培养基(含10%fbs)的细胞培养皿中,用载玻片轻柔挤压研磨,直至细胞都研出;将研磨所得的细胞悬液经200目尼龙网过滤至干净的50ml离心管中,1300rpm,4℃离心6min,弃上清;用40%percoll淋巴细胞分离液5ml重悬细胞,2000rpm,室温离心20min,升速6降速0密度梯度离心,轻轻倒掉上面两层,仅保留最底层的肝脏淋巴细胞;按照5ml 1
×
rbc裂解液的比例加入后充分混匀,室温裂解5min,加入30-40ml 1640培养基终止裂解,1300rpm,4℃离心8min,弃上清;用40ml 1640培养基重悬细胞,清洗一遍,1300rpm,4℃离心6min,弃上清;按照1ml staining buffer/只小鼠的比例加后重悬细胞,计数仪计数后待用。
[0092]
9.5小鼠小肠上皮淋巴细胞悬液的制备
[0093]
颈椎脱臼处死小鼠,浸泡于75%酒精溶液中消毒;逐层剪开小鼠腹腔,取出小鼠肠道,离断十二指肠下段至回盲部间小肠部分,置于装有1640培养基(含10%fbs)的细胞培养皿中;用10ml注射器反复吸取1
×
pbs冲洗肠道,直至肠管冲洗干净,管内无排泄物残留,然后用剪刀将小肠纵切开,剪成3-5mm碎段后转移至50ml离心管中;加入肠消化液50ml,37℃,250rpm水平摇床振荡消化45min;将消化液经200目尼龙网过滤至50ml离心管中,1300rpm,4℃离心6min,弃上清;留取沉淀部分,用40%percoll淋巴细胞分离液5ml重悬细胞,2000rpm,室温离心20min,升速6降速0密度梯度离心,轻轻倒掉上面两层,仅保留最底层的肝脏淋巴细胞;按照5ml 1
×
rbc裂解液的比例加入后充分混匀,室温裂解5min,加入30-40ml 1640培养基终止裂解,1300rpm,4℃离心8min,弃上清;用40ml 1640培养基重悬细胞,清洗一遍,1300rpm,4℃离心6min,弃上清;按照1ml staining buffer/只小鼠的比例加入后重悬,计数仪计数后待用。
[0094]
实施例10磁珠分选细胞(阳性选择)
[0095]
如上述获取小鼠脾脏细胞悬液并计数,1300rpm,4℃离心5min;加入分选buffer,调整终浓度为1
×
108个细胞数/ml,转移至无菌流式分选管;按照50μl/ml的比例加入提前化冻的rat serum;按照50μl/ml的比例加入isolation cocktail,反复吹匀,静置7.5min;按照50μl/ml的比例加入depletion cocktail,反复吹匀,静置2.5min;提前1min于涡旋仪上充分振荡rapid spheres;迅速将涡旋振荡好的rapid spheres按照75μl/ml的比例加入各样本,反复吹匀,静置2.5min;用分选buffer补齐体积至2.5ml,反复轻吹2-3次;将流式分选管置于磁铁中,静置2.5min;另准备一个无菌50ml离心管,将流式分选后的阳性细胞悬液倾斜倒入离心管中;向流式分选管中加入分选buffer 2.5ml,反复轻吹2-3次,置于磁铁中静置2.5min,将阳性分选猴的细胞悬液倾斜倒入离心管中,此步骤重复3-5次;将离心管中分选所得细胞1300rpm,4℃离心5min,弃上清,重悬计数,调整浓度,置于冰上备用。
[0096]
实施例11小鼠模型的建立
[0097]
水流动力学注射(hydrodynamic gene transfer,hgt)是指将含100μg真核表达质粒的溶液2ml,经鼠尾静脉快速(5-8s)注射到小鼠体内,从而将质粒转移到以肝脏为主的多种器官并在高表达,使其在体内稳定表达,利用此技术构建过表达质粒的小鼠模型。
[0098]
11.1同基因/异基因移植小鼠模型
[0099]
以6-8周龄balb/c(h2kd背景,雌性)为供体鼠,6-8周龄balb/c(h2kd背景,雌性)为受体鼠,构建同基因小鼠模型。以6-8周龄c57bl/6(h2kb背景,雌性)为供体鼠,6-8周龄balb/c(h2kd背景,雌性)为受体鼠,构建异基因小鼠模型。预处理条件:移植前第7天开始饮用含硫酸庆大霉素的无菌酸化水,移植前4-12h内经650cgy x线辐照清髓(325cgy/次,间隔2h,剂量率500cgy/min)。移植物制备:移植当天提取供体鼠骨髓细胞(1
×
107/只)和全脾细胞(4
×
106/只),用1
×
pbs配成终体积为200μl/只的细胞悬液,置于冰上,24h内经鼠尾静脉注射给受体鼠。(此为对照实验)
[0100]
11.2 agvhd小鼠模型
[0101]
以6-8周龄c57bl/6(h2kb背景,雌性)为供体鼠,6-8周龄balb/c(h2kd背景,雌性)为受体鼠,构建异基因agvhd小鼠模型。预处理条件:移植前第7天开始饮用含硫酸庆大霉素的无菌酸化水,移植前第3天通过hgt注射真核表达质粒,移植前4-12h内经650cgy x线辐照清髓(325cgy/次,间隔2h,剂量率500cgy/min)。移植物制备:移植当天提取供体鼠骨髓细胞(1
×
107/只)和全脾细胞(4
×
106/只),用1
×
pbs配成终体积为200μl/只的细胞悬液,置于冰上,24h内经鼠尾静脉注射给受体鼠。
[0102]
11.3 agvhd/gvl小鼠模型
[0103]
以6-8周龄c57bl/6(h2kb背景,雌性)为供体鼠,6-8周龄balb/c(h2kd背景,雌性)为受体鼠,同时输注荧光素酶标记的小鼠白血病细胞株a20-luciferase,构建异基因agvhd/gvl小鼠模型。预处理条件:移植前第7天开始饮用含硫酸庆大霉素的无菌酸化水,移植前第3天通过hgt注射真核表达质粒,移植前4-12h内经650cgy x线辐照清髓(325cgy/次,间隔2h,剂量率500cgy/min)。移植物制备:移植当天提取供体鼠骨髓细胞(1
×
107/只)和全脾细胞(4
×
106/只),同时收集a20-luciferase细胞(1
×
107/只),用1
×
pbs配成终体积为200μl/只的细胞悬液,置于冰上,24h内经鼠尾静脉注射给受体鼠。
[0104]
实施例12混合淋巴细胞反应模型(mlr)
[0105]
以6-8周龄c57bl/6(h2kb背景,雌性)供体鼠的脾细胞,经磁珠阳性分选后所得的cd3
+
t细胞作为刺激细胞,刺激6-8周龄balb/c(h2kd背景,雌性)受体鼠发生反应,构建体内mlr模型。预处理条件:回输前第7天开始饮用含硫酸庆大霉素的无菌酸化水,第3天通过hgt注射真核表达质粒,4-12h内经650cgy x线辐照清髓(325cgy/次,间隔2h,剂量率500cgy/min)。回输细胞制备:经上述步骤获取供体鼠来源的cd3
+
t细胞(2
×
106/只),用1
×
pbs洗两遍,用1
×
pbs配成终体积为200μl/只的细胞悬液,置于冰上,24h内经鼠尾静脉注射给受体鼠。
[0106]
实施例13 agvhd评分标准
[0107]
自异基因造血干细胞移植后当天起,每隔2-3天称量记录小鼠体重变化,根据小鼠体重减轻、姿势、活动度、体毛质地和皮肤完整性的指标对小鼠进行agvhd评分并记录。
[0108]
表1-1异基因造血干细胞移植后小鼠agvhd临床积分评分标准表
[0109][0110]
实施例14小鼠组织病理学检测及损伤评
[0111]
异基因造血干细胞移植后第10天,分别收集小鼠的肝脏、肺脏、小肠、皮肤组织,置于装有4%多聚甲醛溶液20ml的50ml离心管中固定过夜,分别制作小鼠各组织的he染色切片,使用正置荧光显微镜放大倍率为200倍或400倍,观察这些组织的病理损伤程度并拍摄图片。
[0112]
损伤评估:皮肤gvhd病理主要观察毛囊破坏情况、皮下脂肪消耗、皮下胶原沉积等指标;肝脏gvhd病理观察汇管区淋巴细胞浸润、胆管坏死、肝细胞灶状坏死;肺脏gvhd病理学观察肺间质、淋巴管周围炎症细胞浸润、肺泡结构破坏;小肠gvhd病理学观察肠道粘膜破损溃疡、绒毛变钝、细胞碎片管腔脱落、固有层炎性细胞浸润、杯状细胞退化凋亡缺失、隐窝上皮细胞凋亡、隐窝丢失等。
[0113]
实施例15小鼠活体成像检测
[0114]
分别于异基因造血干细胞移植后一周,经腹腔注射水合氯醛试剂,在小鼠麻醉状态下进行活体成像,监测移植后受体鼠白血病病情。
[0115]
(1)向小鼠腹腔注射40μl/只水合氯醛,待麻醉后将小鼠固定在成像操作平台上;
[0116]
(2)向小鼠腹腔注射100μg/只萤火虫素底物,静置5min;
[0117]
(3)用小动物活体成像仪拍摄,根据小鼠体内荧光强度评估肿瘤负荷情况。
[0118]
实施例16流式染色检测免疫细胞表型
[0119]
16.1胞膜染色
[0120]
按照约1
×
106细胞数/孔铺板,离心后加入staining buffer 200μl重悬细胞,1300rpm,4℃离心5min,弃上清;按照1:300配制fc block anti-mouse cd16/32ab,每孔加入100μl,4℃封闭结合非特异性抗原15min,补staining buffer 100μl,1300rpm,4℃离心5min,弃上清;按照1:300配制细胞表面标记抗体,每孔加入100μl,4℃避光孵育30min,补staining buffer 100μl,1300rpm,4℃离心5min,弃上清;加入staining buffer 200μl重悬洗涤1遍,1300rpm离心5min,弃上清;加入staining buffer 120μl重悬上机,进行流式细胞仪检测。
[0121]
16.2 treg细胞染色
[0122]
按照约1
×
107细胞数/孔铺板,离心后加入staining buffer 100μl重悬细胞,1300rpm,4℃离心5min,弃上清;包膜染色同上;fixation/permeailization concentrate:diluent按照1:3比例配制固定/破膜工作液,每孔加入100μl,避光室温孵育30min;用ddh2o稀释permeabilization buffer(10
×
)配制破膜缓冲液,每孔补100μl,1300rpm,4℃离心5min,弃上清;用破膜缓冲液按照1:150配制foxp3抗体,每孔加入100μl,4℃避光孵育30min,补破膜缓冲液100μl,1300rpm,4℃离心5min,弃上清;加入破膜缓冲液200μl重悬洗涤1遍,1300rpm离心5min,弃上清;加入staining buffer 120μl重悬上机,进行流式细胞仪
检测。
[0123]
16.3胞内染色
[0124]
按照约1
×
107细胞数/孔铺板,离心后加入胞内刺激液200μl重悬细胞,37℃,co2培养箱刺激4-6h,1300rpm,4℃离心5min,弃上清;加入staining buffer 200μl重悬洗涤1遍,1300rpm离心5min,弃上清;包膜染色同上;加入fixation and permeailization solution 100μl,4℃避光固定破膜30min;用ddh2o稀释permeailization buffer(10
×
)配制破膜缓冲液,每孔补100μl,1300rpm,4℃离心5min,弃上清;用破膜缓冲液按照1:150配制胞内抗体,每孔加入100μl,4℃避光孵育30min,补破膜缓冲液100μl,1300rpm,4℃离心5min,弃上清;加入破膜缓冲液200μl重悬洗涤1遍,1300rpm离心5min,弃上清;加入staining buffer 120μl重悬上机,进行流式细胞仪检测。
[0125]
实施例17泛素组学测序
[0126]
异基因造血干细胞移植后第9天,收集小鼠的肝脏组织液氮冻存,利用非标记蛋白定量技术进行全蛋白泛素化修饰label-free定量蛋白质组学分析,比较组间泛素化水平变化。
[0127]
实施例18统计学分析
[0128]
利用非配对t检验进行两组样本组间数据比较,多组样本均数比较用方差分析;p《0.05时表示有统计学差异,用*表示,p《0.01时用**表示,p《0.001时用***表示。采用log-rank检验比较生存资料,绘制kaplan-meier曲线。利用graphpad prism 8软件分析并绘图。利用艾森novoexpress流式细胞仪分析软件及flowjo软件分析流式结果数据并绘图。
[0129]
效果评价1药物治疗对小鼠agvhd的作用
[0130]
移植前第3天,通过hgt方式经鼠尾静脉给每只受体鼠注射minicircle-brcc3100μg/2ml或对照质粒mini-circle 100μg/2ml,移植后每天观察并记录两组小鼠的生存状况,每隔2-3天记录小鼠体重变化和agvhd评分。tbi预处理后所有小鼠均出现放射发硬、进食饮水量减少,移植后一周左右体重减轻,于移植后8天给对照vector组小鼠出现死亡。观察弓背、脱毛、活动度等agvhd表现,并记录体重变化。brcc3组与vector组相比,小鼠体重体重下降情况、agvhd评分均较低,见图1。在移植后第14天,收集受鼠的皮肤、肺部、肠道组织进行病理h&e染色。结果提示brcc3组皮肤的各层构成、皮下脂肪分布较完整,肺泡结构破坏较少,各级支气管中充血较少,肠道黏膜破损、细胞碎片、管腔脱落较少,绒毛完整性较好,这些部位的炎症细胞浸润均较少等,各靶器官病理损伤程度得到明显缓解,见图2。
[0131]
效果评价2药物对t细胞活化的抑制作用
[0132]
在移植后第10天,颈椎脱臼处死小鼠后,提取小鼠的脾脏、肺脏、肝脏及小肠上皮淋巴细胞,采用流式细胞术检测免疫细胞表型。结果发现,在小鼠脾脏和各靶器官组织中,brcc3组cd69
+
cd4
+
、cd69
+
cd8
+
t细胞的比例和绝对数明显下降,提示brcc3可抑制agvhd小鼠体内t细胞的活化,见图3。
[0133]
效果评价3药物用于抑制t细胞功能
[0134]
模拟体内mlr反应,固定破膜后胞内染色,检测cd4
+
t细胞和cd8
+
t细胞胞内il-4、il-17a、ifnγ及tnfα的分泌情况发现,brcc3过表达可以明显抑制cd4
+
、cd8
+
t细胞分泌ifnγ,提示brcc3可能通过显著下调t细胞分泌ifnγ,抑制t细胞的功能,见图4。
[0135]
效果评价4药物对于其他免疫细胞的作用
[0136]
在移植后第10天,颈椎脱臼处死小鼠后,提取小鼠的脾脏、肺脏、肝脏及小肠上皮淋巴细胞,采用流式细胞术检测小鼠体内脾脏和各靶器官中其他免疫细胞亚群的变化,结果发现,在小鼠脾脏和各靶器官组织中,brcc3过表达组中f4/80
+
cd11b
+
标记的巨噬细胞的比例明显下降,见图5。
[0137]
效果评价5药物用于上调e3泛素连接酶trim25蛋白水平
[0138]
在移植后第9天,收集小鼠的肝脏组织,利用非标记蛋白定量技术进行全蛋白泛素化修饰label-free定量蛋白质组学分析。另一方面,我们在293t细胞中转染brcc3和对照质粒,裂解提取蛋白,利用ip-ms进行质谱分析。联合泛素组学测序和质谱分析的结果筛选出58个蛋白泛素水平下降具有两倍以上意义,且能与brcc3发生相互作用的底物蛋白,其中参与免疫调控信号通路的有三个。进一步,通过在293t细胞中转染shbrcc3和对照质粒,利用western blot方法检测14-3-3、tpp2和trim25三个潜在的底物蛋白的变化,筛选出brcc3的作用底物。结果显示敲低brcc3后,14-3-3和tpp2的蛋白水平没有显著变化,而e3泛素连接酶trim25的蛋白水平显著降低,见图6。
[0139]
效果评价6
[0140]
在293t细胞中分别转染ha-ub、ha-k48、ha-k63和shbrcc3或对照质粒,转染72h后收集细胞,裂解和提取蛋白,用proteina/gbeads免疫沉淀trim25(efp),通过western blot方法检测ha-ub的变化。结果发现,敲低brcc3后,内源性trim25的总泛素、k48位泛素和k63位泛素水平均增加,见图7。然而,加入蛋白酶体抑制剂mg132,brcc3的去泛素化作用被阻断,trim25的泛素化水平恢复,见图8。
[0141]
效果评价7药物用于减少trim25蛋白泛素化修饰水平
[0142]
通过双荧光素酶报告实验,设计荧光素酶报告质粒p125,在293t细胞中转染p125、renila,fh-brcc3或对照质粒,转染48h后收集细胞,利用双荧光报告试剂盒处理样本,并使用酶标仪进行luciferase荧光检测。结果发现,brcc3过表达能显著促进ifnβ的转录活性,见图9。在巨噬细胞系raw264.7细胞中转染shbrcc3或对照质粒,转染72h后收集细胞,提rna并进行逆转录,利用realtime pcr检测ifnβ的表达水平可以发现,敲低brcc3后,ifnβ的表达水平显著下降,见图10。相应的,我们在巨噬细胞系raw264.7细胞中转染fh-brcc3或对照质粒,转染48h后收集细胞,通过trizol法抽提rna并进行逆转录,利用realtime pcr检测ifnβ的表达水平发现,brcc3过表达后,ifnβ的表达水平明显增强,而炎症相关细胞因子il-1β、il-6和il-12p40的表达水平明显下降,见图11。在小鼠的肝脏组织,brcc3过表达组ifnβ的表达水平显著升高,见图12。
[0143]
效果评价8药物减轻gvhd的同时对gvl效应的作用
[0144]
构建了异基因后agvhd/gvl小鼠模型,移植后每天观察并记录两组小鼠的生存状况,移植后12天对照vector组小鼠出现死亡,至31天左右全部死亡,至观察点31天近一半以上brcc3组小鼠仍存活。每隔2-3天记录小鼠体重变化和agvhd评分,相较对照组,brcc3过表达组的小鼠体重下降水平和agvhd评分均较低,见图13。利用小鼠活体成像技术,在移植后3周,经腹腔注射水合氯醛试剂,提前麻醉小鼠,通过腹腔注射萤火虫素底物,活体成像仪检测小鼠体内荧光值进行肿瘤负荷评估。结果发现,brcc3过表达后,小鼠体内a20-luciferase分布显著减少,统计结果具有显著意义,见图14、图15。
[0145]
综上,本发明对去泛素化酶brcc3在小鼠gvhd模型和gvhd/gvl模型中对gvhd以及
gvl的作用进行评估。我们发现brcc3具有抑制异基因造血干细胞移植后急性移植物抗宿主病的作用;能抑制供体t细胞活化和t细胞的功能,抑制巨噬细胞细胞的增殖;通过蛋白酶体途径,下调trim25的泛素化修饰,稳定trim25的蛋白水平,进而促进ifnβ的分泌,抑制agvhd的发生发展;同时还保留gvl效应。
[0146]
显然,上述实施例仅仅是为清楚地说明所作的举例,并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1