棒柄花苷A在制备抑制肝纤维化药物方面的应用的制作方法
棒柄花苷a在制备抑制肝纤维化药物方面的应用
技术领域
1.本发明涉及医药技术领域,具体是棒柄花苷a在制备抑制肝纤维化药物方面的应用。
背景技术:
2.肝纤维化是指细胞外基质(ecm)合成和降解失衡,导致肝内纤维结缔组织异常堆积的病理过程。肝纤维化的发生、发展过程是由多种细胞、细胞因子和信号通路等参与、相互作用和相互调控的结果。活化的肝星状细胞(hsc)在肝损伤部位移行、增殖,表达各种信号传导蛋白,产生大量ecm和细胞因子,是肝纤维化形成的中心环节。因此,如何有效抑制hsc活化、增殖和减少ecm合成已成为目前阻断、逆转肝纤维化的重要策略。
3.磷脂酰肌醇3-激酶(pi3k)/丝氨酸-苏氨酸蛋白激酶(akt)/哺乳动物雷帕霉素靶蛋白(mtor)信号通路是细胞中非常重要的信号传导通路之一。pi3k/akt/mtor信号通路的活化与多种生长因子有关,如:白介素-1β(il-1β)、血小板衍生因子-bb(pdgf-bb)、转化生长因子-β(tgf-β)等。经过细胞因子激活的pi3k/akt/mtor信号通路起到调控细胞生长与增殖、细胞凋亡与周期、基因转录和蛋白翻译等作用。
4.因此,寻找一种能够针对性抑制pi3k/akt/mtor信号通路关键基因的表达,抑制col
‑ⅰ
、col
‑ⅲ
和α-sma表达,阻滞肝纤维化的发展进程的针对性药物是目前需要解决的问题。
技术实现要素:
5.为了解决现有技术中存在的上述技术问题,本发明提供棒柄花苷 a在制备抑制肝纤维化药物方面的应用。具体是如下:
6.棒柄花苷a在制备肝纤维化药物方面的应用,所述棒柄花苷a,是反式-4-(1-丙烯基)-苯酚-β-d-吡喃葡萄糖苷;分子式为c
15h20
o6;分子量为296。
7.进一步的,所述肝纤维化药物,是抑制肝星状细胞增殖或者活化的药物。
8.进一步的,所述肝纤维化药物,是促进肝星状细胞凋亡的药物
9.进一步的,所述肝纤维化药物,是抑制ecm的合成或大量积累的药物。
10.进一步的,所述肝纤维化药物,是抑制细胞中col
‑ⅰ
、col
‑ⅲ
和α-sma的表达的药物。
11.进一步的,所述肝纤维化药物,是下调细胞中p-pi3k、p-akt、 p-fak、p-mtor、p70s6k蛋白表达的药物。
12.进一步的,所述肝纤维化药物,是抑制细胞中pi3k、akt、mtor 信号通路的药物。
13.进一步的,所述肝纤维化药物,是抑制、逆转肝纤维化的药物。
14.棒柄花系以大戟科棒柄花属植物棒柄花(cleidion brevipetiolatumpaxet hoffm.)叶,申请人在前期研究工作中发现棒柄花叶药材具有抗肝炎效果后,对其进行了系统的化学研究,从棒柄花中发现并确定了专属性强的棒柄花苷a(反式-4-(1-丙烯基)-苯
酚-β-d-吡喃葡萄糖苷;分子式为c15h20o6;分子量为296)。棒柄花苷a(棒柄花苷a) 是棒柄花叶中主要的苯丙素类物质,而苯丙素苷类化合物具有抗菌消炎、抗氧化、保肝护肝和抗肿瘤等活性作用,但根据目前的研究结果不足以明确地认定棒柄花苷a具有抗肝纤维化的作用及其作用机制。因此,本技术以干预hsc-t6为靶向,pi3k/akt/mtor信号传导通路为切入点,探究棒柄花苷a的抗肝纤维化的作用及其分子机制,为使用其治疗肝纤维化提供实验依据和理论支持。
15.与现有技术相比,本发明创造的技术效果体现在:
16.(1)棒柄花苷a干预显著抑制细胞增殖、抑制col
‑ⅰ
、col
‑ⅲ
和α-sma的表达,对ecm的过度积累以及hsc的增殖和活化具有明显的抑制作用。
17.(2)棒柄花苷a干预显著导致hsc-t6细胞凋亡率升高,增加促凋亡基因bax的表达,降低抗凋亡基因bcl-2的表达;同时,棒柄花苷a能增加hsc细胞bax、cleaved caspase-3和cleaved caspase-9 等促凋亡蛋白的表达,降低bcl-2抗凋亡蛋白的表达。
18.(3)棒柄花苷a作用后hsc细胞周期停滞在s期,hsc细胞不能正常进入分裂期,不能完成完整的细胞周期,诱导细胞周期停滞。
19.(4)棒柄花苷a能减少促炎因子的分泌,增加抗炎因子的合成,具有一定的抗炎症作用,能延缓肝纤维化的进一步发展。
20.(5)棒柄花苷a能显著地抑制pi3k/akt/mtor信号通路关键基因的表达,能够通过抑制pi3k/akt/mtor信号通路的激活,阻滞肝纤维化的发展进程。
附图说明
21.图1是ppga对hsc-t6细胞活力的影响结果图。
22.图2是ppga对il-1β激活的hsc-t6细胞增殖的影响结果图。
23.图3是ppga对il-1β激活的hsc-t6细胞tnf-a、il-6和il-10含量的影响结果图。
24.图4是ppga对il-1β刺激的hsc-t6细胞α-sma、col
‑ⅰ
和 col
‑ⅲ
mrna的影响结果图。
25.图5是rt-pcr溶解曲线图。
26.图6是ppga对il-1β刺激的hsc-t6细胞col
‑ⅰ
和col
‑ⅲ
平均荧光强度的影响(
×
400)结果图。
27.图7是ppga对il-1β刺激的hsc-t6细胞α-sma、col
‑ⅰ
和 col
‑ⅲ
蛋白的影响结果图,其中1-6分别为:正常对照组,模型组, ppga低、中、高剂量组和ly294002组。
28.图8是ppga对hsc-t6细胞凋亡形态的影响(
×
100)结果图,其中a:正常对照组;b:模型组;c:ly294002组;d:ppga低剂量组; e:ppga中剂量组;f:ppga高剂量组。
29.图9是ppga对il-1β刺激的hsc-t6细胞凋亡率的影响结果图,a:正常对照组;b:模型组;c:ly294002组;d:ppga低剂量组;e:ppga中剂量组;f:ppga高剂量组。
30.图10是ppga对il-1β刺激的hsc-t6细胞bax mrna和 bcl-2mrna的影响结果图。
31.图11是bax、bcl-2的rt-pcr溶解曲线图。
32.图12是ppga对il-1β刺激的hsc-t6细胞bax和bcl-2蛋白表达的影响结果图,其中1-6分别为:正常对照组,模型组,ppga低、中、高剂量组和ly294002组。
33.图13是ppga对il-1β刺激的hsc-t6细胞cleaved caspase-3 蛋白的影响结果图,1-6分别为:正常对照组,模型组,ppga低、中、高剂量组和ly294002组。
34.图14是ppga对il-1β刺激的hsc-t6细胞cleaved caspase-9 蛋白的影响结果图,其中1-6分别为:正常对照组,模型组,ppga低、中、高剂量组和ly294002组。
35.图15是ppga对il-1β刺激的hsc-t6细胞周期的影响结果图,其中a:正常对照组;b:模型组;c:ly294002组;d:ppga低剂量组; e:ppga中剂量组;f:ppga高剂量组。
36.图16是ppga对il-1β刺激的hsc-t6细胞pi3k mrna和aktmrna的影响结果图。
37.图17是pi3k、akt的rt-pcr溶解曲线图。
38.图18是ppga对il-1β刺激的hsc-t6细胞fak、mtor和 p70s6k mrna的影响。
39.图19是fak、mtor、p70s6k的rt-pcr溶解曲线。
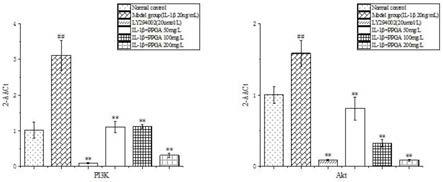
40.图20是ppga对il-1β刺激的hsc-t6细胞p-pi3k/pi3k和 p-akt/akt的影响结果图,其中1-6分别为:正常对照组,模型组,ppga 低、中、高剂量组和ly294002组。
41.图21是ppga对il-1β刺激的hsc-t6细胞p-fak/fak、 p-mtor/mtor和p70s6k的影响结果图,其中1-6分别为:正常对照组,模型组,ppga低、中、高剂量组和ly294002组。
具体实施方式
42.下面结合具体的实施方式来对本发明的技术方案做进一步的限定,但要求保护的范围不仅局限于所作的描述。
43.实施例
44.1材料和仪器
45.1.1材料
46.1.1.1细胞株
47.大鼠肝星状细胞(hsc-t6):上海中乔新舟生物科技有限公司
48.1.1.2药品与试剂
49.ppga:白色絮状物,纯度≥85%,广西壮族自治区中医药研究院; il-1β:派普泰克生物科技(苏州)有限公司(peprotech中国);批号:0606b95c0420;ly294002(pi3k/akt信通路抑制剂):美国 medchemexpress公司,批号:71020900;dmem高糖培养基:美国 thermo fisher公司,批号:8120514;胎牛血清:ausgenex公司,批号:fbssa00618-2;pbs缓冲液:北京索莱宝科技有限公司,批号:20201024;大鼠肿瘤坏死因子α(tnf-α)elisa试剂盒:江苏晶美生物科技有限公司,批号:2020-01;大鼠白细胞介素6(il-6) elisa试剂盒:江苏晶美生物科技有限公司,批号:2020-06;大鼠白细胞介素10(il-10)elisa试剂盒:江苏晶美生物科技有限公司,批号:2020-08;ao/eb荧光染色试剂盒:南京凯基生物科技发展有限公司,批号:0628a20;annexinv-apc/7-aad荧光双染细胞凋亡检测试剂盒:武汉伊莱瑞特生物科技股份有限公司,批号: w2w6gyr4u5;细胞周期检测试剂盒(dna含量检测):武汉伊莱瑞特生物科技股份有限公司,批号:e37c36stcw;rna提取试剂盒:爱思进生物技术有限公司,批号:20218kd1;荧光二抗(兔抗):赛默飞世尔科技(中国)有限公司,批号:vi308619。
50.1.2主要仪器
51.超净工作台:新加坡艺思高科技有限公司;荧光倒置显微镜;日本奥林巴斯株式会社;实时荧光定量pcr仪、连续光谱酶标仪、微量核酸检测仪:美国赛默飞世尔科技公司;流式细胞仪:美国bd公司;双色红外荧光扫描成像系统:美国li-cor公司;纯水仪:成都越纯科技有限公司。
52.2方法
53.2.1细胞培养
54.将hsc-t6细胞接种于含有10%胎牛血清和0.5%双抗(青-链霉素)的dmem培养基中,放置在恒温培养箱(37℃;5%co2)中培养,以1∶3比例传代。取对数生长期细胞用于后续实验。
55.2.2 ppga对hsc-t6细胞生长情况的影响
56.取对数生长期的hsc-t6细胞,用0.25%胰蛋白酶液消化脱壁,离心及计数后,用含10%fcs的dmem培养液配制成5
×
104/ml的细胞悬液,按100ul/孔加入96孔培养板中,在恒温培养箱中培养。24h 后,分别用不同浓度的ppga(6.25mg/l、12.5mg/l、25mg/l、50mg/l、 100mg/l、200mg/l、400mg/l和800mg/l)处理细胞24h、48h和72h。另设正常对照组(不含药物),空白组(只加培养液、mtt、dmso),每组设3个重复孔。药物作用结束后,弃上清液,换以无血清dmem 配制的mtt(0.5mg/ml)溶液,继续在恒温培养箱中孵育4h后,弃上清液,然后按150ul/孔加入dmso裂解细胞,放入酶标仪,以490nm 波长测定od值。计算ppga对hsc-t6细胞的ic
50
。hsc-t6细胞存活率(%)=(实验组od-空白组od)/(正常对照组od-空白组 od)
×
100%。
57.2.3细胞增殖实验
58.取对数生长期的hsc-t6细胞,经过消化、离心及计数后,用完全培养液配制成4
×
104/ml的细胞悬液,按100ul/孔加入96孔培养板中,在恒温培养箱中培养。24h后,将细胞分为6组,分别为:正常对照组(给予完全培养基),模型组(il-1β20ng/ml),ly294002 组(il-1β20ng/ml+ly29400220umol/l),ppga低、中、高剂量组 (il-1β20ng/ml+ppga 50mg/l,100mg/l,200mg/l)。il-1β刺激 hsc-t6细胞30min后,加入ly294002或不同浓度的ppga孵育24h,采用mtt法检测ppga对il-1β刺激的hsc-t6细胞增殖的影响。
59.2.4 ppga对hsc-t6细胞tnf-α、il-6和il-10含量的影响
60.将细胞种在6孔板中,经过药物处理24h后,取细胞培养上清液,按照市售试剂盒操作步骤,采用elisa法检测细胞上清液中tnf-α、 il-6和il-10水平。
61.2.5 ao/eb荧光染色实验
62.hsc-t6细胞经过药物处理24h后,按照吖啶橙/溴化乙锭(ao/eb) 双荧光试剂盒说明书处理细胞。以波长488nm的紫外光激发,荧光显微镜下观察各组细胞的凋亡形态。
63.2.6流式细胞术检测细胞凋亡率
64.细胞按照实验方案进行凋亡诱导,收集细胞,按照annexinv-fitc/7-add荧光双染细胞凋亡检测试剂盒说明书指示,加入 500ulannexinv binding buffer工作液重悬细胞,细胞悬液中加入 5ul的annexinv-apc和5ul的7-aad染色液,混匀,避光孵育 20min,流式细胞仪分析各组细胞凋亡情况。
65.2.7流式细胞术检测细胞周期
66.细胞按照实验方案进行处理,收集细胞,pbs洗涤后加入0.3ml 的pbs重悬细胞,加入1.2ml-20℃无水乙醇,置于-20℃冰箱中1h,离心,pbs洗涤细胞,100ul的rnasea并充分悬浮细胞,37℃水浴30min,加入400ul的pi溶液并充分混匀,冰上避光孵育30min。在流式细胞仪上记录激发波长488nm处红色荧光。
67.2.8免疫荧光法
68.hsc-t6细胞根据实验设计进行给药处理24h后,弃上清液,经过pbs洗涤3次,甲醛固定30min,pbs洗涤3次,0.5%triton x-100 通透20min,pbs洗涤3次,山羊血清封闭30min后,吸去多余血清,一抗4℃孵育过夜。次日,pbs洗涤3次,二抗避光孵育1h,pbs 清洗,用dapi染核5min,封片,在荧光显微镜下观察并拍照,用 image j软件进行荧光定量并计算出平均荧光强度。
69.2.9实时荧光定量pcr
70.按照市售rna提取试剂盒说明书提取hsc-t6细胞rna,进行逆转录,加入荧光染料,通过相对定量实时聚合酶链反应分析系统检测基因表达水平。以β-actin作内参基因,采用2-δδct法对基因的相对表达量进行分析。引物序列由上海捷瑞生物工程有限公司设计并合成。引物序列见表1。
71.表1实时荧光定量pcr引物序列(大鼠)
[0072][0073]
2.10蛋白质印迹法
[0074]
收集经处理后的hsc-t6细胞,加入ripa裂解液,离心,取上清液,bca法检测各组蛋白浓度,加入上样缓冲液,煮沸变性5min,经sds-page凝胶电泳,湿转法将蛋白转至pvdf膜上。加入一抗, 4℃孵育过夜,tbs
·
t缓冲液洗涤3次,二抗孵育常温1h,利用imagestudio lite系统对条带进行扫描。以β-actin作内参基因,用image j 软件对条带进行定量分析。
[0075]
2.11统计学方法
[0076][0077]
数据采用spss 17.0进行处理,以“平均值
±
标准差”表示, 采用单因素方差分析(one-wayanova)进行组间差异性比较,组 间两两比较用lsd法(方差齐)或dunnett’s t3法(方差不齐),p <0.05为差异有统计学意义。检验水准α=0.05。
[0078]
3结果
[0079]
3.1ppga降低hsc-t6细胞活力
[0080]
使用不同浓度的ppga分别作用hsc-t6细胞24h、48h、72h后, ppga均能显著降低
hsc-t6细胞活力,并且呈现明显的浓度依赖性。经计算,ppga对hsc-t6细胞作用24h、48h、72h时的ic50分别为473mg/l、100mg/l、15mg/l。结果见图1。
[0081]
3.2 ppga抑制细胞增殖
[0082]
mtt结果显示,与正常对照组相比,il-1β显著促进hsc-t6细胞增殖(p<0.01);与模型组相比,除ppga低剂量组对细胞增殖的影响无统计学意外(p>0.05),ppga中、高剂量进行干预24h和48h 后均能显著抑制il-1β激活引起的细胞增殖(p<0.01),其抑制作用呈现浓度依赖性。综合考虑,我们选择ppga 50mg/l,100mg/l, 200mg/l作为后续实验的给药浓度,作用时间为24h。结果见表2和图2。
[0083]
表2 ppga对il-1β激活的hsc-t6细胞增殖的影响(n=3)
[0084][0085]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0086]
3.3 ppga降低hsc-t6细胞tnf-α、il-6和il-10水平
[0087]
与正常对照组相比,模型组的hsc-t6细胞培养上清液中tnf-a、 il-6含量明显增加,il-10含量明显降低(p<0.01)。与模型组相比, ppfa低、中、高剂量组细胞培养上清液中tnf-a、il-6含量明显降低(p<0.01),il-10含量明显增加(p<0.01或p<0.05),呈现浓度依赖性。结果见表3、图3。
[0088]
表3 ppga对il-1β激活的hsc-t6细胞tnf-a、il-6和il-10含量的影响(x
±
s,n=3)
[0089][0090]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0091]
3.4 ppga抑制肝星状细胞活化
[0092]
与正常对照组相比,il-1β刺激hsc-t6细胞后,模型组α-sma、 col
‑ⅰ
和col
‑ⅲ
mrna含量和蛋白表达显著增加;模型组col
‑ⅰ
和col
‑ⅲ
平均荧光强度显著增强(p<0.01)。与模
型组相比,除ppga低剂量组col
‑ⅰ
mrna和col
‑ⅲ
平均荧光强度表达无统计学意义(p>0.05)外,ppga各剂量组α-sma、col
‑ⅰ
和col
‑ⅲꢀ
mrna含量和蛋白表达显著降低(p<0.01或p<0.05),且α-sma、 col
‑ⅰ
和col
‑ⅲ
mrna含量表达和α-sma蛋白表达呈浓度依赖性。ppga作用后,col
‑ⅰ
和col
‑ⅲ
平均荧光强度显著减弱。结果见表4、5、6和图4、5、6、7。
[0093]
3.4.1实时荧光定量pcr观察ppga对hsc-t6细胞α-sma、 col
‑ⅰ
和col
‑ⅲ
mrna的影响
[0094]
表4 ppga对il-1β刺激的hsc-t6细胞α-sma、col
‑ⅰ
和col
‑ⅲꢀ
mrna的影响(x
±
s,n=3)
[0095][0096]
注:与空白组比较,
#
p<0.05,
##
p<0.01;与模型组比较,*p<0.05,**p<0.01。
[0097]
3.4.2免疫荧光技术观察ppga对hsc-t6细胞col
‑ⅰ
和 col
‑ⅲ
蛋白平均荧光强度的影响
[0098]
表5 ppga对il-1β刺激的hsc-t6细胞col
‑ⅰ
和col
‑ⅲ
平均荧光强度的影响(x
±
s,n=3)
[0099][0100][0101]
注:与空白组比较,
#
p<0.05,
##
p<0.01;与模型组比较,*p<0.05,**p<0.01。
[0102]
3.4.3免疫印记法观察ppga对hsc-t6细胞α-sma、col
‑ⅰ
和 col
‑ⅲ
蛋白的影响
[0103]
表6 ppga对il-1β刺激的hsc-t6细胞α-sma、col
‑ⅰ
和col
‑ⅲ
蛋白的影响(x
±
s,n=3)
[0104][0105]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0106]
3.5 ppga促进hsc-t6细胞凋亡
[0107]
3.5.1 ppga对hsc-t6细胞凋亡形态的影响
[0108]
ao/eb荧光染色结果显示,与正常对照组相比,il-1β刺激后的 hsc-t6细胞凋亡无明显变化,细胞结构完整并发出绿色荧光。与模型组相比,ppga低、中和高剂量组能显著促进hsc-t6细胞凋亡,部分细胞出现固缩、碎裂或呈圆珠状,发出橘红色荧光。结果见图8。
[0109]
3.5.2 ppga对hsc-t6细胞凋亡率的影响
[0110]
实验结果显示,与正常对照组相比,il-1β刺激hsc-t6细胞后,细胞凋亡率明显降低,但不具有统计学意义(p>0.05)。而ppga 干预能显著促进hsc-t6细胞凋亡,细胞凋亡率显著增加(p<0.01 或p<0.05),呈现明显的浓度依赖性。结果见表7、图9。
[0111]
表7 ppga对il-1β刺激的hsc-t6细胞凋亡率的影响(n=3)
[0112][0113]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0114]
3.5.3 ppga对hsc-t6细胞bax、bcl-2mrna表达的影响
[0115]
与正常对照组相比,il-1β刺激显著促进hsc-t6细胞baxmrna表达显著增加,bcl-2mrna表达显著降低(p<0.01);与模型组相比,除ppga低剂量组bcl-2mrna表达无统计学意义(p> 0.05)外,ppga作用使bax mrna表达显著降低,bcl-2mrna表达显著增加(p<0.01)。结果见表8和图10、图11。
[0116]
表8 ppga对il-1β刺激的hsc-t6细胞bax mrna和bcl-2 mrna的影响(x
±
s,n=3)
[0117][0118]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0119]
3.5.4ppga对hsc-t6细胞bax、bcl-2、cleaved caspase-3和 cleaved caspase-9蛋白表达的影响
[0120]
免疫印迹法结果显示,与正常对照组相比,il-1β刺激显著促进 hsc-t6细胞促凋亡蛋白bax表达显著增加,抗凋亡蛋白bcl-2表达显著降低;cleaved caspase-3和cleaved caspase-9蛋白表达显著增加(p<0.01或p<0.05)。与模型组相比,ppga逆转了这四种蛋白的异常变化,除了ppga低剂量组bax蛋白表达无统计学意义(p >0.05)外,使bax蛋白表达显著降低,bcl-2蛋白表达显著增加; cleaved caspase-3和cleaved caspase-9蛋白表达显著降低(p<0.01 或p<0.05)。结果见表9、10、11和图12、13、14。
[0121]
表9 ppga对il-1β刺激的hsc-t6细胞bax和bcl-2蛋白表达的影响(n=3)
[0122][0123]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0124]
表10 ppga对il-1β刺激的hsc-t6细胞cleaved caspase-3蛋白的影响(n=3)
[0125][0126][0127]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0128]
表11 ppga对il-1β刺激的hsc-t6细胞cleaved caspase-9蛋白的影响(n=3)
[0129][0130]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0131]
3.6 ppga阻滞hsc-t6细胞周期
[0132]
流式细胞术检测细胞周期结果显示,与正常对照组相比,il-1β刺激hsc-t6细胞g0/g1期、s期和g2/m期没有显著变化(p>0.05);与模型组相比,ppga作用于hsc-t6细胞后,其g0/g1期、s期和 g2/m期发生显著改变(p<0.01或p<0.05),且呈明显的浓度依赖性。ppga作用可使hsc-t6细胞不能正常进入分裂期,停滞于s期。结果见表12和图15。
[0133]
表12 ppga对il-1β刺激的hsc-t6细胞周期的影响(n=3)
[0134]
[0135][0136]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0137]
3.7 ppga对pi3k/akt/mtor信号通路的影响
[0138]
与正常对照组相比,模型组pi3k、akt、fak、mtor和p70s6kmrna含量以及pi3k、p-pi3k、p-akt、p-fak、p-mtor和p70s6k 蛋白表达显著增加(p<0.01或p<0.05);与模型组相比,ppga各组的pi3k、akt、fak、mtor和p70s6k mrna含量以及pi3k、p-pi3k、 p-akt、p-fak、p-mtor和p70s6k蛋白表达显著降低(p<0.01或p <0.05),且akt、mtor和p70s6k mrna含量以及p-pi3k、p-fak、 p-mtor和p70s6k蛋白表达呈浓度依赖性。结果见表13、14、15、 16和图16、17、18、19、20、21。
[0139]
3.7.1实时荧光定量pcr检测ppga对pi3k/akt/mtor信号通路的影响
[0140]
表13 ppga对il-1β刺激的hsc-t6细胞pi3kmrna和aktmrna 的影响(n=3)
[0141][0142]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0143]
表14 ppga对il-1β刺激的hsc-t6细胞fak、mtor和p70s6k mrna的影响(n=3)
[0144][0145]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0146]
3.7.2蛋白免疫印迹法ppga对pi3k/akt/mtor信号通路的影响
[0147]
表15 ppga对il-1β刺激的hsc-t6细胞p-pi3k/pi3k和p-akt/akt 的影响(n=3)
[0148][0149]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0150]
表16 ppga对il-1β刺激的hsc-t6细胞p-fak/fak、p-mtor/mtor 和p70s6k的影响(n=3)
[0151][0152][0153]
注:与正常对照组比较,
#
p<0.05,
##
p<0.01;与模型组比较,
*
p<0.05,
**
p<0.01。
[0154]
4讨论
[0155]
肝纤维化的主要特征是以胶原为主要成分的细胞外基质(ecm) 的过度沉积与增生。肝纤维化的形成过程主要取决于胶原的合成、沉积与降解,特别是ⅰ型胶原和ⅲ型胶原。当ⅰ型胶原和ⅲ型胶原的合成与沉积大于降解与吸收时,胶原大量积累,肝内胶原纤维增加,逐渐形成肝纤维化。研究表明,肝星状细胞(hsc)的激活是导致ecm 过度沉淀的中间环节,α-平滑肌肌动蛋白(α-sma)被认为是hsc 活化的标记物。因此,抑制hsc活化被认为是治疗肝纤维化的重要策略。在本研究中,il-1β刺激显著诱导hsc-t6细胞增殖和分泌大量胶原,细胞中α-sma的含量也显著增加,而ppga干预显著抑制细胞增殖、抑制col
‑ⅰ
、col
‑ⅲ
和α-sma的表达。提示,ppga对 ecm的过度积累以及hsc的增殖和活化具有明显的抑制作用。
[0156]
目前,针对hsc预防肝纤维化的治疗策略不仅有抑制hsc的激活、增殖,还有抑制其细胞周期,以及诱导hsc凋亡。细胞凋亡在维持内环境稳定和清除多余的或异常的细胞中起着重要的作用。研究发现,促进细胞凋亡是逆转肝纤维化的关键。诱导细胞凋亡是抑制 hsc活化和清除已活化的hsc细胞的重要途经之一。当细胞凋亡时,会呈现出细胞皱缩、细胞核
固缩、细胞骨架解体等特征性形态学变化,其中细胞核固缩是最显著的变化。本研究发现,经ppga干预后,部分细胞出现固缩、碎裂或呈圆珠状,发出橘红色荧光,且随ppga浓度增大,发出橘红色荧光的细胞液随之增多,提示ppga显著诱导hsc细胞形态发生显著改变。细胞凋亡受到bcl-2家族和caspase家族等基因的严格控制,当细胞受到外部刺激后,促使多种促凋亡蛋白释放,促凋亡蛋白、凋亡蛋白激活因子以及caspase-9在胞浆中结合形成凋亡小体,凋亡小体可进一步诱导caspase-3活化,进而引起细胞凋亡的发生。在本研究中,ppga干预显著导致hsc-t6细胞凋亡率升高,增加促凋亡基因bax的表达,降低抗凋亡基因bcl-2的表达;同时,ppga能增加hsc细胞bax、cleaved caspase-3和 cleaved caspase-9等促凋亡蛋白的表达,降低bcl-2抗凋亡蛋白的表达。此外,我们还研究了ppga对细胞周期的影响。细胞周期分为 g0/g1期、s期和g2/m期,s期是dna复制期也是细胞周期的关键期。本实验中ppga作用后hsc细胞周期停滞在s期,hsc细胞不能正常进入分裂期,不能完成完整的细胞周期。以上结果表明,ppga 能显著诱导hsc凋亡,诱导细胞周期停滞,这可能与其抗肝纤维化作用有关。
[0157]
炎症是不仅是慢性肝病发展的主要因素,还是刺激肝纤维化向肝硬化、肝癌发展的重要因素。hsc在炎症因子作用下发生增殖活化,同时活化的hsc自身也能够分泌大量的炎症因子,例如:tnf-α和 il-1,它们都具有强大的促炎能力,能够加剧炎症反应,引起肝细胞损伤,促进肝纤维化的发生和发展[1,10,15]。因此,本研究检测了 hsc-t6细胞培养上清液中的tnf-α、il-6和il-10水平。il-1β刺激 hsc细胞后其促炎因子tnf-α和il-1水平显著增加,抗炎因子il-10 含量显著降低,而ppga能减少促炎因子的分泌,增加抗炎因子的合成。提示,ppga具有一定的抗炎症作用,能延缓肝纤维化的进一步发展。
[0158]
肝纤维化的发展过程是由多种细胞、细胞因子、信号通路等参与、相互作用、相互调控的结果。pi3k/akt/mtor信号通路是参与肝纤维化发展中最重要的通路之一。fak是一种黏着斑复合体,pi3k是由调节亚基(p85)和催化亚基(p110)组成的异二聚体,fak的激活可导致了pi3k的激活。活化的pi3k能催化磷脂酰肌醇的3-oh端磷酸化,产生4,5-二磷酸磷脂酰肌醇(pip2)及磷脂酰肌醇三磷酸盐(pip3),二者可结合akt使akt磷酸化,从而激活akt。pip3促进akt聚集和激活,可直接磷酸化mtor。mtor激活后,使下游蛋白p70s6k发生磷酸化,启动mrna翻译,参与调控基因转录、蛋白翻译、细胞生长和增殖。该通路与凋亡蛋白和促凋亡蛋白bcl-2家族,以及促凋亡相关因子caspase家族密切相关。活化的pi3k引起akt的突变,磷酸化的akt促进凋亡小体的形成,从而抑制细胞凋亡。在本研究中,il-1β刺激hsc细胞24h后,p-pi3k、p-akt、p-fak、p-mtor和p70s6k 蛋白表达均显著增加,表明pi3k/akt/mtor通路激活。而ppga和 ly294002干预显著下调p-pi3k、p-akt、p-fak、p-mtor和p70s6k 蛋白表达。类似地,rt-pcr实验结果也显示,ppga能显著地抑制 pi3k/akt/mtor信号通路关键基因的表达。以上实验结果说明,ppga 能够通过抑制pi3k/akt/mtor信号通路的激活,阻滞肝纤维化的发展进程。
[0159]
综上所述,本研究初步证明ppga通过阻断pi3k/akt/mtor信号传导通路,显著抑制hsc增殖与活化,抑制ecm的合成和大量积累,促进细胞凋亡,减轻炎症反应水平。本研究对ppga体外抗肝纤维化进行深入探讨,为其治疗肝纤维化提供实验依据和理论支持。
[0160]
最后,应当指出,以上实施例仅是本发明较有代表性的例子。显然,本发明的技术方案并不限于上述实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的
内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1