PI3K抑制剂联合雌激素受体拮抗剂在治疗肿瘤疾病中的用途的制作方法
pi3k抑制剂联合雌激素受体拮抗剂在治疗肿瘤疾病中的用途
技术领域
1.本技术属于医药领域,涉及一种pi3k抑制剂与雌激素受体拮抗剂联合在制备治疗肿瘤疾病的药物中的用途。
背景技术:
2.世界卫生组织国际癌症研究机构(iarc)发布2020年全球癌症发病率、死亡率及发展趋势统计报告,乳腺癌新发病例高达226万,超过肺癌成为全球发病率排名第一的癌种,在女性癌症死亡率中位居第一。乳腺癌可根据浸润情况、组织学分级标准进行分类,近年来基于dna微阵列技术和多基因rt-pcr定量检测方法可对乳腺癌进行分子分型,用来预测乳腺癌的复发转移风险及其相应治疗应答情况。结合分子亚型和免疫组化结果,临床上可将乳腺癌划分为4类:luminal a型(er+/pr+,her2-)、luminal b型(er+/pr+,her2+)、her2+型(er-/pr-/her2+)和三阴性乳腺癌(er-/pr-/her2-)。根据肿瘤生物学及患者身体状况,目前乳腺癌的治疗手段包括手术、放疗和药物治疗;根据药物作用机制又可分为化疗、内分泌治疗(抗雌激素治疗、芳香化酶抑制剂)及靶向治疗(her2靶向制剂)。
3.磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,pi3k)属于脂激酶家族,根据结构与功能,可分为i类、ii类、iii类,i类与肿瘤发生发展最为密切。i类pi3k蛋白为异源二聚体,由一个调节亚基和一个催化亚基构成,根据差异可细分为pi3kα、pi3kβ、pi3kγ、pi3kδ亚型。pi3kα与pi3kβ亚型活性较高,主要参与葡萄糖代谢、血管生成;pi3kγ、pi3kδ则主要在淋巴细胞中表达,在免疫反应、炎症反应中发挥作用。pi3k是pi3k-akt-mtor信号通路的重要组成部分,通过催化pip2转化为pip3激活下游信号,从而完成多种生长因子和信号传导复合物所引起的细胞信号转导级联反应,调控细胞的代谢、生长、增殖、存活、转录、蛋白质合成活动。pi3k-akt-mtor信号通路作为细胞的核心信号转导途径,易出现调控异常,该信号通路失调可见多种人类疾病,如癌症、糖尿病、心血管疾病、神经系统疾病,现发现在乳腺癌、头颈癌、白血病、淋巴瘤、多发性骨髓瘤、前列腺癌、肺癌、卵巢癌、肾癌等中易出现失调。pi3k-akt-mtor途径作为抑制肿瘤生长,诱导细胞死亡的一条关键细胞内信号通路,选择性的抑制pi3k蛋白,可能通过影响下游效应因子akt的磷酸化,从而抑制肿瘤细胞的损伤修复、使细胞分裂阻滞在g1期、诱导和维持细胞凋亡、抗新生血管形成等,发挥抗肿瘤效果。
4.乳腺癌患者中超过一半为雌激素受体(er)或孕激素受体(pr)阳性,说明癌细胞的生长和肿瘤的形成在一定程度上依赖于雌激素的存在。以内分泌治疗为基础的单药或联合疗法已经成为激素受体阳性(hr+)、人表皮生长因子受体2阴性(her2-)绝经后妇女晚期乳腺癌的标准治疗方法。大约20-40%的hr+乳腺癌患者对单一的内分泌疗法有应答,中位缓解持续时间(mdor)约8-14月,其中pi3k通路的过度激活在内分泌疗法耐药患者中十分常见。pik3ca突变在乳腺癌患者中比较常见,在hr+her2-乳腺癌患者中,pik3ca突变的发生率高达30-40%,具有一定的预后价值。
5.buparlisib是一种靶向泛pi3k的抑制剂,在联合内分泌疗法针对治疗hr+her2-晚
期乳腺癌患者的两个iii期临床试验(belle-2和belle-3)中,与pik3ca野生型患者相比,在pik3ca突变患者中观察到更佳的临床获益,但其毒副作用及安全性无法支持该联合疗法在临床上的广泛应用,因此加快了多种选择性pi3k抑制剂的开发进程。pi3k高选择性抑制剂alpelisib和taselisib已在多个临床前肿瘤模型及临床试验中表现出潜在的抗肿瘤活性,因此联合pi3k抑制剂与内分泌疗法在治疗pik3ca突变、hr+/her2-乳腺癌患者中具有潜在的应用价值。
6.cdk4/6抑制剂能够延缓er+/her2-乳腺癌患者内分泌治疗耐药,联合内分泌治疗可以明显延长无进展生存期,临床试验结果表明,abemaciclib联合氟维司群与氟维司群单药相比,患者的pfs更长(16.4月vs 9.3月,p《0.001),客观应答率orr分别为48.1%和21.3%,选择性cdk4/6抑制剂已经批准用于er+/her2-晚期乳腺癌的治疗,但最终耐药仍会发生。考虑到pi3k-akt-mtor信号通路的激活常伴有其他信号通路的改变,因此联合治疗模式对于提高治疗效果有很大的潜在价值。临床前研究及早期临床试验已初步显示cdk4/6抑制剂联合pi3k或mtor抑制剂和内分泌治疗可能会提高疗效,三药联合使体内移植瘤模型持续消退,通过多种途径阻断e2f转录因子释放,导致肿瘤生长阻滞和耐药延迟。
技术实现要素:
7.本发明提供了一种pi3k抑制剂联合内分泌治疗在制备预防或治疗pik3ca突变、hr+、her2-乳腺癌的药物中的用途,并显示了良好的效果。
8.本发明提供一种pi3k抑制剂联合雌激素受体拮抗剂在制备治疗肿瘤疾病的药物中的用途。
9.本发明还提供一种pi3k抑制剂联合cdk4/6激酶抑制剂在制备治疗肿瘤疾病的药物中的用途。
10.本发明进一步提供了一种pi3k抑制剂联合雌激素受体拮抗剂和cdk4/6激酶抑制剂在制备治疗肿瘤疾病的药物中的用途。
11.另一方面,本发明提供一种pi3k抑制剂联合雌激素受体拮抗剂在治疗肿瘤疾病的方法。
12.本发明还提供一种pi3k抑制剂联合cdk4/6激酶抑制剂在治疗肿瘤疾病的方法。
13.本发明进一步提供了一种pi3k抑制剂联合雌激素受体拮抗剂和cdk4/6激酶抑制剂在治疗肿瘤疾病的方法。
14.在一方面,本发明提供了治疗一种肿瘤疾病的药物组合物,包含pi3k抑制剂与雌激素受体拮抗剂;或者,包含pi3k抑制剂与cdk4/6激酶抑制剂;或者,包含pi3k抑制剂、雌激素受体拮抗剂与cdk4/6激酶抑制剂。
15.在本发明优选的实施方案中,肿瘤疾病选自乳腺癌、卵巢癌、前列腺癌、黑色素瘤、脑瘤、食管癌、胃癌、肝癌、胰腺癌、结肠直肠癌、肺癌、肾癌、皮肤癌、成胶质细胞瘤、神经母细胞瘤、肉瘤、脂肪肉瘤、骨软骨瘤、骨瘤、骨肉瘤、精原细胞瘤、睾丸肿瘤、子宫癌、头颈癌、多发性骨髓瘤、恶性淋巴瘤、真性红细胞增多症、白血病、甲状腺肿瘤、输尿管肿瘤、膀胱肿瘤、胆囊癌、胆管癌或绒毛膜上皮癌;优选乳腺癌。
16.在本发明优选的实施方案中,所述乳腺癌为具有pik3ca突变、hr+和/或her2-的乳腺癌,优选hr+her2-pik3ca突变乳腺癌,更优选hr+her2-pik3ca突变的晚期乳腺癌。
17.在本发明优选的实施方案中,pi3k抑制剂为选择性pi3k抑制剂,选自alpelisib、gdc0077、gdc0032、idelalisib、copanlisib、duvelisib、dactolisib、perifosine、gedatosilib、enzastaurin、taselisib、rigosertib、buparlisib、leniolisib、(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺、(s)-2-((2-((4s,5r)-4-(二氟甲基)-5-甲基-2-羰基噁唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺、(s)-2-((2-((s)-3-(二氟甲基)-5-羰基吗啉代)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺、(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-8-氟-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺、(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)-3-甲氧基丙酰胺,或其药学上可接受的盐。
[0018]
在本发明优选的实施方案中,化合物药学上可接受的盐选自硫酸、磷酸、苯磺酸、肉桂酸、酒石酸、乙烷-1,2-二磺酸、乙烷磺酸、富马酸或甲磺酸;优选硫酸、酒石酸、乙烷-1,2-二磺酸、乙烷磺酸、富马酸或甲磺酸;更优选硫酸、乙烷-1,2-二磺酸、乙烷磺酸或甲磺酸;进一步优选乙烷磺酸。
[0019]
在本发明优选的实施方案中,pi3k抑制剂为(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐。
[0020]
在本发明更优选的实施方案中,pi3k抑制剂为
[0021][0022]
在本发明优选的实施方案中雌激素受体激动剂选自他莫昔芬、雷洛昔芬、托瑞米芬或氟维司群;优选氟维司群。
[0023]
在本发明优选的实施方案中,cdk4/6激酶抑制剂选自palbociclib、ribociclib、abemaciclib、(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮、(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(4-氟-1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮、(4-((2,2-二氟乙基)氨基)哌啶-1-基)(6-((5-氟-4-(4-氟-1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮,或其药学上可接受的盐;优选(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐。
[0024]
在本发明优选的实施方案中,pi3k抑制剂为(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐,雌激素受体激动剂为氟维司群,cdk4/6激酶抑制剂为(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐。
[0025]
在本发明优选的实施方案中,pi3k抑制剂的单次给药剂量范围选自0.1-1000mg;优选0.5-10mg;更优选0.5mg、1mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg或10mg。示例性的剂量选自0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg、1.0mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg、20mg、21mg、22mg、23mg、24mg、25mg、26mg、27mg、28mg、29mg、30mg、31mg、32mg、33mg、34mg、35mg、36mg、37mg、38mg、39mg、40mg、41mg、42mg、43mg、44mg、45mg、46mg、47mg、48mg、49mg、50mg、51mg、52mg、53mg、54mg、55mg、56mg、57mg、58mg、59mg、60mg、61mg、62mg、63mg、64mg、65mg、66mg、67mg、68mg、69mg、70mg、71mg、72mg、73mg、74mg、75mg、76mg、77mg、78mg、79mg、80mg、81mg、82mg、83mg、84mg、85mg、86mg、87mg、88mg、89mg、90mg、91mg、92mg、93mg、94mg、95mg、96mg、97mg、98mg、99mg、100mg。
[0026]
在本发明优选的实施方案中,pi3k抑制剂的给药频次为一日一次、一日二次、一日三次、一周一次、一周两次或一周三次。
[0027]
在本发明优选的实施方案中,pi3k抑制剂一日一次给药,单次给药剂量为0.5mg、1mg、2mg、3mg、5mg、6mg、7mg或8mg。
[0028]
在本发明进一步优选的实施方案中,所述(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐一日一次给药,每28天为一周期;单次给药剂量为2mg、2.5mg、3mg、4mg、5mg、6mg、7mg或8mg。
[0029]
在本发明优选的实施方案中,雌激素受体激动剂的单次给药剂量范围选自1-1000mg;优选50-1000mg;更优选50mg、100mg、150mg、200mg、250mg、300mg、400mg、500mg或600mg。示例性的剂量选自1mg、2.5mg、5mg、7.5mg、10mg、12.5mg、15mg、17.5mg、20mg、22.5mg、25mg、27.5mg、30mg、32.5mg、35mg、37.5mg、40mg、42.5mg、45mg、47.5mg、50mg、52.5mg、55mg、60mg、65mg、70mg、75mg、80mg、85mg、90mg、95mg、100mg、105mg、110mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mg、210mg、220mg、230mg、240mg、250mg、260mg、270mg、280mg、290mg、300mg、350mg、400mg、450mg、500mg、550mg、600mg、650mg、700mg、750mg、800mg、850mg、900mg、950mg、1000mg。
[0030]
在本发明优选的实施方案中,雌激素受体激动剂的给药频次为一周一次,一周两次,一周三次、两周一次一月一次、一月两次或一月三次。
[0031]
在本发明优选的实施方案中,雌激素受体激动剂一月一次给药,单次给药剂量为400mg、500mg或600mg。
[0032]
在本发明进一步优选的实施方案中,所述氟维司群的给药剂量为500mg,用药时程为每28天为一周期,在第1周期的第1天和第15天和之后每个周期的第1天给药1次。
[0033]
在本发明优选的实施方案中,cdk4/6激酶抑制剂的单次给药剂量范围选自1-1000mg;优选50-1000mg;更优选50-100mg;更优选25mg、50mg、75mg或100mg。示例性的剂量选自0.1mg、0.2mg、0.3mg、0.4mg、0.5mg、0.6mg、0.7mg、0.8mg、0.9mg、1.0mg、2mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg、16mg、17mg、18mg、19mg、20mg、21mg、22mg、23mg、24mg、25mg、26mg、27mg、28mg、29mg、30mg、31mg、32mg、33mg、34mg、35mg、36mg、37mg、38mg、39mg、40mg、41mg、42mg、43mg、44mg、45mg、46mg、47mg、48mg、49mg、50mg、51mg、52mg、53mg、54mg、55mg、56mg、57mg、58mg、59mg、60mg、61mg、62mg、63mg、64mg、65mg、
66mg、67mg、68mg、69mg、70mg、71mg、72mg、73mg、74mg、75mg、76mg、77mg、78mg、79mg、80mg、81mg、82mg、83mg、84mg、85mg、86mg、87mg、88mg、89mg、90mg、91mg、92mg、93mg、94mg、95mg、96mg、97mg、98mg、99mg、100mg。
[0034]
在本发明优选的实施方案中,cdk4/6激酶抑制剂的给药频次为一日一次、一日二次、一日三次、一周一次、一周两次或一周三次。
[0035]
在本发明优选的实施方案中,cdk4/6激酶抑制剂一日两次给药,单次给药剂量为25mg、50mg、75mg或100mg。
[0036]
在本发明优选的实施方案中,pi3k抑制剂与雌激素受体激动剂或/和cdk4/6激酶抑制剂同时、并行、独立或按顺序地应用。
[0037]
本发明还提供了(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐联合氟维司群在制备治疗乳腺癌的药物中的用途,所述乳腺癌为具有pik3ca突变、hr+和/或her2-的乳腺癌;优选hr+her2-pik3ca突变乳腺癌;更优选hr+her2-pik3ca突变的晚期乳腺癌,所述(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐的给药剂量为4mg、6mg、8mg或10mg,用药频次为一日一次,每28天为一周期;所述氟维司群的给药剂量为500mg,用药时程为每28天为一周期,在第1周期的第1天和第15天和之后每个周期的第1天给药1次。
[0038]
本技术所述联合的给药途径选自口服给药、胃肠外给药、经皮给药,所述胃肠外给药包括但不限于静脉注射、皮下注射、肌肉注射,优选口服给药或肌肉注射。
[0039]
本发明所述的方案中,所述的联合任选的还包含其他组分,所述其他组分包括但不限于其他治疗肿瘤疾病的药物中的用途。
[0040]
本发明还提供一种联合制剂,其包含:
[0041]
(a)一个或多个pi3k抑制剂;
[0042]
(b)一个或多个雌激素受体激动剂;
[0043]
或
[0044]
(a)一个或多个pi3k抑制剂;
[0045]
(b)一个或多个cdk4/6激酶抑制剂;
[0046]
或
[0047]
(a)一个或多个pi3k抑制剂;
[0048]
(b)一个或多个雌激素受体拮抗剂;
[0049]
(c)一个或多个cdk4/6激酶抑制剂。
[0050]
在本发明优选的实施方案中,联合制剂包含:
[0051]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;优选优选(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙烷磺酸盐;
[0052]
(b)雌激素受体激动剂;
[0053]
所述雌激素受体激动剂选自他莫昔芬、雷洛昔芬、托瑞米芬或氟维司群;优选氟维司群;
[0054]
或
[0055]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药学上可接受的盐;优选(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙烷磺酸盐;
[0056]
(b)(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮或其药学上可接受的盐;优选(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐;
[0057]
或
[0058]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;优选(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙烷磺酸盐;
[0059]
(b)雌激素受体拮抗剂;
[0060]
所述雌激素受体拮抗剂选自他莫昔芬、雷洛昔芬、托瑞米芬或氟维司群;优选氟维司群;
[0061]
(c)(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮或其药学上可接受的盐;优选(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐。
[0062]
在本发明优选的实施方案中,联合制剂包含:
[0063]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙磺酸盐;
[0064]
(b)氟维司群;
[0065]
或
[0066]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药学上可接受的盐;优选(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙烷磺酸盐;
[0067]
(b)(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮或其药学上可接受的盐;优选(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐;
[0068]
或
[0069]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;优选(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙烷磺酸盐;
[0070]
(b)氟维司群;
[0071]
(c)(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮或其药学上可接受的盐;优选(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐。
[0072]
在本发明优选的实施方案中,该联合制剂用于治疗肿瘤疾病。
[0073]
在本发明优选的实施方案中,该联合制剂用于治疗乳腺癌、卵巢癌、前列腺癌、黑色素瘤、脑瘤、食管癌、胃癌、肝癌、胰腺癌、结肠直肠癌、肺癌、肾癌、皮肤癌、成胶质细胞瘤、神经母细胞瘤、肉瘤、脂肪肉瘤、骨软骨瘤、骨瘤、骨肉瘤、精原细胞瘤、睾丸肿瘤、子宫癌、头颈癌、多发性骨髓瘤、恶性淋巴瘤、真性红细胞增多症、白血病、甲状腺肿瘤、输尿管肿瘤、膀胱肿瘤、胆囊癌、胆管癌或绒毛膜上皮癌;优选乳腺癌;更优选hr+her2-pik3ca突变的乳腺癌。
[0074]
在本发明优选的实施方案中pi3k抑制剂的单位剂量为0.1-200mg,优选0.1-100mg,更优选0.1-50mg,进一步优选1-30mg,更进一步优选1-10mg,最优选5mg、6mg、7mg或8mg。
[0075]
在本发明优选的实施方案中,雌激素受体激动剂单位剂量为0.1-1000mg;优选100-1000mg;更优选400-800mg;最优选400mg、500mg、600mg、700mg或800mg。
[0076]
在本发明优选的实施方案中,cdk4/6激酶抑制剂单位剂量为0.1-200mg;优选0.1-100mg;更优选50-100mg;最优选25mg、50mg、75mg或100mg。
[0077]
本发明还提供了一种治疗肿瘤疾病的方法,包括向患者施用包括施用有效剂量的下列化合物的组合:
[0078]
(a)pi3k抑制剂;
[0079]
(b)雌激素受体激动剂;
[0080]
pi3k抑制剂与雌激素受体激动剂同时、并行、独立或按顺序地应用。
[0081]
本发明还提供了一种治疗肿瘤疾病的方法,包括向患者施用包括施用有效剂量的下列化合物的组合:
[0082]
(a)pi3k抑制剂;
[0083]
(b)雌激素受体激动剂;
[0084]
(c)cdk4/6激酶抑制剂;
[0085]
pi3k抑制剂、雌激素受体激动剂和cdk4/6激酶抑制剂同时、并行、独立或按顺序地应用。
[0086]
在本发明优选的实施方案中,治疗肿瘤疾病的方法,包括向患者施用包括施用有效剂量的下列化合物的组合:
[0087]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并
[0088]
[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;优选(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并
[0089]
[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙烷磺酸盐;
[0090]
(b)他莫昔芬、雷洛昔芬、托瑞米芬或氟维司群;优选氟维司群。
[0091]
在本发明优选的实施方案中,治疗肿瘤疾病的方法,包括向患者施用包括施用有效剂量的下列化合物的组合:
[0092]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并
[0093]
[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;优选(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并
[0094]
[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙烷磺酸盐;
[0095]
(b)他莫昔芬、雷洛昔芬、托瑞米芬或氟维司群;优选氟维司群;
[0096]
(c)(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮或其药学上可接受的盐;优选(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐。
[0097]
在本发明优选的实施方案中,治疗肿瘤疾病的方法,包括向患者施用包括施用有效剂量的下列化合物的组合:
[0098]
(a)(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺或其药理学上可接受的盐;优选(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺乙烷磺酸盐;
[0099]
(b)(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮或其药学上可接受的盐;优选(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐。
[0100]
本技术还涉及一种上述pi3k抑制剂与雌激素受体激动剂或/和cdk4/6激酶抑制剂,以及一种或多种药用载体、赋形剂或稀释剂的药物组合物。
[0101]
所述药物组合物可以制成药学上可接受的任一剂型。例如,可以配制为片剂、胶囊剂、丸剂、颗粒剂、溶液剂、混悬剂、糖浆剂、注射剂(包括注射液、注射用无菌粉末与注射用浓溶液)、栓剂、吸入剂或喷雾剂。
[0102]
本技术所述的含pi3k抑制剂与雌激素受体激动剂或/和cdk4/6激酶抑制剂的药物组合物,可以单独给药,或者与一种或多种治疗剂联合使用。
[0103]
本技术还提供了一种用于治疗肿瘤疾病的药物中的用途的药物试剂盒,其中包装有本技术所述的pi3k抑制剂与雌激素受体激动剂或/和cdk4/6激酶抑制剂的药物组合物。
[0104]
本技术将pi3k抑制剂与雌激素受体激动剂联合给药,从而增强了肿瘤疾病的药物中的用途,以及改善了治疗效果。
[0105]
本技术将pi3k抑制剂、雌激素受体激动剂和cdk4/6激酶抑制剂联合给药,从而增强了肿瘤疾病的药物中的用途,以及改善了治疗效果。
[0106]
本技术中所述的“联合”是一种给药方式,是指在一定时间期限内给予至少一种剂量的选择性pi3k抑制剂和至少一种剂量的雌激素受体激激动剂或/和至少一种cdk4/6激酶抑制剂,其中两种或三种物质都显示药理学作用。所述的时间期限可以是一个给药周期内,优选4周内,3周内,2周内,1周内,或24小时以内。可以同时或依次给予pi3k抑制剂和雌激素
受体激动剂或/和cdk4/6激酶抑制剂。这种期限包括这样的治疗:通过相同给药途径或不同给药途径给予选择性pi3k抑制剂和雌激素受体激动剂或/和cdk4/6激酶抑制剂。
[0107]
本发明的联合制剂通常包含两种或者两种以上活性成分,这些活性成分可以包装在相同的或者不同的包装中。当活性成分包装在相同的包装中时,所述活性成分可以混合在一起,但优选分开存放,例如包含在不同的容器或者部分中,这样可以将不同活性成分分开给患者给药。不同活性成分可以同时、或者以任何顺序分开给药。当活性成分包含在不同的包装中时,可以同时销售或者分开销售。
[0108]
术语“有效剂量”指在哺乳动物中有效治疗疾病或病症的药物量。在癌症的情况中,治疗有效剂量的药物可减少癌细胞的数目;缩小肿瘤的尺寸;抑制(即一定程度的减缓和优选阻止)癌细胞浸润到周围器官中;抑制(即一定程度的减缓和优选阻止)肿瘤转移;一定程度的抑制肿瘤生长;和/或一定程度的减轻一种或多种与该病症有关的症状。根据药物可阻止现有癌细胞生长和/或杀死现有癌细胞的程度,它可以是细胞抑制性的和/或细胞毒性的。对于癌症治疗,可通过评估存活持续时间、无进展存活(pfs)持续时间、响应率(rr)、响应持续时间和/或生活质量来测量体内功效。
[0109]
本发明的选择性pi3k抑制剂,对野生型、突变型的pi3k-α均有高抑制活性,能通过抑制pi3k/mtor信号通路发挥抗肿瘤效用,对伴随有pik3ca基因突变肿瘤有显著抑制作用。目前正在开展在实体瘤临床实验phase i,对pik3ca基因突变发生率较高的乳腺癌、头颈鳞癌、胃癌有潜在治疗效应。
附图说明
[0110]
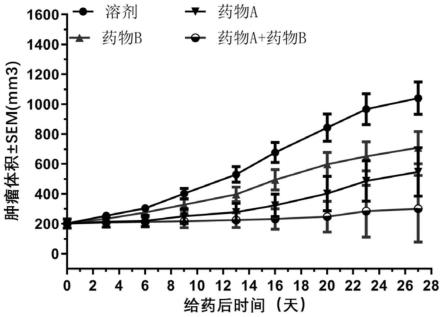
图1为药物a联合药物b对mcf-7人源乳腺癌移植瘤的疗效;
[0111]
图2为药物a联合药物b对mcf-7荷瘤鼠体重的影响;
[0112]
图3为药物a联合药物b、药物c对mcf-7人源乳腺癌移植瘤的疗效;
[0113]
图4为药物a联合药物b、药物c对mcf-7荷瘤鼠体重的影响。
具体实施方式
[0114]
以下将结合实施例更详细地解释本技术,本技术的实施例仅用于说明本技术的技术方案,并非限定本技术的实质和范围。
[0115]
生物评价方法
[0116]
实施例1.评价药物a与药物b联用对人乳腺癌细胞(mcf-7)的增殖抑制作用是否存在协同增效。
[0117]
1.实验材料
[0118]
1.1细胞株及实验试剂
[0119]
人乳腺癌细胞(mcf-7)购自atcc,由上海翰森生物医药科技有限公司保种维持传代培养。
[0120]
药物a:(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐,采用wo2019228341中的方法制备,药物配制使用dmso溶解;
[0121]
药物b使用的为氟维司群原料药,购自selleck公司,货号为s1191,药物配制使用
dmso溶解。
[0122]
luminescent cell viability assay购自promega公司,货号为g7573;
[0123]
emem培养基购自atcc公司,货号为30-2003;
[0124]
fbs购自gibco公司,货号为10091148;
[0125]
胰酶购自gibco公司,货号为25200056;
[0126]
pbs购自gibco公司,货号为10010023。
[0127]
1.2仪器:
[0128]
酶标仪(biotek synergy h1);
[0129]
移液器(eppendorf&rainin)。
[0130]
2.实验方法及处理结果
[0131]
2.1药物a与药物b单药对mcf-7细胞生长抑制评价
[0132]
将生长状态良好的mcf-7细胞接种于96孔板,过夜贴壁生长后,分别给予不同浓度的受试物,两种受试物不同浓度进行交叉作用。
[0133]
药物a终浓度设置为0.41、1.23、3.70、11.11、33.33、100nm,受试物药物b终浓度设置为0.41、1.23、3.70、11.11、33.33、100nm。受试物单用或合用作用于mcf-7细胞144h后,采用ctg方法检测受试物联用对mcf-7细胞的体外增殖抑制作用。
[0134]
根据酶标仪测定的信号值,按下列公式计算细胞生长抑制率:
[0135]
生长抑制率%(inhibition%)=[1-(测定值-最小值均值-本底值)/(最大值均值-本底值-最小值均值)]
×
100%(测定值:化合物孔读值;最小值:zpe孔读值;最大值:hpe孔读值;本底值:加化合物前细胞本底测定值)。
[0136]
药物a与药物b单药对mcf-7细胞生长抑制率结果见表1。
[0137]
表1药物a及药物b单药对mcf-7人乳腺癌生长抑制作用
[0138][0139]
2.2药物a联合药物b对mcf-7人乳腺癌生长抑制评价
[0140]
基于实验2.1的实验结果,将细胞生长抑制率转化为细胞存活率,使用combenefit软件分析两药的联合指数。
[0141]
药物a在0.41-100nm浓度范围内能浓度依赖性地抑制mcf-7细胞生长,药物b在0.41-100nm浓度范围内对细胞增殖最高至60%左右,两种药物联合对mcf-7细胞生长抑制率结果见表2。
[0142]
表2药物a联合药物b对mcf-7人乳腺癌生长抑制作用
[0143][0144]
两种药物联合指数在多种浓度组合条件下均大于1,说明药物a与药物b联用能够对mcf-7细胞增殖抑制起到协同增效作用,具体见表3。
[0145]
表3药物a联合药物b抑制mcf-7人乳腺癌细胞增殖联合指数
[0146][0147][0148]
3.实验结论:
[0149]
药物a与药物b联用能够对mcf-7细胞增殖抑制起到协同增效作用。
[0150]
实施例2.评价药物a与药物b联用对mcf-7人乳腺癌细胞小鼠移植瘤的体内抑制作用
[0151]
1.实验材料
[0152]
药物a:(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐,采用wo2019228341中的方法制备,药物配制用0.5%hpmc;
[0153]
药物b为氟维司群芙仕得,市售药物,阿斯利康生产;
[0154]
人乳腺癌mcf-7细胞,体外单层培养,培养条件为mem培养基中加10%胎牛血清,100u/ml青霉素和100μg/ml链霉素,37℃ 5%co2细胞培养箱中培养。一周两次用胰酶-edta进行常规消化处理传代。当细胞饱和度为80%-90%,数量到达要求时,收取细胞,计数,接种。
[0155]
balb/c裸小鼠,雌性,体重19-23g。
[0156]
2.实验方法
[0157]
将含有10
×
106个mcf-7细胞的pbs同0.1ml的matrigel混合(终体积为0.2ml)接种于已经接种0.36mg雌二醇缓释片的每只小鼠右前肢腋窝皮下,待肿瘤平均体积生长为150-200mm3时分组(d0)。小鼠灌胃给药(p.o)或皮下给药(s.c),每日1次(qd)或每周一次(qw);给药体积10ml/kg或3ml/kg;溶剂组给予相同体积的“溶剂”(0.5%hpmc);具体给药剂量和给药方案见表4。测肿瘤体积,称小鼠体重,记录数据。
[0158]
实验指标为考察药物对肿瘤生长的影响,具体指标为t/c%或抑瘤率tgi(%)。
[0159]
用游标卡尺测量肿瘤直径,肿瘤体积(v)计算公式为:
[0160]
v=1/2
×a×
b2其中a、b分别表示长、宽。
[0161]
t/c(%)=(t-t0)/(c-c0)
×
100其中t、c为实验结束时的肿瘤体积,t0、c0为实验开始时的肿瘤体积。
[0162]
抑瘤率(tgi)(%)=100-t/c(%)。
[0163]
当肿瘤出现消退时,抑瘤率(tgi)(%)=100-(t-t0)/t0
×
100
[0164]
如果肿瘤比起始体积缩小,即t《t0或c《c0时,即定义为肿瘤部分消退(pr);如果肿瘤完全消失,即定义为肿瘤完全消退(cr)。
[0165]
实验结束、达到实验终点、或肿瘤体积达到2000mm3,co2麻醉处死物,随后解剖取瘤、拍照。
[0166]
实验数据用graphpad prism 8.4.3分析、作图。二组肿瘤体积之间比较采用双尾t检验。三组或多组间比较用one-way anova repeated measure,如果f值有显著性差异,应在anova分析之后使用dunnett’s进行多重比较。p《0.05定义为差异有统计学显著性。
[0167]
表4.药物a联合药物b在mcf-7模型中的给药方案
[0168][0169]
3.实验结果
[0170]
药物a联合药物b对mcf-7模型的生长抑制作用如表5所示,mcf-7模型中各组动物的体重变化如表6所示。
[0171]
表5.药物a联合药物b对mcf-7模型的生长抑制作用
[0172][0173]
注:
[0174]
p值d27:根据不同组中各动物的肿瘤体积以溶剂组为对照运用one-way anova进行dunnett分析所得数值;
[0175]
#:不同单药组中各动物的肿瘤体积与联合用药组相比较,运用t-test进行分析所得p《0.05
[0176]
表6.mcf-7模型中各组动物的体重变化
[0177][0178][0179]
注:
[0180]
a:实验时间计算:分组给药当天(day0)开始计算;
[0181]
b:数据以“平均值
±
标准误差”表示
[0182]
实验结束时,药物a、药物b、药物a联合药物b组的肿瘤体积平均值分别为710mm3、547mm3、300mm3,肿瘤抑制率分别为39.37%、58.80%、88.24%;联合组与各自单药组相比具有显著差异(p《0.05),且联合治疗组有4/10小鼠表现为肿瘤部分消退,而单药组未见消退现象。整个实验过程中荷瘤小鼠对联合剂量均能很好耐受,没有体重明显减轻症状发生。药物a联合药物b对mcf-7人源乳腺癌移植瘤的疗效见附图1。药物a联合药物b对mcf-7荷瘤鼠体重的影响见附图2。
[0183]
4.实验结论:
[0184]
药物a联合药物b与两者各自单独治疗相比,显示出更强的抗肿瘤作用,且未表现出明显毒副作用。
[0185]
实施例3.评价药物a与药物b、药物c联用对mcf-7人乳腺癌细胞小鼠移植瘤的体内抑制作用
[0186]
1.实验材料
[0187]
药物a:(s)-2-((2-((r)-4-(二氟甲基)-2-羰基噻唑烷-3-基)-5,6-二氢苯并[f]咪唑并[1,2-d][1,4]噁吖庚英-9-基)氨基)丙酰胺的乙烷磺酸盐,采用wo2019228341中的方法制备,药物配制用0.5%hpmc;
[0188]
药物b为氟维司群芙仕得,市售,阿斯利康生产;
[0189]
药物c:(4-(环丙基氨基)哌啶-1-基)(6-((5-氟-4-(1-异丙基-2-甲基-1h-苯并[d]咪唑-6-基)嘧啶-2-基)氨基)-2-甲基吡啶-3-基)甲酮的对甲基苯磺酸盐,采用wo2018045956a1中的方法制备,药物配制用1%hec。
[0190]
人乳腺癌mcf-7细胞,体外单层培养,培养条件为emem培养基中加10%胎牛血清,100u/ml青霉素和100μg/ml链霉素,37℃5%co2细胞培养箱中培养。一周两次用胰酶-edta进行常规消化处理传代。当细胞饱和度为80%-90%,数量达到要求时,收取细胞,计数,接种。
[0191]
balb/c裸小鼠,雌性,体重18-24g。
[0192]
2.实验方法
[0193]
将含有10
×
106个mcf-7细胞的pbs同0.1ml的matrigel混合(终体积为0.2ml)接种于已经接种0.36mg雌二醇缓释片的每只小鼠右前肢腋窝皮下,待肿瘤平均体积生长为150-200mm3时分组(d0)。小鼠灌胃给药(p.o)或皮下给药(s.c),每日1次(qd)或每周一次(qw);给药体积10ml/kg或3ml/kg;溶剂组给予相同体积的“溶剂”(1%hec);具体给药剂量和给药方案见表7。测肿瘤体积,称小鼠体重,记录数据。
[0194]
实验指标为考察药物对肿瘤生长的影响,具体指标为t/c%或抑瘤率tgi(%)。
[0195]
用游标卡尺测量肿瘤直径,肿瘤体积(v)计算公式为:
[0196]
v=1/2
×a×
b2其中a、b分别表示长、宽。
[0197]
t/c(%)=(t-t0)/(c-c0)
×
100其中t、c为实验结束时的肿瘤体积,t0、c0为实验开始时的肿瘤体积。
[0198]
抑瘤率(tgi)(%)=100-t/c(%)。
[0199]
当肿瘤出现消退时,抑瘤率(tgi)(%)=100-(t-t0)/t0
×
100。
[0200]
如果肿瘤比起始体积缩小,即t《t0或c《c0时,即定义为肿瘤部分消退(pr);如果肿瘤完全消失,即定义为肿瘤完全消退(cr)。
[0201]
实验结束、达到实验终点、或肿瘤体积达到2000mm3,co2麻醉处死物,随后解剖取瘤、拍照。
[0202]
实验数据用graphpad prism 8.4.3分析、作图。二组肿瘤体积之间比较采用双尾t检验。三组或多组间比较用one-way anova repeated measure,如果f值有显著性差异,应在anova分析之后使用dunnett’s进行多重比较。p《0.05定义为差异有统计学显著性。
[0203]
表7.药物a联合药物b、药物c在mcf-7模型中的给药方案
[0204][0205]
3.实验结果
[0206]
药物a联合药物b、药物c对mcf-7模型的生长抑制作用如表8所示,mcf-7模型中各组动物的体重变化如表9所示。
[0207]
表8.药物a联合药物b、药物c对mcf-7模型的生长抑制作用
[0208][0209]
注:p值d27:根据不同组中各动物的肿瘤体积以溶剂组为对照运用one-way anova进行dunnett分析所得数值;
[0210]
表9.mcf-7模型中各组动物的体重变化
[0211][0212]
注:
[0213]
a:实验时间计算:分组给药当天(day0)开始计算;
[0214]
b:数据以“平均值
±
标准误差”表示
[0215]
实验结束时,药物c、药物a+药物b、药物a+药物b+药物c组的肿瘤体积平均值分别为223mm3、99mm3、31mm3,肿瘤抑制率分别为91%、147%、183%;整个实验过程中荷瘤小鼠对联合剂量均能很好耐受,没有停药及死亡现象发生。药物a联合药物b、药物c对mcf-7人源乳腺癌移植瘤的疗效见附图3。药物a联合药物b、药物c对mcf-7荷瘤鼠体重的影响见附图4。
[0216]
4.实验结论:
[0217]
药物a、药物b、药物c三药联合治疗与药物c单独或药物a联合药物b治疗相比,显示出更强的抗肿瘤作用,且未表现出明显毒副作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1