一种纳米氢化镁的原位制备方法与流程
本发明涉及储氢材料和纳米材料
技术领域:
,尤其涉及一种纳米氢化镁的原位制备方法。
背景技术:
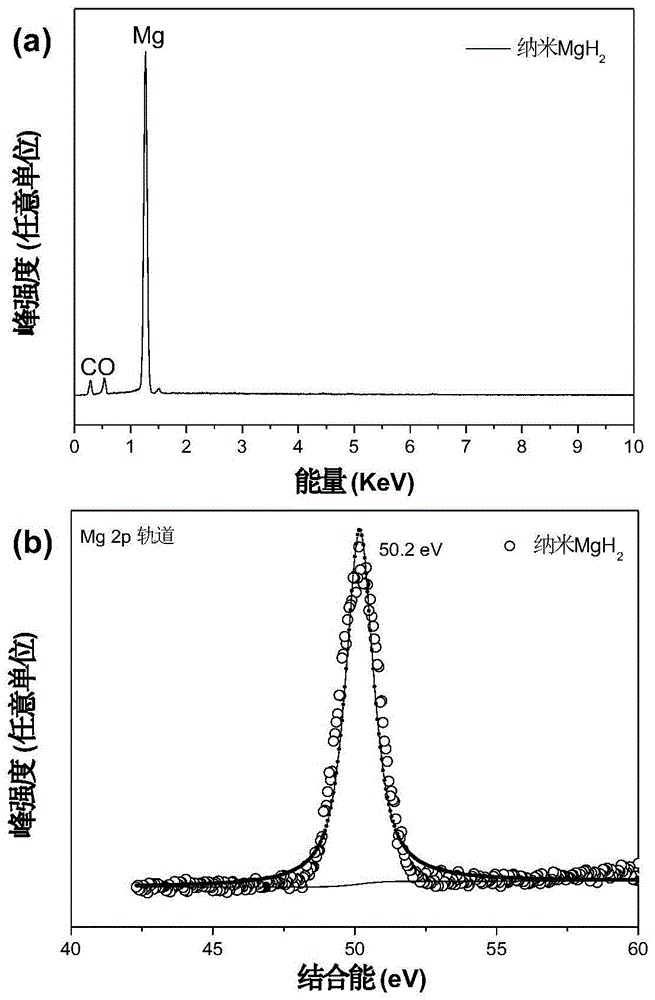
:能源危机的加剧和地球环境的恶化,促使人类加快可再生清洁能源的开发。氢能以其丰富的储量和清洁无污染的特点得到了人们的关注。目前,制约氢经济的瓶颈主要是氢气的储运,而开发基于化学储氢的固体储氢材料被誉为是解决车载储氢问题的最有效途径。mgh2是一种典型的轻金属氢化物储氢材料,其理论储氢容量高达7.6wt%,且可逆性好,受到了研究者的广泛的关注。但mgh2的热力学稳定性较高,起始放氢温度高达300℃,放氢速率缓慢,不利于车载储氢的应用,因此,降低mgh2的吸放氢温度一直是该领域研究的重点。目前,针对mgh2储氢材料的改性研究主要集中在:(1)催化掺杂,(2)成分调变,和(3)纳米化,这三个方面。催化剂掺杂是目前研究最多的改性手段,该方法可以在确保一定储氢容量的基础上显著改善mgh2的吸放氢动力学性能。基于催化改性的方法,人们陆续发现ti-、zr-、v-、nb-、ni-和co-基催化剂对mgh2的脱/加氢动力学性能有明显的改善作用。但mgh2的热力学较为稳定,起始放氢温度仍然较高,而且现有的催化剂主要是基于过渡金属氧化物和卤化物的催化剂,在加热过程中容易与mgh2反应产生副产物mgcl2和mgo等,造成储氢容量的损失。相比于添加催化剂,纳米化有望同时调变mgh2的热力学性能和动力学性能,使mgh2的起始放氢温度显著下降,放氢速率提升,但现有的mgh2纳米化技术大都基于高比表面材料负载mgh2纳米颗粒。为了避免纳米mgh2在制备中发生颗粒长大或团聚需要引入大量的碳、介孔硅等载体材料对纳米产物进行分散,会显著降低材料的储氢容量,不利于实际应用。因此,制备颗粒尺寸小,催化活性高的金属单质催化剂,同时开发无需载体的纳米mgh2制备技术,并将催化掺杂与纳米化技术结合,开发无载体纳米氢化镁原位催化技术是当前进一步改善mgh2基储氢材料最为可行的途径。技术实现要素:本发明的目的在于提供一种催化剂掺杂纳米氢化镁的原位制备方法,该方法以反应[mgcl2-2lih→mgh2+2licl]为基础,利用超声波在液体介质中引发的空化效应,在极小范围内快速提供能量,从而促进反应进行;同时,利用超声波的分散效应控制产物的颗粒尺寸,避免颗粒团聚,能有效实现氢化镁的纳米化制备,在制备过程中加入适当的催化剂前驱体,可实现原位催化掺杂,制备方法简便,无需载体,所得催化剂掺杂的氢化镁储氢材料,具有有效储氢容量高,吸放氢温度低,吸放氢速率快的优点。具体技术方案如下:一种纳米氢化镁的原位制备方法,包括以下步骤:(1)在惰性气氛保护下,将氯化镁和氢化锂放置于有机溶剂中,搅拌,得到混合物的有机悬浊液;(2)在惰性气氛保护下,对所述有机悬浊液进行超声处理,促进混合物发生化学反应,反应结束后,过滤,得到固体反应产物;(3)在惰性气氛保护下,利用有机溶剂对固体反应产物进行清洗、离心和干燥,脱除残留有机物,得到纳米氢化镁。本发明以超声波在液体介质中引发的空化效应提供能量,促进氯化镁和氢化锂之间的化学反应,同时利用超声波的破碎作用控制产物的颗粒尺寸,抑制纳米颗粒团聚,从而获得纳米级的氢化镁。所述惰性气氛是指在惰性气体下进行,所述惰性气体为氩气等。本发明的巧妙之处在于利用超声处理既加速原料反应又控制产物粒径,在简化操作步骤、降低反应能耗的前提下,实现纳米氢化镁的制备。为了能够将原材料进行充分的颗粒细化,以便原料能够在后续操作中更好地分散到有机溶剂里。作为优选,步骤(1)中,在将氯化镁和氢化锂加入至有机溶剂之前,分别将氯化镁和氢化锂进行球磨,得到球磨后的氯化镁和球磨后的氢化锂;所述球磨的转速为100~400转/小时,时间为3~12小时。进一步地,步骤(1)中,所述氯化镁为无水氯化镁,氯化镁与氢化锂的摩尔比为1:2;选择该配比可使氯化镁充分转变为氢化镁,且氢化锂转化为氯化锂,符合下述反应方程式:mgcl2+2lih→mgh2+2licl(1)进一步地,所述的有机溶剂为超干四氢呋喃、超干环己烷或超干乙醚。进一步地,采用步骤(a)替代步骤(1);步骤(a):将氯化镁、氢化锂和过渡金属氯化物一同放置于有机溶剂中,搅拌,得到有机悬浊液;再经步骤(2)和(3),得到催化剂掺杂的纳米氢化镁;所述过渡金属氯化物为无结晶水的氯化物,具体为四氯化钛、三氯化钛、四氯化锆、三氯化钒、五氯化铌、二氯化镍或二氯化钴。本发明以过渡金属氯化物作为催化剂前驱体,氯化镁作为镁源,氢化锂作为氢源及还原剂,超声波产生的空化效应为能量源,通过将粉末分散在有机溶剂中,进行超声处理,促使氢化锂与氯化镁发生化学反应,生成氢化镁和氯化锂,与此同时,氢化锂将过渡金属氯化物还原为金属单质,生成氯化锂;通过有机溶剂清洗超声固体反应产物,可以溶解除去副产物氯化锂,然后离心或抽滤分离,得到固体粉末材料,进一步在动态真空中干燥处理,获得过渡金属催化剂掺杂的纳米氢化镁。进一步地,针对不同过渡金属氯化物,过渡金属氯化物与氯化镁摩尔比的适用范围略不同。其中,对于四氯化钛和三氯化钛而言,过渡金属氯化物与氯化镁的摩尔比为0.01~0.05:1,该配比可以使样品具有较好的吸放氢动力学,且对储氢容量影响较小,而超过该范围则效果不佳;对于四氯化锆、三氯化钒、五氯化铌、二氯化镍和二氯化钴而言,过渡金属氯化物与氯化镁的摩尔比为0.01~0.1:1。进一步地,所述氢化锂与过渡金属氯化物中氯离子的摩尔比为1:1,选择该配比可以使金属氯化物充分被还原,且氢化锂全部转化为氯化锂。进一步地,步骤(2)中,所述超声的功率为100~600w,单次超声时间为0.5-1小时,间歇10-30分钟,累计超声时间为3~24小时。随着超声时间的延长,原料的反应程度逐渐提高,mgh2的产量也随之提高,但过长的超声时间会使体系温度明显提高,使mgh2颗粒出现长大,所得产物吸放氢动力学有所减慢;与延长超声时间类似,过高的功率会造成能量过剩,升高体系的温度导致产物的颗粒增大,不利于产物的性能。更优选,所述超声功率为210w,单次超声时间为0.5小时,间歇30分钟,累计超声时间为6小时。进一步地,步骤(2)中,将超声杆插入所述有机悬浊液中,进行超声处理。采用不同超声仪器进行超声,得到的结果不同;利用配备超声杆的超声波仪器进行制备,效率较高,反应速率较快,而利用超声波清洗机进行制备,对反应的加速效果不好,反应速率慢。进一步地,步骤(3)中,所述的有机溶剂为超干四氢呋喃或超干丙酮;清洗的时间为1~2小时,可以确保副产物氯化锂充分溶解。所述干燥在真空环境(真空度不低于1×10-3torr)或惰性气氛保护下加热实现,处理时间1~2小时。步骤(3)的多次离心操作,需将样品装入离心管内密封,以防止水氧污染,离心转速为5000~10000转/分钟,离心时间为5~20分钟。本发明提供了一种如所述的原位制备方法制得的纳米氢化镁。与现有技术相比,本发明具有以下有益效果:(1)本发明以超声波产生的空化效应为能量源促进氯化镁和氢化锂之间的化学反应,同时,利用超声波的破碎作用控制产物的颗粒尺寸,抑制纳米颗粒团聚,避免了添加各类载体材料抑制颗粒长大所导致的副作用,从而获得纳米级的氢化镁,保持了产物的高储氢容量。(2)本发明方法将氯化镁、氢化锂和过渡金属氯化物一同加入至有机溶剂中进行超声,可同时实现氢化镁的纳米化和催化剂掺杂,充分利用纳米效应及纳米催化效应,使氢化镁的放氢温度大幅度降低。(3)本发明利用lih作为还原剂,在制备纳米氢化镁的同时,可以充分将高价态金属还原,此外,反应前驱体mgcl2易溶于四氢呋喃等有机溶剂,lih密度较低通常漂浮于溶剂表面,氯化锂作为副产物,可溶于多种有机溶剂,上述物质在反应结束后易于除去,能够确保最终产物的纯度。(4)与现有的金属氧化物(tio2、zro2等)或卤化物(tif、ticl3、zrcl4等)催化剂相比,使用本发明方法制备的催化剂,与氢化镁储氢材料混合后不会产生类似mgcl2或mgo的副产物,有利于储氢材料保持高的容量,且催化剂与纳米氢化镁同时生成,同时实现了材料的纳米化和催化剂掺杂,而且催化剂在氢化镁纳米颗粒中分布均匀,催化效果优异。(5)本发明方法制备的纳米氢化镁,颗粒尺寸维持在5nm以内,储氢容量高,吸放氢温度相比常规技术制备的氢化镁大幅度降低。附图说明图1为实施例1制备的纳米氢化镁的eds图谱(a)和xps图谱(b)。图2为实施例1制备的纳米氢化镁的sem照片。图3为实施例1制备的纳米氢化镁的tem图片(a)和高分辨tem图片(b,c)。图4为实施例1制备的纳米氢化镁的随温脱气质谱曲线:(a)氢气析出曲线和(b)四氢呋喃析出曲线。图5为实施例1制备的纳米氢化镁样品与对比例2、对比例3制备的氢化镁随温脱氢质谱曲线的比较图。图6为实施例1制备的纳米氢化镁样品(a)与对比例2、对比例3制备的氢化镁(b)放氢至不同阶段的xrd图。图7为实施例2制备的ti催化掺杂的纳米氢化镁样品的eds图谱(a)和ti元素xps图谱(b)。图8为实施例2制备的ti催化掺杂的纳米氢化镁样品的tem图片(a)和高分辨tem图片(b)。图9为实施例2制备的ti催化掺杂的纳米氢化镁样品与对比例4、对比例5制备的ticl4掺杂的氢化镁随温脱氢质谱曲线的比较图。图10为实施例2和对比例6制备的不同ti催化剂添加量的氢化镁样品随温脱氢质谱曲线比较图。图11为实施例2和对比例6制备的不同ti催化剂添加量的氢化镁样品脱氢产物的xrd比较图。图12为实施例3制备的v催化掺杂的纳米氢化镁样品的eds图谱(a)和v元素xps图谱(b)。图13为实施例3制备的v催化掺杂的纳米氢化镁样品与对比例7、对比例8制备的vcl2掺杂的氢化镁随温脱氢质谱曲线的比较图。图14为实施例4制备的zr催化掺杂的纳米氢化镁样品的eds图谱(a)和zr元素的xps图谱(b)。图15为实施例4制备的zr催化掺杂的纳米氢化镁样品与对比例9、对比例10制备的zrcl4掺杂的氢化镁随温脱氢质谱曲线的比较图。图16为实施例5制备的nb催化掺杂的纳米氢化镁样品与对比例11、对比例12制备的nbcl5掺杂的氢化镁随温脱氢质谱曲线的比较图。图17为实施例6制备的ni催化掺杂的纳米氢化镁样品的sem照片(a),tem照片(b)和高分辨tem照片(c,d)图18为实施例6制备的ni催化掺杂的纳米氢化镁样品与传统方法制备的nicl2掺杂的氢化镁随温脱氢质谱曲线的比较图。具体实施方式下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施例,但本发明的保护范围不仅限于此。实施例1纳米氢化镁的制备(1)将500mg无水氯化镁与500mg氢化锂在氩气气氛手套箱内,分别装入球磨罐,以350转/分钟的转速球磨破碎3小时。(2)在氩气气氛手套箱内,取球磨过的无水氯化镁和氢化锂(摩尔比1:2)共计600mg,装入250ml烧瓶内,随后,向烧瓶内注入150ml超干四氢呋喃,搅拌30min,待氯化镁充分溶解。(3)将超声杆插入烧瓶内,保持超声杆末端位于烧瓶内混合物中部,以210w输出功率进行超声处理,超声过程中为保持样品温度不至升温过高,持续超声半小时间须间歇半小时,累计处理6小时获得超声产物。(4)利用离心的方式(8000转/分钟),分离出步骤(3)中超声产物中的固体粉末,装入100ml烧瓶内,并注入50ml超干四氢呋喃,搅拌2小时进行清洗,使副产物氯化锂充分溶解于四氢呋喃中。(5)利用离心的方式(8000转/分钟)分离出步骤(4)中得到的固体粉末,再次利用四氢呋喃清洗后离心获得固体粉末,在动态真空(真空度为1×10-3torr)中保持2小时干燥,除去残留的四氢呋喃,可获得纳米氢化镁样品,随后将样品在手套箱内保存待用。上述过程中制备的样品为:纳米氢化镁样品(nano-mgh2),从图1a中可以看出,样品中只含有镁元素,微弱的氧信号和碳信号来源于空气中的碳氧污染或微量的有机溶剂残留,表明样品是由镁组成;从图1b中可以看出,所得样品中镁元素的2p自旋轨道峰位于:50.2ev,表明样品中的镁元素全部以氢化镁的形式存在。从图2中可以看出样品是由大量的氢化镁纳米颗粒堆积而成,颗粒多为近似球状。从图3中可以看出,氢化镁纳米颗粒基本维持在5nm,从高分辨透射照片可以标定出氢化镁颗粒的晶面间距0.225nm对应为(200)晶面族。从上述分析可以看出,利用本方法可以成功制备出的纳米氢化镁。将样品以2℃/min从室温加热至400℃,并利用质谱仪分析样品在加热过程中的脱气曲线(图4),从图中可以看出,纳米氢化镁在加热过程中只放出氢气,几乎没有四氢呋喃气体放出,表明有机溶剂在动态真空中已经完全除掉,从放氢曲线可以看出,样品的起始放氢温度低于100℃,第一步放氢峰值温度为190℃,相比常规方法制备的氢化镁样品放氢温度更低。对比例1无反应促进机制条件下制备氢化镁(1)将500mg无水氯化镁与500mg氢化锂在氩气气氛手套箱内,分别装入球磨罐,以350转/分钟的转速球磨破碎3小时。(2)在氩气气氛手套箱内,取球磨过的无水氯化镁和氢化锂(摩尔比1:2)共计600mg,装入250ml烧瓶内,随后,向烧瓶内注入150ml超干四氢呋喃,搅拌12h。(3)利用离心的方式(8000转/分钟),分离出步骤(3)中超声产物中的固体物质。经过上述实验后发现,离心无法收集到固体材料,由此可知,mgcl2与lih之间的反应有较高的能垒,在没有额外能量输入(超声波)的情况下,mgcl2与lih之间在常温常压下反应动力学过慢,因此,超声在本发明中,不但起到控制颗粒团聚长大的作用,还起到加速mgcl2与lih之间化学反应的作用。对比例2在充满氩气的手套箱内,将无水氯化镁和氢化锂(摩尔比1:2)共计1.2g,装入球磨罐中在高能球磨机上进行球磨,球磨气氛为氩气气氛,转速为:500转/分钟,球料比为:120:1,球磨时间为24小时,将球磨后的样品在惰性气氛下放入四氢呋喃中进行清洗两次除去副产物氯化锂,随后通过离心取得固体粉末,在动态真空条件下(真空度为1×10-3torr)除去残留的四氢呋喃可获得球磨法制备的mgh2样品,随后将样品以2℃/min的升温速率加热至400℃,通过质谱仪记录样品在加热过程中的放氢行为。从图5中可以看出,利用超声辅助方法制备的纳米氢化镁比球磨法制备的氢化镁起始温度降低了180℃,第一步放氢峰值温度降低了130℃放氢性能得到明显改善。从图6a中可以看出所制备的氢化镁由于颗粒细小mgh2的衍射峰强度较低,峰宽较大,在放氢过程中,mg的衍射峰逐渐显现,并随着温度升高而加强,放氢产物经吸氢后,mg的峰消失。与对比例2中传统方法制备的mgh2放氢过程相比,超声制备的纳米氢化镁分解得到的金属镁,由于颗粒细小,表面原子所占比例较大,晶格有序度差,衍射峰较宽,与之相比传统方法制备的mgh2放氢产物结晶性较好,峰型尖锐。对比例3在充满氩气的手套箱内,将1g镁粉装入不锈钢管式密闭反应器内,在反应器内充入20大气压的高纯氢气,随后将反应器加热至550和350℃,各保温4小时,将反应器内的镁粉充分氢化为氢化镁,随后将反应器内的氢化镁转移至球磨罐内并在球磨罐内充入50大气压高纯氢气,转速为:500转/分钟,球料比为:120:1,球磨24小时,得到氢化镁样品,随后将样品以2℃/min的升温速率加热至400℃,通过质谱仪记录样品在加热过程中的放氢行为。从图5中可以看出,利用超声辅助方法制备的纳米氢化镁比加热-球磨法制备的氢化镁起始温度降低了125℃,第一步放氢峰值温度降低了90℃放氢性能得到明显改善。从图6b中可以看出,本实施例的mgh2放氢过程中产生的mg与超声制备的纳米氢化镁分解得到的金属镁晶格结构明显不同。实施例2ti催化掺杂的纳米氢化镁样品的制备(1)将无水氯化镁(500mg)和氢化锂(500mg)在氩气气氛手套箱内,分别装入球磨罐,以350转/分钟的转速球磨破碎3小时。(2)在氩气气氛手套箱内,取球磨过的无水氯化镁和氢化锂(摩尔比1:2)共计600mg以及四氯化钛(ticl4)(16.4μl),装入250ml烧瓶内,随后向烧瓶内注入100ml超干环己烷搅拌30min,本实施例的配比,ti催化剂与氯化镁的摩尔比为0.03:1。(3)将超声杆插入烧瓶内,保持超声杆末端位于烧瓶内混合物中部,以210w输出功率进行超声处理,超声过程中为保持样品温度不至升温过高,持续超声半小时间须间歇半小时,累计处理6小时获得超声产物。(4)利用离心的方式(8000转/分钟),分离出步骤(3)中超声产物中的固体粉末,然后装入100ml烧瓶内并注入50ml超干四氢呋喃,磁力搅拌2小时进行清洗,使副产物氯化锂充分溶解于四氢呋喃中。(5)利用离心的方式(8000转/分钟)分离出步骤(4)中得到的固体粉末,再次利用四氢呋喃清洗后离心获得固体粉末,在动态真空(真空度为1×10-3torr)中保持2小时脱除残留的四氢呋喃,可获得ti催化掺杂的纳米氢化镁样品命名为nano-mgh2-0.03ti,随后将样品在手套箱内保存待用。从图7a中可以看出样品中只含有镁元素和钛元素,微弱的氧信号和碳信号来源于空气中的碳氧污染或微量的有机溶剂残留,表明样品的主相是氢化镁,少量钛作为催化剂;从图7b中可以看出,所得样品中钛元素的ti2p3/2-2p1/2双重自旋轨道峰分别位于:453.9和459.3ev,表明利用本方法,ticl4已经完全被还原为ti单质,由此可见,超声波不但能够引发mgh2的合成反应,同样可以引发lih对ticl4的还原反应。从图8中可以看出,氢化镁纳米颗粒基本维持在5nm,从高分辨透射照片可以标定出氢化镁颗粒的晶面间距0.225nm对应为(200)晶面族。从上述分析可以看出,利用本方法可以成功制备出ti催化掺杂的纳米氢化镁样品。将样品以2℃/min从室温加热至400℃,并利用质谱仪分析样品在加热过程中的脱气曲线(图9),从图中可以看出,样品的起始放氢温度为40℃,第一步放氢峰值温度为115℃,相比常规方法制备的氢化镁样品放氢温度更低。此外,针对于ti催化剂与氯化镁的摩尔比为0.01:1和0.05:1制备获得的ti催化掺杂的纳米氢化镁样品,利用质谱仪分析样品在加热过程中的脱气曲线,样品的起始放氢温度为35℃(0.01:1)和50℃(0.05:1),第一步放氢峰值温度为90℃(0.01:1)和125℃(0.05:1)(图9)。对比例4在充满氩气的手套箱内,将无水氯化镁和氢化锂(摩尔比1:2,共计1.2g)以及四氯化钛(32.5μl)装入球磨罐中在高能球磨机上进行球磨,球磨气氛为氩气气氛,转速为:500转/分钟,球料比为:120:1,球磨时间为24小时,将球磨后的样品在惰性气氛下放入四氢呋喃中进行清洗两次除去副产物氯化锂,随后通过离心取得固体粉末,在动态真空条件下(真空度为1×10-3torr)除去残留的四氢呋喃,可获得钛催化掺杂的mgh2样品,本对比例所制备的样品中,钛催化剂与氯化镁的摩尔比为:0.03:1,随后将样品以2℃/min的升温速率加热至400℃,通过质谱仪记录样品在加热过程中的放氢行为。从图9中可以看出,利用超声辅助方法制备的ti催化掺杂的纳米氢化镁比球磨法制备的氢化镁起始温度降低了140℃,第一步放氢峰值温度降低了143℃放氢性能明显优于球磨法制备的样品。对比例5在充满氩气的手套箱内,将1g镁粉装入不锈钢管式密闭反应器内,在反应器内充入20大气压高纯氢气,随后将反应器加热至550和350℃各保温4小时,将反应器内的镁粉充分氢化为氢化镁,随后将反应器内的氢化镁转移至球磨罐内,并加入32.5μl四氯化钛后,充入50大气压高纯氢气,转速为:500转/分钟,球料比为:120:1,球磨24小时,得到钛催化掺杂的氢化镁样品,本对比例所制备的样品中,钛催化剂与mgh2的摩尔比为:0.03:1,随后将样品以2℃/min的升温速率加热至400℃,通过质谱仪记录样品在加热过程中的放氢行为。从图9中可以看出,利用超声辅助方法制备的ti催化掺杂的纳米氢化镁比加热-球磨法制备的ti催化掺杂氢化镁起始温度降低了120℃,第一步放氢峰值温度降低了110℃放氢性能得到明显改善。对比例6利用实施例3中所描述的相同的方法,超声波辅助制备ti催化掺杂的纳米氢化镁,对其中的ticl4用量进行扩展,ti催化剂与氯化镁的摩尔比为0.1:1。从图10中可以发现,本对比例扩大ticl4的用量后,性能明显变差,主要的放氢峰向着高温区偏移,在低温区只有微弱的放氢,这表明添加过量的催化剂会对超声促进mgcl2与lih的反应产生不利影响,使得[mgcl2+2lih→mgh2+2licl]反应的能垒下降,多余的能量促进产物结晶,mgh2颗粒尺寸增大。从图11从可以看出,添加过量的催化剂后,样品放氢的产物mg出现了与对比例2(传统方法)中样品放氢产物类似的峰型。实施例3v催化掺杂的纳米氢化镁样品的制备与实施例2的制备方法相同,不同之处在于所用过渡金属催化剂为:三氯化钒vcl3,表1列出了相应的原料配比及关键工艺,该样品命名为nano-mgh2-0.03v。表1nano-mgh2-0.03v样品的制备工艺及原料配比超声功率(w)超声时间(h)mgcl2+lih(mg)vcl3(mg)210660024从图12a中可以看出样品中只含有镁元素和钒元素,微弱的氧信号和碳信号来源于空气中的碳氧污染或微量的有机溶剂残留,表明样品的主相是氢化镁,少量钒作为催化剂;从图12b中可以看出,所得样品中钛元素的v2p3/2-vp1/2双重自旋轨道峰分别位于:512.5和519.7ev,表明利用本方法,vcl3已经完全被还原为v单质。利用质谱仪分析样品的脱氢曲线(2℃/min)(图13),本实施例样品的放氢性能参数总结在表4,该样品相比常规方法制备的氢化镁样品放氢温度更低。对比例7与对比例4所用方法相同,不同之处在于所用过渡金属氯化物为:三氯化钒,表2所示为本对比例所用球磨工艺与原料配比:表2对比例7样品的制备工艺及原料配比转速(r/min)球料比球磨时间(h)mgcl2+lih(mg)vcl3(mg)500120:124120047本对比例所制备的样品中,v催化剂与mgh2的摩尔比为:0.03:1,图13所示为实施例3样品与本对比例样品的放氢曲线对比图,相关放氢性能参数总结于表4。对比例8与对比例5所用方法相同,不同之处在于所用过渡金属氯化物为:三氯化钒,表3所示为本对比例中混合催化剂与氢化镁所用球磨工艺与原料配比:表3对比例8样品的制备工艺及原料配比转速(r/min)球料比球磨时间(h)mg粉(mg)vcl3(mg)500120:1241000200本对比例所制备的样品中,v催化剂与mgh2的摩尔比为:0.03:1,图13所示为实施例3样品与本对比例样品的放氢曲线对比图,样品的放氢性能参数总结于表4。表4v催化mgh2样品的性能对比样品名起始放氢温度(℃)峰值温度(℃)nano-mgh2-0.03v70163对比例7245293对比例8220263从表4总结的样品性能对比可以看出,超声辅助法制备的样品比传统方法制备的样品具有更优异的放氢动力学性能实施例4zr催化掺杂的纳米氢化镁样品的制备与实施例2的制备方法相同,不同之处在于所用过渡金属催化剂为:四氯化锆zrcl4,表4列出了相应的原料配比及关键工艺,该样品命名为nano-mgh2-0.03zr。表5nano-mgh2-0.03zr样品的制备工艺及原料配比超声功率(w)超声时间(h)mgcl2+lih(mg)zrcl4(mg)2101060035图14a所示为样品的能谱数据(eds),从图中可以看出样品中只含有镁元素和锆元素,微弱的氧信号和碳信号来源于空气中的碳氧污染或微量的有机溶剂残留,表明样品的主相是氢化镁,少量锆作为催化剂;图14所示为样品中钛元素的x射线光电子能谱分析图谱(xps图谱),从图中可以看出,所得样品中锆元素的zr3d5/2-3d3/2双重自旋轨道峰分别位于:177.6和181.1ev,表明利用本方法,zrcl4已经完全被还原为zr单质。从上述分析可以看出,利用本方法可以成功制备出可获得zr催化掺杂的纳米氢化镁样品。利用质谱仪分析样品的脱氢曲线(2℃/min)(图15),样品的放氢性能参数总结在表8,该样品相比常规方法制备的氢化镁样品放氢温度更低。对比例9与对比例4所用方法相同,不同之处在于所用过渡金属氯化物为:四氯化锆,表6所示为本对比例所用球磨工艺与原料配比:表6对比例9样品的制备工艺及原料配比转速(r/min)球料比球磨时间(h)mgcl2+lih(mg)zrcl2(mg)500120:124120070图15所示为实施例4样品与本对比例样品放氢曲线对比图,本对比例样品的放氢性能参数总结于表8。对比例10与对比例5所用方法相同,不同之处在于所用过渡金属氯化物为:四氯化锆,表7所示为本对比例中混合催化剂与氢化镁所用球磨工艺与原料配比:表7对比例10样品的制备工艺及原料配比转速(r/min)球料比球磨时间(h)mg粉(mg)zrcl4(mg)500120:1241000270本对比例所制备的样品中,zr催化剂与mgh2的摩尔比为:0.03:1,图15所示为实施例4样品与本对比例样品放氢曲线对比图,本对比例样品的性能参数总结于表8。表8v催化mgh2样品的性能对比样品名起始放氢温度(℃)峰值温度(℃)nano-mgh2-0.03zr75185对比例9305338对比例10250294从表8总结的样品性能对比可以看出,超声辅助法制备的样品比传统方法制备的样品具有更优异的放氢动力学性能实施例5nb催化掺杂的纳米氢化镁样品的制备与实施例2的制备方法相同,不同之处在于所用过渡金属催化剂为:四氯化锆nbcl5,表9列出了相应的原料配比及关键工艺,该样品命名为nano-mgh2-0.03nb。表9nano-mgh2-0.03nb样品的制备工艺及原料配比超声功率(w)超声时间(h)mgcl2+lih(mg)nbcl5(mg)2101060040图16所示为样品在加热过程中的脱氢曲线(2℃/min),该样品的放氢性能参数总结于表11,相比常规方法制备的氢化镁样品放氢温度更低。对比例11与对比例4所用方法相同,不同之处在于所用过渡金属氯化物为:五氯化铌,表10所示为本对比例所用球磨工艺与原料配比:表10对比例11样品的制备工艺及原料配比转速(r/min)球料比球磨时间(h)mgcl2+lih(mg)nbcl5(mg)500120:124120080本对比例所制备的样品中,nb催化剂与mgh2的摩尔比为:0.03:1,图16所示为实施例5样品与本对比例样品放氢曲线对比图,本对比例样品的放氢性能参数总结于表11。对比例12与对比例5所用方法相同,不同之处在于所用过渡金属氯化物为:五氯化铌,表11所示为本对比例中混合催化剂与氢化镁所用球磨工艺与原料配比:表11对比例12样品的制备工艺及原料配比转速(r/min)球料比球磨时间(h)mg粉(mg)nbcl5(mg)500120:1241000310本对比例所制备的样品中,nb催化剂与mgh2的摩尔比为:0.03:1,图16所示为实施例5样品与本对比例样品放氢曲线对比图,本对比例样品的放氢性能参数总结于表12。表12v催化mgh2样品的性能对比样品名起始放氢温度(℃)峰值温度(℃)nano-mgh2-0.03nb65137对比例11205267对比例12210247从表12总结的样品性能对比可以看出,超声辅助法制备的样品比传统方法制备的样品具有更优异的放氢动力学性能实施例6ni催化掺杂的纳米氢化镁样品的制备与实施例2的制备方法相同,不同之处在于所用过渡金属催化剂为:四氯化锆nicl2,表13列出了相应的原料配比及关键工艺,该样品命名为nano-mgh2-0.03ni。表13nano-mgh2-0.03ni样品的制备工艺及原料配比超声功率(w)超声时间(h)mgcl2+lih(mg)nicl2(mg)2101060020图17所示为nano-mgh2-0.03ni样品的sem和tem图片,从图中可以看出,样品呈现出类似石墨烯的层状结构,从样品的tem照片可以看出,每层样品中包含大量相互交叠的纳米mgh2颗粒,颗粒尺寸维持在3纳米左右,可以看出,通过改变添加剂的成分,对产物的形貌具有一定的调变作用。图18所示为本实施例样品的放氢曲线(2℃/min),本实施例样品的放氢性能参数总结于表16,相比常规方法制备的氢化镁样品放氢温度更低。对比例13与对比例4所用方法相同,不同之处在于所用过渡金属氯化物为:二氯化镍,表14所示为本对比例所用球磨工艺与原料配比:表14对比例13样品的制备工艺及原料配比转速(r/min)球料比球磨时间(h)mgcl2+lih(mg)nicl2(mg)500120:124120080本对比例所制备的样品中,ni催化剂与mgh2的摩尔比为:0.03:1,图18所示为实施例6样品与本对比例样品放氢曲线对比图,本对比例样品的放氢性能参数总结于表16。对比例14与对比例5所用方法相同,不同之处在于所用过渡金属氯化物为:二氯化镍,表15所示为本对比例中混合催化剂与氢化镁所用球磨工艺与原料配比:表15对比例14样品的制备工艺及原料配比转速(r/min)球料比球磨时间(h)mg粉(mg)nicl2(mg)500120:1241000150本对比例所制备的样品中,ni催化剂与mgh2的摩尔比为:0.03:1,图18所示为实施例6样品与本对比例样品放氢曲线对比图,本对比例样品的放氢性能参数总结于表16。表16v催化mgh2样品的性能对比从表12总结的样品性能对比可以看出,超声辅助法制备的样品比传统方法制备的样品具有更优异的放氢动力学性能。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1