一种铵改性的碱性水钠锰矿修复材料及其制备方法与应用
本发明属于环境功能材料领域,具体涉及一种铵改性的碱性水钠锰矿修复材料及其制备方法与应用。
背景技术:
最近几年随着采矿业的发展,大量含有砷的矿物被开采出来,随着这些矿石的开采,砷及其化合物被不断的氧化、分解、转移,造成周围的环境存在着严重的砷污染。自然界存在的砷主要分为有机砷和无机砷,通常来说无机砷的毒性要大一些。因为砷及其化合物的化学特性比较稳定,在环境中不容易被进一步的分解为无害的物质,因此极易对周围的环境造成污染,土壤中过量的砷浓度,会严重阻碍植物的生长,而人体如果一次摄入过量的砷会导致急性中毒,甚至引起死亡,如果长期摄入少量的砷或者其化合物也会导致慢性中毒,甚至会引发神经炎。土壤中无机砷主要以as(iii)和as(v)两种价态存在,as(iii)和as(v)在自然界中主要以亚砷酸(h3aso3)和砷酸根(h2aso4-和haso42-)的形式存在,前者毒性比后者大60倍,而且移动性强,不容易被吸附。
水钠锰矿在土壤中广泛存在,由一层mno6八面体与一层水分子连接堆叠而形成层状锰矿物,其形成的土壤环境条件的ph范围比较宽,既能存在于酸性土壤,也能存于碱性土壤。水钠锰矿由于结晶弱,颗粒细小,常具有较大的比表面积,且电荷零点低、阳离子交换量高、氧化能力强等优点,所以对土壤及水体中的重金属的氧化还原和吸附解吸过程起着重要的作用。
水钠锰矿一般可以通过氧化mn(oh)2或者是还原kmno4合成,前者合成环境一般为碱性,合成的产物为六方片状或板状晶体。后者合成环境则为酸性,合成的产物多为薄片状晶体聚集而成的三维花球状集合。碱性水钠锰矿具有三价锰与四价锰都位于锰氧八面体层内,不含或含少量八面体空位的结构特点,所以碱性水钠锰矿往往结晶相对较好。由于碱性水钠锰矿表面具有大量的可变负电荷,而且比表面积大,所以其具有很好的吸附性能,且对重金属离子的吸附主要是专性吸附,并且其具有四价锰三价锰比例高,所以对as(iii)氧化能力强。因此,碱性水钠锰矿作为一种快速、高效、低成本的修复材料,在减轻环境中重金属污染尤其是砷污染现象中起到了重要的作用。
近年,已有大量利用过渡金属改性水钠锰矿的研究,发现有很好的效果,而铵根作为一种类金属离子,与过渡金属离子相比更具有安全性、价格低廉的优点,所以铵改性的碱性水钠锰矿修复材料的开发和应用对重金属污染废水的处理具有一定的现实意义。
技术实现要素:
为了克服现有技术存在的不足,本发明的目的是提供一种铵改性的碱性水钠锰矿修复材料及其制备方法与应用。
本发明的目的在于提供一种制备铵改性的碱性水钠锰矿修复材料的方法。
本发明的另一个目的在于提供一种由上述制备方法制备得到的铵改性的碱性水钠锰矿修复材料高效去除重金属as(ⅲ)的方法。
本发明的目的至少通过如下技术方案之一实现。
本发明提供的铵改性的碱性水钠锰矿修复材料的制备方法,包括如下步骤:
(1)将氯化锰、氯化铵加入水中,混合均匀,得到混合溶液(含nh4+的nh4cl与mncl2的混合溶液);
(2)将氢氧化钠溶液加入步骤(1)所述混合溶液中,在搅拌状态下通入氧气进行反应,离心取沉淀,洗涤,干燥,研磨成粉,过筛,得到所述铵改性的碱性水钠锰矿修复材料。
进一步地,在步骤(1)所述混合溶液中,氯化铵的浓度为0.5-2m。
进一步地,在步骤(1)所述混合溶液中,氯化锰的浓度为0.25-0.5m。
进一步地,步骤(2)所述氢氧化钠溶液的浓度为4-6m;氢氧化钠溶液的温度为0-4摄氏度。所述氢氧化钠溶液可以提前在在0-4℃条件下冷藏5-10小时。
进一步地,步骤(2)所述氢氧化钠溶液与混合溶液的体积比为1:0.9-1.1。
优选地,步骤(2)所述氢氧化钠溶液与混合溶液的体积比为1:1。
进一步地,步骤(2)所述在搅拌状态下的搅拌速率为450-800rpm;所述氧气的流量为1.5-3l/min;所述反应的时间为4.9-5.1小时。
优选地,步骤(2)所述反应的时间为5小时。
优选地,步骤(2)所述氧气的流量为2l/min。
进一步地,步骤(2)所述待反应液中,oh-与mn2+浓度之比为12-14:1。
进一步地,步骤(2)所述洗涤,包括:用水对沉淀进行离心洗涤至上清液电导率小于20μs·cm-1;所述过筛的筛孔大小为100目。
本发明提供一种由上述的制备方法制得的铵改性的碱性水钠锰矿修复材料。
本发明提供的铵改性的碱性水钠锰矿修复材料在氧化去除重金属as(ⅲ)中的应用,包括如下步骤:
将铵改性的碱性水钠锰矿修复材料投加至含重金属as(ⅲ)的废水中,搅拌处理,过滤取滤液,得到氧化去除重金属as(ⅲ)后的废水。
进一步地,在所述含重金属as(ⅲ)的废水中,as(ⅲ)的浓度为0.02mm-0.2mm;
进一步地,所述含重金属as(ⅲ)的废水的ph值为3.0-9.0;
进一步地,所述铵改性的碱性水钠锰矿修复材料与含重金属as(ⅲ)的废水的质量体积比为0.3-0.5:1g/l;
进一步地,所述搅拌处理的时间为6-48h。
优选地,所述铵改性的碱性水钠锰矿修复材料与含重金属as(ⅲ)的废水的质量体积比为0.4g/l。
与现有技术相比,本发明具有如下优点和有益效果:
本发明提供的铵改性的碱性水钠锰矿修复材料能够应用于处理重金属as(ⅲ)的废水,该铵改性碱性水钠锰矿修复材料相较于未改性的碱性水钠锰矿能快速高效地将as(ⅲ)氧化为as(ⅴ),降低毒性去除效果好,没有二次污染,绿色环保,而且该材料的制备方法工艺简单。
附图说明
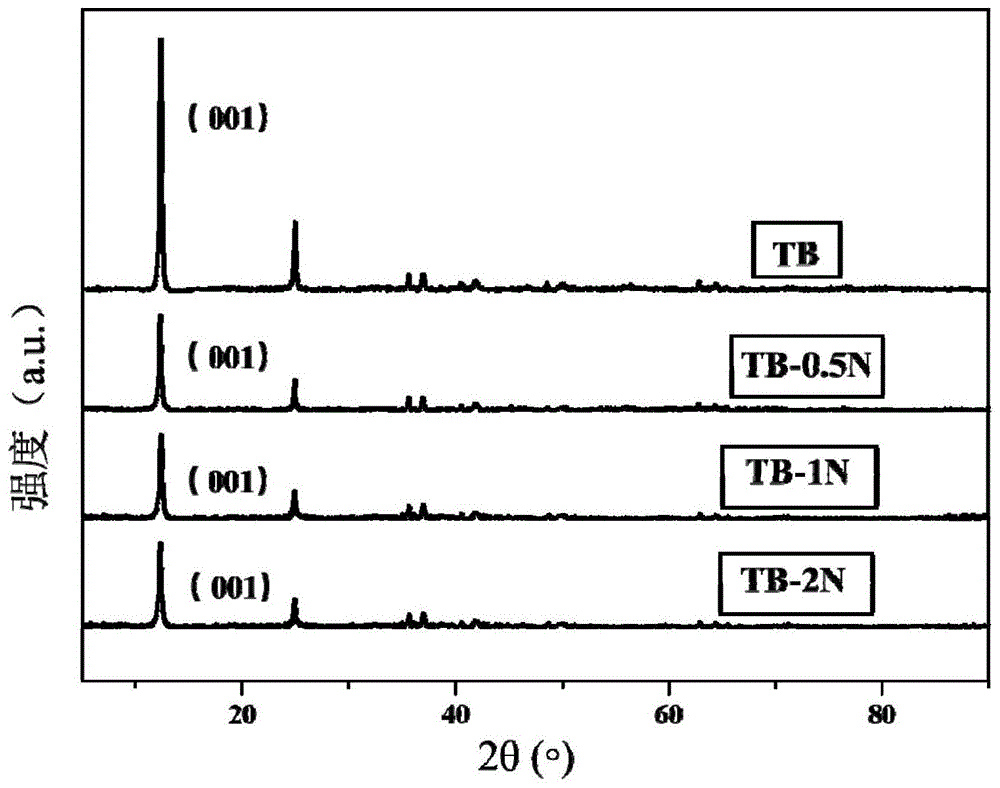
图1为实施例1的不同浓度氯化铵制备的铵改性的碱性水钠锰矿的xrd图;
图2a、图2b、图2c及图2d分别为实施例1中制备的tb、tb-0.5n、tb-1n及tb-1n的扫描电镜图;
图3为实施例5中不同浓度氯化铵制备的铵改性的碱性水钠锰矿氧化去除重金属as(ⅲ)的氧化曲线图;
图4为实施例5中不同重金属as(ⅲ)浓度下,铵改性的碱性水钠锰矿氧化去除重金属as(ⅲ)的氧化曲线图;
图5为实施例5中不同ph条件下,铵改性的碱性水钠锰矿氧化去除重金属as(ⅲ)的氧化曲线图。
具体实施方式
以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
实施例1
一种铵改性的碱性水钠锰矿修复材料的制备方法,包括如下步骤:
(1)取4份氯化锰(每份19.863g),4份去离子水(250ml),分别将4份氯化锰加入4份去离子水中,混合均匀,得到4份溶液,然后往这4份溶液中加入0g、6.686g、13.372g、26.744g氯化铵,混合均匀,得到4份nh4cl与mncl2混合溶液;这4份nh4cl与mncl2混合溶液中,nh4+的浓度分别为0m、0.5m、1m、2m;
(2)将4份氢氧化钠(每份55g)分别加入4份去离子水(每份250ml)中,得到4份浓度为5.5m的naoh溶液;
(3)将4份步骤(2)所述氢氧化钠溶液(温度为4摄氏度)分别加入步骤(1)的4份nh4cl与mncl2混合溶液中,然后分别在转速为800rpm的搅拌状态下通入氧气进行反应,氧气的流量均为2l/min,反应时间均为5小时,离心取沉淀,用去离子水进行离心洗涤至上清液电导率小于20μs·cm-1,冷冻干燥,研磨成粉,过筛(筛孔大小均为100目),得到3份所述铵改性的碱性水钠锰矿修复材料;这3份铵改性的碱性水钠锰矿修复材料分别是由0.5m、1m、2m的nh4+制备得到的,分别标记为tb-0.5n,tb-1n,tb-2n。还得到一份没有经过铵改性的碱性水钠锰矿修复材料,这份材料标记为tb。
上述铵改性的碱性水钠锰矿修复材料和没有经过铵改性的碱性水钠锰矿修复材料的xrd图参照图1所示。与标准pdf谱图比较,与标准峰位基本一致,证明成功合成了碱性水钠锰矿,并且发现经过铵改性的碱性水钠锰矿相比于原碱性水钠锰矿并没有出现新峰,说明结构没有改变;铵改性的碱性水钠锰矿的sem图可参照图2a、图2b、图2c及图2d所示,改性前后形貌均呈现片状,没有明显改变,铵改性之后的碱性水钠锰矿仅颗粒变小,并伴有团聚现象。
实施例2
一种铵改性的碱性水钠锰矿修复材料的制备方法,包括如下步骤:
(1)将19.863g氯化锰加入250ml去离子水中,混合均匀,然后加入6.686g氯化铵,混合均匀,得到nh4cl与mncl2混合溶液;在nh4cl与mncl2混合溶液中,nh4+的浓度为0.5m;
(2)将40g氢氧化钠分别加入250ml去离子水中,得到浓度为5.5m的naoh溶液;
(3)将步骤(2)所述氢氧化钠溶液(温度为1摄氏度)分别加入步骤(1)的nh4cl与mncl2混合溶液中,然后分别在转速为450rpm的搅拌状态下通入氧气进行反应,氧气的流量为2l/min,反应时间为5小时,离心取沉淀,用去离子水进行离心洗涤至上清液电导率小于20μs·cm-1,冷冻干燥,研磨成粉,过筛(筛孔大小均为100目),得到所述铵改性的碱性水钠锰矿修复材料。
上述铵改性的碱性水钠锰矿修复材料和没有经过铵改性的碱性水钠锰矿修复材料的xrd图参照图1所示。与标准pdf谱图比较,与标准峰位基本一致,证明成功合成了碱性水钠锰矿,并且发现经过铵改性的碱性水钠锰矿相比于原碱性水钠锰矿并没有出现新峰,说明结构没有改变;该铵改性的碱性水钠锰矿的sem图可参考图2b所示,改性前后形貌均呈现片状,没有明显改变,铵改性之后的碱性水钠锰矿仅颗粒变小,并伴有团聚现象。
实施例3
一种铵改性的碱性水钠锰矿修复材料的制备方法,包括如下步骤:
(1)将19.863g氯化锰加入250ml去离子水中,混合均匀,然后加入13.372g氯化铵,混合均匀,得到nh4cl与mncl2混合溶液;在nh4cl与mncl2混合溶液中,nh4+的浓度为1m;
(2)将40g氢氧化钠分别加入250ml去离子水中,得到浓度为5.5m的naoh溶液;
(3)将步骤(2)所述氢氧化钠溶液(温度为3摄氏度)分别加入步骤(1)的nh4cl与mncl2混合溶液中,然后分别在转速为700rpm的搅拌状态下通入氧气进行反应,氧气的流量为2l/min,反应时间为5小时,离心取沉淀,用去离子水进行离心洗涤至上清液电导率小于20μs·cm-1,冷冻干燥,研磨成粉,过筛(筛孔大小均为100目),得到所述铵改性的碱性水钠锰矿修复材料。
上述铵改性的碱性水钠锰矿修复材料和没有经过铵改性的碱性水钠锰矿修复材料的xrd图参照图1所示。与标准pdf谱图比较,与标准峰位基本一致,证明成功合成了碱性水钠锰矿,并且发现经过铵改性的碱性水钠锰矿相比于原碱性水钠锰矿并没有出现新峰,说明结构没有改变;铵改性的碱性水钠锰矿的sem图可参考图2c,改性前后形貌均呈现片状,没有明显改变,铵改性之后的碱性水钠锰矿仅颗粒变小,并伴有团聚现象。
实施例4
一种铵改性的碱性水钠锰矿修复材料的制备方法,包括如下步骤:
(1)将19.863g氯化锰加入250ml去离子水中,混合均匀,然后加入26.744g氯化铵,混合均匀,得到nh4cl与mncl2混合溶液;在nh4cl与mncl2混合溶液中,nh4+的浓度为2m;
(2)将40g氢氧化钠分别加入250ml去离子水中,得到浓度为5.5m的naoh溶液;
(3)将步骤(2)所述氢氧化钠溶液(温度为0摄氏度)分别加入步骤(1)的nh4cl与mncl2混合溶液中,然后分别在转速为750rpm的搅拌状态下通入氧气进行反应,氧气的流量为3l/min,反应时间为5小时,离心取沉淀,用去离子水进行离心洗涤至上清液电导率小于20μs·cm-1,冷冻干燥,研磨成粉,过筛(筛孔大小均为100目),得到所述铵改性的碱性水钠锰矿修复材料。
上述铵改性的碱性水钠锰矿修复材料和没有经过铵改性的碱性水钠锰矿修复材料的xrd图参照图1所示。与标准pdf谱图比较,与标准峰位基本一致,证明成功合成了碱性水钠锰矿,并且发现经过铵改性的碱性水钠锰矿相比于原碱性水钠锰矿并没有出现新峰,说明结构没有改变;铵改性的碱性水钠锰矿的sem图可参考图2d,改性前后形貌均呈现片状,没有明显改变,铵改性之后的碱性水钠锰矿仅颗粒变小,并伴有团聚现象。
实施例5
所述铵改性的碱性水钠锰矿修复材料在氧化去除重金属as(ⅲ)中的应用。
实施例5以实施例1制备的tb,tb-0.5n,tb-1n,tb-2n为待测样品,检测这四种物质的氧化去除重金属as(ⅲ)效果。
实施例5以naaso2溶液作为模拟砷污染废水对待测样品进行检测。
naaso2溶液的配制,包括:
分别将多份naaso2加入多份去离子水中,得到多份naaso2溶液;naaso2溶液的浓度为0.04mm、0.08mm、0.16mm、0.2mm。
检测tb,tb-0.5n,tb-1n,tb-2n氧化去除重金属as(ⅲ)的效果。该检测方法包括:取4份浓度为0.08mm的naaso2溶液(模拟含重金属as(ⅲ)的废水),每份250ml,这4份naaso2溶液的ph值均为7.0;然后往这4份naaso2溶液分别加入tb、tb-0.5n、tb-1n、tb-2n。所述tb、tb-0.5n、tb-1n、tb-2n的加入量均为0.1g,将材料加入naaso2溶液中搅拌处理,以一定的时间间隔用注射器分别抽取5ml混合液,用0.45μm的滤头过滤,用紫外分光光度计(检测波长为870nm)测溶液中as(ⅴ)的浓度;相关结果如图3所示,其他条件均相同下,相同反应时间,加入tb-2n的锥形瓶中的as(ⅴ)的浓度越高,说明tb-2n具有最强的氧化能力,去除as(ⅲ)的效果最好。
探究废水中重金属as(ⅲ)浓度对tb-2n氧化去除重金属as(ⅲ)的效果影响。该检测方法,包括:
将浓度为0.02mm、0.04mm、0.08mm、0.16mm、0.2mm的naaso2溶液分别置于5个反应容器中,每个反应容器的naaso2溶液体积均为250ml,而且每个反应容器的naaso2溶液的ph值均为7.0,然后分别往这5个反应容器中加入0.1g的tb-2n,搅拌处理,以一定的时间间隔用注射器分别抽取5ml锥形瓶中的溶液,用0.45μm的滤头过滤,用紫外分光光度计(870nm)测溶液中as(ⅴ)的浓度;相关结果如图4所示,相同反应时间下,加入naaso2浓度为0.08mm时,氧化效果最好。
探究废水ph值对tb-2n氧化去除重金属as(ⅲ)的效果影响。该检测分为实验组和对照组,实验组采用tb-2n作为待测样品,对照组采用tb作为待测样品。其中实验组的操作,包括:
分别取4份浓度为0.08mm的naaso2溶液置于4个反应容器中,每个容器250ml,然后分别调节这4个反应容器的溶液ph值为3.0、5.0、7.0、9.0;接着分别往这4个反应容器中投加0.1g的tb-2n,搅拌处理(时间均为24小时),搅拌24小时后分别用注射器分别抽取5ml锥形瓶中的溶液,用0.45μm的滤头过滤,用紫外分光光度计测溶液中as(ⅴ)的浓度。
对照组的操作与实验组基本一致,唯一不同之处在于:对照组不加入tb-2n,加入的是tb,但加入量与实验组相同。
结果如图5所示,相同反应时间下,ph越小,加入tb-2n和tb的锥形瓶中的as(ⅴ)的浓度均越高,说明氧化效果越好。而且tb-2n的氧化效果要比tb好。
综上所述,本发明实施例提供的铵改性的碱性水钠锰矿修复材料能够应用于处理重金属as(ⅲ)的废水,该铵改性碱性水钠锰矿修复材料相较于未改性的碱性水钠锰矿能快速高效地将as(ⅲ)氧化为as(ⅴ),降低毒性去除效果好,没有二次污染。
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!