一种人IL-12亲和纯化层析柱、其制备方法及利用其纯化重组人IL-12的方法与流程
本发明涉及一种制备重组人IL-12亲和纯化层析柱的工艺、由该工艺制得的重组人IL-12亲和纯化层析柱、及用该亲和纯化层析柱纯化重组人IL-12的方法。具体地说,本发明涉及用抗人IL-12的杂交瘤细胞株制备抗人IL-12单克隆抗体,并用该抗体制备重组人IL-12亲和纯化层析柱,然后用该亲和纯化层析柱纯化重组人IL-12的工艺流程。
背景技术:
重组人白细胞介素12(IL-12)最初称作自然杀伤细胞刺激因子(naturalkillercellstimulatoryfactor,NKSF)或细胞毒性淋巴细胞成熟因子(cytotoxiclymphocytematurationfactor,CLMF),主要是由激活的单核细胞和其他类型的细胞(树突状细胞、B细胞、中性粒细胞以及角质细胞)产生。IL-12所具备的增加NK细胞和活化T细胞的细胞毒活性、诱生IFN-γ、调节Th1细胞的发育等免疫学活性是IL-12抗肿瘤、抗病毒效应的理论基础,动物实验亦充分证实其药用价值。以此为基础,重组人IL-12(rhIL-12)作为一种药物已经进入抗肿瘤、抗病毒性疾病的II/III期临床试验阶段。人IL-12是由p40和p35两个亚基通过二硫键共价连接而成异二聚体糖蛋白,其分子量约为70-75kDa,等电点为4.5-5.5,其中p35亚单位有197个氨基酸残基,含7个半胱氨酸(cys)和3个N糖基化位点,p40亚单位306个氨基酸残基,有10个半胱氨酸,4个N-糖基化位点。p35有3个分子内二硫键,p40有4个分子内二硫键,同时p35和p40之间存在一对分子间二硫键在。单独p40或p35均无生物学活性,而且游离p40可以竞争IL-12p70与IL-12受体的结合位点,从而抑制IL-12的活性。由于 人IL-12的分子的特殊性和复杂性,用原核表达系统或酵母系统进行表达时,其产品无生物学活性,通常采用昆虫或哺乳动物细胞进行表达。本课题组采用中国仓鼠卵巢细胞(CHO)表达人IL-12(见专利ZL03131567.4)。重组人IL-12的纯化工艺是人IL-12工业生产的重要环节,国内外多个研究组或公司均有相关专利或文献报道,例如在本研究组已公开的专利申请200410080518.7(纯化重组人白细胞介素12的方法田志刚等2004年)中采用了超滤、阴离子、阳离子、疏水、分子筛的五步工艺法进行纯化。在国内专利CN101033254(一种纯化重组人白细胞介素12的方法浦勤等2007年)中采用了超滤、阴离子/阳离子、硫胺沉淀、阳离子/阴离子、疏水、分子筛的六步工艺法进行纯化,这两种方法相对繁琐,步骤较多。虽然国内专利ZL01133658.7(人白细胞介素-12在银纹夜蛾中的表达及其纯化的方法孟小林等2004年)中采用亲和法纯化人IL-12,但是该过程为亲和层析一步法纯化,无样品预处理,容易污染亲和柱,而且无人IL-12聚体去除过程。此外,由于重组人IL-12纯化的困难性,目前生物公司所提供的商业重组人IL-12产品,售价往往很高,非常不利于涉及人IL-12的研究及其大规模药用生产的开展。本发明中采用抗人IL-12的杂交瘤细胞株制备单克隆抗体,并用该抗体制备重组人IL-12亲和纯化层析柱,然后用该亲和纯化层析柱纯化重组人IL-12的工艺流程。该流程只需4步即可得到纯度超过95%的rhIL-12样品,可以大大缩短工作流程及时间,并提高回收率和产物的纯度。
技术实现要素:
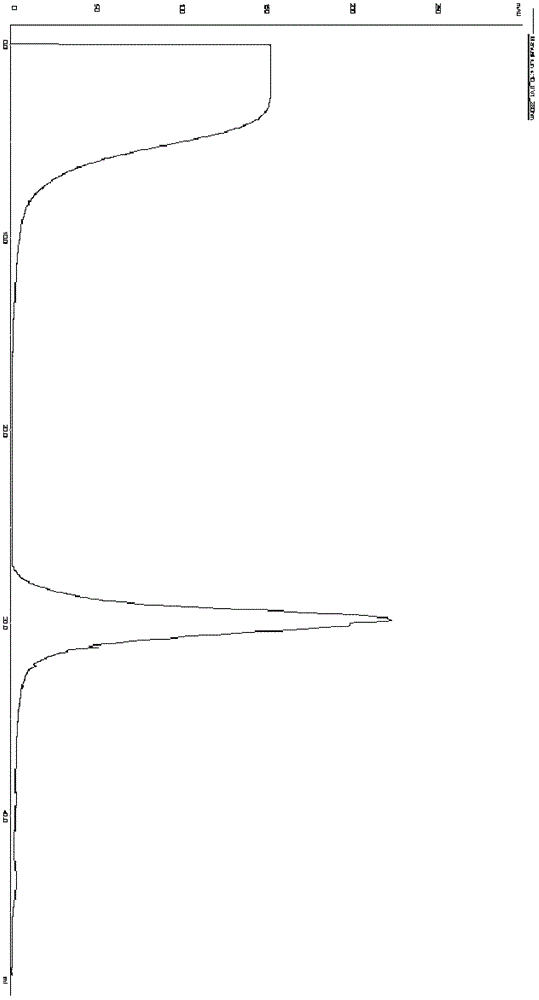
为了克服现有技术的缺点,本发明提供一种制备重组人IL-12亲和纯化层析柱的工艺,以及由该工艺制得的重组人IL-12亲和纯化层析柱。具体地说,本发明涉及用抗人IL-12的杂交瘤细胞株制备单克隆抗体,并用该抗体制备重组人IL-12亲和纯化层析柱。本发明还涉及利用该亲和纯化层析柱纯化重组人IL-12的方法。在本发明的一个实施方案中,本发明涉及一种采用亲和层析柱纯化重 组人IL-12的方法,其特征在于用抗人IL-12单克隆抗体的杂交瘤细胞株制备抗体,用该抗体制备人IL-12亲和纯化层析柱,然后以该亲和纯化层析柱为基础进行纯化重组人IL-12的方法。本发明的一个目的是提供利用人IL-12亲和层析柱纯化重组的人IL-12的方法。具体地,所述方法包括超滤、阴离子交换层析、亲和层析和分子筛四个纯化步骤:a.超滤:获得含重组人IL-12(rhIL-12)的培养上清,选用10-30kD的超滤膜,将上清液超滤浓缩约10-15倍,0.22-0.45μm滤膜过滤除去不溶性微粒;b.阴离子交换层析:采用阴离子交换层析柱,20mMTris-HCl平衡液平衡,40mM组氨酸缓冲液洗脱杂蛋白,0.25MNaCl20mMTris-HCl洗脱目的蛋白;c.亲和层析:采用按照本发明的工艺制得的人IL-12亲和层析柱(这构成本发明的另一个方面,见下)纯化rhIL-12,用20mMTris-HCl平衡液平衡,用20mMGly-HCl缓冲液洗脱,用1MTris将洗脱蛋白的pH调为7.0左右;d.分子筛:利用分子筛去除聚体蛋白,得到纯化的重组人IL-12单体。本领域技术人员应该理解,其中,获得含重组人IL-12(rhIL-12)的培养上清可以通过按国内专利ZL03131567.4中公开的培养方法培养表达重组人IL-12的CHO细胞而获得。在ZL03131567.4中,发明人构建分别表达人IL-12的p40亚单位和p35亚单位的真核表达载体pcDNA3/p40和pEF13/p35,共转染CHO细胞,利用G418和甲硫氨酸亚砜筛选获得高表达重组人IL-12的工程细胞株。所述方法简单的利用人IL-12P40和P35天然表达不平衡的特性,采用两种表达效率不同的载体,以使两条链的表达尽量平衡。该专利的内容通过引用完全结合在本申请中。当然,本发明对如何获得包含重组人IL-12(rhIL-12)的培养上清没有任何限制,只要所述培养上清中包含有活性的重组人IL-12即可用于本发明的纯化方法。本领域技术人员应该理解,所述阴离子交换层析柱包括,但不限于,Sepharose,Capto,Sephadex,Sephacel等为骨架,Q,QAE,DEAE为活性基团的凝胶,例如:Q-SepharoseFF,CaptoQ,Q-SepharoseHP,CaptoDEAE,QAESephadex,DEAE-SepharoseFF,DEAESephadex等;可用的分子筛包括,但不限于,Sephacryl,Superdex,Sephadex,Superose,Sepharose等为骨架的凝胶,例如:SephacrylS-200HR,Superdex200,SephadexG-100等。另外,本领域技术人员还应该理解,本发明提供的利用重组人IL-12亲和层析柱纯化重组的人IL-12的方法所包含的超滤、阴离子交换层析、亲和层析和分子筛四个纯化步骤之间的顺序不是固定不变的,本领域技术人员可以根据实际需要进行适当的调整,例如,可以在进行超滤步骤之后,进行亲和层析,然后再进行阴离子交换层析,等等。本发明的再一个目的是提供利用抗人IL-12的单克隆抗体制备亲和纯化层析柱的方法,所述方法包括下述步骤:a.活化凝胶预处理:取适量的活化凝胶(例如,CNBr或NHS活化的琼脂糖凝胶,购自GE公司),用1mMHCl进行完全溶解,并用1mMHCl冲洗胶体,然后再用0.1MNaHCO3,冲洗胶体;b.抗rhIL-12抗体的偶联及亲和层析柱的制备:通过超滤浓缩的方法将按本发明下文提供的方法制备的或购买的抗rhIL-12抗体浓缩至4-5mg/ml,然后将抗rhIL-12抗体加入活化凝胶中,置4℃过夜,然后用0.1MNaHCO3冲洗胶体,用0.1MTris-HCl缓冲液封闭未结合的活性基团,然后用0.1MTris-HCl缓冲液和0.1M醋酸-醋酸钠缓冲液交替冲洗胶体,最后将共价结合抗rhIL-12抗体的凝胶装柱,制备成纯化rhIL-12的亲和层析柱。其中,步骤a中的活化凝胶可以为CNBr(溴化氰)、NHS(N-羟基硫 代琥珀酰亚胺)、Epoxy(环氧树脂)等活化的Sepharose为骨架的凝胶,例如:CNBr-activatedSepharose4FF、NHS-activatedSepharose4FF、CNBr活化的Sepharose4B、Epoxy-activatedSepharose6B、ActivatedCHSepharose4B、EAHSepharose4B、ECHSepharose4B、ThiopropylSepharose6B等。本发明的又一个目的是提供利用人IL-12杂交瘤制备抗人IL-12单克隆抗体的方法。通常,从产生抗人IL-12抗体的杂交瘤细胞(例如,ATCCCRL-2382,克隆号为20C2,购自美国典型培养物保藏中心(ATCC))收集本发明的抗人IL-12单克隆抗体时,可以从杂交瘤细胞培养上清中获得抗体,具体来说,细胞传代培养3-5天后收培养上清,上清中含有一定浓度的单克隆抗体。或者将杂交瘤细胞注射到不完全弗氏佐剂预先处理的小鼠腹腔,通过抽取小鼠腹水中获得单克隆抗体。通常,杂交瘤都采用BALB/c小鼠作为免疫动物进行抗体生产,常规做法为石蜡或降脂烷腹腔注射1周后,再腹腔注射1-2×106杂交瘤细胞,7-10天左右产生腹水。但是克隆号为20C2的杂交瘤用常规的石蜡预先处理无腹水产生。虽然用不完全弗氏佐剂预先处理可以在10-14天左右产生腹水,但是其效价比裸鼠低至少100倍(图1)。因此,本发明提供利用人IL-12杂交瘤制备抗人IL-12单克隆抗体的方法,所述方法包括下述步骤:用不完全弗氏佐剂处理8-10周龄的裸鼠,每只小鼠腹腔注射500μl不完全弗氏佐剂;3天之后腹腔注射杂交瘤细胞,每只小鼠1×106细胞;7-10天左右产生腹水,收集小鼠腹水,离心收上清即腹水抗体。通过上述方法获得的抗人IL-12抗体,可以ProteinG亲和层析方法纯化。有益效果:本发明提供了一种快速高效的rhIL-12的纯化方法,通过采用hIL-12亲和纯化层析柱纯化重组人IL-12的工艺流程,只需4步即可得到纯度超过95%的rhIL-12样品,可以大大缩短工作流程及时间,并提高回收率和产物的纯度,特别适合工业生产。附图说明从下面结合附图的详细描述中,本发明的上述特征和优点将更明显,其中:图1,由BALB/c和裸鼠生成的抗人IL-12抗体的亲和力比较。图2,抗人IL-12抗体的ProteinG纯化图谱。图3,抗人IL-12抗体纯度鉴定结果。图4,阴离子交换柱纯化rhIL-12的结果。图5,利用本发明的人IL-12亲和柱纯化rhIL-12的结果。图6,分子筛纯化rhIL-12结果。具体实施方式以下实施例将有助于本领域的普通技术人员进一步理解本发明,但不以任何形式限制本发明。实施例中的实验方法,如无特别说明,均采用本领域常规技术,实验试剂均为市售分析纯级别产品。实施例1:单克隆抗体的制备1.培养上清或腹水制备:从产生抗人IL-12的杂交瘤细胞(ATCCCRL-2382,购自美国典型培养物保藏中心(ATCC))收集本发明的抗人IL-12单克隆抗体时,可以从杂交瘤细胞培养上清中获得抗体,具体来说,细胞传代培养2-3天后收培养上清,上清中含有一定浓度的单克隆抗体。或者将杂交瘤细胞注射到不完全弗氏佐剂预先处理的小鼠腹腔,通过抽取小鼠腹水中获得单克隆抗体,具体来说,用不完全弗氏佐剂处理8-10周龄的裸鼠,每只小鼠腹腔注射500μl不完全弗氏佐剂。一周之后腹腔注射杂交瘤细胞,每只小鼠1-2×106细胞,7-10天左右产生腹水,收集小鼠腹水,离心收上清,用PBS(pH7.0)稀释3-5倍后用0.45μm滤膜过滤。2.抗人IL-12单克隆抗体的纯化:通过上述方法获得的培养上清/腹水,可以用ProteinG亲和层析方法纯化。用PBS缓冲液平衡ProteinG亲和层析柱,将处理过的腹水或培养上清上样,再用PBS缓冲液平衡ProteinG亲和层析柱,用0.1M柠檬酸洗脱目的抗体,并立即用0.5MNa2CO3的调节目的抗体的pH为7左右,以免蛋白变性。抗体的纯度用SDS-PAGE鉴定。如图2所示,经过纯化的单克隆抗体的纯度达到95%以上,单克隆抗体分子量重链约50kDa,轻链约26kDa。实施例2:人IL-12亲和层析柱的制备1.CNBr活化的Sepharose4B凝胶预处理称取适量CNBr(溴化氰)活化的Sepharose4B凝胶(购自GE公司),慢慢地加入1mMHCl中并且不断的摇匀,待凝胶完全溶解,静置至凝胶沉底,弃去上清,再加入适量的1mMHCl重新悬起凝胶,再静置15min,弃去上清,反复操作5次。然后再用0.1MNaHCO3(pH=8.3),冲洗胶体,每毫升的胶体用至少5ml0.1MNaHCO3(pH=8.3)冲洗。2.抗rhIL-12抗体的偶联及亲和层析柱的制备通过超滤浓缩的方法将按实施例1制备的或从BD公司购买的(货号为555065,克隆号为20C2)抗rhIL-12的抗体浓缩至4-5mg/ml,然后将rhIL-12抗体加入经步骤1处理的凝胶中,测上清蛋白浓度,置4℃过夜。然后用0.1MNaHCO3(pH=8.3)冲洗胶体5次,用0.1MTris-HCl缓冲液(pH=8.0)封闭未结合的活性基团3次,并静置2h。然后用0.1MTris-HCl缓冲液(pH=8.0)和0.1M醋酸-醋酸钠缓冲液(pH=5.0)交替冲洗胶体,至少洗5个循环。将结合rhIL-12抗体的胶体装柱,制备成纯化rhIL-12抗体的亲和层析柱。实施例3:利用实施例2制备的人IL-12亲和层析柱纯化rhIL-12的方法1.超滤:含rhIL-12的培养上清,选用10-30kD的超滤膜(购自Millipore), 将上清液超滤浓缩至约10-15倍,用0.22-0.45μm滤膜(购自Millipore)过滤除去不溶性微粒。2.阴离子交换层析:采用Q-SepharoseFastFlow柱(购自GE公司),20mMTris-HCl平衡液(pH=8.0)平衡,40mM组氨酸缓冲液洗脱杂蛋白,0.25MNaCl20mMTris-HCl(pH=8.0)洗脱目的蛋白。阴离子柱纯化的rhIL-12样品的纯度达20%以上(结果见图4)。3.亲和层析:采用实施例2制备的人IL-12亲和层析柱纯化rhIL-12,用20mMPBS平衡液(pH=7.2)平衡,用20mMGly-HCl缓冲液(pH=2.5)洗脱,用1MTris(pH=9.0)将洗脱蛋白的pH调为7.0左右。纯化的rhIL-12样品的纯度达80%以上(结果见图5)。4.分子排阻层析:利用SephacrylS-200HR(购自GE公司)去除聚体蛋白,最终rhIL-12蛋白纯度超过95%(结果见图6)。本领域技术人员还应该理解,本发明提供的利用重组人IL-12亲和层析柱纯化重组的人IL-12的方法所包含的超滤、阴离子交换层析、亲和层析和分子筛四个纯化步骤之间的顺序不是固定不变的,本领域技术人员可以根据实际需要进行适当的调整,例如,可以在进行超滤步骤之后,先进行亲和层析,然后再进行阴离子交换层析,等等。实施例4:rhIL-12活性测定参考国内专利201010134960.9(一种检测重组人白细胞介素-12蛋白活性的方法,田志刚等),采用IFN-γ诱生法,使用BenderSystems公司生产的HumanIFN-γELISA试剂盒检测IFN-γ的含量。具体检测步骤如下:1.标准品和待检样品的稀释:IL-12标准品(购自NIBSC)用1640完全培养液(购自GIBCO公司)稀释成以下11个稀释度(ng/ml):25.6、12.8、6.4、3.2、1.6、0.8、0.4、0.2、0.1、0.05、0.025,待检样品也稀释成以下11个稀释度(ng/ml):25.6、12.8、6.4、3.2、1.6、0.8、0.4、0.2、0.1、0.05、0.025,备用;2.IFN-γ的诱生:收集37℃,5%CO2培养的处于对数生长期的NKG细胞(CGMCCNo.2901,购自中国微生物菌株保藏委员会普通微生物中心(CGMCC))于50ml无菌离心管中,800rpm,10min,离心,弃上清,PBS溶液洗涤两遍后,悬于含1640完全培养基中,调整细胞浓度为5×105个/ml,按100μl/孔将细胞加入96孔板。向加有细胞的96孔板对应孔中加入100μl不同稀释度的IL-12标准品和待测上清(每个稀释度做双复孔)。37℃,5%CO2培养24小时后,每孔取50μl培养上清ELISA测定IFN-γ含量;3.IFN-γ的测定:参考BenderSystems公司HumanIFN-γELISA试剂盒的说明书,用标准品的浓度和对应的A值作标准曲线,输入待检样品A值直接求出待检样品IFN-γ含量;4.IL-12活性计算:以IFN-γ含量对样品稀释度作曲线,计算各个实验样品的ED50(即IFN-γ含量为最大浓度的一半时的样品浓度),并按下式计算结果:效价=Pr×ED50r/ED50s。Pr:标准品效价,IU/mg;ED50r:标准品ED50;ED50s:待检样品ED50。结果显示,由本发明实施例3的亲和法纯化的rhIL-12其比活性超过5.0×106IU/mg,因此,按此方法纯化的IL-12有较高的活性。应该理解,尽管参考其示例性的实施方案,已经对本发明进行具体地显示和描述,但是本领域的普通技术人员应该理解,在不背离由后附的权利要求所定义的本发明的精神和范围的条件下,可以在其中进行各种形式和细节的变化,可以进行各种实施方案的任意组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1