一种利用NPU基因突变创制光温敏不育系的方法及其应用与流程
本发明属于农业和生物
技术领域:
,尤其涉及一种利用NPU基因突变创制光温敏不育系的方法及其应用。
背景技术:
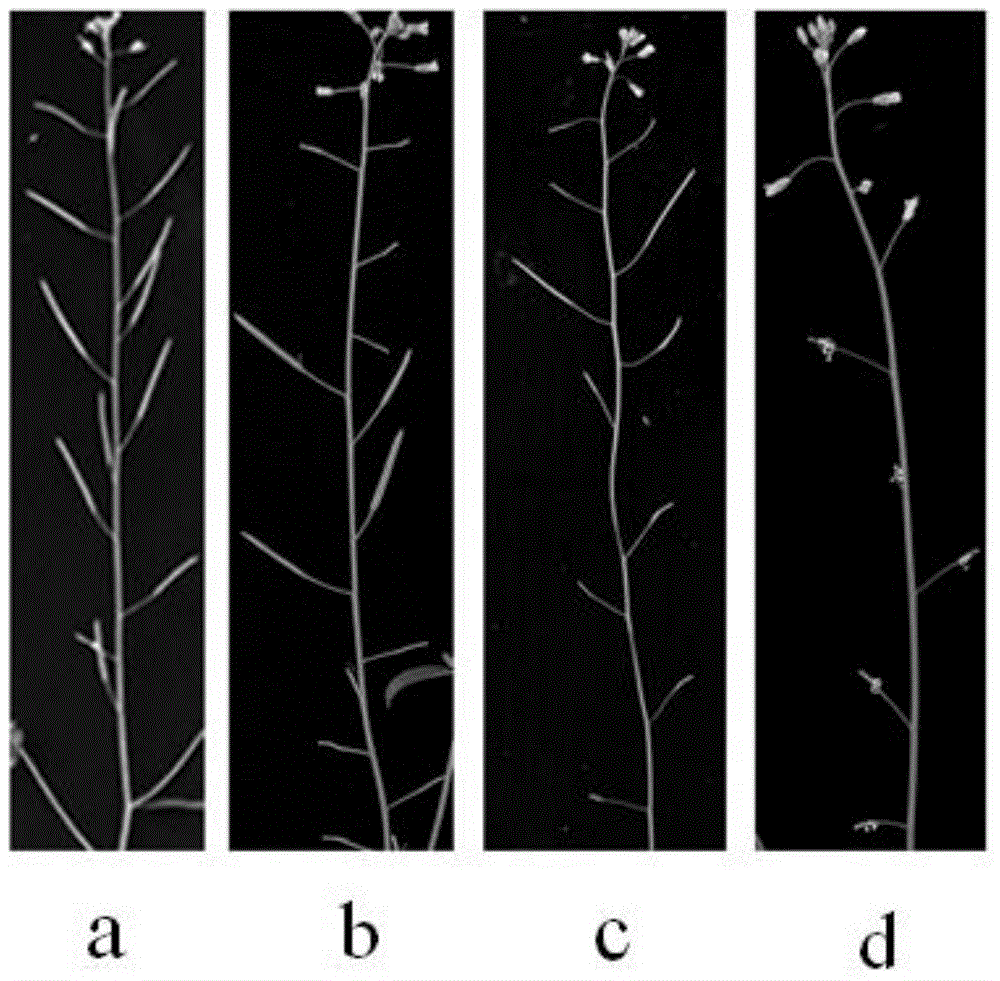
:农业生产中,雄性不育系在杂交制种、提高农业产量中占据巨大优势。雄性不育往往被分为细胞质雄性不育(CMS)和细胞核雄性不育(GMS)两种。三系杂交体系的建立即依赖于细胞质雄性不育。但是,细胞质雄性不育有其自身的缺陷:首先,细胞质雄性不育植株的品质普遍较差;其次,三系杂交水稻的组合增产潜力越来越小;再次,由于野败型的雄性不育细胞质单一,一旦细胞质雄性不育丧失或某种毁灭性病虫害发生,那么就会造成巨大的损失。随着细胞核雄性不育中光温敏条件性雄性不育的发现,两系法杂交水稻应运而生。相对于三系杂交法,光温敏不育系兼有不育系和保持系两种状态。与三系法相比,两系法不受恢保关系的限制,即细胞核不育可以与大量常规品种杂交,配组自由,更容易获得性状优良的杂交优势,从根本上解决三系中雄性不育细胞质单一化的问题。近年来,两系杂交水稻在中国农业生产中的应用越来越广泛。早在1973年石明松在中国湖北从晚粳品种(Oryzasativassp.Japonica)农垦58中选育出光敏感不育系,并提出了一系两用的水稻杂交优势利用新途径。随后,以农垦58S(NK58S)为父本,与籼稻杂交获得的培矮64S(PA64S)也在两系杂交中得到广泛应用,但培矮64S的育性对温度更加敏感。在水稻中,光温敏不育系受单基因隐性位点控制;研究表明,农垦58S与培矮64S的不育性状均受同一个遗传位点的控制,且温度和光照均会对该位点产生影响。至今,共发现十三个水稻光温敏不育系,pms1、pms2、pms3、rpms1、rpms2、tms1、tms2、tms3、tms4、tms5、tms6、rtms1和ms-h,分别定位在第7、3、12、8、9、8、7、6、2、2、5、10和第9条染色体上。研究发现,一个突变的小RNA(smallRNA)osa-smR5864m会导致pms2以及p/tms2-1(农垦58S和培矮64S)突变体的不育表型。拟南芥因为具有较小的基因组、快速的生长周期以及大量的突变体库等无可比拟的优势,而在植物学、生物学领域成为模式植物。此外,拟南芥还能够在严格控制温度、光照等条件的狭小空间中进行培养。研究发现了一些拟南芥条件不育突变体,如PEAMT基因突变体t365以及GA/IAA生物合成受阻的ms33突变体均表现为温敏不育表型。目前,发掘植物雄性不育新种质的常规途径主要包括:对天然雄性不育原始株的发现,人工诱变和连续回交核置换,如我国早期的野败型和马协型水稻雄性不育细胞质是利用天然雄性不育原始株;新疆农科院培育的新海不育系棉花是利用海岛棉的杂种经60COγ射线诱变。然而,传统育种方法筛选和培育理想的可转育的雄性不育系存在诸多困难,如雄性不育系种质资源有限,转育周期过长,杂交不亲和,组合选育局限大等。目前,本领域尚缺乏调控方式简单方便的植物不育系用于植物育种过程,因此需要调控方式简单方便的植物不育系培育技术。技术实现要素:针对本领域存在的技术问题,本发明提供一种利用NPU基因突变创制光温敏不育系的方法及其应用。本发明的第一个方面,在于提供一种培育植物不育系的方法,所述方法包括抑制所述植物植株中与花粉发育相关的NPU蛋白的表达或活性。其中,所述NPU蛋白主要负责初生外壁的沉积。作为本发明的一个优选实施例,所述NPU蛋白做广义理解,可以为NPU蛋白,也可以为其同源蛋白。作为本发明的一个优选实施例,所述植物可以为农作物、林业植物和花卉等;优选地,可以为禾本科、豆科以及十字花科植物,更优选地,可以为拟南芥、水稻、高粱、小麦、大豆或玉米。作为本发明的一个优选实施例,所述NPU蛋白在植物植株花序或花药中的细胞、组织或器官中特异性表达。作为本发明的一个优选实施例,所述细胞或组织包括:绒毡层、小孢子母细胞或其组合。作为本发明的一个优选实施例,所述NPU蛋白在花药发育期特异性表达。作为本发明的一个优选实施例,所述NPU蛋白在花药发育第6、7期特异表达。作为本发明的一个优选实施例,所述花药发育期包括前花药形成阶段(-3-0天)、花药形成阶段和后花药形成阶段(1-5天);其中,0天指花药形成的第1天,-3天为以花药形成当天为起始点,向前推算的第3天,1天、5天分别为以花药形成当天为起始点,向后推算的第1天和第5天。作为本发明的一个优选实施例,所述NPU蛋白的表达在花粉减数分裂期及四分体期达到高峰。作为本发明的一个优选实施例,所述NPU蛋白为在植物植株中特异存在的一类蛋白质,适用于本发明所述的“与花粉发育相关的NPU蛋白”没有特别限制,可以来自任何植物品种,代表性的植物包括,但并不限于:水稻(基因号:Os05G0168400,与拟南芥直系同源NPU蛋白的同源性为85%)、高粱(基因号:Sb09G005000,与拟南芥直系同源NPU蛋白的同源性为84%)、小麦(基因号:TRIUR312622,与拟南芥直系同源NPU蛋白的同源性为82%)、大豆(基因号:Glyma.18G215000,与拟南芥直系同源NPU蛋白的同源性为82%)、玉米(基因号:GRMZM2G063754,与拟南芥直系同源NPU蛋白的同源性为86%)。作为本发明的一个优选实施例,所述NPU蛋白的野生型氨基酸序列选自:SEQIDNO.1、SEQIDNO.2、SEQIDNO.3、SEQIDNO.4、SEQIDNO.5、SEQIDNO.6。作为本发明的一个优选实施例,可以通过以下任意一种方式抑制所述植物植株中与花粉发育相关的NPU蛋白的表达或活性:1)编码所述NPU蛋白的多核苷酸部分或完全缺失;2)修饰表达调控序列以降低或抑制编码所述NPU蛋白的多核苷酸的表达;3)修饰染色体上的多核苷酸序列以降低蛋白的活性;或4)上述1)-3)中的任意组合。其中,所述的“编码NPU蛋白的多核苷酸部分或完全缺失”是利用染色体基因插入的载体将编码内源性靶蛋白的多核苷酸替换为标记基因或部分核苷酸序列缺失的多核苷酸。“部分”缺失的长度根据多核苷酸的种类而有所不同,可以为1-300bp,优选为1-100bp,更优选为1-5bp,其中bp为碱基对。作为本发明的一个优选实施例,所述的“修饰表达调控序列以降低或抑制该多核苷酸的表达或活性”可以通过以下任意一种方式实现:1)通过核苷酸序列的缺失、插入、保守、非保守性取代以及它们的组合,在表达调控序列中诱导突变,以进一步降低表达调控序列的活性;或2)将表达调控序列替换成活性更低的序列。作为本发明的一个优选实施例,所述的表达调控序列包括编码启动子序列、操纵子序列、核糖体结合位点和控制转录与翻译终止的序列中的一种或几种。作为本发明的一个优选实施例,所述“修饰染色体上的多核苷酸序列以降低蛋白的活性”可以通过以下任意一种方式实现:1)通过核苷酸序列的缺失、插入、保守或非保守性取代或它们的组合在序列中诱导突变以进一步降低该序列的活性;或2)将多核苷酸序列替换成经修饰的多核苷酸序列以便获得更弱的蛋白活性。作为本发明的一个优选实施例,所述“抑制所述植物植株中与花粉发育相关的NPU蛋白表达或活性”通过以下任意一种方式实现:1)抑制所述植物植株中NPU基因的表达水平;2)缺失所述植物植株中NPU基因;3)致所述植物植株中NPU基因突变;或4)上述1)-3)的任意组合。作为本发明的一个优选实施例,所述“抑制所述植物植株中与花粉发育相关的NPU蛋白的表达或活性”的方法包括:抑制编码所述NPU蛋白的基因的表达。作为本发明的一个优选实施例,所述“抑制所述植物植株中与花粉发育相关的NPU蛋白的表达或活性”是通过基因突变、基因敲除、基因中断、RNA干扰中的一种或几种的结合实现的。作为本发明的一个优选实施例,编码所述NPU蛋白的基因为NPU基因或其同源基因。作为本发明的一个优选实施例,所述NPU基因能够编码SEQIDNO.1、SEQIDNO.2、SEQIDNO.3、SEQIDNO.4、SEQIDNO.5、SEQIDNO.6所示的氨基酸序列。其中,编码所述NPU蛋白的多核苷酸序列选自:SEQIDNO.7、SEQIDNO.8、SEQIDNO.9、SEQIDNO.10、SEQIDNO.11和SEQIDNO.12。其中,编码SEQIDNO.1的多核苷酸序列为SEQIDNO.7。其中,编码SEQIDNO.2的多核苷酸序列为SEQIDNO.8。其中,编码SEQIDNO.3的多核苷酸序列为SEQIDNO.9。其中,编码SEQIDNO.4的多核苷酸序列为SEQIDNO.10。其中,编码SEQIDNO.5的多核苷酸序列为SEQIDNO.11。其中,编码SEQIDNO.6的多核苷酸序列为SEQIDNO.12。本发明的第二个方面,在于提供一种编码与花粉发育相关的NPU蛋白基因的应用,用于培育植物不育系或制备培育植物不育系的试剂或试剂盒。作为本发明的一个优选实施例,所述的编码NPU蛋白的基因为NPU基因或其同源基因。作为本发明的一个优选实施例,所述植物不育系为与花粉发育相关的NPU蛋白的表达或活性被抑制的植物不育系。作为本发明的一个优选实施例,所述NPU基因能够编码SEQIDNO.1、SEQIDNO.2、SEQIDNO.3、SEQIDNO.4、SEQIDNO.5、SEQIDNO.6所示氨基酸序列。其中,编码所述NPU蛋白的多核苷酸序列选自:SEQIDNO.7、SEQIDNO.8、SEQIDNO.9、SEQIDNO.10、SEQIDNO.11和SEQIDNO.12。其中,编码SEQIDNO.1的多核苷酸序列为SEQIDNO.7。其中,编码SEQIDNO.2的多核苷酸序列为SEQIDNO.8。其中,编码SEQIDNO.3的多核苷酸序列为SEQIDNO.9。其中,编码SEQIDNO.4的多核苷酸序列为SEQIDNO.10。其中,编码SEQIDNO.5的多核苷酸序列为SEQIDNO.11。其中,编码SEQIDNO.6的多核苷酸序列为SEQIDNO.12。本发明的第三个方面,在于提供一种将植物从不育转为可育的方法,包括:步骤1、抑制花粉的初生外壁的沉积;步骤2、降低植株代谢水平,从而恢复初生外壁的沉积;其中,所述植物是与花粉发育相关的NPU蛋白表达或活性被抑制的植物;步骤1中所述“抑制花粉的初生外壁的沉积”是通过抑制与所述植物植株中与花粉发育相关的NPU蛋白的表达实现的。作为本发明的一个优选实施例,所述植物为根据本发明第一个方面所述的方法培育的植物不育系。作为本发明的一个优选实施例,所述降低植株代谢水平是通过降低植株生长的环境温度、减少植株的光照时间中的一种或两种方法的组合实现的。作为本发明的一个优选实施例,所述降低植株生长的环境温度包括将环境温度控制在18-22℃,优选为18-20℃,如19℃等。作为本发明的一个优选实施例,所述降低植株生长的环境温度可以在花药形成阶段,花粉成熟阶段以及开花授粉阶段或其前后2周进行。作为本发明的一个优选实施例,所述降低植株的生长温度为在植株抽薹或抽穗时开始低温培育3-10天,然后恢复至正常温度培育。本发明的第四个方面,在于提供一种植物育种方法,包括如下步骤:步骤1、维持植株不育;步骤2、将植株由不育转为可育;步骤3、维持植株可育并育种。作为本发明的一个优选实施例,步骤1中所述的植株是根据本发明第一个方面所述的方法培育的植物不育系的植株。作为本发明的一个优选实施例,步骤2中所述的将植株由不育转为可育的方法为本发明第三个方面所述的将植物由不育转为可育的方法。本发明的第五个方面,在于提供一种植物细胞,由所述植物细胞发育成的植株中与花粉发育相关的NPU蛋白的表达或活性被抑制。作为本发明的一个优选实施例,所述NPU蛋白做广义理解,可以为NPU蛋白,也可以为其同源蛋白。作为本发明的一个优选实施例,所述植物可以为农作物、林业植物和花卉等;优选地,可以为禾本科、豆科以及十字花科植物,更优选地,可以为拟南芥、水稻、高粱、小麦、大豆或玉米。其中,本发明涉及的概念解释如下:术语“NPU蛋白”、“NPU多肽”指具有NPU蛋白氨基酸序列(如SEQIDNO.1-6)的蛋白或多肽,在未特别指出时,术语“NPU蛋白”包括野生型NPU蛋白和突变型NPU蛋白。本发明所述的NPU蛋白包含但并不仅限于SEQIDNO.1-6所示氨基酸序列,根据植物种类或品种,该蛋白的氨基酸序列可能有所不同。换言之,所述NPU蛋白可以是突变型蛋白及其人工变体,只要有助于通过降低NPU蛋白的活性而培育植物不育系,所述突变型蛋白及其人工变体的氨基酸序列在SEQIDNO.1-6所示氨基酸序列的一个或多个位置包含一个或多个氨基酸的取代、缺失、插入、添加或倒置。本发明所述的“多个”,根据蛋白质中氨基酸残基三维结构的位置或类型而有所不同,优选为2-20个,更优选为2-10个,更优选为2-5个。此外,根据植物的个体或种类,氨基酸的取代、缺失、插入、添加或倒置包括人工变体或天然突变所致的氨基酸的取代、缺失、插入、添加或倒置。本发明所述的“分离的”是指物质从其原始环境中分离出来,如果是天然的物质,则其原始环境即为自然环境,例如,活体细胞内天然状态下的多聚核苷酸和多肽是没有分离纯化的,而如果从天然状态中,将同样的多聚核苷酸或多肽与其他物质分开,则为分离纯化的。本发明所述的“分离的NPU蛋白或多肽”是指NPU蛋白基本上不含与其相关的其它蛋白、脂类、糖类或其它物质。本领域技术人员能够采用标准的蛋白质纯化技术纯化水稻等植物中的NPU蛋白。基本上,纯的多肽在非还原聚丙烯酰胺凝胶上能产生单一的主带。本发明所述的“多肽”可以是重组多肽、天然多肽或合成多肽等,优选为重组多肽。本发明所述的多肽可以是天然纯化的产物,也可以是化学合成的产物,或使用重组技术从原核或真核宿主(如细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生;根据重组技术使用的宿主,所述的多肽可以是糖基化或非糖基化多肽;本发明所述多肽还可以包括起始的甲硫氨酸残基。本发明所述的NPU蛋白还包括NPU蛋白的片段、衍生物及其类似物。本发明中,术语“片段”、“衍生物”和“类似物”是指能保持与本发明所述NPU蛋白相同的生物学功能或活性的多肽。本发明所述的多肽片段、衍生物或类似物可以是:(1)有一个或多个保守或非保守性氨基酸残基被取代的多肽,并优选为保守性氨基酸残基被取代的多肽,其中,被取代的氨基酸残基可以由遗传密码编码;(2)在一个或多个氨基酸残基中具有取代基团的多肽;(3)成熟多肽与另一个化合物,如延长多肽半衰期的化合物,例如聚乙二醇,融合所形成的多肽;(4)附加的氨基酸序列融合到此多肽序列而形成的多肽,如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列或融合蛋白。本发明所述的片段、衍生物和类似物属于本领域熟练技术人员公知的范围。在本发明的优选地实施方式中,“NPU蛋白””或“NPU多肽”序列如SEQIDNO.1-6所示,在本发明的优选地实施方式中,“NPU蛋白””或“NPU多肽”还包括与NPU蛋白功能相同的、SEQIDNO.1-6序列的变异形式,这些变异形式包括但并不限于一个或多个,通常为1-50个,优选为1-30个,更优选为1-20个,更优选为1-10个,氨基酸的缺失、插入和/或取代,以及在碳末端和/或氮末端添加1个或数个氨基酸,通常为20个以内,优选为10个以内,更优选为5个以内。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。在碳末端和/或氮末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。在本发明的优选地实施方式中,“NPU蛋白””或“NPU多肽”还包括NPU蛋白或多肽的活性片段和活性衍生物。其中,所述NPU多肽的变异形式包括:同源序列、保守性变异体、等位变异体、天然突变体、诱导突变体、在高或低的严谨度的条件下能与NPU蛋白DNA杂交的DNA所编码的蛋白。本发明还提供了其他多肽,如包含NPU蛋白或其片段的融合蛋白。除了几乎全长的多肽外,本发明还包括了NPU蛋白的可溶性片段。通常,所述片段具有NPU蛋白序列的至少约10个连续氨基酸,通常具有至少约30个连续氨基酸,优选地,具有至少约50个连续氨基酸,更优选地,具有至少约80个连续氨基酸,最优选地,具有至少约100个连续氨基酸。本发明中所述修饰通常不改变一级结构,所述修饰形式主要包括:体内或体外的多肽的化学衍生形式如乙酰化或羧基化;还包括糖基化。修饰形式还包括具有磷酸化氨基酸残基的序列,如磷酸酪氨酸、磷酸丝氨酸、磷酸苏氨酸;还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的多肽。在本发明中,“NPU保守性变异多肽”指与SEQIDNO.1-6所示的氨基酸序列相比,有至多10个,优选为至多8个,更优选为至多5个,最优选为至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表1进行氨基酸替换而产生。表1最初的残基代表性取代优选取代Ala(A)Val,Leu,IleValArg(R)Lys,Gln,AsnLysAsn(N)Gln,His,Lys,ArgGlnAsp(D)GluGluCys(C)SerSerGln(Q)AsnAsnGlu(E)AspAspGly(G)Pro,AlaAlaHis(H)Asn,Gln,Lys,ArgArgIle(I)Leu,Val,Met,Ala,PheLeuLeu(L)Ile,Val,Met,Ala,PheIleLys(K)Arg,Gln,AsnArgMet(M)Leu,Phe,IleLeuPhe(F)Leu,Val,Ile,Ala,TyrLeuPro(P)AlaAlaSer(S)ThrThrThr(T)SerSerTrp(W)Tyr,PheTyrTyr(Y)Trp,Phe,Thr,SerPheVal(V)Ile,Leu,Met,Phe,AlaLeu其中,所述代表性取代是指本发明能够取代最初的残基的碱基,所述优选取代是本发明最优选的能够取代最初的残基的碱基。本发明所述的多核苷酸可以是DNA形式或RNA形式。其中,DNA形式包括cDNA、基因组DNA或人工合成的DNA;DNA可以是单链的或是双链的;DNA可以是编码链的,也可以是非编码链的;编码成熟多肽的编码区序列可以与SEQIDNO.7-12所示的编码区序列相同或者是简并的变异体。在本发明中,“简并的变异体”在本发明中是指编码具有SEQIDNO.1-6的蛋白质,但与SEQIDNO.7-12所示的编码区序列有差别的核酸序列。编码SEQIDNO.1-6的成熟多肽的多核苷酸为以下任意一种或其任意组合:(1)只编码成熟多肽的编码序列;(2)成熟多肽的编码序列和各种附加编码序列;(3)成熟多肽的编码序列和任选的附加编码序列以及非编码序列。作为本发明的一个优选实施例,所述的NPU多肽的编码序列选自以下任意一种或其任意组合:(1)编码如SEQIDNO.1-6所述多肽的多核苷酸序列;(2)如SEQIDNO.7-12所示的多核苷酸序列;(3)与(1)或(2)所述的多核苷酸序列互补的多核苷酸。在本发明中,“编码多肽的多核苷酸”可以是包括编码该多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。本发明还涉及所述多核苷酸的变异体,所述编码与本发明有相同的氨基酸序列的多肽或多肽的片段、类似物和衍生物;所述多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体,如本领域所知的,等位变异体是一个多核苷酸的替换形式,可以是一个或多个核苷酸的取代、缺失或插入,但不会从本质上改变其编码的多肽的功能。作为本发明的一个优选实施例,本发明还涉及与上述的序列杂交,且两个序列之间具有至少50%,优选为至少70%,更优选为至少80%相同性的多核苷酸。本发明还涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2×SSC,0.1%SDS,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%菲可400,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与SEQIDNO.1-6所示的成熟多肽有相同的生物学功能和活性。本发明还涉及与上述的序列杂交的核酸片段,所述“核酸片段”的长度至少含15个核苷酸,优选为至少含30个核苷酸,更优选为至少含50个核苷酸,最优选为至少含100个核苷酸。所述核酸片段可用于核酸的扩增技术,如PCR,以确定和/或分离编码NPU蛋白的多聚核苷酸。本发明所述的NPU蛋白核苷酸全长序列或其片段通常可以用PCR扩增法、重组法或人工合成法获得。PCR扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cDNA库或按本领域技术人员已知的常规方法所制备的cDNA库作为模板,扩增得到有关序列。当序列较长时,常常需要进行两次或多次PCR扩增,然后再将各次扩增出的片段按正确次序拼接在一起。重组法是将序列克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。人工合成法尤其适用于片段长度较短时,通常,先合成多个小片段,然后再进行连接可获得序列很长的片段。本发明也涉及包含所述多核苷酸的载体以及用所述载体或NPU蛋白编码序列经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽的方法。通过常规的重组DNA技术(Science,1984;224:1431),利用本发明的多聚核苷酸序列表达或生产重组的水稻NPU蛋白。一般来说包含以下步骤:(1)用本发明编码NPU蛋白的多核苷酸或变异体,或用含有编码所述NPU的多核苷酸的重组表达载体转化或转导合适的宿主细胞;(2)在合适的培养基中培养宿主细胞;(3)从培养基或细胞中分离、纯化蛋白质。在本发明中,编码所述NPU蛋白的多核苷酸序列可插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒或其他载体。总之,所述重组表达载体为能在宿主体内复制和稳定的任何质粒和载体。所述表达载体的一个重要特征是:通常含有复制起点、启动子、标记基因和翻译控制元件。本领域技术人员熟知的方法能用于构建含编码NPU蛋白的DNA序列和合适的转录/翻译控制信号的表达载体,所述的本领域技术人员熟知的方法包括体外重组DNA技术、DNA合成技术以及体内重组DNA技术等,所述的DNA序列可有效连接到表达载体中的适当启动子上,以指导mRNA合成。作为本发明的一个优选实施例,所述表达载体还包括翻译起始用的核糖体结合位点和转录终止子,优选地,包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(GFP),或用于大肠杆菌的四环素或氨苄青霉素抗性。作为本发明的一个优选实施例,包含上述的适当DNA序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。所述宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如植物细胞。代表性例子有:大肠杆菌,链霉菌属、农杆菌等。本发明的多核苷酸在高等真核细胞中表达时,在载体中插入增强子序列时将会使转录得到增强。增强子是DNA的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。本领域技术人员清楚如何选择适当的载体、启动子、增强子和宿主细胞。重组DNA转化宿主细胞可采用本领域技术人员熟知的常规技术。当宿主为原核生物如大肠杆菌时,能吸收DNA的感受态细胞可在指数生长期后收获,用CaCl2法处理,采用本领域熟知的方法。另一种方法是使用MgCl2,转化也可用电穿孔的方法进行。当宿主细胞是真核生物时,可选用如下的DNA转染方法:磷酸钙共沉淀法,常规机械法,如显微注射、电穿孔、脂质体包装等。作为本发明的一个优选方案,所述转化植物可以使用农杆菌转化或基因枪转化等方法,例如叶盘法。对于转化的植物细胞、组织或器官可以用常规方法再生成植株,从而获得耐受性改变的植物。获得的转化子可以采用常规方法培养,表达本发明的基因所编码的多肽。根据所使用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,采用合适的方法,如温度转换法或化学诱导法,诱导选择的启动子,将细胞再培养一段时间。本发明的多核苷酸的一部分或全部可作为探针固定在微阵列(microarray)或DNA芯片,又称为“基因芯片”上,用于分析组织中基因的差异表达分析。用NPU蛋白特异的引物进行RNA-聚合酶链反应(RT-PCR)体外扩增也可检测NPU蛋白的转录产物。本发明的主要优点在于:首次发现了对于某些特定的植物不育系,通过调控植株中与花粉发育相关的NPU蛋白的表达或活性,来调控所述植株的育性,实现不育与可育之间的可控转换。此外,还开发了植物不育系在农业育种等方面的应用,大大简化了植物不育系育种方法。附图说明图1-1为雄性不育NPU突变体的低温可育性a为Col植株的正常可育表型,b、c、d分别为NPU植株在18℃、21℃及24℃放置培养时的表型图1-2为植株的亚历山大染色和及其扫描电镜图a为野生型植株及其扫描电镜图,b、c分别为18℃及24℃的NPU植株的亚历山大染色和扫描电镜图图1-3为不同温度下NPU突变体的果荚长度图1-4为不同温度下NPU突变体的果荚数量图2为NPU突变体在不同温度下的透射电镜图a为野生型常温下的透射电镜图;b为突变体常温下的透射电镜图;c为突变体18℃时的透射电镜图图3为光照对NPU突变体育性恢复的影响a为正常光照培养;b为短光照培养图4为NPU蛋白质的同源性及功能保守性分析图4-1为NPU蛋白在几种作物中的直系同源蛋白序列同源性分析。图4-2为水稻NPU互补拟南芥NPU突变体植株的构建图图4-3为水稻NPU互补拟南芥NPU突变体的互补结果植株图具体实施方式下面结合具体实施例,进一步阐述本发明。应当理解的是,这些实施例仅用于解释本发明而不用于限定本发明的保护范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等,分子克隆:实验室手册(NewYork:ColdSpringHarborLaboratoryPress,1989)或植物分子生物学-实验手册(PlantMolecularBiology-ALaboratoryMannual,MelodyS.Clark,Springer-verlagBerlinHeidelberg,1997)中所述的条件,或按照制造厂商所建议的条件。除非特别说明,涉及的百分比和份数均为质量百分比和质量份数。材料与方法植物材料与种植本发明中拟南芥材料为Landsbergerecta生态型。4℃,种子预萌发于0.1%琼脂糖培养基上72h。植物材料培养于蛭石中,培养条件为:室温24℃,光培养16h/暗培养8h(正常条件),直至抽薹。之后将抽薹株转移至不同培养条件下培养。低温培养:18℃或21℃,光照培养箱;正常光照:24℃,光培养16h/暗培养8h;短光照:24℃,光培养8h/暗培养16h;然后进行后续处理。细胞学分析采用尼康数码相机(D-7000)拍摄植物材料。亚历山大染色与DAPI染色可参考Alex&Er,1969;Rossetal.,1996。对于半薄切片,选取花苞不同发育阶段进行固定并包埋于Spurr环氧树脂中。使用PowertomeXL(RMCProducts,Tucson,Arizona,USA)切片机进行每1μm切片,并用甲苯胺蓝进行染色。使用OlympusDX51数码相机(Olympus,Japan)进行花药切片的拍摄。将8nm金颗粒包裹新鲜雄蕊和花粉粒材料进行扫描电镜实验,并利用JSM-840显微镜(JEOL,Japan)观察。对于透射电镜实验,将拟南芥花絮冰上固定于固定液中,固定液的配方为:含有2.5%戊二醛的0.1M磷酸缓冲液,pH值=7.2。花苞材料进一步依次包埋至树脂中(HardPlus’EmbeddingResin,UniteKingdom)。超薄切片(50–70nm)则利用JEM-1230透射电子显微镜(JEOL,Japan)进行观察。同源性分析所有NPU同源序列在NCBI中通过BLASTP获得,利用CLUSTALX进行序列比对,并采用GENEDOC进行序列排版。载体构建利用PCR扩增获得拟南芥NPU启动子及水稻NPU编码框序列。PCR聚合酶采用TOYOBO的KODPlus进行扩增,并利用Takara的限制性内切酶进行双酶切。并利用Takara的DNA连接酶进行连接。NPU突变体的不育表型在低温条件下得以恢复利用T-DNA插入及EMS化学诱变的方式从拟南芥Col和Ler生态型中分离得到NPU-1,NPU-2(Col生态型)和NPU-3(Ler生态型)突变体。如图1-1所示,常温下(24℃),纯合的NPU突变体植株生长正常,但育性丧失,只有短小无种子的果荚。遗传分析表明,NPU突变体属于孢子体雄性不育,受到单基因隐性位点控制。本发明将NPU突变体在24℃培养至抽薹,然后将其移入18℃连续培养,其后续的果荚皆恢复育性。在同样低温条件下,野生型植株未受到影响。亚历山大染色显示:常温下,野生型植株的花粉被染成紫红色(图1-2,a),而NPU突变体植株的花药中没有花粉粒(图1-2,b);低温条件下,NPU突变体植株出现花粉粒,且能被染成紫红色,与野生型相似(图1-2,c)。扫描电镜观察发现,低温下NPU突变体植株的花粉粒表面花粉壁的结构恢复如野生型一样的网格状结构。本发明还统计了不同温度下果荚的长度和可育果荚的数量。结果表明,温度升高,果荚长度变短(图1-3),可育果荚的数量减少(图1-3),NPU蛋白被破坏的程度增强,NPU突变体植株的育性恢复程度变差(图1-4)。综上所述,NPU突变体是低温可以恢复育性的雄性不育突变体,且在低温下,NPU突变体植株的花粉发育可以恢复正常。低温弥补NPU突变体释放的小孢子发育缺陷为了确定NPU突变体在花粉发育中的缺陷,本发明进行了透射电镜观察,,结果如图2所示,其中a为野生型植株常温培育的透射电镜图;b为突变体植株常温培育的透射电镜图;c为突变体植株18℃培育的透射电镜图。常温条件下(24℃),野生型植株四分体时期,小孢子表面有初生外壁形成,在此时期,花粉外壁的原料物质孢粉素堆积在波浪形的顶端,最后这些孢粉素物质有规律的沉积在小孢子的表面,形成T字型的花粉外壁结构。NPU突变体植株在四分体时期没有初生外壁的沉积,孢粉素随意堆叠在小孢子的表面。最后NPU突变体植株的花粉壁上观察不到有规律的T字形结构,球状的孢粉素随意堆叠在小孢子外部,导致小孢子缺少保护而破裂。低温下的NPU突变体植株在四分体时期的小孢子表面无明显的波浪形结构,但是可以观察到初生外壁物质沉积在小孢子表面,孢粉素物质也逐渐有规律地沉积在小孢子的表面,最后形成类似于T字形的花粉外壁,且花粉可以正常发育。结果表明,低温使得NPU突变体的初生外壁沉积缺陷得以恢复,使得花粉发育恢复正常。短光照部分恢复NPU突变体的育性本发明将NPU突变体短光照(8h光照/16h黑暗),将其与正常光照(16h光照/8h黑暗)培养时间的NPU突变体进行比较。结果发现短光照下的NPU植株的育性要略好于正常光照条件下的突变体(如图3所示),结果说明短光照能够使NPU恢复育性。NPU蛋白具有保守的序列及功能NPU蛋白是植物特有的、功能未知的蛋白质,在拟南芥中没有与其同源的蛋白质。研究发现NPU蛋白在细胞膜上定位,并在花药发育第六期和第七期的小孢子母细胞、四分体和绒毡层中有最高表达。预测NPU蛋白具有两个跨膜结构域,但未发现具有明显的已知结构域。经过序列比对发现,不同物种的NPU同源蛋白具有高度保守的序列同源性,这表明NPU蛋白在植物界功能非常保守。在一些常用作物中,NPU蛋白的保守性也是显而易见的(图4-1)。水稻NPU与拟南芥有85%的氨基酸序列同源,与玉米NPU的同源性为84%,与小麦NPU的同源性为84%,与高粱或大豆NPU的同源性为82%。为了确认NPU蛋白在植物中的保守性,本发明采用水稻NPU的编码框序列连接拟南芥启动子互补拟南芥NPU突变体,结果显示拟南芥NPU突变体的不育表型恢复为可育表型,育性与野生型没有明显差别(图4-2)。结果表明水稻NPU蛋白的功能与拟南芥相同,水稻NPU蛋白很可能也负责花粉初生外壁的沉积。这个结果同时表明水稻NPU突变体很有可能也是一个低温恢复的突变体,具有成为农业上的光温敏株系的潜质。综上所述,低温和短光照,均可使NPU突变体植株的不育表型恢复为可育,但低温条件下,NPU突变体植株能够完全恢复育性,而短光照只能使其育性部分恢复。且NPU蛋白的功能在植物界具有高度保守性,如水稻NPU蛋白与拟南芥有85%的氨基酸序列同源,与玉米NPU蛋白的同源性为84%,与小麦NPU蛋白的同源性为84%,与高粱或大豆NPU蛋白的同源性为82%。以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1