GLP-1(7-37)多肽类似物的制作方法
本发明涉及二型糖尿病的治疗。更具体而言,本发明涉及GLP-1(7-37)多肽类似物及所述多肽类似物的脂肪酸修饰物,这些修饰物的制备方法,及含这些修饰物在降血糖药物中的用途。
背景技术:
糖尿病是一种由遗传和环境等多种因素引起的糖代谢紊乱疾病,现已成为继肿瘤、心脑血管疾病之后威胁人类健康和生命安全的第三位重大疾病。糖尿病本身不一定造成危害,但长期血糖增高,大血管、微血管受损并危及心、脑、肾、周围神经、眼睛、足等,据世界卫生组织统计,糖尿病并发症高达100多种,是目前已知并发症最多的一种疾病。因糖尿病死亡者有一半以上是心脑血管所致,10%是肾病变所致。因糖尿病截肢是非糖尿病的10~20倍。为此治疗糖尿病进而预防其并发症是至关重要的社会问题。
糖尿病由于患病机理不同可分为几种类型。其中绝大部分属于二型糖尿病(约90%),主要是因体重过重和缺乏身体活动所致。II型糖尿病患者多存在胰岛素抵抗和胰岛素分泌不足两方面异常,在发病的中晚期往往出现胰岛β细胞凋亡。目前,临床使用的口服降糖药的作用机理多为增强胰岛素敏感性,或促进胰岛素分泌以稳定血糖,均无法解决β细胞凋亡这一难题。而GLP-1及其类似物药物由于具有减缓β细胞凋亡,增进其再生,促使胰岛β细胞分化并增殖的作用,使其成为治疗II型糖尿病的研究重点。
GLP-1是已发现的促胰岛素分泌作用最强的肠肽类激素,它通过与GLP-1受体(GLP-1R)结合发挥作用。GLP-1结合GLP-1R后,激活细胞膜内环腺苷酸(cAMP)和丝裂原激活蛋白激酶(MAPK)通路。胰岛成熟β细胞的GLP-1受体偶联Gs,活化腺苷酰环化酶,产生cAMP,后者与葡萄糖协同刺激胰岛素合成和分泌,刺激胰岛素基因转录和胰岛素原生物合成,可降低胰高血糖素浓度并抑制胰高血糖素分泌,增强细胞对胰岛素的敏感性,刺激胰岛素依赖性糖原合成,降低餐后血糖浓度;通过激活蛋白激酶、磷脂酰肌醇3激酶(PI3K)、MAPK通道,调节凋亡前蛋白及诱导抗凋亡蛋白Bcl-2与Bcl-xL的表达,以减缓β细胞凋亡,增进其再生,促使胰岛β细胞分化并增殖。
GLP-l诱导多种生物学效应,例如剌激胰岛素分泌、抑制胰高血糖素分泌、抑制胃排空、抑制胃运动或肠运动及诱导重量减轻。GLP-l的显著特征是剌激胰岛素分泌而无低血糖相关的危险。GLP-l(1-37a.a)活性很低,并且GLP-l(7-37a.a)和GLP-l(7-36)这两种天然存在的截短肽在体内被迅速清除,并且具有极短的体内半衰期,这限制了GLP-l治疗的有效性。 已知内源性的二肽基酶4(DPP4)通过切割GLP-l肽N末端组氨酸和丙氨酸残基,而使循环的GLP-l肽失活。因此生产一种生理作用与GLP-1类似但不能被很快降解的GLP-1类似物成为研究的热点。
目前市场上获批的GLP-1药物主要有从蜥蜴唾液中分离出的Exenatide-4,以及采用脂肪酸,抗体Fc段或血清白蛋白修饰的人源GLP-1类似物。在这些产品中以诺和诺德公司的脂肪酸修饰的利拉鲁肽在降血红蛋白糖基化及降体重方面最有效且副作用较少。但其不足方面是体内半衰期只有13小时,需要每天给药。且根据最新的结构信息分析,GLP-1脂肪酸修饰后虽然大大提高了其体内半衰期,但由于脂肪酸阻碍了其与受体结合,导致其生物活性降低,计量是其他产品的几十至上百倍。这大大增加了其服药成本,增加了药品副作用风险。因此开发出类似或好于利拉鲁肽药效,但半衰期大大增加,生物学活性更高,剂量更低的药物,具有巨大的市场需求和市场竞争力。
技术实现要素:
本发明涉及一种新的GLP-1(7-37)多肽类似物(下称GLP-1M(7-37)),所述多肽类似物GLP-1M蛋白质的氨基酸序列与天然序列比较,其具有突变A8S和V33R。同时还可以有G16E和/或A24E突变。
本发明还涉及一种SUMO-GLP-1M(7-37)融合蛋白质,以及编码所述SUMO-GLP-1M(7-37)融合蛋白质的多核苷酸序列基因,包含这些多核苷酸序列基因的载体、包括载体的宿主细胞,以及由这些多核苷酸序列基因翻译表达的GLP-1M蛋白质,由该GLP-1M蛋白质作为主要成分的降糖药物。
本发明第一方面提供一种经密码子优化的编码SUMO-GLP-1M(7-37)融合蛋白质的多核苷酸序列基因。
本发明第二方面提供一种构建的表达载体,其包含本发明第一方面的经密码子优化的编码SUMO-GLP-1M(7-37)融合蛋白质的多核苷酸序列基因。所述载体适合驱动异源DNA在细菌中翻译表达HPV L1蛋白质。在一个实施方案中,所述表达载体优选pET24(+)。
本发明的第三方面提供一种构建的工程菌细胞,该细胞包含本发明第一方面的多核苷酸序列基因,或第二方面的表达载体。所述的工程菌宿主细胞是大肠杆菌,在一个实施方案中,所述宿主细胞优选BL21(DE3)细胞株。
本发明第四方面提供多种种由密码子优化的SUMO-GLP-1M(7-37)多核苷酸序列基因表达的GLP-1M蛋白质的氨基酸序列。
本发明第五方面提供一种GLP-1M蛋白质经脂肪酸修饰后形成的GLP-1类似物。
本发明第六方面提供了一种药用组合物,其包含本发明GLP-1M脂肪酸修饰物,所述组合 物中进一步包含可药用的制剂配方。
在一个实施方案中,本发明还提供了一种包含本发明所述GLP-1M或GLP-1M脂肪酸修饰物的药物制剂,所述药物制剂还包含制药上可接受的载体或赋形剂,一个具体的实例可以是如包含GLP-1M脂肪酸修饰物,用1.4mg/ml磷酸氢二钠,5.5mg/ml苯酚,180mM乙醇丙二醇混合物(摩尔比1:4),pH=7.9配制最终成品,-80度或4度保存。
另一方面,本发明提供一种获得HPV L1五聚体的方法,其包括在表达系统中表达经密码子优化的HPV L1蛋白质,然后将含有该蛋白质的裂解上清进行纯化处理。具体方法包括:
A.将设计合成的表达质粒转化到BL21(DE3)中构建工程菌细胞,在工程菌细胞中表达SUMO-GLP-1M融合蛋白质,离心收集菌体。
B.破碎细胞,连续流离心加深层过滤法获取上清。
C.采用亲和方法捕获目的融合蛋白。
D.加入SUMO蛋白质酶切除SUMO标签,得到初步纯化的GLP-1M多肽。
E.采用疏水层析纯化法进一步纯化目的多肽。
F.采用等电点沉淀法获得目的多肽,用NaOH溶液调节pH11.0~12.5使溶液澄清、沉淀全部溶解,按照多肽与脂肪酸最佳摩尔比1:1.5-1:5加入脂肪酸,在15度条件下反应15-120分钟。加入NaOH至终浓度10-50mM,4-15度反应1小时获得修饰后GLP-1M。
G.使用疏水层析法及反向纯化法纯化目的修饰多肽。
H.采用等电点沉淀法获得目的多肽
I.用1.4mg/ml磷酸氢二钠,5.5mg/ml苯酚,180mM乙醇丙二醇混合物(摩尔比1:4),pH=7.9配制最终成品,-80度或4度保存。
本发明所述的制备GLP-1M方法,其中所述GLP-1M蛋白质与天然蛋白比具有突变A8S和V33R。同时还可以有G16E和/或A24E突变。
本发明所述的制备GLP-1M方法,其中所述GLP-1M蛋白质为经过大肠杆菌表达系统DNA密码子优化的GLP-1M基因。
本发明所述的制备GLP-1M方法,其中所述原核宿主细胞选自但不限于XA90,GI698,ER2566,BL21(DE3),B834(DE3),BLR(DE3)。优选BL21(DE3)。
本发明所述的制备GLP-1M方法,其中所述表达条件是:20~37℃温度条件下,诱导表达3~20小时。在一个具体实施例中优选在30℃温度条件下,诱导表达10小时。
另一方面,本发明还提供了GLP-1M的组合物在治疗二型糖尿病中的应用。
根据本发明,本发明的药物可采用患者可接受的形式,包括但不限于注射或鼻腔给药,优选注射剂。
有益效果:
由于采用了氨基酸突变和全新脂肪酸修饰工艺,GLP-1M类似物的体内半衰期在老鼠中比利拉鲁肽增加了6-8倍。相同剂量下的老鼠实验显示,GLP-1M类似物药效比利拉鲁肽药效时间更长。该类似物开发成功后必大大方便了患者服药。
全新设计的多肽具有更高的生物学活性。未修饰的新GLP-1比天然GLP-1(7-37)具有更好的体外生物学活性。修饰后的GLP-1M比利拉鲁肽体内、体外活性更高。由于新GLP-1类似物与利拉鲁肽生产成本类似,该类似物开发成功后必大大降低患者服药成本。
说明书附图
图1为电泳检测SUMO-GLP-1M蛋白表达图谱。
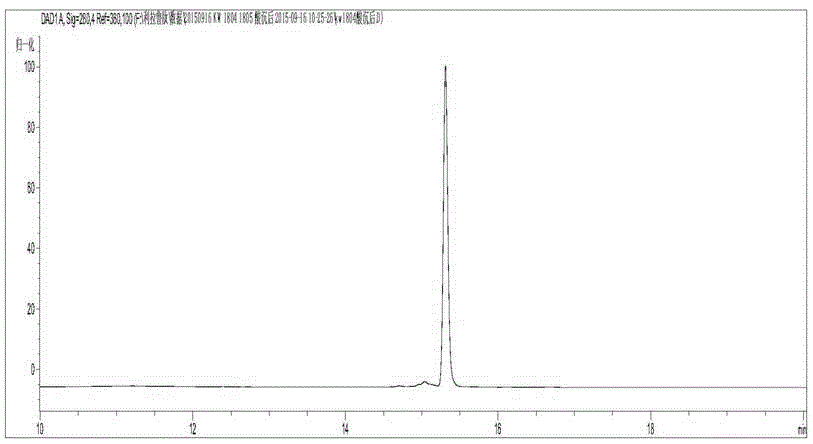
图2为GLP-1M(A8S/V33R)修饰后反向纯度检测图。
图3为GLP-1M(A8S/V33R/G16E/A24E)修饰后反向纯度检测图。
图4为药物对不同糖浓度刺激下胰岛素分泌水平影响图。
图5为人GLP-1R基因转染293细胞经不同浓度受试物与利拉鲁肽刺激后cAMP变化图。
图6-8为不同药物对糖耐量在不同时间的试验图,图6为第一天血糖值组间比较折线图,图7为第二天血糖值组间比较折线图,图8.第三天血糖值组间比较折线图。
图9为利拉鲁肽和受试物皮下注射给药后血药浓度-时间曲线
具体实施例
实施例l:密码子优化的GLP-1M基因的设计,合成与表达质粒构建
根据设计的蛋白序列使用软件进行其多核苷酸序列的密码子优化设计,优化后在其多核苷酸序列的5端加入promoter与rbs序列之间的必要序列,rbs序列,rbs与启动表达密码子ATG的间隔序列,ATG和六个组氨酸的密码子等序列。将上述序列委托上海捷瑞公司合成,并将合成基因在BamH1/SalI之间插入表达载体pET24(+)中完成表达质粒构建。涉及序列如下
蛋白序列GLP-1M(A8S/V33R)
H SEGTFTSDVS SYLEGQAAKE FIAWLRRGRG
表达SUMO-GLP-1M(A8S/V33R)融合蛋白合成多核苷酸序列
ATTTTGTTTAACTTTAATAAGGAGATATACCATGCATCACCATCATCACCACATGTCGGACTCAGAAGTCAATCAAGAAGCTAAGCCAGAGGTCAAGCCAGAAGTCAAGCCTGAGACTCACATCAATTTAAAGGTGTCCGATGGATCTTCAGAGATCTTCTTCAAGATCAAAAAGACCACTCCTTTAAGAAGGCTGATGGAAGCGTTCGCTAAAAGACAGGGTAAGGAAATGGACTCCTTAAGATTCTTGTACGACGGTATTAGAATCCAAGCTGATCAGACCCCTGAAGATTTGGACATGGAGGATAACGATATTATTGAGGCTCACAGAGAACAGATTGGTGGACACTCGGAAGGTACCTTCACCTCTGACGTTTCTTCTTACCTGGAAGGTCAGGCGGCCAAAGAATTCATCGCTTGGCTGCGTCGTGGTCGTGGTTAATAATAA
蛋白序列GLP-1M(A8S/V33R/G16E/A24E)
H SEGTFTSDVS SYLEEQAAKE FIEWLRRGRG
表达SUMO-GLP-1M(A8S/V33R/G16E/A24E)融合蛋白合成多核苷酸序列
ATTTTGTTTAACTTTAATAAGGAGATATACCATGCATCACCATCATCACCACATGTCGGACTCAGAAGTCAATCAAGAAGCTAAGCCAGAGGTCAAGCCAGAAGTCAAGCCTGAGACTCACATCAATTTAAAGGTGTCCGATGGATCTTCAGAGATCTTCTTCAAGATCAAAAAGACCACTCCTTTAAGAAGGCTGATGGAAGCGTTCGCTAAAAGACAGGGTAAGGAAATGGACTCCTTAAGATTCTTGTACGACGGTATTAGAATCCAAGCTGATCAGACCCCTGAAGATTTGGACATGGAGGATAACGATATTATTGAGGCTCACAGAGAACAGATTGGTGGACACTCGGAAGGTACCTTCACCTCTGACGTTTCTTCTTACCTGGAAGAACAGGCGGCCAAAGAATTCATCGAATGGCTGCGTCGTGGTCGTGGTTAATAATAA
实施例2:SUMO-GLP-1M(A8S/V33R)与SUMO-GLP-1M(A8S/V33R/G16E/A24E)蛋白表达
将测序结果正确的重组载体转化大肠杆菌BL21(DE3)(E.coli)宿主细胞,并作为表达重组蛋白质的工程菌进行SUMO-GLP-1M蛋白的表达。工程菌培养基为2×YT培养基(10g/L胰化蛋白胨;5g/L酵母粉;10g/L NaCl)。挑取含重组质粒的菌体单斑于10ml 2×YT培养基中,230转/分钟(rpm),37℃振荡培养过夜。转接5ml过夜菌于500ml2×YT液体培养基中,37℃震荡培养至重组工程菌生长至OD600nm≈0.4~1时,加入终浓度0.2mM的IPTG诱导,在30℃的条件下进行16h重组蛋白质的表达。结果见图1
实施例3:多肽纯化、脂肪酸修饰及修饰后纯化
细胞收集及破碎:对发酵培养物进行离心,弃上清,收获菌体沉淀,称重;使用bufferA(pH 8.0,50mM PB,500mM NaCl)洗涤沉淀,然后将其重悬于buffer A中进行超声波破碎,随后通过高速离心机对破菌液进行离心(16000rpm,30min,4℃),收集上清液。
亲和层析及酶切:亲和柱中装入Ni亲和层析介质10ml,以buffer A平衡层析柱,然后上样,完毕后以Buffer L洗至无蛋白质流出,亲和完毕。以含300mM咪唑Buffer A洗脱收集SUMO-GLP-1M融合蛋白质。按质量比1:100加入SUMO蛋白酶4度过夜酶切融合蛋白。
疏水纯化及等电点沉淀:使用Buffer B(pH 8.0,50mM PB,0.3M硫酸铵)平衡疏水层析柱。将酶切后样品加入终浓度0.3M硫酸铵后上样,以BufferC(20mM NaH2PO4,0.7M NaCl)淋洗层析柱。用20mM乙醇洗脱目的多肽。用HCl调节PH至4.5-5.0过夜沉淀目的多肽。
脂肪酸修饰:离心获得沉淀后多肽。用移液枪逐滴滴入0.5M NaOH,调节pH11.0~12.5,调节pH以观察溶液澄清、沉淀全部溶解作为终点。按照每毫升水溶液加入2μl三乙胺的比例加入三乙胺,按照每毫升水溶液加入1.5ml乙腈的体积比加入乙腈。将反应液移至15℃水浴中,转子搅拌下用移液枪逐滴滴入1M醋酸,调节pH至10.5~11.0。按照多肽与脂肪酸最佳摩尔比1:3计算脂肪酸用量,用电子天平称量脂肪酸粉固体直接倒入多肽溶液中控制水浴温度搅拌反应半小时。反应结束后加入总体积25%的0.5M NaOH(至终浓度0.1M NaOH),快速搅拌混匀。混合后反应液放入15℃水浴中静置1小时,用移液枪滴入1M醋酸调节pH至 7.4~7.6终止反应。
反向纯化:用40%乙腈平衡C18反向纯化柱。将修饰后样品用水稀释2倍后上样C18反向纯化柱后用40%-80%乙腈线性梯度洗脱修饰后多肽。收集样品用C18反向分析柱检测,结果见图2-3.
实施例4刺激胰岛素分泌实验
取出生3~4周的SD大鼠,75%乙醇消毒,无菌取出胰腺,清除胰外网膜,脂肪组织后,经4℃Hanks液漂洗2次,加入2~3倍体积的0.5mg/ml的V型胶原酶,混匀,37℃水浴震荡消化6~8min。至消化浑浊,自然沉淀吸取上清,用4℃Hanks液终止消化,重复上面的消化步骤,直至消化完全,收集各次的消化液,1000rpm离心5min,弃上清,将细胞重悬于含10%胎牛血清的RPMI1640培养基的T75瓶中,37℃5%CO2-95%空气的二氧化碳培养箱中培养。细胞培养至第3d,形成单层细胞,用无糖无血清的RPMI1640 37℃孵育1h,再分别换用低糖(2.8mM)高糖(16.8mM)含药或不含药溶液37℃孵育1h,收集上清,用ELISA检测胰岛素浓度。结果见图4.
实施例5
构建了表达人胰高血糖素样肽-1受体(GLP-1R)基因的293细胞株,将转染后的HEK293/GLP-1R细胞按照每孔2×105个细胞/孔(1ml/孔),接种于12孔板中,放入37℃,5%CO2培养箱中孵育6-8h,待细胞贴壁后,分别在每孔中加入终浓度0.1pM、1pM、10pM、100pM、1000pM和10000pM的利拉鲁肽、GLP-1M(A8S/V33K/G16E/A24E)和GLP-1M(A8S/V33R)(1ml/孔),继续培养24h,利用试剂盒检测cAMP含量。结果表明该重组细胞株经过受试物的刺激后,其细胞中的cAMP含量明显升高,受试物GLP-1M(A8S/V33K/G16E/A24E)的EC50值约是利拉鲁肽的1/4,受试物GLP-1M(A8S/V33R)的EC50值约是利拉鲁肽的1/3(利拉鲁肽的EC50值81.8pM,GLP-1M(A8S/V33K/G16E/A24E)的EC50值21.6pM,GLP-1M(A8S/V33R)的EC50值27.7pM)。
实施例6.糖耐量实验
选4周龄ICR雄性小鼠40只,随机分为4组,实验组分别灌胃0.1mg/kg的利拉鲁肽和0.05mg/kg的2个不同受试物,半小时后同空白组一起灌服25%的葡萄糖水5g/kg。灌胃后2h、6h、12h、24h、48h、72h检测尾静脉血糖含量,第二天和第三天同一时间点灌服葡萄糖并检测血糖值。结果显示,第一天利拉鲁肽组和两个受试物血糖值均明显低于空白组,第二天利拉鲁肽组血糖值已基本等于空白组而受试组仍显著低于空白组,第三天利拉鲁肽无降血糖活性,两个受试组血糖值有所升高但依旧低于空白对照组组。结果见图6-8。
实施例7.SD鼠药代动力学研究
选雄性SD大鼠30只,随机分成3组,分别单次皮下注射0.1mg/kg的利拉鲁肽和0.05mg/kg的2个不同受试物【GLP-1M(A8S/V33K/G16E/A24E)/GLP-1M(A8S/V33R)】,在给药前和给药后不同时间点采血,分离血清,用GLP-1试剂盒检测血清中利拉鲁肽和受试物的含量。结果表明,两个受试物的生物半衰期较利拉鲁肽明显延长,GLP-1M(A8S/V33R)达到26h,GLP-1M(A8S/V33K/G16E/A24E)达到28h(利拉鲁肽生物期半衰期4h)。GLP-1M(A8S/V33R)/利拉鲁肽的相对生物利用度是2163%,GLP-1M(A8S/V33K/G16E/A24E)/利拉鲁肽的相对生物利用度是1833%。结果见图9。
- 还没有人留言评论。精彩留言会获得点赞!