一种测定样本中不同线粒体的比例的方法与流程
本发明涉及测定样本中不同线粒体的比例的方法,具体涉及通过对线粒体DNA的高度可变区进行二代测序并进行分析,从而确定样本中不同线粒体的比例的方法。
背景技术:
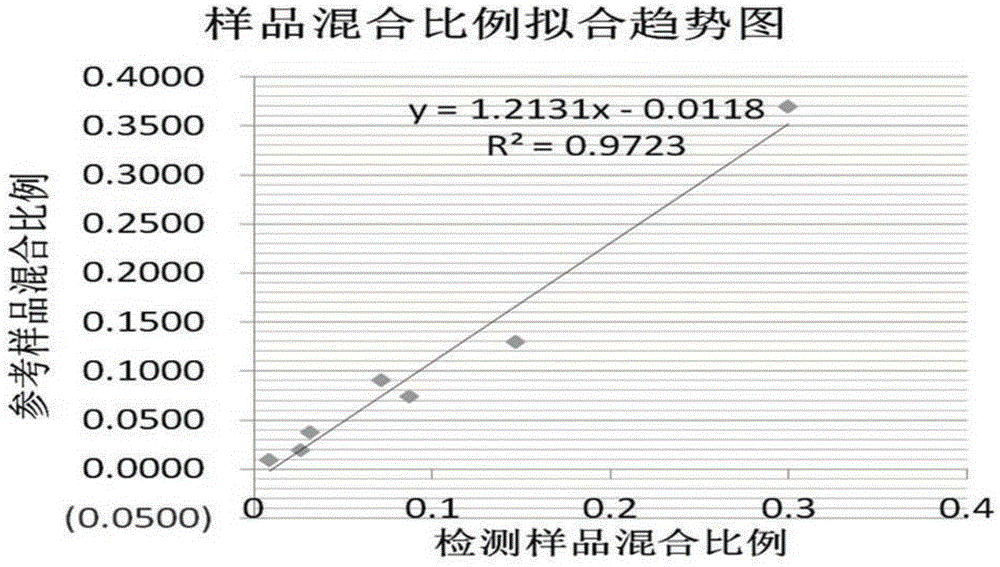
:线粒体是真核细胞内的重要细胞器,是能量产生与转换的场所,还参与脂肪酸的合成以及少量蛋白质的合成。正常的线粒体功能依赖于核基因和线粒体基因的共同作用,任一基因组中的突变都可能引起线粒体功能障碍。因此,有些情况下需要测定样本中不同线粒体(例如正常的与突变的)的比例。但目前尚缺少能够准确地测定样本中不同线粒体的比例的方法。人类线粒体基因组是长度为16,569bp的双链环状DNA分子,由编码区和非编码区构成。其中,编码区包括37个基因。非编码区,又叫控制区或D环区(Displacement-loopregion,D-Loop),由1,122bp组成,在该区域存在有2个长度各为400bp的高度可变区,即HVI区(hypervariableregionI,16,024–16,569)和HVII区(hypervariableregionII,1–576)。技术实现要素:鉴于上述现有技术中存在的不足,本发明的目的在于提供一种准确地测定样本中不同线粒体的比例的方法。本发明的发明人为解决上述技术问题进行了深入研究,结果发现:通过对样本中线粒体DNA的高度可变区的SNP位点进行分析,能够测定样本中不同线粒体的比例,从而完成了本发明。即,本发明包括:1.一种测定样本中不同线粒体的比例的方法,该方法包括:步骤A:对包含不同线粒体的样本中的线粒体的基因组的高度可变区进行PCR扩增,得到扩增产物;步骤B:对扩增产物进行二代测序;步骤C:根据二代测序结果,对样本中的线粒体的基因组的高度可变区的SNP位点进行分析,确定样本中不同线粒体的比例。2.根据项1所述的测定样本中不同线粒体的比例的方法,其中,所述不同线粒体为两种线粒体。3.根据项1~2中任一项所述的测定样本中不同线粒体的比例的方法,其中,所述不同线粒体为来源于同一个体的线粒体。4.根据项1~3中任一项所述的测定样本中不同线粒体的比例的方法,其中,所述线粒体来源于人。5.根据项4所述的测定样本中不同线粒体的比例的方法,其中,所述高度可变区是人类线粒体基因组的HVI区和HVII区。6.根据项1~5中任一项所述的测定样本中不同线粒体的比例的方法,其中,在所述步骤C中,基于已经获得的不同线粒体各自的高度可变区的核苷酸序列信息,确定在不同线粒体之间存在的SNP位点,根据对所述扩增产 物进行二代测序的结果,分别获取各个在所述不同线粒体之间存在的SNP位点上各不同线粒体的SNP出现的频率,根据该频率计算出样本中不同线粒体的比例。7.根据项6所述的测定样本中不同线粒体的比例的方法,其中,所述不同线粒体之间存在的SNP位点的数量为10~20个。8.根据项6或7所述的测定样本中不同线粒体的比例的方法,其中,对于各个在所述不同线粒体之间存在的SNP位点,分别计算样本中不同线粒体的比例,然后对所得到的多个比例取算数平均值。9.根据项1~8中任一项所述的测定样本中不同线粒体的比例的方法,其还包括下述步骤:步骤C0:在所述步骤C之前,对构成所述包含不同线粒体的样本的不同线粒体的基因组高度可变区分别进行PCR扩增和二代测序,由此获得不同线粒体的基因组高度可变区的核苷酸序列信息。10.根据项1~9中任一项所述的测定样本中不同线粒体的比例的方法,其中,被确定的在不同线粒体之间存在的SNP位点满足下述条件:在所述不同线粒体的该位点上,出现某一SNP的频率的差异大于50%,优选大于60%,更优选大于70%,更优选大于80%,更优选大于90%,更优选大于95%,更优选大于99%。11.根据项1~10中任一项所述的测定样本中不同线粒体的比例的方法,其中,所述步骤A中使用由核苷酸序列如SEQIDNO:1所示的上游引物及核苷酸序列如SEQIDNO:2所示的下游引物组成的引物对作为引物,对所述高度可变区进行PCR扩增。12.根据项1~11中任一项所述的测定样本中不同线粒体的比例的方法,其还包括在所述步骤A之前进行的步骤A-1:准备包含不同线粒体的样本。发明效果根据本发明的测定样本中不同线粒体的比例的方法,能够准确度地测定样本中不同线粒体的比例。附图说明图1是本发明的7份混合样本和4份原始样本PCR扩增结果电泳图;泳道1-11分别为各扩增产物的凝胶电泳结果,最左侧为分子量标准DL2000。图2是显示本发明的方法的相关性的图。发明的具体实施方式首先,在一个方面中,本发明提供一种测定样本中不同线粒体的比例的方法(本发明的方法),该方法包括:步骤A:对样本中的线粒体的基因组高度可变区进行PCR扩增,得到扩增产物;步骤B:对扩增产物进行二代测序;步骤C:根据二代测序结果,对样本中的线粒体的基因组高度可变区的SNP位点进行分析,确定测定样本中不同线粒体的比例。在本说明书中,样本是指:包含了不同线粒体的试样。对所述样本没有特殊限制,只要其包含不同线粒体即可,样本可以是动植物组织、动植物细胞或细胞团、微生物等,也可以是通过将不同的线粒体混合在一起而得到的试样。在本说明书中,“不同线粒体”是指:基因组(也称线粒体DNA)的高度可变区的碱基序列不同的线粒体。所述不同线粒体可以是来源于同一个体的线粒体(例如同一个体的正常线粒体与突变线粒体),也可以是不同来源的线粒体。在本说明书中,“不同来源”是指:线粒体来自于不同的物种或同一物种的不同个体。优选地,所述线粒体可以来源于人。人类线粒体基因组是长度为16,569bp的双链环状DNA分子,由编码区和非编码区构成。其中,编码区包括37个基因。非编码区,又叫控制区或D环区(Displacement-loopregion,D-Loop),由1,122bp组成,在该区域存在有2个长度各为400bp的高度可变区,即HVI区(hypervariableregionI,16,024–16,569)和HVII区(hypervariableregionII,1–576)。在所述线粒体为人线粒体的情况下,所述高度可变区可以是人类线粒体基因组的HVI区(hypervariableregionI,16,024–16,569)和HVII区(hypervariableregionII,1–576)。对于对样本中的线粒体DNA的高度可变区进行PCR扩增得到扩增产物的方法没有特殊限制,例如可以采用使用针对所述高度可变区设计的扩增引物的PCR(聚合酶链反应)方法。针对已知碱基序列的线粒体DNA的高度可变区设计其扩增引物是本领域技术人员熟知的,例如可以按照《分子克隆实验指南》(J.萨姆布鲁克(Sambrook.J.)等著,黄培堂等译,第3版,2005)的教导来进行设计,或者利用计算机软件(例如Premier公司开发的PrimerPremier6.0)来进行设计。本发明人发现,通过使用由核苷酸序列如SEQIDNO:1所示的上游引物及核苷酸序列如SEQIDNO:2所示的下游引物组成的引物对作为引物,能够高品质地对人线粒体基因组的高度可变区进行PCR扩增。这里,“高品质”是指:对扩增产物进行琼脂糖凝胶电泳检测时,条带 单一(例如扩增产物条带占99%以上、优选99.5%以上、更优选基本上100%)且特异(扩增产物片段大小与目标片段大小一致,例如扩增产物片段大小与目标片段大小误差在±5%以下、优选±1%以下、更优选±0.5%以下)。PCR(聚合酶链反应)扩增是本领域技术人员熟知的,其一般通过一定的PCR反应程序(温度循环)来实现。所述PCR反应程序一般包含变性、退火、延伸等步骤。在使用上述引物对作为PCR扩增引物的情况下,变性步骤可以在93-98℃(优选94-96℃)进行0.1~10分钟(优选0.5~2分钟);退火步骤可以在52-62℃(优选54-56℃)进行0.1~10分钟(优选0.5~2分钟);延伸步骤可以在72℃进行0.1~10分钟(优选1~5分钟);由上述变性、退火、延伸步骤组成的循环可以进行10-50次(优选25-35次)。优选地,经历上述温度循环前的模板可以在93-98℃(优选94-96℃)进行1~60分钟(优选5~20分钟)的热处理,经历上述温度循环后的扩增产物可以于4℃保温0-12小时。对于对扩增产物进行二代测序的方法没有特殊限制,可以例如采用基于二代测序原理的测序方法来进行。基于二代测序原理的测序方法是本领域技术人员已知的,其通常包括基因组片段化、测序用DNA文库构建、测序及数据分析等步骤。在步骤C中,根据二代测序结果,对样本中的线粒体DNA的高度可变区的SNP位点进行分析,从而确定测定样本中不同线粒体的比例。SNP(SingleNucleotidePolymorphisms,单核苷酸多态性),主要是指在基因组水平上由上单个核苷酸的突变所引起的DNA序列多态性。它是人类可遗传的变异中最常见的一种,占所有已知多态性的90%以上。SNP在人类基因组中广泛存在。SNP所表现的多态性只涉及到单个碱基的变异,这种变异可由单个碱基的转换(如,CT,在其互补链上则为GA)、颠换(如,CA,GT, CG,AT)所引起,也可由碱基的缺失和插入所致,但本说明书所称的SNP并不包括由碱基的缺失和插入引起的那些。在基因组DNA中,任何碱基均可能发生变异,因此SNP既有可能在基因序列内,也有可能在基因以外的非编码序列上。例如,在所述不同线粒体为两种线粒体(例如线粒体P和线粒体Q)的情况下,所述SNP位点可以如下进行。首先,基于已经获得(例如可以通过自行对线粒体P和线粒体Q的高度可变区分别进行二代测序获得)的线粒体P和线粒体Q各自的高度可变区的核苷酸序列信息,确定在线粒体P和线粒体Q之间存在的SNP位点(例如,对应于高度可变区的16,521位,线粒体P中TT型占绝对优势为A%,线粒体Q中TT型占绝对劣势为B%,A-B优选大于50%,更优选大于60%,更优选大于70%,更优选大于80%,更优选大于90%,更优选大于95%,更优选大于99%,最优选为100%)。所述位点可以是一个也可以是多个,从提高测定准确度的角度考虑,优选为多个,例如为2~50个、3~40个、5~30个;从提高可操作性的角度考虑更优选为10~20个。然后,根据对样本进行二代测序的结果,分别获取各个所述位点上所述SNP出现的频率,根据该频率计算出两种线粒体的比例(例如,对于上述高度可变区的16,521位,T出现的频率为C%,则样本中线粒体P所占的比例x为((C-B)/(A-B))。从提高测定准确度的角度考虑,优选对于多个SNP位点,分别计算两种线粒体的比例,然后对所得到的多个比例取算数平均值。例如,在所述不同线粒体为N种线粒体(N为大于2的整数,例如为3)的情况下,所述SNP位点可以如下进行。首先,基于已经获得的N种线粒体各自的高度可变区的核苷酸序列信息,确定在N种线粒体之间存在的SNP 位点。所述位点可以是一个也可以是多个,从提高测定准确度的角度考虑,优选为多个,例如为2~50个、3~40个、5~30个;从提高可操作性的角度考虑更优选为10~20个。然后,根据对样本进行二代测序的结果,分别获取各个所述位点上所述SNP出现的频率,根据该频率计算出N种线粒体的比例。从提高测定准确度的角度考虑,优选对于多个SNP位点,分别计算N种线粒体的比例,然后对所得到的多个比例取算数平均值。对于扩增线粒体DNA的高度可变区的方法没有特殊限制,但通常可以从线粒体中提取出线粒体DNA,并以之作为模板进行PCR扩增。从线粒体中提取线粒体DNA的方法是本领域技术人员已知的(例如可以参考“王文、施立明,一种改进的动物线粒体DNA提取方法,动物学研究,1993(2)”)。此外,也可以不提取线粒体DNA、而直接使用所述样本本身或来自样本的线粒体进行PCR扩增。优选地,本发明的方法还可以包括在所述步骤A之前进行的步骤A-1:准备包含不同线粒体的样本。通常可以将线粒体从包含它的样本中提取出来并进行纯化,使之成为更适于进行PCR扩增的状态。从动植物组织、动植物细胞或微生物中提取线粒体的方法是本领域技术人员已知的。(例如可以参考“臧莹安、丁发源等,从动物组织中提取线粒体的方法。中国兽医杂志,2006年(42)2:61-65”;或者参考碧云天公司细胞线粒体分离试剂盒(货号:C3601)的产品说明书)。实施例以下结合附图和实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例是用于解释本发明,并非对本发明的限定。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。PCR扩增线粒体DNA的高度可变区所有实施例中的线粒体DNA的高度可变区的PCR扩增均按下述方法进行。根据线粒体DNA的高度可变区的全长序列,设计了一对特异性引物,核酸序列如下:HV-F:5-attggacaagtagcatccg-3(SEQIDNO:1)HV-R:5-tgtgagcccgtctaaacat-3(SEQIDNO:2)采用上述引物对进行PCR扩增,得到PCR扩增产物。PCR反应体系如表1:表1成分使用量(μL)10×buffer(Mg2+free)2.5dNTP(2.5mM)2MgCl21.5Taq酶0.2HV-F1HV-R1ddH2O15.8线粒体DNA(50ng/μL)1Total25PCR反应程序:95℃10min;(95℃1min,55℃45sec,72℃2min)30cycles;72℃10min。测序用DNA文库的构建按Illumina公司推荐的二代测序用DNA文库构建的常规方法构建了测序用DNA文库。质检及测序对于构建的测序用DNA文库,分别使用AgilentBioanalyzer2100和采用Q-PCR方法进行质检。经质检合格的文库上IlluminaHiseq2500进行测序。测序策略:PE100;测序数据量:0.01GRawdata/样本。实施例1测定混合样本的线粒体比例(1)混合样本的制备准备了四种不同的线粒体DNA(Mito1,Mito2,Mito3,Mito4),并按照下表中的比例制备了线粒体混合样本。(2)PCR扩增线粒体DNA的高度可变区以混合样本(Mito121,Mito122,Mito123,Mito124,Mito341,Mito342,Mito343)以及混合前的原始样本(Mito1,Mito2,Mito3,Mito4)为模板,采用前面描述的方法扩增了线粒体DNA的高度可变区。PCR扩增结果如图1所示。从电泳结果上可以看到,所有的样本扩增得到了目的条带,且条带单一、特异。(3)构建文库采用前面描述的方法分别构建了上述11个样本的测序用DNA文库。11个样本的AgilentBioanalyzer2100检测结果表明,构建得到了合格的小片段文库。(4)测序按前面的描述,使用IlluminaHiseq2500进行了测序。(5)比例计算Mito121这个样本的比例计算为例,Mito121是由样本Mito1和Mito2混合得来的,对样本Mito1、Mito2和Mito121进行线粒体DNA高度可变区测序,通过序列比对和生物信息分析算法分析,从高度可变区序列中确定12个SNP位点可以区分样本Mito1和Mito2,通过这12个SNP位点来计算Mito121的混合比例,SNP位点信息和计算比例的结果如下表2所示。计算比例的方法如下式所示:x*A+(1-x)*B=Cx为混合样本中A样本的比例;A为样本Mito1中该位点SNP突变类型的百分比B为样本Mito2中该位点SNP突变类型的百分比C为混合样本Mito121该位点SNP碱基类型的百分比表2对于其他样本,比例计算的方法与此相同。表3展示的是根据实验结果计算出来的样本混合比例以及样本真实的混合比例。从实验结果和样本真是混合比例对比可以看到,采用本发明的高通量测序及SNP位点信息分析方法计算出的混合比例跟真实的混合比例基本一致。混合样本线粒体比例检测结果与实际混合比例相关性实验结果如图2所示,从图2可以看到:相关性R2值达到了0.9723,表明采用本发明的检测方法计算出的线粒体混合比例真实可信。本发明的线粒体比例检测方法可以用于测定混合样本的线粒体比例。表3还需要说明的是,在可实施且不明显违背本发明的主旨的前提下,在本说明书中作为某一技术方案的构成部分所描述的任一技术特征或技术特征的组合同样也可以适用于其它技术方案;并且,在可实施且不明显违背本发明的主旨的前提下,作为不同技术方案的构成部分所描述的技术特征之间也可以以任意方式进行组合,来构成其它技术方案。本发明也包含在上述情况下通过组合而得到的技术方案,并且这些技术方案相当于记载在本说明书中。上述说明示出并描述了本发明的优选实施例,如前所述,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域技术人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。工业实用性根据本发明,提供了一种高准确度的基于二代测序的测定样本中不同线粒体的比例的方法。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1