提高测序准确性的方法与流程
在克隆扩增方案中的第一次延伸期间,可能将错误引入DNA。图1示出了第一延伸期间的误掺入(misincorporation)错误的示意图100。在该实例中,首先将DNA分子与表面结合的寡核苷酸杂交。杂交的寡核苷酸然后在称为“第一延伸”的步骤中通过DNA聚合酶延伸。在该实例中,聚合酶在第一延伸步骤期间在特定位置处掺入不正确的核苷酸(误掺入的碱基显示为交叉/星)。在第一次延伸后,进行扩增步骤,其产生在第一次延伸期间生成的DNA分子的多个拷贝。在扩增期间,在第一延伸步骤期间引入的错误在作为克隆群体的部分的所有分子中传播(propagate)。误掺入的碱基将被测序为“高质量错误”,其可能难以与样品中的真实突变区分开。
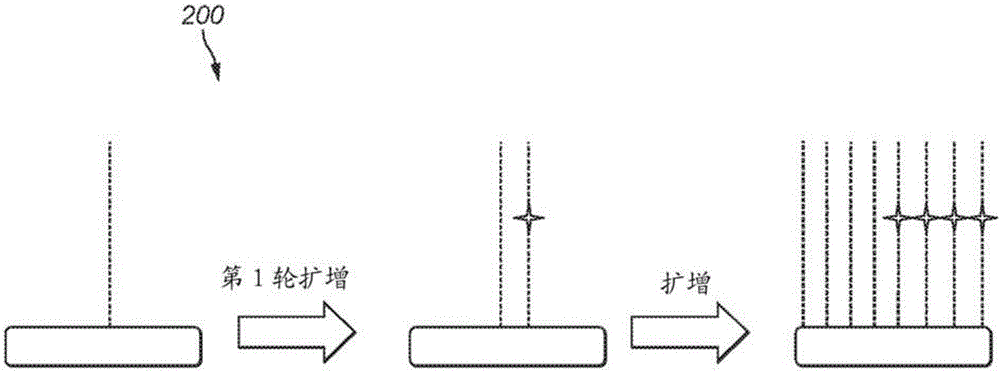
在克隆扩增过程的第一或第二循环中产生的掺入错误在该特定位置被测序时产生混合信号。图2示出了在第一扩增循环期间的误掺入错误的示意图200(误掺入的碱基显示为交叉/星)。在此早期阶段时,克隆群体由两种分子组成;一种分子具有正确的碱基,而另一种分子携带误掺入的碱基。随着克隆扩增过程继续,这两个分子用作模板以产生更多的DNA分子。最终的克隆群体可以由大约相等量的野生型和误掺入的分子两者组成,尽管随机事件可能使比率偏斜。由分子的混合群体产生的混合信号产生“低质量”碱基识别(base call)。误掺入事件发生的时机(timing)(循环数),连同在扩增的早期循环中发生的随机效应,将影响存在于特定克隆群体中的野生型和突变体分子的比例。
在一个实施方案中,本发明的方法可用于实质性减少或消除在第一延伸期间可能产生的高质量错误。
在另一个实施方案中,本发明的方法还可以用于减少由在扩增的前几个循环期间核苷酸的误掺入引起的错误。
根据本发明,提供了具有改善的准确性的测序方法,所述方法包括:
提供核酸模板;
通过线性扩增直接从所述模板核酸产生包含彼此紧密接近保持(retained in close proximity to each other)或可鉴定为从相同模板核酸获得的多个互补寡核苷酸链的群体;并且
对所述接近保持(said proximity retained)(例如表面结合)的寡核苷酸实施测序反应。
优选地,存在有至少三轮的线性扩增。
通过具有最小数量的三轮线性扩增,与典型的指数扩增方法相比,任何引入的错误的影响将被稀释。例如,如果我们假设从表面上的ssDNA链A开始,那么线性扩增仅在每轮中产生拷贝A’,而指数扩增在第一轮中产生A’,但然后在随后的轮次中A和A’两者,那么在第一轮产生A’中产生的错误将导致A’链在第1轮的100%错误(对于两种扩增),在第2轮的50%错误(对于两种扩增),但是然后在第3轮时,只有1/3的A’链在线性扩增中具有错误,但对于指数扩增,2/4的A’链具有错误。在这之后,使用指数扩增继续产生具有错误的A’链的50%,而使用本方法,使用核酸模板的线性扩增,错误变得更稀释。
下面的实例显示了用于线性扩增和指数扩增的错误传播的比较,其中A和A’表示制备的链,并且粗体和下划线表示含有突变的链。
优选地,该方法还包括在线性扩增轮次之后且实施测序反应之前实施互补链群体的进一步(指数)扩增的步骤。
任选地,包含通过线性扩增直接从模板核酸获得的多个互补链的群体在它们结合到表面时保持彼此紧密接近。
或者,包含通过线性扩增直接从模板核酸获得的多个互补链的群体由于它们保持在防止或限制扩散的凝胶或乳液中而保持彼此紧密接近。
优选地,提供多个核酸模板,并且产生多个互补链群体,其中每个群体直接自模板衍生,并且从每个模板衍生的群体衍生的成员保持彼此紧密接近。
有利地,通过在克隆扩增之前通过特定表面结合文库分子的线性扩增创建分子,由所述线性扩增创建的分子保持紧密接近。以这种方式的表面结合非常容易地导致进一步的测序步骤。自相同模板衍生的线性扩增分子群体的紧密接近保持也可以通过在线性扩增后杂交或附着扩增分子来实现,例如如果使用滚环扩增的话。紧密接近的保持还可以通过在凝胶或乳液内进行线性扩增循环以防止自由扩散来实现。这允许利用稀释效应,使得任何误掺入错误将被稀释掉(因为通过线性扩增创建的互补链群体中的两个分子将携带相同突变是极不可能的)。虽然完全在溶液中的线性扩增步骤(即,对于直接从相同核酸模板获得的群体,没有互补链的紧密接近保持)将降低总体错误率,但其仍然导致“高质量错误”得到维持(being carried through),因为此类情况下的误掺入步骤(无论在溶液线性扩增步骤中还是在指数扩增步骤中)将导致携带突变的簇(cluster)。本方法允许区分由于延伸误差所致的假象(artefacts),因为它们(在表面结合或以其它方式接近保持或扩散受限)线性扩增期间被凝胶稀释掉,而真实突变在样品自身中。
任选地,该方法包括将核酸模板附着到表面的步骤。这可以通过将所述核酸模板与位于表面上的第一引物杂交。或者,可以将模板核酸直接附着到表面。
优选地,互补链群体的进一步扩增利用附着于表面的另外的扩增引物,所述另外的扩增引物不参与线性扩增步骤。
任选地,(直接从核酸模板)线性扩增包括以下步骤:
将所述核酸模板与第一引物杂交;
延伸所述第一引物以产生所述模板的互补链;
变性以释放保持紧密接近的互补链(例如它保持结合于表面,因此完全不移动或在附近再杂交之前不扩散得较远);并且
重复杂交和扩增步骤以产生直接从模板核酸获得的表面结合互补链的群体。
任选地,线性扩增可以使用重组酶聚合酶扩增(RPA)。
任选地,线性扩增可以使用“WildfireTM”(Life Technologies)类型扩增,通过模板步行过程(template walking process)制备模板链的线性拷贝。
优选地,克隆扩增步骤是桥式扩增。
优选地,该方法包括测序步骤。
任选地,第一引物结合到固体支持物。
优选地,固体支持物是平面元件。
优选地,固体支持物是流动池。
任选地,固体支持物是珠。
或者,在附着于固体支持物的表面之前环化单链模板核酸,例如通过杂交进行。
环化可以使用环连接酶(circligase)。
滚环扩增(RCA)导致直接从模板核酸获得的互补链的多联体。
优选地,然后将多联体结合到固体支持物。
优选地,固体支持物包含多个第二引物或其片段。
第二引物的片段不具有足够的大小以允许在线性扩增步骤中使用的条件下直接延伸。
优选地,所述方法包括将反向互补寡核苷酸与第二引物片段杂交的步骤,其中所述反向互补寡核苷酸在其5’端包含作为全长第二引物序列的一部分的额外碱基。
复制杂交的引物以延长表面引物,从而使它们适于进一步用于例如指数扩增。
任选地,将第二引物或其片段接枝(graft)到附着点上。
可以通过链霉抗生物素蛋白/生物素连接或通过链霉抗生物素蛋白/双重生物素连接接枝。
任选地,固体支持物上的仅约一半的接枝位点被第一引物占据。
或者,可以存在偏斜比率(skewed ratio)。
任选地,可以通过寡核苷酸浓度,温育时间和/或温度来控制接枝过程。
优选地,随后将第二引物接枝到剩余的可用接枝附着点上。
接枝可以通过使用硫代磷酸酯/盐(thiophosphate)或点击化学(click chemistry)。
点击化学包括可以快速且可靠地使用以将小单元连接在一起的其它化学物质。
任选地,线性扩增步骤可以在显著高于第二引物或其片段的解链温度(Tm)的温度下进行,并且扩增的第二部分在低于第二引物的Tm的温度下进行。
任选地,当与固体支持物结合时,第一引物中的至少一些是封闭的(blocked)。
然后,可以使用标准技术在至少初始线性扩增轮后解封闭(unblock)此类引物,并且可以用于进一步的扩增轮次。
根据另一方面,提供了测序方法,其包括第一方面的线性扩增步骤。
为了更好地理解本发明,将仅通过示例并参考以下附图来描述实施方案,其中:
图1示出了第一延伸期间的误掺入错误的示意图;和
图2示出了在扩增的第一循环期间的误掺入错误的示意图;和
图3示出了用于高通量测序中的提高的准确性的测序结构的部分的实例的侧视图;和
图4示出了用于高通量测序中的提高的准确性的测序结构的部分的另一个实例的侧视图;和
图5A至5F示出了图4的测序结构的侧视图并且显示了通过线性扩增形成DNA分子的小克隆群体的过程的实例;和
图6A至6F示出了图4的测序结构的侧视图并且示出了通过线性扩增稀释DNA聚合酶错误的实例;和
图7A至7E示出了图4的测序结构的侧视图并且显示了通过用聚合酶延伸将短P7寡核苷酸引物转化为全长引物的过程的实例;和
图8A至8D示出了图3的测序结构的侧视图并且显示了在线性扩增后将第二寡核苷酸引物附着到流动池的过程的实例;和
图9A示出了通过滚环扩增(RCA)线性扩增文库的过程的实例;和
图9B示出了测序结构的侧视图,并且显示了将图9A的多联体DNA分子接种到流动池上的过程的实例;
图10A至10C示出了测序结构的侧视图,并且示出了直接在流动池上线性扩增环状文库分子的过程的实例;和
图11A至11E示出了测序结构的侧视图,并示出了经由夹板寡核苷酸(splint oligonucleotide)将文库分子连接到流动池上用于线性扩增的过程的实例。
在某些未示出的实施方案中,本发明的方法使用凝胶或乳液来防止通过特异性模板核酸/文库分子的线性扩增形成的互补链群体的显著扩散。
在各种实施方案中,本发明的方法使用包含单个“全长”表面结合的寡核苷酸引物(例如,全长P5引物)的固体表面和线性扩增以产生DNA分子的小克隆群体。
图3示出了用于高通量测序中的提高的准确性的测序结构300的一部分的实例的侧视图。测序结构300包括固体支持物310。在一个实例中,固体支持物310是平面结构,如流动池。在另一个实例中,固体支持物310是珠(未示出)。多个全长P5寡核苷酸引物315可以结合到测序结构300的表面。用于附着P7寡核苷酸引物的多个附着点320可以结合到固体支持物310的表面。可以使用附着点320,例如以在线性扩增步骤之后,将全长P7寡核苷酸引物附着到固体支持物310,如参考图8A至8D更详细描述的。
图4示出了用于高通量测序中的提高的准确性的测序结构400的一部分的实例的侧视图。测序结构400包括固体支持物410和多个全长P5寡核苷酸引物415。测序结构400还包括多个短P7寡核苷酸引物420。短P7寡核苷酸引物420不具有足够长度以支持扩增,但可以是在扩增方案中的后续步骤中延伸。在一个实例中,短P7寡核苷酸引物420可通过将较长的反向互补寡核苷酸与短P7寡核苷酸引物420杂交并用DNA聚合酶和dNTP(未示出)延伸短P7寡核苷酸引物420来延伸。此引物延伸步骤可在线性扩增步骤之后进行,如下文参照图7A至7E更详细描述。或者,线性扩增步骤可以在显著高于短P7寡核苷酸引物420的解链温度(Tm)的温度下进行,并且扩增的第二部分在低于短P7寡核苷酸引物420的Tm的温度下进行。因为扩增的第二部分在低于短P7寡核苷酸引物420的Tm的温度下进行,短P7寡核苷酸引物420可参与扩增过程。
图5A至5F示出了图4的测序结构400的侧视图,并且显示了通过线性扩增形成DNA分子的小克隆群体的过程的实例。通过线性扩增形成DNA分子的小克隆群体的过程的实例可以包括但不限于以下步骤。
在一个步骤中,图5A显示了接种的DNA分子510与P5寡核苷酸引物415的杂交。
在另一步骤中,图5B显示P5寡核苷酸引物415的延伸以产生互补链515a。互补链515a通过P5寡核苷酸引物415结合到固体支持物410的表面。
在另一步骤中,图5C显示在第二扩增循环(例如,变性,退火和延伸)中接种的DNA分子510与第二P5寡核苷酸引物的杂交。延伸第二P5寡核苷酸引物415以产生第二互补链515b。互补链515b也通过P5寡核苷酸引物415结合到固体支持物410的表面。
在另一步骤中,图5D显示在第三扩增循环(例如,变性,退火和延伸)中接种的DNA分子510与第三P5寡核苷酸引物的杂交。延伸第三P5寡核苷酸引物415以产生第三互补链515c。互补链515c也通过P5寡核苷酸引物415结合到固体支持物410的表面。
在另一步骤中,图5E显示在第四扩增循环(例如,变性,退火和延伸)中接种的DNA分子510与第四P5寡核苷酸引物的杂交。延伸第四P5寡核苷酸引物415以产生第四互补链515d。互补链515d也通过P5寡核苷酸引物415结合到固体支持物410的表面。扩增过程可以重复任何次数。在一个实例中,将线性扩增过程重复10个循环。
在另一步骤中,图5F显示在所需数目的扩增循环完成时除去接种的DNA模板510。互补链515的小群体保持结合到固体支持物410。在完成线性扩增过程后,许多未使用的P5寡核苷酸引物415也可存在于固体支持物410的表面上(未示出)。
在线性扩增过程中,仅将原始接种的DNA分子用作模板以产生新分子。因为只有原始接种的DNA分子用作模板,所以在线性扩增期间可能引入的错误不会被传播。例如,在作为小克隆群体(通过线性扩增产生)的一部分的所有分子中在相同位置引入相同误差的可能性非常低。例如,如果使用的聚合酶的准确性为99.9%(即每1000个核苷酸一个错误),则在“n”数目的分子中在相同位置具有相同误差的概率等于(0.001)n。因此,在两个分子中在相同位置具有突变的概率是一百万之一,并且在三个分子中是十亿分之一。注意,这些计算没有考虑所引入的突变可彼此不同。例如,如果T是正确的碱基,则一个分子可携带A,而另一个分子可携带C突变。通过线性扩增从原始分子创建多个拷贝导致准确性的显著改进,即,与不包括线性扩增的初始步骤的标准扩增程序中的0.1%误差相比,实际上是无错误的技术。当执行某些应用时,用本文中所述的方法可以实现的高准确性水平是特别有益的。例如,当观察体细胞突变(即癌症)时,共有覆盖不能用于“淘汰(weed out)”由于在第一延伸和桥式扩增步骤期间的误掺入而导致的测序错误。通过使用该方法,可以更有信心的是特定的SNP是真正的体细胞突变,而不是误掺入事件。
在另一个实例中,如果在第一轮线性扩增期间引入错误,然后另外九个线性扩增循环再产生九个具有正确碱基的分子,则约90%的信号将由正确的碱基表示。因为90%的信号将由正确的碱基表示,所以仍然可以识别(call)正确的碱基。相比之下,在标准克隆扩增方案(即,第一次延伸,随后直接是表面扩增,其中两种引物存在于流动池表面上并积极参与扩增步骤),第一扩增循环中的错误可导致大约50%的携带突变的分子(尽管通过随机效应,该百分比可以显著更高)。因为大约50%(或可能更高)的分子可能携带突变,所以很难确定正确的碱基。
图6A至6F示出了图4的测序结构400的侧视图,并且示出了通过线性扩增稀释DNA聚合酶错误的实例。
在一个步骤中,图6A显示了接种的DNA分子610与P5寡核苷酸引物415的杂交。
在另一个步骤中,图6B显示P5寡核苷酸引物415的延伸以产生互补链615a。互补链615a通过P5寡核苷酸引物415结合到固体支持物410的表面。
在另一步骤中,图6C显示在第二线性扩增循环(例如,变性,退火和延伸)中接种的DNA分子610与第二P5寡核苷酸引物的杂交。延伸第二P5寡核苷酸引物415以产生第二互补链615b。在第二次延伸期间,通过DNA聚合酶引入误掺入错误620。互补链615b也通过P5寡核苷酸引物415结合固体支持物410的表面。因为短P7寡核苷酸引物420长度不足以支持扩增,所以其中具有错误620的链615b不能参与扩增过程,并且不传播错误620。所有其它扩增链615,即615a,615c和615d在该特定位置具有正确的核苷酸。
在另一步骤中,图6D显示在第三线性扩增循环(例如,变性,退火和延伸)中接种的DNA分子610与第三P5寡核苷酸引物的杂交。延伸第三P5寡核苷酸引物415以产生第三互补链615c。互补链615c也通过P5寡核苷酸引物415结合到固体支持物410的表面。因为短P7寡核苷酸引物420长度不足以支持扩增,所以其中具有错误620的链615b不能参与扩增过程,并且不传播错误620。所有其它扩增链615,即615a,615c和615d在该特定位置具有正确的核苷酸。
在另一步骤中,图6E显示在第四线性扩增循环(例如,变性,退火和延伸)中接种的DNA分子610与第四P5寡核苷酸引物的杂交。延伸第四P5寡核苷酸引物415以产生第四互补链615d。互补链615d也通过P5寡核苷酸引物415结合固体支持物410的表面。同样,因为短P7寡核苷酸引物420长度不足以支持扩增,所以其中具有错误620的链615b不能参与扩增过程且错误620不传播。扩增过程可以重复任何次数。可以基于可接受的错误水平来选择线性扩增循环的数量。因为大多数互补链615在任何特定位置处具有正确的核苷酸序列,所以可以进行测序期间正确的碱基识别。
在另一步骤中,图6F显示在所需数目的线性扩增循环完成时除去接种的DNA模板610。互补链615的小群体保持结合于固体支持物410。
通过在包含短P7寡核苷酸引物的流动池表面上的线性扩增产生的互补链的小克隆群体可以在将短P7寡核苷酸引物转化为全长引物之后进一步扩增。或者,可以在使短P7引物能够参与如前所述的扩增过程的较低温度下进行进一步的扩增循环。
图7A至7E示出了图4的测序结构400的侧视图,并且显示了通过用聚合酶延伸将短P7寡核苷酸引物420转化为全长引物的过程的实例。通过延伸转化短P7寡核苷酸引物420的方法的实例可以包括但不限于以下步骤。
在一个步骤中,图7A显示了接种的DNA分子710与P5寡核苷酸引物415的杂交。
在另一步骤中,图7B显示通过线性扩增产生的小克隆群体715,如参考图5B至5F所述。
在另一个步骤中,图7C显示了与短P7寡核苷酸引物420杂交的多个反向互补寡核苷酸720。反向互补寡核苷酸720在其5'端包含作为全长P7引物序列的一部分的额外碱基。也可以杂交寡核苷酸720,然后将另一个寡核苷酸730与所述寡核苷酸720杂交。然后可以将寡核苷酸引物420和另外的寡核苷酸730连接在一起,以产生较长的P7表面寡核苷酸。
在另一步骤中,图7D显示短P7寡核苷酸引物420已经通过DNA聚合酶延伸至全长寡核苷酸引物725。全长寡核苷酸引物725现在可用于桥式扩增过程。
在另一个步骤中,图7E显示了使用全长寡核苷酸引物725和P5寡核苷酸引物415在桥式扩增过程中产生的DNA分子730的较大的克隆群体。
图8A至8D示出了图3的测序结构300的侧视图,并且示出了在线性扩增后将第二寡核苷酸引物附着到流动池的过程的实例。在线性扩增后附着第二寡核苷酸的过程的实例可以包括但不限于以下步骤。
在一个步骤中,图8A显示了接种的DNA分子810与P5寡核苷酸引物315的杂交。
在另一个步骤中,图8B显示了通过线性扩增产生的小克隆群体815,如参照图5B至5F所述。
在另一个步骤中,图8C显示了多个第二P7寡核苷酸引物820与附着点320的附着。在一个实例中,P7寡核苷酸引物820通过链霉抗生物素蛋白/生物素连接接枝到附着点320上(也可以使用双生物素,因为就其与链霉抗生物素蛋白的相互作用而言,其与单一生物素相比更稳定)。在该实例中,附着点320包含链霉抗生物素蛋白,P7寡核苷酸引物820是生物素化的。在另一个实例中,控制固体支持物310与P5寡核苷酸引物315的初始接枝,使得固体支持物310上的接枝位点仅约一半被P5寡核苷酸引物315占据。可以控制接枝过程,例如,通过寡核苷酸浓度,温育时间和/或温度。P7寡核苷酸引物820随后使用硫代磷酸酯或点击化学(即,可以快速并可靠地将小单元连接在一起的其它化学物质)接枝到剩余的可用接枝位点(例如,附着点320)上。
在另一个步骤中,图8D显示了在桥式扩增过程中使用接枝寡核苷酸引物820和P5寡核苷酸引物415产生的DNA分子825的较大的克隆群体。
图9A示出了通过滚环扩增(RCA)线性扩增文库的过程900的示例。过程900可以例如在溶液中执行。或者,过程900可直接在固体表面上执行。如步骤1所示,将双链DNA模板910变性以形成单链DNA模板915。双链DNA模板910包括与P5和P7寡核苷酸引物序列杂交的衔接头区。如步骤2所示,使用酶环连接酶将单链DNA模板915环化以形成环状DNA模板920。如步骤3所示,在RCA过程中扩增环状DNA模板920以产生线性多联体DNA分子925。环状DNA模板920的RCA从多联体DNA分子925中的相同初始模板分子产生10s-100s线性拷贝。如参考图9B所述,可使用多联体DNA分子925来接种簇生长。线性拷贝全部通过复制原始环状分子形成,因此不传播在RCA步骤期间发生的任何误掺入事件。
图9B示出了测序结构950的侧视图,并且显示了将图9A的多联体DNA分子接种到流动池上的过程的实例。测序结构950包括固体支持物955。在一个实例中,固体支持物955是流动池。结合在固体支持物955的表面上的是多个P5寡核苷酸引物960和多个P7寡核苷酸引物965。将多联体DNA分子925接种到固体支持物955的表面上并与P5寡核苷酸引物960杂交。通过初级延伸大多数(如果不是全部)包含在多联体DNA分子925中的线性拷贝启动簇生长。然后可以使用标准簇扩增方法(如果需要的话),为随后的测序提供足够的材料。还可以使用具有单一类型的引物的表面。在这种情况下的克隆群体将通过RCA产物的单个延伸步骤进行。
图10A至10C示出了测序结构1000的侧视图,并且显示了直接在流动池上线性扩增环状文库分子的过程的实例。直接在流动池上线性扩增环状文库分子的过程的实例可以包括但不限于以下步骤。
在一个步骤中,图10A显示测序结构1000。测序结构1000包括流动池1010。多个P5寡核苷酸引物1015和多个P7寡核苷酸引物1020结合在流动池1010的表面上结合。将单链环DNA模板1025接种到流动池1010的表面上并与P5寡核苷酸引物1015杂交。
在另一步骤中,图10B显示在RCA过程中环状DNA模板1025的线性扩增,以产生互补多联体DNA分子1030。
在另一个步骤中,图10C示出了通过P5寡核苷酸引物1015结合流动池1010的多联体DNA分子1030。在该实例中,仅显示了3个线性扩增的插入序列,但是多联体DNA分子1030可以包含10s-100s的原始DNA模板的线性拷贝。多联体DNA分子1030具有重复结构P5-插入序列-P7'-P5-插入序列-P7'-P5-插入序列二-P7'。在桥式扩增的第一任选循环期间,多联体DNA分子1030可以与多个P7寡核苷酸引物1020(未示出)杂交。随后将P7寡核苷酸引物1020延伸以产生P7-插入序列-P5'链(及其一些多联体)(未示出)。然后,桥式扩增的后续循环将照常进行,并且将倾向于有利于较短的插入序列,使得大多数链仅含有1个插入序列。然后可以使用标准簇扩增方法(如果需要的话),为后续测序提供足够的材料。
图11A至11E示出了测序结构1100的侧视图,并且显示了经由夹板寡核苷酸将文库分子连接到流动池上用于线性扩增的过程的实例。经由夹板寡核苷酸将文库分子连接到流动池上用于线性扩增的过程的实例可包括但不限于以下步骤。
在一个步骤中,图11A显示测序结构1100。测序结构1100包括流动池1110.在流动池1110的表面上结合有多个封闭的P5寡核苷酸引物1115,多个P7寡核苷酸引物1120和多个的P5捕获引物1125。在一个实例中,封闭的P5寡核苷酸引物1115是3'磷酸封闭的寡核苷酸。在另一个实例中,封闭的P5寡核苷酸引物1115包含存在于Illumina测序技术中使用的完全功能性核苷酸上的3'可逆性封闭。还可能具有选择的长度的短P5引物,使得在一定温度以上它们不能参与扩增过程。然后可以在已经进行线性扩增步骤之后延长这些短P5引物。
在另一个步骤中,图11B显示文库模板分子1130通过夹板寡核苷酸1135连接到P5捕获引物1125上。文库模板分子1130不包括与封闭的寡核苷酸引物1115互补的序列。夹板寡核苷酸1135包括与文库模板分子1130和捕获引物1125的一部分互补的序列。夹板寡核苷酸1135促进文库模板分子1130与P5捕获引物1125连接以形成连接的模板分子1140。
在另一步骤中,图11C显示将连接的模板分子1140线性扩增到周围的游离P7寡核苷酸引物1120上,以产生线性扩增的分子1145。
在另一个步骤中,图11D显示了封闭的P5寡核苷酸引物1115的解封闭,以产生多个解封闭的P5寡核苷酸引物1150。在一个实例中,使用T4激酶或磷酸酶将3'磷酸封闭的P5寡核苷酸引物1115解封闭(即转化为3'OH)。或者,如果3'封闭是存在于Illumina测序技术中使用的完全功能性核苷酸上的3'可逆封闭,则可以使用Illumina的切割试剂除去3'封闭。
在另一步骤中,图11E显示了使用标准簇扩增过程的扩增,即2引物介导的扩增方法以产生克隆扩增群体1155。
在本发明的另一个实施方案中,固体支持物可以是珠。在一个实例中,可在乳液中进行基于珠的线性扩增以确保扩增群体的克隆性。在另一个实例中,可以将单个珠接种在单独的纳米孔中,以确保扩增群体的克隆性。在另一个实例中,珠可以悬浮在凝胶状溶液内以防止或基本上最小化珠的自由运动。
在本发明的另一个实施方案中,可以在珠上进行线性扩增。一个或多个珠在线性扩增期间可以在流动池内部,或者线性扩增可以在流动池外部发生,并且一个或多个珠在线性扩增轮次或步骤之后流入流动池中。然后可以将核酸(DNA)复制到珠上以在表面上制备拷贝,或者可以使用标准技术从珠释放核酸分子,并使其在流动池的表面上轻微扩散,保持紧密接近局部化。测序可以使用已知技术在此进行,例如通过合成测序,或者然后可以形成簇,即使用桥式扩增(有效地提供由原始线性扩增群体形成和在原始线性扩增群体内形成的簇)和使用已知测序技术确定的共有序列。例如,如果具有相同基因组序列的10个簇具有位置9处的G并且一个具有T,则有可能弃去T并将其确信识别为G。可以基于位置信息以及还基于序列信息对序列进行分组。
独特的分子标识符(UMI)也可以用于所提出的方法。如果在模板核酸文库中实施UMI,则可以使用UMI信息来鉴定“姐妹”分子,即源自相同模板核酸的分子。
在又一个实例中,可以使珠粘附到玻璃棉或金属棉上以防止它们在溶液周围移动。
- 还没有人留言评论。精彩留言会获得点赞!