在相同的真核细胞产生宿主中发现和产生条件活性生物蛋白的制作方法
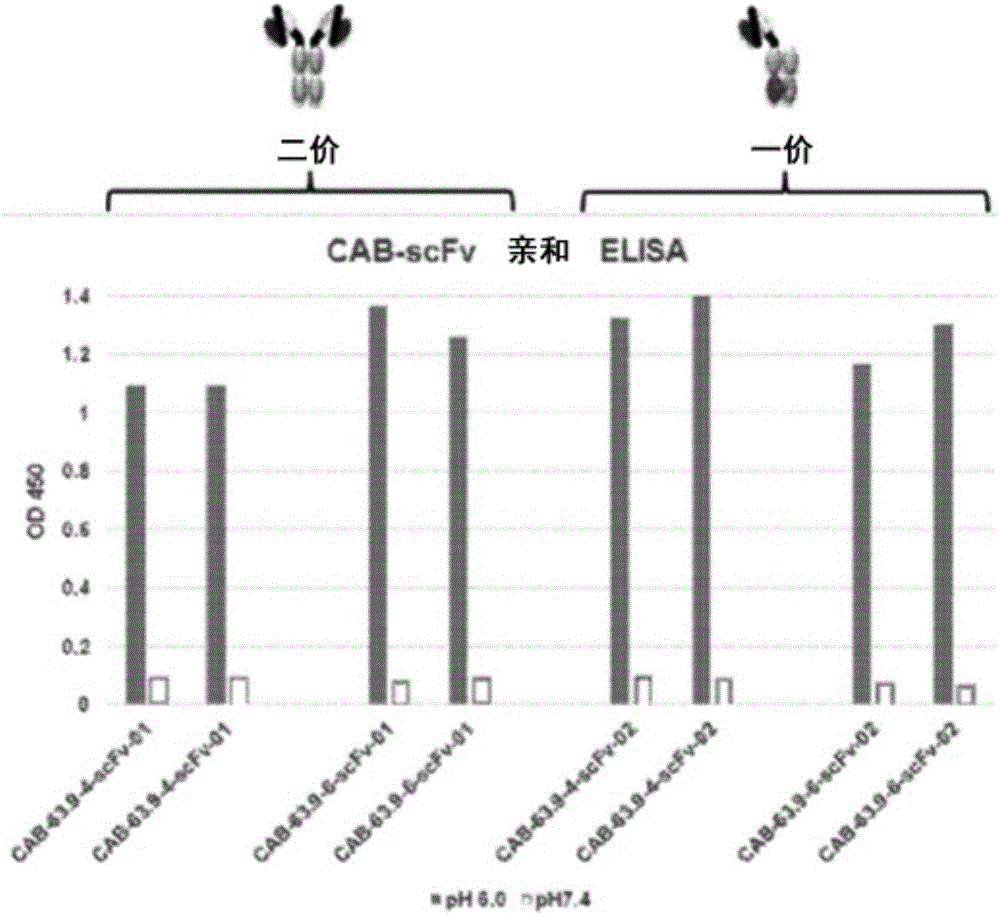
本发明涉及蛋白演变和蛋白活性领域。具体而言,本发明涉及从野生型蛋白制备在野生型蛋白通常遇到的正常生理条件下可逆或不可逆地几乎失活但在其他条件下具有活性的条件活性生物蛋白(conditionallyactivebiologicprotein),特别是治疗性蛋白的方法。例如,演变的蛋白在体温下几乎无活性,但在较低温度下有活性。
背景技术:
:有大量文献描述了演变蛋白,特别是例如酶的各种特性的潜力,以在不同条件下稳定工作。例如,酶已经演变为在较高温度下稳定,具有改变的活性。在高温活性增强的情况下,该增强中的大部分属于Q10律中普遍描述的较高的动力活性,对于酶来说评估为温度每增加10℃,其转换率增加一倍。此外,还存在使蛋白在正常工作条件下(例如该分子在规定温度下的活性)变得不稳定的自然突变的例子。对于温度突变体,这些突变体可以在较低温度下具有活性,但通常较作为其来源的野生型分子具有降低水平的活性。可将此描述为活性下降,该活性受Q10或类似规则支配。人们期望获得有用的具有条件活性的分子,例如这种分子在作为其来源的对应野生型分子通常遇到的条件下几乎无活性,但在其他条件下具有活性,其活性水平等于或高于在对应的野生型分子通常遇到的条件下的活性水平,或在特定微环境中被激活或被失活,或经过一段时间后被激活或被失活。除了温度,其它能够使蛋白演变或优化的条件包括pH、渗透压、重量摩尔渗透压浓度(osmolality)、氧化应激和电解质浓度。其它在演变过程中能够被优化的目标特性包括耐化学性和耐蛋白水解性。已公布了许多演变或改造分子的策略。然而,将蛋白改造或演变为在其野生型工作条件下变为失活或几乎失活(≤10%活性,特别是1%活性),而在新的条件下与其野生型条件的活性相当或高于其野生型条件的活性,需要该失稳突变(destabilizingmutations)与不对抗该失稳效应(destabilizingeffect)的活性增强的突变共存。据预期,不稳定降低该蛋白的活性会比标准规则如Q10所预测的影响大,因此,演变出在低温下有效工作的蛋白的能力,例如,而在它们的正常工作条件下是失活的,可制备一类意想不到的新的蛋白,我们称之为Mirac蛋白。在本申请中,根据作者和日期引用了各种出版物。为了更充分地描述本领域技术人员已知的这些公开物的日期和请求保护的权利要求中所描述的本领域状况,这些出版物以参阅的方式并入本申请。发明概述本发明提供一种制备条件活性生物蛋白的方法,该方法包括以下步骤:选择一种野生型生物蛋白,使用一种或多种演变技术演变编码该野生型生物蛋白的DNA以产生突变DNA,在真核细胞产生宿主中表达该突变DNA以获得突变蛋白,在正常生理条件下和异常条件下对该突变蛋白和野生型蛋白进行测试,选择表现出以下特性中至少一种的条件活性突变蛋白:(a)在正常生理条件下的测试中较野生型蛋白活性下降,以及(b)在异常条件下的测试中较野生型蛋白活性增强,以及在与表达步骤中使用的真核细胞产生宿主相同的真核细胞产生宿主中产生条件活性生物蛋白。另一方面,该条件活性生物蛋白表现出以下两种特性:(a)在正常生理条件下的测试中较野生型蛋白活性下降,以及(b)在异常条件下的测试中较野生型蛋白活性增强。在各个方面中,所述正常生理条件选自温度、pH、渗透压、重量摩尔渗透压浓度、氧化应激和电解质浓度中的一种或多种。在一个特定的方面,所述正常生理条件是温度,其中该条件活性生物蛋白在正常生理温度下是完全失活的,而在低于正常生理温度的异常温度下有活性。在其它方面,该条件活性生物蛋白在野生型正常生理条件下是可逆或不可逆失活的。在一个特定的方面,该蛋白在野生型正常生理条件下是可逆失活的。可选择地,条件活性生物蛋白选自那些在两种或两种以上不同生理条件下表现出活性可逆或不可逆变化的蛋白。在一个实施方案中,所述野生型生物蛋白是一种酶。在某些方面,所述野生型生物蛋白选自下组:组织型纤溶酶原激活物、链激酶、尿激酶、肾素和透明质酸酶。在另一个实施方案中,所述野生型生物蛋白选自降钙素基因相关肽(CGRP)、P物质(SP)、神经肽Y(NPY)、血管活性肠肽(VIP)、血管加压素(vasopressin)和血管抑素。在另一个实施方案中,所述生物蛋白是一种抗体。在另一个实施方案中,任何一个前述实施方案中的正常生理条件为温度;并且所述条件活性生物蛋白在正常生理温度下基本无活性,且在低于正常生理温度的异常温度下有活性。在另一个实施方案中,任何一个前述实施方案中的演变步骤包括选自PCR、易错PCR、改组、寡核苷酸定向诱变、装配PCR、有性PCR诱变、体内诱变、盒式诱变、循环总体诱变、指数总体诱变、位点特异性诱变、基因再组装(genereassembly)、基因位点饱和诱变、体外诱变、连接酶链反应、寡核苷酸合成及其组合的技术。在另一个实施方案中,任何一个前述实施方案中的真核细胞产生宿主选自真菌细胞、昆虫细胞、哺乳动物细胞、腺病毒和植物细胞。在另一个实施方案中,任何一个前述实施方案中的哺乳动物细胞选自Bowes黑色素瘤细胞、COS-7细胞、C127细胞、HeLa细胞、BHK细胞、3T3小鼠成纤维细胞、BHK21叙利亚仓鼠成纤维细胞、MDCK狗上皮细胞、PtK1鼠袋鼠上皮细胞、SP2/0小鼠浆细胞、NS0小鼠浆细胞、HEK293人胚胎肾细胞、COS猴肾细胞、CHO细胞、CHO-S、R1小鼠胚胎细胞、E14.1小鼠胚胎细胞、H1人胚胎细胞、H9人胚胎细胞和PERC.6人胚胎细胞。在另一个实施方案中,任何一个前述实施方案中的产生步骤包括生产(manufacturing)。在另一个实施方案中,任何一个前述实施方案中的条件活性生物蛋白被病毒颗粒用作识别蛋白。在另一个实施方案中,任何一个前述实施方案中的与靶细胞上的靶蛋白结合的条件活性生物蛋白被整合到嵌合抗原受体中。在另一个实施方案中,按照任何一个前述实施方案中的方法制备的条件活性生物蛋白在正常生理条件下可逆地或不可逆地失活。在另一个实施方案中,前一段的条件活性生物蛋白包含至少一种非天然氨基酸。在另一个实施方案中,前两段的条件活性生物蛋白为嵌合抗原受体的一部分。在另一个实施方案中,本发明提供了一种包含条件活性生物蛋白和药学上可接受的载体的药物组合物。附图说明图1为根据本发明的一个实施方案的嵌合抗原受体的示意图。ASTR为抗原特异性靶向区(targetingregion),L为接头,ESD为胞外间隔结构域,TM为跨膜结构域,CSD为共刺激结构域,ISD为细胞内信号传导结构域。图2和3显示将实施例7的条件活性抗体表达为二价抗体或一价抗体在pH6.0和pH7.4以上未显著地改变这些抗体的选择性。图4为尺寸排阻色谱谱图,其表明实施例8的条件活性抗体不聚集。图5显示了通过表面等离子体共振(SPR)测定法测量的实施例8的条件活性抗体的结合速率和解离速率(onandoffrates)。图6A-6B显示了通过实施例8的SPR测定法测量的条件活性抗体的选择性。定义为了便于理解本文提供的实例,将对一些频繁出现的方法和/或术语在本文中进行定义。本文中使用的与测定量有关的术语“约”是指测定量的正常变化,其可由本领域熟练技术人员进行测量和实施与测量目的和测量仪器精度相称的关注等级(levelofcare)所预料。除非另有说明,“约”是指所提供值的变化为+/-10%。本文中使用的术语“试剂”是指一种化合物、化合物的混合物、空间定位化合物系列(例如,VLSIPS肽系列、多核苷酸系列和/或组合小分子系列)、生物大分子、噬菌体肽展示文库、噬菌体抗体(例如,scFv)展示文库、多核糖体肽展示文库或从生物材料,如细菌、植物、真菌或动物(特别是哺乳动物)的细胞或组织中获得的提取物。在下面描述的筛选试验中评价试剂的潜在酶活性。在下面描述的筛选试验中评价试剂作为条件活性生物治疗性酶的潜在活性。限制位点中的“多义碱基需要(ambiguousbaserequirement)”是指不限定为最大范围的核苷酸碱基需要,即不限于特定的碱基(如,在非限制性的实例中,特定的碱基选自A、C、G和T),而可以是至少两种或两种以上碱基中的任一种。本领域以及本文中使用的普遍接受的缩写,代表以下碱基的多义包括:R=G或A;Y=C或T;M=A或C;K=G或T;S=G或C;W=A或T;H=A或C或T;B=G或T或C;V=G或C或A;D=G或A或T;N=A或C或G或T。本文中使用的术语“氨基酸”是指任何含有氨基(-NH2)和羧基(-COOH)的有机化合物;优选为自由基或聚合后作为肽键的一部分。本领域已知的“二十个自然编码的多肽-形成α-氨基酸”是指:丙氨酸(ala或A)、精氨酸(arg或R)、天冬酰胺(asn或N)、天冬氨酸(asp或D)、半胱氨酸(cys或C)、谷氨酸(glu或E)、谷氨酰胺(gln或Q)、甘氨酸(gly或G)、组氨酸(his或H)、异亮氨酸(ile或I)、亮氨酸(leu或L)、赖氨酸(lys或K)、蛋氨酸(met或M)、苯丙氨酸(phe或F)、脯氨酸(pro或P)、丝氨酸(ser或S)、苏氨酸(thr或T)、色氨酸(trp或W)、酪氨酸(tyr或Y)和缬氨酸(val或V)。术语“扩增”是指多核苷酸的拷贝数增加。本文中使用的术语“抗体”是指能够结合抗原的表位的完整的免疫球蛋白分子以及免疫球蛋白分子的片段,例如Fab、Fab'、(Fab')2、Fv和SCA片段。这些抗体片段保留了作为其来源的抗体的一些选择性结合抗原(例如多肽抗原)的能力,可以使用本领域熟知的方法进行制备(参见例如Harlow和Lane,同上),并进一步描述如下。抗体可用于通过免疫亲和层析分离制备量的抗原。这种抗体的各种其它用途为诊断疾病和/或对疾病分期(例如瘤形成)和用于治疗疾病的治疗应用,所述疾病例如:瘤形成、自身免疫疾病、AIDS、心血管疾病、感染等。嵌合抗体、类人抗体、人源化抗体或全人源抗体特别有利于施用给人类患者。Fab片段由抗体分子的一价抗原结合片段组成,并且可以通过用木瓜蛋白酶消化完整抗体分子以产生由完整轻链和部分重链组成的片段来制备。抗体分子的Fab'片段可以通过用胃蛋白酶处理整个抗体分子,然后还原得到由完整轻链和部分重链组成的分子而获得。每个以这种方式处理的抗体分子获得两个Fab'片段。抗体的(Fab')2片段可以通过用胃蛋白酶处理整个抗体分子但不进行随后的还原而获得。(Fab')2片段是通过两个二硫键保持在一起的两个Fab'片段的二聚体。Fv片段定义为含有表达为两条链的轻链可变区和重链可变区的基因工程片段。术语“血-脑屏障”或“BBB”是指外周循环与脑和脊髓之间的生理屏障,其通过脑毛细血管内皮质膜内的紧密连接形成,产生了限制分子(甚至非常小的分子例如尿素(60道尔顿))运输进入脑的牢固屏障。脑内的血-脑屏障、脊髓内的血-脊髓屏障和视网膜内的血-视网膜屏障为中枢神经系统(CNS)内的连续毛细血管屏障,并且在本文中统称为“血-脑屏障”或“BBB”。BBB还包括血-脑脊髓液屏障(脉络丛),其中屏障由室管膜细胞而不是毛细血管内皮细胞组成。术语“细胞产生宿主”或“生产宿主”是指用于生产或制造蛋白质的细胞系。真核细胞产生宿主如哺乳动物细胞,包括但不限于人、小鼠、仓鼠、大鼠、猴细胞系以及酵母、昆虫和植物细胞系。或者可以使用原核细胞产生宿主。在一个方面,哺乳动物细胞产生宿主选自3T3小鼠成纤维细胞;BHK21叙利亚仓鼠成纤维细胞;MDCK,狗上皮细胞;Hela人上皮细胞;PtK1鼠袋鼠上皮细胞;SP2/0小鼠浆细胞;和NS0小鼠浆细胞;HEK293人胚胎肾细胞;COS猴肾细胞;CHO中国仓鼠卵巢细胞、CHO-S中国仓鼠卵巢细胞;R1小鼠胚胎细胞;E14.1小鼠胚胎细胞;H1人胚胎细胞;H9人胚胎细胞;PERC.6人胚胎细胞。在另一方面,真核细胞产生宿主为GS-NS0或GS-CHOK1细胞系。在另一方面,真核细胞产生宿主选自酿酒酵母细胞(S.cerevisiaeyeastcells);和毕赤酵母细胞(picchiayeastcells)。在另一方面,细胞产生宿主为细菌细胞系。如本文中使用的术语“癌症”和“癌的”是指或描述哺乳动物中通常以不受调节的细胞生长为特征的生理状况。癌症的实例包括但不限于B细胞淋巴瘤(霍奇金淋巴瘤和/或非霍奇金淋巴瘤)、脑肿瘤、乳腺癌、结肠癌、肺癌、肝细胞癌、胃癌、胰腺癌、子宫颈癌、卵巢癌、肝癌、膀胱癌、尿道癌、甲状腺癌、肾癌、癌、黑素瘤、头颈癌、脑癌和前列腺癌,包括但不限于雄激素依赖性前列腺癌和雄激素非依赖性前列腺癌。如本文中使用的术语“嵌合抗原受体”或“CAR”或“CAR”是指将抗原特异性移植到细胞毒性细胞例如T细胞、NK细胞和巨噬细胞上的工程化受体。本发明的CAR可以包含至少一个抗原特异性靶向区(ASTR)、胞外间隔结构域(ESD)、跨膜结构域(TM)、一个或多个共刺激结构域(CSD)和细胞内信号传导结构域(ISD)。在一个实施方案中,ESD和/或CSD是任选的。在另一个实施方案中,CAR为双特异性CAR,其对两种不同的抗原或表位具有特异性。在ASTR特异性结合靶抗原后,ISD激活细胞内信号传导。例如,ISD可以以非MHC限制的方式将T细胞特异性和反应性重定向至选择的靶标,从而开发抗体的抗原结合特性。非MHC限制性抗原识别使得表达CAR的T细胞具有独立于抗原加工识别抗原的能力,从而绕过肿瘤逃避的主要机制。此外,当在T细胞中表达时,CAR有利地不与内源性T细胞受体(TCR)α和β链二聚化。具有“嵌合特性”的分子是指这样的分子:1)与第一参考分子部分同源和部分异源;且2)同时与第二参考分子部分同源和部分异源;而不具有3)预先排除同时与一种或多种其它参考分子部分同源和部分异源的可能性。在一个非限制性的实施方案中,嵌合分子可以通过组装重新排列的部分分子序列而制得。在一个非限制性的方面,嵌合多核苷酸分子可以通过使用大量分子模板来合成嵌合多核苷酸而制得,使得到的嵌合多核苷酸具有大量模板的特性。本文中使用的术语“同源(cognate)”是指物种间的演变和功能相关的基因序列。例如,但不限于,在人类基因组中人CD4基因是小鼠3d4基因的同源基因,因为这两个基因的序列和结构表明,它们具有较高的同源性,两个基因都编码一种在通过MHCⅡ类限制抗原识别而传递T细胞激活信号中发挥作用的蛋白。术语“商业规模”是指以适于转售的规模生产蛋白质或抗体。本文中使用的术语“比较窗口”是指至少20个连续核苷酸的概念片段(conceptualsegment),其中多核苷酸序列可以与至少20个连续核苷酸的参考序列进行比较,且比较窗口中的部分多核苷酸序列可包括与参考序列(其不包括添加或缺失)相比20%或低于20%的添加或缺失(即,缺口),使两条序列达到最适比对。用于比较窗口比对的最适比对序列可以按照史密斯局部同源性算法来进行(SmithandWaterman,1981“生物序列的比较(Comparisonofbiosequences)”,AdvApplMath,2:482-489;SmithandWaterman,1981,“重叠基因和信息理论(Overlappinggenesandinformationtheory)”,JTheorBiol,91:379-380;SmithandWaterman,JMolBiol,“普通分子序列的确定(Identificationofcommonmolecularsubsequences)”,1981,147:195-197;Smith等人,1981,“比较的生物序列的排列(Comparativebiosequencemetrics)”,JMolEvol,18:38-46),按照Needleman同源性比对算法来进行(Needleman和Wunsch,1970,“两个蛋白氨基酸序列的相似性搜索的一般适用方法(Ageneralmethodapplicabletothesearchforsimilaritiesintheaminoacidsequenceoftwoproteins)”JMolBiol,48(3):443-453),按照Pearson相似性搜索的方法来进行(PearsonandLipman,1988,“用于生物序列比较的改进工具(Improvedtoolsforbiologicalsequencecomparison)”,ProcNatAcadSciUSA,85:2444-2448),按照这些算法的计算机化运行来进行(GAP,BESTFIT,FASTA,andTFASTAintheWisconsinGeneticsSoftwarePackageRelease7.0,GeneticsComputerGroup,575ScienceDr.,Madison,Wis),或通过检查,根据选择的各种方法产生最佳比对(即,在比较窗口中形成最高同源百分数)。术语“条件活性生物蛋白(conditionallyactivebiologicprotein)”是指野生型蛋白的变体或突变,其在一种或多种正常生理条件下较亲本野生型蛋白活性高或低。这种条件活性蛋白还在身体的选定区域表现出活性,和/或在异常或允许的生理条件下表现出增加的或下降的活性。正常生理条件是温度、pH、渗透压、重量摩尔渗透压浓度、氧化应激和电解质浓度,它们在个体的给药部位或在个体作用部位的组织或器官中被认为是在正常范围内的。异常条件是指偏离了正常可接受范围的条件。在一个方面,条件活性生物蛋白在野生型条件下几乎是无活性的,但在除野生型条件之外是有活性的,其活性与野生型条件的活性相同或高于野生型条件的活性。例如,在一个方面,演变的条件活性生物蛋白在体温下几乎无活性,但在较低温度下有活性。在另一方面,条件活性生物蛋白在野生型条件下是可逆或不可逆失活的。在另一方面,野生型蛋白是一种治疗性蛋白。在另一个方面,条件活性生物蛋白用作药物或治疗剂。在另一个方面,所述蛋白在高含氧血液,例如,在流经肺后或在肾脏中发现的较低pH环境中,或多或少有活性。“保守氨基酸替换”是指具有相似侧链残基的可互换性。例如,一组具有脂肪族侧链的氨基酸:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;一组具有脂肪族羟基侧链的氨基酸:丝氨酸和苏氨酸;一组具有含酰胺侧链的氨基酸:天冬酰胺和谷氨酰胺;一组具有芳香侧链的氨基酸:苯丙氨酸、酪氨酸和色氨酸;一组具有碱性侧链的氨基酸:赖氨酸、精氨酸和组氨酸;以及一组具有含硫侧链的氨基酸:半胱氨酸和蛋氨酸。优选的保守氨基酸替换组为:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸和天冬酰胺-谷氨酰胺。本文中使用的术语“对应于”是指多核苷酸序列与全部或部分参考多核苷酸序列同源(即,是相同的、非严格演变相关的),或多肽序列与参考多肽序列是相同的。相比之下,本文中使用的术语“互补”是指其互补序列与全部或部分参考核苷酸序列同源。例如,核苷序列“TATAC”对应于参考序列“TATAC”,与参考序列“GTATA”互补。本文中使用的术语“共刺激配体”包括特异性结合T细胞上的同源共刺激分子的抗原呈递细胞(例如树突细胞、B细胞等)上的分子,由此除了例如通过TCR/CD3复合物与负载有肽的MHC分子的结合提供的第一信号之外还提供介导T细胞应答(包括但不限于增殖、活化、分化等)的信号。共刺激配体可以包括但不限于CD7、B7-1(CD80)、B7-2(CD86)、PD-L1、PD-L2、4-1BBL、OX40L、诱导型共刺激配体(ICOS-L)、细胞间粘附分子(ICAM)、CD30L、CD40、CD70、CD83、HLA-G、MICA、MICB、HVEM、淋巴毒素β受体、3/TR6、ILT3、ILT4、HVEM、与Toll配体受体特异性结合的激动剂或抗体以及特异性结合B7-H3的配体。共刺激配体还包括特异性结合存在于T细胞上的共刺激分子的抗体,例如但不限于CD27、CD28、4-1BB、OX40、CD30、CD40、PD-1、ICOS、淋巴细胞功能相关抗原-1(LFA-1)、CD2、CD7、LIGHT、NKG2C、B7-H3和与CD83特异性结合的配体。本文中使用的术语“共刺激分子”是指T细胞上的同源结合配偶体,其与共刺激配体特异性结合从而介导T细胞的共刺激反应,例如但不限于增殖。共刺激分子包括但不限于MHC1类分子、BTLA和Toll配体受体。如本文中使用的术语“共刺激信号”是指与第一信号(例如TCR/CD3连接)联合导致T细胞增殖和/或关键分子的上调或下调的信号。本文中使用的术语“细胞毒性细胞”是指可以损伤或破坏侵入的微生物、肿瘤细胞或其他患病组织细胞的细胞。该术语意在包括自然杀伤(NK)细胞、活化的NK细胞、嗜中性粒细胞、T细胞、嗜酸性粒细胞、嗜碱性粒细胞、B细胞、巨噬细胞和淋巴因子活化的杀伤(LAK)细胞等细胞类型。细胞毒性细胞通过抗体、受体、配体或其片段/衍生物与靶细胞结合以形成稳定的复合物,并刺激细胞毒性细胞以破坏靶细胞。术语“降解有效”量是指与不接触酶的底物相比,加工至少50%底物所需的酶量。本文中使用的术语“确定的序列框架”是指一组基于非随机选择的具体序列,一般基于实验数据或结构数据;例如,一个确定的序列框架,除其它变体外,可包括预测形成β片层结构的一组氨基酸序列,或可包括一个亮氨酸拉链七肽重复基序(motif)、一个锌指结构域。“确定的序列核”是包括有限范围可变性的一组序列。而(1)20个常规氨基酸的完全随机10-mer序列可以是(20)10个序列中的任一条序列,以及(2)20个常规氨基酸的伪随机10-mer序列可以是(20)10个序列中的任一条序列,但表现出特定位置和/或整体的特定残基有偏差,(3)如果各残基位被允许是20个常规氨基酸(和/或允许的非常规氨基/亚氨基酸)中的任一个,则确定的序列核是序列的子序列。确定的序列核一般包括变化和未发生变化的残基位,和/或包括变化的残基位,该变化的残基位可包括一个选自氨基酸残基的确定子集的残基等,或者选自从序列库中筛选出的单独序列的片段或全长中的残基。确定的序列核可以指氨基酸序列或多核苷酸序列。确定的序列核的实例为,但不限于,序列(NNK)10和(NNM)10,其中,N代表A、T、G或C;K代表G或T;以及M代表A或C。DNA的“消化”是指用仅在DNA的某些序列发挥作用的限制酶催化DNA的裂解(cleavage)。本文中使用的各种限制酶可市售获得,它们采用的反应条件、辅助因子和其它条件是本领域普通技术人员已知的。为了进行分析,一般向含有1微克质粒或DNA片段的约20微升缓冲液中加入约2单位的酶。为了分离用于构建质粒的DNA片段,一般在较大体积中用20至250单位的酶消化5至50微克的DNA。合适的缓冲液和用于特定限制酶作用的底物量由制造商指定。通常在37℃进行孵育,时间约1小时,但按照供应商的说明可能会有所不同。消化结束后,反应物直接在凝胶上进行电泳,分离出所需的片段。“定向连接”是指其中多核苷酸的5'端和3'端不同的连接,足以确定较佳的连接方向。例如,具有两个钝末端的未经处理的和未消化的PCR产物,在连接至经消化的多克隆位点处形成钝末端的克隆载体中时,一般没有较佳的连接方向;因而,在这些情况下一般不会出现定向连接。相比之下,一般在具有用EcoRI处理的5'端和用BamHI处理的3'端的经消化的PCR产物连接至多克隆位点用EcoRI和BamHI消化的克隆载体中时,出现定向连接。如本文中使用的术语“遗传修饰的细胞毒性细胞靶向的疾病”包括本发明的遗传修饰的细胞对以任何方式参与任何疾病的任何细胞的靶向,而不管遗传修饰的细胞是靶向病变细胞还是健康细胞以实现治疗有益的结果。遗传修饰的细胞包括但不限于遗传修饰的T细胞、NK细胞和巨噬细胞。经遗传修饰的细胞表达本发明的CAR,所述CAR可靶向靶细胞表面上表达的任何抗原。可靶向的抗原的实例包括但不限于在B细胞上表达的抗原;在癌、肉瘤、淋巴瘤、白血病、生殖细胞肿瘤和母细胞瘤上表达的抗原;在各种免疫细胞上表达的抗原;和在与各种血液病、自身免疫疾病和/或炎性疾病相关的细胞上表达的抗原。可以靶向的其它抗原对于本领域技术人员是显而易见的,并且其可以由与其他实施方案相关的本发明的CAR靶向。本文中使用的术语“DNA改组(shuffling)”是指基本上同源但不完全相同的序列之间的重组,在一些实施方案中,DNA改组可包括通过非同源重组交叉(crossover),如通过cer/lox和/或flp/frt系统等。DNA改组可以是随机或者非随机的。术语“药物”或“药物分子”是指包括一种将其对人体或动物体给药时对人体或动物体产生有利效果的物质的治疗剂。优选地,所述治疗剂包括可以治疗、治愈或缓解人体或动物体中一种或多种症状、疾病或异常情况的物质或可以增进人体或动物体健康的物质。“有效量”是指向活的有机体给药一段时间,对于治疗或预防活的有机体内疾病有效的条件活性生物蛋白或片段的量,例如在所需的给药间隔期内,提供治疗的效果。本文中使用的术语“电解质”的含义为在血液或其它体液中带有电荷的矿物质(mineral)。例如,在一个方面,正常生理条件和异常条件可以是“电解质浓度”的条件。在一个方面,待测电解质浓度选自一种或多种离子化的钙、钠、钾、镁、氯、碳酸氢盐和磷酸盐浓度。例如,在一个方面,血清钙的正常范围为8.5至10.2mg/dL。在这方面,异常的血清钙浓度可以在高于或低于正常范围内选择。在另一个实例中,在一个方面,血清氯的正常范围是每升96-106毫当量(mEq/L)。在这方面,异常的血清氯浓度可以在高于或低于正常范围内选择。在另一个实例中,在一个方面,血清镁的正常范围是从1.7-2.2mg/dL。在这方面,异常的血清镁浓度可以在高于或低于正常范围内选择。在另一个实例中,在一个方面,血清磷的正常范围是从2.4到4.1mg/dL。在这方面,异常的血清磷浓度可以在高于或低于正常范围内选择。在另一个实例中,在一个方面,正常的血清或血液中钠的范围是从135到145mEq/L。在这方面,异常的血清或血液中钠浓度可以在高于或低于正常范围内选择。在另一个实例中,在一个方面,正常的血清或血液中钾的范围是从3.7到5.2mEq/L。在这方面,异常的血清或血液中钾浓度可以在高于或低于正常范围内选择。在另一个方面,正常的血清碳酸氢盐范围是从20到29mEq/L。在这方面,异常的血清或血液中碳酸氢盐的浓度可以在高于或低于正常范围内选择。在一个不同的方面,碳酸氢盐水平可以用来指示血液中酸度的正常水平(pH)。术语“电解质浓度”也可以用来定义除血液或血浆以外的组织或体液中特定电解质的条件。在这种情况下,正常生理条件被认为是该组织或液体的临床正常范围。在这方面,异常的组织或体液的电解质浓度可以在高于或低于正常范围内选择。本文中使用的术语“抗原表位”是指抗原如酶多肽上的抗原决定簇,抗体互补位如酶的特异性抗体结合到抗原决定簇上。抗原决定簇通常是由分子的化学活性表面组合如氨基酸或糖侧链组成的,可具有特定的三维结构特点以及特定的电荷特性。本文中使用的“抗原表位”是指能够形成相互结合作用(bindinginteraction)的抗原或其它大分子的那部分,其与抗体的可变区结合体相互作用。通常情况下,这种相互结合作用表现为与CDR的一个或多个氨基酸残基的分子间接触。本文中使用的“酶”是具有特定催化性能的蛋白。例如底物浓度、pH、温度和有无抑试剂存在等因素可以影响催化的速率。通常情况下,对于野生型酶,Q10(温度系数)以温度上升10℃描述反应速率的增加。对于野生型酶,Q10=2到3;换言之,温度每上升10℃反应速率提高到两倍或三倍。在高温下,蛋白变性。在pH值与酶的最佳pH值略有不同时,酶以及也许底物分子所带电荷发生微小变化。离子的变化可以影响底物分子的结合。在极端的pH水平,酶会发生变性,其活性位点被破坏,不再适合底物分子。本文中使用的术语“演变(evolution)”或“演变(evolving)”是指使用一种或多种诱变方法,产生编码新多肽的新多核苷酸,新多肽本身就是一种改进的生物分子和/或有助于另一种改进的生物分子的生成。在一个特定的非限制性方面,本发明涉及从亲本野生型蛋白中演变出条件活性生物蛋白。例如,在一个方面,演变涉及采用美国专利申请公开号2009/0130718(通过参考并入于此)中公开的非随机的多核苷酸嵌合(chimerization)和非随机的定点诱变的方法。更具体地,本发明提供在正常生理条件下较野生型酶亲本分子表现出活性下降,而在一种或多种异常条件下较野生型酶表现出活性增强的条件活性生物酶的演变方法。当术语“片段”、“衍生物”和“类似物”对照参考多肽时,包括保留至少一种至少在本质上与参考多肽相同的生物功能或活性的多肽。此外,术语“片段”、“衍生物”或“类似物”的实例是分子的“前体形式”,如低活性蛋白原(proprotein),其可通过切割修饰而产生具有显著高活性的成熟酶。本文提供了一种由模板多肽生成一组其中在各氨基酸位表现出“单个氨基酸全方位替换”的后代多肽(progenypolypeptide)的方法。本文中使用的“单个氨基酸全方位替换”是关于本文中所描述的20个自然编码的多肽形成的α-氨基酸。术语“基因”是指参与产生多肽链的DNA片段;它包括编码区之前和之后的区域(前导区和拖尾区)以及各编码片段(外显子)之间的间隔序列(内含子)。本文中使用的“遗传不稳定”是指在减少事件(reductiveevents)过程中(其一般涉及通过重复序列的丢失使序列简化)高度重复序列被丢失的自然倾向。缺失往往涉及一个重复拷贝以及重复拷贝之间的一切序列的丢失。本文中使用的术语“遗传修饰的细胞”、“重定向的细胞”,“基因工程化细胞”或“修饰的细胞”是指表达本发明的条件性活性CAR的细胞。术语“异源”是指一条单链核酸序列无法与另一条单链核酸序列或其互补序列进行杂交。因而,异源区是指多核苷酸区或多核苷酸的序列中具有无法与另一条核酸或多核苷酸进行杂交的区或区域。这种区域或区例如为突变区。术语“同源(homologous)”或“部分同源(homeologous)”是指一条单链核酸序列可以与单链核酸序列的互补序列进行杂交。杂交的程度可能取决于许多因素,包括序列之间同一性数量和杂交条件如稍后讨论的温度和盐浓度。优选地,同一性区大于约5bp,更优选地,同一性区大于约10bp。本发明的益处延伸到“工业应用”(或工业生产过程),该术语用于包括在商业性工业中适当的应用(或简称工业)以及非商业性的工业应用(例如在非营利机构的生物医学研究中)。相关的应用包括那些诊断、医药、农业、制造业和学术界领域。术语“相同”或“同一性(identity)”是指两条核酸序列有相同的序列或互补序列。因而,“同一性区”,是指核苷酸或整条多核苷酸区域或区是相同的或与另一条多核苷酸序列区互补。本文中使用的术语“免疫细胞”是指哺乳动物免疫系统的细胞,包括但不限于抗原呈递细胞、B细胞、嗜碱性粒细胞、细胞毒性T细胞、树突状细胞、嗜酸性粒细胞、粒细胞、辅助T细胞、白细胞、淋巴细胞、巨噬细胞、肥大细胞、记忆细胞、单核细胞、自然杀伤细胞、嗜中性粒细胞、吞噬细胞、浆细胞和T细胞。本文中使用的术语“免疫应答”是指包括但不限于先天免疫、体液免疫、细胞免疫、免疫、炎症反应、获得性(适应性)免疫、自身免疫和/或过度免疫的免疫。术语“分离的”是指该物质被从原来的环境(例如,自然环境,如果它是天然存在的)中移出。例如,存在于活体动物中自然产生的核苷酸或酶是未分离的,但从天然系统中共存的部分或全部物质中分离出的相同的核苷酸或酶是分离的。这种多核苷酸可以是载体的一部分,和/或这种多核苷酸或酶可以是组合物的一部分,由于这种载体或组合物不是其天然环境的一部分,其仍然是分离的。使用术语“分离的核酸”用来定义与5'和3'侧翼序列不紧密连接的核酸,例如DNA或RNA分子,而在衍生其的有机体中天然产生的基因组中通常是紧密连接的。因而,该术语描述为,例如,整合至载体如质粒或病毒载体中的核酸;整合至异源细胞基因组(或同源细胞基因组,但位点不同于其天然发生的位点)中的核酸;以及作为单独分子存在的核酸,例如通过PCR扩增或限制酶切产生的DNA片段,或通过体外转录产生的RNA分子。该术语还描述了形成编码其它多肽序列的杂交基因一部分的重组核苷酸,该其它多肽可用于例如产生融合蛋白。本文使用的术语“慢病毒”是指逆转录病毒科的一个属。慢病毒在逆转录病毒中是独特的,其能够感染非分裂细胞;它们可以将大量的遗传信息递送到宿主细胞的DNA中,因此它们是递送基因递送载体的最有效方式之一。HIV、SIV和FIV都是慢病毒的实例。来源于慢病毒的载体提供在体内实现显著水平的基因转移的手段。本文中使用的“配体”是指可被特定受体识别的分子,如随机肽或可变区序列。本领域的熟练技术人员应知道,分子(或大分子复合物)既可以是受体也可以是配体。在一般情况下,具有较小分子量的结合体是指配体,具有较大分子量的结合体是指受体。“连接”是指两条双链核酸片段之间形成磷酸二酯键的过程(Sambrook等人,(1982).分子克隆:分子克隆手册,冷泉港实验室(MolecularCloning:ALaboratoryManual.ColdSpringHarbourLaboratory),ColdSpringHarbor,NY.,p.146;Sambrook等人,分子克隆:分子克隆手册,第二版(MolecularCloning:alaboratorymanual,2ndEd.),ColdSpringHarborLaboratoryPress,1989)。除另有规定外,连接可采用已知的缓冲液和条件来完成,用10个单位的T4DNA连接酶(“连接酶”)连接每0.5微克约等摩尔量的DNA片段。本文中使用的“接头”或“间隔子”是指连接两个分子如DNA结合蛋白和随机肽的分子或分子组合,以使两个分子处于较佳的构型,例如,以使随机肽以最小空间位阻与DNA结合蛋白的受体结合。术语“哺乳动物细胞表面展示”是指出于筛选目将蛋白质或抗体或抗体的一部分在哺乳动物宿主细胞表面上表达并展示的技术;例如通过磁珠和荧光活化细胞分选的组合筛选特异性抗原结合。一方面,哺乳动物表达载体用于同时表达分泌形式和细胞表面结合形式的免疫球蛋白,如在DuBridgeetal.,US2009/0136950中所述,该文献通过引用并入本文。另一方面,所述技术用于病毒载体编码以获得在细胞中表达时展示在细胞膜上的抗体或抗体片段的文库,如Gaoetal.,US2007/0111260中所述,该文献通过引用并入本文。哺乳动物细胞上的全IgG表面展示是已知的。例如,Akamatsuu等人开发了一种哺乳动物细胞表面展示载体,适合基于其抗原结合亲和力和生物活性直接分离IgG分子。使用Epstein-Barr病毒衍生的附加型(episomal)载体,将抗体文库作为完整的IgG分子展示在细胞表面上,并通过磁珠和荧光活化细胞分选的组合筛选特异性抗原结合。从分选的细胞中回收编码具有所需结合特征的抗体的质粒,并将其转化为适于产生可溶性IgG的形式。参见Akamatsuuetal.J.Immunol.Methods,vol.327,第40-52页,2007,该文献通过引用并入本文。Ho等人将广泛用于瞬时蛋白表达的人胚肾293T细胞用于单链Fv抗体的细胞表面展示以进行亲和力成熟。从表达具有较低亲和力的WT抗体的大量的过量细胞中通过单程细胞分选将表达具有更高亲和力的稀有突变体抗体的细胞富集240倍。此外,在对使抗体热点随机化的组合文库进行单个选择后,获得对CD22具有增强的结合亲和力的高度富集的突变体。参见Hoetal.,“Isolationofanti-CD22FvwithhighaffinitybyFvdisplayonhumancells(通过人细胞上的Fv展示分离具有高亲和性的抗-CD22Fv)”ProcNatlAcadSciUSA,vol.103,pages9637–9642,2006,该文献通过引用并入本文。也可以使用对抗原具有特异性的B细胞。这样的细胞可以直接从人供体的外周血单核细胞(PBMC)中分离。从该B细胞库产生重组的抗原特异性单链Fv(scFv)文库,并使用Sindbis病毒表达系统通过哺乳动物细胞表面展示进行筛选。该方法允许通过单轮FACS分离抗原特异性抗体。从阳性克隆和作为完整IgG或Fab片段产生的重组全人源抗体中分离重链(HC)和轻链(LC)的可变区(VR)。以这种方式,分离了几种结合Qβ病毒样颗粒(VLP)的超突变高亲和力抗体、模型病毒抗原以及对尼古丁具有特异性的抗体。所有抗体在细胞培养物中显示高表达水平。在小鼠模型中对人尼古丁特异性单克隆抗体(mAb)进行了临床前验证。参见Beerlietal.,“Isolationofhumanmonoclonalantibodiesbymammaliancelldisplay(通过哺乳动物细胞展示分离人单克隆抗体)”,ProcNatlAcadSciUSA,vol.105,第14336–14341页,2008,该文献通过引用并入本文。酵母细胞表面展示也可以用于本发明,例如,参见KondoandUeda,“Yeastcell-surfacedisplay-applicationsofmoleculardisplay(分子展示的酵母细胞表面展示应用)”,Appl.Microbiol.Biotechnol.,第64卷,第28-40页,2004,其描述了例如使用酿酒酵母的细胞表面工程系统。在酿酒酵母中表达的几种代表性展示系统描述于Leeetal,“Microbialcell-surfacedisplay(微生物细胞表面展示),”TRENDSinBitechnol.,第21卷,第45-52页,2003;以及BoderandWittrup,"Yeastsurfacedisplayforscreeningcombinatorialpolypeptidelibraries(用于筛选组合多肽文库的酵母细胞展示),”NatureBiotechnol.,第15卷,第553页,1997。术语“生产”是指以足够的量产生蛋白质,该量足以允许治疗性蛋白的至少I期临床测试或足以用于诊断性蛋白质的监管批准。本文中使用的“微环境”是指与身体的组织或区的其它区域具有持续的或暂时的、生理的或化学的差异的组织或身体的任何部位或区域。本文中使用的“要被演变的分子特性”包括含有多核苷酸序列的分子,含有多肽序列的分子,含有部分多核苷酸和部分多肽序列的分子。与被演变的分子特性特别相关的,但绝不限于以下实例,包括:特定条件下蛋白的活性,如涉及温度;盐度;渗透压;pH;氧化以及甘油、二甲基亚砜、去污剂和/或在反应环境中接触的任何其它分子种类的浓度。其它的与被演变的分子特性特别相关的,但绝不限于以下实例,包括稳定性,例如在经过曝露于特定环境一段时间后表现出的剩余的分子特性,如在存储过程中会遇到的情况。本文中使用的术语“多特异性抗体”是对至少两种不同表位具有结合亲和力的抗体。可以将多特异性抗体作为全长抗体或抗体片段(例如F(ab')2双特异性抗体)进行制备。工程化抗体可以结合两种、三种或更多种(例如四种)抗原(参见例如US2002/0004587A1)。可以将一个条件性活性抗体工程化为多特异性抗体,或者将两个抗体工程化以包含结合两种抗原的异源二聚体。多特异性抗体也可以是多功能的。术语“突变(mutation)”是指在野生型核酸序列中序列的变化或在肽序列中序列的变化。这种突变可以是点突变,如转换或颠换。所述突变可以是缺失、插入或重复。本文中使用的简并“N,N,G/T”核苷序列代表32种可能的三联体,其中“N”可以是A、C、G或T。本文中使用的术语“天然存在”所适用的对象所指事实为可以在自然界中发现的对象。例如,存在于生物体(包括病毒)中的多肽或多核苷酸序列为天然存在的,其可以从自然的来源中分离,且未在实验室中被人为地有意改造过。一般而言,术语天然存在是指对象存在于非病理(未病变)的个体中,这在物种中是普遍存在的。本文中使用的“正常生理条件”或“野生型工作条件”是指那些在个体的给药部位或在个体作用部位将被考虑的正常范围内的条件:温度、pH、渗透压、重量摩尔渗透压浓度、氧化应激和电解质浓度。本文中使用的“核酸分子”由至少一个碱基或一个碱基对组成,这取决于它是否分别是单链或双链。此外,核酸分子可能唯一地(exclusively)或嵌合地(chimerically)属于任一组含有核苷的分子,作为实例但不限于以下组的核酸分子:RNA、DNA、基因组核酸、非基因组核酸、天然存在的和非天然存在的核酸以及合成的核酸。通过非限制性举例的方式,这包括与任何细胞器如线粒体、核糖体RNA和由不随天然存在的成分一起天然存在的一种或多种成分嵌合组成的核酸分子相关的核酸。此外,“核酸分子”可部分包含一种或多种基于非核苷的成分,作为实例但不限于氨基酸和糖类。因而,通过举例的方式,但不限于此,核酶是部分基于核苷和部分基于蛋白,被认为是“核酸分子”。此外,通过示例的方式,但不限于此,用可检测到的基团,如放射性的或者非放射性的标记来标记核酸分子,同样被认为是“核酸分子”。术语“编码特定酶的核酸序列”或特定酶的“DNA编码序列”或“编码特定酶的核苷酸序列”,以及其它同义词是指DNA序列被置于适当的调控序列控制下,被转录并翻译成酶。“启动子序列”是能够在胞内结合RNA聚合酶的DNA调控区,并启动下游(3'方向)编码序列的转录。启动子是DNA序列的一部分。在该序列的3'端具有起始密码子。该启动子序列包括最低数目的碱基,这种组成对于在高于背景的可检测到的水平上起始转录是必须的。然而,在RNA聚合酶结合序列且从起始密码子(启动子的3'端)开始转录之后,转录朝着下游的3'方向进行。在该启动子序列内会找到转录起始位点(可方便地由核酸酶S1图谱确定)以及负责结合RNA聚合酶的蛋白结合域(共有序列)。术语“编码酶(蛋白)的核酸”或“编码酶(蛋白)的DNA”或“编码酶(蛋白)的多核苷酸”和其它同义词包括仅含有酶的编码序列的多核苷酸以及含有其它编码和/或非编码序列的多核苷酸。在一个优选的实施方案中,“特定的核酸分子种类”是由其化学结构,例举但不限于,其一级结构来确定的。在另一个优选的实施方案中,特定的“核酸分子种类”是由该类核酸的功能或由衍生自该类核酸的产物的功能来确定的。因而,通过非限制性举例的方式,“特定的核酸分子种类”可由归属于它的一种或多种活性或性质来确定的,包括归属于它的表达产物的活性或性质来确定的。“将工作的核酸样品组装至核酸库中”的即时定义包括将核酸样品整合至基于载体的集合(collection)的过程,如通过连接至载体并转化宿主。相关载体、宿主和其它试剂以及它们具体的非限制性实例的说明在下文中提供。“将工作的核酸样品组装至核酸库中”的即时定义还包括将核酸样品整合至非基于载体的库的过程,如通过连接至接头(adaptor)。优选地,接头能够与PCR引物退火,以便于PCR扩增。因此,在非限制性的实施方案中,“核酸库”是由一种或几种核酸分子的基于载体的集合组成。在另一个优选的实施方案中,“核酸库”是由核酸分子的非基于载体的集合组成。而在另一个优选的实施方案中,“核酸库”是由部分基于载体和部分基于非载体的核酸的组合集合组成。优选地,根据各核酸分子种类,含有库的分子集合是可查询的且可分离的。本发明提供“核酸构建体”或“核苷酸构建体”或“DNA构建体”。本文中使用的术语“构建体”是用以描述可任选地与一种或多种其它分子基团如载体或载体进行化学结合的分子,如多核苷酸(例如,酶多核苷酸)。在一个具体的但绝非限制性的方面,核苷酸构建体的实例是适于宿主细胞转化的DNA表达构建体。“寡核苷酸”(或同义的“寡”)是指可化学合成的单链多聚脱氧核苷酸或两条互补的多聚脱氧核苷酸链。这种合成的寡核核苷酸可以带有或不带有5'磷酸。在激酶存在下不随ATP加入磷酸,那些不带有5'磷酸的寡核核苷酸不会与另一条寡核苷酸连接。合成的寡核苷酸会与未被去磷酸化的片段连接。为了实现基于聚合酶的扩增(如通过PCR),提到“32倍简并寡核苷酸是连续地(inseries)由至少第一同源序列、简并N,N,G/T序列和第二同源序列组成。”本文中使用的“同源”是关于基于聚合酶扩增的寡核苷酸和亲本多核苷酸之间的同源性。本文中使用的术语“可操作连接的”是指功能关系中的多核苷酸元件之间的连接。当核酸被置于与另一条核酸序列的功能关系中时,它是“可操作连接的”。例如,如果启动子或增强子影响到编码序列的转录,则它与该编码序列是可操作连接的。可操作连接是指被连接的DNA序列通常是连续的,且在需要连接两个蛋白质编码区时是连续的并位于阅读框内。编码序列“可操作连接至”另一条编码序列,则RNA聚合酶转录这两条编码序列为一条mRNA,然后其被翻译成一条含有来自两条编码序列的氨基酸的多肽。只要表达的序列被最终加工成所需的蛋白,编码序列不必与另一条编码序列是连续的。本文中使用的术语“亲本多核苷酸组合”是由一种或多种不同的核苷酸组成的组合。通常该词用于关于优选通过诱变处理亲本组合获得的后代多核苷酸组合,在这种情况下,术语“亲本”、“起始物”和“模板”可互换使用。术语“患者”或“受试体”是指作为治疗对象的动物,例如哺乳动物如人。所述受试体或患者,可能是雄性或雌性。本文中使用的术语“生理条件”是指温度、pH、渗透压、离子强度、粘度等生化参数,其与活有机体相容和/或通常存在于活的酵母培养细胞或哺乳动物细胞的细胞内。例如,在典型的实验室培养条件下生长的酵母细胞的胞内条件是生理条件。用于体外转录混合物(cocktails)的合适体外反应条件一般是生理条件。通常体外生理条件包括50-200mMNaCl或KCl,pH6.5-8.5,20-45℃和0.001-10mM二价阳离子(例如Mg++、Ca++);优选约150mMNaCl或KCl,pH7.2-7.6,5mM二价阳离子,而且往往包括0.01-1.0%的非特异性蛋白(例如,牛血清白蛋白(BSA))。往往存在非离子型去污剂(吐温、NP-40、TritonX-100),通常约0.001-2%,典型地为0.05-0.2%(v/v)。特定的水溶液条件由医生按常规方法选择。对于一般性的指导,以下缓冲的水溶液条件可以适用:10-250mMNaCl,5-50mMTrisHCl,pH5-8,任选加入二价阳离子和/或金属螯合剂和/或非离子型去污剂和/或膜组分和/或消泡剂和/或闪烁材料(scintillant)。在一些实施方案中,缓冲液可含有BSA、碳酸盐、碳酸氢盐、氯化物盐等中的至少一种。正常生理条件是指病人或个体体内给药部位或作用部位的温度、pH、渗透压、重量摩尔渗透压浓度、氧化应激和电解质的浓度,其被考虑到是在病人体内的正常范围内。本文中采用标准惯例(Standardconvention)(5'到3')来描述双链多核苷酸的序列。本文中使用的术语“群(population)”是指如多核苷酸、多核苷酸的部分或多核苷酸或蛋白成分的集合。“混合的群”是指属于相同的核酸或蛋白家族(即,是相关的)但序列不同(即,不同源)因而生物活性不同的成分的集合。具有“前体形式”的分子是指经过一种或多种共价和非共价化学修饰(例如糖基化、蛋白水解裂解、二聚化或寡聚化、温度诱导或pH诱导的构象变化、与辅因子相连等)的任何组合的分子,从而获得较参考前体分子更成熟的性质不同(例如活性增加)的分子形式。当两种或两种以上的化学修饰(例如两种蛋白水解裂解或一种蛋白水解裂解和一种去糖基化)能够被区分,从而产生成熟的分子,所述参考前体分子可被称为“原前体形式(pre-pro-form)”的分子。本文中使用的术语“伪随机”是指具有有限可变性的一组序列,例如,在另一个位置的残基可变性程度,但任何伪随机位置允许一定程度的残基变化,然而变化是有限的。本文中使用的“准重复单元(Quasi-repeatedunits)”是指将被重新排列的重复且被定义为不相同。事实上,该方法的提出不仅用于由相同起始序列诱变形成的几乎相同的编码单元,还用于某些区显著不同的类似或相关序列的重新排列。然而,如果序列中含有足够的可被该方法重新排列的同源序列,它们可被称为“准重复”单元。本文中使用的“随机肽库”是指编码一组随机肽的一组多核苷酸序列和由那些多核苷酸序列编码的随机肽的组合,以及含有那些随机肽的融合蛋白。本文中使用的“随机肽序列”是指由两种或两种以上的氨基酸单体组成且通过随机的(stochastic)或随机(random)方法构建的氨基酸序列。随机肽可包括含有不可变序列的框架(framework)或骨架(scaffolding)基序。本文中使用的“受体”是指对给定的配体具有亲和力的分子。受体可以是自然产生或人工合成的分子。受体可以其未改变的状态或与其它种类形成聚集体而应用。受体可直接或通过特定的结合物质共价或非共价连接于结合单元。受体的实例包括但不限于抗体,其包括单克隆抗体且能够与特定的抗原决定簇(如位于病毒、细胞或其它材料上)发生抗血清反应,细胞膜受体、碳水化合物和糖蛋白的复合物、酶和激素受体。本文中所用的术语“重组抗体”是指由包含编码抗体的核酸的重组宿主细胞表达的抗体(例如嵌合抗体、人源化抗体或人抗体或其抗原结合片段)。用于产生重组抗体的“宿主细胞”的实例包括:(1)哺乳动物细胞,例如中国仓鼠卵巢(CHO)细胞、COS细胞、骨髓瘤细胞(包括Y0和NS0细胞)、幼仓鼠肾(BHK)细胞、Hela细胞和Vero细胞;(2)昆虫细胞,例如sf9、sf21和Tn5;(3)植物细胞,例如属于烟草属的植物(例如烟草);(4)酵母细胞,例如属于酵母属(例如酿酒酵母)或曲霉属(例如黑曲霉)的酵母细胞;(5)细菌细胞,例如大肠杆菌细胞或枯草芽孢杆菌细胞等。“重组”酶是指通过重组DNA技术生产的酶,即通过将编码所需酶的外源DNA构建体转化的细胞产生的酶。“合成”的酶是指那些通过化学合成制备的酶。术语“相关的多核苷酸”是指多核苷酸的区域或区是相同的,且多核苷酸的区域或区是异源的。本文中使用的“减少重排(Reductivereassortment)”是指通过由重复序列介导的缺失(和/或插入)事件而产生的分子多样性的增加。下列术语用来描述两种或两种以上的多核苷酸序列之间的关系:“参考序列”、“比较窗口”、“序列同一性”、“序列同一性百分数”和“基本上的同一性”。“参考序列”是确定的、用作序列比较基础的序列;参考序列可以是一个较大序列的子序列,例如全长cDNA中的一段序列或序列表中给定的基因序列,或可包括完整的cDNA或基因序列。一般来说,参考序列的长度至少是20个核苷酸,通常至少是25个核苷酸,往往至少是50个核苷酸。由于两个多核苷酸可各自为(1)包括两个多核苷酸之间相似的序列(即,完整的多核苷酸序列的一部分)以及(2)可进一步包括两个多核苷酸之间不同的序列,两个(或两个以上)多核苷酸之间的序列比较一般是在“比较窗口”中通过比较两个多核苷酸的序列来进行,以确定和比较序列相似的局部区域。本文中使用的“重复指数(RI)”是指克隆载体中包含的准重复单元(quasi-repeatedunit)的平均拷贝数。术语“限制位点”是指显示限制酶发生作用所必须的识别序列,其包括催化切割位点。可知切割位点可包含于或不包含于含有低多义性序列(lowambiguitysequence)(即含有限制位点出现频率的主要决定因素的序列)的限制位点的一部分中。因而,在许多情况下,相关限制位点仅含有内部具有切割位点(例如EcoRI位点的G/AATTC)或紧邻切割位点(例如EcoRII位点的/CCWGG)的低多义性序列。在其它情况下,相关限制酶[例如EcoRI位点或CTGAAG(16/14)]包含具有外部切割位点(例如EcoRI位点的N.sub.16部分)的低多义性序列(例如Eco57I位点中的CTGAAG序列)。当提到酶(例如限制酶)“切割”多核苷酸时,它被理解为限制性酶催化或促进多核苷酸的裂解。在一个非限制性的方面,“可选择的多核苷酸”是由5'端区(或末端区域)、中间区域(即内部或中心区)和3'端区(或末端区域)组成的。如在所述的方面中所用,5'端区是位于5'多核苷酸末端(或5'多核苷酸尾)方向的区;因而它一部分或全部位于多核苷酸5'端的一半核苷酸内。同样,3'端区是位于3'多核苷酸末端(或3'多核苷酸尾)方向的区;因而它一部分或全部位于多核苷酸3'端一半核苷酸内。如该非限制性的示例中所用,可以是在任两个区或甚至全部三个区之间重叠的序列。在本文中使用的术语“单链抗体”是指包含多肽连接的VH结构域和VL结构域的多肽,VH结构域和VL结构域通常通过间隔肽连接,并且其可以在氨基末端和/或羧基末端包含其他的氨基酸序列。例如,单链抗体可以包含用于连接编码多核苷酸的系链(tether)区段。作为实例,scFv为单链抗体。单链抗体通常是由具有至少10个连续氨基酸的一个或多个多肽区段组成的蛋白质,该连续氨基酸基本上由免疫球蛋白超家族的基因编码(例如,参见TheImmunoglobulinGeneSuperfamily(免疫球蛋白基因超家族),A.F.WilliamsandA.N.Barclay,inImmunoglobulinGenes,T.Honjo,F.W.Alt,andTHE.Rabbits,eds.,(1989)Academicpress:SanDiego,Calif.,pp.361-368,该文献通过引用并入本文),最常由啮齿类、非人灵长类、禽、猪、牛、绵羊、山羊或人重链或轻链基因序列编码。功能性单链抗体通常含有足够部分的免疫球蛋白超家族基因产物,以便保持与特定靶分子(通常为受体或抗原(表位))结合的性质。如果它们彼此结合的亲和力要高于与其它非特异性分子的亲和力,则该分子对(例如,抗体-抗原对或核酸对)的成员被描述为彼此“特异性结合”。例如,对抗抗原的抗体与该抗原的结合比非特异性的蛋白更有效,可以描述为抗体特异性地结合抗原。(同样,如果核酸探针与靶核酸通过碱基配对作用(见上)形成了特异的二聚体,可以描述为核酸探针特异性地结合靶核酸。)本文中定义的“特异性杂交”是指在第一多核苷酸和第二多核苷酸(例如,具有与第一多核苷酸序列不同,但序列大致相同的多核苷酸)之间形成杂交,其中大致不相关的多核苷酸序列在该混合物中不形成杂交。术语“特定的多核苷酸”是指具有特定的终点和特定的核酸序列的多核苷酸。两个多核苷酸,其中一个多核苷酸具有与第二多核苷酸的一部分相同的序列,但末端不同,构成了两个不同的特定的多核苷酸。如本文中使用的术语“刺激”是指通过刺激分子(例如,TCR/CD3复合物)与其同源配体结合诱导的初级应答,从而介导信号转导事件,所述事件例如但不限于通过TCR/CD3复合物进行的信号转导。刺激可介导某些分子的改变的表达,例如TGF-β的下调和/或细胞骨架结构的重组等。本文中使用的术语“刺激分子”是指T细胞上与存在于抗原呈递细胞上的同源刺激配体特异性结合的分子。本文中使用的术语“刺激配体”是指当存在于抗原呈递细胞(例如树突细胞,B细胞等)上时可与T细胞上的同源结合配偶体(在本文中称为“刺激分子”)特异性结合从而介导T细胞的初级应答的配体,初级应答包括但不限于激活、启动免疫应答以及增殖等。刺激配体是本领域公知的,并且尤其包括负载有肽的MHCI类分子、抗CD3抗体、超级激动剂抗CD28抗体和超级激动剂抗CD2抗体。本文使用的术语“靶细胞”是指与参与疾病并且可以被本发明的遗传修饰的细胞毒性细胞(包括但不限于遗传修饰的T细胞、NK细胞和巨噬细胞)靶向的细胞。其它靶细胞对本领域技术人员是显而易见的,并且可以与本发明的替代实施方案结合使用。术语“T细胞”和“T淋巴细胞”可互换,并且在本文中作为同义语使用。实例包括但不限于初始T细胞、中枢记忆性T细胞、效应记忆性T细胞及其组合。如本文中使用的术语“转导”是指使用病毒载体将外源核酸引入细胞中。本文中使用的“转染”是指使用重组DNA技术将外源核酸引入细胞中。术语“转化”是指向宿主细胞引入“外源”(即外部或胞外)基因、DNA或RNA序列,使得宿主细胞表达引入的基因或序列以产生所需物质,例如由引入的基因或序列编码的蛋白质或酶。引入的基因或序列也可称为“克隆”或“外源”基因或序列,可包括调节或控制序列,例如起始序列、终止序列、启动子序列、信号序列、分泌序列或细胞遗传机制使用的其它序列。基因或序列可以包括非功能性序列或无已知功能的序列。接受和表达引入的DNA或RNA的宿主细胞已经“转化”并且是“转化体”或“克隆”。引入宿主细胞的DNA或RNA可以来自任何来源,包括与宿主细胞相同的属或种的细胞,或不同属或种的细胞。“严格杂交条件”是指两条序列之间仅当同一性为至少90%,优选至少95%,更优选至少97%时才发生的杂交。见Sambrook等人,分子克隆:分子克隆手册第二版,冷泉港实验室出版社,1989年(MolecularCloning:alaboratorymanual,2ndEd.,ColdSpringHarborLaboratoryPress,1989),以参阅的方式全文并入于此。本发明中还包括具有序列与酶多肽的序列“基本上相同(substantiallyidentical)”的多肽。“基本上相同”的氨基酸序列是仅由于保守氨基酸替换形成的与参考序列不同的序列,例如,将同一类的一种氨基酸替换为另一种氨基酸(例如,将一种疏水性氨基酸,如异亮氨酸、缬氨酸、亮氨酸或蛋氨酸替换为另一种,或将一种极性氨基酸替换为另一种,如精氨酸替换为赖氨酸、谷氨酸替换为天冬氨酸,或谷氨酰胺替换为天冬酰胺)。其它“基本上相同”的氨基酸序列是与参考序列或由于一种或多种非保守替换、缺失或插入,特别是当替换发生在分子的非活性位点时,所形成的不同的序列,且前提是多肽基本上保留了其行为特性。例如,可以从酶多肽中去掉一个或多个氨基酸,导致多肽结构的改进,而没有显着改变其生物活性。例如,不是酶发挥生物活性所必须的氨基端或羧基端氨基酸可以去掉。这种改进导致开发了更小的活性酶多肽。本发明提供了“基本上纯的酶”。本文中使用的术语“基本上纯的酶”用来描述完全游离于自然情况下与其结合的蛋白、脂类、碳水化合物、核酸和其它生物材料的分子,如多肽(例如,酶多肽或其片段),例如,基本上纯的分子,如多肽,可至少占目标分子的60%干重。可采用标准方法,包括,例如聚丙烯酰胺凝胶电泳(例如,SDS-PAGE)、柱层析(例如,高效液相色谱(HPLC))和氨基末端氨基酸序列分析来确定多肽的纯度。本文中使用的“基本上纯的”表示目标分子是主要存在的分子(即基于摩尔,它在组合物中的比任何其它的大分子多),优选地,基本上纯的部分是指组合物中目标分子占所有大分子的至少50%(基于摩尔)。一般来说,基本上纯的组合物包括高于组合物中所有大分子约80%到90%的目标分子。更优选地,目标分子被纯化至基本均一(采用常规检测方法检测不到组合物中的污染分子),其中组合物主要由单一的大分子组成。溶剂、小分子(<500道尔顿)和离子元素不视为大分子。术语“治疗”包括:(1)预防或延缓发生于动物体内的状态(state)、疾病或病症的临床症状出现,该动物可能患有或易感于该状态、疾病或病症但尚未经历或表现出该状态、疾病或病症的临床或亚临床症状;(2)抑制该状态、疾病或病症(即,阻止、减少或延缓疾病的发展,或维持治疗情况下疾病的复发,或至少一种临床或亚临床症状);和/或(3)减轻病症(即,引起该状态、疾病或病症的衰退或引起至少其一种临床或亚临床症状的衰退)。对将要进行治疗的病人的好处是在统计学上显著,或至少对病人或医生的好处是可察觉到的。本文中使用的“肿瘤”是指所有赘生细胞生长和增殖,无论是恶性的还是良性的,以及所有癌前和癌性细胞和组织。本文中使用的术语“可变区段(variablesegment)”是指包括随机的、伪随机的或确定的核心序列的新生肽的一部分。“可变区段”是指包括随机的、伪随机的或确定的核心序列的新生肽的一部分。可变区段可包括可变的或不可变的残基位,可变的残基位上的残基可变程度可能是有限的:两种选择由医生定夺。通常情况下,可变区段长约5至20个氨基酸残基(例如,8至10),尽管可变区段可以更长,并可能包括抗体部分或受体蛋白,如抗体片段、核酸结合蛋白、受体蛋白等。术语“变体(variant)”是指在野生型蛋白亲本分子的的一个或多个碱基对、密码子、内含子、外显子或氨基酸残基(分别)被修饰的本发明的多核苷酸或多肽。变体可由任何方法产生,这些方法包括例如,易错PCR(error-pronePCR)、改组(shuffling)、寡核苷酸定向诱变、装配PCR(assemblyPCR)、有性PCR诱变(sexualPCRmutagenesis)、体内诱变、盒式突变、循环总体诱变(recursiveensemblemutagenesis)、指数总体诱变(exponentialensemblemutagenesis)、特异位点诱变、基因再组装、饱和诱变和它们的任意组合。本文公开了用于生产在正常生理条件,例如温度、pH、渗透压、重量摩尔渗透压浓度、氧化应激和电解质浓度中的一种或多种条件,较野生型蛋白活性下降,以及在异常条件下活性增强的变体蛋白的技术。可另外筛选出较野生型蛋白抗化学性和抗蛋白水解性能增强的变体。本文中使用的“载体”、“克隆载体”和“表达载体”是指可以将多核苷酸序列(例如外源基因)引入宿主细胞中以便转化宿主并促进引入序列的表达(例如转录和翻译)的载体。载体包括质粒、噬菌体、病毒等。本文中使用的术语“野生型”是指不包括任何突变的多核苷酸。“野生型蛋白(wildtypeprotein)”、“野生型蛋白(wild-typeprotein)”、“野生型生物蛋白(wild-typebiologicprotein)”或“野生型生物蛋白(wildtypebiologicprotein)”是指可以从自然界中分离的在自然条件下具有一定水平活性的且包含在自然条件下发现的氨基酸序列的蛋白。野生型蛋白可以为人蛋白、哺乳动物蛋白、人病毒蛋白或哺乳动物蛋白。术语“亲本分子”和“目标蛋白”也指野生型蛋白。野生型蛋白优选具有一些期望的性质,例如更高的结合亲和力和/或酶活性、在特定温度和/或pH下更好的稳定性、改善的选择性和/或溶解性。这种野生型蛋白可以通过在蛋白质文库中筛选所需性质获得。术语“工作”,如在“工作样本”中,例如,仅简单地指一个用于工作的样本。同样,“工作分子”,例如,是指用于工作的分子。详细描述本发明涉及改造或演变蛋白以产生在野生型条件下可逆或不可逆失活,而在非正常条件下表现出活性与在野生型条件下相同或相当水平的新分子的方法。本文中这些新蛋白是指“Mirac”蛋白。Mirac蛋白对于发展新疗法特别有价值,其在很短的时间或有限的时期内在宿主中有活性。给定剂量该蛋白的扩展工作(extendedoperation)将对宿主是有害的,这点特别有价值,但为了进行所需的治疗,其活性必须是有限的。有益的应用例包括以高剂量进行局部或全身治疗,以及以高浓度进行局部治疗。在生理条件下的失活可通过给药和蛋白失活速率的组合来确定。催化活性在较短的时间内造成重大的负面影响,这种基于失活的条件对于酶疗法尤为重要。本发明还涉及改造或演变蛋白从而产生不同于野生型分子的新分子的方法,所述新分子随时间可逆或不可逆地活化或失活的或仅在体内特定微环境包括在体内特定器官(如膀胱或肾脏)中才活化或失活。目标野生型蛋白任何治疗性蛋白可以作为用于生产条件活性生物蛋白的目标蛋白,或野生型蛋白。在一个方面,目标蛋白是野生型的酶。目前常用的治疗性酶包括尿激酶和链激酶,用于治疗血液凝块;以及透明质酸酶,作为提高其它药物的吸收和分散的佐剂。在一个方面,为了避免或尽量减少野生型蛋白或酶带来的有害副作用,所选用于生产条件活性生物蛋白的野生型蛋白可以是目前使用的治疗性酶。或者,目前没有作为治疗性酶而使用的酶可选择用于生产条件活性生物蛋白。某些非限制性的实例将在下文进一步详细讨论。治疗性蛋白是那些可以单独用于药物或与其它疗法结合以治疗各种疾病或病症(indications)的蛋白。本发明的条件活性生物蛋白适用于一个或多个病症,包括治疗循环系统疾病、关节炎、多发性硬化症、自身免疫性疾病、癌症、皮肤病,并用于各种诊断形式(diagnosticformats)。取决于蛋白和病症,条件活性生物酶蛋白可以是如下讨论的肠外、外用或口服试剂给药。一些代表性的靶野生型蛋白包括酶、抗体、细胞因子、受体、DNA结合蛋白、螯合剂和激素。更多实例包括工业蛋白和药物蛋白,例如配体、细胞表面受体、抗原、转录因子、信号传导模块(signalingmodules)和细胞骨架蛋白。一些合适类型的酶为水解酶,例如蛋白酶、糖酶、脂肪酶;异构酶,例如消旋酶、差向异构酶、互变异构酶和变位酶;转移酶、激酶、氧化还原酶和磷酸酶。可以通过生成文库并在文库中筛选具有所需性质(例如酶活性、结合亲和力/选择性、热稳定性、对高pH或低pH的耐受性、表达效率或任何其他生物活性)的蛋白发现靶野生型蛋白。可以通过筛选cDNA文库来发现靶野生型蛋白。cDNA文库是插入到宿主细胞集合中的克隆的cDNA(互补DNA)片段的组合,其一起构成生物体的转录组的一部分。cDNA由完全转录的mRNA产生,因此含有生物体的表达蛋白的编码序列。在靶野生型蛋白为抗体的实施方案中,可通过生成抗体文库并在抗体文库中进行筛选来发现野生型抗体。抗体文库可以是多克隆抗体文库或单克隆抗体文库。针对抗原的多克隆抗体文库可以通过将抗原直接注射到动物中或通过将抗原施用于非人动物来产生。这样获得的抗体代表了结合抗原的多克隆抗体的文库。对于单克隆抗体文库的制备,可以使用提供由连续细胞系培养产生的抗体的任何技术。实例包括杂交瘤技术、三源杂交瘤技术、人B细胞杂交瘤技术和EBV-杂交瘤技术(参见例如Cole(1985)inMonoclonalAntibodiesandCancerTherapy,AlanR.Liss,Inc.,pp.77-96)。描述的用于产生单链抗体的技术(参见例如美国专利号4,946,778)可以适于产生单链抗体文库。还存在其他用于生成和筛选抗体文库以发现野生型抗体的方法。例如,可以利用全人源抗体展示文库。这样的文库是展示在宿主细胞表面上的抗体群。优选地,抗体文库代表人抗体所有组成成分,它们具有广泛的结合大范围抗原的能力。因为抗体在细胞表面展示,所以文库中每种抗体的有效亲和力(由抗体亲抗原性引起)增加。不同于其它流行文库类型(例如噬菌体展示文库,其中不太需要用于筛选和鉴定目的的抗体亲抗原性),在本发明中需要通过细胞表面展示提供极好的抗体亲抗原性。细胞表面展示文库使得能够鉴定具有低、中和高结合亲和力的抗体,以及在筛选或选择步骤中鉴定非免疫原性弱表位。循环疾病-血栓形成与溶栓治疗血栓(血块)的定义是在循环系统中形成的来自血液成分中的固体块。血栓是由一系列涉及凝血因子、血小板、红细胞以及与血管壁相互作用的事件而形成的。血小板是可能会导致血管阻塞的血小板、纤维蛋白和被捕获(entrapped)的血细胞的血管内聚集。通过阻塞或阻断血流,血栓剥夺了下游组织的氧气供应。血栓的片段(栓塞)可破坏或阻塞较小的血管。动脉血栓的形成是由于各种因素中的任一种因素所导致的沉淀,这些因素包括潜在的狭窄-动脉粥样硬化、低流量心脏功能、癌症或凝血因子缺乏所形成的血凝过快(hypercoagubility),或异物如支架或导管。导致动脉缺血的血栓可以导致肢体或组织损伤、急性心肌梗死(AMI)、中风、截肢或肠梗塞。发病率和死亡率的主要原因是动脉血栓(冠状动脉血栓和脑动脉血栓)和肺血栓的形成。静脉血栓的形成可能是由于内皮损伤如创伤、不动所导致的瘀积或血凝过快所引起的,但动脉粥样硬化不是一个因素。治疗策略包括机械去除血栓、药物-机械去除血栓及溶栓。血栓治疗用以尽量减少血栓的形成和有助于血栓的去除。血栓治疗包括使用能够抑制血小板活化的抗血小板试剂、抗凝疗法和/或溶栓治疗,以降低血液凝块。抗血小板试剂的实例包括阿司匹林、潘生丁和噻氯匹啶。抗凝血剂的实例包括肝素、华法林、水蛭素和活化的人类蛋白C。溶栓的实例包括组织型纤溶酶原激活物(tPA)/tPA变体、尿激酶和链激酶。溶栓显示了作用的催化模式。急性心肌梗死中的溶栓治疗是公认的。溶栓试剂的使用已成为标准的紧急治疗方法。虽然有效,这些产品仅在约50%的患者中实现完全再灌注(reperfusion),且副作用包括出血(尤其是颅内出血)以及高血压的风险。受损或病变的血管的血凝块的减少,被称为“纤溶”或“纤溶过程”。纤溶是一个蛋白水解过程,是由纤溶酶原激活剂激活蛋白纤维溶酶原,从而形成纤溶酶。纤溶酶降解血液凝块的纤维蛋白丝以溶解凝块。纤维特异性的纤溶酶原激活剂包括组织型纤溶酶原激活剂或变体。非特异性的纤溶酶原激活剂可以包括链激酶和尿激酶。某些常用的溶栓疗法利用几种可获得的组织型纤溶酶原激活剂(tPA)变体中的一种。例如,先前已批准使用的基于tPA的产品变体是阿替普酶(rt-PA)、瑞替普酶(r-PA)和替奈普酶(TNK)。tPA变体批准使用的用途包括例如,用以改善AMI影响心室功能的急性心肌梗死,充血性心力衰竭发病率的减少,以及AMI所致死亡率的下降,用于促进神经功能的恢复并减少残疾的发病率的成人缺血性中风治疗(management),用于急性肺栓塞溶解以及用于伴有不稳定血流动力学的肺栓塞溶解的成人急性大面积肺栓塞治疗。另一种常用的溶栓治疗采用尿激酶。尿激酶是一种用于外周血管疾病治疗的标准溶解剂。链激酶是由几种链球菌分泌的、可以结合并激活人纤溶酶原的蛋白。链激酶与人纤溶酶原的复合物可通过键断裂产生纤溶酶而水解激活其它未结合的纤溶酶原。通常纤溶酶原激活是通过水解Arg561-Val562键。然后Val562的氨基与Asp740形成盐桥,导致构象变化而产生活化的蛋白酶纤溶酶。纤溶酶产生于血液中以分解血液凝块的主要成分-纤维蛋白。链激酶作为一种有效的血块溶解药物用于下列疾病的某些情况:心肌梗死(心脏病发作)、肺栓塞(肺血块)和下肢深静脉血栓(腿部血液凝块)。链激酶属于一组称为纤维蛋白溶解剂的药物。心脏病发作后尽快施以链激酶,可溶解心壁动脉中的血块并减少对心脏肌肉的损害。链激酶是一种细菌产品,因此身体能够形成对该蛋白的免疫力。因此,建议不应在第一次给药四天后再次施用这种产品,因为它可能没有效并会引起过敏反应。出于这个原因,通常只在第一次心脏病发作后给药,进一步的血栓性事件通常用组织型纤溶酶原激活剂(TPA)治疗。链激酶有时也用于预防手术后粘连。链激酶的副作用包括出血(主要和次要)、低血压和呼吸抑制以及可能的过敏反应。此外,改变血小板功能的抗凝血剂、试剂(例如阿司匹林、其它NSAID、潘生丁)可能会增加出血的风险。溶栓的给药一般通过输液或通过静脉单次剂量注射(bolusintravenousdose);或通过机械输液系统。不利的影响可包括严重的颅内、消化道、腹膜后或心包出血。如果发生出血,给药必须立即停止。在本发明的特定实施方案中,tPA、链激酶或尿激酶被选作目标或野生型蛋白。在一个实施方案中,本发明的方法被用于选择在低于正常生理条件的异常温度条件下具有高活性,且在正常生理条件(例如37℃)下完全灭活或失活的条件活性重组的或合成的链激酶变体。在一个方面,异常的温度条件下是室温,例如20-25℃。在另一个方面,本发明提供治疗中风或心脏病发作的方法,该方法包括对患有中风或心脏病发作的病人施以高剂量的条件活性链激酶变体,但允许链激酶变体的迅速失活以免失血过多。循环疾病-肾素/血管紧张素肾素/血管紧张素系统是一种调节血压和水(流体)平衡的激素系统。在低血容量时,肾脏分泌肾素。肾素是一种酶,其将肝脏分泌的血管紧张素水解为肽血管紧张素I。血管紧张素I进一步在肺中被内皮结合的血管紧张素转化酶(ACE)切割成血管紧张素Ⅱ,最重要的血管活性肽。血管紧张素Ⅱ引起血管收缩,导致血压升高。然而,血管紧张素Ⅱ也能刺激肾上腺皮质分泌激素醛固酮。醛固酮引起肾脏的肾小管增加了对钠和水的吸收。这增加了体内的液量,也增加了血压。过度活性的肾素-血管紧张素系统导致血管收缩及钠和水的滞留。这些影响导致了高血压。有很多药物可中断这个系统中的不同步骤,以降低血压。这些药物是用来控制高血压(高血压症)、心力衰竭、肾衰竭和糖尿病的有害影响的主要途径之一。低血容性休克(Hypovolemicshock)是一种急性病症,其中严重的血液和/或体液流失使心脏无法充分地带给人体细胞含氧血。创伤、受伤和内部出血可导致失血。由于烧伤、腹泻、过度出汗或呕吐导致的过多的液体流失可形成血液循环的量下降。低血容性休克的症状包括焦虑、皮肤湿冷、神志不清、呼吸急促或失去知觉。检查时可见休克的迹象,包括血压低、体温低和可能微弱的或虚弱的(thready)脉快。治疗包括静脉输液,输血或血制品,休克治疗和药物如多巴胺、多巴酚丁胺、肾上腺素和去甲肾上腺素,以升高血压和提高心输出量。在一个实施方案中,本发明提供了一种用于筛选在正常生理温度下可逆失活,但在低血容量性休克病人的异常较低温度下恢复活性的条件活性重组肾素变体的方法。该条件活性蛋白可用于治疗低血容量性休克,以帮助提高体内的液体量并升高血压。循环疾病-雷诺氏现象雷诺氏现象(RP),是引起手指、脚趾和偶尔其它四肢变色的血管痉挛症。情绪紧张和寒冷经常触发此现象。当暴露在寒冷的气温下,四肢失去热量。手指和脚趾血液供应通常放缓,以保持身体的核心温度。通过四肢皮肤下的小动脉变窄使血流量减少。压力会在体内导致与寒冷类似的反应。雷诺氏病中,正常的反应被扩大了。该病可引起疼痛、变色以及寒冷和麻木的感觉。该现象是血管痉挛的结果,其减少了对各部分的血液供应。雷诺氏病(原发性雷诺氏现象)中,这种疾病是先天的。雷诺氏综合征(继发性雷诺氏病)中,这种现象是由一些其它的促发因素造成的。手的温度梯度测量是一种用来区分原发性和继发性形式的工具。原发性形式可以发展为继发性形式,在极端情况下,继发性形式可以发展为指尖的坏死或坏疽。雷诺氏现象是一种对寒冷或情绪紧张作出的扩大反应。原发性RP基本上是由微血管血管痉挛介导的。交感神经系统过度活跃,会导致外周血管的极度血管收缩,导致缺氧。慢性、反复发作的情况可导致皮肤、皮下组织和肌肉的萎缩。它也很少导致溃疡和缺血性坏疽。雷诺氏现象的传统的治疗方案包括扩张血管和促进血液循环的处方药。这些处方药包括钙通道阻滞剂,如硝苯地平或地尔硫卓;α阻滞剂,其对抗去甲肾上腺素(收缩血管的激素)d的作用,如哌唑嗪或沙唑嗪;以及放松血管的血管扩张剂,如硝酸甘油膏,或血管紧张素Ⅱ抑试剂氯沙坦、西地那非或前列腺素。由于心理压力,氟西汀(一种选择性的5-羟色胺再摄取抑试剂)及其它抗抑郁药物可能会降低发作频率和严重程度。这些药物可能会引起副作用,如头痛、面色潮红和踝部水肿。药物也可能随着时间的推移失去效力。皮肤血管收缩和血管扩张的调控涉及改变的交感神经活性和许多神经调节剂,包括肾上腺素和非肾上腺素,以及REDOX信号传递和其它信号传递,如RhoA/ROCK通路。皮肤中血管平滑肌细胞(vSMC)的血管收缩被认为是由α1和α2肾上腺素受体介导的去甲肾上腺素激活的。α2C-ARS从反式高尔基体转移至vSMC的细胞表面,然后对涉及RhoA/Rhokinase(ROCK)信号传递通路的这些响应的刺激和信号传递作出反应。皮肤动脉中的冷刺激导致vSMC线粒体中活性氧(ROS)的立即生成。通过RhoA/ROCK通路,ROS参与入REDOX信号传递中。RhoA是一种GTP结合蛋白,其作用是调控依赖于肌动蛋白-肌球蛋白的过程,如vSMC中的迁移和细胞收缩。脉管系统(vascluature)中可能涉及RP已知功能的非肾上腺素神经肽包括降钙素基因相关肽(CGRP)、P物质(SP)、神经肽Y(NPY)和血管活性肠肽(VIP)。Fonseca等人,2009,“雷诺氏现象和系统性硬化症中的神经调节剂和血管功能障碍(NeuronalregulatorsandvasculardysfunctioninRaynaud'sphenomenonandsystemicsclerosis)”,Curr.Vascul.Pharmacol.7:34-39。RP的新疗法包括α-2C肾上腺素受体阻滞剂、酪氨酸蛋白激酶抑试剂、Rho激酶抑试剂和降钙素基因相关肽。降钙素基因相关肽(CGRP)是降钙素家族肽中的一个成员,以两种形式存在:α-CGRP和β-CGRP。α-CGRP是由降钙素/CGRP基因的选择性剪接形成的37个氨基酸的肽。CGRP是外周和中枢神经元中产生的最丰富的肽之一。它是一种强效的肽血管扩张剂,可在疼痛的传递中发挥功能。偏头痛是一种常见的神经系统疾病,其与增加的CGRP水平有关。CGRP扩张颅内血管并传递血管伤害感受(vascularnociception)。将CGRP受体拮抗剂用于治疗偏头痛已经过测试。Arulmani等人,2004,“降钙素基因相关肽以及它在偏头痛病理生理中的作用(Calcitoningene-relatedpeptideanditroleinmigrainepathophysiology)”,Eur.J.Pharmacol.500(1-3):315-330。至少有三个受体亚型已经确定,CGRP通过G蛋白-偶联受体发生作用,该受体的存在和功能的变化调节该肽在各种组织中的效果。CGRP通过受体的信号转导依赖于两个辅助蛋白:受体活性修饰蛋白1(RAMPl)和受体组成蛋白(RCP)。Ghatta2004,降钙素基因相关肽:认识其作用(Calcitoningene-relatedpeptide:understandingitsrole).IndianJ.Pharmacol.36(5):277-283。一项使用激光多普勒血流计(LDF)的有关三种扩血管剂:内皮依赖性血管扩张剂腺苷三磷酸(ATP)、不依赖于内皮的血管扩张剂前列环素(依前列醇;PGI2)和CGRP对雷诺的现象患者和相似数量年龄和性别匹配的对照组的影响的研究表明,由雷诺氏症患者的皮肤血流量上升造成CGRP诱导脸部和手潮红,而对照组CGRP仅引起脸部潮红。PGI2引起两组中脸部和手相似的血流量上升。ATP没有引起病人手或脸部血流量的任何大的改变,但增加了对照组的脸部血流量。Shawket等人,1989,“雷诺氏现象中手的降钙素基因相关肽的选择性过敏症(Selectivesuprasensitivitytocalcitonin-gene-relatedpeptideinthehandsinReynaud'sphenomenon)”,《柳叶刀》(TheLancet),334(8676):1354-1357。在一个方面,野生型蛋白的目标分子是CGRP。在一个实施方案中,本发明提供筛选与雷诺氏综合征相关的、在正常生理条件下可逆失活但在手指或足趾中较低的异常温度下恢复活性的条件活性重组蛋白变体的方法。该条件活性蛋白可用于治疗雷诺氏现象,以防止或减少由于低循环导致的手指或足趾功能的损失。循环疾病-血管加压素精氨酸血管加压素(AVP、血管加压素、抗利尿激素(ADH)是发现于大多数哺乳动物中的一种肽类激素,其通过影响组织通透性控制肾脏的肾小管中分子的重吸收。血管加压素的最重要作用之一,是调节体内保水力(waterretention)。在高浓度下,它通过引入适度的血管收缩提升高血压。血管加压素具有三种效应导致尿渗透压增加(浓度增加)并减少水的排泄。首先,血管加压素会使得肾脏集合管细胞(collectingductcells)的水通透性增加,从而允许水的重吸收和较小体积浓缩尿的排泄(抑制尿分泌(antidiuresis))。这是通过将水通道蛋白-2的水通道插入集合管细胞的顶膜中而产生的。其次,血管加压素引起集合管的内髓部分对尿素的通透性增加,从而允许髓间质增加了对尿素的重吸收。第三,通过增加Na+-K+-2Cl-协同转运蛋白的活性,血管加压素引起在亨利氏环厚上行支血管中对钠和氯重吸收的刺激。NaCl的重吸收驱动了反流倍增,其为髓质集合管中水通道蛋白介导的水重吸收提供渗透梯度。肾集合管周围的高渗组织间液提供了高渗透压以去除水。由蛋白组成的跨膜通道称为水通道蛋白,它插入质膜中极大地增加了水的渗透性。当通道打开时,水通道蛋白通道每秒可使3百万个水分子通过。水通道蛋白-2通道的插入需要血管加压素传递信号。血管加压素与集合管细胞的基底表面上的受体(称为V2受体)结合。该激素的结合触发了细胞内cAMP水平的提高。该“第二信使”启动了一连串事件,最终在集合管细胞的顶端表面的插入水通道蛋白-2通道。水通道使水移出肾元,从而增加了从形成的尿液中重吸收而返回血液中的水的量。从脑垂体后叶释放的血管加压素的主要刺激是增加了血浆渗透压。任何使身体脱水的方法,如大量出汗,增加了血液渗透压并打开了血管加压素-V2受体-水通道蛋白-2通路。因此,低至0.5升/天的尿可能会保持原有180升/天的肾滤液。尿中的盐浓度可以是血液中的四倍。如果血液变得太稀,喝大量的水会使血液变得太稀,血管加压素分泌受到抑制,水通道蛋白-2通道可通过内吞作用进入细胞内。结果是,形成大量的盐浓度仅为血液盐浓度四分之一的水样尿。血管加压素释放的减少或肾对AVP敏感度的下降导致尿崩症(diabetesinsipidus)、高钠血症(增加的血钠浓度)、多尿(产生过多的尿)和多饮(口渴)。高水平的AVP分泌(抗利尿激素分泌过多综合征,SIADH)和由此造成的低钠血症(血液中钠含量低),发生于脑部疾病和肺疾病(小细胞肺癌)。在围手术期,手术应激和一些常用的药物(例如,鸦片、催产素、止吐药)的影响,导致类似的血管加压素分泌过度的情况。这可能会导致数天的轻度低钠血症。血管加压素激动剂用于治疗各种病症,其长效的合成类似物去氨加压素(desmopressin)用于血管加压素分泌量低的病症,以及控制出血(以某些血管性血友病的形式)和极端案例儿童尿床中。特利加压素(Terlipressin)和相关类似物用作特定病症中的血管收缩剂。血管加压素输液已被用来作为第二种治疗对高剂量影响肌力药(inotropes)(例如,多巴胺或去甲肾上腺素)没反应的感染性休克(septicshock)患者的方法。血管加压素受体拮抗剂是干扰血管加压素受体作用的试剂。它们可用于治疗低钠血症。在一个实施方案中,本发明提供了筛选用于涉及血管加压素响应的、在正常生理渗透压下可逆失活但在血液中异常的渗透压下恢复活性的条件活性生物重组的或合成的蛋白变体的方法。在另一个实施方案中,涉及血管加压素响应的蛋白变体在低钠条件下被激活,但在正常血清钠浓度下失活。在一个方面,低钠条件是血清钠<135mEq/L。癌-血管抑素血管抑素是在几种动物中自然产生的蛋白。它作为一种内源性血管生成抑试剂(即,它阻止新血管的生长)。血管抑素能够通过抑制内皮细胞增殖和迁移来抑制肿瘤细胞的生长和转移。血管抑素是纤溶酶的38kD片段(其本身是纤溶酶原的片段)。血管抑素包括纤溶酶原可里格尔区(kringle)1-3。血管抑素产生,例如,通过纤溶酶原的自溶裂解,包括磷酸激酶引起的胞外二硫键还原。血管抑素也可以由不同的基质金属蛋白酶(MMPs),包括MMP2、MMP12和MMP9以及丝氨酸蛋白酶(中性粒细胞弹性蛋白酶、前列腺特异抗原(PSA))切割纤溶酶原而得到。在体内,血管抑素抑制肿瘤的生长和使实验性转移(experimentalmetastasis)保持休眠状态。血管抑素在具有原发肿瘤和其它炎症和退行性疾病的动物中是升高的。已知血管抑素结合许多蛋白,包括血管抑素动蛋白(angiomotin)和内皮细胞表面ATO合酶,还有整合素(integrin)、膜联蛋白II(annexinII)、c-met受体、NG2-蛋白多糖、组织型纤溶酶原激活物、硫酸软骨素糖蛋白和CD26。一项研究表明,IL-12,一种具有强效抗血管生成活性的TH1因子,是血管抑素活性介质。Albin".,J.TranslationalMedicine.Jan.4,2009,7:5。血管抑素结合并抑制内皮细胞表面ATP合成酶。ATP合成酶还出现在多种癌细胞的表面。发现肿瘤细胞表面ATP合成酶在胞外低pH下更活跃,肿瘤微环境的一个标志。发现在胞外酸性pH(pHe)下,血管抑素影响肿瘤细胞表面的ATP合成酶活性。在胞外低pH下,血管抑素直接抗肿瘤发生。在低pH下,血管抑素和抗-β-亚基抗体诱导A549癌细胞的胞内酸化,以及直接的毒性,该毒性在具有低水平的胞外ATP合成酶水平的肿瘤细胞中是不存在的。据推测,肿瘤细胞毒的作用机制依赖于由细胞表面的ATP合成酶的抑制引起的胞内pH异常。Chi和Pizzo,“在胞外低pH值下血管抑素对肿瘤细胞的直接细胞毒性:依赖于细胞表面相关的ATP合酶的机制(AngiostatinisdirectlycytotoxictotumorcellsatlowextracellularpH:amechanismdependentoncellsurface-associatedATPsynthase)”,CancerRes.,2006,66(2):875-82。在一个实施方案中,本发明提供用于确定在正常生理血液pH下活性低于野生型血管抑素,但在低pH下活性增强的条件活性血管抑素变体的方法。低pH被定义为比正常生理pH低。在一个方面,低pH是≤约7.2。在一个特定的方面,低pH是约6.7。在一个方面,条件活性血管抑素变体可被配制并用作抗癌剂。组织通透性的增强-透明质酸酶透明质酸酶是降解透明质酸的酶家族。通过催化间质屏障(interstitialbarrier)的主要成分透明质酸的降解,透明质酸酶降低了透明质酸的粘度,从而提高组织的通透性。在医学上,它被用于与其它药物结合以加速其分散和运送。最常见的应用是在眼科手术中,与局部麻醉剂组合使用。动物源性透明质酸酶包括HydaseTM(PrimaPharmInc.;AkornInc.)、羊型透明质酸酶(Vitrase)(ISTAPharmaceuticals)和牛型透明质酸酶(Amphadase)(AmphastarPharmaceuticals)。目前已批准重组人透明质酸酶作为佐剂以增加其它药物的吸收;皮下输液(皮下注射液体);改善造影剂(radioopaqueagent)吸收的皮下尿路造影中的附属物(adjunct)。(Hylenex;HalozymeTherapeutics,Inc.;BaxterHealthcareCorp.)。在一个实施方案中,透明质酸酶可作为野生型蛋白(亲本分子)用于制备条件活性生物蛋白。透明质酸酶可能在癌症转移和或许在血管生成中发挥作用;因此,过度暴露这些酶可能是有害的。在一个方面,条件活性生物透明质酸酶蛋白将会在正常生理温度下不可逆转或可逆失活,但会在特定的低于正常生理温度的温度范围内较野生型透明质酸酶的活性水平相同或高于其活性水平。自身免疫性疾病-条件活性生物反应调节剂类风湿关节炎(RA)是一种自身免疫性疾病,其特点是导致关节发炎和肿胀并伴随关节逐渐破坏的异常免疫机制。RA也可影响皮肤、结缔组织和身体中的器官。传统的疗法包括非甾体抗炎药(NSAIDs)、COX-2抑试剂和改善病情抗风湿药(disease-modifyinganti-rheumaticdrugs)(DMARDS),如甲氨蝶呤。传统的治疗方案都不理想,尤其是对于长期使用而言。生物反应调节剂,其作用靶标是炎症介质,提供了一种相对新的治疗类风湿关节炎和其它自身免疫性疾病的方法。这种生物反应调节剂包括抗各种炎症介质,如IL-6、IL-6受体、TNF-α、IL-23和IL-12的抗体或其活性部分。一些第一生物反应调节剂是靶向肿瘤坏死因子α(TNF-a),参与RA发病机制的一种前炎症细胞因子的药物。目前市面上可获得几种用于治疗RA的抗TNF-α药物。例如,(依那西普,Amgen)是TNF-α阻滞剂。依那西普是一种二聚体融合蛋白,由连接于人IgGlFc部分的75kD(p75)肿瘤坏死因子受体(TNFR)的胞外配体结合部分组成。依那西普的Fc部分包含CH2域、CH3域和铰链区,但不包含IgGl的CHL域。依那西普是在中国仓鼠卵巢(CHO)哺乳动物细胞表达系统中产生的。它由934个氨基酸组成,分子量约150kD。用于治疗类风湿关节炎、银屑病关节炎、强直性脊柱炎和牛皮癣。严重的副作用,包括由条件致病菌引起的感染包括结核、真菌感染、细菌或病毒感染。也可发生败血症。淋巴瘤或其它恶性肿瘤也有报道。(英利昔单抗)是一种由人恒定区和小鼠可变区组成的嵌合抗TNF-αIgGkI单克隆抗体。Remicade通过静脉注射给药,并用于治疗类风湿关节炎、银屑病、克罗恩病、溃疡性结肠炎和强直性脊柱炎。Remicade的副作用包括严重感染或败血症,很少为某些T细胞淋巴瘤。其它副作用包括肝毒性,某些严重的血液事件、过敏反应和某些严重的神经事件。其它生物反应调节剂包括人源化的抗-6(IL-6)受体抗体。IL-6是一种细胞因子,其有助于消炎、消肿和RA中的关节损伤。一种人源化的抗IL-6受体抗体,阿克特姆拉(Actemra)(tocilizumab,Roche),通过了FDA和欧盟委员会批准用于治疗患有类风湿关节炎的成人患者。阿克特姆拉也在日本批准用于治疗RA和青少年特发性关节炎(sJIA)。III期临床研究表明,阿克特姆拉作为单一疗法,或与MTX或其它DMARD组合治疗,与其它疗法相比减少了RA的迹象和症状。阿克特姆拉是人源化的抗人IL-6受体单克隆抗体,其竞争性地阻止IL-6与其受体的结合。因此,它抑制IL-6的细胞增殖作用,从而导致在RA中滑膜增厚和血管翳形成。阿克特姆拉的严重副作用包括严重的感染和过敏反应,其包括少数病例的过敏性反应。其它副作用包括上呼吸道感染、头痛、鼻咽炎、高血压和增加的ALT。另一种常见的自身免疫性疾病是牛皮癣。过于活跃的免疫系统可导致高水平的IL-12和IL-23、两种已在银屑病斑块中发现的细胞因子蛋白。IL-12和IL-23参与炎症和免疫反应,如自然杀伤细胞的活化和CD4+T细胞分化和活化。中度或重度牛皮癣的一种治疗包括皮下注射StelaraTM(ustekinumab,CentocorOrthoBiotech,Inc.),一种人源化的抗IL-12和IL-23因子的p40亚基的IgGIk单克隆抗体。已证明Stelara可减轻与银屑病斑块有关的某些症状,如斑块厚度、脱屑和发红。Stelara的配方包括L-组氨酸和L-组氨酸盐酸盐一水合物、聚山梨醇酯80和蔗糖,以水配制。StelaraTM的使用影响免疫系统,并可能增加感染的机会,包括肺结核和由细菌、真菌或病毒引起的感染;以及增加某些类型的癌症的风险。生物反应调节剂的副作用很值得注意,部分由于注射患者后的高水平使患者易患严重感染或死亡。这是一种与此类重要药物有关的主要副作用。挑战之一是避免所需抗体剂量的初始高活性水平,从而注射后提供一个长期治疗效果。在一个实施方案中,本发明提供制备能够避免所需抗体剂量的高活性水平,从而注射后提供一个长期治疗效果的条件活性生物反应介质或其片段的方法。本发明的方法可用于设计炎症介质,如IL-6、IL-6受体、TNF-α、IL-23和IL-12的抗体,其在给药条件下如室温下是无活性的,但在体温下慢慢地重折叠(可逆或不可逆的)。它们的抗体或片段在初始注射时是无活性的,但注射后接触到血液数小时至数天后,复性或恢复活性。这可以允许较高的给药量和较长的半衰期(或给药期间)并减少副作用。在一个方面,本发明提供制备在给药条件下如室温下无活性,但在体温下缓慢复性(可逆或不可逆的)的炎症介质的条件活性抗体或其片段的方法。该方法包括以下步骤。选择一种炎症介质。通过杂交瘤细胞进行筛选以确定炎症介质的抗体。人源化该抗炎症介质的抗体。演变该抗炎症介质的抗体并差异筛选用于在两种或两种以上条件下的结合,例如,两种或两种以上温度条件,如在室温和在37℃或更高温度;选择出表现出以下特性中至少一种的突变:(a)在正常生理条件下的测试中较野生型蛋白活性下降,以及(b)在异常条件下的测试中较野生型蛋白活性增强。然后将在重链和轻链变化中确定的改善型突变在重链和轻链内部重新组合,以及通过重链和轻链的组合关联。在两种条件下,例如室温或37℃或更高温度条件下重复筛选这些重组的重链和轻链。此外,可筛选在储存和生理条件下保持活性和稳定性的重组抗体或片段。或者,炎症介质的野生型抗体是已知抗体或变体或其活性片段。在一个方面,第一和第二条件选自以下条件:pH、渗透压、重量摩尔渗透压浓度、氧化应激和电解质浓度。在另一个方面,炎症介质选自IL-6、IL-6受体、TNF-α、IL-23和IL-12。在另一个方面,本发明提供制备在给药条件如室温下无活性但在体温下缓慢复性(可逆或不可逆的)的IL-6的条件活性抗体或其片段的方法。该方法包括以下步骤。在全人体文库中筛选IL-6的抗体。演变该抗体,并在室温和37℃或更高温度条件下差异筛选分子;选择表现出以下特性中至少一种的突变:(a)在正常生理条件下的测试中较野生型蛋白活性下降,以及(b)在异常条件下的测试中较野生型蛋白活性增强。然后将在重链和轻链变化中确定的改善型突变在重链和轻链内部重新组合,以及通过重链和轻链的组合关联。在室温或37℃或更高温度条件下重复筛选这些重组的重链和轻链。此外,筛选在储存和生理条件下保持活性和稳定性的重组抗体或片段。如此确定并产生的所述条件活性抗-IL-6抗体可用于治疗自身免疫性疾病如类风湿关节炎或牛皮癣的方法中,通过对病人施以所需的有效剂量,较施以传统的抗-IL-6抗体生物反应调节剂减少了副作用的严重性。这种方法的一个优点是,相对于目前的高水平生物反应调节剂药物在数周或数月后消除(clearance)半衰期,它使在治疗一段时间后的药物量保持平缓或维持药物水平。采用一种或多种突变技术来演变编码野生型蛋白的DNA,以产生突变DNA文库;表达突变DNA以产生突变蛋白;在正常生理条件和一种或多种异常条件下对文库进行筛选检测。从这些蛋白中筛选出具有以下特性中至少一种的条件活性生物蛋白:(a)在正常生理条件的测试中,较野生型蛋白活性减少,以及(b)在异常条件的测试中,较野生型蛋白活性增强。或者,条件活性生物蛋白选自那些在两种或两种以上不同的生理条件下,表现出活性可逆或不可逆变化的蛋白。条件活性病毒颗粒病毒颗粒长期以来被用作用于将蛋白、核酸分子、化学化合物或放射性同位素运送到靶细胞或组织的递送载体。通常用作递送载体的病毒颗粒包括逆转录病毒、腺病毒、慢病毒、疱疹病毒和腺相关病毒。病毒颗粒通常在配体-受体结合系统中通过用作识别蛋白的表面蛋白识别它们的靶细胞,所述识别蛋白与作为靶细胞的靶蛋白的细胞蛋白特异性结合,(Lentz,“Therecognitioneventbetweenvirusandhostcellreceptor:atargetforantiviralagents(病毒和宿主细胞受体之间的识别事件:抗病毒剂的靶标),”J.ofGen.Virol.,vol.71,pages751-765,1990,该文献通过引用并入本文)。例如,病毒识别蛋白可以是靶细胞上的受体的配体。配体和受体之间的特异性允许病毒颗粒特异性识别靶细胞并将其内含物递送至靶细胞。从野生型病毒开发人工病毒颗粒的技术是本领域技术人员公知的。已知的作为递送载体的人工病毒颗粒包括基于逆转录病毒的人工病毒颗粒(参见例如WO90/07936;WO94/03622;WO93/25698;WO93/25234;美国专利号5,219,740;WO93/11230;WO93/10218;美国专利号4,777,127;英国专利号2,200,651;EP0345242;和WO91/02805)、甲病毒(例如,辛德毕斯病毒(Sindbisvirus)载体、塞姆利基森林病毒(Semlikiforestvirus,ATCCVR-67;ATCCVR-1247)、罗斯河病毒(RossRivervirus,ATCCVR-373;ATCCVR-1246)、委内瑞拉马脑炎病毒(Venezuelanequineencephalitisvirus,ATCCVR-923;ATCCVR-1250;ATCCVR1249;ATCCVR-532))和腺相关病毒(参见例如WO94/12649,WO93/03769;WO93/19191;WO94/28938;WO95/11984和WO95/00655)。通常,通过将外源识别蛋白通过重组技术插入病毒颗粒来构建人工病毒颗粒,通常该插入的识别蛋白代替天然识别蛋白。外源识别蛋白可以为例如抗体、受体、配体或胶原结合结构域。本发明提供一种条件活性识别蛋白,其在正常生理条件下不具有与细胞结合的活性或与细胞结合的活性较低,并且在异常条件下具有与细胞结合的活性或与细胞结合的活性较高。因此条件活性识别蛋白可以基于该部位异常状况的存在优先结合患病组织和/或患病部位的靶细胞,并避免或仅最低限度地结合存在正常生理状况的正常组织的细胞。条件活性识别蛋白可以表达并展示在病毒颗粒的表面上。在一些实施方案中,本发明提供了一种演变野生型识别蛋白并筛选条件活性识别蛋白的方法。与野生型识别蛋白相比,条件活性识别蛋白在正常生理条件下与细胞结合的活性较低,在异常条件下与细胞结合的活性较高。这种条件活性识别蛋白可以通过公知的重组技术插入病毒颗粒以产生条件活性病毒颗粒。在另一个实施方案中,本发明提供了包含条件活性识别蛋白的条件活性病毒颗粒,其允许条件活性病毒颗粒识别并结合患病组织或患病部位的靶细胞,但不结合正常组织的细胞。这种条件活性病毒颗粒可以优先将病毒颗粒内的治疗剂递送至患病组织或患病部位,同时该条件活性病毒颗粒不会或较少将任何治疗组合物递送至正常组织的细胞。在一些实施方案中,患病部位的靶细胞在具有异常pH(例如,pH6.5)或异常温度的区域或微环境内,所述异常是与健康的或不患有特定疾病或疾病状态的身体的其他部分中的pH或温度相比而言的。在该实施方案中,在正常生理pH或温度下,条件活性识别蛋白较野生型识别蛋白具有较低的结合靶细胞的靶蛋白的活性,并且在异常(abnormaloraberrant)pH或温度下较野生型识别蛋白具有较高的结合靶细胞的靶蛋白的活性。以这种方式,识别蛋白将优先结合遭遇异常pH或温度的部位,由此将治疗剂递送到患病部位。在一个实施方案中,病毒颗粒可以包含本发明的条件活性抗体,特别是抗体的可变区(例如Fab,Fab',Fv)。这样的条件活性抗体与野生型抗体相比,可以在正常生理条件下以低于野生型抗体的亲和力结合靶细胞的靶蛋白(作为抗原),所述正常生理条件可以在具有正常组织的位置遭遇,并且在异常条件下以高于野生型抗体的亲和力结合靶细胞的靶蛋白(作为抗原),所述异常条件可能在疾病部位或患病组织处遭遇。可以根据本发明的方法从野生型抗体衍生出条件活性抗体。在一个实施方案中,靶细胞上的靶蛋白包括酪氨酸激酶生长因子受体,例如在例如许多肿瘤中的细胞表面上过表达的酪氨酸激酶生长因子受体。示例性的酪氨酸激酶生长因子为VEGF受体、FGF受体、PDGF受体、IGF受体、EGF受体、TGF-α受体、TGF-β受体、HB-EGF受体、ErbB2受体、ErbB3受体和ErbB4受体。条件活性DNA/RNA修饰蛋白DNA/RNA修饰蛋白已被发现可作为新的基因组工程工具的形式,特别是称为CRISPR的一种形式,其可以允许研究人员对基因进行显微手术,精确且容易地在染色体上的准确位置改变DNA序列(genomeediting,Malietal.,"Cas9asaversatiletoolforengineeringbiology(Cas9作为工程生物学的通用工具),"NatureMethods,第10卷,第957–963页,2013)。例如,镰状细胞性贫血由单碱基突变引起,使用DNA/RNA修饰蛋白可将其校正。该技术可以甚至通过改变单个碱基对精确地删除或编辑染色体的位点(Makarovaetal.,“EvolutionandclassificationoftheCRISPR–Cassystems(CRISPR–Cas系统的演变和分类),”NatureReviewsMicrobiology,第9卷,第467-477页,2011)。用CRISPR进行基因组编辑能够快速并同时对细胞进行多种遗传改变。许多人类疾病,包括心脏病、糖尿病和神经疾病,受到多个基因突变的影响。这种基于CRISPR的技术具有逆转引起疾病的突变和治愈这些疾病或至少降低这些疾病的严重性的潜力。基因组编辑依赖于用于切割基因组DNA的CRISPR相关(Cas)蛋白(一个酶家族)。通常,Cas蛋白由小的导向RNA(guideRNA)引导至基因组中的靶区域,其中导向RNA与靶区域匹配。因为Cas蛋白具有很小的序列特异性或没有序列特异性,所以导向RNA用作Cas蛋白的指针以实现精确的基因组编辑。在一个实施方案中,一种Cas蛋白可与多种导向RNA一起使用以同时校正多种基因突变。存在许多Cas蛋白。实例包括Cas1、Cas2、Cas3'、Cas3“、Cas4、Cas5、Cas6、Cas6e、Cas6f、Cas7、Cas8a1、Cas8a2、Cas8b、Cas8c、Cas9、Cas10、Cas10d、Csy1、Csy2、Csy3、Cse1、Cse2、Csc1、Csc2、Csa5、Csn2、Csm2、Csm3、Csm4、Csm5、Csm6、Cmr1、Cmr3、Cmr4、Cmr5、Cmr6、Csb1、Csb2、Csb3、Csx17、Csx14、Csx10、Csx16、CsaX、Csx3、Csx1、Csx15、Csf1、Csf2、Csf3和Csf4(Makarovaetal.,“EvolutionandclassificationoftheCRISPR–Cassystems(CRISPR–Cas系统的演变和分类),”NatureReviewsMicrobiology,第9卷,第467-477页,2011)。为了进行基因组编辑,Cas蛋白必须进入靶细胞。受试者中的细胞可以在细胞内部具有不同的细胞内pH。患病组织中的一些细胞具有异常的细胞内pH。例如,一些肿瘤细胞往往具有约7.12-7.65的碱性细胞内pH,而正常组织中的细胞具有在6.99-7.20范围内的中性细胞内pH。参见Cardoneetal.,“TheroleofdisturbedpHdynamicsandtheNa(+)/H(+)exchangerinmetastasis(扰动的pH动力学和Na(+)/H(+)在转移中的作用),”Nat.Rev.Cancer,第5卷,第786-795页,2005。在慢性缺氧中,患病组织中的细胞具有约7.2-7.5的细胞内pH,该pH也高于正常组织的细胞内pH(Riosetal.,“ChronichypoxiaelevatesintracellularpHandactivatesNa+/H+exchangeinpulmonaryarterialsmoothmusclecells(在肺动脉平滑肌细胞中慢性缺氧升高细胞内pH并激活Na+/H+交换),”AmericanJournalofPhysiology-LungCellularandMolecularPhysiology,第289卷,第L867-L874页,2005)。此外,在缺血细胞中,细胞内pH通常在6.55-6.65的范围内,其低于正常组织的细胞内pH(Haqberg,“IntracellularpHduringischemiainskeletalmuscle:relationshiptomembranepotential,extracellularpH,tissuelacticacidandATP(骨骼肌缺血期间的细胞内pH:与膜电位、细胞外pH、组织乳酸和ATP的关系),”PflugersArch.,第404卷,第342-347页,1985)。Hanetal.,“FluorescentIndicatorsforIntracellularpH(细胞内pH的荧光指示剂),”ChemRev.,第110卷,第2709-2728页,2010中讨论了病变组织中异常细胞内pH的更多实例。本发明提供了一种从野生型Cas蛋白制备条件活性Cas蛋白的方法,其中条件活性Cas蛋白具有以下特性中的至少一种:在正常细胞内的正常生理条件下相对于野生型Cas蛋白的活性酶活性下降;在靶细胞(例如上述患病细胞中的一种)内的异常条件下相对于野生型Cas蛋白的活性酶活性增强。在一些实施方案中,正常生理条件为大约中性的细胞内pH,异常条件为通常高于或低于中性pH的不同细胞内pH。在一个实施方案中,异常条件为细胞内pH为7.2至7.65或细胞内pH为6.5-6.8。在一些实施方案中,可以使用本发明的条件活性病毒颗粒将条件活性Cas蛋白递送至靶细胞。条件活性病毒颗粒可以包含条件活性Cas蛋白和至少一种用于将Cas蛋白引导至Cas蛋白将要进行基因组DNA编辑的位置的导向RNA。条件活性嵌合抗原受体在一些实施方案中,本发明涉及用于与靶抗原结合的嵌合抗原受体(CAR),其包含至少一个抗原特异性靶向区(ASTR)、跨膜结构域(TM);和细胞内信号传导结构域(ISD)。在一些实施方案中,CAR可以进一步包含胞外间隔结构域(ESD)和/或共刺激结构域(CSD)。参见图1。这些CAR可以将细胞毒性细胞(其表达CAR)引导至患病部位以攻击患病细胞(例如癌细胞)。细胞毒性细胞可用于靶向并破坏患病组织和/或病原体。使用这些细胞毒性细胞去除不想要的组织(即靶组织,例如肿瘤)是一种有前途的治疗方法。可被靶向除去的其它组织包括腺体(例如前列腺)增生、疣和不想要的脂肪组织。表达嵌合抗原受体的细胞毒性细胞可以显著改善细胞毒性细胞的特异性和灵敏度。例如,表达CAR的T细胞(CAR-T细胞)能够使用CAR将T细胞引导至靶肿瘤细胞,该靶肿瘤细胞表达特异性结合CAR的细胞表面抗原。这种CAR-T细胞可以将细胞毒性剂更有选择性地递送至肿瘤细胞。CAR-T细胞可以直接识别靶分子,因此通常不受多态呈递元件(例如人白细胞抗原(HLA))的限制。这种CAR靶向策略的优点有三个方面。首先,由于CAR-T细胞的功能不依赖于HLA状态,所以相同的基于CAR的方法可以用于所有表达相同靶表面抗原的肿瘤患者。第二,抗原加工和呈递机制的讹误(corruption)是肿瘤细胞的共同属性,并且可以助长免疫逃逸。然而,这不提供针对CAR-T细胞的保护。第三,可以使用该系统靶向一系列大分子,包括蛋白、碳水化合物和糖脂。ASTR是CAR用于结合特定靶抗原的胞外区,该特定靶抗原包括蛋白质、碳水化合物和糖脂。在一些实施方案中,ASTR包含抗体、特别是单链抗体或其片段。ASTR可以包含全长重链、Fab片段、单链Fv(scFv)片段、二价单链抗体或双抗体,其中每一个对靶抗原都是有特异性的。ASTR还可以包含另一个蛋白功能结构域以识别和结合靶抗原。由于靶抗原可以具有其他生物学功能,例如作为受体或配体,ASTR可选地包含用于与抗原特异性结合的功能结构域。具有功能结构域的蛋白的一些实例包括连接的细胞因子(其引起对具有细胞因子受体的细胞的识别)、亲和体、来自天然存在的受体的配体结合结构域,以及受体(例如肿瘤细胞上的)的可溶性蛋白/肽配体。事实上,如本领域技术人员将会理解的,几乎任何能够以高亲和力结合给定抗原的分子都可用于ASTR。在一个实施方案中,本发明的CAR包含靶向至少两种不同抗原或相同抗原上的两个表位的至少两个ASTR。在一个实施方案中,CAR包含靶向至少三种或更多种不同抗原或表位的三个或更多个ASTR。当在CAR中存在多个ASTR时,ASTR可以串联排列并且可以通过接头肽隔开(图1)。在一个实施方案中,如果单独的VH结构域足以赋予抗原特异性(“单结构域抗体”),则ASTR包含对靶抗原具有特异性并且具有VH结构域、CH1结构域、铰链结构域以及CH2和CH3(Fc)Ig结构域的全长IgG重链。如果产生完全活性的ASTR需要VH结构域和VL结构域两者,则将含有VH的CAR和全长λ轻链(IgL)引入相同的细胞毒性细胞中以产生活性ASTR。在另一个实施方案中,CAR的每个ASTR包含至少两个单链抗体可变片段(scFv),每个对不同的靶抗原具有特异性。scFv,其中一个可变结构域(VH或VL)的C末端通过多肽接头连接到另一个可变结构域(分别为VL或VH)的N末端。已经开发了这样的抗体片段而没有显著破坏抗原结合或结合的特异性(Chaudharyetal.,“Arecombinantsingle-chainimmunotoxincomposedofanti-Tacvariableregionsandatruncateddiphtheriatoxin(由抗Tac可变区和截短的白喉毒素组成的重组单链免疫毒素),”Proc.Natl.Acad.Sci.,第87卷,第9491页,1990;Bedzyketal.,”“Immunologicalandstructuralcharacterizationofahighaffinityanti-fluoresceinsingle-chainantibody(高亲和力抗荧光素单链抗体的免疫学表征和结构表征),”J.Biol.Chem.,第265卷,第18615页,1990)。这些scFv缺少存在于天然抗体的重链和轻链中的恒定区(Fc)。对至少两种不同抗原具有特异性的scFv串联排列。在一个实施方案中,细胞外间隔结构域可以连接在ASTR和跨膜结构域之间。在另一个实施方案中,scFv片段可以与重链的恒定结构域的全部或一部分融合。在另一个实施方案中,CAR的ASTR包含二价单链可变片段(di-scFv、bi-scFv)。在包含di-scFV的CAR中,各自对抗原具有特异性的两个scFv连接在一起以形成具有两个VH区和两个VL区的单个肽链(Xiongetal.,"Developmentoftumortargetinganti-MUC-1multimer:effectsofdi-scFvunpairedcysteinelocationonPEGylationandtumorbinding(肿瘤靶向抗MUC-1多聚体的开发:di-scFv未配对半胱氨酸位置对PEG化和肿瘤结合的影响),"ProteinEngineeringDesignandSelection,第19卷,第359-367页,2006;Kuferetal.,"Arevivalofbispecificantibodies(双特异性抗体的复活),"TrendsinBiotechnology,第22卷,第238-244页,2004)。在另一个实施方案中,ASTR包含双抗体。在双抗体中,使用接头肽形成scFv,该接头肽太短以至于两个可变区不能折叠在一起,使得scFv二聚化。更短的接头(一个或两个氨基酸)导致形成三聚体,即所谓的三抗体。四抗体也可用于ASTR。当CAR中存在两个或更多个ASTR时,ASTR在单个多肽链上通过寡肽或多肽接头、Fc铰链或膜铰链区彼此共价连接。CAR靶向的抗原存在于被靶向除去的组织(例如肿瘤、腺体(例如前列腺)增生、疣和不想要的脂肪组织)中的细胞表面或内部。虽然CAR的ASTR更加高效地识别和结合表面抗原,但CAR也可靶向细胞内抗原。在一些实施方案中,靶抗原优选对癌症、炎性疾病、神经元疾病、糖尿病、心血管疾病或传染病具有特异性。靶抗原的实例包括被各种免疫细胞、癌、肉瘤、淋巴瘤、白血病、生殖细胞肿瘤、母细胞瘤和与各种血液病、自身免疫疾病和/或炎性疾病相关的细胞表达的抗原。ASTR靶向的癌症特异性抗原包括4-IBB、5T4、腺癌抗原、甲胎蛋白、BAFF、B-淋巴瘤细胞、C242抗原、CA-125、碳酸酐酶9(CA-IX)、C-MET、CCR4、CD152、CD19、CD20、CD200、CD22、CD221、CD23(IgE受体)、CD28、CD30(TNFRSF8)、CD33、CD4、CD40、CD44v6、CD51、CD52、CD56、CD74、CD80、CEA、CNT0888、CTLA-4、DR5、EGFR、EpCAM、CD3、FAP、纤连蛋白外结构域B、叶酸受体1、GD2、GD3神经节苷脂、糖蛋白75、GPNMB、HER2/neu、HGF、人分散因子受体激酶、IGF-1受体、IGF-1、IgG1、LI-CAM、IL-13、IL-6、胰岛素样生长因子I受体、整联蛋白α5β1、整联蛋白αvβ3、MORAb-009、MS4A1、MUC1、粘蛋白CanAg、N-羟乙酰神经氨酸、NPC-1C、PDGF-Ra、PDL192、磷脂酰丝氨酸、前列腺癌细胞、RANKL、RON、ROR1、SCH900105、SDC1、SLAMF7、TAG-72、腱生蛋白C、TGF-β2、TGF-β、TRAIL-R1、TRAIL-R2、肿瘤抗原CTAA16.88、VEGF-A、VEGFR-1、VEGFR2或波形蛋白中的一个或多个。ASTR靶向的炎性疾病特异性抗原包括AOC3(VAP-1)、CAM-3001、CCL11(嗜酸性粒细胞趋化因子-1)、CD125、CD147(基础免疫球蛋白)、CD154(CD40L)、CD2、CD20、CD23(IgE受体)、CD25(IL-2受体的链)、CD3、CD4、CD5、IFN-α、IFN-γ、IgE、IgEFc区、IL-1、IL-12、IL-23、IL-13、IL-17、IL-17A、IL-22、IL-4、IL-5、IL-5、IL-6、IL-6受体、整合素α4、整合素α4β7、Lamaglama、LFA-1(CD11a)、MEDI-528、肌肉生长抑制素、OX-40、rhuMAbβ7、壳硬蛋白(scleroscin)、SOST、TGFβ1、TNF-α或VEGF-A中的一个或多个。本发明ASTR靶向的神经元疾病特异性抗原包括β淀粉样蛋白或MABT5102A中的一种或多种。本发明ASTR靶向的糖尿病特异性抗原包括L-Iβ或CD3中的一种或多种。本发明ASTR靶向的心血管疾病特异性抗原包括C5、心肌肌球蛋白、CD41(整联蛋白α-lib)、纤维蛋白II、β链、ITGB2(CD18)和鞘氨醇-1-磷酸酯中的一种或多种。本发明ASTR靶向的感染病特异性抗原包括炭疽毒素、CCR5、CD4、聚集因子A、巨细胞病毒、巨细胞病毒糖蛋白B、内毒素、大肠杆菌、乙型肝炎表面抗原、乙型肝炎病毒、HIV-1、Hsp90、甲型流感血凝素、脂磷壁酸、铜绿假单胞菌、狂犬病病毒糖蛋白、呼吸道合胞病毒和TNF-α中的一种或多种。靶抗原的其它实例包括在癌细胞上发现的特异性或扩增形式的表面蛋白,例如,B细胞淋巴瘤的IL-14受体、CD19、CD20和CD40,多种癌的LewisY和CEA抗原,乳腺癌和结肠直肠癌的Tag72抗原,肺癌的EGF-R,叶酸结合蛋白和通常在人乳腺癌和卵巢癌中扩增的HER-2蛋白;或病毒蛋白,例如HIV的gp120和gp41包膜蛋白、来自乙型和丙型肝炎病毒的包膜蛋白、来自人巨细胞病毒的糖蛋白B和其他包膜糖蛋白、以及来自癌病毒如卡波西肉瘤相关的疱疹病毒的包膜蛋白。其它潜在的靶抗原包括CD4,其中配体为HIVgp120包膜糖蛋白;和其它病毒受体,例如做为人鼻病毒的受体的ICAM,以及脊髓灰质炎病毒的相关受体分子。CAR的胞外间隔结构域是位于ASTR和跨膜结构域之间的亲水区。在一些实施方案中,该结构域有利于CAR的适当的蛋白折叠。胞外间隔域是CAR的任选组分。胞外间隔结构域可以包含选自抗体的Fc片段、抗体的铰链区、抗体的CH2区、抗体的CH3区、人工间隔序列或其组合的结构域。胞外间隔结构域的实例包括CD8a铰链、由可以小至三个甘氨酸(Gly)的多肽组成的人工间隔区以及IgG(例如人IgG4)的CH1和CH3结构域。CAR的跨膜结构域是能够跨越细胞毒性细胞的质膜的区域。跨膜结构域选自跨膜蛋白(例如I型跨膜蛋白)的跨膜区、人工疏水序列或其组合。跨膜结构域的实例包括T细胞受体、CD28、CD3ε、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、CD154的α链、β链或ζ链的跨膜区域。合成的跨膜结构域可以包含苯丙氨酸、色氨酸和缬氨酸的三联体。任选地,短的寡肽或多肽接头(优选长度为2至10个氨基酸)可形成CAR的跨膜结构域和细胞内信号传导结构域之间的连接。甘氨酸-丝氨酸二联体在跨膜结构域和细胞内信号传导结构域之间提供特别合适的接头。本发明的CAR还包含细胞内信号传导结构域。细胞内信号传导结构域转导效应子功能信号并指导细胞毒性细胞发挥其专门功能,即损害和/或破坏靶细胞。细胞内信号传导结构域的实例包括T细胞受体复合物的ζ链或其任何同源物,例如η链、FcεRly和β链、MB1(Iga)链、B29(Ig)链等、人CD3ζ链、CD3多肽(Δ、δ和ε)、syk家族酪氨酸激酶(Syk、ZAP70等)、src家族酪氨酸激酶(Lck、Fyn、Lyn等)和参与T细胞转导的其他分子,例如CD2、CD5和CD28。具体地,细胞内信号传导结构域可以为人CD3ζ链、FcyRIII、FcsRI、Fc受体的细胞质尾、携带细胞质受体的基于免疫受体酪氨酸的激活基序(ITAM)及其组合。在一些实施方案中,细胞内信号传导结构域包含TCRζ、FcRγ、FcRβ、CD3γ、CD3δ、CD3ε、CD5、CD22、CD79a、CD79b或CD66d的细胞质信号传导结构域。特别优选的是,CAR中的细胞内信号传导结构域包含人CD3ζ的细胞质信号传导结构域。本发明的CAR可以包含共刺激结构域,其具有增强细胞增殖、细胞存活和针对表达CAR的细胞毒性细胞的记忆细胞发育的功能。本发明的CAR可以包含一个或多个共刺激结构域,其选自TNFR超家族、CD28、CD137(4-IBB)、CD134(OX40)、Dap1O、CD27、CD2、CD7、CD5、ICAM-1、LFA-1(CD11a/CD18)、Lck、TNFR-1、PD-1、TNFR-II、Fas、CD30、CD40、ICOSLIGHT、NKG2C、B7-H3或其组合中的蛋白的共刺激结构域。如果CAR包含多于一个共刺激结构域,则这些结构域可以串联布置,任选地通过接头隔开。共刺激结构域是可位于CAR中的跨膜结构域和细胞内信号传导结构域之间的细胞内结构域。在一些实施方案中,本发明的CAR的两个或更多个组分通过一个或多个接头分开。例如,在包含至少两个ASTR的CAR中,两个ASTR可以通过接头隔开。接头是长度为约1至100个氨基酸的寡肽或多肽区。在一些实施方案中,接头的长度可以是例如5-12个氨基酸,5-15个氨基酸或5-20个氨基酸。接头可以由柔性残基如甘氨酸和丝氨酸组成,使得相邻的蛋白结构域相对于彼此自由移动。更长的接头,例如比100个氨基酸更长的接头,可以与本发明的替代实施方式结合使用,并且可以选择这样的接头以例如确保两个相邻结构域在空间上不会彼此干扰。可用于本发明的接头的实例包括但不限于2A接头(例如T2A)、2A样接头或其功能等同物。本发明提供了用于与靶抗原结合的条件活性嵌合抗原受体,其中所述抗原特异性靶向区是从野生型蛋白或其结构域演变而来的,并且具有以下特性的至少一种:(a)在正常生理条件下的测试中较野生型蛋白活性下降,以及(b)在异常条件下的测试中较野生型蛋白活性增强。这意味着ASTR是条件活性蛋白,这一点确保了包含ASTR的CAR是条件活性的。本发明的条件活性CAR具有以下两种特性或其中之一:(1)在正常生理条件下它们对靶抗原的亲和力可逆地或不可逆地降低,和(2)在存在异常条件的患病部位(例如肿瘤微环境或滑液)与不具有条件活性抗原特异性靶向区的相同CAR相比,亲和力增强。由于这些性质,条件活性CAR可优先将细胞毒性细胞引导至患病部位。这种条件活性CAR可以显著减少副作用并允许使用更高剂量的治疗剂来提高治疗功效。条件活性CAR对于开发需要在受试者体内短时间或有限时间的新型治疗剂特别有价值。有益应用的实例包括高剂量的全身治疗以及高浓度的局部治疗。本发明的条件活性CAR通常由包含编码CAR的不同结构域的多核苷酸序列的表达载体产生。本发明的用于识别靶细胞上的抗原并与其结合的ASTR是条件活性的,并且与相应的野生型蛋白的ASTR或其结合结构域(野生型ASTR)相比,其在正常生理条件下没有与靶抗原结合的活性或与靶抗原结合的活性较低,在异常条件下与靶抗原结合的活性较高。一旦本发明鉴定了条件活性ASTR,可通过连接编码单个结构域的多核苷酸序列以形成单个多核苷酸序列(编码条件活性CAR的CAR基因)来组装嵌合抗原受体。各个结构域包括条件活性ASTR、TM和ISD。在一些实施方案中,还可以在CAR中引入其他结构域,包括abESD和CSD(图1)。如果条件活性CAR是双特异性CAR,则CAR基因在N末端至C末端方向可以是例如以下构型:N末端信号序列-ASTR1-接头-ASTR2-胞外间隔结构域-跨膜结构域-共刺激结构域-细胞内信号传导结构域。在一个实施方案中,这样的CAR基因可以包含两个或更多个共刺激结构域。或者,编码条件活性CAR的多核苷酸序列可以在N末端至C末端方向上具有以下构型:N末端信号序列-ASTR1-接头-ASTR2-跨膜结构域-共刺激结构域-细胞内信号传导结构域。在一个实施方案中,这样的CAR可以包含两个或更多个共刺激结构域。如果CAR包含多于两个ASTR,则编码CAR的多核苷酸序列在N末端至C末端方向可以是以下构型:N末端信号序列-ASTR1-接头-ASTR2-接头-(抗原特异性靶向区)n-跨膜结构域-共刺激结构域-细胞内信号传导结构域。这样的CAR可以进一步包含胞外间隔结构域。每个ASTR可以通过接头隔开。在一个实施方案中,这样的CAR可以包含两个或更多个共刺激结构域。通过表达载体将条件活性CAR引入细胞毒性细胞。本文还提供了包含编码本发明的条件活性CAR的多核苷酸序列的表达载体。合适的表达载体包括慢病毒载体、γ逆转录病毒载体、泡沫病毒载体、腺相关病毒(AAV)载体、腺病毒载体、工程化杂交病毒、裸DNA,包括但不限于转座子介导的载体,例如SleepingBeauty、Piggybak、整合酶(如Phi31)。一些其它合适的表达载体包括单纯疱疹病毒(HSV)表达载体和逆转录病毒表达载体。腺病毒表达载体基于腺病毒,其具有低的整合至基因组DNA的能力但具有高的转染宿主细胞的效率。腺病毒表达载体含有足以:(a)支持表达载体的包装和(b)最终在宿主细胞中表达CAR基因的腺病毒序列。腺病毒基因组是36kb的线性双链DNA,其中可以插入外源DNA序列(例如CAR基因)以取代大片腺病毒DNA,以制备本发明的表达载体(GrunhausandHorwitz,“Adenovirusesascloningvectors,”SeminarsVirol.,第3卷,第237-252页,1992)。另一种表达载体基于腺相关病毒(AAV)的,其利用腺病毒偶联系统。这种AAV表达载体具有高的整合到宿主基因组中的频率。它甚至可以感染非分裂细胞,因此使其可用于例如在组织培养物中或在体内将基因递送到哺乳动物细胞中。AAV载体具有广泛的感染性宿主范围。关于AAV载体的产生和使用的细节描述于美国第5,139,941号和第4,797,368号专利中,上述每篇文献通过引用并入本文。逆转录病毒表达载体能够整合到宿主基因组中,递送大量的外源遗传物质,感染大范围的物种和细胞类型并包装在特殊的细胞系中。通过在某些位置将核酸(例如,编码CAR的核酸)插入病毒基因组中以产生复制缺陷性的病毒来构建逆转录病毒载体。虽然逆转录病毒载体能够感染多种细胞类型,但是CAR基因的整合和稳定表达需要宿主细胞的分裂。慢病毒载体衍生自慢病毒,慢病毒是复杂的逆转录病毒,除了常见的逆转录病毒基因gag、pol和env之外,其还含有具有调节或结构功能的其它基因(美国第6,013,516号和第5,994,136号专利)。慢病毒的一些实例包括人免疫缺陷病毒(HIV-1、HIV-2)和猿猴免疫缺陷病毒(SIV)。通过多次减弱HIV毒力基因产生慢病毒载体,例如,使基因env、vif、vpr、vpu和nef缺失以使载体在生物学上是安全的。慢病毒载体能够感染非分裂细胞,并且可用于体内和离体基因转移和CAR基因的表达(美国第5,994,136号专利,该文献通过引用并入本文)。可以通过本领域技术人员已知的任何方法将包含条件活性CAR基因的表达载体引入宿主细胞。如果需要,表达载体可以包括用于转染的病毒序列。或者,可以通过融合、电穿孔、基因枪(biolistics)、转染、脂质转染等引入表达载体。宿主细胞可以在导入表达载体之前在培养物中生长和扩增,然后进行适当的处理以引入和整合载体。然后借助载体中存在的标记物扩增和筛选宿主细胞。可以使用的多种标记物包括hprt、新霉素抗性、胸苷激酶、潮霉素抗性等。本文中使用的术语“细胞”、“细胞系”和“细胞培养物”可以互换使用。在一些实施方案中,宿主细胞为T细胞、NK细胞和NKT细胞。在另一方面,本发明还提供了包含并稳定表达本发明的条件活性CAR的基因工程化细胞毒性细胞。在一个实施方案中,基因工程化细胞包括T淋巴细胞(T细胞)、初始T细胞(TN)、记忆T细胞(例如中枢记忆T细胞(TCM)、效应记忆T细胞(TEM)、天然杀伤细胞和能够产生治疗相关后代的巨噬细胞。在另一个实施方案中,基因工程化细胞是自体细胞。合适的T细胞的实例包括CD4+/CD8-、CD4-/CD8+、CD4-/CD8-或CD4+/CD8+T细胞。T细胞可以是CD4+/CD8-和CD4-/CD8+细胞的混合群体或单个克隆的群。当在体外与表达靶抗原的细胞(例如CD20+和/或CD19+肿瘤细胞)共培养时,本发明的CD4+T细胞还可以产生IL-2、IFN-γ、TNF-α和其它T细胞效应细胞因子。本发明的CD8+T细胞可以溶解表达靶抗原的细胞。在一些实施方案中,T细胞可以是CD45RA+CD62L+初始细胞、CD45ROCD62I7中枢记忆细胞、CD62L”效应记忆细胞或其组合中的任何一种或多种(Bergeretal.,“Adoptivetransferofvirus-specificandtumor-specificTcellimmunity(病毒特异性和肿瘤特异性T细胞免疫的过继转移),”Curr.Opin.Immunol.,第21卷,第224-232页,2009)。可以通过用包含本发明的CAR基因的表达载体稳定转染细胞产生基因工程化细胞毒性细胞。使用表达载体基因工程化细胞的其它方法包括化学转化方法(例如,使用磷酸钙、树枝状大分子、脂质体和/或阳离子聚合物)、非化学转化方法(例如电穿孔、光学转化、基因电转移和/或水动力递送)和/或基于颗粒的方法(例如,使用基因枪和/或磁转染的刺穿感染(impalefection))。证明存在单个整合的未重排载体并表达条件活性CAR的转染细胞可以离体扩增。用于将表达载体引入宿主细胞的物理方法包括磷酸钙沉淀、脂质转染、粒子轰击、显微注射、电穿孔等。用于产生包含载体和/或外源核酸的细胞的方法是本领域众所周知的。参见,例如Sambrooketal.(2001,MolecularCloning:ALaboratoryManual(分子克隆:实验室手册),ColdSpringHarborLaboratory,NewYork)。用于将表达载体引入宿主细胞的化学方法包括胶体分散系统,例如大分子复合物、纳米胶囊、微球、珠和基于脂质的系统,包括水包油乳剂、胶束,混合胶束和脂质体。在各种实施方案中,本发明提供了包含药学上可接受的赋形剂和治疗有效量的本发明的条件活性CAR的药物组合物。组合物中的条件活性CAR可以是编码CAR的多核苷酸、包含条件活性CAR的蛋白或表达CAR蛋白的经遗传修饰的细胞中的任何一种或多种。条件活性CAR蛋白可以是药学上可接受的盐的形式。药学上可接受的盐是指可以在制药工业中作为治疗性蛋白的盐使用的盐,包括例如,钠、钾、钙等的盐,以及普鲁卡因、二苄基胺、乙二胺、乙醇胺、甲基葡糖胺、牛磺酸等的铵盐,以及酸加成盐如盐酸盐和碱性氨基酸等。用本发明的基因工程化细胞毒性细胞或药物组合物治疗的癌症的类型包括癌、母细胞瘤和肉瘤,以及某些白血病或淋巴样恶性肿瘤、良性和恶性肿瘤(benignandmalignanttumors)和恶性肿瘤(malignancies),例如肉瘤、癌和黑色素瘤。癌症可以是非实体瘤(例如血液肿瘤)或实体瘤。还包括成人肿瘤/癌症和儿科肿瘤/癌症。血液癌症是血液或骨髓的癌症。血液学(或血液性)癌症的实例包括白血病,白血病包括急性白血病(例如急性淋巴细胞性白血病、急性髓细胞性白血病、急性骨髓性白血病和成髓细胞性白血病、早幼粒细胞白血病、骨髓单核细胞白血病、单核细胞白血病和红白血病)、慢性白血病(例如慢性髓细胞性白血病、慢性骨髓性白血病和慢性淋巴细胞白血病)、真性红细胞增多症、淋巴瘤、霍奇金病、非霍奇金淋巴瘤(无痛形式和高级形式)、多发性骨髓瘤、瓦尔登斯特伦巨球蛋白血症、重链病、骨髓增生异常综合征、毛细胞白血病和骨髓增生异常。实体瘤是通常不包含囊肿或液体区域的异常组织块。实体瘤可以是良性的或恶性的。按照形成实体瘤的细胞类型命名了不同类型的实体瘤(例如肉瘤、癌和淋巴瘤)。实体瘤如肉瘤和癌的实例包括纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、骨肉瘤和其他肉瘤、滑膜瘤、间皮瘤、尤文氏瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、淋巴恶性肿瘤、胰腺癌、乳腺癌、肺癌、卵巢癌、前列腺癌、肝细胞癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、甲状腺乳头状癌、嗜铬细胞瘤、皮脂腺癌、乳头状癌、乳头状腺癌、髓样癌、支气管癌、肾细胞癌、肝细胞癌、胆管癌、绒毛膜癌、维尔姆斯瘤、宫颈癌、睾丸肿瘤、精原细胞瘤、膀胱癌、黑素瘤和CNS肿瘤(例如神经胶质瘤(如脑干胶质瘤和混合型胶质瘤)、成胶质细胞瘤(glioblastoma,也称为glioblastomamultiforme)、星形细胞瘤、CNS淋巴瘤、生殖细胞瘤、成神经管细胞瘤、神经鞘瘤、颅咽管瘤、室管膜瘤、松果体瘤、成血管细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤、成神经细胞瘤、视网膜母细胞瘤和脑转移)。在一些实施方案中,本发明提供了一种方法,其包括从受试者中取得细胞毒性细胞,通过将本发明的CAR基因引入该细胞毒性细胞基因来工程化该细胞毒性细胞,并将经基因工程化的细胞毒性细胞施用于受试者。在一些实施方案中,细胞毒性细胞选自T细胞、初始T细胞、记忆T细胞、效应T细胞、天然杀伤细胞和巨噬细胞。在一个实施方案中,细胞毒性细胞为T细胞。在一个实施方案中,T细胞获自受试者。T细胞可以从许多来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾组织和肿瘤。在本发明的某些实施方案中,可以使用本领域可用的任何数量的T细胞系。在本发明的某些实施方案中,可以使用本领域技术人员已知的任何数量的技术(例如FicollTM分离)从获自受试者的血液中获得T细胞。在一个优选的实施方案中,来自个体的循环血液的细胞通过单采术(apheresis)获得。单采术产物通常含有淋巴细胞,包括T细胞、单核细胞、粒细胞、B细胞、其他有核白细胞、红细胞和血小板。在一个实施方案中,可以洗涤通过单采血术采集的细胞以除去血浆部分并将细胞置于适当的缓冲液或培养基中用于随后的处理步骤。在本发明的一个实施方案中,用磷酸盐缓冲盐水(PBS)洗涤细胞。在替代实施方案中,洗涤溶液缺乏钙并且可缺乏镁或可缺乏许多(如果不是全部)二价阳离子。此外,令人惊讶地,在不存在钙的情况下的初始活化步骤导致放大的活化。如本领域普通技术人员容易理解的,洗涤步骤可以通过本领域技术人员已知的方法,例如通过使用半自动“流通”离心机(例如Cobe2991细胞处理器,BaxterCytoMate或血细胞回输仪(HaemoneticsCellSaver)5)并按照制造商的说明书进行。洗涤后,可以将细胞重悬于多种生物相容性缓冲液中,例如不含Ca2+且不含Mg2+的PBS、勃脉力A或者含或不含缓冲液的另一种盐溶液。或者,可以除去单采术样品的不期望的组分,并将细胞直接重悬浮在培养基中。在另一个实施方案中,通过溶解红细胞并排除单核细胞(例如通过PERCOLLTM梯度离心或通过逆流淘析离心法)从外周血分离T细胞。可以通过阳性或阴性选择技术进一步分离特定的T细胞亚群,例如CD3+、CD28+、CD4+、CD8+、CD45RA+和CD45RO+T细胞。例如,通过阴性选择富集T细胞群可以用针对阴性选择的细胞所特有的表面标志物的抗体的组合来实现。一种方法是通过负磁性免疫粘附或流式细胞术进行的细胞分选和/或选择,其使用针对存在于阴性选择的细胞上的细胞表面标志物的单克隆抗体的混合物。为了通过阴性选择来富集CD4+细胞,单克隆抗体混合物通常包括针对CD14、CD20、CD11b、CD16、HLA-DR和CD8的抗体。在某些实施方案中,可能需要富集或阳性选择通常表达CD4+、CD25+、CD62Lhi、GITR+和FoxP3+的调节性T细胞。例如,在一个实施方案中,通过与CD3抗体/CD28抗体(即3×28)缀合的珠(例如M-450CD3/CD28T)孵育足以阳性选择所需T细胞的一段时间来分离T细胞。在一个实施方案中,该时间段为约30分钟。在另一个实施方案中,该时间段范围为30分钟至36小时或更长,以及其间的所有整数值。在另一个实施方案中,所述时间段为至少1、2、3、4、5或6小时。在另一个优选的实施方案中,所述时间段为10-24小时。在一个优选的实施方案中,孵育时间段为24小时。为了从患有白血病的患者中分离T细胞,使用更长的孵育时间(例如24小时)可以增加细胞得率。在与其他细胞类型相比T细胞较少的任何情况下,例如从肿瘤组织或免疫受损个体分离肿瘤浸润淋巴细胞(TIL)时,可以使用更长的孵育时间来分离T细胞。此外,使用更长的孵育时间可以提高捕获CD8+T细胞的效率。因此,通过简单地缩短或延长T细胞与CD3/CD28珠结合的时间和/或通过增加或减少珠与T细胞的比例(如在本文中进一步描述的),在培养开始时或在过程中的其它时间点可以优先选择针对的T细胞亚群。此外,通过增加或降低珠或其它表面上的CD3抗体和/或CD28抗体的比例,在培养开始时或在过程中的其它时间点可以优先选择针对的T细胞亚群。技术人员会认识到本发明的上下文也可采用多轮选择。在某些实施方案中,可能期望执行选择过程并在激活和扩增过程中使用“未选择的”细胞。也可以使“未选择的”细胞经历其他轮的选择。然后对获得的细胞毒性细胞进行如本文所述的基因工程化。将编码条件活性CAR的多核苷酸(通常位于表达载体中)引入细胞毒性细胞中,使得细胞毒性细胞将表达,优选稳定表达CAR。通常将编码CAR的多核苷酸整合到细胞毒性细胞宿主基因组中。在一些实施方案中,多核苷酸引入不需要导致整合,而是仅仅对引入的多核苷酸的瞬时保持可能就足够了。以这种方式,可以具有短期效应,其中细胞毒性细胞可以被引入宿主中,然后在预定时间之后开启,例如,在细胞已经能够迁移到特定治疗部位之后。根据细胞毒性细胞的性质和待治疗的疾病,可以以各种各样的方式将基因工程化的细胞毒性细胞引入受试者(例如,哺乳动物)。可以在肿瘤部位引入基因工程化细胞毒性细胞。在一个实施方案中,基因工程化的细胞毒性细胞导向癌症或被修饰以导向癌症。使用的基因工程化细胞毒性细胞的数量将取决于许多因素,例如环境、引入的目的、细胞的寿命、所使用的方案(例如,施用次数)、细胞增殖的能力和重组构建体的稳定性。基因工程化的细胞毒性细胞可以作为分散体施用,通常在感兴趣的位点处或附近注射。细胞可以在生理上可接受的培养基中。应当理解,治疗方法受多变量影响,例如对条件活性CAR的细胞应答、细胞毒性细胞表达条件活性CAR的效率以及,视情况而定,分泌水平、表达的条件活性CAR的活性、受试者的特定需要(其可随时间和情况而变化)、基因工程化的细胞毒性细胞丧失或个体细胞的表达活性丧失引起的细胞活性丧失的速率,等等。因此,期望对每个个体患者,即使存在可以对群体施用的通用细胞,对每个患者进行针对个体的适当剂量方面的监测,并且这种监测患者的实践在本领域中是常规的。由母体分子生成演变分子条件活性蛋白可通过对野生型蛋白进行诱变并筛选单个突变的过程产生,该单个突变在野生型条件下活性降低,在非野生型条件下保持与野生型条件相同的活性或具有更高的活性。任何化学合成或重组诱变方法可用于产生突变多肽群。除非另有说明,本发明的实践可以采用传统的细胞生物学、细胞培养、分子生物学、转基因生物学、微生物学、重组DNA和免疫学的常规技术。这样的技术在文献中得到了充分阐述。参见,例如,MolecularCloningALaboratoryManual(分子克隆A实验室手册),2ndEd.,ed.bySambrook,FritschandManiatis(ColdSpringHarborLaboratoryPress:1989);DNACloning(DNA克隆),VolumesIandII(D.N.Glovered.,1985);OligonucleotideSynthesis(寡核苷酸合成)(M.J.Gaited.,1984);Mullisetal.美国专利号4,683,195;NucleicAcidHybridization(核酸杂交)(B.D.Hames&S.J.Higginseds.1984);TranscriptionAndTranslation(转录和转译)(B.D.Hames&S.J.Higginseds.1984);CultureOfAnimalCells(动物细胞培养)(R.I.Freshney,AlanR.Liss,Inc.,1987);ImmobilizedCellsAndEnzymes(固定的细胞和酶)(IRLPress,1986);B.Perbal,APracticalGuideToMolecularCloning(分子克隆的实践指南)(1984);thetreatise,MethodsInEnzymology(专著-酶学中的方法)(AcademicPress,Inc.,N.Y.);GeneTransferVectorsForMammalianCells(哺乳动物细胞的基因转移载体)(J.H.MillerandM.P.Cabseds.,1987,ColdSpringHarborLaboratory);MethodsInEnzymology(酶学中的方法),第154卷和第155卷(Wuetal.eds.),ImmunochemicalMethodsInCellAndMolecularBiology(细胞和分子生物学中的免疫化学方法)(MayerandWalker,eds.,AcademicPress,London,1987);HandbookOfExperimentalImmunology(试验免疫学手册),Volumesl-IV(D.M.WeirandC.C.Blackwell,eds.,1986);ManipulatingtheMouseEmbryo(小鼠胚胎操作),(ColdSpringHarborLaboratoryPress,ColdSpringHarbor,N.Y.,1986)。本发明提供生产编码具有酶活性的多肽的核酸变体的方法,其中所述变体具有较天然存在的改变的生物活性,该方法包括:(a)修饰核酸,通过(i)将一个或多个核苷酸替换成不同的核苷酸,其中所述核苷酸包括自然的或非自然的核苷酸,(ii)缺失一个或多个核苷酸,(iii)添加一个或多个核苷酸,或(iv)它们的任意组合。在一个方面,非自然的核苷酸包括肌苷。在另一个方面,该方法进一步包括检测由修饰的核酸编码的多肽的改变的酶活性,以确定该编码具有改变的酶活性的修饰的核酸。在一个方面,修饰的步骤(a)由PCR、易错PCR、改组、寡核苷酸定向诱变、装配PCR、有性PCR诱变、体内诱变、盒式诱变、循环总体诱变、指数总体诱变、特异位点诱变、基因重组、基因位点饱和诱变、连接酶链式反应、体外诱变、连接酶链式反应、寡核苷酸合成、任何生成DNA的技术和它们的任意组合构成。在另一个方面,该方法进一步包括至少一个修饰步骤(a)的重复。本发明进一步提供一种从两个或两个以上的核酸生成多核苷酸的方法,该方法包括:(a)确定两个或两个以上的核酸之间的相同部分和不同部分,其中至少一个核酸包括本发明的核酸;(b)提供一组与两个或两个以上核酸中的至少两个序列相关的寡核苷酸;以及(c)用聚合酶延伸该寡核苷酸,由此生成多核苷酸。任何诱变技术可用于本发明的各种实施方案中。随机的(Stochastic)或随机(random)诱变例举亲本分子突变(修饰的或改变的)情形,产生一组具有预先不确定突变的后代分子。因而,在体外随机诱变反应中,例如没有意向中产量的具体预定的产物;有关获得的突变的确切性质,还有有关生成的产物是不确定的,因此是随机的。随机诱变出现于例如易错PCR和随机改组的方法中,其中获得的突变是随机的和预先不确定的。变体形式可由易错转录如易错PCR产生,或使用缺少纠错功能的聚合酶(见Liao(1990)Gene88:107-111),第一变体形式,或通过在致突变菌株(mutatorstrain)(致突变宿主细胞将在下面作进一步详细讨论,其通常是众所周知)中复制该第一变体形式。致突变菌株可包括在任何错配修复功能受损的生物体中的任何突变。这些突变包括mutS、mutT、mutH、mutL、ovrD、dcm、vsr、umuC、umuD、sbcB、recJ等的突变基因产物。损伤是通过加入试剂,如小化合物或表达的反义RNA或其它技术产生的基因突变、等位基因置换、选择性抑制而获得的。损伤可以是基因的损伤,或任何生物体同源基因的损伤。目前广泛使用的用于从起始分子产生可替代蛋白的诱变方法是寡核苷酸定向诱变技术、易错聚合酶链式反应(易错PCR)和盒式诱变,其中特定的待优化区被合成的诱变寡核苷酸替换。在这些情况下,许多突变位点围绕起始序列中的某些位点产生。在寡核苷酸定向诱变中,短序列被合成的诱变寡核苷酸替换。在寡核苷酸定向诱变中,使用限制性酶消化,从多核苷酸中去掉多核苷酸的短序列,且其被合成的其中多个碱基相对于起始序列发生变化的多核苷酸替换。多核苷酸序列也可以通过化学诱变改变。化学诱变剂包括,例如,亚硫酸氢钠、亚硝酸、羟胺、肼或甲酸。核苷酸前体的类似物的其它试剂包括亚硝基胍、5-溴尿嘧啶、2-氨基嘌呤或吖啶。一般来说,这些试剂被添加到PCR反应中替换核苷酸前体,从而使序列突变。也可使用插入剂如普罗黄素、吖啶黄、奎纳克林等。多核苷酸序列的随机突变也可通过X射线或紫外线照射获得。一般来说,如此诱变的质粒多核苷酸被引入大肠杆菌中并作为杂种质粒的池(pool)或文库扩繁。易错PCR使用低精确度(low-fidelity)聚合作用条件在长序列上引入低水平的随机点突变。在未知序列的片段的混合物中,可使用易错PCR诱变该混合物。在盒式诱变中,单模板的序列块通常由(部分)随机序列替换。Reidhaar-OlsonJF和SauerRT:作为蛋白序列信息内容探针的组合盒式诱变(Combinatorialcassettemutagenesisasaprobeoftheinformationalcontentofproteinsequences);Science241(4861):53-57,1988。此外,任何非随机的(non-stochastic)或非随机(non-random)诱变技术可用于本发明的各种实施方案中。非随机诱变的示例情况为如亲本分子被突变(被修饰或改变),从而产生具有一个或多个预定突变的后代分子。可以理解,现实是在许多发生分子加工的反应中存在一定量的背景产物,这些背景产物的存在不影响具有预定产物的诱变方法的非随机性质。定点饱和诱变和合成连接重组是目标产物确切化学结构预定的诱变技术的实例。一种定点饱和突变的方法公开于美国专利申请公开第2009/0130718号,通过参考并入于此。该方法提供了与模板多核苷酸的密码子对应的一套简并引物,进行聚合酶延伸产生包含对应于该简并引物的序列的多核苷酸后代。可表达和筛选该多核苷酸后代以用于定向演变。具体来说,这是产生一组后代多核苷酸的方法,包括步骤(a)提供模板多核苷酸拷贝,各含有大量编码模板多肽序列的密码子;以及(b)对各模板多核苷酸的密码子进行如下步骤:(1)提供一套简并引物,其中各引物含有与模板多核苷酸的密码子对应的简并密码子和至少一个与模板多核苷酸密码子的毗邻序列同源的毗邻序列;(2)提供条件使引物与模板多核苷酸的拷贝退火结合;以及(3)从引物开始沿着模板进行聚合酶延伸反应;由此产生多核苷酸后代,各多核苷酸后代含有与退火引物的简并密码子对应的序列;由此生成一组多核苷酸后代。定点饱和诱变涉及核酸的定向演变和筛选含有演变的核酸的克隆以获得目标活性,如核酸活性和/或特定的蛋白尤其是酶的目标活性。由这一技术提供的突变分子可含有嵌合分子和具有点突变的分子,包括含有碳水化合物、脂类、核酸和/或蛋白成分的生物分子,具体的但不限于以下实例,包括抗生素、抗体、酶、甾体和非甾体类激素。定点饱和诱变一般涉及方法1)制备分子后代(包括由多核苷酸序列组成的分子,由多肽序列组成的分子,以及由部分多核苷酸序列和部分多肽序列组成的分子),从一个或多个祖先或亲代模板,诱变以获得至少一个点突变、添加、缺失和/或嵌合;2)筛选后代分子(优选采用高通量法)筛选出至少一种目标特性(如酶活性的提高或稳定性的增加或新的化疗效果);3)任选地获得和/或编目结构和/或与亲代和/或后代分子有关的功能性信息;以及4)任选地重复步骤1)-步骤3)的任何步骤。在定点饱和诱变中,产生(例如从亲代多核苷酸模板)—在称为“密码子定点饱和诱变”中—多核苷酸后代,各多核苷酸后代含有一套至少多达三个连续的点突变(即含有新密码子的不同碱基),从而每个密码子(或每个编码相同氨基酸的简并密码子家族)在每个密码子位置被代表。对应于并由该多核苷酸后代编码,也产生一套多肽后代,各自具有至少一个单独的氨基酸点突变。在一个优选的方面,在所称的“氨基酸定点饱和诱变”中,沿着多肽在每个氨基酸位置上产生针对19种天然编码的多肽形成α氨基酸置换的突变多肽。对于沿着亲代多肽的每个氨基酸位置,这产生了包括原始氨基酸在内的总计20种不同的多肽后代,如果使用其他氨基酸代替20种自然编码的氨基酸或者在20种天然氨基酸之外使用其他氨基酸,则产生可能≥21种不同的多肽后代。也可采用其它诱变技术,包括重组和更具体的通过含有部分同源区的多核苷酸序列的体内重排的方法来制备编码多肽的多核苷酸的方法,重组该多核苷酸以生成至少一个多核苷酸,并筛选该多核苷酸以产生具有有用属性的多肽。在另一个方面,诱变技术利用细胞的自然属性,以重组分子和/或介导降低序列复杂性和重复或连续的具有同源区的序列范围的还原过程。各种诱变技术,可单独使用或组合使用,提供制备编码生物活性增强的杂种多肽的杂种多核苷酸的方法。在实现这些和其它目标中,按照本发明的一个方面,提供了向合适的宿主细胞中引入多核苷酸并使该宿主细胞在产生杂种多核苷酸的条件下生长的方法。通过使用由限制性酶产生的相容粘末端连接2个多核苷酸片段生成嵌合基因,其中各片段来自单独的祖先(或亲代)分子。另一个实例是亲代多核苷酸的单一密码子位置的诱变(即获得密码子替换、添加或缺失),以产生编码单一位点诱变的多肽的单一多核苷酸后代。此外,已采用体内位点特异性重组系统产生基因杂种,以及体内重组中的随机方法,和同源的但在质粒中截短的基因之间的重组。也有报道通过重叠延伸和PCR产生诱变。非随机的方法已被用来获得大量的点突变和/或嵌合(chimerization),例如全面或详尽的方法已被用来在特定的突变组中产生所有分子,功能归于模板分子中的特定结构群(例如特定的单一氨基酸位置或由两个或两个以上氨基酸位置构成的序列),用以分类和比较特定的突变组。这些或其它演变方法中的任一种方法可用于本发明中,从一个或多个亲代分子产生新的分子群体(文库)。在一些实施方案中,编码野生型蛋白的多核苷酸及其突变体可以通过几种已知的方法进行扩增。最好的已知扩增方法之一是聚合酶链式反应(称为PCR),其详细描述于美国专利号4,683,195、4,683,202和4,800,159以及“PCRProtocols:Aguidetomethodsandapplications(PCR方案:方法和应用指南),”editedbyMichaelA.Innisetal.,AcademicPress,1990,其中每一篇通过引用整体并入本文。用于扩增的另一种方法为EP0320308A2中公开的连接酶链反应(“LCR”),该文献通过引用整体并入本文。在LCR中,制备两个互补探针对,并且在待扩增序列存在下,每对探针将结合所述序列的相对的互补链,使得它们邻接。在连接酶存在下,两个探针对会连接以形成单个单元。通过温度循环,如在PCR中,结合的连接单元从序列解离,然后用作用于连接过量探针对的“靶序列”。美国专利专利号4,883,750描述了类似于LCR的用于将探针对与序列结合的方法。描述于WO/1987/006270中的Qbeta复制酶也可以用作扩增方法。在该方法中,在RNA聚合酶存在下,将具有与待扩增序列的区域互补的区域的RNA复制序列添加至样品。聚合酶将复制可以检测的复制序列。等温扩增方法也可用于核酸扩增,其中限制性内切核酸酶和连接酶用于实现在一条限制位点的链中含有核苷酸5'-[α-硫代]-三磷酸的序列的扩增(Walkeretal.,Proc.Nat'lAcad.Sci.USA,第89卷,第392-396页,1992)。链置换扩增(SDA)是进行多核苷酸序列的等温扩增的另一种方法,其涉及多轮链置换和合成,即切口平移。称为修复链反应(RCR)的类似方法包括在目标扩增区域中对几个探针进行退火,然后进行修复反应,其中仅存在四种碱基中的两种。其它两种碱基可以作为生物素化衍生物加入以便于检测。在SDA中使用类似的方法。还可以使用循环探针反应(CPR)来检测靶特异性序列。在CPR中,具有非特异性DNA的3'和5'序列和特定RNA的中间序列的探针与存在于样品中的DNA杂交。在杂交时,用RNaseH处理反应,并且探针的产物被鉴定为在消化后释放的独特产物。将原始序列退火至另一个循环探针,并重复该反应。根据本发明可以使用描述于第2202328号英国专利申请和WO1989/009284中的其它扩增方法,上述文献各自通过引用整体并入本文。在前一个申请中,“修饰的”引物用于PCR样、模板(待扩增的序列)和酶依赖性合成。可以通过用捕获部分(例如,生物素)和/或检测部分(例如,酶)标记来修饰引物。在后一种应用中,将过量的标记探针加入样品中。在靶序列的存在下,探针结合并被催化切割。切割后,靶序列完整释放以被过量探针结合。标记的探针的切割表明靶序列的存在。其他核酸扩增方法包括基于转录的扩增系统(TAS),包括基于核酸序列的扩增(NASBA)和3SR(Kwohetal.,Proc.Natl.Acad.Sci.USA,第86卷,第1173-1177页,1989)。在NASBA中,可以通过以下方法制备用于扩增的多核苷酸:标准苯酚/氯仿提取制备、临床样品的热变性、用裂解缓冲液和用于分离DNA和RNA的minispin柱处理或RNA的氯化胍提取。这些扩增技术包括使具有靶特异性序列的引物退火。聚合后,用核糖核酸酶H消化DNA/RNA杂交体,同时使双链DNA分子再次热变性。在任一情况下,通过加入第二靶特异性引物使单链DNA完全双链化,接着聚合。然后双链DNA分子通过聚合酶如T7或SP6被多重转录。在等温循环反应中,将RNA逆转录为双链DNA,并用聚合酶如T7或SP6再一次转录。所得产物,无论是截短的还是完全的,都表示靶特异性序列。Daveyetal.,EP0329822A2(通过引用并入本文)公开了包括循环合成单链RNA(“ssRNA”)、ssDNA和双链DNA(dsDNA)的核酸扩增方法,根据本发明可以使用该方法。ssRNA是第一引物寡核苷酸的第一模板,其通过逆转录酶(RNA依赖性DNA聚合酶)延伸。然后通过核糖核酸酶H(核糖核酸酶H,对RNA与DNA或RNA形成的双链体中的RNA有特异性的RNA酶)的作用从所得的DNA:RNA双链体中除去RNA。所得ssDNA是第二引物的第二模板,其还包括与模板有同源性的RNA聚合酶启动子(例如T7RNA聚合酶)5’的序列。然后通过DNA聚合酶(例如大肠杆菌DNA聚合酶I的大的“Kienow”片段)延伸该引物,得到具有与引物之间的原始RNA相同的序列并且在一端还具有启动子序列的双链DNA(“dsDNA”)分子。可以采用该启动子序列通过合适的RNA聚合酶制备DNA的许多RNA拷贝。这些拷贝然后可以重新进入循环,导致非常迅速的扩增。通过适当选择酶,这种扩增可以等温地进行,而不用在每个循环添加酶。由于该方法的循环性质,起始序列可以选择为DNA或RNA的形式。Milleretal.,WO89/06700(通过引用整体并入本文)公开了一种核酸序列扩增方案,该方案基于启动子/引物序列与靶单链DNA(“ssDNA”)的杂交和随后该序列的许多RNA拷贝的转录。该方案不是循环的,即,不从所得的RNA转录物产生新的模板。基于两个(或多个)寡核苷酸的连接(其中该连接是在具有所得“二寡核苷酸”序列的核酸的存在下进行的)从而扩增二寡核苷酸的方法也可用于扩增步骤(Wuetal.,Genomics,第4卷,第560页,1989)。一旦形成,根据已公开的方案(protocol),构建体可以或不必在琼脂糖凝胶上区分大小,插入克隆载体,并转染到合适的宿主细胞内。演变分子的表达一旦生成突变分子库,可采用常规分子生物技术表达DNA。因而,可采用各种已知的方法表达蛋白。例如,简单地说,可采用各种随机的或非随机的方法如本文中描述的那些方法来演变野生型基因。然后采用标准的分子生物技术来消化突变的DNA分子并连接至载体DNA,如质粒DNA。采用标准方法(protocol)将含有单个突变的载体DNA转化至细菌或其它细胞中。可在多孔板,如96-孔板的单个孔中进行高通量表达和筛选。重复该方法获得各突变分子。将所述筛选和分离的多核苷酸引入合适的宿主细胞内。合适的宿主细胞是任何能够促进重组和/或还原重组的细胞。筛得的多核苷酸优选已存在于载体中,该载体包括适当的调控序列。宿主细胞可以是高等的真核细胞如哺乳动物细胞,或低等的真核细胞如酵母细胞,或优选地,宿主细胞可以是原核细胞如细菌细胞。将构建体引入宿主细胞内可以是磷酸钙转染、DEAE-葡聚糖介导转染或电穿孔(例如Ecker和Davis,1986,通过表达反义RNA抑制基因在植物细胞中的表达(InhibitionofgeneexpressioninplantcellsbyexpressionofantisenseRNA),ProcNatlAcadSciUSA,83:5372-5376)。作为有代表性的实例,可使用的表达载体,可提及的是病毒颗粒、杆状病毒、噬菌体、质粒、噬菌粒、粘粒、养粒(fosmids)、细菌人工染色体、病毒DNA(如牛痘病毒、腺病毒、禽痘病毒、伪狂犬病和SV40的衍生物)、基于P1的人工染色体、酵母质粒、酵母人工染色体和其它任何特定的目的宿主(如芽孢杆菌、黑曲霉和酵母菌)。因而,例如,DNA可包括于任一种用于表达多肽的表达载体中。这种载体包括染色体的、非染色体的和人工合成的DNA序列。大量合适的载体是本领域众所周知的且可市售获得。以下载体通过举例的方式提供;细菌:pQE载体(Qiagen)、pBluescript质粒、pNH载体、λ-ZAP载体(Stratagene);ptrc99a、pKK223-3、pDR540、pRIT2T(Pharmacia);真核:pXTl、pSG5(Stratagene)、pSVK3、pBPV、PMSG、pSVLSV40(Pharmacia)。然而,可使用任何其它质粒或其它载体,只要它们是在宿主中可复制且存活的。本发明中可采用低拷贝量或高拷贝量载体。表达载体中的DNA序列可操作地连接至适当的表达调控序列(启动子)来导向RNA的合成。特殊命名的细菌启动子包括lacI、lacZ、T3、T7、gpt、λPR、PL和trp。真核启动子包括CMV早期(immediateearly)、HSV胸苷激酶、早期和晚期SV40、来自逆转录病毒的LTR和小鼠金属硫蛋白-1。合适的载体和启动子的选择是本领域的普通技术水平。表达载体还含有用于翻译起始和转录终止的核糖体结合位点。载体还包括适当的用于扩增表达的序列。用氯霉素转移酶(CAT)载体或其它具有筛选标记的载体,可以从任何目标基因中筛选出启动子区。此外,优选表达载体含有一个或多个选择标记基因,以提供用于筛选转化的宿主细胞的表型性状,如用于真核细胞培养物的二氢叶酸还原酶或新霉素抗性,或如在大肠杆菌中的四环素或氨苄青霉素抗性。表达载体通常包括与编码序列可操作地连接的表达控制序列,包括天然相关或异源启动子区。优选地,表达控制序列将是能够转化或转染真核宿主细胞的载体中的真核启动子系统。一旦载体已经并入合适的宿主,则将宿主保持在适于高水平表达引入的编码序列的条件下以产生突变蛋白。如前所述,在编码突变蛋白的DNA序列已经可操作地连接到表达控制序列(即定位以确保结构基因的转录和翻译)后,所述序列将在宿主中表达。这些表达载体通常在宿主生物体中作为附加体或作为宿主染色体DNA的组成部分可复制。通常,表达载体将含有选择标志物,例如四环素或新霉素,以允许检测用所需DNA序列转化的那些细胞(参见例如美国专利号4,704,362,其通过引用并入本文)。因此,在本发明的另一个方面,可通过还原重组的方法产生新的多核苷酸。该方法包括制备含有连续序列(原始编码序列)的构建体,将它们插入合适的载体,随后将它们引入到合适的宿主细胞中。通过在具有同源区的构建体中的连续序列之间或在准重复单元之间的组合方法产生单独分子识别(molecularidentity)的重排。重排方法重组和/或降低了重复序列的复杂性和规模,并产生了新的分子。可采用各种处理来增强重组率。这些可能包括使用紫外光或破坏DNA的化学品和/或使用显示更高水平的“遗传不稳定”的宿主细胞。因而,重组方法可包括同源重组或指导自身演变的准重复序列的自然属性。在一个方面,宿主生物体或细胞包括革兰氏阴性菌、革兰氏阳性菌或真核有机体。在本发明的另一个方面,革兰氏阴性菌包括大肠杆菌或荧光假单胞菌。在本发明的另一个方面,革兰氏阳性菌包括Streptomycesdiversa、格氏乳杆菌(Lactobacillusgasseri)、乳酸乳球菌(Lactococcuslactis)、乳脂链球菌(Lactococcuscremoris)或枯草芽孢杆菌。在本发明的另一个方面,真核有机体包括酿酒酵母、裂殖酵母、毕赤酵母、乳酸克鲁维酵母、汉逊酵母或黑曲霉(Aspergillusniger)。作为合适宿主的有代表性的实例,可提及的是:细菌细胞,如大肠杆菌、链霉菌、鼠伤寒沙门氏菌;真菌细胞,如酵母;昆虫细胞,如果蝇S2和夜蛾Sf9;动物细胞如CHO、COS或黑色素瘤;腺病毒和植物细胞。选择合适的宿主被认为是本领域熟练技术人员教导的范围内。除了真核微生物例如酵母外,哺乳动物组织细胞培养物也可用于表达本发明的突变多肽(参见Winnacker,“FromGenestoClones(从基因到克隆),”VCHPublishers,N.Y.,N.Y.(1987),其通过引用并入本文)。真核细胞是优选的,因为本领域已经开发了许多能够分泌完整免疫球蛋白的合适的宿主细胞系,包括CHO细胞系、各种COS细胞系、HeLa细胞、骨髓瘤细胞系、B细胞或杂交瘤细胞。这些细胞的表达载体可以包括表达控制序列,例如复制起点、启动子、增强子(Queenetal.,Immunol.Rev.,第89卷,第49页,1986)和必要的加工信息位点,例如核糖体结合位点、RNA剪接位点、聚腺苷酸化位点和转录终止子序列。优选的表达控制序列是来源于免疫球蛋白基因、巨细胞病毒、SV40、腺病毒、牛乳头瘤病毒等的启动子。可以通过将增强子序列插入表达载体中来增加真核DNA转录。增强子是通过启动子增加转录的10-300bp的顺式作用序列。当在转录单元的5'或3'方向时,增强子可以有效地增加转录。如果位于内含子内或编码序列本身内,增强子也是有效的。通常使用病毒增强子,包括SV40增强子、巨细胞病毒增强子、多瘤增强子和多瘤病毒增强子。来自哺乳动物系统的增强子序列也是常用的,例如小鼠免疫球蛋白重链增强子。哺乳动物表达载体系统通常还包括选择性标记基因。合适的标记的实例包括二氢叶酸还原酶基因(DHFR)、胸苷激酶基因(TK)或赋予药物抗性的原核基因。前两个标记基因优选使用在不向生长培养基中加入胸苷的情况下缺乏生长能力的突变细胞系。然后可以通过转化的细胞在非补充培养基上生长的能力鉴定转化的细胞。用作标记的原核药物抗性基因的实例包括赋予对G418、霉酚酸和潮霉素的抗性的基因。根据细胞生产宿主的类型,可以通过公知的方法将含有目的DNA区段的表达载体转移到宿主细胞中。例如,氯化钙转染通常用于原核宿主细胞,而磷酸钙处理、脂质转染或电穿孔可用于真核宿主细胞。用于转化哺乳动物细胞生产宿主的其它方法包括使用聚凝胺、原生质体融合、脂质体、电穿孔和显微注射(一般参见Sambrook等人,同上)。在一个实施方案中,真核细胞生产宿主为选自CHO、HEK293、IM9、DS-1、THP-1、HepG2、COS、NIH3T3、C33a、A549、A375、SK-MEL-28、DU145、PC-3、HCT116、MiaPACA-2、ACHN、Jurkat、MM1、Ovcar3、HT1080、Panc-1、U266、769P、BT-474、Caco-2、HCC1954、MDA-MB-468、LnCAP、NRK-49F和SP2/0细胞系的哺乳动物系统;和小鼠脾细胞以及兔PBMC。在一个方面,哺乳动物系统选自CHO或HEK293细胞系。在一个具体方面,哺乳动物系统为CHO-S细胞系。在另一个具体方面,哺乳动物系统为HEK293细胞系。在另一个实施方案中,真核细胞生产宿主为酵母细胞系统。在一个方面,真核系统选自酿酒酵母细胞或毕赤酵母细胞。在另一个实施方案中,哺乳动物系统可以由合同研究或定制制造组织在商业上创建。例如,对于重组抗体或其他蛋白,Lonza(LonzaGroupLtd,巴塞尔,瑞士)可采用GS基因表达系统TM技术用CHOK1SV或NS0细胞生产宿主产生表达这些产物的载体。特别提到可用于表达重组蛋白的各种哺乳动物细胞培养系统,哺乳动物表达系统的实例包括猴肾成纤维细胞的COS-7系,描述于“SV40病毒转化的猴细胞支持早期SV40病毒突变的复制”(Gluzman,1981),以及其它能表达相容载体的细胞系,例如,C127、3T3、CHO、HeLa和BHK细胞系。哺乳动物表达载体包括复制起点位点、合适的启动子和增强子,以及任何必要的核糖体结合位点,多聚腺苷酸化位点,剪接供体和受体位点,转录终止序列和5'侧翼非转录序列。来自SV40拼接和多聚腺苷酸位点的DNA序列,可用来提供所需的非转录基因元件。然后扩繁细胞和进行“还原重组”。如果需要,可通过引入DNA损伤来刺激还原重组率。体内重组集中于“分子间”的方法统称为“重组”,其在细菌中一般被视为“RecA-依赖”现象。本发明依靠宿主细胞的重组来重组和重排序列,或依靠细胞的能力来介导还原过程,以通过缺失降低细胞中准重复序列的复杂性。这种“还原重组”过程通过“分子内”,RecA-非依赖的方法发生。最终的结果是分子重组至所有可能的组合中。含有目标多核苷酸的宿主细胞可以在经过修饰的适合于激活启动子、筛选转化子或扩增基因的常规营养培养基中培养。培养条件,如温度、pH等,是以前所用的筛选宿主细胞表达的条件,对本领域熟练的技术人员而言是明显的。蛋白表达可通过各种已知的方法诱导,许多遗传系统已被公开用来诱导蛋白表达。例如,使用合适的系统,添加诱导剂可诱导蛋白表达。然后离心沉淀细胞,弃上清液。将细胞与DNA酶、RNA酶和溶菌酶孵育,富集周质蛋白。离心后,将含有新蛋白的上清液转移至新的多孔板中,检测前贮存。本发明的突变蛋白在真核细胞生产宿主(来自突变DNA)中表达,例如哺乳动物细胞生产宿主或酵母细胞生产宿主,其也将用于下游的选自突变蛋白筛选的条件活性生物蛋白的产生。以这种方式鉴定的条件活性生物蛋白可以用于在该方法的先前表达步骤中使用的相同宿主中表达。一般通过离心收集细胞,通过物理或化学方法破坏细胞,所得的粗提物用于进一步纯化。用于表达蛋白的微生物细胞可通过任何方便的方法破坏,包括冻融循环、超声,机械破碎或细胞裂解液的使用。此类方法是本领域熟练的技术人员所熟知的。采用包括硫酸铵或乙醇沉淀、酸提取、阴离子或阳离子交换色谱、磷酸纤维素色谱、疏水层析、亲和层析、羟基磷灰石色谱和凝集素层析的方法,可从重组细胞培养物中回收和纯化表达的多肽或其片段。必要时可使用蛋白复性的步骤,来完成多肽的构型。如果需要,可采用高效液相色谱法(HPLC)作为最后的纯化步骤。然后对鉴定出的具有目标活性的克隆进行测序,以确定编码具有增强活性的酶的多核苷酸序列。从这些文库中鉴定出的多肽(即条件活性生物蛋白)可用于治疗、诊断、研究和相关的目的,和/或可进行一个或多个循环的改组和/或筛选。本发明提供至少为10个氨基酸大小的条件活性生物蛋白的片段,其中该片段具有活性。本发明提供具有酶活性的密码子优化的多肽或其片段,其中密码子使用针对特定生物体或细胞进行了优化。Narum等人,“编码恶性疟原虫裂殖子表面蛋白的基因片段的密码子优化,提高了DNA疫苗蛋白在小鼠体内的表达和免疫原性(CodonoptimizationofgenefragmentsencodingPlasmodiumfalciparummerzoiteproteinsenhancesDNAvaccineproteinexpressionandimmunogenicityinmice)”.Infect.Immun.2001December,69(12):7250-3描述了在小鼠表达系统中密码子的优化。Outchkourov等人,“Equistatin在毕赤酵母中表达的优化,蛋白表达和纯化(OptimizationoftheexpressionofEquistatininPichiapastoris,proteinexpressionandpurification)”,ProteinExpr.Purif.2002February;24(1):18-24描述了在酵母表达系统中密码子的优化。Feng等人,“使用人工合成的基因进行人磷脂转移蛋白的高效表达重组和诱变:C-末端膜结合结构域的证据(Highlevelexpressionandmutagenesisofrecombinanthumanphosphatidylcholinetransferproteinusingasyntheticgene:evidenceforaC-terminalmembranebindingdomain)”Biochemistry2000Dec.19,39(50):15399-409描述了在大肠杆菌表达系统中密码子的优化。Humphreys等人,“使用真核生物信号肽在大肠杆菌中进行高水平的周质表达:编码序列5'端密码子使用的重要性(High-levelperiplasmicexpressioninEscherichiacoliusingaeukaryoticsignalpeptide:importanceofcodonusageatthe5'endofthecodingsequence)”,ProteinExpr.Purif.第20卷,第252-264页,2000描述了密码子的使用如何影响在大肠杆菌中的分泌。条件活性生物蛋白的演变可通过方便的高通量筛选或选择的方法来辅助实现。如上所述,条件活性生物蛋白的表达优化可以通过所使用的载体(载体组分,例如启动子、剪接位点、5'和3'末端和侧翼序列)的优化、宿主细胞的基因修饰以减少基因缺失和重排、通过体内或体外演变相关基因的方法进行的宿主细胞基因活性演变、通过相关基因的演变进行的宿主糖基化酶的优化和/或通过染色体宽度的宿主细胞诱变和选择策略选择具有增强的表达能力的细胞来实现。本文还描述了宿主细胞。可以使用细胞表面展示表达和筛选技术(例如,如上所定义的)来筛选条件活性生物蛋白的突变蛋白。在一个方面,在抗体的恒定区中进行密码子诱变以优化真核细胞表达。保持介导效应子功能的能力的、具有改善的表达特性的密码子优化的Fc变体改善了治疗性抗体的产生。在这方面,例如,可以演变抗体分子的恒定区用于在不同的表达宿主中进行筛选。例如,哺乳动物细胞系可以利用CHO、HEK293和COS-7进行表达筛选。筛选突变体以鉴定可逆或不可逆突变体确定目标分子主要是通过在允许的条件和野生型条件下测定蛋白活性来直接实现的。然后可筛选出活性比(允许/野生型)最大的突变体并采用标准方法通过单个突变的组合生成点突变的排列(permutation)。然后筛选该组合的排列蛋白文库得到在允许和野生型条件之间显示出最大活性差异的蛋白。可采用多种方法筛选上清液的活性,例如采用高通量活性测定,如荧光检测,鉴定出对想要的特征(温度、pH等)敏感的蛋白突变体。例如,筛选温度敏感的突变体,使用市售底物,在较低温度(如25℃)和原始蛋白功能的温度(如37℃)下测定各突变体的酶活性或抗体活性。反应最初可以是多孔检测的形式,如96-孔检测,采用不同的形式,如14ml管的形式进行验证。本发明进一步提供用于确定酶的筛选检测,其包括:(a)提供大量核酸或多肽;(b)从大量多肽中获得待测酶活性的候选多肽;(c)测试候选多肽的酶活性;以及(d)确定那些在异常或非生理条件下表现出增加的酶活性,而在正常生理条件,如温度、pH、氧化应激、重量摩尔渗透压浓度、电解质浓度或渗透压下,较野生型酶蛋白的酶活性减少的候选多肽。在一个方面,该方法进一步包括在测试具有条件生物活性的候选多肽之前,修饰至少一种核酸或多肽。在另一个方面,测试步骤(c)还包括:检测在宿主细胞或宿主生物体中多肽的增加表达。在另一个方面,测试步骤(c)还包括在约pH3-约pH12的pH范围内检测酶活性。在另一个方面,测试步骤(c)还包括在约pH5-约pH10的pH范围内测试酶活性。在另一个方面,测试步骤(c)还包括在约pH6-约pH8的pH范围内测试酶活性。在另一个方面,测试步骤(c)还包括在pH6.7和约pH7.5下测试酶活性。在另一个方面,测试步骤(c)还包括在约4℃-约55℃的温度范围内检测酶活性。在另一个方面,测试步骤(c)还包括在约15℃-约47℃的温度范围内检测酶活性。在另一个方面,测试步骤(c)还包括:在约20℃-约40℃的温度范围内检测酶活性。在另一个方面,测试步骤(c)还包括在约25℃-约37℃的温度范围内检测酶活性。在另一个方面,测试步骤(c)还包括在正常渗透压和异常(正的或负的)渗透压的条件下检测酶活性。在另一个方面,测试步骤(c)还包括在正常电解质浓度和异常(正的或负的)电解质浓度的条件下检测酶活性。受试电解质浓度选自钙、钠、钾、镁、氯、碳酸氢盐和磷酸盐浓度中的一种,在另一个方面,测试步骤(c)还包括检测形成稳定反应产物的酶活性。在另一个方面,本发明提供特异结合本发明具有酶活性的多肽或其片段的纯化的抗体。在一个方面,本发明提供特异结合具有酶活性的多肽的抗体片段。筛选测试的正常生理条件和异常条件可以是选自温度、pH、渗透压、重量摩尔渗透压浓度、氧化和电解质浓度以及两种或更多种这样的条件的组合的任何条件。例如,温度的正常生理条件可以是37.0℃的正常人体温度,而温度的异常条件可以是不同于温度37.0℃的温度。正常生理条件和异常条件也可以是正常生理pH和异常pH。在正常生理条件和异常条件下的测试可以使用介质进行,例如可以含有例如缓冲液的液体介质。常见的筛选缓冲液为Krebs缓冲液。然而,可以使用本领域技术人员已知的适合于测试的其他缓冲液。这些缓冲液中的许多缓冲液试图模拟体液如血清或淋巴液的组成。用于本发明方法的缓冲液可以含有选自通常在哺乳动物或人的体液中发现的一种或多种无机化合物、离子和有机分子中的至少一种组分。这样的组分的实例至少包括营养物和代谢物,以及可以在体液中发现的任何其它组分。在这些实施方案中,缓冲液中所述组分的浓度可与通常在哺乳动物(优选人)的天然存在的体液中发现的相同组分的浓度相同或基本上相同。这可以被称为体液中该组分的正常生理浓度。在一个实施方案中,正常生理条件下的测试是在正常生理pH例如pH7.4的组合物中进行的。该测试在选自通常在哺乳动物或人的体液中发现的无机化合物、离子和有机分子中的至少一种组分的存在下进行。在异常条件下的测试是在与正常生理pH不同的异常pH(例如pH6)下、在相同组分(例如缓冲液)的存在下进行。因此,在该实施方案中,进行两种测试的流体包括相同浓度的相同组分,该浓度应优选在正常生理浓度范围内或接近正常生理浓度范围。例如,正常生理条件下的测试可以在上述的选自无机化合物、离子和有机分子的至少一种组分的存在下在缓冲液中于正常生理温度(例如37℃)下进行。异常条件下的测试在相同组分存在下在缓冲液中于不同的异常温度(例如36℃)下进行。再次,在其中进行两种测试的、包含相同浓度的相同组分的流体应优选在正常生理浓度的范围内。用于正常生理浓度下的测试的流体中的一种或多种组分的存在可以改进用于选择条件活性生物蛋白的选择过程。无机化合物或离子可以选自硼酸、氯化钙、硝酸钙、磷酸二铵、硫酸镁、磷酸一铵、磷酸一钾、氯化钾、硫酸钾、硫酸铜、硫酸铁、硫酸锰、硫酸锌、硫酸镁、硝酸钙、钙、铜、铁、锰和锌的螯合物、钼酸铵、硫酸铵、碳酸钙、磷酸镁、碳酸氢钾、碳酸氢钠、硝酸钾、盐酸、二氧化碳、硫酸、磷酸、碳酸、尿酸、氯化氢、尿素、磷离子、硫酸离子、氯离子、镁离子、钠离子、钾离子、铵离子、铁离子、锌离子和铜离子中的一种或多种。一些无机化合物的正常生理浓度的实例包括:浓度范围为2-7.0mg/dL的尿酸、浓度范围为8.2-11.6mg/dL的钙离子、浓度范围为355-381mg/dL的氯离子、浓度范围为0.028-0.210mg/dL的铁离子、浓度范围为12.1-25.4mg/dL的钾离子、浓度范围为300-330mg/dL的钠离子、浓度范围为15-30mM的碳酸。有机化合物可以选自例如氨基酸,如组氨酸、丙氨酸、异亮氨酸、精氨酸、亮氨酸、天冬酰胺、赖氨酸、天冬氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、谷氨酸、苏氨酸、谷氨酰胺、色氨酸、甘氨酸、缬氨酸、吡咯赖氨酸、脯氨酸、硒代半胱氨酸、丝氨酸、酪氨酸及其混合物。一些氨基酸的正常生理浓度的实例包括:3.97±0.70mg/dL的丙氨酸、2.34±0.62mg/dL的精氨酸、3.41±1.39mg/dL的谷氨酸、5.78±1.55的谷氨酰胺mg/dL、1.77±0.26mg/dL的甘氨酸、1.42±0.18mg/dL的组氨酸、1.60±0.31mg/dL的异亮氨酸、1.91±0.34mg/dL的亮氨酸、2.95±0.42mg/dL的赖氨酸、0.85±0.46mg/dL的甲硫氨酸、1.38±0.32mg/dL的苯丙氨酸、2.02±6.45mg/dL的苏氨酸、1.08±0.21mg/dL的色氨酸、1.48±0.37mg/dL的酪氨酸和2.83±0.34mg/dL的缬氨酸。有机化合物可以是非蛋白、含氮化合物如肌酸、肌酸酐、胍基乙酸、尿酸、尿囊素、腺苷、尿素、氨和胆碱。这些化合物中的一些的正常生理浓度的实例包括:1.07±0.76mg/dL的肌酸、0.9-1.65mg/dL的肌酸酐,0.26±0.24mg/dL的胍基乙酸、4.0±2.9mg/dL的尿酸、0.3-0.6mg/dL的尿囊素、1.09±0.385mg/dL的腺苷、27.1±4.5mg/dL的尿素和0.3-1.5mg/dL的胆碱。有机化合物可以是有机酸,例如柠檬酸、α-酮戊二酸、琥珀酸、苹果酸、富马酸、乙酰乙酸、β-羟基丁酸、乳酸、丙酮酸、α-酮酸、乙酸、和挥发性脂肪酸。这些有机酸中的一些有机酸的正常生理浓度的实例包括:2.5±1.9mg/dL柠檬酸、0.8mg/dL的α-酮戊二酸、0.5mg/dL的琥珀酸、0.46±0.24mg/dL的苹果酸、0.8-2.8mg/dL的乙酰乙酸、0.5±0.3mg/dL的β-羟基丁酸、8-17mg/dL的乳酸、1.0±0.77mg/dL的丙酮酸、0.6-2.1mg/dL的α-酮酸、1.8mg/dL的挥发性脂肪酸。有机化合物可以是糖(糖类),如葡萄糖、戊糖、己糖、木糖、核糖、甘露糖和半乳糖、以及包括乳糖、GlcNAcβ1-3Gal、Galα1-4Gal、Manα1-2Man、GalNAcβ1-3Gal和O-糖苷、N-糖苷、C-糖苷或S-糖苷的二糖。这些糖中的一些糖的正常生理浓度的实例包括:83±4mg/dL的葡萄糖、102±73mg/dL的多糖(如己糖)、77±63mg/dL的葡糖胺、0.4-1.4mg/dL的己糖醛酸酯(作为葡萄糖醛酸)和2.55±0.37mg/dL的戊糖。有机化合物可以是脂肪或其衍生物,例如胆固醇、卵磷脂、脑磷脂、鞘磷脂和胆汁酸。这些化合物中的一些化合物的正常生理浓度的实例包括:40-70mg/dL的游离胆固醇、100-200mg/dL的卵磷脂、0-30mg/dL的脑磷脂、10-30mg/dL的鞘磷脂和0.2-0.3mg/dL的胆汁酸(作为胆酸)。有机化合物可以是蛋白,例如纤维蛋白原、抗血友病球蛋白、免疫γ球蛋白、免疫优球蛋白、同种凝集素、β-假球蛋白、牛血清白蛋白、糖蛋白、脂蛋白和白蛋白。例如,白蛋白的正常生理浓度为3.35mg/dL。有机化合物可以是维生素,例如维生素A、胡萝卜素、维生素E、抗坏血酸、硫胺素、肌醇、叶酸、生物素、泛酸、核黄素。这些维生素中一些维生素的正常生理浓度的实例包括:0.019-0.036mg/dL的维生素A、0.90-1.59mg/dL的维生素E、0.42-0.76mg/dL的肌醇、0.00162-0.00195mg/dL的叶酸和0.00095-0.00166mg/dL的生物素。抗体和基于抗体的筛选方法本发明提供特异结合本发明酶的分离的或重组抗体。这些抗体可用于分离、鉴定或定量本发明的酶或相关多肽。这些抗体可用于在本发明范围内分离其它多肽或其它相关的酶。所述抗体可被设计用来结合酶的活性位点。因而,本发明提供使用本发明的抗体抑制酶的方法。所述抗体可用于免疫沉淀、染色、免疫亲和柱等。如果需要,编码特定抗原的核酸序列的生成,可通过免疫后进行多肽或核酸的分离、扩增或克隆以及将多肽固定于本发明的阵列(array)。或者,本发明的方法可用于修饰由待修饰细胞产生的抗体的结构,例如,抗体的亲和力可增加或减少。而且,制备或修饰抗体的能力可为通过本发明的方法改造至细胞的表型。免疫方法、制备和分离抗体(多克隆的和单克隆的)的方法是本领域熟练的技术人员已知的,并描述于科学和专利文献中,见例如Coligan,免疫学流行手册(CURRENTPROTOCOLSINIMMUNOLOGY),Wiley/Greene,NY(1991);Stites(eds.)基础和临床免疫学(第7版)(BASICANDCLINICALIMMUNOLOGY)(7thed.)LangeMedicalPublications,LosAltos,Calif.("Stites");Goding,单克隆抗体:原理及操作(第2版)(MONOCLONALANTIBODIES:PRINCIPLESANDPRACTICE)(2ded.)AcademicPress,NewYork,N.Y.(1986);Kohler(1975)“分泌特异性抗体的融合细胞的连续培养物(Continuousculturesoffusedcellssecretingantibodyofpredefinedspecificity)”,Nature256:495;Harlow(1988)抗体,实验室手册(ANTIBODIES,ALABORATORYMANUAL),ColdSpringHarborPublications,NewYork。除了传统在动物体内的方法以外,抗体也可在体外产生,例如使用重组抗体结合位点表达噬菌体展示库。见例如,Hoogenboom(1997)“生产高亲和力抗体的文库筛选策略的设计和优化(Designingandoptimizinglibraryselectionstrategiesforgeneratinghigh-affinityantibodies)”,TrendsBiotechnol.15:62-70;andKatz(1997)“通过噬菌体展示技术发现或改造的配体亲和力和特异性的结构和机械确定(Structuralandmechanisticdeterminantsofaffinityandspecificityofligandsdiscoveredorengineeredbyphagedisplay)”,Annu.Rev.Biophys.Biomol.Struct.26:27-45。多肽或肽可用于制备特异结合多肽,例如本发明酶的抗体。得到的抗体可用于免疫亲和色谱法以分离或纯化多肽或确定是否多肽存在于生物样本中。在该方法中,蛋白试剂,如提取物或生物样本与能够特异结合本发明的一种多肽的抗体接触。在免疫亲和法中,所述抗体附着在固体支持物,如珠或其它柱形基质上。所述蛋白试剂在抗体能够特异结合本发明的一种多肽的条件下与抗体接触。洗涤后去除非特异结合的蛋白,洗脱特异结合的多肽。生物样本中蛋白结合抗体的能力可采用任何一种本领域熟练的技术人员所熟悉的方法来确定。例如,结合可通过用可检测标记,如荧光剂、酶标物或放射性同位素标记抗体而确定。或者,抗体结合样本的能力可利用带有可检测标记的二级抗体来测定。特定的检测包括ELISA检测、双抗体夹心法、放射免疫分析和Western印迹。产生的作用于本发明多肽的多克隆抗体可通过向动物体内直接注射多肽或通过对非人类的动物施用多肽而获得。然后获得的抗体结合多肽自身。在这种方式下,即使仅编码多肽片段的序列也可用于产生可结合于整个原生多肽的抗体。然后该抗体可用于从表达该多肽的细胞中分离多肽。为了制备单克隆抗体,可采用任何由连续细胞株培养产生抗体的技术。实例包括杂交瘤技术、单克隆抗体的制备,可使用提供由连续的细胞株培养产生的抗体的任何技术。实例包括杂交瘤技术,三体杂交瘤技术、人类B细胞杂交瘤技术和EB病毒杂交瘤技术(见例如,Cole(1985年),单克隆抗体和癌症治疗(MonoclonalAntibodiesandCancerTherapy),AlanR.Liss,Inc.,pp.77-96)。所述用于生产单链抗体的技术(见例如,美国专利第4946778号)可适用于生产作用于本发明多肽的单链抗体。或者,可用转基因小鼠表达作用于这些多肽或其片段的人源化的抗体。产生的作用于本发明多肽的抗体可用于从其它生物体和样本中筛选类似的多肽(例如,酶)。在这些技术中,来自于生物体的多肽与抗体接触,检测到那些特异结合抗体的多肽。任何以上描述的方法可用于检测抗体结合。筛选方法和“在线”监测装置在本发明方法的操作中,可使用多种仪器和方法用于本发明的多肽和核酸,例如,为了筛选具有酶活性的多肽,为了筛选作为潜在的调节剂,例如酶活性的激活剂或抑试剂的化合物,为了筛选结合本发明多肽的抗体,为了筛选与本发明核酸杂交的核酸,为了筛选表达本发明的多肽的细胞等。阵列或“生物芯片”本发明的核酸或多肽可以被固定于或应用到阵列上。阵列可用于筛选或监测组合物(例如,小分子、抗体、核酸等)文库,针对它们结合或调节本发明核酸或多肽的活性的能力。例如,在本发明的一个方面,监测的参数是酶基因的转录表达。细胞的一种或多种或所有转录物可通过含有细胞转录物,或细胞转录物的核酸代表或其互补核酸的样本的杂交来测定,通过与固定于阵列或“生物芯片”上的核酸杂交来测定。通过使用微芯片上的核酸“阵列”,一些或全部细胞转录物可同时被定量。或者,含有基因组核酸的阵列也可用于测定通过本发明方法新改造的细胞株的基因型。多肽“阵列”也可用于同时定量多种蛋白。本发明可利用任何已知的“阵列”,还被称作“微阵列”或“核酸阵列”或“多肽阵列”或“抗体阵列”或“生物芯片”或它们的变体来操作。一般地,阵列是大量的“点”或“靶元件”,各靶元件包括确定量的一种或多种生物分子,例如,寡核苷酸,固定于底物表面的特定区,用于特异结合样本分子,例如,mRNA转录物。在本发明方法的操作中,任何已知的阵列和/或制作和使用阵列的方法或它们的变体可全文或部分并入于此,描述于例如,美国专利号6277628、6277489、6261776、6258606、6054270、6048695、6045996、6022963、6013440、5965452、5959098、5856174、5830645、5770456、5632957、5556752、5143854、5807522、5800992、5744305、5700637、5556752、5434049;也见,例如,WO99/51773、WO99/09217、WO97/46313、WO96/17958;也见,例如,Johnston(1998)“基因芯片:了解基因调控的希望阵列(Genechips:Arrayofhopeforunderstandinggeneregulation)”,Curr.Biol.8:R171-R174;Schummer(1997)“用于构建高密度核酸阵列的廉价手持装置(InexpensiveHandheldDevicefortheConstructionofHigh-DensityNucleicAcidArrays)”,Biotechniques23:1087-1092;Kern(1997)“在高密度网格cDNA过滤检测中基因组大克隆插入的直接杂交(Directhybridizationoflarge-insertgenomicclonesonhigh-densitygriddedcDNAfilterarrays)”,Biotechniques23:120-124;Solinas-Toldo(1997)“用于基因组失衡筛查的生物芯片:基于基质的比较基因组杂交(Matrix-BasedComparativeGenomicHybridization:BiochipstoScreenforGenomicImbalances)”,Genes,Chromosomes&Cancer20:399-407;Bowtell(1999)“通过微阵列用于获得从起始到终止的表达数据的选择(OptionsAvailable--FromStarttoFinish--forObtainingExpressionDatabyMicroarray)”,NatureGeneticsSupp.21:25-32。也见公开的美国专利申请号20010018642、20010019827、20010016322、20010014449、20010014448、20010012537、20010008765。毛细管阵列毛细管阵列,如GIGAMATRIXTMDiversaCorporation,SanDiego,Calif可用于本发明的方法中。本发明的核酸或多肽可固定于或应用阵列上,包括毛细管阵列。阵列可用于筛选或监测组合物(例如,小分子、抗体、核酸等)文库,针对它们结合或调节本发明核酸或多肽活性的能力。毛细管阵列提供另一个捕捉(holding)和筛选样本的系统。例如样本筛选装置可包括大量毛细管形成相邻的毛细血管阵列,其中各毛细管包括至少一个壁,其限定腔用于保留样本。所述装置可进一步包括置于阵列相邻的毛细管之间的间质材料,并在间质材料内形成一种或多种参考标记。用于筛选样本的毛细管,其中所述毛细管适合于结合在毛细管阵列中,可包括第一个壁,其限定的腔用于保留样本,以及第二壁,其由过滤材料形成,过滤激发能量提供给腔以激发样品。多肽或核酸,例如配体可被引入第一组件中到至少毛细管阵列的一个毛细管的一部分中。毛细管阵列的各毛细管可包括至少一个壁,其限定的腔用于保留第一组件。气泡可被引入在第一组件后面的毛细管中。第二组件可被引入毛细管中,其中第二组件通过气泡与第一组件分开。目标样本可作为用可检测粒子标记的第一液引入毛细管阵列的毛细管中,其中毛细管阵列的各毛细管包括至少一个壁,其限定的腔用于保留第一液和可检测粒子,其中至少一个壁包被有用于使可检测粒子结合到至少一个壁的结合物质。该方法可进一步包括从毛细管中去掉第一液,其中结合的可检测粒子保留在毛细管内,并向毛细管中引入第二液。所述毛细管阵列可包括许多含有至少一个限定腔的外壁的单个毛细管。毛细管外壁可以是一个或多个融合在一起的壁。同样地,所述壁可限定的腔是圆柱形、方形、六角形或任何其它几何形状,只要壁形成保留液体或样本的腔。毛细管阵列的毛细管可以靠近在一起,形成一个平面结构。毛细管可结合在一起,通过融合(例如,其中的毛细血管是由玻璃制成)、粘合、键合或侧壁-侧壁夹紧。毛细管阵列可由任何数量的单个毛细管组成,例如,范围从100到4,000,000的毛细管。毛细管阵列可由约100,000或更多单个毛细管结合在一起形成微滴度板。药物组合物在某些实施方案中,本发明旨在制备条件活性生物蛋白,其在异常条件下的活性与在正常生理条件下的活性的活性比例较大(例如,在异常生理条件和正常生理条件之间更大的选择性)。在异常条件下的活性与在正常生理条件下的活性的比例或选择性可以为至少约2:1,或至少约3:1,或至少约4:1,或至少约5:1,或至少约6:1,或至少约7:1,或至少约8:1,或至少约9:1,或至少约10:1,或至少约11:1,或至少约12:1,或至少约13:1,或至少约14:1,或至少约15:1,或至少约16:1,或至少约17:1,或至少约18:1,或至少约19:1,或至少约20:1,或至少约30:1,或至少约40:1,或至少约50:1,或至少约60:1,或至少约70:1,或至少约80:1,或至少约90:1,或至少约100:1。在一个实施方案中,条件活性生物蛋白是一种抗体,其在异常条件下的活性与在正常生理条件下的活性比例为至少约5:1,或至少约6:1,或至少约7:1,或至少约8:1,或至少约9:1,或至少约10:1。在一个实施方案中,条件活性生物蛋白用于靶向肿瘤部位,并且条件活性生物蛋白在肿瘤部位具有特定的活性,并且在非肿瘤部位(正常生理条件)该活性显著较低或不具有该活性。在一个实施方案中,条件活性生物蛋白为旨在与另一种试剂(例如本文别处公开的那些试剂)缀合的抗体。条件活性抗体比作为其来源的野生型抗体可以具有更高的在异常条件下的活性与在正常生理条件下的活性比例。例如,与另一试剂缀合的条件活性抗体的在异常条件下的活性与在正常生理条件下的活性比例为至少约10:1,或至少约11:1,或至少约12:1,或至少约13:1,或至少约14:1,或至少约15:1,或至少约16:1,或至少约17:1,或至少约18:1,或至少约19:1,或至少约20:1。当缀合的试剂是例如有毒或放射性时,这可能是特别重要的,因为希望这种缀合的试剂集中在患病部位或治疗部位。产生/生产条件活性生物蛋白一旦在筛选步骤中鉴定了本发明的条件活性生物蛋白,就可以合成或重组产生该条件活性生物蛋白。条件活性生物蛋白可以在体外或体内重组表达。可以使用本领域已知的任何方法制备和分离条件活性生物蛋白。还可以使用本领域熟知的化学蛋白合成方法对条件活性生物蛋白进行全部或部分合成。参见例如Caruthers(1980)“Newchemicalmethodsforsynthesispolynucleotides(合成多核苷酸的新化学方法)”,NucleicAcidsRes.Symp.Ser.215-223;Horn(1980),"Synthesisofoligonucleotidesoncellulose.PartII:designandsyntheticstrategytothesynthesisof22oligodeoxynucleotidescodingforGastricInhibitoryPolypeptide(GIP)1(纤维素上的寡核苷酸合成。第二部分:合成编码胃抑制多肽(GIP)1的22个寡核苷酸的设计和合成策略",NucleicAcidsRes.Symp.Ser.225-232;Banga,A.K.,TherapeuticPeptidesandproteins,Formulation,ProcessingandDeliverySystems(1995)(治疗性肽和蛋白、制剂、加工和递送系统)TechnomicPublishingCo.,Lancaster,Pa。例如,可以使用各种固相技术进行肽合成(参见例如Roberge(1995)"AstrategyforaconvergentsynthesisofN-linkedglycopeptidesonasolidsupport(用于在固体支持物上汇集合成N-连接的糖肽的策略)",Science269:202;Merrifield(1997)"Conceptandearlydevelopmentofsolid-phasepeptidesynthesis(固相肽合成的概念和早期发展)",MethodsEnzymol.289:3-13),可以根据制造商提供的说明书,例如使用ABI43IA肽合成仪(PerkinElmer)实现自动化合成。固相化学肽合成方法也可以用于合成多肽或片段。从1960年代早期后,这样的方法在本领域中是已知的,(Merrifield,R.B.,"Solid-phasesynthesis.I.Thesynthesisofatetrapeptide(固相合成,I四肽的合成)",J.Am.Chem.Soc,85:2149-2154,1963)(也参见Stewart,J.M.andYoung,J.D.,SolidPhasePeptideSynthesis(固相肽合成),2ndEd.,PierceChemicalCo.,Rockford,111.,pp.11-12)),并且最近已经用于市售的实验室肽设计和合成试剂盒(CambridgeResearchBiochemicals)。这样的市售的实验室试剂盒普遍利用H.M.Geysen等人("Useofpeptidesynthesistoprobeviralantigensforepitopestoaresolutionofasingleaminoacid(使用肽合成来探测病毒抗原的表位以解析单个氨基酸),"Proc.Natl.Acad.Sci.,USA,81:3998(1984))的教导,并且将其用于在大量“棒”或“针”的尖端上合成肽,所有这些棒或针都连接到单个板。当使用这样的系统时,将棒或针的板倒置并插入对应的孔或贮存器的第二板中,所述孔或贮存器含有用于将适当的氨基酸连接或锚定到针或棒尖端的溶液。通过重复这样的工艺步骤,即倒置并将棒和针的尖端插入到合适的溶液中,将氨基酸构建成所需的肽。此外,许多可用的FMOC肽合成系统是可用的。例如,可以使用应用生物系统(AppliedBiosystems)公司的431ATM型自动化肽合成仪在固体支持物上组装多肽或片段。通过直接合成或合成可以采用其它已知技术进行连接的一系列片段,这样的设备提供了得到本发明的肽的现成途径。本发明的条件活性生物蛋白也可以是糖基化的。糖基化可以在翻译后以化学方式或通过细胞生物合成机制添加,其中后者包括已知糖基化基序的使用,该糖基化基序可以对该序列而言是天然的或可以作为肽添加或添加至核酸编码序列中。糖基化可以是O-连接的或N-连接的。如上所定义的本发明的条件活性生物蛋白包括所有“模拟物”和“拟肽物”形式。术语“模拟物”和“拟肽物”是指具有与本发明的多肽基本相同的结构和/或功能特性的合成化合物。模拟物可以完全由合成的、非天然的氨基酸类似物组成,或者是部分天然的肽氨基酸和部分非天然的氨基酸类似物的嵌合分子。只要天然氨基酸保守取代不会实质上改变模拟物的结构和/或活性,模拟物也可以包含任何量的这样的取代。就作为保守变体的本发明的多肽而言,将使用常规实验确定模拟物是否在本发明的范围内,即,其结构和/或功能是否未发生实质性改变。本发明的多肽模拟物组合物可以包含非天然结构组分的任何组合。在另一方面,本发明的模拟物组合物包括以下三个结构基团中的一个或全部:a)除天然酰胺键(“肽键”)连接之外的残基连接基团;b)替代天然存在的氨基酸残基的非天然残基;或c)诱导二级结构模拟的残基,即诱导或稳定二级结构(例如β转角、γ转角、β折叠、α螺旋构象等)的残基。例如,当本发明的多肽的全部或一些残基通过除天然肽键之外的化学手段连接时,其可以称为模拟物。单独的肽模拟物残基可以通过肽键、其它化学键或偶联方式连接,例如戊二醛、N-羟基琥珀酰亚胺酯、双官能马来酰亚胺、N,N'-二环己基碳二亚胺(DCC)或N,N'-二异丙基碳二亚胺(DIC)。可用作传统酰胺键(“肽键”)的替代物的连接基团包括例如酮亚甲基(例如用-C(=O)-CH2-代替-C(=O)-NH-)、氨基亚甲基(CH2-NH)、亚乙基、烯烃(CH=CH)、醚(CH2-O)、硫醚(CH2-S)、四唑(CN4-)、噻唑、逆酰胺(retroamide)、硫代酰胺或酯(参见例如Spatola(1983)inChemistryandBiochemistryofAminoAcids,Peptidesandproteins,第7卷,pp267-357,"PeptideBackboneModifications(肽主链修饰),"MarcellDekker,N.Y.)。当本发明的多肽包含全部或一些非天然残基以代替天然存在的氨基酸残基时,本发明的多肽也可称为模拟物。非天然残基在科学和专利文献中有详细描述;以下描述了用作天然氨基酸残基的模拟物的几种示例性非天然组合物及其使用指南。可以通过使用例如以下物质进行代替生成芳香族氨基酸的模拟物:D-或L-萘丙氨酸;D-或L-苯基甘氨酸;D-或L-2-噻吩基丙氨酸;D-或L-1、-2、3-或4-芘酰基丙氨酸;D-或L-3-噻吩基丙氨酸;D-或L-(2-吡啶基)-丙氨酸;D-或L-(3-吡啶基)-丙氨酸;D-或L-(2-吡嗪基)-丙氨酸;D-或L-(4-异丙基)-苯基甘氨酸;D-(三氟甲基)-苯基甘氨酸;D-(三氟甲基)-苯丙氨酸;D-p-氟-苯丙氨酸;D-或L-p-联苯基苯丙氨酸;D-或L-p-甲氧基-联苯基苯丙氨酸;D-或L-2-吲哚(烷基)丙氨酸;和D-或L-烷基胺,其中烷基可以是取代或未取代的甲基、乙基、丙基、己基、丁基、戊基、异丙基、异丁基、仲丁基、异戊基或非酸性氨基酸。非天然氨基酸的芳香环包括例如噻唑基、噻吩基、吡唑基、苯并咪唑基、萘基、呋喃基、吡咯基和吡啶基芳环。酸性氨基酸的模拟物可以通过用例如非羧化氨基酸取代并同时保持负电荷,通过用(膦酰基)丙氨酸取代,或通过硫酸化苏氨酸取代生成。羧基侧基(例如,天冬氨酰基或谷氨酰基)还可以通过与诸如1-环己基-3-(2-吗啉基-(4-乙基))碳二亚胺或1-乙基-3(4-氮阳离子-4,4-二甲基戊基)碳二亚胺的碳二亚胺(R'-N=C=N-R')反应来选择性修饰。通过与铵离子反应,天冬氨酰基或谷氨酰基也可以被转化为天冬酰胺酰基和谷氨酰胺酰基残基。可以通过用例如(除赖氨酸和精氨酸外还有)以下氨基酸取代产生碱性氨基酸的模拟物:鸟氨酸、瓜氨酸或(胍基)-乙酸或(胍基)烷基-乙酸取代,其中烷基定义如上。腈衍生物(例如,含有代替COOH的CN-部分)可以被取代以得到天冬酰胺或谷氨酰胺。可以将天冬酰胺酰基和谷氨酰胺酰基残基脱酰胺得到相应的天门冬酰基或谷酰基残基。可以通过使精氨酰基与例如一种或多种常规试剂(包括例如苯甲酰甲醛、2,3-丁二酮、1,2-环己烷二酮或茚三酮)反应来产生精氨酸残基模拟物,该反应优选在碱性条件下进行。可以通过使酪氨酰基与例如芳族重氮化合物或四硝基甲烷反应来产生酪氨酸残基模拟物。N-乙酰基咪唑和四硝基甲烷可分别用于形成O-乙酰基酪氨酰基物质和3-硝基衍生物。通过使半胱氨酰残基与例如α-卤代乙酸酯(如2-氯乙酸或氯乙酰胺)和相应的胺反应产生半胱氨酸残基模拟物;以得到羧甲基或羧氨基甲基衍生物。也可以通过使半胱氨酰残基与例如以下物质反应产生半胱氨酸残基模拟物:溴三氟丙酮、α-溴-β-(5-咪唑基)丙酸、氯乙酰磷酸酯、N-烷基马来酰亚胺、3-硝基-2-吡啶基二硫化物、甲基2-吡啶基二硫化物、对氯汞基苯甲酸盐、2-氯汞基-4-硝基苯酚和氯-7-硝基苯并-氧杂-1,3-二唑。可通过赖氨酰与例如琥珀酸酐或其它羧酸酐反应产生赖氨酸模拟物(和改变氨基末端残基)。赖氨酸和其它含α-氨基的残基模拟物也可以通过与亚氨酸酯如吡啶亚氨酸甲酯、磷酸吡哆醛、吡哆醛、氯硼氢化物、三硝基苯磺酸、O-甲基异脲、2,4-戊二酮反应以及转酰胺酶催化的与乙醛酸的反应。甲硫氨酸的模拟物可以通过与例如甲硫氨酸亚砜反应产生。脯氨酸的模拟物包括例如哌啶酸、噻唑烷羧酸、3-或4-羟基脯氨酸、脱氢脯氨酸、3-或4-甲基脯氨酸或3,3-二甲基脯氨酸。组氨酸残基模拟物可通过组氨酰基与例如二乙基原碳酸酯或对溴苯甲酰甲基溴反应而产生。其它模拟物包括例如通过脯氨酸和赖氨酸的羟基化产生的模拟物;通过丝氨酰或苏氨酰残基的羟基的磷酸化产生的模拟物;通过赖氨酸、精氨酸和组氨酸的α-氨基的甲基化产生的模拟物;通过N-末端胺的乙酰化产生的模拟物;通过主链酰胺残基的甲基化或用N-甲基氨基酸取代产生的模拟物;或通过C-末端羧基的酰胺化产生的模拟物。本发明多肽的残基(例如氨基酸)也可以被相反手性的氨基酸(或拟肽残基)替代。因此,任何以L-构型天然存在的氨基酸(根据化学实体的结构,其也可以称为R或S)可以被相同化学结构类型但手性相反的氨基酸或手性相反的肽模拟物取代,称为D-氨基酸,其也可以称为R-或S-形式。本发明的模拟多肽可以使用任何蛋白化学合成技术合成。在典型的体外蛋白合成方法中,通过在肽和氨基酸之间形成肽键,使肽长度延长一个氨基酸。肽键的形成是连接反应,其可以使用天然氨基酸或非天然氨基酸。因此,可以将非天然氨基酸引入本发明的多肽中以制备模拟物。蛋白化学合成技术描述于Nilssonetal.,"ChemicalSynthesisofProteins(蛋白质的化学合成),"Annu.Rev.Biophys.Biomol.Struct.,第34卷,第91–118页,2005(通过引用并入本文)。固相合成和半合成方法也可合成含有新氨基酸的许多小蛋白。例如,参见以下出版物:Crick,F.J.C.,Barrett,L.Brenner,S.Watts-Tobin,R.“Generalnatureofthegeneticcodeforproteins(蛋白质遗传密码的一般性质),”Nature,1227–1232(1961);Hofmann,K.,Bohn,H.“Studiesonpolypeptides.XXXVI.Theeffectofpyrazole-imidazolereplacementsontheS-proteinactivatingpotencyofanS-peptidefragment(多肽的研究,XXXVI.吡唑-咪唑替代物对S-肽片段的S-蛋白激活效能的影响),”J.AmChem,5914–5919(1966);Kaiser,E.T.“Syntheticapproachestobiologicallyactivepeptidesandproteinsincludingenyzmes(生物活性肽和包括酶的蛋白质的合成方法),”AccChemRes,47–54(1989);Nakatsuka,T.,Sasaki,T.,Kaiser,E.T.“Peptidesegmentcouplingcatalyzedbythesemisyntheticenzymethiosubtilisin(由半合成酶硫代枯草杆菌蛋白酶催化的肽段偶联),”JAmChemSoc,3808–3810(1987);Schnolzer,M.,Kent,SBH.“Constructingproteinsbydovetailingunprotectedsyntheticpeptides:backbone-engineeredHIVprotease(通过使未保护的合成肽吻合构建蛋白:主链工程化的HIV蛋白酶),”Science,221–225(1992);Chaiken,I.M.“Semisyntheticpeptidesandproteins(半合成肽和蛋白),”CRCCritRevBiochem,255–301(1981);Offord,R.E.“Proteinengineeringbychemicalmeans?(通过化学手段的蛋白质工程化?)”ProteinEng.,151–157(1987);和Jackson,D.Y.,Burnier,J.,Quan,C.,Stanley,M.,Tom,J.,Wells,J.A.“ADesignedPeptideLigaseforTotalSynthesisofRibonucleaseAwithUnnaturalCatalyticResidues(一种用于合成具有非天然催化残基的核糖核酸酶A的全合成的设计的肽连接酶),”Science,243(1994)。本发明的模拟多肽还可以通过重组技术产生,其通过将多肽的编码序列插入表达载体并利用真核细胞生产宿主的蛋白翻译机制来产生多肽。蛋白翻译机制读取编码序列的密码子,并使用tRNA引入编码的氨基酸以产生多肽。有几种技术可用于改变蛋白翻译机制,以允许其将非天然氨基酸并入重组多肽中。经验证的方法取决于通过氨酰基-tRNA合成酶识别非天然氨基酸,其通常需要高选择性以确保蛋白翻译的保真度。可以工程化这些合成酶以放宽底物特异性,使得非天然氨基酸可以连接到tRNA,然后tRNA将非天然氨基酸带到蛋白质翻译机制以并入多肽中。例如,发现在大肠杆菌苯丙氨酰基-tRNA合成酶(PheRS)中用Gly取代Ala294增加了底物结合口袋的尺寸,并且导致tRNAPhe被对氯苯丙氨酸(p-Cl-Phe)乙酰化。参见M.Ibba,P.KastandH.Hennecke,Biochemistry,33:7107(1994)。携带该突变体PheRS的大肠杆菌菌株允许并入对氯苯丙氨酸或对溴苯丙氨酸以替代苯丙氨酸。参见例如M.IbbaandH.Hennecke,FEBSLett.,364:272(1995);和N.Sharma,R.Furter,P.KastandD.A.Tirrell,FEBSLett.,467:37(2000)。类似地,证明了在大肠杆菌酪氨酰-tRNA合成酶的氨基酸结合位点附近的点突变Phel30Ser允许和酪氨酸相比更有效地并入氮杂酪氨酸。参见F.Hamano-Takaku,T.Iwama,S.Saito-Yano,K.Takaku,Y.Monden,M.Kitabatake,D.SollandS.Nishimura,J.Biol.Chem.,275:40324(2000)。第一种方法通过重新分配有义密码子起作用,其工程化至少一种氨酰基-tRNA合成酶。酶通常向tRNA添加天然氨基酸以转运至用于蛋白合成的蛋白翻译机制。然而,用于特定tRNA的氨酰基-tRNA合成酶可以被改变,使得其可以具有一定程度的混杂性以将非天然氨基酸非特异性地改变为tRNA以活化tRNA。活化的tRNA可以携带非天然氨基酸到蛋白质翻译机制(核糖体),并将非天然氨基酸添加到肽,其中编码序列的密码子需要特定的tRNA。换句话说,该特定tRNA的密码子已被重新指定为非天然氨基酸。重组多肽包含19种天然氨基酸和至少一种非天然氨基酸,其中多肽中的一种天然氨基酸已被至少一种非天然氨基酸取代。用非天然氨基酸成功取代天然氨基酸依赖于使用在天然氨基酸的生物合成中缺乏的营养缺陷型表达宿主。使用这样的宿主限制了来自重新分配的有义密码子的天然氨基酸的竞争,并且提高了目标蛋白的并入效率和产量。已经重新分配了许多氨基酸密码子(包括Met、Pro、Tyr、Phe、Leu、Val等),并且通过该方法将超过60个非天然氨基酸并入蛋白质。参见Hendricksonetal.,“Incorporationofnonnaturalaminoacidsintoproteins(非天然氨基酸并入蛋白),”Annu.Rev.Biochem.,第73卷,第147-176页,2004;Voloshchuketal.,“Incorporationofunnaturalaminoacidsforsyntheticbiology(用于合成生物学的非天然氨基酸的并入),”Mol.Biosyst.,第6卷,第65-80页,2010,二者通过引用并入本文。该方法的主要限制是非天然氨基酸将替换整个多肽序列中的天然氨基酸,如果这种全局取代是不想要的,这会限制其应用。一种解决方案是将不想要的位点(将不被取代)突变为其他天然氨基酸,使得仅保留所需的取代位点用于非天然氨基酸。通过该修饰,该方法可以在任何所需位点位点特异性地引入非天然氨基酸以产生模拟多肽。制备模拟重组多肽的另一种方法是通过使用变偶(wobble)密码子。变偶密码子是指通过非经典的Watson-Crick碱基配对由tRNA解码的密码子。如在“变偶假设”中提出的,通过在tRNA的第一反密码子碱基(其与密码子三联体的第三碱基进行配对)处的修饰实现非经典(或变偶)配对。例如,许多生物体仅具有一个tRNA来解码Phe的两个密码子,即UUU和UUC。结果,tRNA上的GAA反密码子通过Watson-Crick碱基配对与UUC密码子结合,并通过“变偶”碱基配对与UUU密码子结合。由于密码子和反密码子之间的变偶配对,一个tRNA可以与几个密码子配对,并且给定的密码子可以与多于一个的tRNA配对。利用这种性质,可将变偶密码子分配给非天然氨基酸,以产生含有天然氨基酸和至少一个非天然氨基酸的重组蛋白。例如,Phe通常由两个密码子UUC和UUU编码,两个密码子均由单个tRNA识别。通过表达对非天然氨基酸具有特异性并含有“AAA”反密码子的氨酰基-tRNA合成酶和tRNA的正交对(orthogonalpair),可以实现非天然氨基酸在UUU密码子处的有效引入(Kwonetal.,“Breakingthedegeneracyofthegeneticcode(破坏遗传密码的简并性),”J.Am.Chem.Soc.,第125卷,第7512-7513页,2003,该文献通过引用并入本文)。使用该方法,Phe可以基本上定量地被分配给UUC密码子,非天然氨基酸被分配给UUU变偶密码子。此外,可以将多个拷贝的非天然氨基酸以位点特异性的方式引入多肽中。用于产生重组模拟多肽的第三种方法是通过使用偏好的密码子(biasedcodon)。优选的密码子在生物体之间是不同的,甚至在相同生物体的不同组织或细胞类型之间也是不同的。tRNA类的细胞内容物是蛋白合成速率和蛋白合成量的决定因素。因此,异源宿主细胞中的重组蛋白的产生通常经密码子优化以匹配优选的宿主细胞密码子偏好(不同生物体的密码子使用数据库和给定基因的密码子分析可在以下网址找到:http://www.kazusa.or.jp/codon/)。偏好的密码子的使用提供了将非天然氨基酸引入重组多肽的另一种方法。例如,在用于Arg的六种简并密码子中,大肠杆菌中很少使用AGG和AGA。将氨酰基-tRNA合成酶和与AGG密码子配对的tRNA组成的正交对引入大肠杆菌表达宿主,可以使非天然氨基酸与tRNA连接。因此,与非天然氨基酸连接的tRNA可将非天然氨基酸带到密码子AGG,其中通常可编码Arg。该方法已经证明对于体外基于无细胞的系统是可行的,其中在AGG密码子处将与AGG密码子配对的且与化学合成的非天然氨基酸连接的tRNA并入(Hohsakaetal.,FEBSLetters,第344卷,第171-174页,1994)。如果氨酰基-tRNA合成酶可以被工程化以将非天然氨基酸正交连接至tRNA,则该方法可以适用于基于大肠杆菌细胞的表达系统。类似地,可以将偏好密码子分配给在显示出密码子偏好性的哺乳动物细胞中的非天然氨基酸。例如,通过研究在不同哺乳动物细胞中的人乳头瘤病毒基因表达,Frazer和他的同事发现乳头瘤病毒蛋白表达由密码子使用和tRNA可用性决定。发现在分化的和未分化的角质形成细胞之间tRNA库有实质性差异(Zhaoetal.,“Genecodoncompositiondeterminesdifferentiation-dependentexpressionofaviralcapsidgeneinkeratinocytesinvitroandinvivo(基因密码子组成在体外和体内确定角质形成细胞中病毒衣壳基因的分化依赖性表达),”Mol.CellBiol.,第25卷,第8643-8655页,2005),并且在它们的tRNA中观察到的偏好性可能是乳头瘤病毒专门在上皮细胞中复制的原因。例如,在CHO和Cos1细胞中,似乎TCG是偏好性密码子,因此可能被分配给非天然氨基酸。由于密码子偏好现象在不同的真核生物体中广泛存在,利用这种密码子进行非天然氨基酸的位点特异性并入可以应用于许多真核细胞生产宿主。限制是将氨酰基-tRNA合成酶工程化以将非天然氨基酸正交连接至可与生产宿主中偏好的密码子配对的tRNA。用于产生模拟多肽的第四种方法是通过抑制终止密码子。一般来说,通过蛋白释放因子(RF)的作用,蛋白翻译终止于三个终止密码子(由UAG(琥珀)、UAA(赭石)和UGA(蛋白石)编码)之一。然而,已经观察到氨基酸临时通读终止密码子在多种物种中天然发生。抑制是由tRNA反密码子的突变或密码子-反密码子的错配引起的(Beier&Grimm,“MisreadingofterminationcodonsineukaryotesbynaturalnonsensesuppressortRNAs,”NucleicAcidsRes.,第29卷,第4767-4782页,2001)。利用终止密码子抑制代表产生含有非天然氨基酸的蛋白的另一种方式,并且通常包括引入可将非天然氨基酸连接到可与终止密码子配对的tRNA的氨酰基-tRNA合成酶。例如,已经开发了氨酰基-tRNA合成酶和与琥珀终止密码子配对的tRNA,以在琥珀密码子处位点特异性地引入非天然氨基酸,因为它是真核生物基因组(在人中为23%)和原核生物基因组(在大肠杆菌中为7%)中最少使用的终止密码子(Liuetal.,“Geneticincorporationofunnaturalaminoacidsintoproteinsinmammaliancells,”Nat.Methods,第4卷,第239-244页,2007)。赭石终止密码子和蛋白石终止密码子也已经用于引入非天然氨基酸(etal.,“Completesetoforthogonal21staminoacyl-tRNAsynthetase-amber,ochreandopalsuppressortRNApairs:concomitantsuppressionofthreedifferentterminationcodonsinanmRNAinmammaliancells,”NucleicAcidsRes.,第32卷,第6200-6211页,2004)。迄今为止,通过这种方法已将超过70种非天然氨基酸以位点特异性的方式并入重组蛋白中(Liu&Schultz,“Addingnewchemistriestothegeneticcode,”Annu.Rev.Biochem.,第79卷,第413-444页,2010)。通常,可以获得在期望位点的超过95%的非天然氨基酸并入效率(定义为全长产物中非天然氨基酸的占有率),这使其成为最常用的非天然氨基酸并入方法。本发明还包括本领域技术人员已知的用于将非天然氨基酸引入重组多肽中的任何其它技术。一种这样的技术涉及使用四碱基对密码子(Andersonetal.,“Anexpandedgeneticcodewithafunctionalquadrupletcodon.Proc.Natl.Acad.Sci.U.S.A.,第101卷,第7566-7571页,2004)。关于产生模拟重组多肽的更多讨论可以在美国专利号7,045,337和WO2010132341A2中找到,以上文献通过引用并入本文。如上所述,真核细胞生产宿主中的条件活性生物蛋白的表达优化也可以通过以下方式实现:所使用的载体(载体组分,例如启动子、剪接位点、5'和3'末端和侧翼序列)的优化、宿主细胞的基因修饰以减少基因缺失和重排、通过体内或体外演变相关基因的方法演变宿主细胞基因活性、通过相关基因的演变优化宿主糖基化酶和/或通过染色体宽宿主细胞诱变和选择策略以选择具有增强的表达能力的细胞。本文进一步描述了宿主细胞。在一个方面,在抗体的恒定区中进行密码子诱变以优化真核细胞表达。具有改善的表达特性、保持介导效应子功能的能力的密码子优化的Fc变体改善了治疗性抗体的产生。在这方面,例如,可以演变抗体分子的恒定区用于在不同的表达宿主中的筛选,例如使用CHO、HEK293和COS-7的哺乳动物细胞系表达筛选。本发明还提供通过天然过程(例如翻译后加工(例如磷酸化、酰化等))或通过化学修饰技术修饰本发明的多肽的方法。修饰可发生在多肽中的任何地方,包括肽主链、氨基酸侧链和氨基或羧基末端。应当理解,相同类型的修饰可以以相同或不同程度存在于给定多肽中的几个位点。给定的多肽也可以具有许多类型的修饰。修饰包括乙酰化、酰化、PEG化、ADP-核糖基化、酰胺化、黄素的共价连接、血红素部分的共价连接、核苷酸或核苷酸衍生物的共价连接、脂质或脂质衍生物的共价连接、磷脂酰肌醇的共价连接、交联环化、二硫键形成、脱甲基化、形成共价交联、形成半胱氨酸、形成焦谷氨酸、甲酰化、γ-羧化、糖基化、GPI锚形成、羟基化、碘化、甲基化、肉豆蔻酰化、氧化、聚乙二醇化、蛋白水解加工、磷酸化、异戊烯化、外消旋化、硒化、硫酸化和转移RNA介导的氨基酸添加至蛋白质,例如精氨酰化。参见例如Creighton,T.E.,proteins—StructureandMolecularProperties(蛋白质—结构和分子性质)2ndEd.,W.H.FreemanandCompany,NewYork(1993);PosttranslationalCovalentModificationofproteins(蛋白质的翻译后共价修饰),B.C.Johnson,Ed.,AcademicPress,NewYork,pp.1-12(1983)。合成多肽或其片段可以通过已知方法回收和纯化,包括硫酸铵或乙醇沉淀、酸提取、阴离子或阳离子交换层析、磷酸纤维素层析、疏水相互作用层析、亲和层析、羟基磷灰石层析和凝集素层析。如果需要,可以使用蛋白重折叠步骤来完成多肽的构型。如果需要,高效液相色谱(HPLC)可用于最终纯化步骤。本发明提供了包含至少一种条件活性生物蛋白的制剂,其中所述制剂是液体或干燥的。蛋白制剂任选地包含缓冲液、辅因子、第二蛋白或其他蛋白、和任选的一种或多种赋形剂。在一个方面,所述制剂用作治疗性条件活性生物蛋白,其在异常或非生理条件下有活性但在正常生理条件(例如温度、pH、渗透压、氧化应激和重量摩尔渗透压浓度)下活性较低或无活性。标准纯化技术可用于重组条件活性生物蛋白或合成条件活性生物蛋白。在一些实施方案中,用于产生条件活性生物蛋白的真核细胞生产宿主与用于表达从演变步骤产生的突变体DNA的真核细胞生产宿主相同。在一个实施方案中,真核细胞生产宿主是选自CHO、HEK293、IM9、DS-1、THP-1、HepG2、COS、NIH3T3、C33a、A549、A375、SK-MEL-28、DU145、PC-3、HCT116、MiaPACA-2、ACHN、Jurkat、MM1、Ovcar3、HT1080、Panc-1、U266、769P、BT-474、Caco-2、HCC1954、MDA-MB-468、LnCAP、NRK-49F和SP2/0细胞系;以及小鼠脾细胞和兔PBMC的哺乳动物系统。在一个实施方案中,多种哺乳动物细胞生产宿主可用于制备候选物,包括成纤维细胞(3T3,小鼠;BHK21,叙利亚仓鼠)、上皮细胞(MDCK,狗;Hela,人;PtK1,鼠袋鼠)、浆细胞(SP2/0和NS0,小鼠)、肾细胞(293,人;COS,猴)、卵巢细胞(CHO,中国仓鼠)和胚胎细胞(R1和E14.1,小鼠;H1和H9,人;PERC.6,人)。在某些方面,重组条件活性生物抗体在CHO、NS0和SP2/0细胞系中产生。在具体方面,哺乳动物生产宿主为CHO-S细胞系。最常使用的表达载体系统为谷氨酰胺合成酶表达系统和基于二氢叶酸还原酶基因的其他系统。在另一个实施方案中,真核细胞生产宿主为酵母细胞系统。在一个方面,酵母细胞系统选自酿酒酵母或毕赤酵母细胞。在本发明的方法中,用于筛选演变的分子的生产宿主与用于选定分子的下游制备的宿主相同。在本发明的另一方面,用于发现和演变蛋白的遗传系统与用于制备商业应用的蛋白的遗传系统完全相同。工程化条件活性生物蛋白本发明的条件活性生物蛋白可以通过本文所述的一种或多种蛋白工程技术来工程化。蛋白工程技术的非限制性实例包括抗体缀合、工程化多特异性抗体和工程化抗体的Fc区。工程化缀合的条件活性抗体本发明提供的条件活性抗体可以与分子缀合。因为条件活性抗体优先作用于脑、滑液、肿瘤微环境或干细胞小环境,所以条件活性抗体可以与将被与条件活性抗体一起转运到脑/滑液或肿瘤微环境的分子(治疗剂或诊断剂)缀合。在一些实施方案中,该分子具有毒性,该毒性可以通过缀合至条件活性抗体以优先作用于患病部位而降低。条件活性抗体与分子(治疗性或诊断性)的缀合可以是共价或非共价的。共价缀合可以是直接缀合或通过接头缀合。在某些实施方案中,通过构建蛋白融合物(即通过对编码条件活性抗体和例如用于治疗神经病症的药物的两个基因进行基因融合并表达为单一蛋白)实现直接缀合。在某些实施方案中,直接缀合是通过在条件活性抗体的两个部分之一上的反应基团与神经药物/显像剂上的相应基团或受体之间形成共价键来实现。在某些实施方案中,通过修饰(即基因修饰)待缀合的两个分子中的一个使其包括反应基团(作为非限制性实例,巯基或羧基)而该反应基团在适当条件下与另一待缀合的分子共价连接实现直接缀合。作为一个非限制性实例,可将具有所需反应基团(即半胱氨酸残基)的分子(即氨基酸)引入例如条件活性抗体并与神经药物形成的二硫键。用于将核酸共价缀合至蛋白的方法也是本领域已知的(即光交联,参见例如Zatsepinetal.Russ.Chem.Rev.,74:77-95(2005))。如本领域普通技术人员容易理解的,非共价缀合可以为任何非共价连接手段,包括疏水键、离子键、静电相互作用等。还可以使用多种接头进行缀合。例如,可以使用各种双功能蛋白偶联剂缀合条件活性抗体和神经药物,双功能蛋白偶联剂例如N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(SPDP)、琥珀酰亚胺基-4-(N-马来酰亚胺基甲基)环己烷-1-羧酸酯(SMCC)、亚氨基四氢噻吩(IT)、亚氨酸酯的双功能衍生物(例如二亚胺代己二酸二甲酯盐酸盐)、活性酯(例如辛二酸二琥珀酰亚胺酯)、醛(例如戊二醛)、双叠氮化合物(例如双(对叠氮基苯甲酰基)己二胺)、双重氮衍生物(例如双(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(例如甲苯-2,6-二异氰酸酯)和双活性氟化合物(例如1,5-二氟-2,4-二硝基苯)。也可以使用由通过肽键连接的一至二十个氨基酸组成的肽接头。在某些这样的实施方案中,氨基酸选自二十种天然存在的氨基酸。在某些其它这样的实施方案中,一个或多个氨基酸选自甘氨酸、丙氨酸、脯氨酸、天冬酰胺、谷氨酰胺和赖氨酸。接头可以是在递送至脑时促进神经药物释放的“可裂解接头”。例如,可以使用酸不稳定接头、肽酶敏感接头、光不稳定接头、二甲基接头或含二硫化物接头(Charietal.,CancerRes.,52:127-131(1992);U.S.PatentNo.5,208,020)。用于抗体缀合的交联剂试剂的一些实例包括BMPS、EMCS、GMBS、HBVS、LC-SMCC、MBS、MPBH、SBAP、SIA、SLAB、SMCC、SMPB、SMPH、磺基-EMCS、磺基-GMBS、磺基-KMUS、磺基-MBS、磺基-SIAB、磺基-SMCC、磺基-SMPB和SVSB(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯)。缀合的治疗剂可以对身体有毒,例如放射性颗粒、化疗药物或细胞毒素。使用本发明的条件活性抗体将缀合的治疗剂递送至患病部位将显著降低这些治疗剂的毒性作用。将放射性粒子与抗体缀合的技术是本领域已知的。替伊莫单抗和托西莫单抗是放射性粒子缀合的单克隆抗体的实例。两者都是与不同放射性粒子缀合的针对CD20抗原的抗体。类似地,将化疗药物与抗体缀合的技术也是本领域已知的。存在与化疗药物缀合的两种市售抗体:色瑞替尼(brentuximabvedotin,)和曲妥珠单抗(ado-trastuzumabemtansine,)。色瑞替尼由与称为MMAE的化疗药物连接的、靶向CD30抗原(在B细胞和T细胞上发现)的抗体制成。曲妥珠单抗由与称为DM1的化疗药物连接的、靶向HER2蛋白的抗体制成。将细胞毒素与抗体缀合的技术也是本领域已知的。例如,地尼白细胞介素(denileukindiftitox,癌症药物)由与毒素连接的、被称为白细胞介素-2(IL-2)的免疫系统蛋白组成,其中该毒素来自导致白喉的细菌。预期任何放射性粒子、化疗药物和细胞毒素均可以缀合到本发明的条件活性抗体以降低这些试剂的副作用。在一些实施方案中,放射性粒子与条件活性抗体缀合以治疗异常组织。放射性粒子可以包括用一种或多种放射性同位素浸渍的粒子,并且通常具有足够的放射性用于异常组织中的细胞的局部消融。粒子可以包括玻璃、金属、树脂、白蛋白或聚合物。放射性粒子中的金属可以选自铁、钆和钙。放射性粒子中的一种或多种放射性同位素的实例选自镓67(67Ga)、钇-90(90Y)、镓-68(68Ga)、铊-201(201T1)、锶-89(89Sr)、铟-III(111In)、碘-131(131I)、钐-153(153Sm)、锝-99m(99mTc)、铼-186(186Re)、铼-188(188Re)、铜-62(62Cu)和铜-64(64Cu)。优选地,组合物中的放射性同位素发射β辐射、γ辐射和/或正电子。在一些实施方案中,与条件活性抗体缀合的化疗药物选自蒽环类药物、拓扑异构酶I和/或II抑制剂、纺锤体毒物植物生物碱、烷化剂、抗代谢物、嘌呤类似物或嘧啶类似物、抗叶酸剂、玫瑰树碱和骆驼蓬碱。蒽环类药物(或蒽环类抗生素)源自链霉菌属细菌。这些化合物用于治疗大范围的癌症,包括例如肝细胞癌、白血病、淋巴瘤、乳腺癌、子宫癌、卵巢癌和肺癌。蒽环类药物包括但不限于多柔比星(doxorubicin)、柔红霉素(daunorubicin)、表柔比星(epirubicin)、伊达比星(idarubicin)、戊柔比星(valrubicin)、吡柔比星(pirarubicin)、佐柔比星(zorubicin)、阿柔比星(aclarubicin)、地托比星(detorubicin)、洋红霉素(carminomycin)、吗啉代阿霉素(morpholinodoxorubicin)、吗啉代柔红霉素(morpholinodaunorubicin)、甲氧基吗啉基多柔比星(methoxymorpholinyldoxorubicin)及其药学上可接受的盐。拓扑异构酶是维持DNA拓扑结构的必需酶。I型或II型拓扑异构酶的抑制通过扰乱正确的DNA超螺旋而干扰DNA的转录和复制。一些I型拓扑异构酶抑制剂包括喜树碱衍生物。喜树碱衍生物是指喜树碱类似物,例如伊立替康(irinotecan)、托泊替康(topotecan)、己糖胺、昔来替康(silatecan)、鲁特替康(lutortecan)、卡伦替康(karenitecin,BNP1350)、吉马替康(gimatecan,ST1481)、贝曲替康(belotecan,CKD602)及其药学上可接受的盐。II型拓扑异构酶抑制剂的实例包括但不限于安吖啶(amsacrine)、依托泊苷(etoposide)、磷酸依托泊苷和替尼泊苷(teniposide)。这些是表鬼臼毒素的半合成衍生物,表鬼臼毒素为天然存在于美国盾叶鬼臼(Podophyllumpeltatum)根中的生物碱。纺锤体毒素植物生物碱源自植物并通过阻碍细胞分裂所必需的微管功能来阻断细胞分裂。这些生物碱包括但不限于长春花生物碱(如长春花碱、长春新碱、长春地辛、长春瑞滨和长春西汀)和紫杉烷类。紫杉烷包括但不限于紫杉醇、多西他赛(docetaxel)、拉洛他赛(larotaxel)、卡巴他赛(cabazitaxel)、奥他赛(ortataxel)、替司他赛(tesetaxel)及其药学上可接受的盐。烷化剂因它们在细胞中存在的条件下向许多电负性基团添加烷基的能力而得名。它们通过与生物学上重要的分子中的氨基、羧基、巯基和磷酸基团形成共价键而损害细胞功能。值得注意的是,它们的细胞毒性被认为是由对DNA合成的抑制引起的。烷化剂包括但不限于氮芥、环磷酰胺、苯丁酸氮芥、异环磷酰胺和铂化合物(如奥沙利铂、顺铂或卡铂)。抗代谢物是抑制代谢物的利用的化学物,代谢物是正常代谢的一部分。这种物质在结构上通常与它们干扰的代谢物相似。抗代谢物的存在改变细胞生长和细胞分裂。嘌呤类似物或嘧啶类似物防止核苷酸并入DNA,从而停止DNA合成并因此阻止细胞分裂。它们还影响RNA合成。嘌呤类似物的实例包括硫唑嘌呤、巯嘌呤、硫鸟嘌呤、氟达拉滨、喷司他丁和克拉屈滨。嘧啶类似物的实例包括抑制胸苷酸合酶的5-氟尿嘧啶(5FU)、氟尿苷(FUDR)和胞嘧啶阿拉伯糖苷(阿糖胞苷)。抗叶酸剂是损害叶酸功能的化疗药物。众所周知的实例是甲氨蝶呤,其是抑制二氢叶酸还原酶(DHFR)的叶酸类似物,因此防止了四氢叶酸的形成。四氢叶酸是嘌呤和嘧啶合成所必需的。这会抑制DNA、RNA和蛋白质的产生(因为四氢叶酸还参与氨基酸丝氨酸和甲硫氨酸的合成)。其它抗叶酸剂包括但不限于甲氧苄啶、雷替曲塞、乙胺嘧啶和培美曲塞。其他化疗药物也可以与条件活性抗体缀合,例如玫瑰树碱和骆驼蓬碱。玫瑰树碱是从夹竹桃科的常绿树中分离的天然植物生物碱产物。例如9-羟基玫瑰树碱鎓、N2-甲基-9-羟基玫瑰树碱鎓、2-(二乙基氨基-2-乙基-9-羟基玫瑰树碱乙酸乙酯、2-(二异丙基氨基乙基)-9-羟基玫瑰树碱乙酸乙酯、2-(β哌啶基-2-乙基)9-羟基玫瑰树碱鎓都是有效的化疗药物。骆驼蓬碱是从骆驼蓬种子中分离的天然植物生物碱产物。骆驼蓬碱类化疗药物包括:骆驼蓬碱、二氢骆驼蓬碱,骆驼蓬醇(harmol)、去甲骆驼蓬碱(harmalol)和哈尔满碱(harman)、以及喹唑啉衍生物:鸭嘴花碱(vasicine)和鸭嘴花酮碱(vasicinone)。在一些实施方案中,与条件活性抗体缀合的细胞毒素包括紫杉醇、细胞松弛素B、短杆菌肽D、溴化乙锭、依米丁、丝裂霉素、依托泊苷、替尼泊苷、长春新碱、长春花碱、秋水仙素、多柔比星、柔红霉素、二羟基蒽二酮、米托蒽醌、光辉霉素、放线菌素D、1-脱氢睾酮、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔和嘌呤霉素及其类似物或同系物。其它毒素包括例如蓖麻毒素、CC-1065和类似物、多卡霉素。其他毒素包括白喉毒素和蛇毒(例如眼镜蛇毒)。在一些实施方案中,本发明的条件活性抗体可以与诊断剂缀合。用于本发明的诊断剂可以包括本领域已知的任何诊断剂,例如在以下参考文献中提供的诊断剂:Armstrongetal,DiagnosticImaging(诊断影像学),5thEd.,BlackwellPublishing(2004);Torchilin,V.P.,Ed.,TargetedDeliveryofImagingAgents(显象剂的靶向递送),CRCPress(1995);Vallabhajosula,S.,MolecularImaging:RadiopharmaceuticalsforPETandSPECT(分子成像:用于PET和SPECT的放射性药物),Springer(2009)。可以以多种方式检测诊断剂,包括使用该诊断剂提供和/或增强可检测信号,所述可检测信号包括但不限于γ-发射、放射性信号、回声信号、光学信号、荧光信号、吸收信号、磁性信号或断层扫描信号。用于对诊断剂成像的技术可以包括但不限于单光子发射计算机断层摄影(SPECT)、磁共振成像(MRI)、光学成像、正电子发射断层摄影(PET)、计算机断层摄影(CT)、X射线成像、γ射线成像等。在一些实施方案中,诊断剂可以包括结合例如金属离子以用于多种诊断成像技术的螯合剂。示例性的螯合剂包括但不限于乙二胺四乙酸(EDTA)、[4-(1,4,8,11-四氮杂环十四-1-基)甲基]苯甲酸(CPTA)、环己烷二胺四乙酸(CDTA)、亚乙基双(氧亚乙基次氮基)(EGTA)、二亚乙基三胺五乙酸(DTPA)、柠檬酸、羟乙基乙二胺三乙酸(HEDTA)、亚氨基二乙酸(IDA)、三亚乙基四胺六乙酸(TTHA)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四(亚甲基膦酸)(DOTP)、1,4,8,11-四氮杂环十二烷-1,4,8,11-四乙酸(TETA)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)及其衍生物。放射性同位素可以并入本文所述的一些诊断剂中,并且可以包括发射γ射线、正电子、β和α粒子和X射线的放射性核素。合适的放射性核素包括但不限于Ac、As、At、nB、128Ba、212Bi、75Br、77Br、14C、109Cd、62Cu、64Cu、67Cu、18F、67Ga、68Ga、3H、123I、125I、130I、131I、111In、177Lu、13N、15O、32P、33P、212Pb、103Pd、186Re、188Re、47Sc、153Sm、89Sr、99mTc、88Y和90Y。在某些实施方案中,放射性试剂可包括mIn-DTPA、99mTc(CO)3-DTPA、99mTc(CO)3-ENPy2、62/64/67Cu-TETA、99mTc(CO)3-IDA和99mTc(CO)3三胺(环状或直链)。在其他实施方案中,试剂可以包括DOTA及其与111In、177Lu、153Sm、88/90Y、62/64/67Cu或67/68Ga的各种类似物。在一些实施方案中,脂质体可以例如通过掺入附着于螯合物的脂质如DTPA-脂质进行放射性标记,如以下参考文献中所提供:Phillipsetal,WileyInterdisciplinaryReviews:NanomedicineandNanobiotechnology,第1卷,第69-83页(2008);Torchilin,V.P.&Weissig,V.,Eds.Liposomes2ndEd.:OxfordUniv.Press(2003);Elbayoumi,T.A.&Torchilin,V.P.,Eur.J.Nucl.Med.Mol.Imaging,33:1196-1205(2006);Mougin-Degraef,M.etal,Int'lJ.Pharmaceutics,344:110-117(2007)。在其他实施方案中,诊断剂可以包括光学剂,例如荧光剂、磷光剂、化学发光剂等。许多试剂(例如染料、探针、标记物或指示剂)是本领域已知的,并且可以用于本发明。(参见例如Invitrogen,TheHandbook--AGuidetoFluorescentProbesandLabelingTechnologies,TenthEdition(2005))。荧光剂可以包括多种有机和/或无机小分子或多种荧光蛋白及其衍生物。例如,荧光剂可以包括但不限于花青、酞菁、卟啉、吲哚菁、罗丹明、吩噁嗪、苯基呫吨、吩噻嗪、吩硒嗪、荧光素、苯并卟啉、方酸、二吡咯并嘧啶、并四苯、喹啉、吡嗪、咕啉、克酮酸、吖啶酮、菲啶、若丹明、吖啶、蒽醌、硫属吡喃鎓类似物、二氢卟酚、萘酞菁、次甲基染料、吲哚鎓染料、偶氮化合物、薁、氮杂薁、三苯基甲烷染料、吲哚、苯并吲哚、吲哚羰花青、苯并吲哚羰花青和具有4,4-二氟-4-硼-3a,4a-二氮杂-s-苯并二茚通用结构的BODIPYTM衍生物,和/或这些中的任何一个的缀合物和/或衍生物。可以使用的其它试剂包括但不限于例如荧光素、荧光素-聚天冬氨酸缀合物、荧光素-聚谷氨酸缀合物、荧光素-聚精氨酸缀合物、吲哚菁绿、靛青-十二天冬氨酸缀合物、吲哚菁(NIRD)-聚天冬氨酸缀合物、异硫丹蓝、吲哚二磺酸盐、苯并吲哚二磺酸盐、双(乙基羧甲基)吲哚菁、双(戊基羧甲基)吲哚菁、多羟基吲哚磺酸盐、聚羟基苯并吲哚磺酸盐、刚性杂原子吲哚磺酸盐、吲哚菁二丙酸(indocyaninebispropanoicacid)、吲哚菁二联己酸(indocyaninebishexanoicacid)、3,6-二氰基-2,5-[N,N,N',N'-四(羧甲基)氨基]吡嗪、3,6-[(N,N,N',N'-四(2-羟乙基)氨基]吡嗪-2,5-二羧酸、3,6-双(N-氮杂环丁烷基)吡嗪-2,5-二羧酸、3,6-双(N-吗啉基)吡嗪-2,5-二羧酸、3,6-双(N-哌嗪基)吡嗪-2,5-二羧酸、3,6-双(N-硫代吗啉基)吡嗪-2,5-二羧酸,3,6-双(N-硫代吗啉基)吡嗪-2,5-二羧酸S-氧化物、2,5-二氰基-3,6-双(N-硫代吗啉基)吡嗪S,S-二氧化物、吲哚羰花青四磺酸盐、氯代吲哚羰花青和3,6-二氨基吡嗪-2,5-二羧酸。在其它实施方案中,诊断剂可包括本领域通常众所周知的造影剂,包括例如超顺磁性氧化铁(SPIO)、钆或锰的络合物等。(参见例如Armstrongetal,DiagnosticImaging,5thEd.,BlackwellPublishing(2004))。在一些实施方案中,诊断剂可以包括磁共振(MR)显像剂。示例性的磁共振试剂包括但不限于顺磁性试剂、超顺磁性试剂等。示例性的顺磁性试剂可以包括但不限于钆喷酸、钆特酸、钆双胺、钆、加多利道(Gadoteridol)、锰福地吡(Mangafodipir)、钆弗塞胺(Gadoversetamide)、檬酸铁铵、钆贝酸、钆布醇或钆塞酸。超顺磁性试剂可以包括但不限于超顺磁性氧化铁和铁烯。在某些实施方案中,诊断剂可包括例如在以下参考文献中提供的X射线造影剂:H.SThomsen,R.N.MullerandR.F.Mattrey,Eds.,TrendsinContrastMedia,(Berlin:Springer-Verlag,1999);P.Dawson,D.CosgroveandR.Grainger,Eds.,TextbookofContrastMedia(ISISMedicalMedia1999);Torchilin,V.P.,Curr.Pharm.Biotech.,第1卷,第183-215页(2000);Bogdanov,A.A.etal,Adv.DrugDel.Rev.,第37卷,第279-293页(1999);Sachse,A.etah,InvestigativeRadiology,第32卷,第44-50页(1997)。X射线造影剂的实例包括但不限于碘帕醇、碘美普尔、碘海醇、碘普罗胺、碘普胺、碘沙星、碘佛醇、碘替拉唑、碘替卡因、碘克沙醇、碘克莫司、碘葡萄糖、碘克沙醇、碘磺胺、碘沙仑、伊洛比林、碘帕醇、碘美醇(iosimenol)。在某些实施方案中、X射线造影剂可以包括碘帕醇、碘美普尔、碘普胺、碘海醇、碘伏特、碘佛醇、碘卡醇、碘克沙醇、碘吡咯和碘西莫。在一些实施方案中,条件活性抗体可以与蛋白缀合,例如白细胞介素、细胞因子、酶、生长因子或其他抗体。这种蛋白的一些实例包括例如肿瘤坏死因子、α-干扰素(EFN-α)、β-干扰素(IFN-β)、神经生长因子(NGF)、血小板衍生生长因子(PDGF)、组织纤溶酶原激活物(TPA)、凋亡剂(例如WO97/33899中公开的TNF-α、TNF-β、AIMI),AIMII(参见WO97/34911)、Fas配体(Takahashietal.,J.Immunol.,第6卷,第1567-1574页,1994)和VEGI(WO99/23105)、血栓形成剂或抗血管生成剂(例如,血管抑素或内皮抑制素);或生物反应调节剂,例如淋巴因子(例如白细胞介素-1(“IL-1”)、白细胞介素-2(“IL-2”)、白细胞介素-6(“IL-6”)、粒细胞-巨噬细胞集落刺激因子(“GM-CSF”)和粒细胞集落刺激因子(“G-CSF”))或生长因子(例如生长激素(“GH”))。在一些实施方案中,本发明提供的用于穿过BBB的条件活性抗体可以缀合至用于治疗神经病症的药物。药物将与抗体一起转运穿过BBB,并保留在脑中用于治疗神经病症。神经病症是指影响CNS和/或病因在CNS中的疾病或病症。示例性CNS疾病或病症包括但不限于神经病、淀粉样变性、癌症、眼部疾病或病症、病毒或微生物感染、炎症、局部缺血、神经变性疾病、癫痫、行为障碍和溶酶体贮积病。为了本申请的目的,CNS将被理解为包括眼睛,其通常通过血液-视网膜屏障与身体的其余部分隔离(sequestered)。神经疾病的具体实例包括但不限于神经变性疾病(包括但不限于路易体病、脊髓灰质炎后综合征、Shy-Draeger综合征、橄榄体脑桥小脑萎缩、帕金森氏病、多系统萎缩、纹状体黑质变性、tau蛋白病理性改变(包括但不限于阿尔茨海默病和核上性麻痹)、朊病毒疾病(包括但不限于牛海绵状脑病、瘙痒病、克雅氏综合征、库鲁病、Gerstmann-Straussler-Scheinker病、慢性消耗性疾病和致命家族性失眠),延髓性麻痹、运动神经元疾病和神经系统异型变性疾病(包括但不限于卡纳万病、亨廷顿病、神经元蜡样脂褐质沉积症、亚历山大病、图雷特氏综合征、Menkes卷发综合症、科凯恩氏综合症(Cockaynesyndrome)、Halervorden-Spatz综合症、拉福拉病(laforadisease)、Rett综合症、肝性关节变性、Lesch-Nyhan综合症和Unverricht-Lundborg综合症)、痴呆(包括但不限于皮克氏病和脊髓小脑性共济失调)、癌症(例如CNS和/或脑,包括由身体其它部位的癌症引起的脑转移)。用于治疗神经病症的药物包括但不限于抗体、肽、蛋白、一个或多个CNS靶的天然配体、一个或多个CNS靶的天然配体的修饰形式、适体、抑制性核酸(即小抑制性RNA(siRNA)和短发夹RNA(shRNA))、核酶和小分子或任何上述的活性片段。示例性神经病症药物包括但不限于:抗体、适体、蛋白、肽、抑制性核酸和小分子和任何上述的活性片段,以上物质本身为或特异性识别和/或作用于(即,抑制、激活或检测)CNS抗原或靶分子,靶分子例如但不限于淀粉样蛋白前体蛋白或其部分、淀粉样蛋白β、β-分泌酶、γ-分泌酶、tau、α-突触核蛋白、帕金蛋白、亨廷顿蛋白、DR6、早老素、ApoE、神经胶质瘤或其他CNS癌症标志物和神经营养因子。神经病症药物和其可以治疗的疾病的非限制性实例包括用于治疗阿尔茨海默氏病、急性和慢性脑损伤、中风的抗BACE1抗体;用于治疗阿尔茨海默病的抗Aβ抗体;用于治疗中风、急性脑损伤、脊髓损伤的神经营养因子;用于治疗慢性脑损伤(神经发生)的脑源性神经营养因子(BDNF)和成纤维细胞生长因子2(FGF-2);用于治疗脑癌的抗表皮生长因子受体(EGFR)-抗体;用于治疗帕金森病的神经胶质细胞系衍生的神经因子(GDNF);用于治疗肌萎缩性侧索硬化和抑郁症的脑源性神经营养因子(BDNF);用于治疗脑的溶酶体贮积病症的溶酶体酶;用于治疗肌萎缩性侧索硬化的睫状神经营养因子(CNTF);用于治疗精神分裂症的神经调节蛋白-1;和用于治疗HER2阳性癌症的脑转移的抗HER2抗体(例如曲妥单抗)。在一些实施方案中,条件活性抗体的缀合可以发生在这些抗体的Fc区上。上述缀合分子、化合物或药物可以与Fc区缀合,如美国专利号8,362,210中所述(该文献通过引用并入本文)。例如,Fc区可以与细胞因子或毒素缀合以被递送至条件活性抗体显示优先活性的部位。将多肽与抗体的Fc区缀合的方法是本领域已知的。参见,例如,美国专利号5,336,603、5,622,929、5,359,046、5,349,053、5,447,851、5,723,125、5,783,181、5,908,626、5,844,095和5,112,946;EP307,434;EP367,166;EP394,827;PCT公开WO91/06570、WO96/04388、WO96/22024、WO97/34631和WO99/04813;Ashkenazietal.,Proc.Natl.Acad.Sci.USA,第88卷,第10535-10539,页1991;Trauneckeretal.,Nature,第331卷,第84-86页,1988;Zhengetal.,J.Immunol.,第154卷,第5590-5600页,1995;和ViIetal.,Proc.Natl.Acad.Sci.USA,第89卷,第11337-11341页,1992,上述文献通过引用整体并入本文。工程化多特异性条件活性抗体多特异性抗体是具有多表位特异性的抗体。多特异性抗体包括但不限于包含重链可变结构域(VH)和轻链可变结构域(VL)的抗体,其中VHVL单元具有多表位特异性;具有两个或更多个VL和VH结构域的抗体,其中每个VHVL单元结合不同的表位;具有两个或更多个单可变结构域的抗体,其中每个单可变结构域结合不同的表位;包含一个或多个抗体片段的抗体;以及包含已经共价或非共价连接的抗体片段的抗体。为了构建包括双特异性抗体在内的多特异性抗体,获得了具有至少一个游离巯基的抗体片段。抗体片段可以从全长条件活性抗体获得。可以将条件活性抗体酶促消化以产生抗体片段。示例性酶促消化方法包括但不限于胃蛋白酶、木瓜蛋白酶和Lys-C。示例性抗体片段包括但不限于Fab、Fab'、F(ab')2、Fv、双抗体(Db);串联双抗体(taDb)、线性抗体(参见美国专利号5,641,870;5,641,870;Zapataetal.,ProteinEng.,第8卷,第1057-1062页(1995));单臂抗体、单可变结构域抗体、迷你抗体(Olafsenetal(2004)ProteinEng.Design&Sel.,第17卷,第315-323页)、单链抗体分子、Fab表达文库产生的片段、抗独特型(抗Id)抗体、互补决定区(CDR)和表位结合片段。抗体片段也可以使用DNA重组技术产生。编码抗体片段的DNA可以克隆到质粒表达载体或噬菌粒载体中并直接在大肠杆菌中表达。抗体酶促消化方法、DNA克隆和重组蛋白表达方法是本领域技术人员熟知的。抗体片段可以使用常规技术纯化,并且可以进行还原以产生游离硫醇基。具有游离硫醇基的抗体片段可以与交联剂例如双马来酰亚胺反应。这种交联的抗体片段被纯化,然后与具有游离硫醇基的第二抗体片段反应。将两个抗体片段交联的最终产物纯化。在某些实施方案中,每个抗体片段为Fab,并且其中两个Fab通过双马来酰亚胺连接的最终产物在本文中被称为双马来酰亚胺-(硫-Fab)2或双Fab。可利用此类多特异性抗体和抗体类似物(包括双Fab)快速合成大量抗体片段组合或天然抗体的结构变体或特定抗体片段组合。多特异性抗体可以用改性交联剂合成,使得其他功能部分可以连接到多特异性抗体。改性交联剂允许任何巯基反应性部分的连接。在一个实施方案中,N-琥珀酰亚胺基-S-乙酰基硫代乙酸酯(SATA)连接到双马来酰亚胺以形成双马来酰亚胺基-乙酰基硫代乙酸酯(BMata)。在对掩蔽的硫醇基去保护之后,具有巯基反应性(或硫醇-反应性)部分的任何官能团可以连接到多特异性抗体。示例性的硫醇反应性试剂包括多功能接头试剂、捕获剂(即亲和性标记试剂,例如生物素-接头试剂)、检测标记(例如荧光团试剂)、固相固定试剂(例如SEPHAROSETM、聚苯乙烯或玻璃)或药物-接头中间体。硫醇反应性试剂的一个实例是N-乙基马来酰亚胺(NEM)。这种具有改性交联剂的多特异性抗体或抗体类似物可以进一步与药物部分试剂或其它标记物反应。多特异性抗体或抗体类似物与药物-接头中间体的反应分别提供多特异性抗体药物缀合物或抗体类似物药物缀合物。用于制备多特异性抗体的许多其它技术也可用于本发明中。描述这些技术的参考文献(通过引用并入本文)包括:(1)MilsteinandCuello,Nature,第305卷,第537页(1983),WO93/08829,和Trauneckeretal.,EMBOJ.,第10卷,第3655页(1991),关于具有不同特异性的两个免疫球蛋白重链-轻链对的重组共表达;(2)美国专利号5,731,168,关于杵臼(knob-in-hole)工程化;(3)WO2009/089004A1,关于用于制备抗体Fc异源二聚体分子的工程化静电转向效应;(4)美国专利号4,676,980和Brennanetal.,Science,第229卷,第81页(1985),关于交联两个或多个抗体或片段;(5)Kostelnyetal.,J.Immunol.,第148卷,第1547-1553页(1992),关于使用亮氨酸拉链产生双特异性抗体;(6)Hollingeretal.,Proc.Natl.Acad.Sci.USA,第90卷,第6444-6448页(1993),关于使用“双抗体”技术制备双特异性抗体片段;(7)Gruberetal.,J.Immunol.,第152卷,第5368页(1994),关于使用单链Fv(sFv)二聚体;(8)Tuttetal.J.Immunol.147:60(1991),关于制备三特异性抗体;和(9)US2006/0025576A1和Wuetal.NatureBiotechnology,第25卷,第页1290-1297页(2007),关于具有三个或更多个功能性抗原结合位点的工程化抗体,包括“章鱼抗体(Octopusantibodies)”或“双重可变结构域免疫球蛋白”(DVD)。本发明的多特异性抗体也可以按照WO/2011/109726中所述产生,该文献通过引用整体并入本文。在一个实施方案中,用于穿过BBB的条件活性抗体被工程化以制备多特异性抗体(例如双特异性抗体)。该多特异性抗体包含结合BBB-R的第一抗原结合位点和结合脑抗原的第二抗原结合位点。至少BBB-R的第一抗原结合位点是条件活性的。脑抗原是在脑中表达的抗原,其可以被抗体或小分子靶向。这种抗原的实例包括但不限于:β-分泌酶1(BACE1)、淀粉样蛋白β(Aβ)、表皮生长因子受体(EGFR)、人表皮生长因子受体2(HER2)、Tau、载脂蛋白E4(ApoE4)、α-突触核蛋白、CD20、亨廷顿蛋白、朊病毒蛋白(PrP)、富含亮氨酸的重复激酶2(LRRK2)、帕金蛋白、早老素1、早老素2、γ分泌酶、死亡受体6(DR6)、淀粉样蛋白前体蛋白(APP)、p75神经营养因子受体(p75NTR)和半胱天冬酶6。在一个实施方案中,抗原为BACE1。在一些实施方案中,多特异性抗体可靶向与癌症治疗细胞(例如NK细胞和本文提及的其它细胞)占用的抗原,以通过充当免疫效应细胞来活化癌症治疗细胞。这种情况的一个实例为靶向CD16A抗原以使NK细胞与表达CD30的恶性肿瘤斗争的CAR。双特异性、四价AFM13抗体是可以递送该效应的抗体的实例。这种类型的实施方案的进一步细节可以在例如以下文献中找到:Rothe,A.,etal.,“Aphase1studyofthebispecificanti-CD30/CD16AantibodyconstructAFM13inpatientswithrelapsedorrefractoryHodgkinlymphoma,”Blood,vol.125,no.26,pp.4024-4031,2015。多特异性抗体具有高选择性以优先靶向含有多特异性抗体可结合的所有或大多数靶(抗原)的组织。例如,与仅可以表达一种抗原的非靶细胞相比,双特异性抗体可以通过对表达由双特异性抗体识别的两种抗原的靶细胞显示出更大的偏好性来提供对靶细胞的选择性。因此,由于系统的动力学,在平衡时,结合靶细胞的双特异性抗体比结合非靶细胞的双特异性抗体多。工程化用于穿过BBB的条件活性抗体BBB具有由BBB受体(BBB-R)介导的内源性转运系统,BBB受体(BBB-R)为允许大分子转运穿过BBB的特异性受体。例如,使用内源性转运系统可以将结合BBB-R的抗体转运穿过BBB。这样的抗体可以用作通过使用穿过BBB的内源性BBB受体介导的转运系统将药物或其他药剂转运通过BBB的载体。这样的抗体不需要对BBB-R具有高亲和力。不是对BBB-R具有低亲和力的条件活性抗体的抗体已被描述为比高亲和力抗体更高效地穿过BBB,如US2012/0171120(通过引用并入本文)中所述。用于工程化抗体进入脑的另一种方法是工程化抗体以使其通过中枢神经系统淋巴管被递送到脑。因此,抗体可以被工程化以结合或模拟免疫细胞,例如T细胞或通过淋巴管运输到中枢神经系统的滑液或脑脊液。中枢神经系统的淋巴管的细节描述于例如Louveau,A.,etal.,“Structuralandfunctionalfeaturesofcentralnervoussystemlymphaticvessels,”Nature523,pp.337-341,2015年7月16日,以及引用该文章的且在本申请的申请日前公众可获得的文章,所有这些文献的全部内容通过引用并入本文,用于提供中枢神经系统淋巴系统和在该系统中运行的流体和细胞的细节。与传统抗体不同,条件活性抗体不需要对BBB-R具有低亲和力以穿过BBB并保留在脑内。条件活性抗体可以对BBB的血液侧上的BBB-R具有高亲和力,并且而对BBB的脑侧有很少的亲和力或没有亲和力。药物(例如药物缀合物)可以偶联到条件活性抗体,以与抗体一起穿过BBB并被转运到脑中。BBB-R是在脑内皮细胞上表达的跨膜受体蛋白,其能够跨越血脑屏障转运分子。BBB-R的实例包括转铁蛋白受体(TfR)、胰岛素受体、胰岛素样生长因子受体(IGF-R)、低密度脂蛋白受体(包括但不限于低密度脂蛋白受体相关蛋白1(LRP1)和低密度脂蛋白受体相关蛋白8(LRP8))和肝素结合表皮生长因子样生长因子(HB-EGF)。本文中的示例性BBB-R为转铁蛋白受体(TfR)。TfR是由二硫键连接的两个亚单位(每个表观分子量为约90,000)组成的跨膜糖蛋白(分子量为约180,000),其在脊椎动物中参与铁摄取。在一些实施方案中,本发明提供由针对BBB-R的亲本或野生型抗体产生的条件活性抗体。条件活性抗体结合BBB血液侧上的BBB-R,并且与BBB脑侧上的亲本或野生型抗体相比,其对BBB-R具有较低的亲和力。在一些其他实施方案中,与野生型或亲本抗体相比,条件活性抗体对BBB血液侧上的BBB-R有亲和力,对BBB脑侧上的BBB-R没有亲和力。血浆是与脑细胞外液(ECF)非常不同的体液。如Somjen(“IonsintheBrain:NormalFunction,Seizures,andStroke,”OxfordUniversityPress,2004,16和33页)和Redzic(“Molecularbiologyoftheblood-brainandtheblood-cerebrospinalfluidbarriers:similaritiesanddifferences,”FluidsandBarriersoftheCNS,vol.8:3,2011)所述,脑细胞外液具有比血浆显著更少的K+、更多的Mg2+和H+。血浆和脑ECF之间的离子浓度的差异导致两种流体之间渗透压和重量摩尔渗透压浓度的显著差异。表1显示了血浆和脑ECF中常见离子的毫摩尔浓度。表1.血浆(动脉血浆)和脑细胞外液(CSF)中的常见离子脑ECF还包含比血浆显著更多的乳酸盐,并且比血浆显著更少的葡萄糖(Abi-Saabetal.,“StrikingDifferencesinGlucoseandLactateLevelsBetweenBrainExtracellularFluidandPlasmainConsciousHumanSubjects:EffectsofHyperglycemiaandHypoglycemia,”JournalofCerebralBloodFlow&Metabolism,第22卷,第271–279页,2002)。因此,存在几种生理条件,其在BBB的两侧之间存在不同,例如pH、各种物质(例如乳糖、葡萄糖、K+、Mg2+)的浓度、渗透压和重量摩尔渗透压浓度。对于pH的生理条件,人血浆具有比人脑ECF更高的pH。对于K+浓度的生理条件,脑ECF具有比人血浆更低的K+浓度。对于Mg2+浓度的生理条件,人脑ECF具有比人血浆显著更多的Mg2+。对于渗透压的生理条件,人脑ECF具有不同于人血浆的渗透压。在一些实施方案中,脑ECF的生理条件可以是具有特定神经病症的患者的脑ECF的组成、pH、渗透压和重量摩尔渗透压浓度,其可以不同于一般人群的脑ECF的生理条件。因此,本发明提供了一种用于演变编码针对BBB-R的模板抗体的DNA以产生突变DNA文库的方法。然后表达突变DNA文库以获得突变抗体。筛选突变抗体以获得具有以下特性的条件活性抗体:在至少一种血浆生理条件下与BBB-R结合,并且在脑ECF中的至少一种脑生理条件下对BBB-R的亲和力较模板抗体低或没有亲和力。因此,所选择的突变抗体在血浆侧对BBB-R具有低或高亲和力,而在脑ECF侧对BBB-R具有低亲和力或无亲和力。该选择的突变抗体可用作用于跨BBB转运的条件活性抗体。这样的条件活性抗体有利于穿过BBB并保留在脑ECF中。对脑侧的BBB-R的低亲和力降低了条件活性抗体相对于模板抗体被转运穿过BBB至脑外并返回到血液中的速率(或移除)。在一些其它实施方案中,本发明提供了用于演变编码针对BBB-R的模板抗体的DNA以产生突变DNA文库的方法。然后表达突变DNA文库以获得突变抗体。筛选突变抗体以获得具有以下特性的条件活性抗体:在至少一种血浆生理条件下与BBB-R结合,并且在至少一种脑生理条件下对BBB-R有很少的亲和力或没有亲和力。因此,所选择的突变抗体为条件活性抗体。这样的条件活性抗体在穿过BBB并保留在脑ECF中是有利的。在血浆侧与BBB-R结合后,条件活性抗体被转运通过BBB,在脑ECF侧对BBB-R有很少的亲和力或没有亲和力意味着条件活性抗体不可能被转运出大脑。条件活性抗体对BBB-R的亲和力可以通过其半数最大抑制浓度(IC50)来测量,所述半数最大抑制浓度(IC50)是需要多少抗体来抑制50%的已知BBB-R配体与BBB-R的结合的量度。常见的方法是进行竞争性结合测定,例如竞争性ELISA测定。测量TfR(BBB-R)的IC50的示例性竞争性ELISA测定法为其中增加浓度的抗TfR抗体与生物素化TfRA竞争结合TfR的竞争ELISA测定法。抗TfR抗体竞争性ELISA可以在包被有2.5μg/ml纯化的鼠TfR胞外结构域的PBS溶液的Maxisorp板(Neptune,N.J.)中于4℃下进行一整夜。用PBS/0.05%吐温20洗涤板,并使用PBS中的Superblock封闭缓冲液(ThermoScientific,Hudson,新罕布什尔州)封闭板。将每种单独的抗TfR抗体(1:3连续稀释)的滴定与生物素化的抗TfRA(0.5nM最终浓度)组合,并在室温下加入板1小时。用PBS/0.05%吐温20洗涤板,向板中加入HRP-链霉亲和素(SouthernBiotech,伯明翰市),并在室温下温育1小时。用PBS/0.05%吐温20洗涤板,使用TMB底物(BioFXLaboratories,奥因斯米尔斯)检测结合到板上的生物素化的抗TfRA。高IC50表示需要更多的条件活性抗体来抑制BBB-R的已知配体的结合,因此抗体对该BBB-R的亲和力相对较低。相反,低IC50表示需要较少的条件活性抗体来抑制已知配体的结合,因此抗体对该BBB-R的亲和力相对较高。在一些实施方案中,来自血浆中BBB-R的条件活性抗体的IC50可以为约1nM至约100μM,或约5nM至约100μM,或约50nM至至约100μM,或约100nM至约100μM,或约5nM至约10μM,或约30nM至约1μM,或约50nM至约1μM。用于滑液的工程化条件活性生物蛋白在工业化国家,关节疾病是残疾和提前退休的主要原因。关节疾病常常在难以修复的关节处导致损伤。滑液是在人或动物体的关节(例如,膝、髋、肩)的滑膜腔中在面向关节形成表面的软骨和滑膜之间发现的体液。滑液为软骨提供营养并且还用作关节的润滑剂。软骨和滑膜的细胞分泌流体,所述流体在关节形成表面之间用作润滑剂。人类滑液包含约85%的水。它源自血浆的透析液,其本身由水、溶解的蛋白质、葡萄糖、凝血因子、矿物离子、激素等组成。蛋白质例如白蛋白和球蛋白存在于滑液中,并且被认为在润滑关节区域中起重要作用。在人滑液中还发现了一些其它蛋白,包括糖蛋白,例如α-1-酸性糖蛋白(AGP)、α-1-抗胰蛋白酶(A1AT)和润滑素。滑液具有与身体的其他部分非常不同的组成。因此,滑液具有不同于身体其他部分(例如血浆)的生理条件。例如,滑液具有小于约10mg/dL的葡萄糖,而人血浆中的平均正常葡萄糖水平为约100mg/dL,一天中在70-100mg/dL之间的范围内波动。此外,滑液中的总蛋白水平约为血浆蛋白水平的三分之一,因为大分子例如蛋白质不容易通过滑膜进入滑液。还已经发现人体滑液的pH高于人血浆中的pH(Jebensetal.,“OntheviscosityandpHofsynovialfluidandthepHofblood,”TheJournalofBoneandJointSurgery,第41B卷,第388-400页,1959;Farretal.,“SignificanceofthehydrogenionconcentrationinsynovialfluidinRheumatoidArthritis,”ClinicalandExperimentalRheumatology,第3卷,第99-104页,1985)。因此,滑液具有与身体其他部分的生理条件(例如血浆中的生理条件)不同的若干生理条件。滑液具有高于身体其他部分(特别是血浆)的pH。滑液具有比身体其他部分(例如血浆)更低的葡萄糖浓度。滑液也具有比身体其他部分(例如血浆)更低的蛋白浓度。已经使用几种抗体通过将抗体引入滑液来治疗关节疾病。例如,已知受伤关节中的滑液含有对骨关节炎的进展有影响的许多因素(参见例如Fernandes,etal.,"TheRoleofCytokinesinOsteoarthritisPathophysiology",Biorheology,第39卷,第237-246页,2002)。已知通过活化的滑膜细胞产生的细胞因子(例如白细胞介素-1(IL-1)和肿瘤坏死因子-α(TNF-α))上调基质金属蛋白酶(MMP)基因表达。MMP的上调导致关节中基质和非基质蛋白的降解。中和细胞因子的抗体可以阻止骨关节炎的进展。使用抗体作为药物是治疗关节疾病的有前途的策略。例如,已经开发了抗体(例如抗聚集蛋白聚糖或聚集蛋白聚糖酶的抗体)以治疗骨关节炎,所述骨关节炎迄今是关节疾病中最普遍的(WO1993/022429A1)。已经开发了针对乙酰化高迁移率族蛋白1(HMGB1)的抗体用于诊断或治疗关节疾病,该关节疾病为炎性、自身免疫、神经变性或恶性疾病/病症,例如关节炎。该抗体可用于检测滑液中HMGB1的乙酰化形式(WO2011/157905A1)。也已经开发另一种抗体(CD20抗体)用于治疗关节的结缔组织和软骨的损伤。然而,这些抗体的抗原通常在携带重要生理功能的身体的其它部分表达。针对这些抗原的抗体尽管在治疗关节疾病方面是有效的,但也可以显著干扰这些抗原在身体其他部分的正常生理功能。因此,患者可能经历严重的副作用。因此,期望开发治疗剂,例如针对细胞因子或其它抗原的抗体,其可以在滑液中以更高的亲和力优先结合其抗原(蛋白或其它大分子),而不结合或仅弱结合身体其他部分的相同抗原以减少副作用。这种条件活性生物蛋白可以是条件活性抗体。在一些实施方案中,本发明还提供作为除抗体之外的蛋白的条件活性生物蛋白。例如,可以通过本发明开发条件活性免疫调节剂用于优先调节滑液中的免疫应答,其可以对身体其他部分的免疫应答产生较小的影响或无影响。条件活性生物蛋白可以是细胞因子信号传导的条件活性抑制剂(SOCS)。这些SOCS中的许多参与抑制JAK-STAT信号传导途径。细胞因子信号传导的条件活性抑制剂可以优先抑制滑液中的细胞因子信号传导,而不抑制或在较小程度上抑制身体其他部分的细胞因子信号传导。在一些实施方案中,本发明提供了源自野生型生物蛋白的条件活性生物蛋白。条件活性生物蛋白在身体的某些部分(例如血浆中)中的至少一种生理条件下比野生型生物蛋白具有更低的活性,并且在滑液中的至少一种生理条件下具有比野生型生物蛋白更高的活性。这种条件活性生物蛋白可以优先在滑液中起作用,但不能或较小程度地作用于身体的其他部分。因此,这种条件活性生物蛋白可能具有减少的副作用。在一些实施方案中,条件活性生物蛋白是针对滑液中或暴露于滑液的抗原的抗体。尽管抗原通常是细胞因子,但这样的抗原可以是参与关节疾病中的免疫应答/炎症的任何蛋白。该条件活性抗体在身体其他部分(例如血浆)中的至少一种生理条件下对该抗原的亲和力比野生型抗体对相同抗原的亲和力更低,而在滑液的至少一种生理条件下其对该抗原的亲和力比野生型抗体更高。这样的条件活性抗体可以与身体其他部分中的抗原弱结合或完全不结合,但是在滑液中结合(例如强烈地和紧密地结合或者更强地结合)抗原。用于肿瘤的工程化条件活性生物蛋白实体瘤中的癌细胞能够在其周围形成肿瘤微环境以支持癌细胞的生长和转移。肿瘤微环境是肿瘤存在的细胞环境,包括周围的血管、免疫细胞、成纤维细胞、其他细胞、可溶性因子、信号传导分子、细胞外基质和可促进肿瘤转化、支持肿瘤生长和侵袭、保护肿瘤免受宿主免疫、培养治疗抗性并为休眠转移茁壮成长提供微环境的机械因子(mechanicalcue)。肿瘤及其周围的微环境密切相关,不断交互。肿瘤可以通过释放细胞外信号、促进肿瘤血管生成和诱导外周免疫耐受来影响它们的微环境,而微环境中的免疫细胞可以影响癌细胞的生长和演变。参见wartsetal.“TumorMicroenvironmentComplexity:EmergingRolesinCancerTherapy,”CancerRes,vol.,72,第2473-2480页,2012。肿瘤微环境通常是缺氧的。随着肿瘤块增加,肿瘤内部生长远离现有血液供应,这导致难以将氧完全供应到肿瘤微环境。与血浆中约40mmHg的氧分压相比,在超过50%的局部晚期实体肿瘤中,肿瘤环境中的氧分压低于5mmHg。相反,身体的其他部分不是缺氧的。缺氧环境导致基因不稳定性,其通过下调核苷酸切除修复和错配修复的途径与癌症进展相关。缺氧还引起缺氧诱导因子1α(HIF1-α)的上调,其诱导血管生成,并且与较差的预后以及与转移相关的基因的激活相关。参见Weberetal.,“Thetumormicroenvironment,”SurgicalOncology,第21卷,172-177页,2012andBlagosklonny,“Antiangiogenictherapyandtumorprogression,”CancerCell,第5卷,第13-17页,2004。此外,肿瘤细胞往往依赖不需要氧的乳酸发酵产生的能量。因此,肿瘤细胞不太可能使用需要氧气的正常有氧呼吸。使用乳酸发酵的结果是肿瘤微环境是酸性的(pH6.5-6.9),与身体的其它部分相比,身体的其它部分通常是中性或微碱性的。例如,人血浆的pH为约7.4。参见Estrellaetal.,“AcidityGeneratedbytheTumorMicroenvironmentDrivesLocalInvasion,”CancerResearch,第73卷,第1524-1535页,2013。由于与位于身体其他部分的细胞相比,增殖性癌细胞的营养需求相对较高,因此肿瘤微环境中的营养物利用度也较低。此外,肿瘤微环境还包含在身体的其他部分中通常不存在的许多不同的细胞类型。这些细胞类型包括内皮细胞及其前体、周细胞、平滑肌细胞、成纤维细胞、癌相关的成纤维细胞、成肌细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、肥大细胞、T和B淋巴细胞、天然杀伤细胞和抗原呈递细胞(例如巨噬细胞和树突细胞)(Lorussoetal.,“Thetumormicroenvironmentanditscontributiontotumorevolutiontowardmetastasis,”HistochemCellBiol,第130卷,第1091-1103页,2008)。因此,肿瘤微环境具有不同于身体其他部分的生理条件(例如血浆中的生理条件)的至少几种生理条件。肿瘤微环境的pH(酸性)低于身体的其他部分,特别是血浆(pH7.4)。肿瘤微环境具有比身体其他部分(例如血浆)更低的氧浓度。此外,肿瘤微环境具有比身体其他部分(特别是血浆)更低的营养利用度。肿瘤微环境也具有一些不同的细胞类型,这些细胞类型在身体的其他部分(特别是血浆)中不常见。一些癌症药物包括可以穿透到肿瘤微环境中并作用于其中的癌细胞的抗体。基于抗体的癌症治疗已经成熟,并且已经成为用于治疗患有血液恶性肿瘤和实体瘤的患者的最成功和重要的策略之一。存在一系列被人癌细胞表达的细胞表面抗原,与在正常组织中相比,在癌细胞中该细胞表面抗原被过表达、突变或选择性表达。这些细胞表面抗原是抗体癌症治疗的优良靶标。可被抗体靶向的癌细胞表面抗原分为几个不同的类别。造血分化抗原是通常与分化簇(CD)分组相关的糖蛋白,并且包括CD20、CD30、CD33和CD52。细胞表面分化抗原是在正常细胞和肿瘤细胞表面上发现的糖蛋白和碳水化合物的不同组。参与生长和分化信号传导的抗原通常是生长因子和生长因子受体。作为癌症患者中抗体靶标的生长因子包括CEA2、表皮生长因子受体(EGFR;也称为ERBB1)12、ERBB2(也称为HER2)13、ERBB3(REF.18)、MET(也称为HGFR)19、胰岛素样生长因子1受体(IGF1R)20、肝配蛋白受体A3(EPHA3)21、肿瘤坏死因子(TNF)相关的凋亡诱导配体受体1(TRAILR1;也称为TNFRSF10A)、TRAILR2(也称为TNFRSF10B)和核因子κB配体的受体激活剂(RANKL;也称为TNFSF11)22。参与血管生成的抗原通常是支持新微血管系统形成的蛋白或生长因子,包括血管内皮生长因子(VEGF)、VEGF受体(VEGFR)、整联蛋白αVβ3和整联蛋白α5β1(REF.10)。肿瘤基质和细胞外基质是肿瘤不可或缺的支持结构。作为治疗靶标的基质抗原和细胞外基质抗原包括成纤维细胞激活蛋白(FAP)和腱生蛋白。参见Scottetal.,“Antibodytherapyofcancer,”NatureReviewsCancer,第12卷,第278-287页,2012。除了抗体之外,其他生物蛋白也有望用于癌症治疗。实例包括肿瘤抑制剂例如成视网膜细胞瘤蛋白(pRb)、p53、pVHL、APC、CD95、ST5、YPEL3、ST7和ST14。也可以将一些诱导癌细胞凋亡的蛋白引入肿瘤以缩小肿瘤的尺寸。有至少两种可以诱导肿瘤凋亡的机制:肿瘤坏死因子诱导的机制和Fas-Fas配体介导的机制。参与两种凋亡机制中的任一种的至少一些蛋白可以被引入肿瘤用于治疗。癌症干细胞是能够产生在特定癌症样品中发现的所有细胞类型的癌细胞,因此是肿瘤形成细胞。它们可以通过自我更新并分化成多种细胞类型的干细胞过程产生肿瘤。认为癌症干细胞作为独特的群体在肿瘤中存留,并通过产生新的肿瘤而引起复发和转移。开发靶向癌症干细胞的特异疗法可以提高癌症患者的存活并改善生活质量,特别是对于转移性疾病的患者。这些用于治疗肿瘤的药物通常干扰除了肿瘤之外的身体其他部分的正常生理功能。例如,诱导肿瘤凋亡的蛋白也可以诱导身体某些其它部分的细胞凋亡,从而引起副作用。在使用抗体治疗肿瘤的实施方案中,抗体的抗原也可以在其执行正常生理功能的身体的其它部分表达。例如,单克隆抗体贝伐单抗(靶向血管内皮生长因子)防止肿瘤血管生长。该抗体还可以阻止身体其他部分的血管生长或修复,从而导致出血、伤口愈合不良、血凝块和肾损伤。更有效的肿瘤治疗非常需要开发主要或单独靶向肿瘤的条件活性生物蛋白。在一些实施方案中,本发明提供了由野生型生物蛋白产生的条件活性生物蛋白,所述野生型生物蛋白可以是肿瘤治疗的候选物。条件活性生物蛋白在除了肿瘤微环境之外的身体部分(例如血浆)中的至少一种生理条件下较野生型生物蛋白具有更低的活性,而在肿瘤微环境中的至少一种生理条件下较野生型生物蛋白具有更高的活性。这种条件活性生物蛋白可优先作用于肿瘤微环境中的癌细胞以治疗肿瘤,因此不太可能引起副作用。在生物蛋白为针对肿瘤细胞表面上的抗原的抗体且在肿瘤细胞中该抗原暴露于肿瘤微环境的实施方案中,在身体的其它部分(例如非肿瘤微环境)中,条件活性抗体对抗原的亲和力低于野生型抗体,而在肿瘤微环境中其对抗原的亲和力高于野生型抗体。这样的条件活性抗体可以在体内其它部分与抗原弱结合或完全不结合,但在肿瘤微环境中与抗原更好地结合或与抗原强力紧密地结合。在一些实施方案中,条件活性抗体是针对免疫检查点蛋白的抗体,导致对免疫检查点的抑制。此类条件活性抗体具有以下特性的至少一种:(1)与作为条件活性抗体来源的野生型抗体相比,在肿瘤微环境中其对免疫检查点蛋白的结合亲和力增强,和(2)与作为条件活性抗体的来源的野生型抗体相比,在非肿瘤微环境中对免疫检查点蛋白的结合亲和力降低。免疫检查点用作免疫系统的内源抑制途径以维持自身耐受性并调节对抗原刺激(即外源分子、细胞和组织)的免疫应答的持续时间和程度。参见Pardoll,NatureReviewsCancer,第12卷,第252-264页,2012。通过抑制一个或多个检查点蛋白抑制免疫检查点可以引起免疫系统(特别是T细胞)的超活化,从而诱导免疫系统攻击肿瘤。适用于本发明的检查点蛋白包括CTLA4及其配体CD80和CD86、PD1及其配体PDL1和PDL2、T细胞免疫球蛋白和粘蛋白蛋白-3(TIM3)及其配体GAL9、B和T淋巴细胞衰减子(BTLA)及其配体HVEM(疱疹病毒进入介质)、受体如杀伤细胞免疫球蛋白样受体(KIR)、淋巴细胞活化基因-3(LAG3)和腺苷A2a受体(A2aR)、以及配体B7-H3和B7-H4。其它合适的免疫检查点蛋白描述于Pardoll,NatureReviewsCancer,第12卷,第252-264页,2012andNirschl&Drake,ClinCancerRes,第19卷,第4917-4924页,2013,其公开内容通过引用并入本文。CTLA-4和PD1是两个最知名的免疫检查点蛋白。CTLA-4可以下调T细胞活化的途径(Fongetal.,CancerRes.69(2):609-615,2009;andWeber,CancerImmunol.Immunother,58:823-830,2009)。阻滞CTLA-4已被证明增强T细胞活化和增殖。CTLA-4的抑制剂包括抗CTLA-4抗体。抗CTLA-4抗体结合CTLA-4并阻断CTLA-4与其配体CD80或CD86的相互作用,从而阻断由CTLA-4与其配体的相互作用引发的免疫应答的下调。已知检查点蛋白PD1在对感染产生炎症反应时抑制外周组织中T细胞的活性并限制自身免疫。响应于特异性抗原靶标或同种异体细胞在混合淋巴细胞反应中的刺激,体外PD1阻滞可以增强T细胞增殖和细胞因子产生。已证明PD1表达和降低的免疫应答之间的强相关性是由PD1的抑制功能引起,即通过诱导免疫检查点(Pardoll,NatureReviewsCancer,12:252-264,2012)。PD1阻滞可以通过多种机制实现,包括结合PD1或其配体PDL1或PDL2的抗体。过去的研究已经发现了针对几个检查点蛋白(CTLA4、PD1、PD-L1)的抗体。这些抗体通过抑制免疫检查点从而超激活免疫系统(特别是T细胞)用于攻击肿瘤,从而有效治疗肿瘤(超激活免疫系统)。然而,超激活的T细胞也可以攻击宿主细胞和/或组织,导致对患者身体的附带损伤。因此,基于使用这些已知抗体来抑制免疫检查点的治疗是难以控制的,并且对患者的风险也是一个严重的问题。例如,FDA批准的针对CTLA-4的抗体由于其高毒性而带有黑盒警告。本发明通过提供针对免疫检查点蛋白的条件活性抗体解决了超激活T细胞的附带损伤的问题。这些条件活性抗体优先激活肿瘤微环境中的免疫检查点。同时,条件活性抗体不抑制或较少抑制在非肿瘤微环境(例如,正常身体组织)中的免疫检查点,使得在非肿瘤微环境中减少对身体造成附带损伤的可能性。这个目标是通过将条件活性抗体工程化为在肿瘤微环境中比在非肿瘤微环境中更活跃来实现的。在一些实施方案中,针对免疫检查点蛋白的条件活性抗体在肿瘤微环境中与免疫检查点蛋白的结合活性与在非肿瘤微环境中与相同免疫检查点蛋白的结合活性的比例至少为约1.1,或至少约1.2,或至少约1.4,或至少约1.6,或至少约1.8,或至少约2,或至少约2.5,或至少约3,或至少约5,或至少约7,或至少约8,或至少约9,或至少约10,或至少约15,或至少约20。测量抗体的结合活性的典型测定法为ELISA测定。高度致免疫肿瘤(例如恶性黑素瘤)最易受到通过免疫系统操作获得的超激活免疫系统的攻击。因此,针对免疫检查点蛋白的条件活性抗体可能对于治疗这种高度致免疫肿瘤特别有效。然而,其他类型的肿瘤也易受超激活免疫系统的攻击。在一些实施方案中,针对免疫检查点蛋白的条件活性抗体可以用于联合疗法。例如,联合疗法可包括针对肿瘤细胞表面分子(肿瘤特异性抗原)的条件活性抗体和针对免疫检查点蛋白的条件活性抗体。在一个实施方案中,条件活性抗体对肿瘤细胞表面分子的结合活性和条件活性抗体对免疫检查点蛋白的结合活性可存在于单个蛋白,即本文公开的双特异性条件活性抗体中。在一些另外的实施方案中,联合疗法可以包括针对肿瘤细胞表面分子(肿瘤特异性抗原)的条件活性抗体和针对两种或更多种不同免疫检查点蛋白的两种或更多种条件活性抗体。在一个实施方案中,所有这些结合活性可以存在于单个蛋白,即本文公开的多特异性抗体中。因为条件活性抗体在肿瘤微环境中的活性比针对相同肿瘤细胞表面分子或检查点蛋白的、作为条件活性抗体来源的野生型抗体的活性更高,所以这些联合疗法可提供增强的功效和显著降低的毒性。这些条件活性抗体(特别是针对免疫检查点蛋白的抗体)的降低的毒性能够使有效抗体例如本文所述的ADC抗体以及更高剂量的抗体得以安全使用。在一些实施方案中,针对检查点蛋白的条件活性抗体可以是前药形式。例如,条件活性抗体可以是在被切割并变成药物形式之前没有所需药物活性的前药。或者因为催化这种切割的酶优先存在于肿瘤微环境中或者因为条件活性抗体使得切割位点在肿瘤微环境中较在非肿瘤微环境中的切割位点更容易接近,前药可以优先在肿瘤微环境中被切割。用于包括肿瘤干细胞在内的干细胞龛的工程化条件活性生物蛋白干细胞存在于体内称为干细胞龛的环境中,其构成组织生理学的基本单位,整合介导干细胞对生物体需要的反应的信号。然而,龛还可以通过对干细胞或其他靶标施加异常功能来诱导病理。干细胞和它们的龛之间的相互作用产生了维持组织所需的以及干细胞疗法的最终设计所需的动态系统(Scadden,“Thestem-cellnicheasanentityofaction,”Nature,第441卷,第1075-1079页,2006)。脊椎动物中的常见干细胞龛包括生殖系干细胞龛、造血干细胞龛、毛囊干细胞龛、肠干细胞龛和心血管干细胞龛。干细胞龛是不同于身体其他部分(例如血浆)的专用环境(Drummond-Barbosa,“StemCells,TheirNichesandtheSystemicEnvironment:AnAgingNetwork,”Genetics,第180卷,第1787–1797页,2008;Fuchs,“SocializingwiththeNeighbors:StemCellsandTheirNiche,”Cell,第116卷,第769–77页8,2004)。干细胞龛是缺氧的,其中氧化性DNA损伤减少。氧水平的直接测量已经显示,与血浆相比骨髓通常是相当缺氧的(~1%-2%O2)(Keithetal.,“Hypoxia-InducibleFactors,StemCells,andCancer,”Cell,第129卷,第465–472页,2007;Mohyeldinetal.,“OxygeninStemCellBiology:ACriticalComponentoftheStemCellNiche,”CellStemCell,第7卷,第150–161页,2010)。此外,干细胞龛需要具有几种其他因素来调节龛内的干细胞特征:细胞外基质组分、生长因子、细胞因子和环境的物理化学性质的因素,包括pH、离子强度(例如Ca2+浓度)和代谢物。因此,干细胞龛具有不同于身体其他部分的生理条件(例如血浆中的生理条件)的至少几种生理条件。干细胞龛具有比身体的其他部分(特别是血浆)更低的氧浓度(1-2%)。干细胞龛的包括pH和离子强度在内的其它生理条件也可以不同于身体的其他部分。干细胞疗法是将新的成体干细胞引入受损组织以便治疗疾病或损伤的介入策略。这种策略取决于干细胞的自我更新和随后产生具有不同程度分化能力的后代的能力。干细胞疗法提供了组织再生的巨大潜力,而再生的组织可以潜在地代替身体中的患病和受损区域,具有最小的排斥和副作用的风险。因此,将药物(生物学蛋白(例如抗体)或化学化合物)递送至干细胞龛以影响干细胞的更新和分化是干细胞疗法的重要部分。存在关于干细胞龛如何影响哺乳动物中干细胞的更新和/或分化的若干实例。第一种是在皮肤中,其中已知β-1整联蛋白在原发细胞上差异表达,并通过与基质糖蛋白配体的相互作用参与干细胞群体的约束定位。第二,在神经系统中,腱生蛋白C的缺失改变了脑室下区的神经干细胞数量和功能。腱生蛋白C似乎调节干细胞对成纤维细胞生长因子2(FGF2)和骨形态发生蛋白4(BMP4)的敏感性,导致干细胞倾向增加。第三,另一种基质蛋白,即含Arg-Gly-Asp的唾液酸蛋白(骨桥蛋白(OPN))现在已被证明有助于造血干细胞调节。OPN与已知在造血干细胞、CD44和α4和α5β1整联蛋白上的几种受体相互作用。OPN的产生变化明显,特别是在成骨细胞激活的情况下。因为OPN的缺乏导致刺激条件下的超生理性干细胞扩增,所以缺乏OPN的动物具有增加的HS细胞数。因此,OPN似乎作为对造血干细胞数量的约束条件,限制了在稳态条件下或具有刺激的条件下的干细胞的数量。参见Scadden,“Thestem-cellnicheasanentityofaction,”Nature,第441卷,第1075-1079页,2006。Xieetal.“Autocrinesignalingbasedselectionofcombinatorialantibodiesthattransdifferentiatehumanstemcells,”ProcNatlAcadSciUSA,第110卷,第8099-8104页,2013公开了使用抗体影响干细胞分化的方法。该抗体是粒细胞集落刺激因子受体的激动剂。与激活细胞沿着预定途径分化的天然粒细胞集落刺激因子不同,分离的激动剂抗体将人类髓系CD34+骨髓细胞转分化为神经祖细胞。Melidonietal.(“Selectingantagonisticantibodiesthatcontroldifferentiationthroughinducibleexpressioninembryonicstemcells,”ProcNatlAcadSciUSA,第110卷,第17802–17807页,2013)还公开了使用抗体干扰FGF4与其受体FGFR1β之间的相互作用,因此阻断自分泌FGF4介导的胚胎干细胞分化。对干细胞分化中配体/受体功能的了解使得能够实现应用生物蛋白干扰这些配体/受体以调节或甚至指导干细胞分化的策略。通过将抗体施用到干细胞龛中控制未经基因修饰的人干细胞的分化的能力可以为基于干细胞的治疗剂提供新的离体或体内方法。在一些实施方案中,本发明提供了由野生型生物蛋白产生的条件活性生物蛋白,其能够进入包括癌干细胞的干细胞龛以调节干细胞或肿瘤发展。条件活性生物蛋白在身体其他部分的至少一种生理条件下较野生型生物蛋白具有更低的活性,而在干细胞龛的至少一种生理条件(例如癌症干细胞环境)下较野生型生物蛋白具有更高的活性。这种条件活性生物蛋白不太可能引起副作用,并且优先作用于干细胞龛以调节干细胞的更新和分化。在一些实施方案中,条件活性生物蛋白为抗体。这样的条件活性抗体可以与身体的其它部分的抗原弱结合或完全不结合,但是与干细胞龛中的抗原牢固且紧密结合。本发明的用于滑液、肿瘤微环境和干细胞龛的条件活性蛋白是通过演变编码野生型生物蛋白的DNA以产生突变DNA文库的方法产生的。然后表达突变DNA文库以获得突变蛋白。对突变蛋白进行筛选以获得具有以下特性的条件活性生物蛋白:在选自滑液、肿瘤微环境和干细胞龛的身体第一部分的至少一种生理条件下,其具有比野生型生物蛋白更高的活性,并且在不同于身体第一部分的身体第二部分的至少一种生理条件下,具有比野生型生物蛋白更低的活性。身体第二部分可以是血浆。这种选择的突变生物蛋白是条件活性生物蛋白,其在身体第一部分具有高活性,而在身体第二部分具有低活性。这种条件活性生物蛋白在降低野生型蛋白的副作用方面是有利的,因为条件活性生物蛋白在其不打算作用的身体其他部分具有较低的活性。例如,如果条件活性生物蛋白被有目的地引入肿瘤微环境,则条件活性生物蛋白在除了肿瘤微环境以外的身体部分具有低活性的事实意味着,这样的条件活性生物蛋白不太可能干扰除了肿瘤微环境之外的身体部分的正常生理功能。同时,条件活性生物蛋白在肿瘤微环境中具有高活性,这使得条件活性生物蛋白在治疗肿瘤方面具有更高的疗效。由于副作用降低,与野生型生物蛋白相比,条件活性生物蛋白将允许安全使用显著更高剂量的蛋白。这对于针对细胞因子或生长因子的抗体是特别有益的,因为针对细胞因子或生长因子的抗体可能干扰身体其他部分中细胞因子或生长因子的正常生理功能。通过使用具有降低的副作用的条件活性生物蛋白,可以使用更高的剂量以实现更高的功效。用于在滑液、肿瘤微环境或干细胞龛之一中起作用的条件活性生物蛋白还使得能够使用新的药物靶标。使用传统的生物蛋白作为治疗剂可能导致不可接受的副作用。例如,表皮生长因子受体(EGFR)的抑制可以非常有效地抑制肿瘤生长。然而,抑制EGFR的药物也会抑制皮肤和胃肠(GI)道的生长。副作用使得EGFR不适合作为肿瘤药物靶标。使用仅在肿瘤微环境中以高亲和力结合EGFR但在体内任何其他部分不具有或具有非常低的亲和力的条件活性抗体将显著降低副作用,并同时抑制肿瘤生长。在这种情况下,EGFR可以通过使用条件活性抗体成为有效的新的肿瘤药物靶标。在另一个实例中,抑制细胞因子通常有益于修复关节损伤。然而,抑制体内其他部分的细胞因子也可能抑制身体的免疫应答,引起免疫缺陷。因此,滑液中的细胞因子不是开发用于治疗关节损伤的传统抗体药物的理想靶标。然而,通过使用优先结合滑液中的细胞因子同时不结合或仅弱结合体内其他部分中的相同细胞因子的条件活性抗体,可以显著降低免疫缺陷的副作用。因此,滑液中的细胞因子可能成为使用条件活性抗体修复关节损伤的合适靶标。具有条件活性生物蛋白的工程化病毒颗粒病毒颗粒长期以来被用作用于将蛋白、核酸分子、化学化合物或放射性同位素转运到靶细胞或组织的递送载体。通常用作递送载体的病毒颗粒包括逆转录酶病毒、腺病毒、慢病毒、疱疹病毒和腺相关病毒。通常在配体-受体结合系统中,病毒颗粒通过表面蛋白识别它们的靶细胞,所述表面蛋白作为识别蛋白用于特异性结合到作为靶细胞的靶蛋白的细胞蛋白(Lentz,“Thereognitioneventbetweenvirusandhostcellreceptor:atargetforantiviralagents,”J.ofGen.Virol.,第71卷,第751-765页,1990,通过引用并入本文)。例如,病毒识别蛋白可以是靶细胞上的受体的配体。配体和受体之间的特异性允许病毒颗粒特异性识别并将其内容物递送至靶细胞。从野生型病毒开发人工病毒颗粒的技术是本领域技术人员公知的。作为递送载体的已知人工病毒颗粒包括基于逆转录病毒的人工病毒颗粒(参见例如WO90/07936;WO94/03622;WO93/25698;WO93/25234;美国专利号5,219,740;WO93/11230;WO93/10218;美国专利号4,777,127;英国专利号2,200,651;EP0345242;andWO91/02805)甲病毒(例如,辛德毕斯(Sindbis)病毒载体、塞姆利基(Semliki)森林病毒(ATCCVR-67;ATCCVR-1247)、罗斯河病毒(ATCCVR-373;ATCCVR-1246)、委内瑞拉马脑炎病毒(ATCCVR-923;ATCCVR-1250;ATCCVR1249;ATCCVR-532))和腺相关病毒(参见例如WO94/12649,WO93/03769;WO93/19191;WO94/28938;WO95/11984和WO95/00655)。通常,通过将外源识别蛋白插入病毒颗粒中来构建人工病毒颗粒,该外源识别蛋白通常通过重组技术代替天然识别蛋白。外来识别蛋白可以是例如抗体、受体、配体或胶原结合结构域。本发明提供条件活性识别蛋白,其在正常生理条件下没有与细胞结合的活性或活性较低,并且在异常条件下具有与细胞结合的活性或活性较高。因此条件活性识别蛋白可以基于患病组织和/或患病部位处异常条件的存在优先结合该部位的靶细胞,并避免或仅最低限度地结合存在正常生理条件的正常组织的细胞。条件活性识别蛋白可被表达并在病毒颗粒的表面上展示。在一些实施方案中,本发明提供了一种演变野生型识别蛋白和筛选条件活性识别蛋白的方法。条件活性识别蛋白在正常生理条件下比野生型识别蛋白具有更低的结合细胞的活性,并且在异常条件下比野生型识别蛋白具有更高的结合细胞的活性。这种条件活性识别蛋白可以通过公知的重组技术插入病毒颗粒中以产生条件活性病毒颗粒。在另一个实施方案中,本发明提供了包含条件活性识别蛋白的条件活性病毒颗粒,条件活性识别蛋白使得条件活性病毒颗粒识别并结合患病组织的或位于患病部位的靶细胞,而不识别和结合正常组织细胞。这种条件活性病毒颗粒可优先将病毒颗粒内的治疗剂递送到患病组织或患病部位,而条件活性病毒颗粒较少递送或不递送治疗剂到正常组织的细胞。在一些实施方案中,与健康的或不患有特定疾病或疾病状态的身体其他部分中的pH或温度相比,患病部位的靶细胞处于具有异常pH(例如,pH6.5)或异常温度的区域或微环境内。在该实施方案中,正常生理pH或温度下,条件活性识别蛋白在与靶细胞的靶蛋白结合方面比野生型识别蛋白的活性更低,并且在异常pH或温度下在与靶细胞的靶蛋白结合方面比野生型识别蛋白的活性更高。以这种方式,识别蛋白将在遭遇异常pH或温度的部位优先结合,由此将治疗剂递送到患病部位。在一个实施方案中,病毒颗粒可以包含本发明的条件活性抗体,特别是抗体的可变区(例如Fab、Fab'、Fv)。这种条件活性抗体可以在正常生理条件下以低于野生型抗体的亲和力结合靶细胞的靶蛋白(作为抗原),所述正常生理条件可在具有正常组织的位置处遇到,并且在异常生理条件下以高于野生型抗体的亲和力结合靶细胞的靶蛋白,所述异常生理条件可在患病部位或患病组织中遇到。可以根据本发明的方法由野生型抗体衍生条件活性抗体。在一个实施方案中,靶细胞上的靶蛋白包括在例如许多肿瘤中的细胞表面上过表达的酪氨酸激酶生长因子受体。示例性的酪氨酸激酶生长因子为VEGF受体、FGF受体、PDGF受体、IGF受体、EGF受体、TGF-α受体、TGF-β受体、HB-EGF受体、ErbB2受体、ErbB3受体和ErbB4受体。工程化条件活性DNA/RNA修饰蛋白已经发现DNA/RNA修饰蛋白作为新的基因组工程化工具的形式,特别是称为CRISPR的一种形式,其可以允许研究人员对基因进行显微手术,精确地并且容易地在染色体上的精确位置改变DNA序列(genomeediting,Malietal.,"Cas9asaversatiletoolforengineeringbiology,"NatureMethods,第10卷,第957-963页,2013)。例如,镰状细胞性贫血由单碱基突变引起,其可能通过使用DNA/RNA修饰蛋白被校正。该技术可以甚至通过改变单个碱基对精确地删除或编辑染色体的位,(Makarovaetal.,“EvolutionandclassificationoftheCRISPR–Cassystems,”NatureReviewsMicrobiology,第9卷,第467-477页,2011)。用CRISPR进行的基因组编辑能够快速并同时对细胞进行多种基因改变。包括心脏病、糖尿病和神经疾病在内的许多人类疾病受到多个基因突变的影响。这种基于CRISPR的技术具有逆转引起疾病的突变和治疗这些疾病或至少降低这些疾病的严重性的潜力。基因组编辑依赖于用于切割基因组DNA的CRISPR相关(Cas)蛋白(酶家族)。通常,Cas蛋白由小的导向RNA引导至基因组中的靶区域,其中RNA与靶区域匹配。因为Cas蛋白具有很少的序列特异性或没有序列特异性,所以导向RNA充当Cas蛋白的指针以实现精确的基因组编辑。在一个实施方案中,一种Cas蛋白可与多种导向RNA一起使用以同时校正多种基因突变。存在许多Cas蛋白。实例包括Cas1、Cas2、Cas3'、Cas3”、Cas4、Cas5、Cas6、Cas6e、Cas6f、Cas7、Cas8a1、Cas8a2、Cas8b、Cas8c、Cas9、Cas10、Cas10d、Csy1、Csy2、Csy3、Cse1、Cse2、Csc1、Csc2、Csa5、Csn2、Csm2、Csm3、Csm4、Csm5、Csm6、Cmr1、Cmr3、Cmr4、Cmr5、Cmr6、Csb1、Csb2、Csb3、Csx17、Csx14、Csx10、Csx16、CsaX、Csx3、Csx1、Csx15、Csf1、Csf2、Csf3和Csf4(Makarovaetal.,“EvolutionandclassificationoftheCRISPR–Cassystems,”NatureReviewsMicrobiology,第9卷,第467-477页,2011)。为了进行基因组编辑,Cas蛋白必须进入靶细胞。受试者中的细胞可以在细胞内部具有不同的细胞内pH。患病组织中的一些细胞具有异常的细胞内pH。例如,一些肿瘤细胞往往具有约7.12-7.65的碱性细胞内pH,而正常组织中的细胞具有在6.99-7.20范围内的中性细胞内pH(参见Cardoneetal.,“TheroleofdisturbedpHdynamicsandtheNa(+)/H(+)exchangerinmetatasis,”Nat.Rev.Cancer,第5卷,第786-795页,2005)。在慢性缺氧中,患病组织中的细胞具有约7.2-7.5的细胞内pH,也高于正常组织的细胞内pH(Riosetal.,“ChronichypoxiaelevatesintracellularpHandactivatesNa+/H+exchangeinpulmonaryarterialsmoothmusclecells,”AmericanJournalofPhysiology-LungCellularandMolecularPhysiology,第289卷,第L867-L874页,2005)。此外,在缺血细胞中,细胞内pH通常在6.55-6.65的范围内,其低于正常组织的细胞内pH(Haqberg,“IntracellularpHduringischemiainskeletalmuscle:relationshiptomembranepotential,extracellularpH,tissuelacticacidandATP,”PflugersArch.,第404卷,第342-347页,1985)。在Han等人的“FluorescentIndicatorsforIntracellularpH,”ChemRev.,第110卷,第2709-2728页,2010中讨论了患病组织中异常细胞内pH的更多实例。本发明提供了一种从野生型Cas蛋白产生条件活性Cas蛋白的方法,其中条件活性Cas蛋白具有以下特性的至少一种:(1)在正常细胞内的正常生理条件下,相对于野生型Cas蛋白具有降低的酶活性,和(2)在靶细胞(例如上述的一种疾病细胞)内的异常条件下,相对于野生型Cas蛋白具有提高的酶活性。在一些实施方案中,正常生理条件为约中性的细胞内pH,异常条件为高于或低于中性的不同的细胞内pH。在一个实施方案中,异常条件是细胞内pH为7.2-7.65或细胞内pH为6.5-6.8。在一些实施方案中,可以使用本发明的条件活性病毒颗粒将条件活性Cas蛋白递送至靶细胞。条件活性病毒颗粒包含条件活性Cas蛋白和至少一个导向RNA,该导向RNA用于将Cas蛋白引导至Cas蛋白将要编辑的基因组DNA的位置。工程化条件活性抗体的Fc区可结晶片段区(Fc区)是抗体的尾部区域,其与称为Fc受体的细胞表面受体和补体系统的一些蛋白相互作用。不同于对每种抗原有特异性的Fab区,一个种类的所有抗体的Fc区对于每个物种都是相同的,而不管抗体结合哪种抗原。Fc受体是蛋白的免疫球蛋白基因超家族的成员。在免疫系统中的许多细胞上发现Fc受体,包括吞噬细胞(如巨噬细胞和单核细胞)、粒细胞(如嗜中性粒细胞和嗜酸性粒细胞)以及先天免疫系统(自然杀伤细胞)或适应性免疫系统(例如B细胞)的淋巴细胞。在与抗体结合后,Fc受体激活这些细胞并允许这些细胞鉴定和消除结合在抗体的Fab区上的抗原(例如微生物病原体)。Fc受体介导的杀伤机制包括补体依赖性细胞毒性(CDC)、抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP)。在一些实施方案中,Fc区被工程化以在Fc区中引入诸如氨基酸取代的突变。Fc区中的这种取代可以增加突变抗体在血清中的半衰期。例如,IgG抗体的半衰期与其对新生受体FcRn的pH依赖性地结合相关,所述新生受体FcRn在内皮细胞的表面上表达,并以pH依赖性方式保护IgG免于降解。在Fc区的几个氨基酸取代,例如T250Q/M428L和M252Y/S254T/T256E+H433K/N434F已显示抗体对FcRn的结合亲和力增加,并可用于延长抗体的半衰期。还可以将氨基酸取代引入Fc区以改变效应子功能。例如,IgG类中的人抗体以不同的亲和力结合Fcγ受体(FcγRI、FcγRIIa、FcγRIIIa)、抑制性FcγRIIb受体和补体(C1q)的第一成分,在这些不同抗体之间产生非常不同的效应子功能抗体。IgG抗体与FcγR或C1q的结合取决于位于抗体的铰链结构域和CH2结构域中的残基。人抗体IgG1或IgG2残基233-236处和抗体IgG4残基327、330和331处的氨基酸取代可以大大降低ADCC和CDC。此外,在Fc区中不同位置(包括K322)的丙氨酸置换显著降低了补体激活。在美国专利号8,362,210中描述了工程化Fc区的更多实例,该文献全部内容通过引用并入本文。在一些实施方案中,抗体的Fc区可以被工程化以能够识别抗原(US2010/0256340,通过引用并入本文)。至少一个,优选两个额外的Fab片段可以连接到抗体的Fc区上。在一些实施方案中,额外的Fab片段是条件活性的。例如,设计用于穿过血脑屏障(BBB)的本发明的抗体可以含有这种额外的Fab片段,该额外的Fab片段对血浆侧上的BBB-R具有低亲和力并且对脑侧上的BBB-R没有亲和力。抗体还可以结合多种脑抗原,因此具有优先作用于存在这些抗原的部位的较高选择性。本发明提供至少一种组合物,其包括(a)条件活性生物蛋白;和(b)合适的载体或稀释剂。本发明还提供至少一种组合物,其包括(a)由本文所述的核酸编码的条件活性生物蛋白;和(b)合适的载体或稀释剂。所述载体或稀释剂可任选为药用(根据已知)载体或稀释剂。所述组合物可任选进一步包括至少一种化合物、蛋白或组合物。条件活性生物蛋白可以是药用盐的形式。药用盐表示其在制药行业一般可以治疗性蛋白的盐形式使用,包括例如钠盐、钾盐、钙盐等,普鲁卡因、二苄胺、乙二胺、乙醇胺、泛影葡胺、牛磺酸的胺盐等,以及酸加成盐如盐酸盐、碱性氨基酸等。本发明进一步提供至少一种条件活性生物蛋白的制备方法或组合物,用于治疗有效量给药以调节或治疗至少一种在细胞、组织、器官、动物或患者中亲本分子相关疾病,和/或在相关的疾病之前、之后或期间的本领域已知的和/或描述于本文中的相关疾病。因而,本发明提供诊断或治疗细胞、组织、器官或动物中与野生型蛋白相关的疾病的方法,包括给细胞、组织、器官或动物接触或施以有效量的本发明的至少一种条件活性生物蛋白。该方法可任选进一步包括用有效量的本发明的0.001-50mg/kg的条件活性生物蛋白作用于细胞、组织、器官或动物。该方法可任选进一步包括采用至少选自下列模式中的一种接触或给药:肠外、皮下、肌肉、静脉、关节内、支气管内、腹腔内、囊内、软骨内、腔内、体腔内、小脑内、侧脑室、结肠内、子宫颈管内、胃内、肝内、心肌内、骨内、骨盆内、心包内、腹腔、胸腔内、前列腺内、肺内、直肠内、肾内、视网膜内、椎管内、滑膜腔内、胸内、胎儿宫内、膀胱内、药丸(bolus)、阴道、直肠、口腔、舌下、鼻内或透皮吸收。该方法可任选进一步包括在条件活性生物蛋白接触或给药之前、同时或之后,给药含有有效量的至少一种选自至少一种下列可检测标记或报告因子的化合物或蛋白的至少一种组合物:TNT拮抗剂、抗风湿药、肌肉松弛剂、麻醉药、非类固醇消炎药(NSAID)、止痛药、麻醉剂、镇静剂、局部麻醉剂、神经肌肉阻断剂、抗菌剂、抗牛皮癣剂、皮质类固醇、合成代谢类固醇、促红细胞生成素、免疫接种、免疫球蛋白、免疫抑试剂、生长激素、激素替代药物、放射性药物、抗抑郁药、抗精神病药物、兴奋剂、哮喘药物、β激动剂、吸入类固醇、肾上腺素或其类似物、细胞毒性或其它抗癌药物、抗代谢药,如甲氨蝶呤或抗增殖剂。本发明进一步提供至少一种条件活性生物蛋白用于诊断至少一种细胞、组织、器官、动物或患者中野生型蛋白相关疾病的方法,和/或之前、之后或期间相关的本领域已知的和/或本文中所述的疾病。药用载体部分由所施用的特定组合物来确定,以及通过用于给药的特定方法来确定。因此,有多种适合本发明药物组合物的试剂。可施用多种载体溶液,例如,盐缓冲液等。这些溶液是无菌的且一般不含杂质。这些组合物可通过常规的众所周知的杀菌技术进行灭菌。这些组合物可含有大约生理条件所需的药用辅料,如pH调节和缓冲液、毒性调节剂等,例如,醋酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。这些试剂中的条件活性生物蛋白的浓度可以有很大的不同,主要基于液体体积、粘度、体重等,按照选定的给药模式和病人的需求进行选择。适于口服给药的试剂可包括:(a)溶液,如包被有效量的核酸悬浮于稀释剂中,如水、盐水或PEG400;(b)胶囊、袋装或片剂,各含有预定量的活性成分,如液体、固体、颗粒或明胶;(c)在合适的溶液中的悬浮剂;以及(d)合适的乳剂。本发明的用于口服给药的药物组合物和制剂,可采用本领域众所周知的适当的和合适剂量的药用载体进行配制。此类载体能够使药物以单位剂量适合病人摄入形式进行配制,如片剂、丸剂、粉剂、锭剂、胶囊、液体、糖锭、凝胶剂、糖浆、膏剂、悬浮物等。如果需要,在加入合适的其它化合物之后,口服药物制剂可配制成固体赋形剂、任选地研磨产生的混合物和加工颗粒混合物,以得到片剂或锭剂的药芯。合适的固体赋形剂为碳水化合物或蛋白填料包括,例如,糖,包括乳糖、蔗糖、甘露醇或山梨醇;来自玉米、小麦、水稻、马铃薯或其它植物的淀粉;纤维素,如甲基纤维素、羟丙基甲基纤维素或钠羧甲基纤维素;及树胶,包括阿拉伯胶和黄蓍胶;及蛋白,例如,明胶和胶原蛋白。可加入崩解剂或增溶剂,如交联聚乙烯吡咯烷酮、琼脂、褐藻酸或其盐,如海藻酸钠。片剂形式可包括一种或多种乳糖、蔗糖、甘露醇、山梨醇、磷酸钙、玉米淀粉、马铃薯淀粉、黄蓍胶、微晶纤维素、洋槐、明胶、胶体二氧化硅、交联甲羧纤维素钠、滑石粉、硬脂酸镁、硬脂酸和其它赋形剂,着色剂、填充剂、粘合剂、稀释剂、缓冲剂、滋润剂、防腐剂、调味剂、染料、崩解剂和药用载体。本发明提供含有与适于制备悬浮液的赋形剂混合的条件活性生物蛋白的悬浮液。此类赋形剂包括悬浮剂,如羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、海藻酸钠、聚乙烯吡咯烷酮、胶黄蓍胶和胶洋槐悬浮剂,及分散或润湿剂,如自然存在的磷脂(例如,卵磷脂)、环氧烷烃(alkyleneoxide)与脂肪酸的缩合产物(例如,聚氧乙烯硬脂酸)、环氧乙烷与长链脂肪醇的缩合产物(例如,十七碳乙烯-氧十六醇)、环氧乙烷与来自脂肪酸和己糖醇的部分酯的缩合产物(例如,聚氧乙烯山梨醇单油酸酯),或环氧乙烷与来自脂肪酸和己糖醇酐的部分酯的缩合产物(例如,聚氧乙烯失水山梨醇单油酸酯)。悬浮液也可包含一种或多种防腐剂,如乙基或正丙基对羟基苯,一种或多种着色剂,一种或多种调味剂和一种或多种甜味剂如蔗糖、阿斯巴甜或糖精。制剂可用于调节重量摩尔渗透压浓度。锭剂形式可包括有风味的活性成分,通常是蔗糖和阿拉伯胶或黄蓍胶,以及含有在惰性基质如明胶和甘油或蔗糖和阿拉伯胶乳液、凝胶等中的锭剂,除了活性成分之外,还含有本领域已知的载体。已知当口服给药条件活性生物蛋白时,必须使其免于消化。这一般是通过将条件活性生物蛋白与可使其抵抗酸或酶的水解的组合物混合或将条件活性生物蛋白包被于合适的抵抗载体如脂质体中而实现的。使蛋白免于消化的方法是本领域众所周知的。药物组合物可被封装,例如,在脂质体中,或在制剂中,使活性成分缓慢释放。包被的条件活性生物蛋白,单独或与其它合适的成分组合可制备气雾剂(例如,它们可被“雾化”),通过吸入给药。气雾剂可被放入加压的可接受的推进剂中,如二氯二氟甲烷、丙烷、氮等。适合的直肠给药试剂包括,例如,由栓剂基体包被的核酸组成的栓剂。适合的栓剂基体包括天然或人工合成的甘油三酸脂或石蜡烃。此外,也有可能使用由基质包被的核酸的组合组成的明胶直肠胶囊,所述基质包括,例如液体甘油三酸脂、聚乙二醇和石蜡烃。本发明的皮肤或局部给药组合物可包括,除了条件活性生物蛋白之外,在乳膏、软膏、溶液或水凝胶制剂中的药用载体和其它化合物,只要添加的成分不影响治疗性蛋白的给药。也可加入常规的药用乳化剂、表面活性剂、助悬剂、抗氧化剂、渗透促进剂、填料、稀释剂和防腐剂。水溶性聚合物也可用作载体。适合肠外给药的制剂,例如,通过关节内(关节中)、静脉、肌肉、皮内、腹膜内,及皮下途径,包括水性和非水性的等渗无菌注射液,它可包含抗氧化剂、缓冲液、硫双二氯酚和使制剂与接受的血液等渗的溶质,以及水性和非水性的无菌悬浮液,其可包括悬剂、增溶剂、增稠剂、稳定剂和防腐剂。在本发明的操作中,组合物可通过,例如静脉输液、口服、外用、腹膜内、膀胱内或鞘内给药。在一个方面,肠外给药模式是优选的含有条件活性生物蛋白的组合物给药方法。所述组合物可方便地以单位剂量形式给药并可通过制药领域任何众所周知的方法来制备,例如,描述于“Remington药物科学(Remington'sPharmaceuticalSciences)”,MackPublishingCo.EastonPa.,18thEd.,1990。静脉给药制剂可含有药用载体如无菌水或盐水,聚烷撑二醇如聚乙二醇、植物油、氢化萘等。还可参见和修改美国专利号4318905中的描述。含有条件活性生物蛋白的包被的组合物制剂可存在于单剂量或多剂量密封容器中,如安瓶和小瓶。注射液和悬浮液可由前面描述的无菌粉末、颗粒和片剂制备得到。本发明还提供至少一种条件活性生物蛋白组合物、装置和/或根据本发明用于诊断至少一种野生型蛋白相关疾病的给药方法。本发明还提供含有至少一种条件活性生物蛋白和至少一种药用载体或稀释剂的组合物。所述组合物可任选进一步包括有效量的至少一种选自至少一种可检测标记或报告因子的化合物或蛋白,细胞毒性或其它抗癌药物,抗代谢药如甲氨蝶呤,抗增殖剂,细胞因子或细胞因子拮抗剂,TNF拮抗剂,抗风湿药,肌肉松弛剂,麻醉剂,非类固醇消炎药(NSAID),镇痛药,麻醉剂,镇静剂,局部麻醉剂,神经肌肉阻滞剂,抗菌剂,抗牛皮癣剂,皮质类固醇,合成代谢类固醇,促红细胞生成素,免疫接种,免疫球蛋白,免疫抑试剂,生长激素,激素替代药物,放射性药物,抗抑郁药,抗精神病药物,兴奋剂,哮喘药物,β-受体激动剂,吸入类固醇,肾上腺素或类似物。本发明还提供含有至少一种本发明的条件活性生物蛋白的医疗装置,其中所述装置适于接触或给药至少一种条件活性生物蛋白,通过至少一种选自下组的模式:肠外、皮下、肌肉、静脉、关节内、支气管内、腹腔内、囊内、软骨内、腔内、体腔内、小脑内、脑室内、结肠内、子宫颈管内、胃内、肝内、心肌内、骨内、骨盆内、心包内、腹膜内、胸膜内、前列腺内、肺内、直肠内、肾内、视网膜内、椎管内、滑膜内、胸内、胎儿宫内、膀胱内、药丸、阴道、直肠、口腔、舌下、鼻内或透皮吸收。在另一个方面,本发明提供一种试剂盒,其含有在第一容器中的至少一种本发明的条件活性生物蛋白或其片段的冻干形式,以及任选的第二容器,其含有无菌水、无菌缓冲液或至少一种选自下组的防腐剂:苯酚、间甲酚、对甲酚、邻甲酚、氯甲酚、苯甲醇、苯基亚硝酸盐、苯氧乙醇、甲醛、三氯叔丁醇、氯化镁、烷基尼泊金酯(alkylparaben)、苯扎氯铵、苯乙铵氯、钠脱氢和硫柳汞或它们在稀释剂水溶液中的混合物。在一个方面,试剂盒中第一容器中的条件活性生物蛋白或特定部分或变体的浓度与第二容器的成分重组(reconstituted)为浓度约0.1mg/ml至约500mg/ml。在另一个方面,第二容器进一步包括等渗剂。在另一个方面,第二容器进一步包括生理可接受的缓冲液。在一个方面,本发明提供治疗至少一种野生型蛋白介导的疾病的方法,包括对有需求的患者施以试剂盒中的制剂,在给药前重配制。本发明还提供用于人类药用或诊断用的制造商的说明,包括包被材料和含有溶液或至少一种本发明的条件活性生物蛋白的冻干形式的容器。制造商的说明可任选包括具有容器作为以下给药途径的装置或系统的组件,所述给药途径为:肠外、皮下、肌肉、静脉、关节内、支气管内、腹腔内、囊内、软骨内、腔内、体腔内、小脑内、脑室内、结肠内、子宫颈管内、胃内、肝内、心肌内、骨内、骨盆内、心包内、腹膜内、胸膜内、前列腺内、肺内、直肠内、肾内、视网膜内、椎管内、滑膜内、胸内、胎儿宫内、膀胱内、药丸、阴道、直肠、口腔、舌下、鼻内或透皮吸收。因为在免疫系统和中枢神经系统之间存在直接联系,本发明的条件活性生物蛋白还可用于脑疾病或其它中枢神经系统疾病(Louveauetal.,“Structuralandfunctionalfeaturesofcentralnervoussystemlymphaticvessels,”Nature,第523卷,pp.337-341,2015,由此通过引用整体并入本文)。直接连接由在硬脑膜窦内衬的功能性淋巴管组成。通过这种直接连接,条件活性生物蛋白(特别是条件活性抗体)可能能够进入中枢神经系统并作用于其中的靶标。本发明还提供了本文所述的任何公开内容。以下实施例是说明性的,但对本发明的方法不具有限制性。在本领域中通常遇到的并且对于本领域技术人员来说显而易见的对各种条件和参数的其它合适的修改和调整也在本发明的范围内。实施例1:用于温度突变的多壁检测(例如,96-孔检测)概述荧光底物被添加到多壁板的每一个孔中,在野生型或新的较低反应温度(例如,上述的37℃或25℃)下保持适当的时间。通过在荧光酶标仪中在适合的激发和发射光谱(例如,320nm激发/405nm发射)下测定荧光来检测荧光。测定相对荧光单位(RFU)。从野生型分子和质粒/载体转化的细胞中获得的上清液作为阳性和阴性对照。对每个样品,各反应温度下,以及阳性和阴性对照进行重复反应。在较低的温度下有活性(例如,突变体在25℃有活性),且在野生型温度下活性下降(例如,在37℃下活性下降10%、20%、30%、40%或更多),因而活性比高于或等于约1.1或以上(例如,在25℃或37℃下的活性比(25℃/37℃)高于或等于1.1或以上)的突变体,可被视为推测的主要温度敏感型苗头突变体(hit)。然后采用相同的检测方法,重新筛选这些推测的主要温度敏感型苗头突变体,以验证任何主要的苗头突变体(primaryhit)。实施例2:用于确定温度突变体活性的不同的检测方法(例如,14-mL检测)概述将确定的主要温度敏感型苗头的突变体在14ml培养试管中表达,并在野生型(例如,37℃)和较低的温度(例如,25℃)下测定它们的酶活性。按照上述多壁法表达蛋白并纯化,除了表达是在不同的形式(14ml试管)中进行,而不是多壁(96-孔板)形式。各突变体的上清液被转移至多壁板中,例如96-孔板。在指定的反应温度(野生型,较低温度)下向各管中加入荧光底物,保持所需的一段时间。野生型分子用作阳性对照,来自细胞的仅用载体转化的上清液用作阴性对照。通过在荧光酶标仪中在适合的激发和发射光谱(例如,320nm激发/405nm发射)下测定荧光来检测荧光。测定相对荧光单位(RFU)。对每个样品,各反应温度下,以及阳性和阴性对照进行重复反应。在较低温度(例如,25℃)下有活性,但在野生型(例如,37℃)下显示出活性下降至少30%或以上,因而在较低温度(例如,25℃)下与在野生型温度(例如,37℃)下的活性比等于或高于1.5的突变体,被确定为温度敏感型苗头突变体。将突变体在较低温度(例如,25℃)下的活性与野生型分子在野生型温度(例如,37℃)下的活性进行比较。如果分子较野生型分子在较低温度(例如,25℃)下的活性高,其表示为剩余活性>1,优选为2或高于2,如果突变体在野生型温度(37℃)下较野生型分子显示出总体的活性下降,可确定突变体的表型为温度敏感的突变体。实施例3:所发现的苗头突变体的进一步演变概述如果需要,由前面确定的所有或筛选的突变型产生新的组合变体库。新的文库可被设计成含有各筛选突变体的每个可能的氨基酸变体的组合,并如前述重筛得到新的苗头突变体。实施例4:温度下降后酶活性的可逆性概述通过将突变体暴露于高温下然后返回到较低温度(例如,25℃)下,可进一步检测温度敏感的演变的突变体,以确定是否酶活性在较低温度(例如,25℃)下是可逆的或不可逆的。温度敏感的突变体表达于任何需要的形式中,例如前面所述的14ml培养试管中。检测突变体在几种条件下的活性,包括野生型温度(例如,37℃)以及其它温度,随后再暴露于必须的低温(例如,25℃)。在较低温度下有活性的突变体,当温度上升或升至野生型温度时活性下降(即,在较低和较高温度下的活性比相同或高于1、1.5或2或更高),当再次降至较低温度时显示出基线(baseline)活性,被评分为“可逆型”。在较低温度下有活性的突变体,当温度上升或升高至野生型温度时显示出活性下降(即,在较低和较高温度下的活性比相同或高于1、1.5或2或更高),当温度再次下降至较低温度时显示出至少等量下降的活性,被评分为“不可逆型”。实施例5:筛选条件活性血管抑素变体的材料和方法筛选条件活性血管抑素变体的材料和方法可适用ChiandPizzo,“在胞外低pH值下血管抑素对肿瘤细胞的直接细胞毒性:依赖于细胞表面相关的ATP合酶的机制(AngiosatinisdirectlycytotoxictotumorcellsatlowextracellularpH:amechanismdependentoncellsurface-associatedATPsynthase)”,CancerRes.2006;66(2):875-882,通过参考并入于此。材料。来自于人纤溶酶原的野生型血管抑素因子1-3,可从Calbiochem(Darmstadt,德国)获得并在无菌PBS中重新配制。直接作用于有催化活性的ATP合酶β亚单位的多克隆抗体可以制备得到,牛F1ATP合酶亚单位可如前述方法进行纯化(Moser等人,“血管抑素结合人内皮细胞表面的ATP合酶(AngiostatinbindsATPsynthaseonthesurfaceofhumanendothelialcells)”,ProcNatlAcadSciUSA1999;96:2811-6;Moser等人,“内皮细胞表面的Fl-FOATP合酶在ATP合成中是有活性的并受到血管抑素的抑制(EndothelialcellsurfaceFl-FOATPsynthaseisactiveinATPsynthesisandisinhibitedbyangiostatin)”,ProcNatlAcadSciUSA;2001;98:6656-ól)。卡立泊来德(Cariporide)可溶解于无菌水中并进行无菌过滤。细胞培养。A549(来自肺癌组织的人上皮细胞株)或其它癌细胞株(DU145、LNCaP或PC-3细胞)可以从例如,ATCC获得。人脐静脉内皮细胞(HUVEC)可以从人脐静脉中分离得到,如所述(Grant等人,“在分化中的内皮细胞以基质胶诱导胸腺素h4基因(Matrigelinducesthymosinh4geneindifferentiatingendothelialcells)”,JCellSci1995;108:3685-94)。HUVEC细胞可用来作为在细胞表面表达ATP合酶的细胞系的阳性对照。细胞可培养于含有1%青霉素链霉素和10%血清替代培养基3(Sigma,St.Louis,MO)的DMEM(LifeTechnologies,Carlsbad,CA)中,以尽量减少纤溶酶原的存在。低pH(6.7)培养基可通过在5%CO2条件下减少碳酸氢钠至10mmol/L,并补充34mmol/LNaCl以保持渗透压,或在17%CO2条件下孵育22mmol/L碳酸氢钠培养基来制备。使用的低pH的方法可根据试验限制和检测而不同。流式细胞实验。为了保证ATP合酶在肿瘤细胞株的细胞表面发挥功能,可采用流式细胞实验。例如,A549细胞株可培养于不同pH培养基(10、22和44mmol/L碳酸氢钠的DMEM)中,在缺氧(0.5%O2、5%CO2,N2平衡)与常氧(21%O2、5%CO2)的条件下培养1、12、24、48和72小时。活细胞可以被阻滞,与抗β-亚单位抗体孵育,洗涤、阻滞,与羊抗兔FITC标记的二抗(SouthernBiotech,Birmingham,AL)孵育,再次洗涤,所有步骤于4℃下进行。碘化丙啶(BDBiosciences,SanJose,CA)可包含于所有样本中以区别具有受损细胞膜的细胞。10,000个细胞FITC的平均荧光强度可通过FACSCCalibur流式细胞仪(BectonDickinson,FranklinLakes,NJ)进行定量,摄入碘化丙啶的细胞可以被排除,以消除线粒体ATP合酶在CellQuest软件(BDBiosciences)中的检测。细胞表面ATP生成检测。96-孔板中的A549或1-LN细胞(每孔60,000个细胞)可加入新鲜的培养基并用血管抑素、血管抑素变体、抗β-亚单位抗体、兔抗牛血清白蛋白IgG(OrganonTeknika,WestChester,PA)、茋类化合物(piceatannol)(已知的ATP合酶F1的抑试剂作为阳性对照,Sigma)处理,或单独将培养基置于37℃,5%CO2中30分钟。然后细胞与0.05mmol/LADP孵育20秒。移走上清液,采用如(23)描述的CellTiterGlo发光检测(Promega,Madison,WI)检测产生的ATP。细胞裂解液可进行类似的分析以确定细胞内的ATP池在任何条件下无差异。可通过LuminoskanAscent(ThermoLabsystems,Helsinki,Finland)进行记录。数据是基于各独立试验的标准测定,以每个细胞ATP的摩尔数来表示。细胞增殖检测。血管抑素对癌细胞株的影响可用3-(4,5-二甲基噻唑-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑盐、内盐(innersalt)(MTS)在无血清培养基中的增殖检测来评价。在37℃,5%CO2中孵育20小时后,在存在或不存在血管抑素情况下,96-孔板的各孔中的相对细胞数可按照制造商的方案(protocol)采用Aqueous单细胞增殖检测(Promega)来测定。培养基的pH值可在5%CO2条件下通过改变碳酸氢盐浓度来调节。细胞的细胞毒性评估。为了量化细胞死亡和细胞裂解,从细胞质释放到上清液中的乳酸脱氢酶(LDH)的活性,可用细胞毒性检测试剂盒(Roche,Indianapolis,IN)进行测定。用血管抑素、血管抑素变体,抗β-亚单位抗体、兔IgG、卡立泊来德(cariporide)和TritonX(用于透化细胞的去污剂)处理的癌细胞(例如A549细胞)(每孔5,000个细胞)可分别在37℃,5%CO2或17%CO2,,中性和低pH条件下孵育15小时。细胞毒性指数可用四份处理样本的平均吸收度除以对应于相同pH培养基的四份未处理样本的平均吸收度计算得到。细胞坏死和凋亡的评价。为了确定血管抑素诱导的细胞坏死模式,可进行组蛋白-DNAELISA。血管抑素、血管抑素变体、抗β-亚单位抗体、兔IgG和卡立泊来德(cariporide)对A549细胞的影响(每孔5,000个细胞)可采用ELISA细胞凋亡和坏死检测(Roche)来确定,取决于核外组蛋白-DNA片段的检测。细胞凋亡或坏死可分别由在含或不含试剂的条件下,在37℃孵育15小时之后四份样本的细胞裂解液或上清液来确定。细胞凋亡或坏死指数可通过四份处理样本的平均吸收度除以对应于相同pH值培养基的四份未处理样本的平均吸收度来计算得到。培养基的pH值可由在5%CO2或17%CO2条件下进行孵育来调节。细胞内pH值(pHi)测定。pHi可根据带有盖玻片的35mm微孔盘(MatTek,Ashland,MA)中细胞的荧光来测定。细胞可被置于细胞生长因子减少的、不含酚红的Matrigel(BDBiosciences)中。过夜生长后,更换培养基,并向细胞中加入pH敏感的荧光染料cSNARF(MolecularProbes,Eugene,OR),15分钟后置于新鲜的培养基中20分钟恢复。然后细胞被放入37℃,5%CO2的显微镜平台(stage)上1小时,收集发射光谱,从各含7个细胞和15个细胞之间的区域中计算得到pHi(WahlML,GrantDS.“胞外pH值的微环境和胞外基质蛋白对血管抑素活性和胞内pH值的影响(EffectsofmicroenvironmentalextracellularpHandextracellularmatrixproteinsonangiostatin'sactivityandonintracellularpH)”,GenPharmacol2002;35:277-85)。在开始收集光谱时,从盘中去掉培养基,将细胞置于1mL含或不含pH抑试剂血管抑素、抗β-亚单位、兔IgG或卡立泊来德(cariporide)--一种钠氢交换抑试剂的新鲜培养基中。培养基的pH值可在如上所述固定的5%CO2条件下通过改变碳酸氢盐浓度来调节。实施例6.用于最佳抗体表达的Fc密码子变体文库的产生和筛选本实施例提供了产生Fc密码子变体文库的方法和筛选方法以获得优化的Fc变体,该变体与Fc多肽的亲本形式相比具有改善的在生产宿主细胞中的表达。Fc密码子变体文库的设计和构建对于靶区域中的每个密码子(在本例中为人IgG1分子的Fc部分),设计一对简并引物(正向和反向),其包括靶密码子和每侧20个碱基。靶密码子的第3位(摇摆位置)含有允许使用相同密码子在靶位置产生所有沉默突变的混合碱基(表2)(实施例A)。如果相应的氨基酸可以由另一个密码子编码,则设计第二组简并引物用于相同的密码子位置(实施例B)。将相应的正向和反向简并引物以1:1混合,退火至模板,并使用热稳定性DNA聚合酶通过链置换延伸至全长产物。模板用DpnI消化,将全长延伸产物转化到大肠杆菌中。对每个诱变反应的最多12个集落进行测序。将序列确认的突变体排列在96孔板中并储备于甘油中。甘油储备液用于小量制备质粒DNA,该质粒DNA用于转染入哺乳动物细胞和筛选。表2:合成寡核苷酸中简并碱基的代码符号混合碱基RA,GYC,TMA,CKG,TSC,GWA,THA,C,TBC,G,TVA,C,GDA,G,TNA,C,G,T实施例A:靶密码子=CCC(脯氨酸)→正向引物:CCD,反向引物:HGG实施例B:靶密码子=TCG(丝氨酸)→正向引物1:TCH,反向引物1:DGA→正向引物2:AGY,反向引物2:RCT未显示靶密码子侧翼的20个碱基。总引物长度:43个碱基。Fc密码子变体文库的表达和基于ELISA的筛选将来自Fc密码子变体文库的克隆转染到哺乳动物细胞系中。产生全长IgG并分泌到培养基中。使用ELISA测定对表达的Fc密码子变体的上清液进行筛选以获得高于亲本克隆的IgG表达水平。通过测量转染效率用β-半乳糖苷酶测定法归一化ELISA数据。将在初级筛选中鉴定的排名靠前的变体(tophits)重新转染并重新筛选三次以确认提高的表达水平。实施例7:scFv条件活性抗体的产生药物靶X的两种条件活性抗体(CAB-scFv-63.9-4和CAB-scFv-63.9-6)表达为具有野生型人IgG1Fc的同源二聚体(产生图2-3所示的二价抗体CAB-scFv-63.9-4-01和CAB-scFv-63.9-6-01)以及在“杵臼”体系中表达为异源二聚体,产生单价scFv(产生图2-3中的单价抗体scFvCAB-scFv-63.9-4-02和CAB-scFv-63.9-6-02)。通过ELISA测定测量这些抗体在pH6.0和pH7.4下对药物靶X的结合亲和力。如图2所示,scFv抗体在pH6.0和pH7.4下显示出对药物靶X的亲和力,这与全二价抗体相当。此外,如图3所示的这些scFv抗体在pH6.0和pH7.4下的选择性也与全二价抗体相当。该实施例证明本发明的条件活性抗体具有与scFv抗体或全二价抗体相当的亲和力和选择性。因此,本发明的条件活性抗体可以作为单个DNA链插入在本发明的CAR-T平台中编码CAR的DNA分子中。实施例8:条件活性抗体的表达根据本发明的一个实施方案,通过同时筛选在pH6.0和pH7.4下的选择性和亲和力以及表达水平产生药物靶X的条件活性抗体。使用FLAG标签在血清中进行筛选,因为在血清中存在可能导致假阳性筛选的人抗体。筛选缓冲液为碳酸盐缓冲液(具有Ringer-标准缓冲液的krebs缓冲液,但不同于PBS)。发现所产生的条件活性抗体在pH6.0下与野生型抗体相比对药物靶X具有更高的亲和力,但是在pH7.4下与野生型抗体相比对相同的药物靶X具有更低的亲和力。此外,这些条件活性抗体都具有如下表3所示的高表达水平,其中“克隆”列显示抗体,表达水平“mg/ml”显示在第二列中。将这些抗体的克隆以所要求的表达水平(“订购量(amountordered)”,预期表达水平)发送到服务提供商。然而,这些抗体的实际表达水平(“交付量”)非常高并且超过预期的表达水平。表3高表达水平的条件活性抗体克隆mg/ml订购量交付量BAP063.6-hum10F10-FLAG7150294BAP063.6-HC-H100Y-FLAG6.6150238BAP063.8-LC046HC04-FLAG7200332.5BAP063.8-LC062HC02-FLAG5.8200220.4BAP063.9-13-1-FLAG5.350123BAP063.9-29-2-FLAG4.950102BAP063.9-45-2-FLAG5.450129BAP063.9-13-3-FLAG5.950130BAP063.9-21-3-FLAG5.350117BAP063.9-21-4-FLAG750176BAP063.9-29-4-FLAG8.250196BAP063.9-48-3-FLAG750125BAP063.9-49-4-FLAG5.350126BAP063.9-61-1-FLAG5.15097BAP063.9-61-2-FLAG55092以BAP063.9-13-1抗体为例,条件活性抗体在缓冲液中不显示聚集,如图4所示。通过尺寸排阻色谱分析BAP063.9-13-1抗体。在图4中,仅检测到一个峰,表明抗体很少聚集或没有聚集。也使用表面等离子体振子共振(SPR)测定条件活性抗体以测量它们对药物靶X的结合和解离速率。已知SPR测定用于测量条件活性抗体的结合和解离速率。在碳酸氢盐存在下进行SPR测定。条件活性抗体的体内结合和解离速率(在动物和人中)是条件活性抗体的非常重要的特征。观察到,与阴性对照(BAP06310F10,其在pH6.0和pH7.4下具有相似的结合速率)相比,条件活性抗体在pH6.0下具有快的结合速率,在pH7.4下具有更慢的结合速率)(图5)。此外,将温度从室温升至60℃不会显著改变SPR测定结果(图5)。SPR测定还显示,与pH7.4相比,这些条件活性抗体在pH6.0下是高度选择性的(图6A-6B显示了一种抗体作为实例)。将条件活性生物抗体总结于表4中。所述抗体中的两种表达为scFv(BAP063.9-13.3和BAP063.9-48.3)。将抗体在60℃孵育1小时未改变大多数抗体的亲和力(“热稳定性”)。在使用SPR于pH6.0和pH7.4下测量结合活性的两列报告数据中(表4的最后两列),与“BAP063.6-hum10F10-FLAG”(阴性对照,表4第二行)进行了对比。这些抗体的选择性可以通过最后两列中的数据之间的差异来确定。两种scFv抗体具有非常高的选择性(与pH7.4下的0%相比,在pH6下的选择性为75%和50%)。实施例9:演变抗体的轻链或重链使用CPE分别演变抗体F1-10F10的重链和轻链。筛选轻链突变体以发现具有条件活性的26个轻链突变体,在这种情况下,突变体在pH6.0下比野生型更具有活性,并且突变体在pH7.4下比野生型活性低。26个轻链突变体在轻链中的8个不同位置具有突变。26个轻链突变体中的多于5个在所述8个位置中的3个位置出现突变。这3个位置被认为是轻链中的热点。筛选重链突变体以发现具有条件活性的28个重链突变体。28个重链突变体在重链的8个不同位置具有突变。28个重链突变体中的多于5个在所述8个位置中的3个位置处具有突变。这3个位置被认为是重链中的热点。通过ELISA测定来证实轻链突变体和重链突变体的条件活性。由该实施例产生的最佳条件活性抗体在pH6.0下的活性与在pH7.4下的活性具有17倍的差异。此外,许多条件活性抗体具有在正常生理pH7.4和异常pH6.0之间的pH下可逆的活性。有趣的是,当在5.0-7.4的pH范围内通过ELISA测定测试条件活性抗体的活性时,从该实施例产生的大多数条件活性抗体在约5.5-6.5的pH下表现出最佳的结合活性。通过使用全细胞的FACS(荧光激活细胞分选)测定也证实了由本实施例产生的条件活性抗体的活性,其中CHO细胞用于在pH6.0和pH7.4下表达抗体的抗原。将条件活性抗体加入CHO细胞中以测量结合活性。FACS测定证实了在用于测量条件活性抗体在pH6.0相对于pH7.4的选择性的ELISA测定的结果中的总趋势。实施例10:在特殊缓冲液中选择条件活性抗体对根据本发明通过演变步骤产生的突变抗体在正常生理pH7.4下进行测定,并在异常pH6.0下进行测定。使用包括在人血清中发现的碳酸氢盐的磷酸盐缓冲盐水(PBS)溶液进行两种测定。溶液中碳酸氢盐的浓度是人血清中碳酸氢盐的典型浓度,即生理浓度。使用不含碳酸氢盐的相同PBS溶液进行比较试验。在本实施例中测量突变型抗体或条件活性抗体的结合活性的测定法为ELISA测定法。发现在含有碳酸氢盐的PBS缓冲溶液中的测定使条件活性抗体的选择的成功率显著更高。此外,使用含有碳酸氢盐的PBS缓冲溶液选择的条件活性抗体往往具有高得多的pH6.0下的活性与pH7.4下的活性的比例,从而提供明显更高的选择性。进一步观察到,当在没有碳酸氢盐的PBS缓冲溶液中测试使用具有碳酸氢盐的PBS缓冲溶液选择的条件活性抗体时,条件活性抗体在pH6.0下的选择性相对于在pH7.0下的选择性显著降低,当将生理量的碳酸氢盐加入到该PBS缓冲溶液中时,相同的条件活性抗体的选择性得以恢复。在另一个测定中,在添加了碳酸氢盐的Krebs缓冲液中测试所选择的条件活性抗体。在该添加有碳酸氢盐的Krebs缓冲液中也观察到pH6.0下的活性与pH7.4下的活性的比例较高。看起来这可能至少部分是由于在Krebs缓冲溶液中存在碳酸氢盐。当在PBS缓冲溶液中碳酸氢盐的浓度降低至低于其生理浓度的浓度时,观察到条件活性抗体在7.4的正常生理pH下的活性增加。观察到条件活性抗体在pH7.4的活性增加与PBS缓冲溶液中碳酸氢盐浓度的降低有关。当在pH7.4下进行测定时,野生型抗体不受PBS缓冲溶液中不同的碳酸氢盐含量的影响,因为其活性在与条件活性抗体测试相同的所有PBS缓冲溶液的碳酸氢盐浓度下保持相同。实施例11:在不同缓冲液中选择条件活性抗体将根据本发明的演变步骤产生的突变抗体在正常生理pH(7.4)和异常pH(6.0)下进行ELISA测定。两种ELISA测定使用不同的缓冲液进行,包括基于Krebs缓冲液的具有牛血清白蛋白(BSA)的缓冲液和基于PBS缓冲液的具有碳酸氢盐和BSA的缓冲液。与使用在不含碳酸氢盐的PBS缓冲溶液中的测定所选择的那些条件活性抗体相比,使用在具有碳酸氢盐的PBS缓冲溶液中的测定所选择的条件活性抗体显示出高得多的pH6.0下的活性与pH7.4下的活性的比例。此外,当与不含碳酸氢盐的PBS缓冲溶液中的测定相比时,添加有碳酸氢盐的Krebs缓冲溶液也提供更高的pH6.0下的活性与pH7.4下的活性的比例。看来碳酸氢盐对于选择合适的条件活性抗体是重要的。本文提及的所有文献通过引用整体并入本文,或者提供它们特别依赖的公开内容。必须注意,如本文和所附权利要求中所使用的,单数形式“一种(a、an)”和“该(the)”包括复数指代,除非上下文另有明确规定。此外,术语“一种(a、an)”、“一个或多个”和“至少一个”在本文中可以互换使用。术语“包含”、“包括”、“具有”和“由…构成”也可以互换使用。除非另有说明,在说明书和权利要求书中使用的表示成分的量、性质如分子量、百分比、比例、反应条件等的所有数字应理解为在所有情况下由术语“约”修饰,无论术语“约”是否存在。因此,除非指出为相反,否则说明书和权利要求书中阐述的数值参数为近似值,其可以根据本发明寻求获得的期望性质而变化。至少,并且不试图将等同原理的应用限制在权利要求的范围内,每个数值参数应当至少根据所报告的有效数字的数目并通过应用普通的舍入技术来解释。尽管阐述本发明的宽范围的数值范围和参数是近似值,但是在具体实施例中我们尽可能精确地报告列出的数值。然而,任何数值必然固有地包含某些误差,该误差是由在这些数值的各自的测试测量中发现的标准偏差导致的。应当理解,本文公开的每种组分、化合物、取代基或参数应被解释为公开为单独使用或与一种或多种本文公开的每种其它组分、化合物、取代基或参数组合使用。还应理解,本文公开的每种组分、化合物、取代基或参数的每个量/值或量/值的范围被解释为也与本文公开的任何其它组分、化合物、取代基或参数的每个量/值或量/值的范围相组合公开,因此为了本说明书的目的,用于本文公开的两种或多种组分、化合物、取代基或参数的量/值或量/值范围的任何组合也彼此组合地公开。还应当理解,本文公开的每个范围应被解释为对具有相同数量的有效数字的公开范围内的每个具体值的公开。因此,1-4的范围应被解释为对值1、2、3和4的明确公开。还应当理解,本文公开的每个范围的每个下限应解释为结合对于相同的组分、化合物、取代基或参数的每个范围的每个上限和本文公开的每个范围内的每个具体值。因此,本发明被解释为对通过将每个范围的每个下限与每个范围的每个上限或每个范围内的每个具体值组合或通过将每个范围的每个上限与每个范围的每个特定值结合而得到的所有范围的公开。此外,在说明书或实施例中公开的组分、化合物、取代基或参数的具体量/值应解释为对一个范围的下限或上限的公开,因此可以与在本申请其他地方公开的针对相同组分、化合物、取代基或参数的一个范围的任何其他下限或上限或具体量/值组合以形成针对该组分、化合物、取代基或参数的范围。然而,应当理解,尽管在前面的描述中已经阐述了本发明的众多特征和优点以及本发明的结构和功能的细节,但是该公开仅是说明性的,且可以在由所附权利要求表达的、术语的宽泛一般含义所指示的全部范围内,在本发明的原理下进行详细的改变,尤其是对部件的形状、尺寸和布置进行该改变。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1