白介素2的超级激动剂、部分激动剂和拮抗剂的制作方法
背景
白介素2(IL-2)是主要由活化的CD4+T细胞产生的多能细胞因子,其在产生正常免疫应答中发挥重要的作用。IL-2促进活化的T淋巴细胞的增殖和扩增,增强B细胞生长,并且活化单核细胞和天然杀伤细胞。正是凭借这些活性,IL-2得到测试并且用作癌症的批准治疗(阿地白介素(aldesleukin),)。
在真核细胞中,人IL-2作为153个氨基酸的前体多肽合成,从所述前体多肽中去除20个氨基酸以产生成熟的分泌性IL-2(Taniguchi 1983)。重组人IL-2已在大肠埃希氏菌(E.coli)(Rosenberg 1984)、昆虫细胞(Smith 1985)和哺乳动物COS细胞(Taniguchi 1983)中产生。
白介素-2(IL-2)是首先被鉴定为T细胞生长因子的四α-螺旋束I型细胞因子(Morgan等人,Science 193:1007(1976)),但随后显示其具有广泛的作用。IL-2促进T辅助分化(Zhu等人,Annual review of immunology 28:445(2010);Liao等人,Nat Immunol 9:1288(2008);及Liao等人,Nat Immunol 12:551(2011))和调节性T(Treg)细胞的发育(Cheng等人,Immunol Rev 241:63(2011)),诱导天然杀伤和淋巴因子活化的杀伤活性(Liao等人,Immunity 38:13(2013)),并介导活化诱导的细胞死亡(AICD)(Lenardo等人,Nature 353:858(1991))。
IL-2通过与三种不同的受体相互作用起作用:白介素2受体α(IL-2Rα;CD25)、白介素2受体β(IL-2Rβ;CD122)和白介素2受体γ(IL-2Rγ;CD132;共同γ链)。待鉴定的第一种受体是IL-2Rα,其是在T细胞活化后出现的55kD多肽(p55),并且最初被称为Tac(代表T活化)抗原。IL-2Rα以约10-8M的Kd结合IL-2,并且也被称为“低亲和力”IL-2受体。IL-2与仅表达IL-2Rα的细胞的结合不导致任何可检测的生物学应答。
IL-2经由静息T细胞和NK细胞上的中间亲和力受体(Kd约10-9M)(其由IL-2Rβ和共同的细胞因子受体γ链γc(IL-2Rγ)组成)或经由活化的淋巴细胞和Treg细胞(其另外表达IL-2Rα(CD25))上的高亲和力受体(Kd约10-11M)发信号(Lenardo等人,Nature 353:858(1991);及Yuan等人,Immunol Rev 259:103(2014))。鉴于γc由IL-4、IL-7、IL-9、IL-15和IL-21的受体共享(Leonard等人,Nature Reviews Immunology 1:200(2001))并且由具有X染色体连锁性严重联合免疫缺陷的人中突变的基因编码(Noguchi等人,Cell 73:147(1993年4月9日)),IL-2Rβ被IL-15的受体共享(Waldmann,Nature Reviews Immunology 6:595(2006)),IL-15是一种对于NK细胞和记忆CD8+T细胞的正常发育至关重要的细胞因子(Waldmann,Nature Reviews Immunology 6:595(2006))。
结合其受体的IL-2和IL-15的三维结构提供了对受体装配和信号传导的了解(Wang等人,Science 310:1159(2005);及Ring等人,Nat Immunol 13:1187(2012))。除了它们在正常免疫应答中的生理作用之外,IL-2和IL-15还可以促进病理应答,并且治疗目标是维持这些细胞因子的期望作用,同时阻断不利的自身免疫或免疫抑制应答。针对人IL-2Rα的两种单克隆抗体(mAb),即达利珠单抗(Daclizumab)和巴利昔单抗(Basiliximab)得到FDA批准,并且在肾移植排斥(Vincenti等人,N Engl J Med 338:161(1998))、心脏移植(Hershberger等人,N Engl J Med 352:2705(2005))、多发性硬化(Gold等人,Lancet 381:2167(2013))和哮喘(Bielekova等人,Proc Natl Acad Sci USA 101:8705(2004);及Busse等人,Am J Respir Crit Care Med 178:1002(2008))中展现出功效,但是它们不经由NK和记忆CD8+细胞上表达的中间亲和性IL-2Rβ-γc受体阻断IL-2信号传导并且不能阻断IL-15信号传导(Tkaczuk等人,Am J Transplant 2:31(2002))。虽然抗-人IL-2Rβ mAb Mikβ1可以阻断IL-2和IL-15向表达IL-2Rβ-γc受体的细胞的反式呈递(trans-presentation)(Morris等人,Proc Natl Acad Sci USA 103:401(2006)),但是它在经由其高亲和力异三聚体受体复合物阻断通过IL-2或IL-15的反式信号传导中是相对无效的(Morris等人,Proc Natl Acad Sci USA 103:401(2006);及Waldmann等人,Blood 121:476(2013))。因此,需要可阻断一种或多种IL-2和/或IL-15功能的新型IL-2突变蛋白。本公开提供了用作IL-2部分激动剂和拮抗剂的新型IL-2突变蛋白。
概述
IL-2对免疫系统发挥了广谱的作用,并且它在调节免疫活化和稳态两者中发挥重要的作用。作为免疫系统刺激剂,IL-2已经在治疗癌症和慢性病毒感染中得到应用。IL-2的刺激影响也可以导致破坏,介导自身免疫和移植物排斥。由于其在免疫调节和疾病中的工具性作用,鉴定新型IL-2分子,如IL-2部分激动剂和拮抗剂仍然是研究的活跃领域。
基于对IL-2与其关联受体如何相互作用的新了解,本文中提供了新型IL-2组合物。在大多数情况下,IL-2经由三种不同受体起作用:IL-2Rα、IL-2Rβ和IL-2Rγ。大多数细胞,如静息T细胞不响应IL-2,由于它们仅表达IL-2Rβ和IL-2Rγ(它们对IL-2具有低亲和力)。在刺激时,静息T细胞表达相对高亲和力IL-2受体IL-2Rα。IL-2与IL-2Rα的结合引起此受体序贯结合IL-2Rβ,和IL-2Rγ,引起T细胞活化。
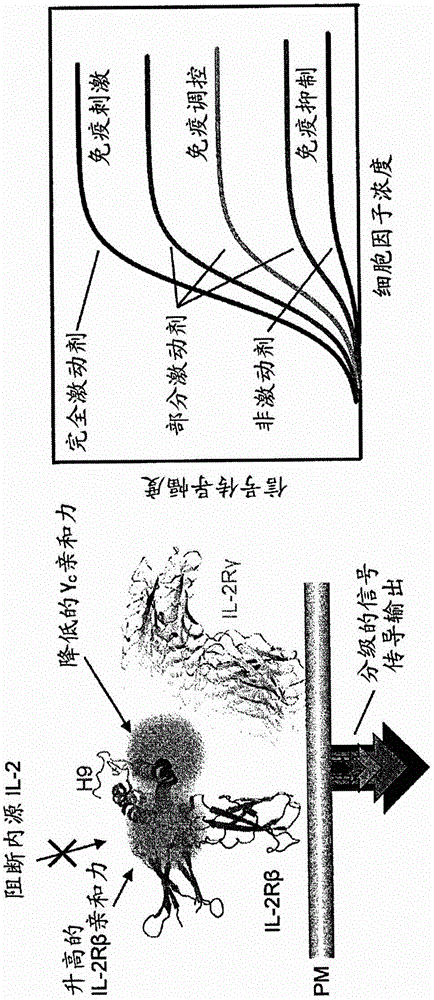
先前开发出由于对IL-2Rβ的增强的结合亲和力而具有提升的作用的IL-2“超级因子(superkine)”(Levin等人,Nature 484:529(2012))。假设此高亲和力超级因子/IL-2Rβ复合物可以充当显性阴性支架以创建“受体信号传导夹”以阻断内源信号传导。定向突变这些超级-IL-2“完全激动剂”以降低对IL-2Rγc的结合会减弱IL-2Rβ-γc异二聚化,并且代表新一类的基于机制的IL-2部分激动剂和非信号传导(中性)分子,其通过阻断内源细胞因子并且自身不施加作用而在功能上起拮抗剂的作用(参见图1中的示意图)。
本文中提供了新型人白介素-2(IL-2)突变蛋白或其变体。具体地讲,提供了IL-2突变蛋白,其具有升高的对IL-2Rβ受体的结合能力和降低的对IL-2Rγc受体的结合能力。例如,此类IL-2突变蛋白在降低或抑制一种或多种IL-2和/或IL-15功能为有用的应用中(例如,在治疗移植物抗宿主病(GVHD)和成人T细胞白血病中)作为IL-2部分激动剂和拮抗剂得到应用。还提供了编码此类IL-2突变蛋白的核酸、制备此类IL-2突变蛋白的方法、包含此类IL-2突变蛋白的药物组合物和使用此类IL-2突变蛋白的治疗方法。
在一个方面中,本文中提供了IL-2突变蛋白,所述IL-2突变蛋白与野生型人IL-2相比具有更大的对IL-2Rβ的结合亲和力和降低的对IL-2Rγc受体的结合亲和力(hIL-2)。在一些实施方案中,IL-2突变蛋白包含:(a)提供IL-2Rβ结合亲和力的一个或多个氨基酸取代,其选自根据野生型hIL-2编号的氨基酸位置24、65、74、80、81、85、86、89、92和/或93;和(b)降低IL-2Rγc受体结合亲和力的一个或多个氨基酸取代,其选自根据野生型hIL-2编号的氨基酸位置18、22、126和/或130。
在多个实施方案中,所述提高IL-2Rβ结合亲和力的氨基酸取代包括:Q74N、Q74H、Q74S、L80F、L80V、R81D、R81T、L85V、I86V、I89V和/或I93或其组合。在某些实施方案中,所述提高IL-2Rβ结合亲和力的氨基酸取代包括:L80F、R81D、L85V、I86V和I92F。在一些实施方案中,所述提高IL-2Rβ结合亲和力的氨基酸取代包括:N74Q、L80F、R81D、L85V、I86V、I89V和I92F。在一些实施方案中,所述提高IL-2Rβ结合亲和力的氨基酸取代包括:Q74N、L80V、R81T、L85V、I86V和I92F。在某些实施方案中,所述提高IL-2Rβ结合亲和力的氨基酸取代包括:Q74H、L80F、R81D、L85V、I86V和I92F。在一些实施方案中,所述提高IL-2Rβ结合亲和力的氨基酸取代包括:Q74S、L80F、R81D、L85V、I86V和I92F。在某些实施方案中,所述提高IL-2Rβ结合亲和力的氨基酸取代包括:Q74N、L80F、R81D、L85V、I86V和I92F。在某些实施方案中,所述提高IL-2Rβ结合亲和力的氨基酸取代包括:Q74S、R81T、L85V和I92F。
在一些实施方案中,所述降低IL-2Rγc受体结合亲和力的氨基酸取代包括氨基酸取代L18R、Q22E、A126T和/或S130R或其组合。在具体的实施方案中,所述降低IL-2Rγc受体结合亲和力的氨基酸取代包括Q126T。在某些实施方案中,所述降低IL-2Rγc受体结合亲和力的氨基酸取代包括L18R和Q22E。在一些实施方案中,所述降低IL-2Rγc受体结合亲和力的氨基酸取代包括L18R、Q22E和Q126T。在某些实施方案中,所述降低IL-2Rγc受体结合亲和力的氨基酸取代包括L18R、Q22E、Q126T和S130R。
在一个实施方案中,IL-2突变蛋白与野生型人IL-2相比具有更大的对IL-2Rβ的结合亲和力和降低的对IL-2Rγc受体的结合亲和力,其中IL-2突变蛋白包含氨基酸取代L80F、R81D、L85V、I86V、I92F和Q126T。
在一个实施方案中,IL-2突变蛋白与野生型人IL-2相比具有更大的对IL-2Rβ的结合亲和力和降低的对IL-2Rγc受体的结合亲和力,其中IL-2突变蛋白包含氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V和I92F。
在一个实施方案中,IL-2突变蛋白与野生型人IL-2相比具有更大的对IL-2Rβ的结合亲和力和降低的对IL-2Rγc受体的结合亲和力,其中IL-2突变蛋白包含氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V、Q126T和I92F。
在一个实施方案中,IL-2突变蛋白与野生型人IL-2相比具有更大的对IL-2Rβ的结合亲和力和降低的对IL-2Rγc受体的结合亲和力,其中IL-2突变蛋白包含氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V、I92F、Q126T和S130R。
在某些实施方案中,主题IL-2突变蛋白与野生型hIL-2相比具有降低的刺激IL-2Rβ+T细胞中的STAT5磷酸化的能力。在一些实施方案中,T细胞是CD8+T细胞。
在一些实施方案中,主题IL-2突变蛋白与野生型hIL-2相比具有降低的刺激IL-2Rβ+细胞中的pERK1/ERK2信号传导的能力。
在某些实施方案中,主题IL-2突变蛋白是IL-2和/或IL-15拮抗剂。在一些实施方案中,IL-2突变蛋白是CD8+T细胞中的IL-2和/或IL-15STAT5磷酸化的抑制剂。在一些实施方案中,IL-2突变蛋白是IL-2和/或IL-15诱导的CD8+T细胞增殖的抑制剂。在一些实施方案中,IL-2突变蛋白是IL-2依赖性的TCR诱导的细胞增殖的抑制剂。在一个实施方案中,IL-2突变蛋白是IL-2依赖性Th1、Th9和/或Treg分化的抑制剂。在某些实施方案中,IL-2突变蛋白是Th17分化的促进剂。在一些实施方案中,突变蛋白是NK细胞的IL-2依赖性活化的抑制剂。
在另一个方面中,本文中提供了IL-2突变蛋白融合蛋白,其包含与人Fc抗体片段连接的本文中描述的任一种IL-突变蛋白。
在另一个方面中,本文中提供了药物组合物,其包含本文中描述的任一种IL-2突变蛋白或IL-2突变蛋白融合蛋白和药学可接受载体。在一些实施方案中,药物组合物包含具有氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V、I92F、Q126T和S130R的IL-2突变蛋白。
在又一个方面中,本文中提供了治疗患有移植物抗宿主病(GVHD)的受试者的方法。在多个实施方案中,方法包含对受试者施用治疗有效量的包含本文中公开的任一种IL-2突变蛋白的药物组合物。在一些实施方案中,药物组合物包含具有氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V、I92F、Q126T和S130R的IL-2突变蛋白。
在另一个方面中,本文中提供了治疗患有成人T细胞白血病的受试者的方法。在某些实施方案中,该方法包括向所述受试者施用治疗有效量的包含本文中公开的任一种IL-2突变蛋白的药物组合物。在一些实施方案中,药物组合物包含具有氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V、I92F、Q126T和S130R的IL-2突变蛋白。
附图说明
图1显示了用于产生本文中提供的主题IL-2突变蛋白的示意图。左边,在IL-2上,绿色区域指示先前报道的变化以产生对IL-2Rβ具有高亲和力结合的H9“超级IL-2”,从而阻断内源性IL-2的结合。红色圆圈指示IL-2的变化,其降低与IL-2Rγc的结合和IL-2Rβ-γc异二聚化。右边,根据对IL-2Rγc结合的破坏水平,应当产生不同水平的活性和功能,如指示。
图2显示了如本文中描述的IL-2突变蛋白文库的FACS概貌。将人IL-2基因的易错PCR的产物进行选择。经由六轮选择产生第一代IL-2文库。使用与藻红蛋白(PE)缀合的四聚体IL-2Rβ进行第一轮以结合表达IL-2突变蛋白的酵母(A)。使用用PE标记的单体IL-2Rβ实现选择的后续轮次。(B)来自第二代IL-2文库的结果。
图3描绘了相对于野生型IL-2序列显示的具有高亲和力IL-2Rβ结合的IL-2突变蛋白中改变的氨基酸残基。还显示了每种突变蛋白和IL-2对IL-2Rβ的结合亲和力。
图4显示了对IL-2Rβ具有高亲和力结合的IL-2突变蛋白对CD25-和CD25+天然杀伤(NK)细胞的刺激作用。在经处理的(A)CD25-和(B)CD25+YT-1NK细胞中证实的野生型IL-2和IL-2突变蛋白6-6、D10、和H9对STAT5磷酸化的剂量响应关系。圆圈野生型IL-2;正方形6-6;三角形向上H9;三角形向下D10。
图5显示了IL-2突变蛋白结合的CD25非依赖性。CD25-和CD25+YT-1NK细胞的STAT5磷酸化的剂量响应曲线。(A)IL-2和IL-2(F42A)(圆圈,实线野生型IL-2,CD25+细胞;正方形,实线IL-2F42A,CD25+细胞;三角形向上,虚线野生型IL-2,CD25-细胞;三角形向下,虚线,IL-2F42A,CD25-细胞)。(B)H9和H9(F42A)(圆圈,实线野生型H9,CD25+细胞;正方形,实线H9F42A,CD25+细胞;三角形向上,虚线H9,CD25-细胞;三角形向下,虚线,H9F42A,CD25-细胞)。虽然F42A突变使CD25+细胞上的野生型IL-2的剂量响应曲线向右转变,但对CD25-没有观察到的影响,H9和H9 F42A的剂量响应曲线是基本上重叠的,不管CD25表达如何。
图6描绘了几种IL-2突变蛋白“超级激动剂”(即,对IL-2Rβ具有高亲和力结合的突变蛋白)在缺乏IL-2Rα的情况下刺激T细胞的能力。用IL-2突变蛋白或野生型IL-2刺激从CD25敲除小鼠分离的T细胞。提供了IL-2突变蛋白的剂量响应曲线和响应的EC50。如显示,所有测试的IL-2突变蛋白相对于野生型IL-2在缺乏IL-2Rα的情况下导致相对升高的T细胞刺激。
图7是比较IL-2突变蛋白“超级激动剂”诱导有经历的T细胞刺激的相对能力的FACS分析。用两种浓度的(10ng/ml或1ng/ml)的IL-2突变蛋白或野生型IL-2刺激T细胞。在每个FACS概貌中显示了刺激的T细胞的百分比。
图8显示了IL-2“超级激动剂”突变蛋白D10对天然杀伤(NK)细胞功能,特别是自发和抗体依赖性细胞介导的细胞毒性的影响。将天然杀伤细胞(效应子)和经Cr51标记的肿瘤细胞(靶物)在存在野生型IL-2或IL-2突变蛋白D10的情况下与或不与抗EGFR抗体西妥昔单抗(cetuximab)一起孵育5小时。NK细胞自发细胞毒性的D10刺激由于高剂量IL-2(*p=0.008,**p=0.001),在没有IL-2或D10刺激的情况下有最小的自发细胞毒性。此外,D10的添加增强西妥昔单抗抗体的ADCC。
图9显示了D10的晶体结构。L85V的初始疏水核心突变导致靶向多个疏水性核心残基和高亲和力共有序列的第二代IL-2文库。D10的晶体结构在螺旋C之前的环区域中含有明确限定的电子密度。
图10显示了相对于IL-2,对IL-2Rβ具有高亲和力结合的IL-2“超级激动剂”突变蛋白展现出CD8+T细胞而非Treg的增强的刺激。在接受PBS、20μgIL-2、20μg H9或1.5μg IL-2/抗IL-2单克隆抗体复合物(IL-2/mAb)的小鼠的脾中测定(A)宿主CD3+CD8+CD44高记忆表型(MP)T细胞和(B)宿主CD3+CD4+CD25高T细胞(调节T细胞)的总细胞计数。
图11显示了相对于IL-2,对IL-2Rβ具有高亲和力结合的IL-2突变蛋白激动剂展现出增强的抗肿瘤响应及降低的不利作用。肺水肿(肺湿重)充当IL-2处理后不利毒性作用的量度,并通过在干燥之前和之后称重肺测定(A)。P值意指治疗方式之间的比较。*,p<0.05;**,p<0.01。(B)使用B16F10黑素瘤细胞在体内测试IL-2突变蛋白的抗赘生性质。给C57B1/6小鼠(n=3-4只小鼠/组)皮下注射106个B16F10黑色素瘤细胞,然后一旦肿瘤结节变得可见和可触摸(其通常对应于肿瘤细胞注射后的第4至5天或约15mm2的肿瘤大小),每天注射PBS、20μg IL-2、20μg H9或1.5μg IL-2/抗IL-2单克隆抗体复合物(IL-2/mAb)达5天。显示以mm2计的平均肿瘤面积(+/-SD)对肿瘤接种后的时间。P值意指IL-2与其它治疗方式的比较。
图12显示了通过破坏γc结合产生基于机制的IL-2突变蛋白。(A)H9-IL-2Rβ-γc复合物的结构(H9是绿色;IL-2Rβ是蓝色;γc是金色)。以青色显示了对H9-RETR掺入以破坏IL-2与γc的相互作用的突变(L18R,Q22E,Q126T,和S130R)(图的右边部分)。(B,C)H9-IL-2Rβ(C)和H9-RET-IL-2Rβ(D)复合物对γc的结合的表面等离子体共振分析。
图13显示了对IL2Rγc具有降低的结合亲和力的IL-2突变蛋白的减弱的信号传导。(A,B)对野生型IL-2或各种H9变体测试其在CD25-(A)和CD25+(B)YT-1人NK样细胞中诱导STAT5磷酸化的能力。(C,D)相对于细胞因子刺激后CD25-YT-1细胞中的最大表面表达,IL-2Rβ(C)和IL-2Rγ(D)的内化动力学。(E)将新鲜分离的(上部图)或预活化的(下部图)的CD8+T细胞保持未刺激或者用1μg/ml IL-2、H9-RE、H9-T、H9-RET或H9-RETR刺激30分钟。通过流式细胞术测定CD25表达(左图)或pSTAT5(右图)。(F)用IL-2、H9、H9-RET或H9-RETR处理如指定的细胞,裂解,并且用针对pSTAT5或总STAT5的抗体进行蛋白质印迹。(G)由野生型IL-2、H9、H9-RE、H9-T、H9-RET和H9-RETR诱导的pSTAT5的剂量响应曲线。(H)由野生型IL-2、H9、H9-RET和H9-RETR得到的磷酸-S6核糖体蛋白(pS6)的剂量响应曲线。MFI,均值荧光强度。对于剂量响应实验(A,B,G,H),横坐标指示以ng/ml计的细胞因子浓度的对数。MFI,均值荧光强度。数据代表每组的至少两个实验(误差条,一式三份的S.E.M.)。
图14显示了在两种不同测定中对IL2Rγc具有降低的结合亲和力的IL-2突变蛋白的减弱的信号传导。(A)CD25-YT1人NK样细胞上的磷酸-ERK1/ERK2蛋白的剂量响应曲线。(B)新鲜分离的(上部图)或预活化的(下部图)人CD8+T细胞上的IL-2Rβ和IL-2Rγ表达的比较。数据代表每组的至少两个实验。误差条代表一式三份的SEM.。
图15显示了响应IL-2、H9、H9-RE、H9-T、H9-RET和H9-RETR的增殖和CD25表达。由IL-2和H9而非由H9-RET或H9-RETR诱导新鲜分离的人CD8+T细胞的增殖的诱导,H9-T有中间作用。用CFSE标记细胞,用指定的IL-2变体刺激,并且在5天后通过流式细胞术评估CFSE稀释。
图16显示了H9-RET和RETR对增殖、STAT5结合、和基因表达的影响。(A)在具有不同浓度的指定的IL-2变体的96孔板中培养新鲜分离的和预活化的人CD8+T细胞达2天,并且测量[3H]-胸苷掺入。棒代表均值±S.E.M。从2名个体供体组合细胞。数据代表至少两个独立实验。(B)用IL-2、H9、H9-RET和H9-RETR(1μg/ml)处理24小时的预活化的CD8+T细胞的RNA-Seq热图分析。显示了基因,其表达相对于对照被IL-2上调或下调(根据颜色量表,在-1.00和1.00之间归一化每种基因的表达)。显示了优先上调(红色)或下调(绿色)≥2倍的mRNA。(C)用指定的细胞因子刺激后上调(空心棒)或下调(实心棒)的mRNA数目。IL-2、H9、H9-RET和H9-RETR分别诱导731、742、65和23种mRNA,并且抑制437、397、13和46种mRNA(倍数变化≥2;p值<1e-10)。(D)基于ChIP-Seq的STAT5B结合位点的数目及其在用IL-2变体处理的预活化的CD8+T细胞中的全基因组分布。显示了5’非翻译区(5’UTR)、外显子、内含子、和3’非翻译区(3’UTR),如在人RefSeq数据库(汇编GRCh37.p9)中限定。TSS上游的5kb称为启动子区。(E)使用IL-2诱导的STAT5B峰实施热图聚簇,其以STAT“峰顶点”(以位置“0”指示)的上游约1kb和下游1kb为中心。由IL-2、H9、H9-RET和H9-RETR诱导的结合强度以红色的强度指示。(F)在保持未刺激或用IL-2、H9、H9-RET和H9-RETR刺激24小时的预活化的细胞中相对于RPL7的IL2RA、LTA、CISH、IL7RA和BCL6 RNA的表达。数据代表至少两个实验,除了RNA-Seq实验外,其中通过RT-PCR确认选择基因(参见文本)。
图17描绘了用IL-2、H9、H9-RE、H9-T、H9-RET或H9-RETR处理的预活化的CD8+T细胞上的CD25表达。数据代表三个独立实验。
图18显示了H9-RETR抑制IL-2R介导的信号传导。(A和B)H9-RET和H9-RETR是IL-2和IL-15的竞争性抑制剂。在缺乏或存在1μg/ml H9-RET或H9-RETR的情况下将预活化的人CD8+T细胞与指定浓度的IL-2或IL-15孵育。(C和D)H9-RETR在预活化的CD8+T细胞中比抗Tac或Mikβ1单抗更有效阻断IL-2和IL-15诱导的STAT5磷酸化。(E和F)H9-RETR比抗Tac或Mikβ1更有效抑制IL-2诱导的或IL-15诱导的增殖。显示了均值±S.E.M。数据代表三个独立实验。(G)H9-RETR在体内抑制IL-2-诱导的(上图)和IL-15诱导的(下图)STAT5磷酸化。在IL-2或IL-15之前60分钟向C57BL/6小鼠注射(i.p)Fc4或Fc4-H9-RETR。30分钟后在脾CD4+CD25+FoxP3+T细胞中测量pSTAT5。指示MFI。数据代表三个独立实验。(H)Fc4-H9-RETR减弱GVHD。对BALB/c小鼠进行辐照(950cGy),并移植1000万个T消耗的骨髓(BM)细胞,不含或含有来自C57BL/6小鼠的200万个Treg消耗的泛-T细胞。通过以100μg/剂量每天两次i.p.注射10天,用Fc4或Fc4-H9-RETR融合蛋白处理接受泛-T细胞的小鼠。数据表示从三个独立实验合并的存活曲线,并使用Kaplan-Meier方法和对数秩检验进行分析。对于Fc4对H9-RETR-Fc4,p=0.0001。(I)如指示,在存在或缺乏UPC10,达利珠单抗,Mikβ1或H9-RETR的情况下阻断用50U/ml IL-2培养3天的ED40515(+)T细胞的增殖。数据代表两个实验,每个实验一式三份进行。(J)用UPC10、达克珠单抗、Mikβ1或H9-RETR处理的来自具有郁积型ATL的患者的细胞的自发性6天增殖测定。一式三份进行测定。
图19显示IL-2突变蛋白H9-RET和h9-RETR对CD8+T细胞的影响。(A)H9-RET和H9-RETR抑制IL-2-诱导的CD25在预活化的CD8+T细胞上的表达。(B)在存在或缺乏H9-RET或H9-RETR的情况下用IL-2刺激的预活化的人CD8+T细胞中的IL2RA mRNA水平(相对于RPL7表达归一化)。数据代表三个独立实验。(C)H9-RETR对IL-2-和IL-15诱导的T细胞增殖的抑制。新鲜分离的CD8+T细胞进行CFSE标记并在存在或缺乏1μg/ml H9-RET或H9-RETR的情况下用IL-2或IL-15(1μg/ml)刺激,并评估CFSE稀释。数据代表三个独立实验(A和C)或者自一式三份完成的两个独立实验合并(B)。
图20显示IL-2突变蛋白H9-RET和h9-RETR对CD8+T细胞的影响。(A)H9-RET和H9-RETR都抑制新鲜分离的CD8+T细胞的TCR诱导的增殖。细胞用CFSE标记,在有或没有1μg/ml的H9-RET或H9-RETR的情况下用平板结合的抗-CD3(2μg/ml)+可溶性抗CD28(1μg/ml)刺激4天,并且通过流式细胞术评估CFSE稀释。(B)1μg/ml的H9-RET或H9-RETR抑制用2μg/ml抗CD3+1μg/ml抗-CD28刺激4天的外周血CD8+T细胞上的TCR诱导的CD25表达。数据代表三个独立实验。
图21显示H9-RET和H9-RETR阻断Th1、Th9和Treg分化,但是促进Th17分化。在缺乏或存在H9-RET或H9-RETR的情况下,在各种T辅助极化条件下分化细胞。数据代表每种类型细胞的至少两个独立实验。
图22显示H9-RETR阻断IL-2诱导的NK细胞活化和细胞毒性。(A)与IL-2不同,H9-RET和H9-RETR(1μg/ml)在孵育24小时后都不刺激原代人NK细胞中的CD69表达,但H9-RETR抑制IL-2(100ng/ml)诱导的CD69表达。实验进行两次。(B,C)H9-RET和H9-RETR都不刺激原代人NK细胞中的细胞毒性,而103ng/mL的H9-RETR抑制HER18(B)和K562(C)靶细胞的IL-2诱导的NK细胞细胞毒性。NK细胞和靶细胞在指定的细胞因子存在下以10∶1的比率孵育4小时。通过51Cr释放测定HER18细胞裂解并一式三份进行;通过流式细胞术评估K562细胞的裂解。进行四个独立实验。
图23是用于图18G中的实验的方案的示意图。
详述
为了使本公开更容易理解,某些术语和短语在下面以及贯穿整个说明书定义。
定义
本文中引用的所有参考文献通过引用方式整体并入,如同完全阐述一样。除非另有定义,本文中使用的技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。Singleton等人,Dictionary of Microbiology and Molecular Biology第3版,J.Wiley&Sons(New York,NY 2001);3月,Advanced Organic Chemistry Reactions,Mechanisms and Structure第5版,J.Wiley&Sons(New York,NY 2001);以及Sambrook和Russell,Molecular Cloning:A Laboratory Manual第3版,Cold Spring harbor Laboratory Press(Cold Spring Harbor,NY 2001),为本领域技术人员提供了本公开中使用的许多术语的一般指导。适当时,涉及使用市售试剂盒和试剂的方法通常根据制造商定义的方案和/或参数进行,除非另有说明。
如本文中所用,“IL-2”意指野生型IL-2,无论是天然的还是重组的。成熟的人IL-2作为133个氨基酸的序列(少信号肽,其由另外的20个N端氨基酸组成)发生,如Fujita等人,PNAS USA,80,7437-7441(1983)中描述。人IL-2的氨基酸序列(SEQ ID NO:1)见于Genbank,在登录定位符(accession locator)NP_000577.2下。成熟人IL-2的氨基酸序列描述于SEQ ID NO:2中。鼠(小家鼠(Mus musculus))IL-2氨基酸序列见于Genbank,在登录定位符(SEQ ID NO:3)下。成熟鼠IL-2的氨基酸序列描述于SEQ ID NO:4。
SEQ ID NO:1
MYRMQLLSCIALSLALVTNSAPTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAQSKNFHLRPRDLISNINVIVLELKGSETTFMCEYADETATIVEFLNRWTTFCQSIISTLT
SEQ ID NO:2
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAQSKNFHLRPRDLISNINVIVLELKGSETTFMCEYADETATIVEFLNRWTTFCQSIISTLT
SEQ ID NO:3
MYSMQLASCVTLTLVLLVNSAPTSSSTSSSTAEAQQQQQQQQQQQQHLEQLLMDLQELLSRMENYRNLKLPRMLTFKFYLPKQATELKDLQCLEDELGPLRHVLDLTQSKSFQLEDAENFISNIRVTVVKLKGSDNTFECQFDDESATVVDFLRRWIAFCQSIISTSPQ
SEQ ID NO:4
APTSSSTSSSTAEAQQQQQQQQQQQQHLEQLLMDLQELLSRMENYRNLKLPRMLTFKFYLPKQATELKDLQCLEDELGPLRHVLDLTQSKSFQLEDAENFISNIRVTVVKLKGSDNTFECQFDDESATVVDFLRRWIAFCQSIISTSPQ
如本文中所用,“IL-2突变蛋白”意指已经对白介素-2蛋白进行特定取代的IL-2多肽。IL-2突变蛋白的特征在于在天然IL-2多肽链的其它残基中或处的一个或多个位点处的氨基酸插入,缺失,取代和修饰。根据本公开,任何此类插入,缺失,取代和修饰导致保留IL-2Rβ结合活性的IL-2突变蛋白。示例性突变蛋白可包括1、2、3、4、5、6、7、8、9、10或更多个氨基酸的取代。
突变蛋白还包括在IL-2的其它位置处的保守修饰和取代(即,对突变蛋白的二级或三级结构具有最小影响的那些)。此类保守取代包括Dayhoff在The Atlas of Protein Sequence and Structure 5(1978)和由Argos于EMBO J.,8:779-785(1989)中描述的那些。例如,属于下组之一的氨基酸代表保守改变:第I组:ala、pro、gly、gln、asn、ser、thr;组II:cys、ser、tyr、thr;组III:val、ile、leu、met、ala、phe;组IV:lys、arg、his;组V:phe、tyr、trp、his;和VI组:asp、glu。
“根据IL-2编号”意指参照在野生型IL-2的成熟序列中正常发生该氨基酸的位置来鉴定所选择的氨基酸,例如R81意指存在于SEQ ID NO:2中的第81个氨基酸精氨酸。
术语“具有IL-2Rαβγ受体的细胞类型”意指已知具有这种受体型的细胞,即T细胞,活化的T细胞,B细胞,活化的单核细胞和活化的NK细胞。术语“具有IL-2Rβγ受体的细胞类型”意指已知具有该受体型的细胞,即B细胞,静息单核细胞和静息NK细胞。
如本文中所用,关于多肽或DNA序列的术语“同一性”意指两个分子之间的亚基序列同一性。当两个分子中的亚基位置被相同的单体亚基(即,相同的氨基酸残基或核苷酸)占据时,则分子在该位置是相同的。两个氨基酸或两个核苷酸序列之间的相似性是相同位置数目的直接函数。一般来说,比对序列,使得获得最高阶匹配。如果必要,那么可以使用发表的技术和广泛可用的计算机程序,如GCS程序包(Devereux等,Nucleic Acids Res.12:387,1984),BLASTP,BLASTN,FASTA(Atschul等,J.Molecular Biol.215:403,1990)计算同一性。可以使用序列分析软件,如威斯康星大学生物技术中心(University of Wisconsin Biotechnology Center)(1710 University Avenue,Madison,Wis.53705)的遗传学计算机组的序列分析软件包,以其默认参数测量序列同一性。
术语“多肽”,“蛋白质”或“肽”意指任何氨基酸残基链,不管其长度或翻译后修饰(例如糖基化或磷酸化)。
在本公开的突变体IL-2多肽是“基本上纯的”的情况下,按重量(干重)计,它们可以是至少约60%感兴趣的多肽,例如含有突变体IL-2氨基酸序列的多肽。例如,按重量计,多肽可以是至少约75%,约80%,约85%,约90%,约95%或约99%感兴趣的多肽。纯度可以通过任何适当的标准方法,例如柱色谱,聚丙烯酰胺凝胶电泳或HPLC分析测量。
“激动剂”是与靶物相互作用以引起或促进靶物的活化增加的化合物。
“部分激动剂”是如下的化合物,其与激动剂与相同的靶物相互作用,但是即使通过增加部分激动剂的剂量也不产生与激动剂一样大的生物化学和/或生理作用的量级。
“超级激动剂(super agonist)”是能够产生比靶受体的内源性激动剂更大的最大应答,并且因此具有超过100%的功效的一类激动剂。
“拮抗剂”是例如通过阻止,减少,抑制或中和激动剂的活性对抗激动剂的作用的化合物。“拮抗剂”还可以阻止,抑制或降低靶物,例如靶受体的组成性活性,甚至在没有鉴定的激动剂的情况下。
“可操作地连接”意指感兴趣的核苷酸序列(即,编码IL-2突变蛋白的序列)以允许核苷酸序列表达的方式连接于调节序列(例如,在体外转录/翻译系统中或当将载体引入宿主细胞中时在宿主细胞中)。“调节序列”包括启动子,增强子和其它表达控制元件(例如多聚腺苷酸化信号)。参见例如Goeddel(1990)于Gene Expression Technology:Methods in Enzymology 185(Academic Press,SanDiego,Calif.)。调节序列包括在许多类型的宿主细胞中指导核苷酸序列的组成性表达的那些,以及仅在某些宿主细胞中指导核苷酸序列表达的那些(例如组织特异性调节序列)。本领域技术人员应当理解,表达载体的设计可以取决于诸如待转化的宿主细胞的选择,期望的蛋白质的表达水平等因素。可以将本发明的表达构建体引入宿主细胞中,从而产生本文中公开的人IL-2突变蛋白或产生其生物活性变体。
术语“宿主细胞”和“重组宿主细胞”在本文中可互换使用。应当理解,此类术语不仅指特定的受试细胞,而且指此类细胞的后代或潜在后代。因为某些修饰可能由于突变或环境影响而在后代中发生,所以此类后代实际上可能不与亲本细胞相同,但仍然包括在如本文中使用的术语的范围内。
如本文中所用,术语“转化”和“转染”意指用于将外来核酸(例如DNA)引入宿主细胞中的多种本领域公认的技术,包括磷酸钙或氯化钙共沉淀,DEAE-葡聚糖介导的转染,脂转染、粒子枪或电穿孔。
如本文中所用,术语“药学可接受载体”包括但不限于与药物施用相容的盐水,溶剂,分散介质,涂层材料,抗细菌剂和抗真菌剂,等张剂和吸收延迟剂等。补充的活性化合物(例如抗生素)也可以掺入组合物中。
如本文中所用,术语“癌症”(或“癌性”),“过度增殖性”和“赘生性”意指具有自主生长能力的细胞(即以快速增殖细胞生长为特征的异常状态或状况)。过度增殖性和赘生性疾病状态可以分类为病理性(即表征或构成疾病状态),或者它们可以分类为非病理性(即,作为偏离正常,但与疾病状态无关)。该术语意在包括所有类型的癌性生长或致癌过程,转移组织或恶性转化的细胞,组织或器官,而不考虑组织病理学类型或侵入性阶段。“病理性过度增殖”细胞发生在以恶性肿瘤生长为特征的疾病状态中。非病理性过度增殖性细胞的实例包括与伤口修复相关的细胞增殖。术语“癌症”或“肿瘤”用于指各种器官系统的恶性肿瘤,包括影响肺,乳腺,甲状腺,淋巴腺和淋巴样组织,胃肠器官和泌尿生殖道的恶性肿瘤,以及腺癌,其通常认为包括恶性肿瘤,如大多数结肠癌,肾细胞癌,前列腺癌和/或睾丸肿瘤,非小细胞肺癌,小肠癌和食管癌。
术语“癌”是本领域公认的,并且意指上皮或内分泌组织的恶性肿瘤,包括呼吸系统癌,胃肠系统癌,泌尿生殖系统癌,睾丸癌,乳腺癌,前列腺癌,内分泌系统癌和黑素瘤。“腺癌”意指源自腺组织或其中肿瘤细胞形成可识别的腺体结构的癌。
如本文中所用,术语“造血赘生性病症”意指涉及造血起源的增生性/赘生性细胞的疾病,例如源自髓样,淋巴样或红细胞样谱系或其前体细胞。优选地,疾病源自分化不良的急性白血病(例如,成红细胞性白血病和急性巨核细胞白血病)。其它示例性髓样病症包括但不限于急性早幼粒细胞性白血病(APML),急性骨髓性白血病(AML)和慢性骨髓性白血病(CML)(综述于Vaickus,L.(1991)Crit Rev.,Oncol./Hemotol 11:267-97);淋巴样恶性肿瘤包括但不限于急性成淋巴细胞白血病(ALL),包括B谱系ALL和T谱系ALL,慢性淋巴细胞性白血病(CLL),幼淋巴细胞白血病(PLL),毛细胞白血病(HLL)和瓦尔登斯特伦(Waldenstrom)巨球蛋白血症(WM)。恶性淋巴瘤的其它形式包括但不限于非霍奇金(Hodgkin)淋巴瘤及其变体,外周T细胞淋巴瘤,成人T细胞白血病/淋巴瘤(ATL),皮肤T细胞淋巴瘤(CTCL),大颗粒淋巴细胞性白血病(LGF),霍奇金病和Reed Stemberg病。
IL-2突变蛋白
IL-2突变蛋白部分激动剂和拮抗剂
在一个方面中,本文中提供作为部分激动剂和拮抗剂的IL-2突变蛋白。在某些实施方案中,本文中提供了与野生型IL-2(例如,人IL-2,SEQ ID NO:2)相比含有一个或多个降低IL-2突变蛋白对IL-2Rγc受体的结合亲和力的突变的IL-2突变蛋白。如本文中所用,术语“共同γc链”、“IL-2Rγc”、“Yc”、“IL-2Rγ”、“IL-2受体亚基γ”和“IL-2RG”(Genbank登录号:NM_000206和NP_000197(人)和NM_013563和NP_038591(小鼠))均指I型细胞因子受体家族的成员,其是针对至少6种不同白介素受体的受体复合物的细胞因子受体亚基,包括但不限于IL-2、IL-4、IL-7、IL-9、IL-15和IL-21受体。IL-2Rγc与IL-2Rβ相互作用,以主要在记忆T细胞和天然杀伤(NK)细胞上形成中间亲和力IL-2受体,并与IL-2Rα和IL-2Rβ相互作用,以在活化的T细胞和调节性T细胞(Treg)上形成高亲和力IL-2受体。不受任何特定运行理论束缚,认为此类突变蛋白可以通过在结合IL-2Rβ+/IL-2Rγc+细胞(例如静息T细胞和天然杀伤(NK)细胞)上的IL-2Rβ时减弱或抑制IL-2β/IL-2γc异二聚化和信号传导而用作IL-2部分激动剂或拮抗剂的功能。
示例性的主题IL-2突变蛋白在至少约50%、至少约65%、至少约70%、至少约80%、至少约85%、至少约87%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%约99%与野生型IL-2相同。突变可以由氨基酸残基的数量或含量的变化组成。例如,突变体IL-2可以具有比野生型IL-2更大或更小数目的氨基酸残基。或者或另外,示例性突变体多肽可以含有存在于野生型IL-2中的一个或多个氨基酸残基的取代。在多个实施方案中,突变体IL-2多肽可以通过单个氨基酸残基的添加,缺失或取代而不同于野生型IL-2。
作为说明,包括与参考氨基酸序列SEQ ID NO:2至少95%相同的氨基酸序列的IL-2突变蛋白是除了包括SEQ ID NO:2的参考氨基酸序列的多至5个改变外包含与参考序列相同的序列的多肽。例如,参考序列中高达5%的氨基酸残基可以缺失或用另一个氨基酸取代,或可以将参考序列中总氨基酸残基的高达5%的氨基酸数目插入参考序列中。参考序列的这些改变可发生在参考氨基酸序列的氨基(N--)或羧基(C--)末端位置或在那些末端位置之间的任何位置,在参考序列的残基之间个别或在参考序列内的一个或多个连续组中散布。
在某些实施方案中,IL-2突变蛋白以比野生型IL-2小至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的亲和力结合IL-2Rγc。IL-2突变蛋白的结合亲和力也可以表示为比野生型IL-2低1.2、1.4、1.5、2、5、10、15、20、25、50、100、200、250或更多倍的对IL-2γc的亲和力。可以使用本领域已知的任何合适的方法测量主题IL-2突变蛋白对IL-2γc的结合亲和力。用于测量IL-2Rγc结合的合适方法包括但不限于放射性配体结合测定(例如饱和结合,斯卡恰特(scatchard)图,非线性曲线拟合程序和竞争结合测定);非放射性配体结合测定(例如,荧光偏振(FP),荧光共振能量转移(FRET)和表面等离子体共振测定(参见例如Drescher等人,Methods Mol Biol 493:323-343(2009));液相配体结合测定(例如实时聚合酶链式反应(RT-qPCR)和免疫沉淀);和固相配体结合测定(例如多孔板测定,珠上配体结合测定,柱上配体结合测定,和滤器测定)。
在某些实施方案中,相对于野生型IL-2,IL-2突变蛋白破坏IL-2Rβ与IL-2Rγc的缔合,使得该IL-2Rβ/IL-2Rγc相互作用减少约2%,约5%、约10%、约15%、约20%、约50%、约75%、约90%、约95%或更多。
在一些实施方案中,降低IL-2突变蛋白对IL-2Rγc受体的结合亲和力的一个或多个突变是氨基酸取代。在一些实施方案中,与野生型IL-2(SEQ ID NO:2)相比,主题IL-2突变蛋白由1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸取代组成。取代的氨基酸残基可以是但不一定是保守取代,其通常包括下组内的取代:甘氨酸、丙氨酸;缬氨酸、异亮氨酸、亮氨酸;天冬氨酸、谷氨酸;天冬酰胺、谷氨酰胺;丝氨酸、苏氨酸;赖氨酸;精氨酸;和苯丙氨酸、酪氨酸。在具体的实施方案中,取代位于接触IL-2Rγc结合界面的IL-2的氨基酸残基处。
在某些实施方案中,氨基酸取代是选自根据野生型hIL-2(例如,SEQ ID NO:2)编号的位置:18、22、126和/或130的野生型IL-2的一个或多个氨基酸位置处的取代。在某些实施方案中,降低IL-2Rγc受体结合亲和力的氨基酸取代包括氨基酸取代L18R、Q22E、A126T和/或S130R或其组合。
在一些实施方案中,降低IL-2Rγc受体结合亲和力的氨基酸取代包括Q126T。在其它实施方案中,降低IL-2Rγc受体结合亲和力的氨基酸取代包括L18R和Q22E。在一些实施方案中,降低IL-2Rγc受体结合亲和力的氨基酸取代包括L18R,Q22E和Q126T。在其它实施方案中,降低IL-2Rγc受体结合亲和力的氨基酸取代包括L18R,Q22E,Q126T和S130R。
在一些实施方案中,对IL-2Rβ受体具有降低的结合亲和力的IL-2突变蛋白还包括1、2、3、4、5、6、7、8、9或10个或更多个增加IL-2Rβ结合亲和力的突变。如本文中所用,术语“IL-2Rβ”和“CD122”(Genbank登录号NM_000878和NP_000869(人))均指I型细胞因子受体家族的成员,其与IL-2Rγc相互作用以主要在记忆T细胞和天然杀伤(NK)细胞上形成中间亲和力IL-2受体,并与IL-2Rα和IL-2Rγc相互作用,以在活化的T细胞和调节T细胞(Treg)上形成高亲和力IL-2受体。不受任何具体的运行理论束缚,认为具有对IL-2Rβ的强结合亲和力和对IL-2Rγc的弱结合亲和力的此类IL-2突变蛋白充当显性阴性支架以产生“受体信号传导夹”以阻断内源信号传导。此类IL-2突变蛋白将减弱IL-2Rβ-γc异二聚化,并且代表一类新型基于机制的IL-2部分激动剂和非信号传导(中性)分子,其通过阻断内源性细胞因子并且不自身施加作用在功能上起拮抗剂作用(参见图1中的示意图)。
在某些实施方案中,相对于野生型IL-2(例如,SEQ ID NO:2),主题IL-2突变蛋白包括至少一个突变(例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个氨基酸残基的缺失、添加或取代),并且以比野生型IL-2更高的亲和力结合IL-2Rβ。
在某些实施方案中,IL-2突变蛋白以比野生型IL-2大至少1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的亲和力结合IL-2Rβ。IL-2突变蛋白的结合亲和力也可以表示为比野生型IL-2大1.2、1.4、1.5、2、5、10、15、20、25、50、100、200、250或更多倍的对IL-2Rβ的亲和力。可以通过本领域技术人员已知的任何合适的方法评估主题IL-2突变蛋白与IL-2Rβ的结合,包括但不限于上述方法。
在一些实施方案中,增加IL-2Rβ结合亲和力的至少一个突变是氨基酸取代。在一些实施方案中,增加IL-2Rβ结合亲和力的氨基酸取代包括在根据野生型hIL-2(SEQ ID NO:2)编号的氨基酸位置I24、P65、Q74、L80、R81、L85、I86、I89、I92、和/或V93处的取代:在某些实施方案中,取代包括I24V、P65H、Q74R、Q74H、Q74N、Q74S、L80F、L80V、R81I、R81T、R81D、L85V、I86V、I89V、I92F、和/或V93I或其组合。在某些实施方案中,取代包括Q74N、Q74H、Q74S、L80F、L80V、R81D、R81T、L85V、I86V、I89V、和/或I93V或其组合。
在一些实施方案中,增加IL-2Rβ结合亲和力的氨基酸取代包括:L80F、R81D、L85V、I86V和I92F。在一些实施方案中,增加IL-2Rβ结合亲和力的氨基酸取代包括:Q74N、L80F、R81D、L85V、I86V、I89V、和I92F。在一些实施方案中,增加IL-2Rβ结合亲和力的氨基酸取代包括:Q74N、L80V、R81T、L85V、I86V和I92F。在一些实施方案中,增加IL-2Rβ结合亲和力的氨基酸取代包括:Q74H、L80F、R81D、L85V、I86V和I92F。在一些实施方案中,增加IL-2Rβ结合亲和力的氨基酸取代包括:Q74S、L80F、R81D、L85V、I86V和I92F。在某些实施方案中,增加IL-2Rβ结合亲和力的氨基酸取代包括:Q74N、L80F、R81D、L85V、I86V和I92F。在一些实施方案中,增加IL-2Rβ结合亲和力的氨基酸取代包括:Q74S、R81T、L85V和I92F。
在某些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L80F、R81D、L85V、I86V、I92F和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAQSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:5)。
在多个实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V和I92F。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAQSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCQSIISTLT(SEQ ID NO:6)。
在示例性实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V、I92F和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAQSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:7)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、L80F、R81D、L85V、I86V、I92F、Q126T和S130R。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAQSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIIRTLT(SEQ ID NO:8)。
在某些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代Q74N、L80F、R81D、L85V、I86V、I89V、I92F和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHFDPRDVVSNVNVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:9)。
在多个实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N、L80F、R81D、L85V、I86V、I89V和I92F。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHFDPRDVVSNVNVFVLELKGSETTFMCEYADETATIVEFLNRWITFCQSIISTLT(SEQ ID NO:10)。
在一个示例性实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N、L80F、R81D、L85V、I86V、I89V、I92F和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHFDPRDVVSNVNVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:11)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N、L80F、R81D、L85V、I86V、I89V、I92F、Q126T、和S130R。在某些实施方案中、IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHFDPRDVVSNVNVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIIRTLT(SEQ ID NO:12)。
在某些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代Q74N、L80V、R81T、L85V、I86V、I92F和Q126T。在某些实施方案中、IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHVTPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:13)。
在多个实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N,L80V、R81T、L85V、I86V和I92F。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHVTPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCQSIISTLT(SEQ ID NO:14)。
在多个实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N,L80V、R81T、L85V、I86V、I92F、和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHVTPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:15)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N,L80V、R81T、L85V、I86V、I92F、Q126T、和S130R。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHVTPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIIRTLT(SEQ ID NO:16)。
在某些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代Q74H、L80F、R81D、L85V、I86V、I92F和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAHSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:17)。
在多个实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74H、L80F、R81D、L85V、I86V和I92F。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAHSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCQSIISTLT(SEQ ID NO:18)。
在一个示例性的实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74H、L80F、R81D、L85V、I86V、I92F、和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAHSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:19)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74H、L80F、R81D、L85V、I86V、I92F、Q126T、和S130R。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLAHSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIIRTLT(SEQ ID NO:20)。
在某些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代Q74S、L80F、R81D、L85V、I86V、I92F和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLASSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:21)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74S、L80F、R81D、L85V、I86V和I92F。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLASSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCQSIISTLT(SEQ ID NO:22)。
在多个实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74S、L80F、R81D、L85V、I86V、I92F、和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLASSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:23)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74S、L80F、R81D、L85V、I86V、I92F、Q126T、和S130R。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLASSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIIRTLT(SEQ ID NO:24)。
在某些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代Q74N、L80F、R81D、L85V、I86V、I92F和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:25)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N、L80F、R81D、L85V、I86V和I92F。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCQSIISTLT(SEQ ID NO:26)。
在多个实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N、L80F、R81D、L85V、I86V、I92F、和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:27)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74N、L80F、R81D、L85V、I86V、I92F、Q126T、和S130R。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLANSKNFHFDPRDVVSNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIIRTLT(SEQ ID NO:28)。
在某些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代Q74S、R81T、L85V、I92F和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLLLDLQMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLASSKNFHLTPRDVISNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:29)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22E、Q74S、R81T、L85V、和I92F。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLASSKNFHLTPRDVISNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCQSIISTLT(SEQ ID NO:30)。
在某些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22S、Q74H、R81T、L85V、I92F、和Q126T。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLASSKNFHLTPRDVISNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIISTLT(SEQ ID NO:31)。
在一些实施方案中,与野生型人IL-2相比,对IL-2Rβ具有更大的结合亲和力和对IL-2Rγc受体具有降低的结合亲和力的主题IL-2突变蛋白包括氨基酸取代L18R、Q22S、Q74H、R81T、L85V、I92F、Q126T、和S130R。在某些实施方案中,IL-2突变蛋白具有氨基酸序列:
APTSSSTKKTQLQLEHLRLDLEMILNGINNYKNPKLTRMLTFKFYMPKKATELKHLQCLEEELKPLEEVLNLASSKNFHLTPRDVISNINVFVLELKGSETTFMCEYADETATIVEFLNRWITFCTSIIRTLT(SEQ ID NO:32)。
在多个实施方案中,主题IL-2突变蛋白具有根据下式的氨基酸序列:
A-P-T-S-S-S-T-K-K-T-Q-L-Q-L-E-H-L-(X1)n-L-D-L-(X2)n--M-(X3)n--L-N-G-I-N-N-Y-K-N-P-K-L-T-R-M-L-T-F-K-F-Y-M-P-K-K-A-T-E-L-K-H-L-Q-C-L-E-E-E-L-K-(X4)n--L-E-E-V-L-N-L-A-(X5)n--S-K-N-F-H-(X6)n-(X7)n--P-R-D-(X8)n--(X9)n--S-N-(X10)n--N-V-(X11)n--(X12)n--L-E-L-K-G-S-E-T-T-F-M-C-E-Y-A-D-E-T-A-T-I-V-E-F-L-N-RW-I-T-F-C-(X13)n--S-I-I-(X14)n--T-L-T,其中:
每个n单独选自0或1;
X1是L(野生型)或R;
X2是Q(野生型)或E;
X3是I(野生型)或V;
X4是P(野生型)或H;
X5是Q(野生型),R,H,N或S;
X6是L(野生型),F或V;
X7是R(野生型),I,T或D;
X8是L(野生型)或V;
X9是I(野生型)或V;
X10是I(野生型)或V;
X11是I(野生型)或F;
X12是V(野生型)或I;
X13是A(野生型)或T;并且
X14是S(野生型)或R。(SEQ ID NO:50)。
在根据SEQ ID NO:50的IL-2突变蛋白的某些实施方案中,至少在X1、X2、X3、X4、X5、X6、X7、X8、X9、X10、X11、X12、X13或X14之一处的氨基酸不是野生型氨基酸。在一些实施方案中,至少在X1、X2、X3、X4、X5、X6、X7、X8、X9、X10、X11、X12、X13或X14的2、3、4、5、6、7、8、9、10、11、12、13、或14处的氨基酸不是野生型氨基酸。在一些实施方案中,IL-2突变蛋白与SEQ ID NO:50的IL-2突变蛋白具有至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同源性。
在一些实施方案中,作为部分激动剂的主题IL-2突变蛋白与野生型IL-2相比具有一种或多种降低的功能。
在某些实施方案中,IL-2突变蛋白具有降低的刺激依赖于IL-2Rβ/IL-2Rγc异二聚化的一种或多种信号传导途径的能力。在一些实施方案中,与野生型hIL-2相比,主题IL-2突变蛋白具有降低的刺激IL-2Rβ+细胞中的STAT5磷酸化的能力。在一些实施方案中,IL-2突变蛋白以野生型IL-2刺激相同细胞中的STAT5磷酸化的水平的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更小的水平刺激IL-2Rβ+细胞中的STAT5磷酸化。在一些实施方案中,IL-2Rβ+细胞是T细胞。在具体实施方案中,T细胞是CD8+T细胞。在一些实施方案中,CD8+T细胞是新鲜分离的CD8+T细胞。在其它实施方案中,CD8+T细胞T细胞是活化的CD8+T细胞。在其它实施方案中,IL-2Rβ+细胞是天然杀伤(NK)细胞。
在一些实施方案中,与野生型hIL-2相比,突变蛋白具有降低的刺激IL-2Rβ+细胞中的ERK1/ERK2信号传导的能力。在一些实施方案中,IL-2突变蛋白以野生型IL-2刺激相同细胞中的pERK1/ERK2信号传导的水平的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更小的水平刺激IL-2Rβ+细胞中的pERK1/ERK2信号传导。在一些实施方案中,IL-2Rβ+细胞是T细胞。在具体的实施方案中,所述T细胞是CD8+T细胞。在一些实施方案中,CD8+T细胞是新鲜分离的CD8+T细胞。在其它实施方案中,CD8+T细胞T细胞是活化的CD8+T细胞。在其它实施方案中,IL-2Rβ+细胞是天然杀伤(NK)细胞。
可以使用本领域已知的任何合适的方法,例如通过STAT5和ERK1/2的磷酸化来测量STAT5和ERK1/2信号传导。例如,可以使用对这些分子的磷酸化形式特异的抗体结合如本文中所述的流式细胞术分析来测量STAT5和ERK1/2磷酸化。
在一些实施方案中,与野生型hIL-2相比,突变蛋白具有降低的刺激IL-2Rβ+细胞中的PI 3激酶信号传导的能力。在一些实施方案中,IL-2突变蛋白以野生型IL-2刺激相同细胞中的PI 3激酶信号传导的水平的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更小的水平刺激IL-2Rβ+细胞中的PI 3激酶信号传导。在一些实施方案中,IL-2Rβ+细胞是T细胞。在具体实施方案中,T细胞是CD8+T细胞。在一些实施方案中,CD8+T细胞T细胞是活化的CD8+T细胞。在其它实施方案中,IL-2Rβ+细胞是天然杀伤(NK)细胞。
PI 3-激酶信号传导可以使用本领域已知的任何合适的方法来测量。例如,可以使用对磷酸-S6核糖体蛋白特异性的抗体结合如本文中所述的流式细胞术分析来测量PI 3-激酶信号传导。
在某些实施方案中,与野生型IL-2相比,突变蛋白具有降低的诱导淋巴细胞增殖的能力。在一些实施方案中,淋巴细胞是T细胞。在具体实施方案中,淋巴细胞是原代CD8+T细胞。在其它实施方案中,淋巴细胞是活化的CD8+T细胞。可以使用本领域已知的任何合适的方法测量细胞增殖。例如,可以使用羧基荧光素二乙酸琥珀酰亚胺二酯(CFSE)稀释测定或通过[3H]-胸苷掺入来测量淋巴细胞增殖,如本文中所述。在一些实施方案中,IL-2突变蛋白以野生型IL-2诱导淋巴细胞增殖的水平的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更小的水平诱导淋巴细胞增殖。
在一些实施方案中,与野生型IL-2相比,IL-2突变蛋白具有降低的活化淋巴细胞中的IL-2Rα表达的能力。在一些实施方案中,IL-2突变蛋白以野生型IL-2活化相同细胞中的IL-2Rα表达的水平的1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更小的水平活化淋巴细胞中的IL-2Rα表达。在一些实施方案中,淋巴细胞是CD8+T细胞。在一些实施方案中,CD8+T细胞是新鲜分离的CD8+T细胞。在其它实施方案中,CD8+T细胞是活化的CD8+T细胞。
不受任何特定运行理论束缚,认为展现出增强的IL-2Rβ结合和降低的IL-2Rγc的IL-2突变蛋白可以作为显性阴性IL-2拮抗剂用作功能并且干扰一种或多种IL-2依赖性功能。此类拮抗剂通过干扰IL-2与IL-2Rβ的结合而用作功能,同时也抑制IL-2Rβ/IL-2Rγc异二聚化。此外,由于IL-15信号传导通过IL-2Rβ/IL-2Rγc受体结合用作功能,认为此类IL-2突变蛋白也可以用作IL-15拮抗剂的功能。在某些实施方案中,IL-2突变蛋白抑制一种或多种IL-2和/或IL-15功能。
在一些实施方案中,抑制一种或多种IL-2和/或IL-15功能的IL-2突变蛋白包括在根据野生型hIL-2编号的氨基酸位置18、22和126处的氨基酸取代。在一些实施方案中,IL-2突变蛋白的氨基酸取代包括根据野生型hIL-2编号的L18R、Q22E和Q126T。
在一些实施方案中,抑制一种或多种IL-2和/或IL-15功能的IL-2突变蛋白包括在根据野生型hIL-2编号的氨基酸位置18、22、126和130处的氨基酸取代。在一些实施方案中,IL-2突变蛋白的氨基酸取代包括根据野生型hIL-2编号的L18R、Q22E、Q126T和S130R。
在某些实施方案中,突变蛋白是CD8+T细胞中IL-2和/或IL-15STAT5磷酸化的抑制剂。在一些实施方案中,突变蛋白是IL-2和/或IL-15诱导的CD8+T细胞增殖的抑制剂。在一些实施方案中,突变蛋白是IL-2依赖性的TCR诱导的细胞增殖的抑制剂。
IL-2促进Th1、Th9和Treg T细胞分化并抑制Th17分化。因此,不受任何特定运行理论束缚,认为用作IL-2拮抗剂功能的IL-2突变蛋白能够抑制Th1、Th9和/或Treg细胞分化或促进Th17细胞分化。在一些实施方案中,IL-2突变蛋白是IL-2依赖性Th1、Th9和/或Treg分化的抑制剂。在某些实施方案中,突变蛋白是Th17分化的促进剂。
在某些实施方案中,突变蛋白是天然杀伤(NK)细胞的IL-2依赖性活化的抑制剂。可以通过本领域已知的任何合适的方法测量NK细胞的IL-2活化,例如通过测量IL-2诱导的CD69表达和/或细胞毒性,如本文所述。
IL-2突变蛋白的重组表达、表达载体和宿主细胞
在多个实施方案中,用于本发明实践中的多肽是合成的,或通过重组核酸分子的表达产生。在多肽是嵌合体(例如,至少含有突变体IL-2多肽和异源多肽的融合蛋白)的情况下,其可以由杂合核酸分子编码,所述杂合核酸分子含有编码突变体IL-2的全部或部分的一个序列和编码异源多肽的全部或部分的第二序列。例如,本文中所述的主题IL-2突变蛋白可以与六组氨酸标签融合以促进细菌表达的蛋白质的纯化,或与血凝素标签融合,以促进在真核细胞中表达的蛋白质的纯化。
用于构建编码IL-2突变蛋白的DNA序列并在适当转化的宿主中表达那些序列的方法包括但不限于使用PCR辅助的诱变技术。也可以用标准重组技术制备由对IL-2多肽缺失或添加氨基酸残基组成的突变。在缺失或添加的情况下,编码IL-2的核酸分子任选地用合适的限制性内切核酸酶消化。所得的片段可以直接表达或通过例如将其连接到第二片段进一步操作。如果核酸分子的两个末端包含彼此重叠的互补核苷酸,则可以促进连接,但是也可以连接平末端片段。PCR产生的核酸也可用于产生各种突变体序列。
完整的氨基酸序列可用于构建反向翻译的基因。可以合成含有编码IL-2突变蛋白的核苷酸序列的DNA寡聚物。例如,可以合成编码期望的多肽的部分的几个小寡核苷酸,然后连接。单个寡核苷酸通常含有用于互补组装的5’或3’突出端。
除了通过表达已经通过重组分子生物学技术改变的核酸分子产生突变多肽外,可以化学合成主题IL-2突变蛋白。化学合成的多肽由本领域技术人员常规产生。
一旦组装(通过合成,定点诱变或另一种方法),会将编码IL-2突变蛋白的DNA序列插入表达载体中,并且可操作地连接到适于在期望的转化宿主中表达IL-2突变蛋白的表达控制序列。可以通过核苷酸测序,限制性作图和在合适的宿主中表达生物活性多肽确认正确的装配。如本领域中公知,为了在宿主中获得转染基因的高表达水平,基因必须可操作地连接到在所选的表达宿主中有功能的转录和翻译表达控制序列。
编码IL-2突变蛋白的DNA序列(无论是通过定点诱变,化学合成或其它方法制备)还可以包括编码信号序列的DNA序列。如果存在的话,此类信号序列应当是被选择用于IL-2突变蛋白表达的细胞识别的信号序列。它可以是原核的,真核的或两者的组合。它也可以是天然IL-2的信号序列。信号序列的包含取决于是否期望从制备它的重组细胞分泌IL-2突变蛋白。如果选择的细胞是原核的,那么通常优选DNA序列不编码信号序列。如果选择的细胞是真核的,那么通常优选编码信号序列,最优选使用野生型IL-2信号序列。
IL-2突变蛋白融合蛋白
如上所述,示例性主题IL-2突变蛋白可以制备为包括主题IL-2突变蛋白和异源多肽(即,多肽,其不是IL-2的多肽或其突变体)的融合或嵌合多肽(参见例如美国专利号6,451,308)。示例性异源多肽可以增加嵌合多肽在体内的循环半衰期,并且因此可以进一步增强突变体IL-2多肽的性质。在多个实施方案中,增加循环半衰期的多肽可以是血清白蛋白,例如人血清白蛋白,或缺少IgG重链可变区的抗体的IgG亚类的Fc区的。示例性的Fc区可以包括抑制补体固定和Fc受体结合的突变,或者它可以是裂解的,即能够结合补体或通过另一种机制,如抗体依赖性补体裂解(ADCC;USSN 08/355,502 1994年12月12日提交)裂解细胞。
“Fc区”可以是与通过用木瓜蛋白酶消化IgG产生的IgG C末端结构域同源的天然存在的或合成的多肽。IgG Fc具有约50kDa的分子量。突变体IL-2多肽可以包括整个Fc区,或保留延长其作为其中一部分的嵌合多肽的循环半衰期的能力的较小部分。此外,全长或片段化Fc区可以是野生型分子的变体。也就是说,它们可以含有可以影响或可以不影响多肽功能的突变;如下文进一步描述的,在所有情况下天然活性不是必需的或期望的。在某些实施方案中,IL-2突变蛋白融合蛋白(例如,如本文中所述的IL-2部分激动剂或拮抗剂)包括IgG1、IgG2、IgG3或IgG4Fc区。
Fc区可以是“裂解性”或“非裂解性”,但通常是非裂解性的。非裂解性Fc区通常缺少高亲和力Fc受体结合位点和C′1q结合位点。鼠IgG Fc的高亲和力Fc受体结合位点包括IgG Fc的位置235处的Leu残基。因此,可以通过突变或缺失Leu 235来破坏Fc受体结合位点。例如,Glu取代Leu 235抑制Fc区结合高亲和力Fc受体的能力。通过突变或缺失IgG的Glu 318、Lys 320和Lys 322残基,可以功能性破坏鼠C″1q结合位点。例如,Ala残基取代Glu 318,Lys 320和Lys 322使得IgG1 Fc不能指导抗体依赖性补体裂解。相比之下,裂解性IgG Fc区具有高亲和力Fc受体结合位点和C′1q结合位点。高亲和力Fc受体结合位点包括IgG Fc的235位的Leu残基,并且C′1q结合位点包括IgG1的Glu 318、Lys 320和Lys 322残基。裂解性IgG Fc在这些位点处具有野生型残基或保守氨基酸取代。裂解性IgG Fc可以靶向细胞,用于抗体依赖性细胞毒性或补体指导性细胞溶解(CDC)。人IgG的适当突变也是已知的(参见例如Morrison等人,The Immunologist 2:119-124,1994;和Brekke等人,The Immunologist 2:125,1994)。
在其它实施方案中,嵌合多肽可以包括主题IL-2突变蛋白和用作抗原性标签功能的多肽,如FLAG序列。FLAG序列通过如本文中所述的生物素化的、高度特异性的抗FLAG抗体识别(还参见Blanar等人,Science 256:1014,1992;LeClair等人,Proc.Natl.Acad.Sci.USA 89:8145,1992)。在一些实施方案中,嵌合多肽还包含C-末端c-myc表位标签。
在其它实施方案中,嵌合多肽包括突变体IL-2多肽和异源多肽,其用作功能以增强突变体IL-2多肽的表达或指导突变体IL-2多肽的细胞定位,如Aga2p凝集素亚基(参见例如Boder和Wittrup,Nature Biotechnol.15:553-7,1997)。
在其它实施方案中,可以产生包含突变体IL-2和抗体或其抗原结合部分的嵌合多肽。嵌合蛋白的抗体或抗原结合组分可以充当靶向部分。例如,其可以用于将嵌合蛋白定位到细胞或靶分子的特定子集。产生细胞因子-抗体嵌合多肽的方法描述于例如美国专利号6,617,135。
编码突变体IL-2的核酸分子
在一些实施方案中,单独或作为嵌合多肽(如上文所述的那些)的一部分的主题IL-2突变蛋白可通过核酸分子的表达获得。正如IL-2突变蛋白可以根据其与野生型IL-2多肽的同一性描述一样,编码它们的核酸分子将必然与编码野生型IL-2的核酸分子具有某种同一性。例如,编码主题IL-2突变蛋白的核酸分子可以与编码野生型IL-2的核酸(例如,SEQ ID NO:2)是至少50%、至少65%、优选至少75%、更优选至少85%且最优选至少95%(例如99%)相同的。
提供的核酸分子可以包含天然存在的序列,或与天然存在的序列不同,但由于遗传密码的简并性,编码相同多肽的序列。这些核酸分子可以由RNA或DNA(例如,基因组DNA、cDNA或合成DNA,如通过基于亚磷酰胺的合成产生)或这些类型的核酸内的核苷酸的组合或修饰组成。此外,核酸分子可以是双链或单链(即,有义链或反义链)。
核酸分子不限于编码多肽的序列;也可以包括位于编码序列(例如,IL-2的编码序列)上游或下游的一些或所有非编码序列。分子生物学领域的普通技术人员熟悉用于分离核酸分子的常规程序。它们可以例如通过用限制性内切核酸酶处理基因组DNA或通过进行聚合酶链反应(PCR)产生。在核酸分子是核糖核酸(RNA)的情况下,可以例如通过体外转录产生分子。
本公开的示例性分离的核酸分子可以包括在天然状态下本身找不到的片段。因此,本公开涵盖重组分子,例如其中核酸序列(例如,编码突变体IL-2的序列)掺入载体(例如质粒或病毒载体)或异源细胞的基因组(或同源细胞的基因组,在除天然染色体位置以外的位置)中的那些重组分子。
如上所述,主题IL-2突变蛋白可以作为嵌合多肽的一部分存在。除了上述异源多肽之外或代替上述异源多肽,主题核酸分子可以含有编码“标志物”或“报告物”的序列。标志物或报告物基因的实例包括β-内酰胺酶,氯霉素乙酰转移酶(CAT)、腺苷脱氨酶(ADA)、氨基糖苷磷酸转移酶(neor,G418r)、二氢叶酸还原酶(DHFR)、潮霉素-B-磷酸转移酶(hygromycin-B-hosphotransferase,HPH)、胸苷激酶(TK)、lacz(编码β-半乳糖苷酶)和黄嘌呤鸟嘌呤磷酸核糖基转移酶(XGPRT)。本领域技术人员将意识到另外的有用试剂,例如,可以充当标志物或报告物功能的另外的序列。
可以通过将突变引入从任何生物细胞(如哺乳动物的细胞)获得的编码IL-2的DNA中获得主题核酸分子。因此,主题核酸(及它们编码的多肽)可以是小鼠、大鼠、豚鼠、牛、绵羊、马、猪、兔、猴、狒狒、狗或猫的核酸。在一个实施方案中,核酸分子是人的核酸分子。
突变体IL-2基因产物的表达
上述核酸分子可以包含在能够指导其在例如已经用载体转导的细胞中表达的载体内。因此,除了主题IL-2突变蛋白之外,包含编码主题IL-2突变蛋白的核酸分子的表达载体和用这些载体转染的细胞在优选的实施方案中。
当然应该理解,不是所有的载体和表达控制序列都能同样好地发挥功能以表达本文中所述的DNA序列。在相同表达系统下,所有宿主也不会同样好地发挥作用。然而,本领域技术人员可以在这些载体,表达控制序列和宿主中进行选择而无需过多的实验。例如,在选择载体中,必须考虑宿主,因为载体必须在其中复制。还应考虑载体的拷贝数,控制该拷贝数的能力和由载体编码的任何其它蛋白质,如抗生素标志物的表达。例如,可以使用的载体包括允许编码IL-2突变蛋白的DNA以拷贝数扩增的载体。此类可扩增载体是本领域中公知的。它们包括例如能够通过DHFR扩增(参见例如Kaufman,美国专利号4,470,461,Kaufman和Sharp,“Construction of a Modular Dihydrafolate Reductase cDNA Gene:Analysis of Signals Utilized for Efficient Expression”,Mol.Cell.Biol.,2,第1304-19页(1982))或谷氨酰胺合成酶(“GS”)扩增(参见例如美国专利号5,122,464和欧洲公开申请338,841)扩增的载体。
在一些实施方案中,本公开的人IL-2突变蛋白将从载体,优选表达载体表达。载体可用于宿主细胞中的自主复制,或可以在引入宿主细胞中后整合到宿主细胞的基因组中,从而与宿主基因组一起复制(例如,非附加体哺乳动物载体)。表达载体能够指导与它们可操作地连接的编码序列的表达。通常,在重组DNA技术中有用的表达载体通常是质粒(载体)的形式。然而,也包括其它形式的表达载体,如病毒载体(例如,复制缺陷型逆转录病毒,腺病毒和腺伴随病毒)。
示例性重组表达载体可以包括可操作地连接到待表达的核酸序列的一个或多个调节序列,其基于待用于表达的宿主细胞选择。
可以设计表达构建体或载体以在原核或真核宿主细胞中表达IL-2突变蛋白或其变体。
可以通过常规转化或转染技术将载体DNA引入原核或真核细胞中。用于转化或转染宿主细胞的合适方法可见于Sambrook等人(1989)Molecular Cloning:A Laboratory Manual(第二版,Cold Spring Harbor Laboratory Press,Plainview,N.Y.)和其它标准分子生物学实验室手册。
蛋白质在原核生物中的表达最经常在具有含有组成性或诱导型启动子的载体的大肠埃希氏菌(Escherichia coli)中进行。在大肠埃希氏菌中最大化重组蛋白表达的策略可以参见例如Gottesman(1990)于Gene Expression Technology:Methods in Enzymology 185(Academic Press,San Diego,Calif.),第119-128页和Wada等人(1992)Nucleic Acids Res.20:2111-2118。用于从细胞培养,收获,破坏或提取IL-2突变蛋白或其变体的方法基本上描述于例如美国专利号4,604,377;4,738,927;4,656,132;4,569,790;4,748,234;4,530,787;4,572,798;4,748,234;和4,931,543,其全部内容通过引用的方式并入本文。
在一些实施方案中,也可以在真核生物,如酵母或人细胞中制备重组IL-2突变蛋白或其生物活性变体。合适的真核宿主细胞包括昆虫细胞(可用于在培养的昆虫细胞(例如Sf9细胞)中表达蛋白质的杆状病毒载体的实例包括pAc系列(Smith等人(1983)Mol.Cell Biol.3:2156-2165)和pVL系列(Lucklow和Summers(1989)Virology 170:31-39));酵母细胞(用于在酵母酿酒酵母(S.cerenvisiae)中表达的载体的实例包括pYepSec1(Baldari等人(1987)EMBO J.6:229-234),pMFa(Kurjan和Herskowitz(1982)Cell 30:933-943),pJRY88(Schultz等人(1987)Gene 54:113-123)、pYES2(Invitrogen Corporation,San Diego,Calif.)和pPicZ(Invitrogen Corporation,San Diego,Calif.));或哺乳动物细胞(哺乳动物表达载体包括pCDM8(Seed(1987)Nature 329:840)和pMT2PC(Kaufman等人(1987)EMBO J.6:187:195))。合适的哺乳动物细胞包括中国仓鼠卵巢细胞(CHO)或COS细胞。在哺乳动物细胞中,表达载体的控制功能通常由病毒调节元件提供。例如,常用的启动子源自多瘤,腺病毒2,巨细胞病毒和猿猴病毒40。对于原核和真核细胞两者的其它合适的表达系统,参见Sambrook等人(1989)Molecular Cloning:A Laboratory Manual(第二版,Cold Spring Harbor Laboratory Press,Plainview,N.Y.)的第16和17章。参见Goeddel(1990)于Gene Expression Technology:Methods in Enzymology 185(Academic Press,San Diego,Calif.)。
可以优化编码本公开的人IL-2突变蛋白的序列以在感兴趣的宿主细胞中表达。可以将序列的G-C含量调整至给定细胞宿主的平均水平,如通过参考在宿主细胞中表达的已知基因计算。用于密码子优化的方法是本领域中公知的。可以优化IL-2突变蛋白编码序列内的密码子以增强宿主细胞中的表达,使得已经优化编码序列内的约1%,约5%、约10%、约25%、约50%、约75%或高达100%的密码子以在特定宿主细胞中表达。
适合使用的载体包括用于细菌中的基于T7的载体(参见例如Rosenberg等人,Gene 56:125,1987),用于哺乳动物细胞中的pMSXND表达载体(Lee和Nathans,J.Biol.Chem.263:3521,1988),和用于昆虫细胞中的杆状病毒衍生的载体(例如,表达载体pBacPAK9,来自Clontech,Palo Alto,Calif.)。
在一些实施方案中,编码此类载体中的主题IL-2突变蛋白的核酸插入物可以与启动子可操作地连接,所述启动子基于例如在其中寻求表达的细胞类型来选择。
在选择表达控制序列中,还应考虑多种因素。这些包括例如序列的相对强度、其可控性以及其与编码主题IL-2突变蛋白的实际DNA序列的相容性,特别是关于潜在的二级结构而言。宿主应该通过考虑它们与选择的载体的相容性,由本发明的DNA序列编码的产物的毒性,它们的分泌特征,它们正确折叠多肽的能力,它们的发酵或培养需求以及纯化由DNA序列编码的产物的容易性选择。
在这些参数内,本领域技术人员可以选择各种载体/表达控制序列/宿主组合,其将在发酵上或在大规模动物培养(例如使用CHO细胞或COS 7细胞)中表达期望的DNA序列。
在一些实施方案中,表达控制序列和表达载体的选择将取决于宿主的选择。可以使用多种表达宿主/载体组合。用于真核宿主的有用的表达载体包括例如具有来自SV40,牛乳头瘤病毒,腺病毒和巨细胞病毒的表达控制序列的载体。用于细菌宿主的有用的表达载体包括已知的细菌质粒,例如来自大肠埃希氏菌的质粒,包括col E1、pCRI、pER32z、pMB9及其衍生物,更宽的宿主范围的质粒,例如RP4,噬菌体DNA,例如,噬菌体λ(例如NM989)和其它DNA噬菌体(例如M13和丝状单链DNA噬菌体)的许多衍生物。用于酵母细胞的有用的表达载体包括2μ质粒及其衍生物。用于昆虫细胞的有用载体包括pVL 941和pFastBacTM 1(GibcoBRL,Gaithersburg,Md.)。Cate等人,“Isolation Of The Bovine And Human Genes For Mullerian Inhibiting Substance And Expression Of The Human Gene In Animal Cells”,Cell,45,第685-98页(1986)。
此外,在这些载体中可以使用极其多种表达控制序列中的任一种。此类有用的表达控制序列包括与前述表达载体的结构基因相关的表达控制序列。有用的表达控制序列的实例包括例如SV40或腺病毒的早期和晚期启动子,lac系统,trp系统,TAC或TRC系统,噬菌体λ的主要操纵基因和启动子区,例如PL,fd外壳蛋白的控制区,3-磷酸甘油酸激酶或其它糖酵解酶的启动子,酸性磷酸酶的启动子(例如PhoA),酵母a-交配系统的启动子,杆状病毒的多角体启动子和已知控制原核或真核细胞或其病毒的基因表达的其它序列,及其各种组合。
T7启动子可以用于细菌,多角体蛋白启动子可以用于昆虫细胞,并且巨细胞病毒或金属硫蛋白启动子可以用于哺乳动物细胞。此外,在高等真核生物的情况下,组织特异性和细胞类型特异性启动子是可广泛可用的。这些启动子因其指导核酸分子在体内给定组织或细胞类型中表达的能力而命名。技术人员熟知许多启动子和可用于指导核酸表达的其它调节元件。
除了促进插入的核酸分子转录的序列之外,载体可以含有复制起点和编码选择标志物的其它基因。例如,新霉素抗性(neor)基因对表达其的细胞赋予G418抗性,并且因此允许转染细胞的表型选择。本领域技术人员可以容易地确定给定的调节元件或选择标志物是否适合于在特定的实验背景中使用。
可以用于本发明的病毒载体包括例如逆转录病毒,腺病毒和腺伴随载体,疱疹病毒,猿猴病毒40(SV40)和牛乳头瘤病毒载体(参见例如Gluzman(编),Eukaryotic Viral Vectors,CSH Laboratory Press,Cold Spring Harbor,N.Y.)。
含有并表达编码本文公开的主题IL-2突变蛋白的核酸分子的原核或真核细胞也是本发明的特征。本发明的细胞是转染的细胞,即通过重组DNA技术引入核酸分子,例如编码突变体IL-2多肽的核酸分子的细胞。也认为此类细胞的后代在本发明的范围内。
表达系统的精确组分不是至关重要的。例如,可以在原核宿主,如细菌大肠埃希氏菌中,或在真核宿主,如昆虫细胞(例如Sf21细胞)或哺乳动物细胞(例如COS细胞、NIH 3T3细胞或HeLa细胞)中产生IL-2突变蛋白。这些细胞可从许多来源获得,包括美国典型培养物保藏中心(Manassas,Va.)。在选择表达系统中,重要的仅是组件彼此相容。技术人员或普通技术能够做出此类确定。此外,如果在选择表达系统中需要指导,那么熟练技术人员可以查阅Ausubel等人(Current Protocols in Molecular Biology,John Wiley and Sons,New York,N.Y.,1993)和Pouwels等人(Cloning Vectors:A Laboratory Manual,1985增刊1987)。
表达的多肽可以使用常规生物化学程序从表达系统中纯化,并且可以用作例如如本文中所述的治疗剂。
在一些实施方案中,根据用于产生突变蛋白的宿主生物体,获得的IL-2突变蛋白将是糖基化的或未糖基化的。如果选择细菌作为宿主,那么产生的IL-2突变蛋白将是未糖基化的。另一方面,真核细胞将糖基化IL-2突变蛋白,尽管可能不以与天然IL-2被糖基化相同的方式。由转化的宿主产生的IL-2突变蛋白可以根据任何合适的方法纯化。已知用于纯化IL-2的各种方法。参见,例如,Current Protocols in Protein Science,第2卷.John E.Coligan,Ben M.Dunn,Hidde L.Ploehg,David W.Speicher,Paul T.Wingfield编,Unit 6.5(Copyright 1997,John Wiley and Sons,Inc.)。可以使用阳离子交换,凝胶过滤和或反相液相色谱从在大肠埃希氏菌中产生的包含体中,或从产生给定突变蛋白的哺乳动物或酵母培养物的条件化培养基中分离IL-2突变蛋白。
构建编码IL-2突变蛋白的DNA序列的另一个示例性方法是通过化学合成。这包括通过编码展现出所述特性的IL-2突变蛋白的蛋白质序列的化学手段直接合成肽。该方法可以在影响IL-2与IL-2Rα,IL-2Rβ和/或IL-2Rγ的相互作用的位置处掺入天然和非天然氨基酸两者。或者,编码期望的IL-2突变蛋白的基因可以通过使用寡核苷酸合成仪的化学手段合成。此类寡核苷酸基于期望的IL-2突变蛋白的氨基酸序列设计,并且优选地选择在会产生重组突变蛋白的宿主细胞中有利的那些密码子。在这方面,公认的是遗传密码是简并的:氨基酸可以由超过一个密码子编码。例如,Phe(F)由两个密码子TIC或TTT编码,Tyr(Y)由TAC或TAT编码,并且his(H)由CAC或CAT编码。Trp(W)由单一密码子TGG编码。因此,应当理解,对于编码特定IL-2突变蛋白的给定DNA序列,将存在许多将编码该IL-2突变蛋白的DNA简并序列。例如,应当理解,除了图2中所示的突变蛋白5-2的优选DNA序列之外,还会有许多编码所示的IL-2突变蛋白的简并DNA序列。认为这些简并DNA序列在本公开的范围内。因此,本发明上下文中的“其简并变体”意指编码特定突变蛋白并因此实现特定突变蛋白表达的所有DNA序列。
可以通过本领域中已知的任何合适的方法测定IL-2突变蛋白的生物活性。此类测定包括PHA母细胞(PHA-blast)增殖和NK细胞增殖。
治疗方法
在一些实施方案中,可以向受试者施用主题IL-2突变蛋白和/或表达它们的核酸,以治疗与异常凋亡或分化过程有关的病症(例如细胞增殖性病症或细胞分化疾病,如癌症,例如通过产生主动或被动免疫)。在治疗此类疾病中,公开的IL-2突变蛋白可以拥有有利的性质,如降低的血管渗漏综合征。
细胞增殖性和/或分化性病症的实例包括癌症(例如癌、肉瘤、转移性病症或造血赘生性病症,例如白血病)。转移性肿瘤可以源自大量原发性肿瘤类型,包括但不限于前列腺、结肠、肺、乳腺和肝的那些。本发明的组合物(例如突变体IL-2多肽和/或编码它们的核酸分子)也可以施用给具有病毒感染(例如AIDS或流感)的患者。
突变体IL-2多肽可以用于治疗具有,怀疑具有或可以有风险形成任何类型的癌症(包括肾癌或黑素瘤)或任何病毒性疾病的患者。示例性的癌包括从宫颈、肺、前列腺、乳房、头和颈、结肠和卵巢的组织形成的那些。该术语还包括癌肉瘤,其包括由癌性和肉瘤组织组成的恶性肿瘤。
增殖性病症的其它实例包括造血赘生性病症。
增殖性和/或分化性病症的其它实例包括皮肤病症。皮肤病症可涉及真皮,表皮或下皮层中的细胞或细胞组或层的异常活性,或真皮-表皮连接处的异常。例如,皮肤病症可以涉及角化细胞(例如,过度增殖基底和立即上基质角质形成细胞),黑素细胞,朗格汉斯(Langerhans)细胞,梅克尔(Merkel)细胞,免疫细胞和在一个或多个表皮层(例如基底层(生发层)、棘层、颗粒层、透明层或角质层)中发现的其它细胞的异常活性。在其它实施方案中,病症可涉及真皮细胞,例如真皮层(例如乳头层或网状层)中发现的真皮内皮,成纤维细胞,免疫细胞(例如,肥大细胞或巨噬细胞)的异常活性。
皮肤病症的实例包括银屑病、银屑病关节炎、皮炎(湿疹)(例如剥脱性皮炎或特应性皮炎)、毛发红糠疹、玫瑰糠疹(pityriasis rosacea)、红斑痤疮、副银屑病、苔癣样糠疹(pityriasis lichenoider)、扁平苔癣(lichen planus)、光泽苔藓、鱼鳞病样皮肤病、角皮病(keratodermas)、皮肤病、斑秃、坏疽性脓皮病、白癜风、类天疱疮(例如眼瘢痕性类天疱疮或大疱性类天疱疮)、,荨麻疹、汗孔角化病(prokeratosis)、涉及关节囊内衬的上皮相关细胞的过度增殖和炎症的类风湿性关节炎;皮炎,如溢脂性皮炎和日光皮炎;角化病如脂溢性角化病、老年角化病、光线性角化病、光诱发的角化病(photo-induced keratosis)和毛囊角化病(keratosis follicularis);寻常痤疮;瘢痕疙瘩和预防瘢痕疙瘩形成;痣;疣,包括疣、湿疣(condyloma)或尖锐湿疣,以及人乳头瘤病毒(HPV)感染,如性病疣(venereal wart);白斑;扁平苔藓;和角膜炎。皮肤病症可以是皮炎,例如特应性皮炎或过敏性皮炎,或银屑病。
适于治疗的患者也可具有银屑病。术语“银屑病”旨在具有其医学含义,即主要累及皮肤并产生凸起的,增厚的,鳞屑的,不留疤痕的损害的疾病。病变通常是被重叠的有光泽的鳞屑覆盖的尖锐分界的红斑丘疹(erythematous papules)。鳞屑通常是银色或微乳白色。经常发生指甲损害,导致凹陷性病斑(pitting)、指甲分离、增厚和变色。银屑病有时与关节炎相关,并且它可以是有严重后果的。角质形成细胞的过度增殖是银屑病表皮增生以及表皮炎症和角化细胞分化减少的关键特征。已经调用多种机制来解释表征银屑病的角化细胞过度增殖。无序的细胞免疫也牵涉银屑病的发病机制。银屑病病症的实例包括慢性静止性银屑病(chronic stationary psoriasis),寻常性银屑病,发疹性(滴状)银屑病,银屑病性红皮病,泛发性脓疱性银屑病(Von Zumbusch),脓疱性环状银屑病和局部脓疱性银屑病。
或者,或除了直接施用于患者的方法之外,在一些实施方案中,突变体IL-2多肽可以用于离体方法。例如,可以在培养基中体外培养细胞(例如,从患者分离并且置于或维持在培养物中的外周血淋巴细胞或纯化的淋巴细胞群体),并且接触步骤可以通过将IL-2突变体加入到培养基影响。培养步骤可以包括其它步骤,其中用其它作用剂刺激或处理细胞,例如以刺激增殖,或扩增与感兴趣的抗原(例如癌抗原或病毒抗原)反应的细胞群。然后,在已经治疗患者后对患者施用细胞。
在某些实施方案中,用作本文中所述的IL-2拮抗剂的主题IL-2突变蛋白可用于治疗其中抑制一种或多种IL-2和/或IL-15依赖性功能有用的一种或多种状况。在某些实施方案中,本文中所述的IL-2突变蛋白拮抗剂用于治疗其中抑制IL-2Rβ/IL-2Rγ异二聚化和下游信号传导有用的一种或多种疾病或病症(例如GVDH或白血病)。
在一个实施方案中,治疗方法用于治疗移植物抗宿主病(GVHD)。在一些实施方案中,治疗包括对具有GVHD的受试者施用治疗有效量的作为IL-2拮抗剂的IL-2突变蛋白的步骤。已知IL-2和IL-15促成GVHD((Ferrara等人,Journal of Immunology 137:1874(1986);和Blaser等人,Blood 105:894(2005))。因此,不受任何具体运行理论约束,认为本文中所述的IL-2拮抗剂可用于治疗GVHD。在一个实施方案中,用于治疗GVHD的IL-2突变蛋白包括与野生型IL-2相比降低其与IL-2Rγc受体的结合的一个或多个突变(例如,降低IL-2Rγc受体结合的任一种突变,如本文中描述)。在一些实施方案中,降低IL-2Rγc受体结合亲和力的突变包括氨基酸取代L18R、Q22E、Q126T和S130R。在一些实施方案中,进一步具有降低的IL-2Rγc受体结合亲和力的IL-2突变蛋白进一步包括与野生型IL-2相比增加IL-2突变蛋白对IL-2Rβ的结合亲和力的一个或多个氨基酸突变(例如,如本文所述,增加IL-2Rβ结合的任一种突变)。在一些实施方案中,IL-2突变蛋白进一步包括氨基酸取代L80F、R81D、L85V、I86V和I92F。在一些实施方案中,IL-2突变蛋白包括氨基酸取代L18R、Q22E、L80F、R81D、L85V、Q126T、S130R、I86V和I92F。
在另一个实施方案中,治疗方法用于治疗IL-2和/或IL-15介导的白血病。在具体实施方案中,白血病是成人T细胞白血病(ATL)。ATL的特征在于CD4+T细胞的恶性扩增,其展现出牵涉IL-2和IL-15的自分泌信号以及IL-9的旁分泌信号的早期生长阶段。此类细胞因子依赖性增殖在患有慢性和郁积型,但不是急性ATL的患者中是明显的。因此,不受任何特定的运行理论束缚,认为IL-2部分激动剂和拮抗剂可以用于治疗白血病的此类形式。在一些实施方案中,治疗包括对患有成人T细胞白血病的受试者施用治疗有效量的作为IL-2拮抗剂的IL-2突变蛋白的步骤。在一些实施方案中,患者患有慢性和郁积型ATL。在一个实施方案中,用于治疗ATL的IL-2突变蛋白包括与野生型IL-2相比降低其与IL-2Rγc受体结合的一个或多个突变(例如,降低IL-2Rγc受体结合的任一种突变,如本文中所述)。在一些实施方案中,降低IL-2Rγc受体结合亲和力的突变包括氨基酸取代L18R、Q22E、Q126T和S130R。在一些实施方案中,进一步具有降低的IL-2Rγc受体结合亲和力的IL-2突变蛋白进一步包括与野生型IL-2相比增加IL-2突变蛋白对IL-2Rβ的结合亲和力的一个或多个氨基酸突变(例如,增加IL-2Rβ结合的任一种突变,如本文中所述)。在一些实施方案中,IL-2突变蛋白进一步包括氨基酸取代L80F、R81D、L85V、I86V和I92F。在一些实施方案中,IL-2突变蛋白包括氨基酸取代L18R、Q22E、L80F、R81D、L85V、Q126T、S130R、I86V和I92F。
药物组合物和施用方法
在一些实施方案中,主题IL-2突变蛋白和核酸可以掺入组合物(包括药物组合物)中。此类组合物通常包括多肽或核酸分子和药学可接受载体。
将药物组合物配制成与其意图的给药途径相容。本发明的突变体IL-2多肽可以口服给予,但更可能将通过肠胃外途径施用它们。肠胃外施用途径的实例包括例如静脉内、皮内、皮下、经皮(局部)、经粘膜和直肠施用。用于肠胃外应用的溶液或悬浮液可以包括以下组分:无菌稀释剂,如注射用水、盐水溶液、不挥发性油、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗细菌剂如苄醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或亚硫酸氢钠;螯合剂如乙二胺四乙酸;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐和用于调节张力的作用剂,如氯化钠或右旋糖。可以用酸或碱,如磷酸二氢钠和/或磷酸氢二钠、盐酸或氢氧化钠调节pH(例如,至约7.2-7.8的pH,例如7.5)。胃肠外制剂可以封装在由玻璃或塑料制成的安瓿,一次性注射器或多剂量小瓶中。
适合于可注射使用的药物组合物包括无菌水溶液(在水溶性的情况下)或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水、Cremophor ELTM.(BASF,Parsippany,N.J.)或磷酸盐缓冲盐水(PBS)。在所有情况下,组合物应当是无菌的,并且在存在容易的可注射性的程度上应当是流体的。它在制造和储存条件下应该是稳定的,并且必须针对微生物,如细菌和真菌的污染作用进行防腐。载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)及其合适的混合物的溶剂或分散介质。可以例如通过使用涂层材料,如卵磷脂,通过在分散体的情况下维持所需的粒度以及通过使用表面活性剂,如十二烷基硫酸钠维持适当的流动性。通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、酚、抗坏血酸、硫柳汞等,可以实现防止微生物的作用。在许多情况下,优选在组合物中包含等张剂,例如糖、多元醇(如甘露醇、山梨醇)、氯化钠。可注射组合物的延长吸收可通过在组合物中包括延迟吸收的作用剂(例如单硬脂酸铝和明胶)来实现。
无菌可注射溶液可以通过将所需量的活性化合物掺入根据需要具有上文列举的成分中的一种或组合的合适溶剂中,然后过滤灭菌来制备。通常,通过将活性化合物掺入无菌媒介物中制备分散体,所述无菌媒介物包含基础分散介质和来自上文列举的那些的需要的其它成分。在用于制备无菌注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其产生活性成分加上来自其先前无菌过滤的溶液的任何另外的需要成分的粉末。
口服组合物(如果使用的话)通常包括惰性稀释剂或可食用载体。为了口服治疗施用的目的,活性化合物可以与赋形剂一起掺入并以片剂、锭剂或胶囊剂,如明胶胶囊的形式使用。口服组合物也可以使用流体载体制备,用作漱口剂。可以包括药学相容粘合剂和/或辅助材料作为组合物的一部分。片剂、丸剂、胶囊、锭剂等可以含有任何下列成分或类似性质的化合物:粘合剂,如微晶纤维素、黄蓍胶或明胶;赋形剂如淀粉或乳糖,崩解剂如藻酸,PrimogelTM或玉米淀粉;润滑剂如硬脂酸镁或SterotesTM;助流剂如胶体二氧化硅;甜味剂如蔗糖或糖精;或调味剂,如薄荷、水杨酸甲酯或橙味调味剂。
在通过吸入施用的情况下,从含有合适的推进剂,例如气体如二氧化碳的加压容器或分配器,或雾化器以气溶胶喷雾的形式递送主题IL-2突变蛋白或编码它们的核酸。此类方法包括在美国专利号6,468,798中描述的那些方法。
也可以通过经粘膜或透皮手段进行主题IL-2突变蛋白或核酸的系统施用。对于经粘膜或经皮施用,在配制剂中使用适合于待渗透的屏障的渗透剂。此类渗透剂通常是本领域中已知的,并且包括例如用于经粘膜施用的去污剂,胆汁盐和夫西地酸衍生物。可以通过使用鼻喷雾或栓剂实现经粘膜施用。对于透皮施用,将活性化合物配制成软膏剂、软膏(salve)、凝胶或乳膏,如本领域中通常已知。
在一些实施方案中,也可以以栓剂(例如,使用常规栓剂基质,如可可脂和其它甘油酯)或保留灌肠剂的形式制备化合物(突变体IL-2多肽或核酸)以进行直肠递送。
在一些实施方案中,也可以通过使用本领域中已知的方法转染或感染施用化合物(主题IL-2突变蛋白或核酸),所述方法包括但不限于McCaffrey等人(Nature 418:6893,2002),Xia等人(Nature Biotechnol.20:1006-1010,2002),或Putnam(Am.J.Health Syst.Pharm.53:151-160,1996,勘误表于Am.J.Health Syst.Pharm.53:325,1996)中描述的方法。
在一个实施方案中,用将保护突变体IL-2多肽免于从体内快速消除的载体制备主题IL-2突变蛋白或核酸,如受控释放配制剂,包括植入物和微囊化递送系统。可以使用可生物降解的生物相容性聚合物,如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。可以使用标准技术制备此类配制剂。材料还可以从Alza Corporation和Nova Pharmaceuticals,Inc.商购获得。脂质体悬浮液(包括用针对病毒抗原的单克隆抗体靶向到受感染的细胞的脂质体)也可以用作药学可接受载体。这些可以根据本领域技术人员已知的方法制备,例如,美国专利号4,522,811。
可以通过细胞培养物或实验动物中的标准药学程序确定此类主题IL-2突变蛋白或核酸化合物的剂量、毒性和治疗功效,例如用于测定LD50(对50%群体致死的剂量)和ED50(在50%的群体中治疗有效的剂量)。毒性和治疗效果之间的剂量比率是治疗指数,并且其可以表示为比率LD50/ED50。展现出高治疗指数的化合物是优选的。虽然可以使用展现出毒性副作用的化合物,但是应当注意设计将此类化合物靶向受影响组织的部位的递送系统,以便使对未感染的细胞的潜在损害最小化,从而减少副作用。
从细胞培养测定和动物研究获得的数据可以用于配制用于人的剂量范围。此类化合物的剂量优选位于包括ED50的循环浓度范围内,具有很少的毒性或没有毒性。剂量可以在此范围内变化,这取决于所使用的剂型和所使用的施用途径。对于本发明方法中使用的任何化合物,治疗有效剂量可以最初从细胞培养测定中估计。可以在动物模型中配制剂量以达到循环血浆浓度范围,其包括如在细胞培养物中测定的IC50(即达到症状的半最大抑制的测试化合物的浓度)。此类信息可以用于更准确地确定人体中的有用剂量。可以例如通过高效液相色谱测量血浆中的水平。
如本文中所定义,主题IL-2突变蛋白的治疗有效量(即有效剂量)取决于选择的多肽。例如,可以施用在约0.001至0.1mg/kg患者体重范围内的单剂量;在一些实施方案中,可以施用约0.005,0.01,0.05mg/kg。在一些实施方案中,施用600,000IU/kg(IU可以通过淋巴细胞增殖生物测定确定,并且以国际单位(IU)表示,如由世界卫生组织白介素-2(人)的第一国际标准建立)。剂量可以类似于但预期小于规定的剂量。组合物可以每天一次或多次至每周一次或多次施用一次;包括每隔一天一次。熟练技术人员将理解,某些因素可以影响有效治疗受试者所需的剂量和时机,包括但不限于疾病或病症的严重性、先前的治疗、受试者的一般健康和/或年龄以及存在的其它疾病。此外,用治疗有效量的主题IL-2突变蛋白治疗受试者可以包括单一治疗或可以包括一系列治疗。在一个实施方案中,每8小时施用组合物达5天,接着2-14天的休息期,例如9天,然后每8小时再施用5天。
药物组合物可与施用说明书一起包括在容器,包装或分配器中。
提供以下实施例以描述本文中提供的本发明的某些实施方案,且不应解释为限制。
实施例
实施例1:酵母表面上的IL-2的功能性表达
尽管先前已经在噬菌体上展示了IL-2(Buchli等人,Arch.Biochem.Biophys.339:79-841997),但是现有系统不适于定向进化,因此不适合于获得具有改善的对IL-2R亚基的结合的IL-2突变体。为了克服这点,在酵母细胞的表面上表达IL-2。将人IL-2DNA克隆到酵母展示载体pCT302中。用pCT302_IL-2载体转化酿酒酵母(Saccharomyces cerevisiae)菌株EBY100,并在SD-CAA平板上于30℃下生长3天。将IL-2酵母的单个菌落在30℃下在SD-CAA中生长过夜,然后在20℃下在SGCAA中引入2天。在生物素化的γ存在下,用四聚化的生物素化的IL-2Rβ、生物素化的γ或生物素化的IL-2Rβ对酵母进行染色。将IL-2Rβ和γ的胞外域进行C端生物素化并偶联至藻红蛋白-缀合的链霉亲和素,以用作染色和分选试剂。通过在冰上将2μM生物素化的IL-2Rβ与470nM链霉亲和素-藻红蛋白(SA-PE,Invitrogen)一起孵育15分钟来形成IL-2Rβ四聚体。这些受体“四聚体”增强了低亲和力单体胞外域(ECD)与IL-2的相互作用的亲合力,使得能够从文库中最大回收IL-2变体。类似溶液野生型IL-2,酵母-展示的IL-2较弱地结合至单独的IL-2Rβ,不结合至单独的γ,但在IL-2Rβ的存在下的确结合至γ,如通过流式细胞术所示的对角线染色证明(数据未显示)。因此,酵母-展示的IL-2概括了用可溶性IL-2看到的细胞上的异二聚体受体复合物的协同装配,并且因此适合作为文库选择的平台。
实施例2:IL-2突变体文库的构建和筛选
第一代体外策略是创建整个IL-2基因的易错PCR文库。第一代突变IL-2文库如下构建。使用 II随机诱变试剂盒按照制造商的说明书使野生型人白介素-2(IL-2)经受易错诱变。以下引物用于易错PCR:5’-GCACCTACTTCAAGTTCTAC-3’(“IL-2_errprone_for)和5’-GCCACCAGAGGATCC-3’(“IL-2_errprone_rev)。然后,使用以下引物扩增易错PCR反应的产物:5’AGTGGTGGTGGTGGTTCTGGTGGTGGTGGTTCTGGTGGTGGTGGTTCTGCTAGCGCACCTACTTCAAGTTCTAC-3’(SEQ ID NO:33)和5’ACACTGTTGTTATCAGATCTCGAGCAAGTCTTCTTCGGAGATAAGCTTTTGTTCGCCACCAGAGGATCC-3’(SEQ ID NO:34),得到约130μg的DNA。用限制酶NheI和BamHI双重消化酵母展示载体pCT302,并凝胶纯化。将IL-2DNA和pCT302DNA以5:1μg比率与电感受态EBY100酵母混合在一起。将酵母电穿孔以促进文库DNA进入酵母中。将此电穿孔重复约20次,得到1x108个转化体的最终文库大小。
第一代IL-2文库的选择:使文库经受针对IL-2Rβ的六轮选择(图2A)。在第一轮中,用470nM四聚体IL-2Rβ标记文库,所述四聚体IL-2Rβ通过混合2μM生物素化的IL-2Rβ与470nM链霉亲和素-藻红蛋白缀合物(SAV-PE)15分钟而形成。将文库与IL-2Rβ一起孵育1.5小时、用PBS-BSA缓冲液(磷酸盐缓冲盐水+牛血清白蛋白)洗涤,并且在4℃下与Miltenyi抗PE微珠孵育20分钟。再次洗涤细胞,并流过磁性柱用于选择。将此选择方法再连续重复5次,变化仅在于IL-2Rβ浓度中(第2轮-1μM,第3轮-1μM,第4轮-300nM,第5轮-300nM,第6轮-100nM,所有单体IL-2Rβ)。在选择结束后,将第5轮和第6轮酵母培养物铺在SD-CAA平板上,这产生单独的酵母菌落。测试18个所得的酵母菌落与500nM IL-2Rβ的结合。从这18个酵母菌落中分离的IL-2DNA进行测序。相对于野生型IL-2中的相应残基,这18个酵母菌落中的氨基酸差异显示在表1中。
表1
第二代IL-2文库的文库构建:基于高百分比的含有L85V的克隆,构建了主要聚焦于疏水核心残基的第二IL-2文库。构建了定点IL-2文库,其具有在Q74、L80、R81、L85、I86、I89、I92、V93处的突变。使得Q74以H/K/N/Q/R/S变化。使得R81用NNK简并密码子在所有20种氨基酸中变化,其中N表示为腺嘌呤、胸腺嘧啶、鸟嘌呤和胞嘧啶核苷酸各自的25%混合物,并且K为鸟嘌呤或胸腺嘧啶。使得剩余的残基以F/I/L/V变化。使用以下寡聚物通过装配PCR构建文库:
IL-2_affmat_ass01
GCACCTACTTCAAGTTCTACAAAGAAAACACAGCTACAACTGGAGCA(SEQ ID NO:35)
IL-2_affmat_ass02
CAAAATCATCTGTAAATCCAGAAGTAAATGCTCCAGTTGTAGCTGTG(SEQ ID NO:36)
IL-2_affmat_ass03
GGATTTACAGATGATTTTGAATGGAATTAATAATTACAAGAATCCCA(SEQ ID NO:37)
IL-2_affmat_ass04B
AACTTAGCTGTGAGCATCCTGGTGAGTTTGGGATTCTTGTAATTATT(SEQ ID NO:38)
IL-2_affmat_ass05B
GGATGCTCACAGCTAAGTTTTACATGCCCAAGAAGGCCACAGAACTG(SEQ ID NO:39)
IL-2_affmat_ass06
GTTCTTCTTCTAGACACTGAAGATGTTTCAGTTCTGTGGCCTTCTTG(SEQ ID NO:40)
IL-2_affmat_ass07
CAGTGTCTAGAAGAAGAACTCAAACCTCTGGAGGAAGTGCTAAATTTA(SEQ ID NO:41
IL-2_affmat_ass08GTGAAAGTTTTTGCTSYKAGCTAAATTTAGCACTTCCTCC(SEQ ID NO:42)
IL-2_affmat_ass09
AGCAAAAACTTTCACNTCNNKCCCAGGGACNTCNTCAGCAATNTCAACGTANTCNTCCTGGAACTAAAGGGATC(SEQ ID NO:43)
IL-2_affmat_ass10
CATCAGCATATTCACACATGAATGTTGTTTCAGATCCCTTTAGTTCCAG(SEQ ID NO:44)
IL-2_affmat_ass11
ATGTGTGAATATGCTGATGAGACAGCAACCATTGTAGAATTTCTGAACA(SEQ ID NO:45)
IL-2_affmat_ass12
AGATGATGCTTTGACAAAAGGTAATCCATCTGTTCAGAAATTCTACAAT(SEQ ID NO:46)
IL-2_affmat_ass13TTTTGTCAAAGCATCATCTCAACACTAACTGGATCCTCTGGTGGC(SEQ ID NO:47)
用以下寡聚物扩增定点PCR:
PCR扩增寡聚物(包括50bp同源性)
dL-2_site2_assFor:
5’-
AGTGGTGGTGGTGGTTCTGGTGGTGGTGGTTCTGGTGGTGGTGGTTCTGCTAGCGCACCTACTTCAAGTTCTAC-3’(SEQ ID NO:48)
IL-2_site2_assRev:
5’-
ACACTGTTGTTATCAGATCTCGAGCAAGTCTTCTTCGGAGATAAGCTTTTGTTCGCCACCAGAGGATCC-3’(SEQ ID NO:49)
PCR产生40μg DNA,将其与双重消化的pCT302和电感受态EBY100酵母混合,并如用第一代文库一样电穿孔。
第二代IL-2文库的选择:使文库经受针对IL-2Rβ的五轮选择(图2B)。与用第一代文库完全一样进行此选择方法,只是对使用的IL-2Rβ的浓度进行修改(第1轮-1μM,第2轮-100nM,第3轮-30nM,第4轮-30nM,第5轮-10nM,所有单体IL-2Rβ)。在选择结束后,将第4轮和第5轮酵母培养物铺在SD-CAA平板上,这产生单独的酵母菌落。来自这两轮的48个单独的酵母克隆在96孔板块形式中培养,并且通过用5nM IL-2Rβ、然后用SAV-PE标记进行筛选。筛选产生了对IL-2Rβ的7种高亲和力结合剂(图3和表2)。相对于野生型IL-2中的相应残基在这7种高亲和力结合剂间的氨基酸差异与对IL-2Rβ的结合亲和力一起显示在表2中。
表2
实施例3:IL-2突变蛋白蛋白表达和纯化
将人IL-2变体(氨基酸1-133)、IL-2Rβ胞外域(氨基酸1-214)和γc(氨基酸34-232)与N-末端gp67信号序列和C-末端六组氨酸标签以读码框的方式克隆到pAcGP67-A载体(BD Biosciences)中,并使用杆状病毒表达系统产生。通过在SF900II培养基(Invitrogen)中生长的草地贪夜蛾(Spodoptera frugiperda,Sf9)细胞中的转染和扩增来制备杆状病毒储液,并且在 Insect XPRESSTM培养基(Lonza)中生长的悬浮液粉纹夜蛾(Trichoplusia ni)(High FiveTM)细胞中进行蛋白质表达。蛋白质被表达,并且在48-60小时后通过镍琼脂糖(QIAGEN)从HighFiveTM上清液中捕获、浓缩并通过在10mM HEPES(pH 7.2)和150mM NaCl中平衡的SuperdexTM200柱(GE Healthcare)上的尺寸排阻色谱纯化。表达完全糖基化在SPR和基于细胞的测定中使用的IL-2变体。对于生物素化受体表达,将IL-2Rβ和γc克隆到具有C-末端生物素受体肽(BAP)-LNDIFEAQKIEWHE和六组氨酸标签的pAcGP67-A载体中。在过量生物素(100uM)的情况下共表达受体蛋白与BirA连接酶。
实施例4:CD25-和CD25+天然杀伤(YT-1)细胞的刺激
将YT-1和CD25+YT-1细胞在补充有10%胎牛血清、2mM L-谷氨酰胺、最低非必需氨基酸、丙酮酸钠、25mM HEPES和青霉素-链霉素(Gibco)的RPMI 1640培养基中培养。如下纯化CD25+YT-1细胞:用FACS缓冲液(磷酸盐缓冲盐水+2%牛血清白蛋白)洗涤1x 107个细胞,并用1mL FACS缓冲液中的PE-缀合的抗人CD25(1:20;Biolegend,San Diego,CA)于4℃下染色20分钟。用偶联至抗-PEIgG的顺磁性微珠标记染色的细胞,并根据制造商的说明书(Miltenyi Biotec,Bergisch Gladbach,Germany)用LS分离柱分离。将洗脱的细胞以1x105个细胞的浓度重悬于完全RPMI培养基中,并扩增用于随后的实验。经由使用 C6流式细胞仪的具有FL-2通道的流式细胞术监测细胞的富集。
通过用流式细胞术测定STAT5磷酸化来测定YT-1细胞上的H9、D10和6-6的剂量-响应关系(图4A和4B)。用FACS缓冲液洗涤CD25+或CD25-YT-1细胞,并重悬于96孔板中的200μL具有指定浓度的野生型、6-6、H9或D10的FACS缓冲液内。在室温下刺激细胞20分钟,然后通过添加甲醛至1.5%固定,并孵育10分钟。用100%冰冷的甲醇在冰上透化细胞20分钟,然后在-80℃孵育过夜。将固定的、透化的细胞用过量的FACS缓冲液洗涤,并与在FACS缓冲液中以1:20稀释的50μL Alexa647缀合的抗STAT5 pY694(BD Biosciences,San Jose,CA)孵育20分钟。将细胞在FACS缓冲液中洗涤两次,并使用 C6流式细胞仪以FL-4通道测定平均细胞荧光。
通过利用IL-2的充分表征的突变,即第42位的苯丙氨酸突变到丙氨酸(F42A)进一步测试了IL-2突变蛋白(所谓的“超级-2”分子)的CD25非依赖性,所述突变消除对CD25的结合但不影响其结合至IL-2Rβ或IL-2Rγ的能力(Mott,1995)。也将此突变引入H9突变蛋白中,产生H9F42A。在CD25-和CD25+YT-1细胞上通过IL-2、IL-2F42A、H9和H9F42A的STAT诱导进行比较(图5)。尽管IL-2F42A突变使CD25+细胞上的野生型IL-2的剂量响应曲线右移约1个对数,但F42A突变对CD25-细胞上的STAT诱导没有可观察到的影响(图5A)。相比之下,H9和H9F42A的剂量响应曲线在CD25-和CD25+细胞上基本上重叠(图5B)。因此,这些实验证明,虽然IL-2突变蛋白不明显受益于CD25的存在,但它们的活性对破坏CD25界面的突变不敏感。
实施例5:CD25-和CD25+T细胞的刺激
分别使用经抗体包被的CD4T细胞分离磁珠(Stem Cell Technologies and Miltenyi Biotec)从PBMC(Stanford Blood Bank)和BALB/C小鼠的脾和淋巴结制备人和小鼠CD4T细胞。对于首次用于试验的细胞刺激测定,立即使用细胞。为了产生体外‘有经历的’T细胞,在用碳酸氢盐缓冲液(pH 9.6)中的二抗(Vector Labs)预包被孔,然后用100ng/mL的抗CD3(对于人类为OKT3,对于小鼠为2C11,eBiosciences)包被板。用可溶性抗CD28以0.1x106个细胞/孔接种T细胞(对于人为CD28.2,对于小鼠为37.51,eBiosciences)。将细胞在完全TCR刺激下培养3天,然后在条件化培养基中静置2天,并且在新鲜培养基中静置2天。在使用前,通过Lympholyte-M(Cederlane)离心收集活细胞并计数。
评估IL-2突变蛋白对缺乏CD25表达或经表达的CD25的T细胞的活性(图6)。在1ng/ml至1000ng/ml的蛋白质浓度范围在STAT5磷酸化方面,测定野生型IL-2和6种IL-2突变蛋白的剂量响应关系。IL-2突变蛋白刺激CD25缺陷T细胞中的STAT5磷酸化的能力与其对IL-2Rβ的亲和力高度相关。由IL-2突变蛋白引起的STAT5磷酸化的增加比IL-2大两个数量级。
还评估了IL-2突变蛋白刺激有经历的人CD4+T细胞上的STAT5磷酸化的能力(图7),所述细胞表达大量完全IL-2受体复合物,CD25(IL-2Rα)、IL-2Rβ和γc。体外TCR刺激人CD4T细胞并静置以产生‘有经历的’人CD4+CD25+T淋巴细胞。在1ng/mL时,几乎没有观察到STAT5磷酸化的差异。每种IL-2变体(包括野生型)刺激超过90%的细胞。在0.1ng/mL下,观察到小的差异。野生型IL-2导致48%pSTAT5刺激,并且IL-2突变蛋白产生65-79%的pSTAT5刺激。因此,IL-2突变蛋白明显比野生型IL-2更好地刺激有经历的人T细胞,但是增强不如在缺乏CD25的细胞上一样明显
实施例6:NK细胞细胞毒性测定
使用EGFR(内皮生长因子受体)-表达鳞状肿瘤细胞系(SCC6)和EGFR单克隆抗体西妥昔单抗评估了D10IL-2突变蛋白对天然杀伤细胞功能,特别是自发和抗体依赖性细胞介导的细胞毒性(ADCC)的影响。人EGFR阳性鳞状细胞癌细胞系SCC6作为礼物从J.Sunwoo实验室(Stanford,CA)获得。在补充有10%热灭活的FCS(HyClone Laboratories)、100U/mL青霉素和100μg/mL链霉素(均来自Invitrogen Life Technologies)的DMEM/F12培养基(Invitrogen Life Technologies)中培养SCC6细胞系。在37℃下在5%CO2中在培养物中粘附生长细胞。西妥昔单抗(小鼠嵌合IgG1抗人表皮生长因子受体-EGFR;IMC-C225;)获自Bristol-Myers Squibb。
如下进行铬释放:从含有约1x109个细胞的健康供体白细胞-减少的系统(LRS)产物中分离NK细胞。通过根据制造商的说明书使用NK细胞分离珠(Miltenyi Biotec)进行阴性磁性细胞分选来分离NK细胞。评估NK细胞的纯度(如通过CD3-CD56+流式细胞术定义的>90%纯度)。用150μCi51Cr/1x106个细胞标记SCC6靶细胞2小时。在将纯化的NK细胞以0∶1、1∶1和5∶1的可变的效应子∶靶细胞比率51Cr标记的SCC6细胞在单独的培养基、西妥昔单抗(100pg/mL)、IL-2(1000IU/mL)、IL-2D10(1pg/mL)、IL-2D10(10pg/mL)、或包括西妥昔单抗(100pg/mL)+IL-2(1000IU/mL)、西妥昔单抗(100pg/mL)+IL-2D10(1pg/mL)或西妥昔单抗(100pg/mL)+IL-2D10(10pg/mL)的组合中培养5小时后测定裂解百分比。一式三份进行测定。在存在或缺乏可变浓度的西妥昔单抗、IL-2或IL-2D10的情况下,用51Cr标记的SCC6细胞培养纯化的NK细胞。NK细胞自发细胞毒性的D10刺激优于高剂量IL-2(图8,*p=.008,**p=.001),在没有IL-2或D10刺激的情况下具有最小的自发细胞毒性。与单独的高剂量IL-2或西妥昔单抗相比,类似地通过D10刺激增加西妥昔单抗结合的SCC6的ADCC(*p=.0005,**p=.0001)。值得注意的是,与高剂量IL-2相比,用D10在所有效应子∶靶物比率(包括1∶1)下发生细胞毒性(自发和ADCC两者)更优的功能性增强。
实施例7:IL-2突变蛋白在对抑制子-类型T细胞(Treg)的相对低刺激的情况下导致增强的记忆表型扩增
在体内评估IL-2突变蛋白H9对表达低水平CD25但高水平IL-2Rβγ的记忆表型CD8+T细胞的扩增的效能。C57B1/6小鼠接受PBS、20μg IL-2、20μg H9或1.5μg IL-2/抗IL-2单克隆抗体复合物,并通过流式细胞术评估脾CD3+CD4+CD44高记忆表型T细胞的总细胞计数。制备脾细胞悬液,并且用荧光染料-缀合的单克隆抗体CD3(克隆145-2C11,eBioscience)、CD4(克隆RM4-5,Caltag Laboratories)、CD8a(克隆53-6.7,BD Biosciences)、CD25(克隆PC61,BD Biosciences)、CD44(克隆IM7,eBioscience)NK1.1(克隆PK136,BD Biosciences)和Thy1.1(克隆HIS51,eBioscience)染色。使用BD FACSCantoTM II流式细胞仪获得至少100,000个活细胞,并使用FlowJo软件(TriStar,Inc.)分析。如图10A所示,相对于其它治疗形式,用公开的IL-2突变蛋白处理导致记忆表型T细胞的更大的扩增,且CD3+CD4+CD25高T细胞调节T细胞的扩增有限(图10B)。
实施例8:IL-2突变蛋白的降低的体内毒性
已知IL-2治疗可以导致严重的副作用,如急性肺水肿,其是目前阻止更有效使用IL-2的限制。因此,评估了公开的IL-2突变蛋白相对于IL-2的毒性(图11A)。C57B1/6小鼠每天接受PBS,20μg IL-2、20μg H9或1.5μg IL-2/抗-IL-2单克隆抗体复合物的腹膜内注射达连续5天。在过继性细胞转移后6天,取出肺,并在58℃下在真空下干燥过夜之前和之后称重。通过从脱水后肺重量减去初始肺重量计算肺湿重。
实施例9:IL-2突变蛋白的增加的体内抗肿瘤活性
在体内测试公开的IL-2突变蛋白对肿瘤细胞的效能。将100μl RPMI中的106个B16F10黑素瘤细胞注射到小鼠背部的上部真皮中(每组3-4只小鼠)。处理由PBS、20μg IL-2、20μg H9或1.5μg IL-2/抗IL-2单克隆抗体复合物(IL-2/mAb)的每日5次注射组成,并在肿瘤结节在约15mm2的大小时清楚可见并且可触知后一天开始。公开的IL-2突变蛋白导致增强的体内抗肿瘤活性,如图11B中表明。
实施例10:IL-2突变蛋白和IL-2的结构比较
重组表达几种IL-2突变蛋白以便通过表面等离子体共振(SPR)测量它们对IL-2Rβ的结合亲和力和动力学。IL-2至IL-2Rβ的亲和力为KD=280nM。IL-2突变蛋白聚簇成低、中和高亲和力类别。低亲和力IL-2突变蛋白(5-2和6-6)分别以50至70nM的KD结合IL-2Rβ,从野生型IL-2的4-6倍的亲和力增加几乎完全通过L85V取代。从二级定点文库选择的中和高亲和力突变体分别具有10-15nM(C5,H4)和1.2-1.7nM(B1,D10,E10,G8,H9)的KD。以解离速率的降低一致表现亲和力增加,并且高亲和力IL-2突变蛋白在L80F/R81D/L85V/I86V/I92F的随机化位置中含有共有序列。
为了理解IL-2突变蛋白的结构结果,将D10突变蛋白以及结合到IL-2Rβ和γc的D10的三级复合物结晶。在单独的D10的结构中,6个突变中的5个在不与IL-2Rβ接触的位置中聚簇在B-C环上和C螺旋核心内。值得注意的是,B-C螺旋接头区域与该区域部分或完全无序的其它IL-2结构相比在电子密度图中是良好排序的(图9)。总的来说,F80、V85和V86取代似乎塌陷成疏水簇,其稳定环并将C螺旋‘钉’到分子的核心中,从而相对于螺旋B堆积。H74和D81突变是溶剂暴露的,并且因此,它们的结构作用是不太清楚的,然而Asp是可以进一步有助于螺旋C结构的公知的螺旋N-加帽残基。6个共有突变中仅一个I92F位于与受体复合物中的IL-2Rβ接触的位置。Phe92深深插入C和A螺旋之间,与Ile92相比仅有助于复合物中被IL-2Rβ掩埋的分子表面的另外因此,其IL-2Rβ接触可能仅对D10的总体约300倍亲和力增加产生较小的贡献。
还测定了D10三级受体复合物的低分辨率结构以评估突变是否已经扰乱IL-2Rβ/γc受体对接几何学。将D10和IL-2Rβ的稳定三级复合物结晶,并在缺乏CD25的情况下纯化。在D10三级复合物中的总体IL-2Rβ/γc异二聚体构造和细胞因子/IL-2Rβ接触模式基本上与先前报道的四级装配体相同。因此,超级-2的效能增加不是由于受体二聚体构造的结构变化导致的,而是可能是由于亲和力增强导致的。
如较早讨论,IL-2的C-螺旋似乎在结合至IL-2Rα后经历微妙的复位(repositioning),如在二级和四级复合物两者中看到的。相比之下,在PDB数据库中的三种野生型无配体结构的检查揭示了C-螺旋位置的可变性,与该螺旋中相对于分子的其余部分的更高B因子一致。进行D10的结构与无配体的IL-2,和受体复合物中的IL-2的结构的比较。观察到D10中的C螺旋比游离形式更类似于在IL-2的两种受体结合的构象中看到的,已经经历上移并进入螺旋核中。
使用分子动力学(MD)模拟询问IL-2突变蛋白被赋予对IL-2Rβ的更高的结合亲和力的机制。构建原子上详细的马尔可夫状态模型(Markov state model,MSM)以直接探测IL-2对IL-2突变蛋白的相对构象柔性。此MSM中的状态来自由原子论模拟产生的快速相互转换构象的动力学聚簇。这些亚稳状态中的每一个对应于潜在的自由能量图景中的局部最小值,其最终确定系统的结构和动力学。MSM的分析表明IL-2突变蛋白可以比IL-2更稳定,并且IL-2比IL-2突变蛋白访问几乎多两倍的簇。例如,与IL-2的约0.05相比,IL-2突变蛋白填充状态具有约0.20的平衡概率。与IL-2相比,螺旋B、B-C环和螺旋C在IL-2突变蛋白中是刚性化的。由于进化突变位于B-C环(H74,D81)上,并且在B和C螺旋堆积界面(F80,V85,V86)内,两个螺旋(不仅仅是螺旋C)受益于突变并且经历共同的稳定化。F92似乎起螺旋C和螺旋A之间的分子楔的作用,在螺旋的更为C末端起额外的稳定化影响的作用。MD模拟暗示螺旋B也在超级-2中经历稳定化是一个惊喜,因为这从IL-2晶体结构的比较是不明显的。IL-2Rα主要在B螺旋和D螺旋的部分上结合至IL-2。MD模拟表明IL-2Rα与IL-2的结合可以使螺旋B刚性化的可能性,并且这种结构稳定化可以传播到B-C环和螺旋C。原则上,类似于IL-2突变蛋白中的进化突变的表观效应。
来自每种蛋白质的模拟的最高填充的构象的可视化显示,螺旋C在IL-2中比在IL-2突变蛋白中远更有柔性,并且IL-2突变蛋白中的突变也确实稳定受体结合样构象。
实施例11:部分IL-2激动剂和拮抗剂
先前开发了由于增强的对IL-2Rβ的结合亲和力而具有提升作用的IL-2“超级因子”(Levin等人,Nature 484:529(2012))。假设此高亲和力超级因子/IL-2Rβ复合物可以充当显性阴性支架以创建“受体信号传导夹”,从而阻断内源信号传导。这些超级IL-2“完全激动剂”减少与γc的结合的定向突变将减弱IL-2Rβ-γc异二聚化并且代表新一类的基于机制的IL-2部分激动剂和非信号传导(中性)分子,所述分子通过阻断内源性细胞因子并且自身不施加作用而功能性地用作拮抗剂(参见图1中的示意图)。
基于IL-2-IL-2R晶体结构,鉴定了IL-2-γc界面处的四个关键残基(图12A),并且产生了H9变体,每个H9变体含有一个(Q126T)、两个(L18R,Q22E)、三个(L18R、Q22E和Q126T)或四个(L18R、Q22E、Q126T和S130R)突变(分别表示为H9-T、H9-RE、H9-RET和H9-RETR,基于新引入的氨基酸)。通过表面等离子体共振,重组H9和H9-RET蛋白质对IL-2Rβ具有相似的亲和力。然而,尽管H9-IL-2Rβ复合物有效地结合γc(图12B),但H9-RET-IL-2Rβ不然(图12C)。
为了测定H9变体的活性,纯化NK样YT-1细胞的CD25+和CD25-亚-群,并定量信号传导。H9突变体表现为IL-2部分激动剂,产生从STAT5的磷酸化的野生型Emax(最大可能效应)水平的约90%下降到约10%的信号传导功效的范围(图13A),其中每种类似物的活性的水平与γc界面处的突变程度负相关。信号传导效能相对独立于IL-2Rα,如通过CD25+(图13B)对比CD25-(图13C)YT-1细胞上的H9-RET和H9-RETR的相对Emax值证明,表明了改变的对IL-2Rβ和γc的结合主要负责H9变体的行为。
H9-RET和H9-RETR也展现其它IL-2信号传导途径的减少的诱导,包括CD25+YT-1细胞中的pERK1/ERK2(图14A)。由于受体内化是信号传导中的关键事件,还评估了响应于IL-2变体的YT-1细胞中的IL-2Rβ和IL-2Rγ的表面表达。与IL-2和H9一样,H9-RET和H9-RETR两者都驱动快速和完全的IL-2Rβ内化(图13B),但是这些部分激动剂在促进γc的内化方面效率低得多(图13C),这与它们对γc的结合降低一致。因此,可变地破坏H9的γc-结合界面可以产生多种IL-2部分激动剂,潜在地具有广泛的一大批信号传导功效。
接下来,分析这些分子在原代细胞中的效果。确定H9-RET和H9-RETR都不能在新鲜分离的CD8+T细胞(图13,E和F,上图)中诱导pSTAT5,所述新鲜分离的CD8+T细胞比活化的CD8+T细胞表达更少的IL-2β和IL-2Rγ(图14b,上图对比下图)和几乎无或无IL-2Rα(图13E,左上图)。然而,显著地,在用抗-CD3+抗CD28活化CD8+T细胞后,H9-RET可以诱导STAT5(图13E,右下图;图13F,下图;图13G)和S6核糖体蛋白(图13H)(PI 3-激酶信号传导途径的成员)的弱/部分磷酸化,而H9-RETR基本上保持惰性。有趣的是,H9-T在新鲜分离的CD8+T细胞中显著诱导pSTAT5(图13E,右上图),并且这在预活化的T细胞中显著增加,虽然仍然达不到用IL-2、H9或H9-RE观察到的水平(图13E,右下图和图13G)。因此,H9-T和H9-RET展现出表明真正的部分激动剂的中间活性。
鉴于由H9-RET和H9-RETR诱导的弱pSTAT5表达,进一步研究了这些分子对淋巴细胞增殖的影响。既然IL-2和H9强烈诱导原代CD8+T细胞的增殖并且H9-T在其作用中是中间的,H9-RET和H9-RETR都不诱导这些细胞的增殖,如通过羧基荧光素二乙酸琥珀酰亚胺基二酯(CFSE)稀释(图15)或通过[3H]-胸苷掺入(图16A,上图)评估。然而,当使用预活化的细胞时,H9-RETR仍然没有效果,但是H9-RET可再现地诱导增殖(图16B,下图),揭示了H9-RET可以在不同的细胞亚群中诱导不同的功能结果,与H9-RET对新鲜分离的对比预活化的CD8+T细胞中的pSTAT5的差异影响一致(图13E)。如预期的,IL-2和H9可以在预活化的CD8+T细胞中有效诱导IL-2Rα表达,并且H9-T在其IL-2Rα诱导水平上是中间的,而H9-RET和H9-RETR显著降低IL-2Rα表达,实际上降低到低于对照水平,推测反映它们与内源性IL-2的有效竞争(图17)。RNA-Seq接下来用于进一步阐明H9-RET和H9-RETR在预活化的CD8+T细胞中的弱作用的基础(图16,B和C)。如预期的,IL-2和H9诱导控制细胞周期或参与细胞因子信号传导的基因(例如CCND2、IL2RA、CISH和CDK6)但抑制许多其它基因(例如IL7R、BCL6),而H9-RET仅具有弱刺激活性,并且H9-RETR几乎没有效果(图16B和表S1,揭示了完全和部分激动剂信号之间的基因表达的定量和定性差异两者。IL-2和H9诱导的基因多于它们抑制的基因,而H9-RETR抑制的基因多于它诱导的基因,尽管其总体作用是最小的(图16C)。由于STAT5是IL-2诱导的转录的关键介质,染色质免疫沉淀和下一代测序(ChIP-Seq)用于全局评估基因组STAT5结合。H9-RET和H9-RETR-诱导的STAT5与共有TTCnnnGAA基序的结合,但是在比用IL-2或H9观察到的位点少得多的位点处(图16D)。基于热图聚簇,仅约35%的IL-2诱导的STAT5位点也由H9-RET诱导,而H9-RETR几乎无影响(图16E)。通过RT-PCR证实了由IL-2和H9对预活化的CD8+T细胞中的几种STAT5靶基因的诱导(IL2RA、CISH、LTA)或抑制(IL7RA、BCL6)(图16F),而H9-RET和H9-RETR都没有作用,除了有趣的是,与RETR不同,RET再现性地降低了BCL6表达(图16F)。
上述研究建立了H9-RET的减弱的活性和H9-RETR的可忽略的活性,其有效地是IL-2的显性阴性拮抗剂。鉴于它们对IL-2Rβ的增强的结合和降低预活化的T细胞上的IL-2Rα表达的能力,假设这些分子将不仅会抑制内源性IL-2,而且还抑制IL-15,其也经由IL-2Rβ和γc信号传导。实际上,H9-RET和H9-RETR两者都抑制CD8+T细胞中的IL-2-诱导的(图18A)和IL-15-诱导的(图18B)pSTAT5,其中H9-RETR更有效。通过H9-RET和H9-RETR处理对pSTAT5的抑制与它们将TCR-诱导的(图17)和IL-2-诱导的(图19A)CD25表达降低至低于在未刺激的对照细胞中观察到的那些水平的水平相关。相应地,H9-RET和H9-RETR在预活化的人CD8+T细胞中抑制IL-2-诱导的IL2RA mRNA表达(图19B)以及IL-2-和IL-15-诱导的增殖(图19C)。
因为H9-RETR抑制IL-2信号传导,所以推测H9-RETR也会抑制TCR-诱导的细胞增殖,这取决于IL-2,并且情况确实如此(图20A)并且与减少的CD25表达相关(图20B)。类似地,由于IL-2可以促进Th1、Th9和Treg分化但抑制Th17分化(Liao等人,Immunity 38:13(2013)),检查了H9-RET和H9-RETR对这些过程的影响。引人注目的是,H9-RET和H9-RETR两者都抑制Th1、Th9和Treg分化,但加强了Th17分化(图21),从而强调了它们作为IL-2的有效拮抗剂的作用。
H9-RETR也有效阻断由IL-2对原代人NK细胞的活化,如通过IL-2-诱导的CD69表达(图22A)和对乳腺癌细胞系HER18(图22B)和慢性骨髓性白血病细胞系K562(图22C)的细胞毒性测量。H9-RET和H9-RETR都不刺激原代NK细胞进行的CD69表达或细胞毒性(图22A)。
实施例12:部分IL-2激动剂和拮抗剂-体内作用
鉴于H9-RETR在体外作为IL-2/IL-15拮抗剂的有效性,我们研究了其在体内拮抗内源细胞因子的作用的能力。由于IL-2具有短的血清半衰期(Boyman等人,Nature Reviews Immunology 12:180(2012)),H9-RETR融合至人IgG4的Fc片段(Fc4),所述Fc片段是具有降低的抗体依赖性细胞性细胞毒性/吞噬(ADCC/ADCP)的同种型(Strohl,Current Opinion in Biotechnology 20:685(2009))。引人注目的是,与针对CD25的抗-Tac mAb和针对IL-2Rβ的Mikβ1mAb(Morris等人,Proc Natl Acad Sci US A 103:401(2006))相比,H9-RETR-Fc4有效得多地阻断预活化的人CD8+T细胞中的IL-2-(图18C)和IL-15-介导的(图18D)pSTAT5诱导,并且抑制IL-2-(图18E)和IL-15-(图18F)诱导的人CD8+T细胞增殖。重要的是,H9-RETR-Fc4在阻断IL-2增殖(图18E)中与抗Tac和Mikβ1的组合一样有效,并且在抑制IL-15-诱导的增殖中比Mikβ1更有效(图18F)。
接下来评估H9-RETR-Fc的体内有效性。在稳态条件下,Treg细胞是表达高亲和力IL-2受体的原代细胞的主要群体,并且可以起IL-2信号传导的系统性‘晴雨表’的作用。在施用IL-2或IL-15之前用H9-RETR-Fc4预处理小鼠显著抑制CD4+FoxP3+Treg细胞中STAT5的磷酸化,如离体评估(图23和图18G),指示H9-RETR-Fc4作为IL-2拮抗剂的体内潜力。由于IL-2和IL-15信号传导促成实验鼠模型中的急性GVHD(Ferrara等人,Journal of Immunology 137:1874(1986);和Blaser等人,Blood 105:894(2005)),假设H9-RETR-Fc4可以在完全-MHC错配的骨髓移植的T细胞-介导的C57BL/6-到-BALB/C模型中抑制致死性GVHD。实际上,用H9-RETR-Fc4处理10天的小鼠比用同种型对照Fc4蛋白处理的小鼠具有更长的存活期(P<0.001)(图18H)。
人T细胞嗜淋巴细胞病毒-I(HTLV-I)引起成人T细胞白血病(ATL),即CD4+T细胞的恶性扩增,所述CD4+T细胞展现出牵涉通过IL-2和IL-15的自分泌信号和通过IL-9的旁分泌信号的早期生长阶段。此类细胞因子依赖性增殖在患有慢性和郁积型,但不是急性ATL的患者中是明显的(Ju等人,Blood 117,1938(2011))。因此,测试了该系统中H9-RETR的功效。首先使用ATL-洐生的细胞系ED40515,其生长在体外通过添加外源IL-2支持。H9-RETR有效抑制这些细胞的增殖,并且优于达利珠单抗和Mikβ1(图18I)。在那里,接下来使用从具有郁积型ATL的患者新鲜分离的细胞,并在6天测定中测定自发增殖。10μg/ml的RETR比达利珠单抗略有效,并且比Mikβ1有效得相当多(图18J),强调其在控制这些强力增殖的恶性细胞中的潜在效用。
部分激动,定义为在配体饱和时减少的信号传导幅度(Emax),是通常与靶向GPCR、通道和其它多通跨膜蛋白的小分子相关的药理学性质。还没有证明通过I型跨膜受体二聚体响应于蛋白质生长因子、如细胞因子的可调信号传导(部分激动)的概念。基于结构信息,如下工程化IL-2变体,即通过增强在一个受体结合位点(IL-2Rβ)处的亲和力,同时减弱在第二受体结合位点(γc)处的相互作用以操纵二聚化和信号启动。由于增强的IL-2Rβ结合,这些分子相对于内源性IL-2占优势,并且它们的γc相互作用水平设置由细胞察知的信号的强度,从而在部分激动剂的Emax水平上“夹住”信号传导幅度。使用这些部分激动剂,证明了新鲜分离的对比预活化的CD8+T细胞具有IL-2信号传导强度的截然不同的活化阈值,如通过H9-T和H9-RET对这些细胞的差异作用证明,而H9-RETR(其是一种极弱的部分激动剂,如pSTAT诱导所示)具有显著的抑制性质,具有作为新一类免疫抑制剂的潜力。特别地,它可以阻断如离体评估的IL-2Rα诱导,延长在GVHD模型中存活,并且有效地抑制来自患有郁积型ATL的患者的外周血T细胞的自发增殖。除了其对T细胞的影响外,H9-RETR还抑制NK-介导的细胞毒性。考虑到部分激动剂的差异活性,较大的一批IL-2变体可以揭示甚至更宽的独特信号传导活性谱,范围从部分激动到完全拮抗并且潜在地包括对T细胞亚群、如Treg对比效应T细胞具有独特作用的另外的分子。此外,我们已经使用的合理设计方法可以适合于其它γc家族细胞因子,并且实际上也适合于更宽范围的细胞因子和生长因子。另外的部分激动剂细胞因子类似物潜在可以剖析其它方面多向性免疫途径的功能并且根据上下文具有独特的治疗益处。
材料与方法
蛋白质表达和纯化
分泌人IL-2(氨基酸1-133)及其变体、人IL-2Rβ胞外域(氨基酸1-214)和γc胞外域(氨基酸34-232),并且使用杆状病毒表达系统纯化,如先前所述(Morgan等人,Science 193:1007(1976年9月10日))。简言之,将所有构建体序列克隆到具有N-末端gp67信号肽和C-末端六组氨酸标签的pAcGP67A载体(BD Biosciences)中。用质粒构建体转染在SF900 II SFM培养基(Invitrogen)中在28℃下培养的草地贪夜蛾(Sf9)昆虫细胞,以建立高滴度重组病毒,随后将其扩增。用高滴度病毒感染在昆虫Xpress培养基(Lonza)中于28℃下生长的粉纹夜蛾昆虫细胞(Invitrogen)以表达重组蛋白(Zhu等人,Annual Review of Immunology 28:445(2010)和W.Liao等人,Nat Immunol 9:1288(2008))。在用重组病毒感染后三天,经由Ni-NTA(Qiagen)亲和色谱提取蛋白质、浓缩,并且用在10mM HEPES(pH7.3)和150mM NaCl中平衡的Superdex 200分筛柱(GE Healthcare)进一步纯化至>98%同质性。还通过将人IgG4 Fc结构域(Fc4)或后面有C末端人IgG4 Fc结构域的人IL-2RETR变体(Fc4-RETR)克隆到含有N末端gp67信号肽和C末端六组氨酸标签的pAcGP67A载体中,使用该杆状病毒表达系统分泌和纯化Fc4和Fc4-RETR融合蛋白。从具有工程化的Ser228 Pro突变的经修饰的pFUSE-hIgG4-Fc载体(Invivogen)获得人IgG4 Fc结构域(Liao等人,Nat Immunol 12:551(2011))。对于体内实验,如先前所述(Cheng等人,Immunol Rev 241:63(2011))使用Triton X-114从制备的蛋白质中去除内毒素,并且用LAL生色内毒素定量试剂盒(Thermo Scientific)确认内毒素去除。
对于生物素化的蛋白质表达,表达具有C-末端生物素受体肽(BAP)-LNDIFEAQKIEWHE的γc,并经由Ni-NTA(Qiagen)亲和色谱纯化,然后用0.SmM Bicine pH8.3,100mM ATP,100mM乙酸镁和500mM生物素(Sigma)中的可溶性BirA连接酶生物素化。通过在10mM HEPES(pH 7.3)和150mM NaCl中平衡的Superdex 200柱(GE Healthcare)上的尺寸排阻色谱纯化蛋白质。
表面等离子体共振结合测量
经由在Biacore T100仪器上使用Biacore SA传感器芯片(GE Healthcare)的表面等离子体共振(SPR)研究表征结合相互作用。以低密度(RUmax<100个响应单位)将γc固定于芯片表面,并将H9:IL-2Rβ或H9-RET:IL-2Rβ复合物的连续稀释液暴露于表面60秒。然后跟踪解离200秒。将无关的生物素化蛋白质固定在参考通道中以从测量中减去非特异性结合。在25℃下在补充有0.2%BSA的HBS-P+缓冲液(GE Healthcare)中进行实验。所有结合研究以30mL/min的流速进行以使质量运输贡献最小化并防止分析物的再结合。对于所有测量,假定1∶1 Langmuir结合模型,使用Biacore T100评估软件2.0版实施数据分析及平衡和动力学参数的测定。
CD25+YT-1细胞的组织培养和磁性纯化
在RPMI完全培养基(补充有10%胎牛血清、2mM L-谷氨酰胺、最低非必需氨基酸、丙酮酸钠、25mM HEPES和青霉素-链霉素(Gibco)的RPMI 1640培养基)中培养未修饰的YT9(Zhu等人,AnnualReview of Immunology 28:445(2010))和CD25+YT-1天然杀伤样细胞(Liao等人,Nat Immunol 9:1288(2008))。在37℃下在具有5%CO2的湿润气氛中维持这两种细胞系。
如先前详述(Liao等人,Immunity 38:13(2013)),经由磁性选择纯化表达或不表达CD25的YT-1细胞的亚群。用FACS缓冲液(含有0.1%牛血清白蛋白的磷酸盐缓冲盐水pH 7.2)洗涤1000万个未分选的CD25+YT-1细胞,随后在4℃下与FACS缓冲液中的PE-缀合的抗人CD25抗体(Biolegend,克隆BC96)孵育2小时。然后将PE-染色的CD25+细胞在4℃下用缀合至抗-PE IgG的顺磁性微珠标记20分钟,用冷FACS缓冲液洗涤一次,并根据制造商的方案使用LS MACS分离柱(Miltenyi Biotec)分选。将洗脱的细胞重悬并在RPMI完全培养基中生长,并使用Accuri C6流式细胞仪评价CD25+细胞的富集。通过使用PE-缀合的抗人CD25抗体的流式细胞术分析监测分选的CD25+YT-1细胞上的CD25表达的持久性。
细胞内磷酸-STAT5和磷酸-ERK1/2的流式细胞术分析将大约2x105个YT或CD25+YT-1细胞在96孔板的每个孔中涂铺,用FACS缓冲液洗涤,并重悬于FACS缓冲液中,所述FACS缓冲液含有IL-2、H9、H9-RET或H9-RETR的连续稀释液。将细胞在37℃下刺激20分钟,并立即通过加入甲醛至1.5%固定,然后在室温下孵育10分钟。然后将细胞用100%冰冷的甲醇在4℃下透化30分钟以允许检测细胞内信号效应物。将固定且透化的细胞用FACS缓冲液洗涤两次,并在室温下与在FACS缓冲液中稀释的Alexa488-缀合的抗-STAT5 pY694(BD Biosciences)或Alexa488-缀合的抗ERK1/2 pT202/pY204(BD Biosciences)孵育2小时。然后将细胞在FACS缓冲液中洗涤两次,并在Accuri C6流式细胞仪(BD Biosciences)上定量平均荧光强度(MFI)。产生剂量-响应曲线,并且在扣除未刺激细胞的MFI并相对于通过细胞因子刺激诱导的最大信号强度归一化之后使用GraphPad Prism数据分析软件计算EC50和Emax值。
人CD8+T细胞分离及pSTAT5和pS6-核糖体蛋白的细胞内染色
从来自NIH血库的健康供体获得血沉棕黄层(buffy coat),并使用淋巴细胞分离培养基(Mediatech,Inc.,VA)通过梯度离心分离外周血单核细胞(PBMC)。使用人CD8+T细胞分离试剂盒I(Miltenyi Biotec,Germany)分离细胞。对于预活化细胞,用2μg/ml板结合的抗-CD3mAb(BD Biosciences)预包被6孔板。将细胞以1x106个细胞/ml接种于具有1μg/ml可溶性抗-CD28mAb(BD Biosciences)的完全培养基(补充有谷氨酰胺、青霉素、链霉素和10%FBS的RPMI培养基)中3天,然后在新鲜培养基中静置48小时。如先前所述(Liao等人,Immunity 38:13(2013))对原代人CD8+T细胞进行剂量响应实验;简言之,将细胞用IL-2、H9、H9-RET、H9-RETR的连续稀释液处理,然后在室温下用Phosflow Fix Buffer I固定10分钟(BD Biosciences),并用FACS缓冲液洗涤一次。然后通过缓慢加入冷的BD PhosflowTM Perm缓冲液III使细胞透化,并在冰上孵育30分钟。洗涤细胞,并在室温下在黑暗中用PE-缀合的抗STAT5 pY694(BD Biosciences)或APC-缀合的抗磷酸-S6核糖体蛋白(Ser235/236)(克隆D57.2.2E)染色30分钟,再次用FACS缓冲液洗涤,并在FACSCanto II流式细胞仪(BD Biosciences)上获得数据,并使用FlowJo(Tree Star)分析。
STAT5磷酸化的离体分析
C57BL/6小鼠来自Jackson实验室。动物方案由NHLBI动物护理和使用委员会批准并遵循NIH指南,“Using Animals in Intramural Research”。使用制造商的方案(BD Bioscience)测定STAT5磷酸化。简言之,将IL-2或IL-15i.p.注射到C57BL/6小鼠中,分离总体脾细胞,立即使用BD PhosphoflowTM Lyse/Fix缓冲液固定,用冰冷的PBS洗涤两次,使用抗CD4和抗CD25抗体(Biolegend)染色,然后使用BD PhosFlow Perm缓冲液III在冰上在黑暗中透化30分钟。然后用冰冷的FACS缓冲液洗涤细胞两次,用抗FoxP3按照制造商的方案(eBioscience)染色,用冰冷的FACS缓冲液洗涤两次,并用抗磷酸-STAT5-PE(1:30)(BD)在室温下在黑暗中染色30分钟。用FACS缓冲液洗涤细胞三次,并在FACS Canto流式细胞仪(BD)上获得数据并使用FlowJo(Tree Star)分析。
IL-2受体内化实验
将IL-2、H9、H9-RET或H9RETR(1μM)与96孔板中的3x105个YT-1细胞孵育2、5、10、15、30、60、90、120、180或240分钟。将细胞立即转移到冰上以防止进一步的受体内化,并用冰冷的PBSA缓冲液(PBS中的0.1%BSA)洗涤两次。在冰上用PBSA缓冲液中的别藻蓝蛋白-缀合的抗人IL-2Rβ抗体(TU27;Biolegend)和藻红蛋白-缀合的抗人IL-2Rγ抗体(TUGh4;Biolegend)的1:50稀释液同时染色细胞30分钟。在冰冷的PBSA缓冲液中再洗涤两次后,将细胞在室温下用在PBSA中的1.5%多聚甲醛固定10分钟,最后洗涤一次,并重悬于PBSA缓冲液中。用Accuri C6流式细胞仪定量平均细胞荧光。用Prism软件包(GraphPad)使用非线性最小二乘方回归将内化数据拟合成单指数衰减模型。
对IL-2诱导的pSTAT5的抑制
在缺乏或存在H9-RET或H9-RETR的情况下用IL-2刺激新鲜分离的和预活化的人CD8+T细胞,并评估pSTAT5水平。将细胞与或不与抗-Tac或Mikβ1或Fc4-H9-RETR孵育1小时,然后用一系列剂量的IL-2或IL-15刺激30分钟,并通过流式细胞术测量pSTAT5水平。对于NK细胞实验,在存在或缺乏指定的IL-2变体的情况下用IL-15的连续稀释液刺激新鲜分离的人NK细胞(NK细胞分离试剂盒II,Miltenyi Biotech),并评估pSTAT5。
蛋白质印迹分析
在含有1%IGEPAL CA-630(Sigma)的RIPA缓冲液中裂解用或不用细胞因子刺激的细胞。在4至12%Bis-Tris NuPAGE凝胶(Invitrogen)上解析等量的裂解物,转移至膜,并且将膜与针对pSTAT5(Y694)(Cell Signaling Technology,Inc.,Beverly,MA)或STAT5(BD Transduction Laboratories,San Diego,CA)的抗体在室温下孵育1小时。用山羊抗兔IgG(H+L)-HRP缀合物(1:5,000稀释)和用山羊抗小鼠IgG(H+L)-HRP缀合物(1:10,000稀释)(Biorad)检测结合的抗体。使用增强的化学发光(ECL,GE healthcare)显现免疫印迹。在一些实验中,在室温下在剥离缓冲液(Millipore)中孵育15分钟后再使用膜。
CFSE稀释和EdU增殖测定
在室温下用PBS中的2.5μM CFSE(Molecular Probes)将新鲜分离或预活化的CD8+T细胞(20x 106/ml)标记7分钟,并立即用100%FBS(2ml/样品)洗涤一次,然后在完全RMPI中洗涤两次。在缺乏或存在野生型IL-2、H9、H9-RET、H9-RETR或IL-2+H9-RETR的情况下培养2x106/ml经CFSE标记的细胞。通过在指定时间点的CFSE稀释的流式细胞术分析来评估细胞增殖。对于EdU增殖测定,如上所述培养预活化的CD8+T细胞。在收获前16小时,添加10mM EdU,如指示对细胞进行表面抗原染色,然后根据制造商的方案(BD Biosciences)进行细胞内EdU染色。通过流式细胞术评估细胞增殖。
ED40515细胞和来自患有郁积型ATL的患者的细胞的增殖
用PBS洗涤IL-2-依赖性ED40515(+)(Lenardo,Nature 353:858(1991))细胞两次。将细胞以1x104个细胞/100μl/孔的具有或没有IL-2和具有或没有试剂的RPMI 1640培养基接种到96孔板中,然后在37℃下孵育3天。
来自ATL患者的血液样品在Clinical Trials Team,Lymphoid Malignancies Branch,NCI,NIH的护理下获得。本研究方案由美国国家癌症研究所的机构审查委员会(Institutional Review Board of National Cancer Institute)批准。根据赫尔辛基宣言获得知情同意。来自ATL患者的外周血单核细胞(PBMC)通过Ficoll-Hypaque密度梯度离心从它们的肝素化血液中分离。将1x105个细胞/100μl/孔的等分试样在补充有10%FBS且具有或没有试剂的RPMI 1640培养基中离体培养6天。
在培养的最后6小时期间,用1μCi(0.037MBq)[3H]胸苷脉冲ED40515(+)细胞或ATL PBMC,然后用细胞收获器(Tomtec,Hamden,CT)收获细胞,用MicroBeta2微板计数器(PerkEmer)计数。该测定一式三份进行。
NK细胞的活化
将外周血单核细胞(PBMC)在1μg/mL IL-2类似物存在下培养24小时。然后用APC-缀合的抗-CD56(BD Biosciences)、Pacific Blue-缀合的抗-CD3(BioLegend)和FITC-缀合的抗-CD69(BD Biosciences)对细胞染色。使用FACSAria II(BD Biosciences)通过流式细胞术分析样品。NK细胞门控为CD3阴性,CD56阳性。
使用Ficoll-Paque Premium(GE Life Sciences)通过梯度离心分离PBMC,然后使用人类NK细胞分离试剂盒(Miltenyi)纯化未接触的NK细胞,随后使用autoMACS(Miltenyi)分离。每1x106个细胞用150μCi 51Cr(Perkin Elmer)标记HER18靶细胞2小时。将NK细胞以10∶1效应子:靶物比率添加到10,000个HER18细胞。在不同浓度的IL-2类似物存在下培养4小时后测定特异性裂解。
通过原代NK细胞对K562细胞的裂解如描述进行(Yuan等人,Immunol Rev 259,103(2014))。简言之,使用人NK分离试剂盒(STEMCELL)纯化未接触的人NK细胞。用PKH67绿色荧光细胞接头试剂盒(SigmaAldrich)标记K562细胞,将NK细胞以10∶1比率添加到5,000个K562细胞,在不同浓度的IL-2类似物存在下在37℃下培养4小时,并置于冰上以防止进一步的反应性。然后用碘化丙啶(PI)(Sigma-Aldrich)对细胞染色,并通过流式细胞术测定PI+PKH67+K562细胞的百分比。
T辅助极化和胞内细胞因子染色
在缺乏或存在指定的细胞因子的情况下,在不同的T辅助极化条件下分化首次接触实验的CD4+C57BL/6T细胞。4天后,首先针对如指定的表面抗原对细胞染色,然后用在BD细胞固定(cytofix)和细胞透化(cytoperm)中的针对IFNγ(eBioscience),IL-17A(eBioscience)、IL-4(BioLegend)、IL-9(BioLegend)或FoxP3(eBioscience)的抗体,或eBioscience FoxP3染色缓冲液试剂盒,根据制造商的方案染色细胞。使用FlowJo软件(Tree Star,Inc)在FACSCanto II流式细胞仪(Becton Dickinson)上分析染色的细胞。所有小鼠细胞因子来自Peprotech。
RNA-Seq分析
将预活化的人CD8+T细胞在完全培养基中静置两天,用1μg/ml野生型IL-2、H9、H9-RET或H9-RETR刺激24小时,并且分离来自5x106个细胞的总RNA(RNeasy试剂盒,Qiagen,Valencia,CA)。汇集来自5个供体的RNA,并使用1μg汇集的RNA合成cDNA。如先前所述(Liao等人,Immunity 38:13(2013),制备RNA-seq文库。使用Illuminna HiSeq2000平台对PCR扩增产物进行条形码化并测序。使用Bowtie 0.12.4(Leonard,Nature Reviews.Immunology1:200(2001))将测序读段与人类基因组(hg18,NCBI版本36.1)比对。保留独特定位的读段,并且使用RPKM(每百万定位读段每千碱基的读段)计算基因的数字表达水平。使用R包edgeR鉴定差异表达的基因,并且在未处理或用IL-2变体处理24小时的细胞之间比较倍数变化(以log2标度)差异。
ChIP-Seq文库制备和分析
将预活化的CD8+T细胞用不同的细胞因子处理90分钟,然后用1%多聚甲醛化学交联。将来自1-2千万个细胞的染色质超声处理成250-500bp的片段,用抗-STAT5B(Invitrogen)免疫沉淀,并且处理以进行测序,如先前所述(Noguchi等,Cell 73:147(1993))。使用Bowtie 0.12.4(Leonard,Nature Reviews.Immunology 1:200(2001))将所有读段与人类基因组(hg18,NCBI版本36.1)比对。将独特定位的读段转换为浏览器可扩展数据(BED)文件,并且过滤重复读段(相同基因组位置中的多个读段)。然后,将过滤的(非冗余的)BED文件转换成二进制数据(binary tiled data)(.tdf),并使用Integrative Genome Viewer(Broad Institute)可视化。
通过RT-PCR进行的基因表达分析
使用RNeasy Plus微型试剂盒(Qiagen)分离总RNA,并且与寡聚物dT(Invitrogen)和Omniscript逆转录试剂盒(Quiagen)一起使用200ng以合成cDNA。使用ABI 7900HD序列检测系统进行定量RT-PCR。RT引物和探针来自Applied Biosystems。相对于RPL7归一化表达水平。
对同种异体宿主的骨髓移植
将来自NCI-Frederick癌症研究室(Cancer Research Facility)的7周龄雌性C57BL/6(H2Kb)和BALB/c(H2Kd)小鼠维持在无特定病原体的设施中,并根据由NCI动物护理和使用委员会批准的批准动物方案处理。用950cGy全身辐照条件化BALB/c小鼠,然后用单独的或与200万个经Treg消耗的泛-T细胞一起的来自C57BL/6小鼠的1000万个T细胞消耗的骨髓细胞重建。使用来自Miltenyi Biotec的试剂盒,用抗CD90[Thy1.2]微珠(总T细胞消耗)或抗CD25(Treg消耗)进行T细胞消耗。另外,用Fc4或H9-RETR-Fc4(100μg i.p.两次/天,持续10天)处理接受泛-T细胞的小鼠。全身辐照后,饮用水从第-1天至第+14天补充环丙沙星。监测存活和体重减轻。根据Kaplan-Meier法分析存活,并使用对数秩检验比较存活曲线。使用GraphPad Prism 4软件进行统计分析。
其它实施方案
应当理解,虽然本发明已经结合其详细描述进行了描述,但是前面描述旨在说明而不是限制本发明的范围,其由所附权利要求书的范围限定。其它方面、优点和修改在所附权利要求书的范围内。例如,尽管在整个说明书中提及IL-2,但是本领域技术人员将理解,本文中所述的方法和组合物同样适用于具有此特性的其它细胞因子,例如粒细胞-巨噬细胞集落刺激因子(GM-CSF)、IL-2、IL-3、IL-5、IL-6或IL-15。因此,本发明还包括与野生型相比对其各自的受体具有增加的结合亲和力的GM-CSF、IL-2、IL-3、IL-5、IL-6和IL-15的突变体,以及用于鉴定和使用那些突变体的方法。
- 还没有人留言评论。精彩留言会获得点赞!