维生素D测定法中对维生素D差向异构体特异性的结合配偶体的制作方法
背景
本发明涉及用于确定怀疑含有维生素D分析物及其代谢物的样品中其存在和/或量的组合物、方法和试剂盒。
许多小分子化合物或半抗原,诸如例如药物和维生素,以同分异构形式存在,其中只有一种形式是活性的。为了获得分析物的活性形式的准确测量,必须解决该分析物的非活性同分异构体的存在。分析物的两种同分异构形式(即活性形式和非活性形式)的测量值可导致可能对个体不利(取决于分析物的活性形式的功能)的不准确性。准确地评价生物样品中一对同分异构分析物的每种的水平是重要的,尤其当仅一种同分异构体是活性的,并且包括非活性同分异构体的量的测量值扭曲了样品中分析物的水平。例如,测量生物样品中的维生素D水平是重要的,因为维生素D缺乏与哺乳动物中许多病症相关。在婴儿中,例如,包括3-差向异构体的量的维生素D测量值可导致婴儿中维生素D水平的不准确评价,这进而可导致缺乏合适的补充。测量维生素D的活性形式是重要的,使得婴儿可以接受适当的维生素D疗法(如果必要)。
术语“维生素D”是指一类脂溶性开环甾类化合物。在人类中,维生素D是独特的,因为它可作为胆钙化甾醇(维生素D3)或麦角钙化甾醇(维生素D2)被摄取,以及因为机体也可以在日照充足时(由胆甾醇)合成维生素D。由于此后一特性,一些人认为维生素D是非必要膳食维生素,尽管大多数人认为它是必要营养素。维生素D在钙离子体内平衡的正性调节中具有重要的生理作用。维生素D3是由动物合成的维生素形式。其如同维生素D2一样也是添加至乳制品和某些食品的常见补充剂。
膳食和内在合成的维生素D3两者都必须经历代谢活化来生成生物活性代谢物。在人类中,维生素D3活化的初始步骤主要在肝脏中发生并涉及羟基化以形成中间代谢物25-羟基胆钙化甾醇。钙二醇是维生素D3在循环系统中的主要形式。维生素D2也经历类似的代谢活化,成为25-羟基维生素D2。这些化合物共同地被称作25-羟基维生素D(缩写为25(OH)D),并且它们是在血清中测量以确定维生素D状态的主要代谢物;25(OH)D及其差向异构体两者都为需要被转化成1,25(OH)D以发挥生物功能的前激素。1,25(OH)D的生物活性与3-差向-1,25(OH)D的生物活性的比较是复杂的。
维生素D化合物25-羟基维生素D3和25-羟基维生素D2在3-位是差向异构的,其中所述差向异构体分别被命名为25-羟基维生素D3和3-差向-25-羟基维生素D3和25-羟基维生素D2和3-差向-25-羟基维生素D2。只有这些差向异构化合物的每种的一种差向异构体,即分别25-羟基维生素D3和25-羟基维生素D2是活性的。25-羟基维生素D3和25-羟基维生素D2的差向异构体的结构在图1中阐述。
评价生物样品中的维生素D水平是重要的,因为维生素D缺乏与哺乳动物中的许多疾病相关。需要用于准确和灵敏测定样品中的维生素D、维生素D的差向异构形式和维生素D类似物及其代谢物的浓度的试剂和方法。
概述
根据本文所述的原理的一些实例涉及测定怀疑含有维生素D分析物的样品中的维生素D分析物的量的方法。在测定介质中提供组合,其包括样品、对维生素D分析物的差向异构体特异性的维生素D差向异构体结合配偶体(其中所述维生素D差向异构体结合配偶体不在任何可检测的程度上结合维生素D分析物)和对维生素D分析物特异性的维生素D结合配偶体。在维生素D差向异构体结合配偶体与维生素D分析物的差向异构体结合以及维生素D结合配偶体与维生素D分析物结合的条件下孵育测定介质以形成维生素D结合配偶体结合的复合物。测定维生素D结合配偶体结合的复合物的量,并与样品中的维生素D分析物的量相关。
根据本文所述的原理的一些实例涉及如上所阐述的方法,其中针对式I化合物产生所述维生素D差向异构体结合配偶体,例如,抗体:
(R1)p-(L)q-Z,其中
或H,其中至少一个R1不是H,
Y是O、S、CR或NR4,
X是-O-(CH2)n-C(O)-、-(CH2)w-C(O)-、-(CH2)w-C(O)-(CH2)x-C(O)-、-(CH2)w-C(O)-NH(CH2)y-C(O)-、-NR3-C(O)-,
R独立地是H或烷基,
R2独立地是H或烷基,
R3、R4、R5和R6独立地是H或烷基,或者R4和R5可以一起形成键,或者R5和R6可以一起形成键,
R11是H、烷基或酰基,
n是1至10的整数,
w是0至10的整数,
x是1至10的整数,
y是1至10的整数,
p是1至10的整数,
L是连接基团,
q是0或1,且
Z是聚(氨基酸)免疫原性载体或非聚(氨基酸)免疫原性载体,
或其针对上述化合物中的两种或更多种产生。
根据本文所述的原理的一些实例涉及如上所阐述的方法,其中针对式II化合物产生维生素D差向异构体抗体:
NHR1’-(CH2)r’-NR1’’-((CH2)r’-NR1’’’)s’-(CH2)r’-NR7’-Z’,其中
R1’、R1’’或R1’’’各自独立地选自
和H,
其中R1’、R1’’或R1’’’中的至少一个不是H,
n’是1至10的整数,
r’独立地是1至10的整数,
s’是1至10的整数,
R7’是H或烷基,
R11’是H、烷基或酰基,且
Z’是聚(氨基酸)免疫原性载体或非聚(氨基酸)免疫原性载体。
根据本文所述的原理的一些实例涉及测定怀疑含有维生素D分析物的样品中的维生素D分析物的量的方法。在测定介质中以组合提供样品、作为对维生素D分析物特异性的维生素D抗体的捕获抗体和对维生素D分析物的差向异构体特异性的维生素D差向异构体抗体(其中所述维生素D差向异构体抗体不在任何可检测的程度上结合维生素D分析物)。在维生素D抗体结合维生素D分析物以形成维生素D抗体结合的复合物和维生素D差向异构体抗体结合维生素D分析物的差向异构体的条件下孵育所述测定介质。将维生素D抗体结合的复合物与结合维生素D抗体结合的复合物中的维生素D分析物的检测抗体组合,其中所述检测抗体包含信号产生系统的成员。测量由信号产生系统产生的信号,并与样品中的维生素D分析物的量相关。
附图简述
本文提供的附图不是按比例的,并且为了便于理解根据本文所述的原理的某些实例的目的而提供,并且通过说明而非限制所附权利要求的范围的方式来提供。
图1是25-羟基维生素D3和25-羟基维生素D2的差向异构形式的化学式的描绘。
图2是按照根据本文所述的原理的实施例的化合物的合成的示意图。
图3是按照根据本文所述的原理的实施例的化合物的合成的示意图。
图4是按照根据本文所述的原理的实施例的化合物的合成的示意图。
图5是按照根据本文所述的原理的实施例的化合物的合成的示意图。
图6是按照根据本文所述的原理的实施例的化合物的合成的示意图。
图7是按照根据本文所述的原理的实施例的化合物的合成的示意图。
图8是按照根据本文所述的原理的实施例的化合物的合成的示意图。
图9说明使用添加和不添加抗-3-差向异构体-VD抗体的试剂产生的标准曲线的比较。
图10是用于使用抗-3-差向异构体-VD抗体测定样品中的3-差向-25(OH)D的免疫测定的标准曲线。
具体实施方案的详述
根据本文所述的原理的结合配偶体诸如例如抗体可用于尽可能减少或消除维生素D分析物的非差向异构形式的测定中的3-差向异构体交叉反应性。采用针对作为式I化合物(其中Z是免疫原性载体)的免疫原制备的抗体作为阻断剂,可以实质上避免由3-差向异构体维生素D与维生素D分析物的抗体的交叉反应性引起的总非差向异构维生素D分析物的过度估计。
根据本文所述的原理的一些实例涉及测定怀疑含有维生素D分析物的样品中的维生素D分析物的量的方法。在测定介质中提供组合,其包括样品、对维生素D分析物特异性的维生素D结合配偶体和对维生素D分析物的差向异构体特异性的维生素D差向异构体结合配偶体,其中所述维生素D差向异构体结合配偶体不在任何可检测的程度上结合维生素D分析物。如下文更详细讨论,所述测定可以是均质或非均质的,竞争性或非竞争性的。在一些实例中,根据测定的性质,包括作为维生素D类似物的试剂,并且在一些实例中,采用对维生素D分析物的结合配偶体特异性的第三结合配偶体。在维生素D差向异构体结合配偶体与维生素D分析物的差向异构体结合以及维生素D结合配偶体与维生素D分析物结合的条件下孵育测定介质以形成维生素D结合配偶体结合的复合物。测定维生素D结合配偶体结合的复合物的量,并与样品中的维生素D分析物的量相关。
维生素D的测定法的一般描述
如上所提及,根据本文所述的原理的一些实例涉及测定怀疑含有维生素D分析物的样品中的维生素D分析物的存在和量中的一者或两者的方法,并且可以在本文中被称为“维生素D的测定法”。在本文所讨论的任何实例中,可以采用对维生素D的一种或多种差向异构体特异性的结合配偶体诸如,例如根据本文所述的原理的抗体作为阻断剂,以减少或消除维生素D分析物的测定法中来自维生素D的差向异构体的干扰。
短语“维生素D”是指25-羟基维生素D;钙二醇;1,25-二羟基维生素D2;1,25-二羟基维生素D3;1,25-二羟基维生素D4;1,25-二羟基维生素D5;和1,25-二羟基维生素D6中的一种或多种;包括所有上述的差向异构形式和代谢物。因此,维生素D分析物包括如上所定义的维生素D和维生素D的差向异构体。根据本文所述的原理的一些实例涉及测定怀疑含有维生素D的差向异构形式(例如3-差向-25-羟基维生素D3或3-差向-25-羟基维生素D2)的样品中的维生素D的差向异构形式的存在和量中的一者或两者的方法,并且可以在本文中被称为“维生素D的差向异构体的测定法”。
通过说明而非限制的方式,在用于测定维生素D分析物的方法的一个实例中,提供了组合,其包含样品,结合配偶体诸如例如根据本文所述的原理产生的维生素D的差向异构体的抗体,结合配偶体诸如例如维生素D分析物的抗体和包含维生素D类似物和信号产生系统的成员的缀合物。
如上所提及,“在介质中以组合”提供样品和试剂。尽管添加至介质以形成组合的顺序可以变化,但对于本文所述的测定形式的一些实施方案,将存在特定优先性。通过说明而非限制的方式,在一个实例中,添加顺序是同时添加所有材料,并测定测定介质对信号具有的影响,如在均质测定法中。通过说明而非限制的方式,在另一个实例中,可以依次组合各试剂,或试剂组。在一些实施方案中,在如上所讨论的各添加之后,可以涉及孵育步骤。在非均质测定法中,在一个或多个孵育步骤之后还可以采用分离和洗涤步骤。
短语“维生素D类似物”是指与维生素D分析物竞争受体的化合物,诸如维生素D的抗体或维生素D的差向异构体的抗体。维生素D类似物可以是修饰的维生素D,其中所述修饰提供方式将维生素D接合至另一分子诸如,但不限于,例如支持物、标记、小分子或小分子的结合配偶体。维生素D类似物可以直接或通过连接基团间接地连接至另一分子。维生素D类似物可以是例如与维生素D结构相关的分子或通过连接基团与另一分子缀合的维生素D。在根据本文所述的原理的一些实例中,维生素D类似物可以是式I化合物,其中Z是聚(氨基酸)标记部分或非聚(氨基酸)标记部分,或其中Z是免疫原性载体,其中此类式I化合物与维生素D分析物竞争结合维生素D抗体。
待分析的样品是怀疑含有维生素D分析物的样品。所述样品可以是生物样品或非生物样品。生物样品可以来自哺乳动物受试者或非哺乳动物受试者。哺乳动物受试者可以是,例如,人或其它动物物种。生物样品包括生物体液,诸如全血、血清、血浆、痰、淋巴液、精液、阴道粘液、排泄物、尿、脊髓液、唾液、粪便、脑脊液、泪液、粘液等;生物组织,诸如毛发、皮肤、来自器官或其它机体部分的切片或切除组织;等等。在许多情况下,所述样品是全血、血浆或血清。非生物样品包括但不限于,例如废物流,其也可以使用根据本文所述的原理的化合物进行分析。
可以在任何适宜的介质中制备样品,所述介质可以是例如,测定介质,其在下文中更充分地讨论。在一些情况下,可以对样品施加预处理,诸如以裂解血细胞。在一些实例中,此类预处理在随后不干扰测定的介质中进行。
介质中的组合经受使维生素D分析物和维生素D类似物与维生素D分析物的抗体结合以形成复合物的条件。测量复合物的量,其中复合物的量与样品中维生素D分析物的存在和量中的一者或两者相关。
维生素D分析物的测定可以在不分离(均质)或分离(非均质)任何测定组分或产物的情况下进行。非均质测定通常涉及一个或多个分离步骤,并且可以是竞争性或非竞争性的。免疫测定可以涉及标记或未标记的试剂。涉及未标记的试剂的免疫测定通常包括形成相对大复合物,所述相对大复合物涉及由根据本文所述的原理的免疫原性缀合物制备的一种或多种抗体。对于抗体复合物的检测,此类测定包括例如免疫沉淀素和凝集法,以及相应的光散射技术例如,例如浊度测定法(nephelometry)和比浊法(turbidimetry)。标记免疫测定包括但不限于例如化学发光免疫测定、酶免疫测定、荧光偏振免疫测定、放射免疫测定、抑制测定、诱导发光测定、以及荧光氧通道测定。
一种通常的免疫测定组包括使用有限浓度的根据本文所述的原理的抗体的免疫测定。另一组免疫测定涉及使用过量的一种或多种主要试剂,诸如例如过量的根据本文所述的原理的抗体。另一组免疫测定包括无分离均质测定,其中在标记的维生素D类似物与根据本文所述的原理产生的抗体结合、因此与样品中可存在的维生素D分析物竞争后,来自标记的维生素D类似物的信号被调节。
如上所提及,所述测定可以在不分离(均质)或分离(非均质)任何测定组分或产物的情况下进行。均质免疫测定由以下例举:Rubenstein等人,美国专利号3,817,837,第3栏,第6行至第6栏,第64行中公开的EMIT®测定(Siemens Healthcare Diagnostics Inc.,Deerfield,IL);免疫荧光法,诸如Ullman等人,美国专利号3,996,345,第17栏,第59行至第23栏,第25行中公开的那些;酶通道免疫测定(“ECIA”),诸如Maggio等人,美国专利号4,233,402,第6栏,第25行至第9栏,第63行中公开的那些;荧光偏振免疫测定(“FPIA”),如例如尤其是美国专利号5,354,693中公开的那些;和酶免疫测定,诸如酶联免疫吸附测定(“ELISA”)。非均质测定的示例为放射免疫测定,其公开于Yalow等人,J. Clin. Invest. 39:1157 (1960)中。上述公开内容的相关部分全部通过引用并入本文。
其它酶免疫测定是例如由Ngo和Lenhoff,FEBS Lett. (1980) 116:285-288讨论的酶调节介导的免疫测定(“EMMIA”);由Oellerich,J. Clin. Chem. Clin. Biochem. (1984) 22:895-904公开的底物标记的荧光免疫测定(“SLFIA”);由Khanna等人,Clin. Chem. Acta (1989) 185:231-240公开的组合酶供体免疫测定(“CEDIA”);均质颗粒标记的免疫测定,诸如颗粒增强的比浊抑制免疫测定(“PETINIA”),颗粒增强的比浊免疫测定(“PETIA”);亲和力二氧化铬介导免疫测定(“ACMIA”)测定形式,其描述于美国专利号7,186,518、5,147,529、5,128,103、5,158,871、4,661,408、5,151,348、5,302,532、5,422,284、5,447,870和5,434,051中,其公开内容以其整体并入本文。
其它测定包括吖啶酯标记测定,诸如美国专利号6,355,803;6,673,560;7,097,995和7,319,041中讨论的那些,其相关公开内容通过引用并入本文。吖啶酯标记测定的一个具体实例为使用顺磁性颗粒作为固相的吖啶酯标记免疫测定(“ADVIA”免疫测定)。其它测定包括溶胶颗粒免疫测定(“SPIA”),分散染料免疫测定(“DIA”);金属免疫测定(“MIA”);酶膜免疫测定(“EMIA”);和发光免疫测定(luminoimmunoassay)(“LIA”)。其它测定类型包括免疫传感器测定,其涉及在结合维生素D分析物后,监测存在的缀合物的光学、声学和电学特性的变化。此类测定包括例如光学免疫传感器测定、声学免疫传感器测定、半导体免疫传感器测定、电化学换能器免疫传感器测定、电位型免疫传感器测定、电流型电极测定。
非均质测定通常涉及一个或多个分离步骤,并且可以是竞争性或非竞争性的。各种竞争性和非竞争性非均质测定形式公开于Davalian等人,美国专利号5,089,390,第14栏,第25行至第15栏,第9行,其通过引用并入本文。在竞争性非均质测定的一个实例中,使具有与之结合的维生素D分析物的抗体的支持物与介质接触,所述介质含有怀疑含有维生素D分析物的样品和作为标记的维生素D类似物的标记的根据本文所述的原理的化合物。怀疑含有维生素D分析物的样品已经用分析物的差向异构形式的抗体处理,以结合维生素D分析物的所有差向异构形式。样品中的维生素D分析物与标记的维生素D类似物竞争结合维生素D分析物的抗体。将支持物和介质分离之后,支持物或介质的标记活性通过常规技术测定,并且与样品中的维生素D分析物的量相关。在上述竞争性非均质测定的一个变型中,所述支持物包含维生素D类似物作为标记的试剂,并且维生素D抗体包含标记。
在一些实例中,待分析的样品在测定介质中与维生素D分析物的抗体和标记的维生素D类似物组合。怀疑含有维生素D分析物的样品已经用分析物的差向异构形式的抗体处理,以结合维生素D分析物的所有差向异构形式。检查介质中包含标记的维生素D类似物和维生素D分析物的抗体的复合物的存在和量中的一者或两者,其中此类复合物的存在和/或量指示样品中维生素D分析物的存在和/或量。
在根据本文所述的原理的一些实例中,待分析的样品经受预处理,以从内源性结合物质诸如例如结合维生素D的血浆或血清蛋白释放维生素D分析物。可以例如通过添加消化剂或释放剂或依次使用的消化剂和释放剂的组合,从内源性结合物质释放维生素D分析物。所述消化剂为分解内源性结合物质、使得它们不再可以结合维生素D的试剂。此类试剂包括但不限于蛋白酶K,以及蛋白酶K和蛋白变性剂诸如,例如洗涤剂(例如十二烷基硫酸钠)。通过说明而非限制的方式,用于从内源性结合物质释放维生素D的释放剂包括酸性变性剂诸如,例如水杨酸、华法林、磺酸类、甲苯磺酸类、萘磺酸、苯胺萘磺酸类(ANS)(包括例如1-苯胺基萘-8-磺酸(1,8-ANS)和8-苯胺基萘-1-磺酸(8-ANS))、水杨酸类和上述的衍生物。
用于进行消化或释放作用的条件诸如,例如持续时间、温度、pH和介质中释放剂的浓度取决于例如内源性结合物质的性质,样品的性质,以及释放剂的性质。通常,所述条件足以获得所需的效果或功能。在根据本文所述的原理的一些实例中,释放剂的有效浓度为约0.01至约20 mg/mL,或约0.01至约10 mg/mL,或约0.01至约5 mg/mL,或约0.1至约20 mg/mL,或约0.1至约10 mg/mL,或约0.1至约5 mg/mL,或约0.1至约1 mg/mL。从内源性结合物质释放维生素D分析物的样品的预处理可以在进行测定之前作为单独的步骤,或在测定中作为第一个步骤进行。在任一情况下,可能需要一种或多种试剂来停止消化剂和/或释放剂的作用。
进行测定的条件包括在通常提供最佳测定灵敏度的适度pH下在水性缓冲介质中进行测定。水性介质可以仅为水,或可以包括0.1至约40体积%的助溶剂。介质的pH将在例如约4至约11的范围内,或约5至约10的范围内,或约6.5至约9.5的范围内。pH将通常为任何特异性结合对的结合成员的最佳结合,该测定的其它试剂诸如信号产生系统的成员等等的pH最佳值之间的折中。各种缓冲剂可用来实现所需pH和在测定期间保持pH。通过说明而非限制的方式,说明性缓冲剂包括例如硼酸盐、磷酸盐、碳酸盐、TRIS、巴比妥、PIPES、HEPES、MES、ACES、MOPS和BICINE。所采用的具体缓冲剂不是关键的,但在个别测定中,可以优选一种或另一种缓冲剂。
测定方法中可以使用各种辅助材料。例如,除缓冲剂之外,介质可以包含采用的介质和试剂的稳定剂。在一些实施方案中,除这些添加剂之外,可以包括蛋白诸如,例如白蛋白;有机溶剂诸如,例如甲酰胺;季铵盐;聚阴离子诸如,例如硫酸葡聚糖;结合增强剂,例如聚亚烷基二醇;多糖诸如,例如葡聚糖或海藻糖。介质也可以包含用于防止形成血块的试剂。此类试剂是本领域中众所周知的,且包括但不限于例如EDTA、EGTA、柠檬酸盐、肝素。介质也可以包含一种或多种防腐剂,诸如但不限于例如叠氮化钠、硫酸新霉素、PROCLIN® 300、链霉素。介质可以另外包含一种或多种表面活性剂。如果采用,任何上述材料以足以获得所需效果或功能的浓度或量存在。
可以以一个或多个时间间隔向介质施加一个或多个孵育时段,所述时间间隔包括添加测定中采用的各种试剂(包括上述那些)之间的任何时间间隔。介质通常在足以发生各种试剂组分的结合以及样品中的维生素D的结合的温度和时间下孵育。适度的温度通常用于实施该方法,且测量时段期间通常为恒温,优选为室温。在一些实例中,孵育温度范围为例如约5℃至约99℃,或约15℃至约70℃,或约20℃至约45℃。在一些实例中,孵育的时间段为例如约0.2秒至约24小时,或约1秒至约6小时,或约2秒至约1小时,或约1分钟至约15分钟。时间段取决于介质的温度和各种试剂结合的速率,这通过缔合速率常数、浓度、结合常数和解离速率常数测定。
在用于测定怀疑含有维生素D分析物的样品中的维生素D分析物的方法的实例中,在介质中提供组合,其中该组合包括样品、释放剂(如果样品未经预处理以从内源性结合物质释放维生素D分析物),维生素D的抗体,和标记的维生素D类似物,其中该标记为聚(氨基酸)标记或非聚(氨基酸)标记。在其之前或与之同时,怀疑含有维生素D分析物的样品用分析物的差向异构形式的抗体处理,以结合维生素D分析物的所有差向异构形式。检查该介质的包含维生素D和维生素D的抗体的复合物或包含标记的化合物和维生素D的抗体的复合物中的一者或两者的存在和/或量。复合物中的一者或两者的存在和/或量指示样品中维生素D分析物的存在和/或量。
一些已知的测定法利用信号产生系统(sps),其采用第一和第二sps成员。名称“第一”和“第二”是完全任意的,且并不意在暗示sps成员间的任何顺序或排序,或在本方法中添加sps成员的任何顺序。sps成员可以是关联的,因为sps的一个成员的活化产生产物(诸如,例如光或活化产物),其导致sps的另一个成员的活化。
在测定法的一些实施方案中,sps成员包含敏化剂诸如,例如光敏剂,和化学发光组合物,其中敏化剂的活化产生使化学发光组合物活化的产物。第二sps成员通常产生可检测信号,所述可检测信号与结合和/或未结合的sps成员的量(即与所检测的维生素D分析物或与根据本文所述的原理的化合物结合或未结合的sps成员的量)相关。在根据本文所述的原理的一些实例中,敏化剂试剂或化学发光试剂之一包含本化合物试剂。
在下文讨论的测定法的实例中,怀疑含有维生素D分析物的样品,在其之前或与之同时,用分析物的差向异构形式的抗体处理,以结合维生素D分析物的所有差向异构形式。
在一个具体实例中,可以采用诱导发光免疫测定法。诱导发光免疫测定法在美国专利号5,340,716 (Ullman)(其公开内容通过引用并入本文)中提及。在一种方法中,该测定法使用具有与之缔合的光敏剂的颗粒,其中维生素D类似物与该颗粒结合(颗粒-化合物试剂)。化学发光试剂包含维生素D分析物的抗体。维生素D分析物与颗粒-化合物试剂竞争与维生素D的抗体结合。如果存在维生素D分析物,则较少数目的颗粒-化合物试剂分子与化学发光试剂紧密接近。因此,测定信号将减小。当两种标记紧密接近时,光敏剂产生单线态氧,并活化化学发光试剂。经活化的化学发光试剂随后产生光。所产生的光的量与所形成的复合物的量相关,其进而与样品中存在的维生素D分析物的量相关。
在诱导发光免疫测定法的另一个具体实例中,该测定法使用具有与之缔合的化学发光化合物的颗粒,其中维生素D类似物与颗粒结合(颗粒-化合物试剂)。光敏剂试剂包含维生素D的抗体。维生素D分析物与颗粒-化合物试剂竞争与维生素D的抗体结合。如果存在维生素D分析物,较少数目的颗粒-化合物试剂分子与光敏剂试剂紧密接近。因此,测定信号将减小。当两种标记紧密接近时,光敏剂产生单线态氧,并活化颗粒-化合物试剂的化学发光化合物。经活化的化学发光化合物随后产生光。所产生的光的量与所形成的复合物的量相关,其进而与样品中存在的维生素D分析物的量相关。
在诱导发光测定法的另一个具体实例中,采用光敏剂颗粒,其与小分子的结合配偶体诸如,例如抗生物素蛋白或链菌抗生物素蛋白(其为生物素的结合配偶体)缀合。也采用包含生物素的维生素D类似物(化合物-生物素试剂)。包含维生素D分析物的抗体的化学发光试剂用作检测系统的一部分。将反应介质孵育以允许光敏剂颗粒的抗生物素蛋白或链菌抗生物素蛋白借助于抗生物素蛋白和生物素之间的结合而与化合物-生物素试剂结合,并且还允许作为化学发光试剂的一部分的维生素D分析物的抗体与维生素D分析物或与光敏剂颗粒现在连接的维生素D类似物结合。然后,用光辐照该介质以激发光敏剂,其在其激发态能够使氧活化为单线态。因为由于存在维生素D分析物,现在较少的化学发光试剂与光敏剂紧密接近,所以单线态氧对化学发光试剂的活化较少,且发光较少。然后检查介质的发光或发射光的存在和/或量,其存在与维生素D分析物的存在和/或量相关,其中在维生素D分析物存在下,观察到信号减小。
在诱导发光测定法的另一个具体实例中,采用光敏剂颗粒,其与小分子的结合配偶体诸如,例如抗生物素蛋白或链菌抗生物素蛋白(其为生物素的结合配偶体)缀合。缀合试剂包含与生物素缀合的维生素D分析物的抗体。采用维生素D类似物,其中该化合物与化学发光颗粒连接(化学发光-化合物试剂)。将反应介质孵育以允许光敏剂颗粒的抗生物素蛋白或链菌抗生物素蛋白借助于抗生物素蛋白和生物素之间的结合而与抗体-生物素试剂结合,并且还允许维生素D分析物的抗体与样品中如果存在的维生素D分析物和与作为化学发光-化合物试剂的一部分的维生素D类似物结合。然后,用光辐照该介质来激发光敏剂,其在其激发态能够使氧活化为单线态。因为由于存在维生素D分析物,现在较少的化学发光-化合物试剂与光敏剂紧密接近,所以单线态氧对化学发光试剂的活化较少,且发光较少。然后检查介质的发光或发射光的存在和/或量,其存在与维生素D分析物的存在和/或量相关,其中在维生素D分析物存在下,观察到信号减小。
通过说明而非限制的方式,用于检测维生素D分析物的测定形式的另一个实例为ACMIA测定形式。对于ACMIA测定形式,涂覆有维生素D类似物的二氧化铬颗粒(二氧化铬颗粒试剂)用作第一组分。第二组分为维生素D分析物的抗体。与报告酶(例如β-半乳糖苷酶)交联以形成抗体-酶缀合物的该抗体,以过量(即大于结合样品中可能存在的所有维生素D分析物所需的量)添加至反应容器中。预先经受用释放剂处理的样品用维生素D分析物的抗体来处理,所述抗体与样品中的维生素D分析物结合。抗体-酶缀合物与样品在介质中混合,以允许维生素D分析物与抗体结合。接下来,添加二氧化铬颗粒试剂以结合尽(bind up)任何过量的抗体-酶缀合物。然后,施加磁铁,其将所有二氧化铬颗粒和过量抗体-酶从悬浮液中拉出,并将上清液转移至最终的反应容器。将报告酶的底物添加至最终的反应容器中,并且将酶活性分光光度测量为吸光度随时间的变化。该信号的量与样品中维生素D分析物的量相关。
根据本文所述的原理的维生素D测定法的另一个实例为使用顺磁性颗粒作为固相的吖啶酯标记免疫测定法(ADVIA免疫测定法)。用于维生素D测定法的该实例的检测系统包括作为小分子缀合物或捕获缀合物的小分子-标记的维生素D类似物(捕获部分),作为固相(SP)的小分子的结合配偶体涂覆的顺磁性胶乳颗粒,和吖啶酯标记的维生素D分析物的抗体(检测抗体)。小分子可以是例如生物素或荧光素,且各个结合配偶体可以是链菌抗生物素蛋白或荧光素抗体。维生素D类似物可以与小分子直接连接,或者通过连接基团诸如,例如蛋白,例如牛血清白蛋白(BSA)与小分子连接。患者样品中的维生素D分析物与捕获部分的维生素D类似物竞争与吖啶酯标记的检测抗维生素D抗体结合。怀疑含有维生素D的样品用1,8-ANS进行预处理。该测定法可以根据随之提供的制造商说明书,在Centaur®、Centaur® XP或Centaur® CP设备(Siemens Healthcare Diagnostics Inc.,Newark DE)上进行。该信号的量与样品中的差向异构维生素D分析物的量相关。
根据本文所述的原理的维生素D分析物的测定法的另一个实例是使用顺磁性颗粒作为固相的吖啶酯标记免疫测定法(ADVIA免疫测定法)。用于维生素D测定法的该实例的检测系统包括作为生物素缀合物或捕获缀合物的小分子-标记的维生素D分析物的抗体(捕获抗体),作为固相(SP)的链菌抗生物素蛋白涂覆的顺磁性胶乳颗粒,和吖啶酯标记的维生素D类似物(检测半抗原)。吖啶酯标记可以与维生素D类似物直接结合以形成检测半抗原,或者可以使用连接基团,包括例如蛋白诸如,例如BSA。患者样品中的维生素D分析物与吖啶酯标记的检测半抗原竞争与抗维生素D抗体结合。怀疑含有维生素D的样品用1,8-ANS进行预处理。该测定法可以根据随之提供的制造商说明书,在Centaur®、Centaur® XP或Centaur®CP设备(Siemens Healthcare Diagnostics Inc.,Newark DE)上进行。在上述吖啶酯测定法的变型中,小分子可以是例如生物素或荧光素。该信号的量与样品中的差向异构维生素D分析物的量相关。
可以测定的样品中维生素D分析物的浓度通常为例如约10-5至约10-17M,或约10-6至约10-14M。考量诸如测定法是定性、半定量还是定量的(相对于样品中存在的维生素D分析物的量),具体检测技术,和维生素D分析物的预期浓度通常决定各种试剂的浓度。
一种或多种分析物的差向异构形式的抗体的浓度取决于例如分析物的差向异构形式的怀疑浓度和(非差向异构)维生素D分析物的预期浓度中的一种或多种。在一些实例中,一种或多种分析物的差向异构形式的抗体的浓度足以结合样品中的维生素D分析物的所有差向异构形式。在一些实例中,基于样品中的分析物的差向异构形式的预期浓度,一种或多种分析物的差向异构形式的抗体的浓度是过量的。
测定介质中各种试剂的浓度将通常由维生素D分析物的目标浓度范围、测定的性质等决定。然而,试剂各自的最终浓度通常凭经验确定,以优化测定法在目标范围的灵敏度。也就是说,显著的维生素D分析物的浓度变化应当提供可精确测量的信号差异。考量诸如信号产生系统的性质和分析物的性质通常决定各种试剂的浓度。
如上所提及,样品和试剂以组合提供于介质中。尽管添加至介质的顺序可以变化,但对于本文所述的测定形式的一些实施方案,将存在特定优先性。最简单的添加顺序当然是同时添加所有材料,并测定测定介质对信号具有的影响,如在均质测定法中。或者,可以依次组合各试剂,或试剂组。在一些实施方案中,在如上所述的各添加之后,可以涉及孵育步骤。在非均质测定法中,在一个或多个孵育步骤之后还可以采用洗涤步骤。
化合物
如上所提及,根据本文所述的原理的一些实例涉及针对式I化合物且包括下述化合物中的两种或更多种的混合物产生的结合配偶体诸如,例如适体和抗体:
(R1)p-(L)q-Z,其中
或H,其中至少一个R1不是H,
Y是O、S、CR或NR4,
X是-O-(CH2)n-C(O)-、-(CH2)w-C(O)-或-NR3-C(O)-,例如,在一些实例中,当Y是NR4时,X是-O-(CH2)n-C(O)-,例如当Y是O或S时,X是-(CH2)w-C(O)-、-(CH2)w-C(O)-(CH2)x-C(O)-或-(CH2)w-C(O)-NH(CH2)y-C(O)-,例如,或者,当Y是CR 时,X是-NR3-C(O)-,
R独立地是H或烷基,
R2独立地是H或烷基,
R3、R4、R5和R6独立地是H或烷基,或者R4和R5可以一起形成键,或者R5和R6可以一起形成键,
R11是H、烷基或酰基,
n是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,
w是例如0至10,1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,
x是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,
y是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,
p是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,
L是连接基团,
q是0或1,且
Z是OR8,其中R8是H、烷基或NR9R10,其中R9和R10独立地是H或烷基,聚(氨基酸)免疫原性载体部分,非聚(氨基酸)免疫原性载体部分,聚(氨基酸)标记部分,非聚(氨基酸)标记部分,非标记聚(氨基酸)部分,非免疫原性载体聚(氨基酸)部分或支持物。
如本文所使用,术语“烷基”包括直链、支链,或环状构型的指定碳原子数的那些烷基。“烷基”的实例包括但不限于例如甲基、乙基、丙基、异丙基、丁基、仲丁基和叔丁基、戊基、己基、庚基、环丙基、环丁基、环戊基、环己基、环庚基、降冰片基。在一些实例中,烷基含有1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10个碳原子,其可以是未取代的或其中的一个或多个可以被羟基,1至5、或1至4、1至3、或1至2、或2至5、或2至4、或2至3、或3至5、或3至4、或4至5个碳原子的烷氧基中的一个或多个取代。
如本文所使用,术语“酰基”意指R12C(O)-,其中R12是烷基或芳基。
如本文所使用,术语“芳基”意指通过去除一个原子衍生自芳族烃且含有一个或多个芳族环、通常一至四个芳族环的有机基团,诸如例如苯基(衍生自苯)、萘基(衍生自萘)等,例如苯基、萘基、菲基。
如本文所使用,短语“连接基团”是指化学部分,其可以包含约2至约50个原子或4至约30个原子(不计算氢),并且可以包含2至约30个原子、或3至约20个原子的链,所述原子各自独立地选自通常由碳、氧、硫、氮和磷组成的组。在一些实例中,部分或全部所述连接基团可以是连接的分子的一部分,诸如但不限于,例如聚(氨基酸)上的氨基酸残基。连接基团中的杂原子的数目可以是0至约20、或1至约15、或约2至约10。所述连接基团可以是脂族或芳族的。当存在杂原子时,氧通常作为键合至碳、硫、氮或磷的氧代或氧基存在,氮通常作为通常键合至碳、氧、硫或磷的硝基、亚硝基或氨基存在;硫与氧相似;而磷通常作为膦酸单或二酯和磷酸单或二酯键合至碳、硫、氧或氮。在连接基团和待缀合的分子之间形成共价键的常见官能团为烷基胺、脒、硫代酰胺、醚、脲、硫脲、胍、偶氮、硫醚和羧酸酯、磺酸酯和磷酸酯、酰胺和硫酯。
在大多数情况下,当连接基团具有连接官能团(用于与基团反应的官能团),诸如例如,包括氮和硫类似物的非氧代羰基基团、磷酸酯基团、氨基基团,烷基化剂诸如卤代或甲苯磺酰基烷基,氧基(羟基或硫类似物、巯基)氧代羰基(例如,醛或酮),或活性烯烃诸如乙烯基砜或α-、β-不饱和酯时,这些官能团被连接至胺基团、羧基基团、活性烯烃、烷基化剂,例如溴乙酰基。当连接胺和羧酸或其氮衍生物或磷酸时,形成酰胺、脒和磷酰胺。当连接硫醇和活化烯烃时,形成硫醚。当连接硫醇和烷基化剂时,形成硫醚。当在还原条件下连接醛和胺时,形成烷基胺。当连接酮或醛和羟胺(包括其衍生物,其中取代基取代羟基基团的氢)时,形成肟官能团(=N-O-)。当连接羧酸或磷酸和醇时,形成酯。
如本文所使用,术语“免疫原性载体”意指与半抗原缀合的基团或部分。免疫原性载体和半抗原的缀合物可以注射入能够引发免疫应答的生物体,诸如但不限于哺乳动物、禽类(例如鸡或鸽)、两栖动物或爬行动物;或者所述缀合物可用于接种体外样品(哺乳动物,包括人、禽类、两栖动物或爬行动物)或以其它方式可用于产生半抗原的结合配偶体的技术中。
短语“结合配偶体”是指作为特异性结合对的成员的分子,其是特异性结合另一分子并因此被定义为与另一分子互补的两种不同分子之一。例如,特异性结合对的一个成员可以在表面上或在空腔中具有特异性结合特异性结合对的另一成员的特定空间和极性组织的区域。通过说明而非限制的方式,所述结合配偶体可以是例如抗体或适体(例如,核酸适体或肽适体)。在一个实例中,免疫原性载体可以用作免疫原以诱导免疫应答并引发半抗原的结合配偶体的产生。其它技术包括噬菌体展示和体外选择。免疫原性载体有时也被称为抗原载体。在根据本文所述的原理的一些实例中,合成包含免疫原性载体(包括聚(氨基酸)和非聚(氨基酸)免疫原性载体)的免疫原,并用于制备抗体。半抗原是能够特异性结合至相应抗体的化合物,但本身不充当用于制备所述抗体的免疫原(或抗原)。因此,将半抗原连接至可用于例如产生抗体的免疫原性载体。
作为免疫原性载体的聚(氨基酸)的分子量范围(以道尔顿计)为例如约5,000至约10,000,000,或约20,000至约600,000,或约25,000至约250,000。“聚(氨基酸)免疫原性载体部分”包括蛋白诸如,例如,白蛋白、血清蛋白,例如球蛋白、眼晶状体蛋白和脂蛋白。说明性蛋白包括但不限于例如牛血清白蛋白(BSA)、匙孔䗩血蓝蛋白(KLH)、卵卵白蛋白和牛γ球蛋白(BGG)。“非聚(氨基酸)免疫原性载体部分”包括多糖、核酸和颗粒(生物材料和合成材料)。各种免疫原性载体公开于Davalian等人,美国专利号5,089,390,第4栏第57行至第5栏第5行中,其通过引用并入本文。
如上所提及,所述免疫原性载体部分可以是多糖,所述多糖是单糖的高分子量聚合物,其可以天然或合成制备并通常涉及单糖的重复缩合。多糖的实例是淀粉、糖原、纤维素、碳水化合物胶,诸如阿拉伯树胶、琼脂等等。所述多糖还可含有聚(氨基酸)残基和/或脂质残基。
如本文所使用,术语“标记”包括聚(氨基酸)标记和非聚(氨基酸)标记。术语“聚(氨基酸)标记部分”包括作为蛋白的标记,例如但不限于例如酶、抗体、肽和免疫原。对于标记蛋白诸如,例如酶,重均分子量范围将为约10,000至约600,000,或约10,000至约300,000。例如,每约200,000分子量的蛋白通常存在至少一个根据本文所述的原理的化合物(类似物基团),或每约150,000分子量至少约1个,或每约100,000分子量至少约1个,或每约50,000的分子量至少约1个,或每40,000分子量至少约1个,或每30,000分子量至少约1个,或每20,000分子量至少1个,或每10,000分子量至少1个,或每5,000分子量至少1个。在酶的情况下,类似物基团的数目通常为1至约20,约2至约15,约3至约12,或约6至约10。
通过说明而非限制的方式,酶包括氧化还原酶诸如,例如脱氢酶,例如葡萄糖-6-磷酸脱氢酶(G6PDH)和乳酸脱氢酶;涉及过氧化氢的产生和使用过氧化氢将染料前体氧化为染料的酶诸如,例如辣根过氧化物酶、乳过氧化物酶和微过氧化物酶;水解酶诸如,例如碱性磷酸酶和β-半乳糖苷酶;荧光素酶诸如,例如萤火虫荧光素酶和细菌荧光素酶;转移酶;酶的组合,诸如但不限于糖氧化酶,例如葡萄糖和半乳糖氧化酶,或杂环氧化酶,诸如尿酸酶和黄嘌呤氧化酶,其与采用过氧化氢以氧化染料前体的酶(即过氧化物酶诸如辣根过氧化物酶、乳过氧化物酶或微过氧化物酶)偶联。
如本文所使用,术语“非-聚(氨基酸)标记”包括不是蛋白的那些标记。所述非聚(氨基酸)标记能够直接被检测或可通过产生可检测信号的反应检测。所述非聚(氨基酸)标记可以是同位素的或非同位素的,并且通过说明而非限制的方式,可以是例如放射性同位素、发光化合物(其包括但不限于例如荧光化合物和化学发光化合物)、编码催化剂的多核苷酸、促进剂(promoter)、染料、辅酶、酶底物、放射性基团、小有机分子(分子量200至2,000)、颗粒和可扩增的多核苷酸序列。
如上所提及,“小有机分子”具有约200至约2,000,或约200至约1,500,或约200至约1,000,或约200至约500的分子量。此类“小有机分子”包括但不限于例如生物素、荧光分子(诸如荧光素和罗丹明)、化学发光分子和二硝基苯酚。小有机分子的结合配偶体是特异性识别并结合至所述小分子的分子。小分子的结合配偶体由所述小分子的性质限定,并且包括但不限于,例如抗生物素蛋白、链菌抗生物素蛋白、小有机分子的抗体(其包括但不限于荧光分子的抗体(例如荧光素抗体和罗丹明抗体)、化学发光分子的抗体和二硝基苯酚的抗体)。
如本文所使用,术语“非标记聚(氨基酸)部分”和“非免疫原性载体聚(氨基酸)部分”是指通常不被认为是标记或免疫原性载体的聚(氨基酸),尽管在某些情况下此类部分可以是标记或免疫原性载体。例如,抗体可以不被认为是标记,但如果抗体被修饰以包括信号产生部分或信号产生系统的一部分,则可以是标记。此外,抗体可以不被认为是免疫原性载体,但尽管如此在某些情况下能够是免疫原性载体,因为其分子量更高。
在一些实例中,非聚(氨基酸)标记可以选自支持物、磁性颗粒、吖啶酯、磁性颗粒和吖啶酯(诸如例如,吖啶酯标记的顺磁性颗粒)的组合、化学发光颗粒和敏化剂颗粒。
术语“共价”是指分子的连接,诸如通过直接连接,例如分子之间的化学键。术语“非共价”是指分子的连接,其涉及连接至分子的互补特异性结合对(sbp)成员之间的特异性结合。
在一些实例中,根据本文所述的原理的化合物可以与支持物结合,例如通过共价或非共价结合。如上所提及,在根据本文所述的原理的一些实例中,R2可以是支持物,其可以由有机或无机的、固体或液体的水不溶性材料构成,并且其可以是透明的或部分透明的。所述支持物可具有例如许多形状的任一种,诸如但不限于颗粒(颗粒状支持物),包括珠粒、薄膜、膜、管、孔、条、棒、纤维或平坦表面,诸如例如板或纸。所述支持物可以或可以不在其中采用它的介质中可悬浮。可悬浮支持物的实例是例如聚合物材料,诸如胶乳、脂质双层或脂质体、油滴、细胞和水凝胶以及磁性颗粒。其它支持物组合物包括聚合物,通过说明而非限制的方式,诸如硝化纤维素、醋酸纤维素、聚(氯乙烯)、聚丙烯酰胺、聚丙烯酸酯、聚乙烯、聚丙烯、聚(4-甲基丁烯)、聚苯乙烯、聚甲基丙烯酸酯、聚(对苯二甲酸乙二醇酯)、尼龙、聚(丁酸乙烯酯),例如其可以本身使用或与其它材料结合使用。所述支持物可以用或可以不用例如染料、催化剂或其它可检测基团进一步标记。
在根据本文所述的原理的一些实例中,所述支持物可以是颗粒。所述颗粒具有至少约0.02微米且不大于约100微米的平均直径。在一些实例中,所述颗粒具有约0.05微米至约20微米,或约0.3微米至约10微米的平均直径。所述颗粒可以是有机的或无机的、可溶胀的或不可溶胀的、多孔的或非多孔的,优选具有通常为约0.7 g/mL至约1.5 g/mL的接近于水的密度,并且由可以是透明的、部分透明的或不透明的材料构成。所述颗粒可以是例如生物材料,诸如细胞和微生物,例如红细胞,白细胞,淋巴细胞,杂交瘤,链球菌,金黄色葡萄球菌和大肠杆菌,病毒。所述颗粒也可以是由有机和无机聚合物、脂质体、胶乳颗粒、磁性或非磁性颗粒、磷脂囊泡、乳糜微粒、脂蛋白等构成的颗粒。在一些实例中,所述颗粒是二氧化铬(chrome)颗粒或胶乳颗粒。
磁性颗粒包括顺磁性颗粒、铁磁性颗粒和抗磁性颗粒。此类颗粒包括但不限于例如周期表的周期4-7的过渡金属,包括铬、铜、钴、铝、锰、铁和镍。
化学发光颗粒是具有与之缔合的化学发光化合物的颗粒。如本文所使用,短语“与之缔合”意味着化合物诸如例如化学发光化合物和颗粒可以通过例如直接或间接键合、吸附、吸收、并入或溶解来缔合。可以利用的化学发光化合物的实例是美国专利号5,340,716和6,251,581中阐述的那些,其相关公开内容通过引用并入本文。在根据本文所述的原理的一些实例中,化学发光化合物是可光活化物质,其直接或由光敏化激发后,或与单线态氧反应后,经历化学反应以形成亚稳态反应产物,其能够分解,同时或随后发射光(通常在250-1200 nm的波长范围内)。术语“可光活化的”包括“可光化学活化的”。在一些实例中,所述化学发光化合物是与单线态氧反应以形成二氧杂环丁烷或二氧杂环丁酮的那些。后者通常是富电子烯烃。此类富电子烯烃的示例是烯醇醚、烯胺、9-亚烷基-N-烷基-9,10-二氢化吖啶(alkylacridan)、芳基乙烯基醚、二噁烯(dioxenes)、芳基咪唑、9-亚烷基-苍耳烷和光泽精。其它化合物包括鲁米诺(luminol)和其它邻苯二甲酰肼,以及借助于通过光化学不稳定保护基团保护它们而被保护免于经历化学发光反应的化学发光化合物,此类化合物包括,例如,萤火虫荧光素、水通道蛋白(aquaphorin)和鲁米诺。可以利用的此类化学发光化合物的实例是美国专利号5,709,994(其相关公开内容通过引用并入本文)中阐述的那些。
敏化剂颗粒是具有与之缔合的敏化剂化合物的颗粒,其包括但不限于光敏剂化合物。可以利用的敏化剂化合物的实例是美国专利号5,340,716和6,251,581(其相关公开内容通过引用并入本文)中阐述的那些。
光敏剂是通常通过用光激发产生单线态氧的敏化剂。在一些实例中,所述光敏剂比所述化学发光化合物吸收更长的波长且具有比所述化学发光化合物更低的能量三重态。所述光敏剂可以是可光活化的(例如,染料和芳族化合物)。所述光敏剂通常是由共价键合的原子构成的化合物,其通常具有多个共轭双键或三键。所述化合物应当吸收在200-1100 nm,通常300-1000 nm,优选450-950 nm的波长范围内的光。典型的光敏剂包括但不限于例如丙酮、二苯甲酮、9-噻吨酮、曙红、9,10-二溴蒽、亚甲基蓝、金属卟啉(例如血卟啉)、酞菁、叶绿素、玫瑰红、勃克明斯特富勒烯(buckminsterfullerene),以及这些化合物的衍生物。其它光敏剂的实例列举于N.J. Turro,"Molecular Photochemistry",第132页,W. A. Benjamin Inc.,N.Y. 1965中。所述光敏剂有助于其中通过单线态氧活化的光活化。通常,所述光敏剂吸收光且因此形成的经激发的光敏剂使氧活化以产生单线态氧,所述单线态氧与化学发光化合物反应以产生亚稳定发光中间体。
在本文阐述的式中,通过键的波形线指示式中的部分的连接点。
根据本文所述的原理的一些实例涉及针对式IV化合物(其为式I化合物且包括下述化合物中的两种或更多种的混合物)产生的结合配偶体诸如,例如抗体,其中:
或H,其中至少一个R1不是H。
根据本文所述的原理的一些实例涉及针对(7aS,E)-4-((Z)-2-((R)-5-羟基-2-亚甲基-亚环己基)亚乙基)-7a-甲基八氢-1H-茚-1-酮(HMCHEMOIO衍生物)或式V化合物(其为式I化合物且包括下述化合物中的两种或更多种的混合物)产生的结合配偶体诸如,例如抗体,其中:
或H,其中至少一个R1不是H。
根据本文所述的原理的一些实例涉及针对式VI化合物(其为式I化合物且包括下述化合物中的两种或更多种的混合物)产生的结合配偶体诸如,例如抗体,其中:
(R1)p-(L)q-是NHR1-(CH2)r-NR1-((CH2)r-NR1)s-(CH2)r-NR7-,其中R1独立地是
或
或
或H,
其中至少一个R1不是H,
r独立地是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,
s是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,且
R7是H或烷基。
根据本文所述的原理的一些实例涉及针对下式II化合物且包括下述化合物中的两种或更多种的混合物产生的结合配偶体诸如,例如抗体:
NHR1’-(CH2)r’-NR1’’-((CH2)r’-NR1’’’)s’-(CH2)r’-NR7’-Z’,其中
R1’、R1’’或R1’’’各自独立地选自
,
,
和H,
其中R1’、R1’’或R1’’’中的至少一个不是H,
r’ 独立地是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,
s’是例如1至10,或1至9,或1至8,或1至7,或1至6,或1至5,或1至4,或1至3,或1至2,或2至10,或2至9,或2至8,或2至7,或2至6,或2至5,或2至4,或2至3,或3至10,或3至9,或3至8,或3至7,或3至6,或3至5,或3至4,或4至10,或4至9,或4至8,或4至7,或4至6,或4至5,或5至10,或5至9,或5至8,或5至7,或5至6,或6至10,或6至9,或6至8,或6至7,或7至10,或7至9,或7至8,或8至10,或8至9,或9至10的整数,
R7’是H或烷基,
R11’是H、烷基或酰基,且
Z’是聚(氨基酸)免疫原性载体或非聚(氨基酸)免疫原性载体。
在一些实例中,s’是1。在一些实例中,R7’是H。在一些实例中,r’是2。在一些实例中,R1’’和R1’’’是H;在一些实例中,R1’和R1’’’是H;且在一些实例中,R1’和R1’’是H。在一些实例中,R1’、R1’’和R1’’’无一是H,即R1’、R1’’和R1’’’都是
或
或
。
根据本文所述的原理的一些实例涉及药物组合物,其包含有效量的例如针对式I化合物产生或针对式II化合物产生或针对式V化合物产生或针对式VI化合物产生的抗体。
化合物的制备
通过说明而非限制的方式,下文讨论制备作为根据本文所述的原理的HMCHEMOIO衍生物的化合物的方法的实例。可以采用其它方法以形成上述化合物和与本文所述的原理一致的其它化合物。
制备式VII化合物((7aS,E)-4-((Z)-2-((R)-5-羟基-2-亚甲基亚环己基)亚乙基)-7a-甲基八氢-1H-茚-1-酮)的实例阐述于图2中。参考图2,将式VIII化合物(其中R11O是乙酰基)处理以形成式IX的缩酮。在一个实例中,在芳族溶剂诸如苯中,在强有机酸诸如例如对甲苯磺酸存在下,在形成缩酮的条件(温度和时间)下,用乙二醇处理式VIII化合物。在一些实例中,反应在回流下进行约10小时至约24小时或约12至约20小时的时段。
处理式IX化合物以引入卤化物基团诸如,例如氯化物基团或溴化物基团。在一个实例中,在有机溶剂诸如例如烷烃(例如,己烷)中,例如在将溴化物基团引入式IX化合物的条件下,用N-溴代琥珀酰亚胺和自由基引发剂诸如例如偶氮二异丁腈处理式IX化合物,以得到式X化合物。在一些实例中,反应在回流下进行约30分钟。
去除式X化合物的卤化物,以得到具有两个共轭双键的式XI化合物。在一个实例中,在极性有机溶剂诸如例如醚(例如四氢呋喃)中,例如在用于去除卤化氢的条件下,用弱碱诸如例如四正丁基氟化铵处理式X化合物,以形成双键(式XI化合物)。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约2小时。
通过在极性有机溶剂诸如例如烷醇(例如,甲醇或乙醇)中用无机碱诸如例如氢氧化钠或氢氧化钾处理而去除式XI化合物的乙酰基(R11)。反应组分经受用于去除乙酰基的条件,以得到式XII的化合物。在一些实例中,反应期间的温度为约15℃至约25℃,或在室温下。反应时间段为约4小时至约8小时。
在水和极性有机溶剂诸如例如丙酮的混合物中,在用于去除缩酮的条件下,例如使用强有机酸诸如例如对甲苯磺酸,去除式XII化合物的缩酮基团,以得到式XIII化合物。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约12小时至约48小时。
通过在极性有机溶剂诸如例如烷醇(例如甲醇或乙醇)、醚(例如乙醚)、酮(例如丙酮)或上述中的两种或更多种的组合中,在用于打开式XIII的环的条件下,用用于打开环的试剂处理式XIII化合物,诸如例如用UV光处理(光反应),来形成式VII化合物。在一些实例中,光反应期间的温度为约-20℃至约0℃。光反应时间段为约1至约10分钟或约3至约5分钟。光反应之后,使中间体在乙醇中回流约3小时。
通过说明而非限制的方式,图3描述了制备式IIa化合物(通过实例而非限制的方式,其中Z为BSA)的方法的实例。参考图3,使式VII化合物与氨基氧基乙酸(XIX)反应,以形成式XX的肟(2-((7aS,E)-4-((Z)-2-((R)-5-羟基-2-亚甲基亚环己基)亚乙基)-7a-甲基八氢-1H-茚-1-亚基氨基氧基)乙酸)。在有机溶剂诸如例如醇(例如甲醇或乙醇)中,在用于形成肟的条件下,进行该反应。在一些实例中,反应期间的温度为约10℃至约30℃或约15℃至约25℃。反应时间段为约1小时至约30小时或约2小时至约24小时。
在单独反应中,将聚(氨基酸)免疫原性载体(在该实例中,通过说明而非限制的方式,BSA(式II的Z’为BSA))与式XXI化合物组合,以形成式XXIa化合物。反应在约5.0至约7.0或约5.5至约6.5或约6的pH的水性缓冲介质中进行。反应介质中包括用于促进BSA的羧酸官能团与XXI的一个或多个胺基团反应的活化剂。此类偶联剂包括但不限于1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(EDAC)、N-羟基琥珀酰亚胺(NHS)或N,N,N′,N′-四甲基-O-(N-琥珀酰亚胺基)脲鎓四氟硼酸盐或上述中的两种或更多种的组合。反应在用于形成酰胺的条件下进行。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为例如约3小时至约24小时,或约4小时至约20小时,或约4小时至约10小时。
用活化剂诸如但不限于例如1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(EDAC)、N-羟基琥珀酰亚胺(NHS)或N,N,N′,N′-四甲基-O-(N-琥珀酰亚胺基)脲鎓四氟硼酸盐或上述中的两种或更多种的组合处理式XX化合物,以形成活化的XX。在极性有机溶剂诸如例如烷醇(例如甲醇或乙醇)、醚(例如乙醚或四氢呋喃)、酮(例如丙酮)、二甲基亚砜、乙腈、二氯甲烷或二甲基甲酰胺(DMF)或上述中的两种或更多种的组合(其也可以含有水)中进行反应。在一些实例中,反应期间的温度为约15℃至约30℃,或约20℃至约25℃,或约室温。反应时间段为约12小时至约36小时,或约20至约30小时。使活化的XX与式XXIa化合物反应,以得到式IIa化合物。如所示,R1’是式IIa化合物的部分,且R1’’和R1’’’各自是H。然而,与本文所述的原理一致,R1’’和R1’’’中的一者或两者可以是式IIa化合物的部分。在有机溶剂诸如例如DMF或DMSO中,例如在用于形成酰胺的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约30℃,或约20℃至约25℃,或约室温。反应时间段为约12小时至约36小时,或约20至约30小时。
通过说明而非限制的方式,图4描述了制备式VIa化合物和将式VIa化合物转化成式IIa化合物(通过实例而非限制的方式,其中Z为BSA)的方法的替代实例。参考图4,使式VII化合物与氨基氧基乙酸(XIX)反应,以形成式XX的肟。在有机溶剂诸如例如醇(例如甲醇或乙醇)中,在用于形成肟的条件下,进行该反应。在一些实例中,反应期间的温度为约10℃至约30℃或约15℃至约25℃。反应时间段为约1小时至约30小时或约2小时至约24小时。
将式XX的肟与式XXI化合物组合以形成式VIa化合物。在有机溶剂诸如例如烷烃(例如,己烷或戊烷)中,在用于形成酰胺的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约10小时至约48小时。
使式VIa化合物与聚(氨基酸)免疫原性载体(通过说明而非限制的方式,式II的Z’为BSA)反应,以得到式IIa化合物。如所示,R1’是式IIa化合物的部分,且R1’’和R1’’’各自是H。然而,与本文所述的原理一致,所得产物可以是化合物的混合物,其中在混合物的一种化合物中,R1’是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’两者都是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’’两者都是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’以及R1’’’所有三者都是式IIa化合物的部分。在有机溶剂诸如例如烷烃(例如,己烷或戊烷)中,在用于形成酰胺的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约10小时至约48小时。
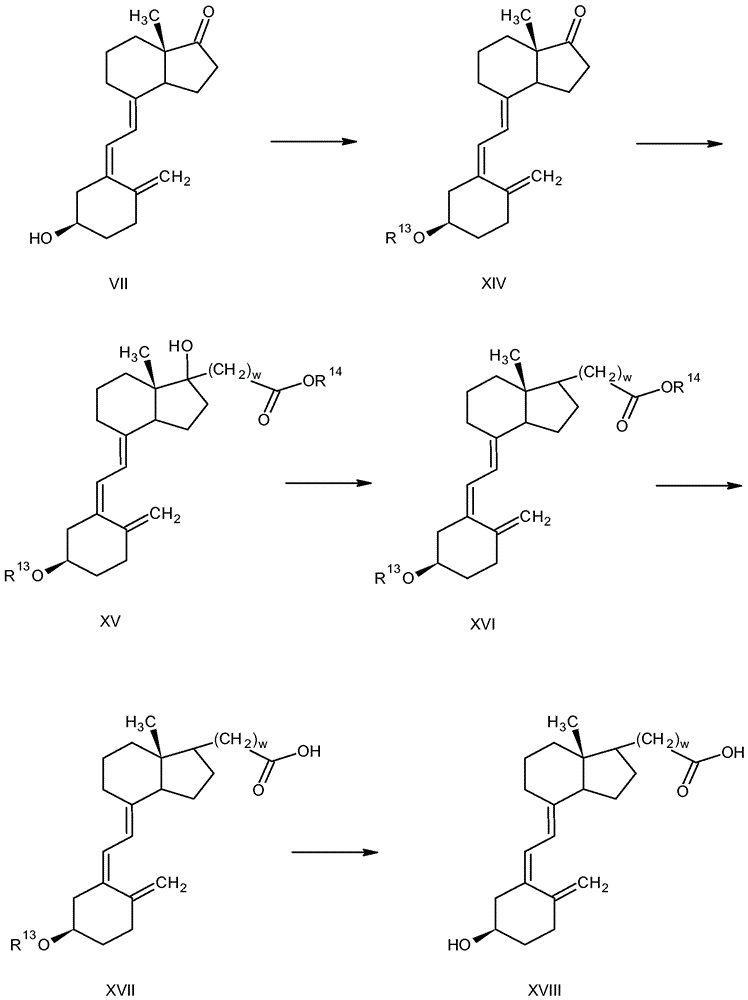
通过说明而非限制的方式,描述了制备根据本文所述的原理的化合物实例的方法的另一个实例,参考图5。可以采用其它方法以形成与本文所述的原理一致的化合物。式XVIII化合物(Y是式I中的C)的制备阐述于图5中。参考图5,处理式VII化合物(例如,如图3中所讨论制备)以保护游离羟基(R13是保护基团),以形成式XIV化合物。反应条件取决于例如保护基团的性质。
在一个实例中,在用于形成甲硅烷基醚的条件下用叔丁基二甲基甲硅烷基氯处理式VII化合物。在极性有机溶剂诸如例如吡啶、二甲基亚砜、醚(例如四氢呋喃、乙醚或1,4-二氧杂环己烷)、乙腈、二氯甲烷或二甲基甲酰胺(DMF)中,进行该反应。在一些实例中,反应期间的温度为约10℃至约30℃或约15℃至约25℃。反应时间段为约1小时至约30小时或约2小时至约24小时。
通过实例而非限制的方式,保护基团的实例是甲硅烷基(诸如但不限于,例如三甲基甲硅烷基、三甲基甲硅烷基、叔丁基二甲基甲硅烷基、三异丙基甲硅烷基、叔丁基二苯基甲硅烷基)、叔丁氧基羰基(t-Boc)、芴基甲基氧基羰基(Fmoc)、乙酰氨基甲基(Acm)、三苯基甲基(Trt)、苄基氧基羰基、联苯基异丙基氧基羰基、1-戊基氧基羰基、异冰片基氧基羰基、α-二甲基-3,5-二甲氧基苯基氧基羰基、邻硝基苯基亚磺酰、2-氰基-1,1-二甲基-乙氧基羰基、溴苄基氧基、氨基甲酰基和甲酰基。
通过例如在锌存在下与α-卤代酯反应(Reformatsky反应),从式XIV化合物形成式XV化合物。在该实例中,用Reformatsky试剂诸如例如BrZnCH2COOR14(在所示实例中的Zn和α-溴乙酸乙酯,w = 1)处理式XIV化合物,以得到式XV化合物。在有机溶剂诸如例如醚(例如四氢呋喃或乙醚)或芳族溶剂(例如苯或甲苯)中,进行该反应。在一些实例中,反应期间的温度为约4℃至约100℃或约10℃至约90℃。反应时间段为约4小时至约24小时。
将式XV化合物的游离羟基还原以形成式XVI化合物。可以通过方法处理式XV化合物以还原羟基,所述方法包括但不限于例如,甲苯磺酸酯形成,随后用金属氢化物诸如例如LiAlH4或NaBH4处理;去除羟基以形成烯烃(诸如例如,通过用浓有机酸例如浓硫酸或浓盐酸处理),随后在催化剂诸如例如铂或钯存在下氢化。反应条件取决于例如,采用的试剂的性质和溶剂的性质中的一者或两者。
处理所得式XVI化合物以将酯基水解成羧酸基团(脱酯化反应),以得到式XVII化合物。许多方法可用于脱酯化,且包括但不限于例如,皂化或用碱水溶液诸如例如用NaOH或KOH在加热下处理;或酸水解或用酸水溶液诸如例如无机酸水溶液(诸如例如盐酸或硫酸)处理。反应条件取决于例如,试剂的性质和酯的性质中的一者或多者。
通过从式XVII化合物去除保护基团R13而形成式XVIII化合物。各种方法可以用于去除保护基团,并且包括但不限于用稀无机酸(诸如例如盐酸或硫酸)处理;在极性有机溶剂(诸如例如烷醇(例如甲醇或乙醇)、醚(例如乙醚或四氢呋喃)、酮(例如丙酮)、二甲基亚砜、乙腈、二氯甲烷或二甲基甲酰胺(DMF)或上述中的两种或更多种的组合(其也可以含有水))中,在用于去除保护基的条件下,用有机酸(诸如例如乙酸)处理,以得到式XVIII化合物。反应条件取决于例如,试剂的性质和保护基团的性质中的一者或多者。
通过说明而非限制的方式,图6描述了制备式VIb化合物和将式VIb化合物转化成式IIb化合物(通过实例而非限制的方式,其中Z’为KLH)的方法的实例。参考图6,处理式XVIII化合物以活化羧酸基团诸如但不限于,形成N-羟基琥珀酰亚胺(NHS)酯(式XXII化合物)的反应。在极性有机溶剂诸如例如二甲基亚砜、醚(例如四氢呋喃或乙醚)、乙腈、二氯甲烷或二甲基甲酰胺(DMF)中,例如在用于形成NHS酯的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约4小时至约48小时。
将式XXII的NHS酯与式XXI化合物组合以形成式VIb化合物。在有机溶剂诸如例如烷烃(例如,己烷或戊烷)中,例如,在用于形成酰胺的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约4小时至约48小时。
使式VIb化合物与聚(氨基酸)免疫原性载体(例如,式II的Z’为KLH)反应,以得到式IIb化合物。如所示,R1’是式IIb化合物的部分,且R1’’和R1’’’各自是H。然而,与本文所述的原理一致,所得产物可以是化合物的混合物,其中在混合物的一种化合物中,R1’是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’两者都是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’’两者都是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’以及R1’’’所有三者都是式IIb化合物的部分。在有机溶剂诸如例如烷烃(例如,己烷或戊烷)中,在用于形成酰胺的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约4小时至约48小时。
在替代途径中,可以以与上面对于图3用于制备式IIa化合物所述的方式类似的方式从式XVIII化合物制备式IIb化合物。
通过说明而非限制的方式,描述了制备根据本文所述的原理的化合物实例的方法的另一个实例,参考图7。可以采用其它方法以形成与本文所述的原理一致的化合物。式XXVII化合物(Y在式I中为O,且w为0至10或1至10)的制备阐述于图7中。参考图7,处理式VII化合物(例如,如图2中所讨论制备)以保护游离羟基(R15是保护基团),以形成式XXIII化合物。反应条件取决于例如保护基团的性质。
在一个实例中,在用于形成甲硅烷基醚的条件下用叔丁基二甲基甲硅烷基氯(通过实例而非限制的方式)处理式VII化合物。在极性有机溶剂诸如例如吡啶、二甲基亚砜、醚(例如四氢呋喃、乙醚或1,4-二氧杂环己烷)、乙腈、二氯甲烷或二甲基甲酰胺(DMF)中,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约4小时至约48小时。
通过例如将酮基还原成羟基而从式XXIII化合物形成式XXIV化合物。可以通过方法处理式XXIII化合物以还原羟基,所述方法包括但不限于用金属氢化物诸如例如LiAlH4或NaBH4处理以得到式XXIV化合物。在有机溶剂诸如例如烷醇(例如乙醇)中,进行该反应。在一些实例中,反应期间的温度为约0℃至约25℃。反应时间段为约0.5小时至约4小时。
通过例如在碱存在下与卤代酯(诸如,通过实例而非限制的方式)α-卤代酯反应,从式XXIV化合物形成式XXV化合物。在该实例中,用例如BrCH2COOR16(在所示实例中的α-溴乙酸乙酯,w是1且R16是乙基)处理式XXV化合物,以得到式XXV化合物。通过在碱诸如例如KOH、NaOH、Na2CO3或K2CO3存在下从式XXIV化合物的羟基形成醇盐离子,并使醇盐与卤代酯反应,进行该反应。用于反应的溶剂是水性溶剂,其可以含有1%至40%的极性有机溶剂,诸如如上所述的极性有机溶剂。在一些实例中,反应期间的温度为例如约50℃至约100℃或约50℃至约90℃。反应时间段为例如约0.5小时至约24小时,或约1至约8小时。
处理所得式XXV化合物以将酯基水解成羧酸基团(脱酯化反应),以得到式XXVI化合物。许多方法可用于脱酯化,且包括但不限于例如,皂化或用碱水溶液诸如例如用NaOH或KOH在加热下处理;酸水解或用酸水溶液诸如例如无机酸水溶液(诸如例如盐酸或硫酸)处理。反应条件取决于例如,试剂的性质和酯的性质中的一者或多者。
通过从式XXVI化合物去除保护基团R15而形成式XXVII化合物。各种方法可以用于去除保护基团,并且包括但不限于用稀无机酸(诸如例如盐酸或硫酸)处理;在极性有机溶剂(诸如例如烷醇(例如甲醇或乙醇)、醚(例如乙醚、四氢呋喃或1,4-二氧杂环己烷)、酮(例如丙酮)、二甲基亚砜、乙腈、二氯甲烷、二甲基甲酰胺(DMF)或上述中的两种或更多种的组合(其也可以含有水))中,在用于去除保护基的条件下,用有机酸(诸如例如乙酸)处理,以得到式XXVII化合物。反应条件取决于例如,试剂的性质和保护基团的性质中的一者或多者。
通过说明而非限制的方式,图8描述了制备式VIc化合物和将式VIc化合物转化成式IIc化合物(通过实例而非限制的方式,其中Z’为酶G6PDH)的方法的实例。参考图8,处理式XXVII化合物以活化羧酸基团诸如但不限于,形成N-羟基琥珀酰亚胺(NHS)酯(式XXVIII化合物)的反应。在极性有机溶剂诸如例如二甲基亚砜、醚(例如四氢呋喃、乙醚或1,4-二氧杂环己烷)、乙腈、二氯甲烷或二甲基甲酰胺(DMF)中,例如,在用于形成NHS酯的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约1小时至约24小时。
将式XXVIII的NHS酯与式XXI化合物组合以形成式VIc化合物。在有机溶剂诸如例如烷烃(例如,己烷或戊烷)中,例如,在用于形成酰胺的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约1小时至约24小时。
使式VIc化合物与酶G6PDH(例如式II的Z’为G6PDH)反应,以得到式IIc化合物。如所示,R1’是式IIc化合物的部分,且R1’’和R1’’’各自是H。然而,与本文所述的原理一致,所得产物可以是化合物的混合物,其中在混合物的一种化合物中,R1’是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’两者都是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’’两者都是式IIa化合物的部分,并且在混合物的另一种化合物中,R1’和R1’’以及R1’’’所有三者都是式IIc化合物的部分。在有机溶剂诸如例如烷烃(例如,己烷或戊烷)中,在用于形成酰胺的条件下,进行该反应。在一些实例中,反应期间的温度为约15℃至约25℃。反应时间段为约1小时至约24小时。
在替代途径中,可以以与上面对于图3用于制备式IIa化合物所述的方式类似的方式从式XXVII化合物制备式IIc化合物。
根据本文所述的原理的其它化合物可以以与上述的方式类似的方式制备。
结合配偶体的制备
可以使用根据本文所述的原理的化合物的实例(其中Z是聚(氨基酸)免疫原性载体或非聚(氨基酸)免疫原性载体)来制备维生素D的结合配偶体,诸如例如,例如维生素D的适体或维生素D的抗体,其包括但不限于对维生素D3特异性的抗体,对维生素D2特异性的抗体,对25-羟基维生素D3特异性的抗体,对25-羟基维生素D2特异性的抗体,对3-差向-25-羟基维生素D3特异性的抗体和对3-差向-25-羟基维生素D2特异性的抗体。特别感兴趣的是对3-差向-25-羟基维生素D3特异性的抗体,对3-差向-25-羟基维生素D2特异性的抗体和对其它维生素D化合物的差向异构体特异性的抗体(“差向异构维生素D的抗体”),其可用于3-差向-25-羟基维生素D3和3-差向-25-羟基维生素D2的测定中,或其可用于非差向异构维生素D的测定中以减少或消除来自可以存在于待测试维生素D的存在的样品中的维生素D的差向异构形式诸如例如3-差向-25-羟基维生素D3和3-差向-25-羟基维生素D2的干扰。
抗体可以是单克隆抗体或多克隆抗体,且可以包括完整免疫球蛋白或其片段,所述免疫球蛋白包括,但不限于,各种类别和同种型诸如,例如IgA、IgD、IgE、IgG和IgM。其片段可以包括Fab、Fv和F(ab')2、Fab'等。另外,适当时,可以使用免疫球蛋白或其片段的聚集物、聚合物和缀合物,只要维持对于特定分子的结合亲和力。
根据本文所述的原理的抗体可以通过以下技术制备,包括但不限于例如免疫宿主并收集血清(多克隆),制备连续杂交细胞系并收集分泌的蛋白(单克隆),或克隆和表达至少编码特异性结合天然抗体所需的氨基酸序列的核苷酸序列或其诱变版本。
可以通过技术诸如制备连续杂交细胞系并收集分泌的蛋白(体细胞杂交技术)来制备单克隆抗体。可以根据Köhler和Milstein, Nature265:495-497, 1975的标准技术来产生单克隆抗体。单克隆抗体技术的综述见于Lymphocyte Hybridomas,编辑Melchers 等人,Springer-Verlag (New York 1978),Nature 266: 495 (1977),Science 208: 692 (1980)和Methods of Enzymology 73 (Part B): 3-46 (1981)。
在用于制备抗体的另一种方法中,可以从染色体DNA切出编码抗体结合位点的序列,并插入克隆载体,其可以在细菌中表达,以产生具有相应的抗体结合位点的重组蛋白。该方法涉及克隆和表达至少编码特异性结合天然抗体所需的氨基酸序列的核苷酸序列或其诱变版本。
在用于生产单克隆抗体的一种方法中,第一步骤包括用例如免疫原免疫产生抗体的动物,诸如小鼠、大鼠、山羊、绵羊或牛,所述免疫原包含式I化合物,其中Z为免疫原性载体。免疫可在使用或不使用佐剂下进行,所述佐剂诸如完全弗氏佐剂或其它佐剂,诸如单磷酰脂质A和合成的海藻糖二棒杆菌分枝菌酸酯(trehalose dicorynomycolate)佐剂。下一步骤包括将脾细胞与产生抗体的动物分离,并诸如通过使用聚乙二醇或其它技术使所述产生抗体的脾细胞与适当的融合配偶体,通常是骨髓瘤细胞融合。通常,所使用的骨髓瘤细胞是通常在次黄嘌呤-胸苷(HT)培养基中生长、但不能在次黄嘌呤-氨基喋呤-胸苷(HAT)培养基中生长、用于选择融合细胞的那些。下一步骤包括选择融合细胞,通常通过在HAT培养基中选择。下一步骤包括使用免疫测定诸如例如酶联免疫吸附测定法(ELISA)或其它适于筛选的免疫测定法来筛选用于产生适当的抗体的克隆杂合体。
可以通过筛选方法来选择具有必需特异性的抗体(根据本文所述的原理由免疫原制备),所述筛选方法,通过说明而非限制的方式,包括ELISA、斑点印迹、Western分析和表面等离子体共振。以该方式,获得抗体,其在特定测定中结合目标维生素D分析物并且不在任何可检测程度上结合非目标维生素D分子。在根据本文所述的原理的一些实例中,结合目标维生素D分析物的抗体对于目标维生素D分析物具有以下结合亲和力:例如,约107至约1014升/摩尔,或约107至约1011升/摩尔,或约107至约1012升/摩尔,或约108至约1014升/摩尔,或约108至约1011升/摩尔,或约108至约1012升/摩尔。在一些实例中,特异性结合目标维生素D分析物的抗体应当对于非目标维生素D分子具有以下结合亲和力:例如,小于约104升/摩尔,或小于约103升/摩尔,或小于约102升/摩尔,或小于约10升/摩尔。
在根据本文所述的原理的一个实例中,从上述式I化合物(其中Z是免疫原性载体)制备的免疫原用于制备对3-差向-25-羟基维生素D3特异性的抗体,其中所述抗体不在任何可检测的程度上与25-羟基维生素D3或维生素D的其它变体(包括例如非-差向-维生素D化合物诸如例如25-羟基维生素D;钙二醇;1,25-二羟基维生素D3;1,25-二羟基维生素D4;1,25-二羟基维生素D5;和1,25-二羟基维生素D6)结合。
在根据本文所述的原理的一个实例中,从上述式I化合物(其中Z是免疫原性载体)制备的免疫原用于制备对3-差向-25-羟基维生素D3特异性的抗体,其中所述抗体不在任何可检测的程度上与25-羟基维生素D3或维生素D的其它变体(包括例如非-差向-维生素D化合物诸如例如25-羟基维生素D;钙二醇;1,25-二羟基维生素D3;1,25-二羟基维生素D4;1,25-二羟基维生素D5;和1,25-二羟基维生素D6)结合。
在根据本文所述的原理的另一个实例中,从上述式I化合物(其中Z是免疫原性载体)制备的免疫原用于制备对3-差向-25-羟基维生素D2特异性的抗体,其中所述抗体不在任何可检测的程度上与25-羟基维生素D2或维生素D的其它变体(包括例如非-差向-维生素D化合物诸如例如25-羟基维生素D;钙二醇;1,25-二羟基维生素D3;1,25-二羟基维生素D4;1,25-二羟基维生素D5;和1,25-二羟基维生素D6)结合。
短语“任何可检测的程度”意指特异性结合目标维生素D分析物(例如,3-差向-25-羟基维生素D)的抗体对于非目标维生素D分子(例如,非-差向-维生素D化合物)具有以下结合亲和力:例如,小于约104升/摩尔,或小于约103升/摩尔,或小于约102升/摩尔,或小于约10升/摩尔。
通过说明而非限制的方式,在一个实例中,采用免疫原,其中式I化合物中的Z是BSA。该免疫原用于腹膜内免疫小鼠(例如,BALB/c小鼠,Swiss Webster小鼠或AJ小鼠品系)。使用3-差向-25-羟基维生素D3和卵白蛋白的缀合物(卵白蛋白缀合物)测试来自这些小鼠的血清样品的抗-3-差向-25-羟基维生素D3抗体。采用微量滴定板ELISA,并检测所述抗体与卵白蛋白缀合物、随后与3-差向-25-羟基维生素D3的结合。在融合前三天加强具有最高滴度的小鼠。在融合当天,从这些小鼠收获脾细胞,并使用PEG辅助融合方案与骨髓瘤细胞系P3X63Ag8.653融合。约十天之后,使用板ELISA筛选杂交瘤上清液的抗-3-差向-25-羟基维生素D3抗体。将阳性克隆进一步扩增,亚克隆,并使用蛋白A琼脂糖柱纯化上清液。使用ELISA测试纯化的抗体样品与卵白蛋白缀合物的结合以及与游离3-差向-25-羟基维生素D3的结合。
通过说明而非限制的方式,对如上所述制备的对3-差向-25-羟基维生素D3特异性或对3-差向-25-羟基维生素D2特异性的抗体的具体实例包括例如抗体4G8和抗体8F10。
在一些实例中,根据本文所述的原理的抗体可用于纯化维生素D化合物。例如,抗体诸如上述那些可以结合支持物,且所述支持物可用于纯化维生素D化合物。在一个实例中,3-差向-25-羟基维生素D3的抗体可以结合亲和纯化色谱基质诸如,例如柱,并且维生素D制备物可以与色谱基质接触,其中基质上的抗体结合来自维生素D制备物的3-差向-25-羟基维生素D3,而从基质洗脱其它维生素D化合物。
采用根据本文所述的原理的抗体作为阻断抗体的维生素D分析物的测定法的具体实例
根据本文所述的原理的抗体可用于尽可能减少或消除维生素D分析物的非差向异构形式的测定中的3-差向异构体交叉反应性。采用针对作为式I化合物(其中Z是免疫原性载体)的免疫原制备的抗体作为阻断剂,可以实质上避免由3-差向异构体维生素D与维生素D分析物的抗体的交叉反应性引起的总非差向异构维生素D分析物的过度估计。
在非差向异构维生素D分析物的测定法的一个实例中,该测定法采用包含烯属染料的化学发光珠粒(chemibead)试剂作为化学发光试剂和25-羟基维生素D3作为维生素D类似物。将怀疑含有非差向异构维生素D分析物的样品在测定介质中与生物素化的非差向异构维生素D分析物的抗体和作为抗体8F10的第二抗体组合,然后与化学发光珠粒试剂组合。化学发光珠粒结合未被来自样品的非差向异构维生素D分析物占据的单克隆抗体结合位点的级分。抗体8F10结合样品中存在且通过与生物素化抗体的交叉反应干扰测定的3-差向-25-羟基维生素D3。随后,将包含光敏剂(敏化珠粒)的链霉抗生物素蛋白偶联的敏化剂珠粒添加至反应混合物。这导致形成化学发光珠粒/敏化珠粒对,其浓度与样品中的非差向异构维生素D分析物的浓度成反比。在680 nm下照射后,敏化剂珠粒产生单线态氧,其扩散至化学发光珠粒中,所述化学发光珠粒与敏化珠粒配对,与化学发光中的烯属染料反应,并在大约612 nm处触发化学发光信号,其与非差向异构维生素D分析物浓度成反比。
采用标记的根据本文所述的原理的化合物的维生素D分析物的测定法的实例
可以使用式I化合物(其中Z是聚(氨基酸)标记或非聚(氨基酸)标记或支持物)进行维生素D分析物的测定。
通过说明而非限制的方式,在用于检测维生素D分析物的测定法的一个实例中,采用ACMIA测定形式。采用涂覆有维生素D类似物(其为式I化合物,其中Z是非聚(氨基酸)标记)的作为二氧化铬颗粒(二氧化铬颗粒试剂)的二氧化铬颗粒作为第一组分。第二组分是维生素D分析物的抗体。 将交联至报告酶(例如,β-半乳糖苷酶)以形成抗体-酶缀合物的该抗体以过量(即大于结合样品中可能存在的全部维生素D分析物所需的量的量)添加至反应容器。预先经受用释放剂处理的样品用维生素D的抗体处理,所述维生素D的抗体结合样品中的维生素D分析物。在介质中将所述抗体-酶缀合物与样品混合,以允许维生素D分析物结合至所述抗体。接下来,添加二氧化铬颗粒试剂以结合尽任何过量抗体-酶缀合物。然后,施加磁体,所述磁体从悬浮液中拉出所有二氧化铬颗粒和过量的抗体-酶,并且将上清液转移至最终反应容器。将所述报告酶的底物添加至所述最终反应容器,并且将酶活性分光光度测量为吸光度随时间的变化。该信号的量与样品中的维生素D分析物的量相关。
在上述实例中,根据本文所述的原理的抗体可用于阻断样品中可存在的3-差向-25-羟基维生素D3与维生素D分析物的抗体的结合。抗3-差向-25-羟基维生素D3抗体可以是针对免疫原产生的抗体,所述免疫原是式I化合物,其中Z是免疫原性载体。
检查步骤
在测定方法的下一步骤中,检查介质的包含维生素D分析物和维生素D分析物的抗体的复合物和/或包含维生素D类似物和维生素D的抗体的复合物的存在。复合物中的一者或两者的存在和/或量指示样品中维生素D分析物的存在和/或量。
短语“测量维生素D分析物的量”是指维生素D的定量、半定量和定性测定。定量、半定量和定性的方法,以及用于测定维生素D分析物的所有其它方法,都被认为是测量维生素D分析物的量的方法。例如,仅检测怀疑含有维生素D分析物的样品中维生素D分析物的存在或不存在的方法被认为包括在本发明范围内。术语“检测”和“测定”以及测量的其它常见同义词被考虑在本发明范围内。
在许多实施方案中,介质的检查涉及从介质检测信号。信号的存在和/或量与样品中维生素D分析物的存在和/或量相关。检测的特定模式取决于信号产生系统的性质。如上所讨论,存在许多方法,通过该方法,产生信号的信号的标记可以产生可通过外部装置检测的信号。信号产生系统的活化取决于信号产生系统成员的性质。
测量期间的温度通常范围为例如约10℃至约70℃,或约20℃至约45℃,或约20℃至约25℃。在一种方法中,使用已知浓度的维生素D分析物形成标准曲线。也可以使用校准物和其它对照。
由任何标记产生的发光或光可以目测、摄影、光量测定、分光光度测量,诸如通过使用光电倍增器或光电二极管,或通过测定其与介质中维生素D分析物的量相关的量的任何其它适宜装置。信号的存在和/或量的检查还包括信号的检测,这通常仅是其中阅读信号的一个步骤。通常使用仪器阅读信号,所述仪器的性质取决于信号的性质。所述仪器可以是但不限于例如分光光度计,荧光计,吸收分光计,光度计和化学光度计(chemiluminometer)。
用于进行测定法的包含试剂的试剂盒
可以基于特定测定法的性质配制包含用于进行测定法的试剂的试剂盒。在根据本文所述的原理的一些实例中,试剂盒可以包含结合配偶体诸如,例如,针对免疫原产生的抗体,所述免疫原是式I化合物,其中Z是免疫原性载体。在根据本文所述的原理的一些实例中,试剂盒可以包含试剂,所述试剂是式I化合物,其中Z是聚(氨基酸)标记部分或非聚(氨基酸)标记部分,其包括支持物。试剂盒还可以包括用于进行维生素D分析物的特定测定法的其它试剂。在一些实施方案中,试剂盒包含包装组合的生物素-结合配偶体,诸如例如抗生物素蛋白或链菌抗生物素蛋白,其与颗粒,生物素化的式I化合物以及标记的维生素D分析物抗体缔合。该试剂盒可以进一步包括用于进行测定的其它试剂,其性质取决于具体测定形式。
所述试剂可以各自在分开容器中,或者各种试剂可以组合于一个或多个容器中,这取决于试剂的交叉反应性和稳定性。该试剂盒可以进一步包括用于进行测定的其它分别包装的试剂,诸如例如额外的特异性结合对成员,信号产生系统成员,和辅助试剂。
试剂盒中各种试剂的相对量可以在很大程度上变化,以提供显著优化本发明方法期间需要发生的反应和进一步显著优化测定灵敏度的试剂浓度。在适当情形下,试剂盒中的一种或多种试剂可以作为通常冻干的干燥粉末(包括赋形剂)提供,其在溶解后将提供用于使用根据本文所述的原理的化合物试剂进行方法或测定的适当浓度的试剂溶液。该试剂盒可以进一步包括利用试剂(其包括根据本文所述的原理的化合物试剂)的方法的书面说明书。
如本文所使用,短语“至少”意味着指定项的数目可以等于或大于所述数目。如本文所使用,短语“约”意味着所述数目可以相差±10%;例如“约5”意指4.5至5.5的范围。
通过说明而非限制的方式,以下讨论涉及根据本文所述的原理的具体实施例;该具体实施例并不意图限制本公开内容和所附权利要求的范围。在不背离本公开内容的精神和范围的情况下,可以设想许多修改和替代组合物、方法和系统。
实施例
除非另有说明,以下实验中的材料可以购自Sigma-Aldrich Chemical Corporation (St. Louis MO)或Fluka Chemical Corporation (Milwaukee WI)。本文公开的份数和百分数以重量/体积计,除非另有说明。
定义:
mg = 毫克
g = 克
ng = 纳克
mL = 毫升
µL = 微升
µmol = 微摩尔
℃ = 摄氏度
min = 分钟
sec = 秒
hr = 小时
w/v = 重量/体积
TLC = 薄层色谱法
HPLC = 高效液相色谱法
EDA = 乙二胺
EtOAc = 乙酸乙酯
DMF = 二甲基甲酰胺
DMSO = 二甲基亚砜
MeOP = 1-甲氧基-2-丙醇
MES = 2-(N-吗啉代)乙磺酸
CMO =羧基甲氧基肟
TMB =四甲基联苯胺
SNHS =磺基-N-羟基琥珀酰亚胺
高pH洗涤缓冲液= 5.5 mM Na3PO4 + 4.4 mM Na2CO3, pH 11
半抗原洗涤缓冲液 = 50 mM HEPES、300mM NaCl、1mM EDTA、0.1% Triton® X405、0.15% Proclin®防腐剂和1mg/ml新霉素
DI = 去离子
ELISA =酶联免疫吸附测定法
UPA = 超微粒分析仪
LOCI = 发光氧通道免疫测定法
BSA = 牛血清白蛋白
BGG = 牛丙种球蛋白
mIgG = 小鼠免疫球蛋白
MS = 质谱分析法。
实施例1
图2化合物(其中R11是乙酰基)的制备
使5-雄甾烯-3α-醇-17-酮乙酸酯(VIII)(100 mg)与乙二醇(0.245 ml)和对甲苯磺酸一水合物(4 mg)在苯中在回流下反应过夜,以得到5-雄甾烯-3α-醇-17-酮乙酸酯乙烯缩酮(IX)(112 mg)。在己烷(13 ml)中将乙烯缩酮IX(112 mg)用N-溴代琥珀酰亚胺(69 mg)/偶氮异丁腈(3.3 mg)在回流下溴化30分钟,以得到化合物X,随后用四丁基氟化铵(1M,在THF中,1.6 ml)/THF(7.3 ml)在室温下脱去溴化氢2小时,以得到雄甾-5,7-二烯-3α-醇-17-酮乙酸酯乙烯缩酮(XI)(55 mg)。使雄甾-5,7-二烯-3α-醇-17-酮乙酸酯乙烯缩酮(XI)(55 mg)与1N氢氧化钠(2 mL)在甲醇(10 ml)中在室温下反应约5小时,以得到雄甾-5,7-二烯-3α-醇-17-酮乙烯缩酮(XII)(48 mg)。使雄甾-5,7-二烯-3α-醇-17-酮乙烯缩酮(XII)(48 mg)与对甲苯磺酸一水合物(35 mg)在丙酮(5 mL)和水(0.2 mL)的混合物中在室温下过夜反应,以得到雄甾-5,7-二烯-3α-醇-17-酮(XIII)(43.4 mg)。在乙醚(1100 ml)中在-20至0℃下在具有VYCOR®滤光片(Ace Glass Incorporated, Vineland, NJ)的450 w汞灯下辐照雄甾-5,7-二烯-3α-醇-17-酮(XIII)(43.4 mg) 5分钟,以得到前-HMCHEMOIO,将其在乙醇(15 ml)中回流3小时,以产生HMCHEMOIO (VII) (13.5 mg)。
使来自上述的HMCHEMOIO (VII) (13.5 mg)与O-(羧甲基)羟胺半盐酸盐(12 mg)和乙酸钠(24 mg)在1 ml甲醇中在室温下反应过夜,以得到HMCHEMOIO-CMO (13.2 mg)(图3中的式XX化合物,其中n = 1)。
如下制备阳离子化BSA:将三亚乙基四胺(0.5 mL)(图3中的式XXI化合物,其中各自r = 1且s = 1)添加至4.5 ml 50 mM MES缓冲液(pH6),并将pH调节至6,随后添加20 mg BSA。将组合混合以完全溶解组分。每小时将EDAC(5 mg)添加至上述溶液,持续5小时。将溶液在10mL Amicon®室(Amicon Inc., Beverly MA)中用10 x 10 mL洗涤缓冲液(10mM磷酸盐 + 300nM NaCl)(pH7)洗涤。然后,将100 mg Tween®20添加至50 mL圆底烧瓶。添加洗涤缓冲液(50 mL)并将混合物搅拌10分钟以分散Tween 20。将阳离子化BSA(图3中的式XXIa化合物,其中各自r = 1且s = 2)以约5 mg/mL储存于含有0.2% Tween® 20的洗涤缓冲液中。
为了制备HMCHEMOIO-CMO BSA (图3中的式IIa化合物),将EDAC (25 mg)和10 mg NHS与如所述制备的13.2 mg HMCHEMOIO-CMO (XX)一起置于10 ml烧瓶中。将DMF (0.5 ml)添加至烧瓶。将混合物在室温下搅拌24小时,以得到活化的HMCHEMOIO-CMO。溶液是澄清的。TLC(1:1乙酸乙酯:甲醇)指示没有剩余的起始材料。
将来自上述的活化的HMCHEMOIO-CMO逐滴添加至来自上述的阳离子化BSA溶液,并将混合物在室温下搅拌过夜。将混合物转移至Amicon®室(Amicon Inc., Beverly MA),然后用5 x 10 ml洗涤缓冲液洗涤,并浓缩(30,000截止值)至约4 mL。将混合物在SD-25柱(GE Healthcare Bio-Sciences, Pittsburg PA)上使用洗脱缓冲液(pH 7.0)作为洗脱液进一步分离,以得到HMCHEMOIO-CMO BSA化合物的混合物(如上述关于图3中的式IIa化合物所讨论的混合物)。
实施例2
抗体的制备
免疫AJ品系的小鼠(雌性,至少8周龄)以产生单克隆抗体。第一次免疫是含有完全弗氏佐剂(来自Sigma-Aldrich, 目录# F5881)的100 µl体积中的100 µg来自上述的免疫原(HMCHEMOIO-CMO BSA)。三周后,用含有不完全弗氏佐剂(来自Sigma-Aldrich 目录# F5506)的100 µL体积中的100μg相同免疫原给予加强免疫。随后,在另外3周之后,用含有不完全弗氏佐剂的100 µL体积中的100μg相同免疫原给予第二次加强免疫。在最后一次加强免疫后一周,对小鼠采血,并在ELISA中针对抗3-差向异构体抗体测试抗血清。随后,在连续三天给予融合前加强,然后与相同免疫原(不含任何佐剂的50 µL体积PBS中的20μg)融合。在第四天,处死小鼠并进行脾切除。取出脾细胞,并通过标准方法使用命名为P3-X63Ag8.653 (ATCC CRL-1580™)的非分泌性鼠骨髓瘤细胞系进行融合。通过标准方法进行克隆。
通过结合和抑制ELISA筛选克隆。以下结合ELISA免疫测定程序根据以下方案。以与上述对于BSA缀合物所述的方式类似的方式在每孔50μL的PBS中以1 µg/mL用与卵白蛋白缀合的3-差向异构体包被板。在室温下进行板包被1小时或更长。然后将板轻轻拍干并用每孔200μL的封闭缓冲液稀释剂(含有0.05% Tween® 20的PBS中的0.5%酪蛋白溶液)封闭。在2-8℃下进行板封闭1小时或过夜。然后将板洗涤三次并轻轻拍干。然后如下将待筛选的单克隆抗体添加至各孔:将25μL PBS与25μL从融合生长板中的相应孔转移的培养上清液混合。孵育在室温下在板振荡下持续约1小时。将板使用具有板堆垛机的洗板机(BioTek, Winooski VT)洗涤,其中洗涤缓冲液为含有0.05% Tween® 20的Milli-Q®水(Millipore Corporation, Billerica, MA)。以每孔50μL添加酶缀合物(在封闭缓冲液稀释液稀释至1:3000的与HRP偶联的山羊抗小鼠IgG)。在室温在振荡下进行孵育约1小时。然后洗涤板,并以每孔100μL的体积添加显色溶液(TMB,来自Moss Substrates, Pasadena MD),在室温下持续10分钟。使用ELISA读板器在650 nm读板。
基于上述筛选技术,选择产生合适单克隆抗体的杂交瘤。一种此类单克隆抗体被命名为抗体8F10,并且是IgG2a κ抗体。另一种此类单克隆抗体被命名为抗体4G8,并且是IgG2a κ抗体。
另外,还根据以下方案使用抑制ELISA程序筛选克隆。以每孔50μL在磷酸盐缓冲盐水中以1 µg/mL用与卵白蛋白缀合的3-差向异构体包被板。在室温下进行板包被1小时或更长,或在约2℃至8℃下进行板包被过夜。然后将板轻轻拍干并用每孔200μL的封闭缓冲液稀释剂(含有0.05% Tween® 20的PBS中的0.5%酪蛋白溶液)封闭。通过在室温下在板振荡下孵育30分钟或更长而进行板封闭。洗涤板。然后如下将待筛选的单克隆抗体与游离的3-差向异构体一起添加至各孔:从融合生长板中的相应孔转移每孔25μL培养上清液,并添加25 µL 2µg/mL 3-差向异构体-25OH维生素D3。孵育在室温下在板振荡下持续约1小时。将板使用具有板堆垛机的洗板机(BioTek, Winooski VT)洗涤,其中洗涤缓冲液为含有0.05% Tween® 20的Milli-Q®水(Millipore Corporation, Billerica, MA)。以每孔50μL添加酶缀合物(在封闭缓冲液稀释液稀释至1:3000的与HRP偶联的山羊抗小鼠IgG)。在室温在振荡下进行孵育约1小时。然后洗涤板,并以每孔100μL的体积添加显色溶液(TMB,来自Moss Substrates, Pasadena MD)。如果所需抗体存在于杂交瘤上清液中,则观察到与不含游离3-差向异构体的孔相比光密度降低。使用25OH维生素D3替代游离3-差向异构体-25 OH维生素D3作为对照以监测抗体的特异性。选择结合3-差向异构体且不结合25OH维生素D3的抗体。
多克隆抗体产生:用500μg/剂量的HMCHEMOIO-CMO BSA免疫兔。进行一次初始免疫和五次加强免疫,分开两周,收集两次测试采血和一次生产性出血,并如上所述在ELISA中测试抗血清。
实施例3
25OH维生素D的免疫测定
免疫测定程序
采用的25OH维生素D (25(OH)D)免疫测定形式是基于LOCI®测定技术的均质竞争性化学发光免疫测定法。在Siemens Dimension® EXL自动化集成临床化学系统(Siemens Healthcare Diagnostics Inc., Deerfield, IL)上进行测定。该测定法测量血清和血浆样品中的25(OH)D2和/或25(OH)D3的总浓度。LOCI®测定试剂包括一种释放试剂、两种合成珠粒试剂和生物素化的单克隆抗25OH维生素D抗体试剂。第一珠粒试剂(命名为“敏化珠粒”)用链霉抗生物素蛋白包被并含有光敏染料。第二珠粒试剂(命名为“化学发光珠粒”)用25(OH)D3类似物包被并含有化学发光染料。将样品与释放试剂孵育,以便从维生素D结合蛋白释放25(OH)D分子,包括3-差向异构化合物。然后将反应混合物与生物素化的抗体孵育以形成25(OH)D-生物素化的抗体复合物。因为生物素化的抗体(绵羊单克隆抗体)与3-差向-25(OH)D交叉反应,所以添加100 µg/mL的抗3-差向异构体-VD抗体8F10.1,以尽可能减少来自3-差向异构体维生素D化合物的测定信号。添加化学发光珠粒以结合过量的游离生物素化抗体。然后添加敏化珠粒以结合生物素化抗体的生物素部分。作为结果,形成化学发光珠粒-类似物/抗体-生物素/链霉抗生物素蛋白-敏化珠粒的聚集物。用680 nm的光照射反应混合物从敏化珠粒产生单线态氧,其扩散至化学发光珠粒并触发化学发光反应。在612 nm测量所得化学发光信号,并且其与样品中的总25(OH)D的浓度成反比。
用于免疫测定的试剂的制备
25(OH)D3化学发光珠粒的合成 – 通过将EPRM-EDA与25(OH)D3氨基甲酸酯偶联来合成25(OH)D3化学发光珠粒。采用的材料为EPRM-EDA珠粒,1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDAC)、Fluka磺基-N-羟基琥珀酰亚胺(SNHS)、25(OH)D3-3-氨基甲酸酯、Gafac®表面活性剂溶液16%、无水DMSO、含有10% MeOP和1% Gafac®表面活性剂的50mM MES pH6缓冲液。
EPRM-EDA珠粒的制备-将EPRM珠粒(2000 mg,20.0 mL)添加至40 mL小瓶。该EPRM珠粒通过与美国专利号7,179,660中所述的程序类似的程序制备,且化学发光化合物为2-(4-(N,N,二-十四烷基)-苯氨基-3-苯基二甲基噻吩与铕的螯合物。将EDA(800 mg,890 μL)与10 mL MES pH 6缓冲液(“缓冲液”)和约4.2 mL 6N HCl组合。该混合物的pH为约6.9,或调节为约6.9。在涡旋下将EDA溶液添加至EPRM珠粒,并在室温下将混合物摇动15分钟。在15 mL小瓶中将氰基硼氢化钠(400 mg)与10 mL DI水组合,并将该组合添加至来自上述的珠粒混合物。将混合物在37℃下摇振18-20小时。将珠粒转移至六个40 mL离心管。添加MES缓冲液,使体积达到35 mL,将该混合物以19,000 rpm离心处理30分钟。倾倒上清液,并用搅拌棒使珠粒再悬浮于2 mL缓冲液中,并添加额外的缓冲液至35 mL。将混合物以18瓦特功率超声处理30秒,使用冰将混合物保持冷却。洗涤/超声处理步骤进行4次,以去除所有活化化学品。最后的MES缓冲液离心处理之后,将含有5%MeOP和0.1%Tween®20的2 mL缓冲液 (“第二缓冲液”)添加至管中,用于再悬浮步骤。添加额外的第二缓冲液至35 mL,然后超声处理。将珠粒悬浮液以19,000 rpm离心处理30分钟。弃去上清液。最终的超声处理在各个管中使用12 mL第二缓冲液,以得到25 mg/mL稀释液。粒径为277 nm,如在UPA仪器上所测定。
以类似于美国专利号6,153,442和美国专利申请公开号20050118727A(其相关公开内容通过引用并入本文)中所述方法的方式制备EPRM化学发光珠粒。该EPRM化学发光珠粒包含氨基葡聚糖内层和具有游离醛官能团的葡聚糖醛外层。参见例如美国专利号5,929,049、7,179,660和7,172,906,其相关公开内容通过引用并入本文。在利用合适的缓冲剂(诸如例如MES)的缓冲水性介质中,反应在约0至约40℃的温度,约5.5至约7.0、或约6的pH下进行约16至约64小时。通过添加合适的淬灭剂(诸如例如羧基甲氧基胺半盐酸盐(CMO))和随后洗涤颗粒来淬灭反应。
外部葡聚糖醛层上的醛基在还原胺化条件下与乙二胺反应以形成试剂EPRM-EDA,其具有包含亚乙基链和末端胺基的侧链部分。所述还原胺化条件包括使用还原剂,诸如例如金属氢化物。该反应在约20℃至约100℃的反应期间温度下在水性介质中进行约1小时至约48小时。
25(OH)D3-3-氨基甲酸酯(25(OH)D3-3-氨基甲酸酯)的合成 - 在氮气下在室温下将5-ml烧瓶(用箔片覆盖)中的22 mg (55 µmol)购自ChemReagents.com,Sugarland TX的25(OH)D3、100 mg (420 µmol)碳酸二琥珀酰亚胺酯(DSC)、100 μL三乙胺于1 mL无水乙腈中的混合物搅拌18小时,以制备活化的25(OH)D3。TLC (EtOAc:己烷= 2:1)显示没有剩余起始材料。通过将150 mg羧基甲氧基胺半盐酸盐(CMO)、0.3 ml三乙胺和1 ml DMF添加至10 ml烧瓶添加来制备悬浮液。在搅拌下将含有活化的25(OH)D3的溶液逐滴添加至CMO悬浮液,其再继续18小时。施加真空以尽可能去除溶剂(保持加热浴温度低于50℃)。将EtOAc (25 ml)添加至残余物,将其用2 ml盐水洗涤三次。将有机相用无水Na2SO4干燥并过滤;使用旋转蒸发仪去除溶剂。干燥之后获得粗产物(42 mg),并通过HPLC纯化。在高真空下干燥之后获得纯产物(24 mg)。将产物溶解于1.2 ml无水DMSO中。将等分试样转移至小瓶中,将其保持在-70℃下。
将EPRM-EDA与半抗原25(OH)D3-氨基甲酸酯偶联 - 将1.2 mg半抗原添加至2-mL小瓶。将11.2 mg EDAC和15.5 mg SNHS加上3.73 mL无水DMSO添加至5-mL小瓶。旋转EDAC/SNHS溶液以溶解内容物。将1.14 mL EDAC/SNHS溶液添加至含有半抗原的小瓶。将混合物旋转22小时。将EPRM-EDA (200 mg)用高pH洗涤缓冲液洗涤一次,然后用MES pH6缓冲液洗涤。向5-mL小瓶中添加1.08 mL (100 mg)洗涤缓冲液,随后添加143 mL 1.6% Gafac®表面活性剂。向小试管中添加256μL无水DMSO,随后添加49 µL EDAC/SNHS/半抗原。将DMSO/半抗原溶液逐滴添加至珠粒混合物(在添加期间进行涡旋)。将珠粒/半抗原混合物在室温下旋转过夜。
将珠粒/半抗原混合物转移至50-mL离心管并用10% 1-甲氧基-2-丙醇/1% Gafac®表面活性剂/MES pH6缓冲液稀释至35 mL。将管以18,500 rpm在10℃下离心30分钟。弃去上清液,并用1 mL相同缓冲液替换。用搅拌棒再悬浮沉淀。将小瓶用相同缓冲液填充至35 mL。将管在18-21瓦特下超声处理1分钟,使用冰以保持管冷却。将离心/洗涤重复六次。在第六次洗涤后,将缓冲液切换至半抗原洗涤缓冲液(pH 7.2),并再进行两次洗涤。在最后一次洗涤并用1 mL 半抗原洗涤缓冲液重悬浮后,添加4 mL 半抗原洗涤缓冲液。将珠粒混合物在杯式超声波仪中以50%功率超声处理。通过UPA测量粒径为298 nm。进行百分比固体测定,并将珠粒混合物稀释至10 mg/mL。将该化学发光珠粒试剂配制于50 mM MES缓冲液中。
抗25(OH)D抗体的生物素化 – 将NHS-PEO4-生物素(Pierce Chemical Company, Rockford IL)与抗25(OH)D抗体(绵羊单克隆抗体,来自Bioventix, Farnham, Surrey, UK)偶联。将3 mg抗25(OH)D抗体在10 mL Amicon中用10 ml抗体透析缓冲液(10 mM NaH2PO4pH 7.0/300 mM NaCl)各自缓冲液交换两次,然后浓缩至3.0 mg/mL。将1mg NHS-PEO4-生物素溶解于100 µL抗体透析缓冲液中,以制备10 mg/mL生物素试剂溶液,将其添加(35 µL)至抗25(OH)D抗体溶液。将反应混合物在室温下摇动过夜。将混合物在10 mL Amicon中用10 mL抗体透析缓冲液各自洗涤三次,然后浓缩至约1 mL。在UV A280上测量浓度。在水性缓冲液中配制生物素化的抗25(OH)D抗体试剂,所述水性缓冲液含有25 mM柠檬酸缓冲液、300 mM NaCl、1mM EDTA、封闭蛋白和防腐剂(pH 5.0)。
敏化珠粒 - 使用与美国专利号6,153,442、7.022,529、7,229,842和美国专利申请公开号20050118727A中描述的方法类似的方法制备链菌抗生物素蛋白-敏化剂珠粒。光敏剂为双-(三己基)-硅-叔丁基-酞菁。敏化珠粒试剂的浓度在含有150 mM的NaCl的HEPES缓冲液(pH 8.0)中为200 μg/mL。
释放试剂 - 5 mM HEPES缓冲液中的水杨酸钠。
免疫测定的结果
添加抗3-差向异构体-VD抗体8F10.1(抗3-差向异构体VD Ab)对测定的3-差向异构体交叉反应性的影响显示于表1中。含有25(OH)D2或25(OH)D3化合物的十个患者血清掺入100 ng/mL购自Sigma (储备号751324)的3-差向异构体维生素D3化合物。通过掺入和未掺入3-差向异构体化合物的25(OH)D2或25(OH)D3值之间的差异除以添加的3-差向异构体化合物的量来计算3-差向异构体交叉反应性。在添加100 µg/mL的抗3-差向异构体-VD抗体8F10.1的情况下,平均3-差向异构体交叉反应性从13.7%降低至小于2%。
表 1
图9说明使用添加和不添加抗3-差向异构体-VD抗体8F10.1 (3-差向异构体Ab)的试剂产生的标准曲线的比较。两条曲线的完全重叠显示抗3-差向异构体-VD抗体8F10.1不影响25(OH)D3(图9中的25OH Vit D3)的测量,指示抗体对3-差向异构体化合物是特异性的并且与25(OH)D3没有可观察到的交叉反应性。
实施例4
3-差向-25OH维生素D的免疫测定
免疫测定程序
3-差向-25OH维生素D (3-差向-25(OH)D)的测量采用基于类似于上述实施例3中所述的LOCI®测定技术的均质竞争性化学发光免疫测定法。在Siemens Dimension® EXL自动化集成临床化学系统(Siemens Healthcare Diagnostics Inc.)上进行测定。用于测量3-差向-25(OH)D的LOCI®测定试剂包括一种释放试剂、两种合成珠粒试剂和生物素化的单克隆抗3-差向异构体抗体试剂。第一珠粒试剂(敏化珠粒)用链霉抗生物素蛋白包被并含有光敏染料。第二珠粒试剂(化学发光珠粒)用以与上述对于实施例1所述的方式类似的方式制备的3-差向异构体类似物(上述式IIa化合物,其中Z’是非聚(氨基酸)标记,即EPRM-EDA化学发光珠粒)包被。将样品与释放试剂孵育,以便从维生素D结合蛋白释放25(OH)D分子,包括3-差向异构化合物。然后将反应混合物与生物素化的抗体孵育以形成3-差向-25(OH)D/生物素化的抗体复合物。添加化学发光珠粒以清除过量的游离生物素化抗体。然后添加敏化珠粒以结合生物素化抗体的生物素部分。作为结果,形成化学发光珠粒-类似物/抗体-生物素/链霉抗生物素蛋白-敏化珠粒的聚集物。用680 nm的光照射反应混合物从敏化珠粒产生单线态氧,其扩散至化学发光珠粒并触发化学发光反应。在612 nm测量所得化学发光信号,并且其与样品中的总3-差向-25(OH)D的浓度成反比。
用于免疫测定的试剂的制备
3-差向异构体类似物化学发光珠粒的合成 - 以与上述实施例3中对于25(OH)D3化学发光珠粒的合成所述的方式类似的方式制备用于检测3-差向-25(OH)D的该测定中使用的化学发光珠粒,其中半抗原是式IIa化合物,其中Z’是化学发光珠粒。
化学发光珠粒试剂 - 50 nM MES缓冲液中的3-差向异构体类似物化学发光珠粒。
抗3-差向异构体-VD抗体8F10.1的生物素化 -以与上文实施例3中对于抗25(OH)D抗体的生物素化所述的方式类似的方式进行抗3-差向异构体-VD抗体8F10.1的生物素化。
生物素化的抗体试剂 -25 mM柠檬酸缓冲液中的如上所述的生物素化的抗3-差向异构体-VD抗体8F10.1。
敏化珠粒试剂 -敏化珠粒试剂与实施例3中相同。
免疫测定的结果
图10说明用于使用抗3-差向异构体-VD抗体8F10.1测定样品中的3-差向-25(OH)D的免疫测定的标准曲线。化学发光千计数代表如上所述测量的化学发光信号。
本说明书中引用的所有出版物和专利申请通过引用并入本文,如同每个单独的出版物或专利申请被特别和单独指明通过引用并入一样。
应当理解,上述实施例仅说明代表本文所述的原理的许多具体实施例中的一些。明显地,在不背离如以下权利要求所定义的范围的情况下,本领域技术人员可以容易地设想出许多其它布置。
- 还没有人留言评论。精彩留言会获得点赞!