党参中抗衰老成分的提取方法及应用与流程
本发明涉及中药提取物技术领域,特别涉及一种党参中抗衰老成分的提取方法,还涉及提取到的党参中抗衰老成分的应用。
背景技术:
中药品种繁多,且大多数中药中含有多糖类成分,因此,如何充分利用好这一宝贵的自然资源是目前亟待解决的课题。目前对中药中多糖类成分的研究还存在以下主要问题:(1)分离纯化工艺较繁琐,成本较高,不利于工业化;(2)结构研究还较肤浅,大多仅确定了部分一级结构,而对其高级结构未见报道;(3)活性研究一般用的都是粗多糖,缺乏多糖结构与活性关系的研究。因此,实用、高效的分离纯化技术研究和深入、系统的构-效关系研究应是今后中药中多糖类成分研究的主要方向。
党参为桔梗科植物党参Cdoonopisispilosula(Farneh.)Nan-nf,素花党参CodonoPsispilouslaNannfvar.modesatN(annf)L.T.shen或川党参Codonopisisatngshenoliv.的干燥根,是我国常用的补益中药。本品性甘、味平,主治脾肺虚弱,气短心悸,内热消渴等症,临床上广泛用于降血脂、降血糖、抗衰老等症。
党参化学成分的研究主要集中在香豆素、黄酮等小分子化合物,而对其中多糖类成分尚停留在粗多糖的含量测定及提取工艺优化的层面,缺乏进一步的分离精制过程研究;另外,对党参药理活性的研究大多仅针对粗提物,不利于明确药理活性物质基础,更阻碍了深入探讨党参化学成分与药理活性之间关系的作用机制研究。因此,进行党参多糖的分离纯化、进一步寻找药材党参的活性成分并阐述相应的构-效关系,是目前亟待解决的问题。只有不断地、更加深入地解决这些问题才能使党参这一传统中药更好的服务于人类的健康事业。
技术实现要素:
针对目前对党参多糖的研究多集中在粗多糖的药理活性研究上,对其进一步的分离纯化还需要更深入的研究,本发明旨在建立党参粗多糖的提取和分离方法,获得党参多糖分级组分,并进一步寻找、追踪党参多糖的抗衰老活性部位,为探索党参参多糖的构-效关系、完善药材党参的质量评价体系乃至新药资源开发奠定了基础,提供了一种党参中抗衰老成分的提取方法。
本发明还提供了提取到的党参中抗衰老成分的应用。
本发明是通过以下步骤得到的:
一种党参中抗衰老成分的提取方法,包括以下步骤:
(1)党参粉碎后脱脂,用乙醇回流去除小分子化合物,得药渣,晾干;
(2)药渣用水加热回流提取若干次,提取液合并后减压浓缩,离心取上清液,采用80%乙醇醇沉得醇沉多糖,醇沉多糖经过洗涤、溶剂挥干后得到党参粗多糖;
(3)党参粗多糖制成溶液,用0.45μm的滤膜抽滤,选择300KD的超滤膜进行超滤,然后依次用30KD和5KD的超滤膜分别对党参粗多糖进行超滤,分别得到党参多糖组分Co1、Co2、Co3。
所述的提取方法,优选步骤(3)中超滤压力为0.21MPa,温度为25℃。
所述的提取方法,优选步骤(1)中脱脂用的萃取液为石油醚,用量为党参体积的3倍,冷凝水回流脱脂5-6h,弃去萃取液,重复操作3次。
所述的提取方法,优选步骤(1)中去除小分子化合物使用95%的乙醇溶液,体积为党参粉末体积的3倍,回流提取,弃去提取液,循环重复3次,回流时间分别为2.0、1.5、1.0h。
所述的提取方法,优选步骤(2)中水的加入量为党参质量的10-12倍,85℃加热回流提取2次,回流时间分别均为1.0h。
所述的提取方法,优选步骤(2)中2次水提取液合并后减压浓缩至十到十六分之一体积,离心取上清液,采用80%乙醇醇沉。
所述的提取方法,优选步骤(2)中醇沉多糖依次以无水乙醇、丙酮、无水乙醚洗涤。
所述的提取方法,优选步骤(2)中离心转速4000r/min,时间15min。
提取方法提取得到的参多糖组分Co3在制备抗衰老药物中的应用。
本发明的有益效果:
1.本发明选用超滤分级多糖技术,耗时短,操作简便,试验之前的准备工作即为超滤杯的清洗和超滤膜的预处理,且超滤膜的清洁也十分简便,只需2~4天即可完成分级,而用常规的离子柱层析分级则需要约10天,不但耗时长且耗费大量的试剂和人工,同时给环境带来污染。同常规的分离方法相比,超滤膜分级具有分离效率高、能耗低、设备简单、无污染等优点,是行之有效的、具有广阔发展前景的分离方法。
2.本发明将得到的三个党参多糖组分分别进行体外抗氧化实验,通过还原能力、DPPH自由基清除能力、羟自由基清除能力、超氧阴离子自由基清除能力四个指标综合、全面地分析了党参各组分的抗氧化能力。为进一步进行体内的抗氧化实验奠定了基础。
3.本发明最终将体外抗氧化活性最高的组分进行了体内的抗氧化实验验证,通过党参多糖对D-半乳糖所致的衰老作用,得出党参多糖具有显著的抗衰老活性,为开发有效的抗衰老药物提供依据。
附图说明
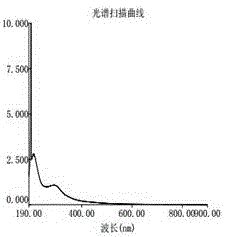
图1为Co1组分紫外光谱扫描图,
图2为Co2组分紫外光谱扫描图,
图3为Co3组分紫外光谱扫描图,
图4为Co1组分红外光谱,
图5为Co2组分红外光谱图,
图6为Co3组分红外光谱图,
图7为党参多糖三组分还原能力比较,浓度单位为mg/mL,
图8为党参多糖组分Co1、Co2、Co3清除率比较,
图9为党参多糖组分Co1、Co2、Co3清除率比较,
图10为党参多糖组分Co1、Co2、Co3超氧阴离子清除能力比较。
具体实施方式
下面结合具体实施例对本发明进行进一步说明:
实施例1
1.仪器与试药
1.1仪器
TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司);中空纤维超滤试验装置(北京旭邦膜设备有限责任公司);中空纤维超滤组件截留分子量分别为300KD、150KD、30KD、10KD、5KD、3KD(内压式超滤膜有效膜面积为0.3m2,外压式超滤膜有效膜面积为0.9m2)(北京旭邦膜设备有限责任公司);漩涡震荡器(北京华尔博科技有限责任公司);LGJ-10冷冻干燥机(北京四环科学仪器四厂);高速冷冻离心机(Hettich有限责任公司);ML503电子天平(Mettler Toledo仪器(上海)有限公司)。
1.2试药
考马斯亮蓝G-250(上海迈坤化工有限公司);牛血清白蛋白(北京恒业中远化工有限公司);安捷伦1260(Agilent 1260Infinity)系统色谱柱型号:安捷伦(Agilent Zorbox SB-C18,4.6×150mm,5m)。
2.实验方法与结果
2.1分析方法
2.1.1紫外光谱扫描
将党参多糖样品配成0.1mg/ml的溶液,用紫外-可见分光光度计在波长190~900nm范围内进行紫外扫描。
2.1.2党参粗多糖含量测定
总糖含量的测定采用硫酸-苯酚比色法(同“方法2.2”)。
2.1.蛋白含量的测定
多糖样品的蛋白含量采用考马斯亮蓝法(同“方法2.3”)。
2.2实验方法
2.2.1党参多糖粗提液的制备
(1)取党参药材100.0g,置1000mL圆底烧瓶中,加入3倍体积的石油醚回流脱脂3次,每次6h,将脱脂后的药材挥干溶剂,再用95%乙醇回流3次,每次乙醇加入量均为600mL,回流时间分别为2.0、1.5、1.0h,以去除单糖等小分子化合物,过滤,药渣晾干;
(2)药渣用水加热回流提取2次,每次蒸馏水加入量均为1200mL,回流时间分别均为1.0h,2次提取液合并后减压浓缩至150mL,离心(4000r/min,15min)取上清液,采用80%乙醇醇沉,醇沉多糖依次以无水乙醇、丙酮、无水乙醚洗涤,溶剂挥干后得到党参粗多糖样品。称重并计算醇沉多糖的提取率。
2.2.2超滤法分级党参多糖的研究
将制备好的党参多糖溶解得到的溶液初步的采用0.45μm的滤膜抽滤,以除去溶液中的固形物,降低对超滤膜的污染。选用合适的超滤膜,在适当的压力和膜通量的情况下,以一定的流速进行超滤,当压力变大时,可以加入适量的去离子水以降低提取液的浓度,反复的超滤,得到少量的浓缩液和大量的滤过液。整个超滤系统由蠕动泵、超滤装置、压力表、调压阀及相应的管路组成。
2.2.2.1超滤膜的选择
控制超滤压力为0.21MPa,温度为25℃,待条件稳定后,取上述制备好的提取液500ml,浓缩至100ml。选择截留分子量分别为300KD、150KD、30KD、10KD、5KD、3KD的超滤膜,分别计算其截留率R和膜通量J。选择合适的超滤膜。不同规格的超滤膜对截留率和膜通量的影响,如下表1所示:
表1 不同规格的超滤膜对截留率和膜通量的影响
由表1可知:截留分子量越大,截留率越低,膜通量越大,30KD和10KD相比截留率相差不明显,而膜通量显著增加;5KD和3KD相比截留率液相差不明显,而5KD的膜通量显著增加,因此,选择300KD的超滤膜进行初滤,30KD和5KD分别对多糖进行截留。
2.2.2.2超滤压力的选择
选择截留分子量为10KD的超滤膜,实验温度为25℃,取上述制备好的提取液500ml,浓缩至100ml。分别在0.1MPa、0.15MPa、0.2MPa、0.25MPa、0.3MPa压力下,考察党参多糖提取液的膜通量,选择合适的操作压力,进行溶液的分级。在一定的条件下,不同的压力对截留率和膜通量的影响如下表2:
表2 超滤压力对截留率和膜通量的影响
由表2可知,适当的增加超滤压力,膜通量在一定范围内可以提高,但随着超滤压力的增大,膜表面的浓度也会增加,因此导致截留率会相应的降低,由上表可以看出,当超滤压力为0.2MPa时,膜通量相对较大,而截留率也不至于太低,因此选择超滤压力为02MPa较合适。
2.2.2.3超滤温度的选择
控制超滤压力为0.21MPa,截留分子量为10KD的超滤膜,取上述制备好的提取液500ml,浓缩至100ml。采用恒温水浴锅控制温度,分别选定实验温度为25℃、35℃、45℃,考察党参多糖提取液的膜通量和截留率的变化,最终选择合适的温度。
多糖的生物活性会随着温度的升高而改变,因此一般情况下超滤的温度不宜超过50℃。因此,本试验控制在45℃以下,以下表3是超滤温度分别为25℃、35℃、45℃时,对截留率和膜通量的影响:
表3 超滤温度对截留率和膜通量的影响
一般情况,膜通量会随着温度的升高而增加,但是随着温度的升高,溶液的黏度也会增加,相应的膜的截留率也会下降,因此在保证有一定的膜通量的情况下,选择25℃作为超滤温度,更加好操作。
2.2.2.4超滤法分离党参多糖的流程
将预处理的党参多糖粗提液采用中空纤维超滤实验装置,设定超滤压力为0.20MPa,超滤温度为25℃,超滤膜选用CLN-300KD、CLN-30KD、CLN-5KD三种滤膜,其中CLN-300KD的超滤膜起初滤的作用,CLN-30KD和CLN-5KD分别可截留3万以上,3万~5000,和5000以下分子质量的多糖共三个组分,分别记为Co1、Co2、Co3。
2.2.3党参多糖组分的含量测定和结构分析
2.2.3.1党参多糖含量的测定
将得到的党参多糖分级组分,采用硫酸-苯酚法测定含量,并计算多糖的纯度:
党参多糖含量=(A/0.6085)×100%
党参多糖的纯度=(截留液体积×截留液浓度)/多糖干制品的质量%
党参多糖组分Co1、Co2、Co3的糖含量如下:
表4 党参多糖各组分的多糖得率
由表4可知,党参多糖分级组分Co3多糖含量和得率均较高,表明,党参多糖中低分子量的多糖含量较高。
2.2.3.2党参多糖紫外光谱扫描
将得到的党参多糖组分配置成浓度为0.5mg/ml的溶液,采用紫外分光光度计,对190-900nm分别进行全波长扫描,记录扫描图谱。图1、2、3分别为党参多糖组分Co1、Co2、Co3的紫外光谱,光谱显示在200nm波长处均有多糖的吸收峰,表明三种组分均含有多糖成分;在280nm波长处有吸收峰,证明三种组分含有少量的蛋白质。
2.2.3.3党参多糖红外光谱扫描
将多糖样品干燥至恒重,分别取3.0mg与KBr混合研磨均匀后压片,使用红外光谱扫描仪在4000-400cm-1内进行扫描,记录扫描图谱。由图4、5、6可知党参多糖组分Co1和Co2差别不大,886cm-1处有明显的β-D葡萄糖的吸收峰;图4和图5均显示在3418cm-1处,图6显示在3408cm-1处有吸收强度一大的宽峰,这是糖分子内或分子间氢键O-H伸缩振动引起的吸收,也包括-NH2中-N-H的伸缩振动;三个组分均提示在2930cm-1处有次甲基(-CH2)中-C-H的伸缩振动的吸收峰;Co1、Co2均在1455-1261cm-1处,Co3在1417-1101cm-1处显示有-C-H的变角振动;三图中均显示有1633cm-1的吸收峰,此吸收峰为-C=O的伸缩振动;三图中均显示有1056cm-1的吸收峰,此为醇羟基的变角振动;图4、5显示有923cm-1的吸收,此吸收为吡喃糖环醚键(-C-O-C-)的非对称伸缩振动;923cm-1、866cm-1的吸收为α-D葡萄糖的特征吸收。
实施例2体外抗氧化化研究
1.仪器与试药
1.1仪器
TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司);德国Heidolph旋转蒸发器(艾拓思实验设备(上海)有限公司);KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);ML503电子天平(Mettler Toledo仪器(上海)有限公司);Milli QA纯水处理器(Millipore公司)。
1.2试药
实施例1得到的党参多糖Co1、党参多糖Co2、党参多糖Co3,磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸TCA、三氯化铁、1,1-二苯基-2-三硝基苯肼(DPPH)、硫酸亚铁、水杨酸、抗坏血酸Vc、三羟甲基氨基甲烷(Tris)、邻苯三酚(焦性没食子酸)均为分析纯。
2.方法与结果
2.1党参多糖的抗氧化活性检测方法
2.1.1党参多糖不同组分还原能力的测定
采用铁离子还原能力测定法。由于样品的还原能力与其抗氧化性成正相关性,因此样品反应后的生成物在700nm处的吸光度值的大小反映了其还原能力的大小。具体方法如下:
吸取1.0ml 1.0mg/ml的多糖待测液至试管中,加入3.0ml磷酸盐缓冲液(0.2M,PH6.6)以及2.5ml质量分数为1.0%的铁氰化钾溶液(K3[Fe(CN)6),混合均匀后将该体系置于50℃恒温20min,然后加入2.5ml质量分数为10%的三氯乙酸(TCA)溶液,混合均匀,3000r离心10min。移取2.5ml上清液与另一试管中,加入2.5ml蒸馏水及0.5ml质量分数为0.1%的三氯化铁(FeCl3)溶液,混合均匀,静置10min后,在700nm处测定体系的吸光度。以蒸馏水作为阴性对照,以同浓度维生素C溶液为阳性对照,每个样品重复测定3次,取平均值,见表5。以吸光度值A为纵坐标,见图7。
表5 党参多糖组分Co1、Co2、Co3抗氧化能力测定表
2.1.2党参多糖DPPH自由基清除能力的测定
采用DPPH氧化法测定。DPPH·自由基,由于苯环的共轭和位阻及硝基的吸电子作用,属于比较稳定的有机自由基,具有单电子而使其在517nm处有一强吸收(呈深紫色)。当存在自由基清除剂时,由于其单电子配对而使其吸收消失,吸光度变小,紫色变浅,其退色程度与其所接受的电子数成定量关系。并且随着抗氧化剂浓度的增加,DPPH·溶液颜色逐渐越淡,说明对DPPH·自由基的清除率逐渐增加。具体方法如下:
取1.0mg/ml的多糖溶液2.0ml,加入2.0ml现配的0.2mmol/LDPPH-乙醇溶液,混匀后静置30min,以50%的乙醇作参比,在517nm测定样品的吸光度A。同时测定2ml蒸馏水+2mlDPPH-乙醇溶液的吸光度ADPPH。样品对DPPH的清除率为:
自由基清除率(%)=(ADPPH-A样品)/ADPPH×100%
分别取样品Co1、Co2、Co3,分别配置浓度为0.125、0.25、0.5、1.0、2.0、5.0mg/ml的供试品溶液,测定其吸光度值A,并计算DPPH清除率如下表6:
表6 党参多糖Co1、Co2、Co3DPPH自由基清除率测定表
以DPPH自由基清除率为纵坐标,见图8。
2.1.3党参多糖羟自由基清除能力测定
采用水杨酸法,通过反应H2O2+Fe→·OH+OH-+Fe3+,产生羟自由基(·OH);·OH氧化水杨酸产生有色物质,该产物在510nm处有强吸收;若体系中加入清除·OH的物质,则会减少有色物质生成,吸光度降低;吸光度越低,清除·OH效果越好。具体方法如下:
取10ml的试管,每支加入2ml的FeSO4溶液(6mmol/L)以及2ml不同浓度的多糖溶液,然后加入2ml的H2O2(6mmol/L)溶液,摇匀后静置10min,再加入2ml的水杨酸(6mmol/L)溶液,摇匀后静置30min,测定其在510nm处吸光度值A510,以蒸馏水按同样方法做空白,以Vc作阳性对照。每个样品重复试验3次,取其平均值。羟自由基的清除率(%)计算公式如下:
清除率(%)=A0-(Ai-Aj)/A0×100%
A0—不加样品溶液的吸光度值;
Ai—加入样品溶液反应后的吸光度值;
Aj—不加水杨酸时溶液的吸光度值。
分别取样品Co1、Co2、Co3,分别配置浓度为0.125、0.25、0.5、1.0、2.0、5.0mg/ml的供试品溶液,测定其吸光度值A,并计算羟自由基清除率如下表7:
表7 党参多糖组分Co1、Co2、Co3羟自由基清除率测定表
以浓度为横坐标,以羟自由基清除率为纵坐标见图9。
在一定的范围内多糖清除羟自由基的能力随着浓度的增大而增强,相同浓度下,多糖对羟自由基清除能力为Co3>Co2>Co1。
2.1.4党参多糖超氧阴离子自由基清除能力测定
采用邻苯三酚自氧化法。邻苯三酚在碱性条件下能发生自氧化,生成有色中间物(在365nm处有最大吸收峰)和O2-﹒,而O2-﹒对自氧化又起催化作用,依据有色中间物生成量的多少,可判断O2-﹒生成量的多少。
取6mlTris-HCl(50mmol/L,PH=8.12)缓冲液置于各试管中,分别加入不同浓度多糖溶液0.5ml,混匀后水浴(37℃)10min,然后加入1ml经37℃预热过的邻苯三酚盐酸溶液(7mmol/L,PR),摇匀。精确反应4min后用0.5ml浓盐酸终止反应,测定其在325nm处的吸光度值A,即加入多糖溶液后,邻苯三酚的自氧化速率。依照以上方法,用蒸馏水,代替样品,所测值A0为邻苯三酚的自氧化速率,以VC作为阳性对照,每个样品重复试验3次,取其平均值。清除率(%)计算公式如下:
清除率(%)=(A0-A)/A0×100%
式中:A0——空白邻苯三酚的自氧化速率;
A——加入样品溶液后邻苯三酚的自氧化速率。
取样品Co1、Co2、Co3,分别配置浓度为0.125、0.25、0.5、1.0、2.0、5.0mg/ml的供试品溶液,测定其吸光度值A,并计算超氧阴离子自由基清除率,如下表8。
表8 党参多糖Co1、Co2、Co3超氧阴离子自由基清除率测定表
以多糖浓度为横坐标,以超氧阴离子自由基清除率为纵坐标,见图10。
综合以上实验结果,对党参多糖不同分子量组分Co1、Co2、Co3抗氧化能力比较如表9。
表9 党参多糖Co1、Co2、Co3抗氧化能力比较
结论:分子量越小,抗氧化能力越强,党参多糖三组分在一定的范围内抗氧化能力均随着多糖浓度的增大而增强,以Vc作阳性对照,表明党参多糖组分Co3具有较强的抗氧化能力。为下一步进行体内药理活性研究奠定基础。
实施例3对D-半乳糖所致衰老小鼠的保护作用
衰老小鼠模型的建立有多种,主要分为自然衰老和人为干预衰老,由于自然衰老模型的建立周期比较长,所以一般选择人为干预建立衰老模型,研究表明D-半乳糖致衰老模型,容易建立,且小鼠的身体机能表现明显,所以本试验选择D-gal致衰老模型小鼠,由于本试验模型建立时需要颈背部皮下注射,为避免同一笼的小鼠相互撕咬或抓挠,选择相对温顺的雌性小鼠。经体外抗氧化实验表明采用超滤法分离得到的党参多糖三组分中Co3的抗氧化能力较强,即清除体内自由基的能力较强,因此本试验设定,党参多糖Co3高、中、低三个剂量组为实验组,以维生素E为阳性对照组,并同时设定,模型对照组和空白对照组,共分为六组,通过测定小鼠血清和肝脏中SOD、GSH-Px和GSH酶的活性以及MDA含量验证党参多糖Co3对D-半乳糖致衰老小鼠的保护作用,追踪党参多糖的抗衰老活性部位。
1.实验材料与仪器
1.1实验动物
一月龄清洁型雌性ICR Mice 60只,体重20±2g,购于山东省实验动物中心,许可证号:SCXK(鲁)20140007。饲养环境安静,室温25℃,各组小鼠自由进食、饮水。
1.2药品与试剂
1.3实验仪器
TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司);
高速冷冻离心机(Hettich有限责任公司);
ML503电子天平(Mettler Toledo仪器(上海)有限公司);
MagNALyser全自动组织匀浆仪(罗氏诊断产品(上海)有限公司);
KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司);
SpectraMax 190微孔板检测系统(酶标仪)(美谷分子仪器(上海)有限公司);
数显电热恒温水浴锅(北京市永光明医疗器械有限公司);
漩涡震荡器(北京华尔博科技有限责任公司);
微量移液器(sigma公司);
96孔培养板(Costar,美国)。
2.方法与结果
2.1药物的配置
(1)D-半乳糖的配置:取一定量的D-半乳糖溶于生理盐水配置成80mg/kg,即4mg/ml体积浓度的D-gal溶液,储存于4℃冰箱中备用。
(2)党参多糖溶液的配置:称取一定量的党参粗多Co3,溶于生理盐水中配置成400mg/kg,即20mg/ml体积浓度的多糖溶液,储存于4℃冰箱中备用。
2.2实验动物分组及给药
2.2.1动物分组
将购进的健康育龄清洁级ICR纯系雌性小鼠,经一周环境适应性饲养,随机分为6组:正常对照组、模型对照组、VE阳性对照组、党参多糖Co3低剂量组、党参多糖Co3中剂量组、党参多糖Co3高剂量组。每组10只,分笼饲养。
2.2.2给药
除正常对照组每天颈背部皮下注射生理盐水,其他5组均按80mg/kg/d的剂量颈背部皮下注射D-gal。与此同时,党参多糖Co3低、中、高剂量组分别以100mg/kg/d、200mg/kg/d、400mg/kg/d灌胃,VE阳性对照组以25mg/kg/d灌胃,正常对照组和衰老模型组小鼠则以相应体积的生理盐水灌胃。实验周期为48天。
2.2.3组织样品的处理及制备
每周对小鼠的体重测量两次,按照相应体重确定给药量,实验第48天,停止药物干预,小鼠禁食12小时,以眼眶后静脉丛法取血,取血后颈椎脱臼法处死小鼠,取出肝脏用0.9%预冷的生理盐水制备10%的组织匀浆备用。分别测定SOD、GSH-PX、T-AOC的酶活性,及MDA的含量。
(1)血清的制备:ICR小鼠静脉丛取血后,将血液移入2ml离心管中,静置2h,再将离心管放入冷冻离心机3500rpm/min离心15min,取上清,并将上清置于-80℃冰箱中储存。
(2)肝组织:将小鼠颈部脱臼处死后,以手术剪及镊子迅速解剖,取出肝脏组织,并用预冷的生理盐水将血液及残留脂肪组织清洗干净,再用定性滤纸将小鼠肝脏组织表面的水分吸干,使用电子天平准确称取小鼠肝脏1g,加入预冷的生理盐水,并用组织匀浆仪对肝脏组织进行研磨,制备成10%的肝脏组织匀浆备用。
2.3实验指标的测定
2.3.1组织样品蛋白含量测定
小鼠血清、肝脏组织匀浆的蛋白含量测定采用碧云天生物有限公司的Bradford蛋白浓度测定试剂盒进行检测,检测载体为96孔酶标板。
(1)蛋白标准曲线的制备:取一96孔板,按表10所述分别加入相应的试剂:
表10 蛋白含量测定参考表
(2)各孔加入200μlG250染色液,室温放置3~5min。
(3)用酶标仪测定A595,或560~610nm之间的其他波长的吸光度。
(4)根据标准曲线和使用的样品体积计算出样品中的蛋白浓度。
2.3.2MDA含量测定
MDA含量测定的意义及原理:丙二醛(MDA)可以形成脂质过氧化物,通过测定MDA的量来反应机体内脂质过氧化的程度。本试剂盒在较高的温度及酸性环境中与TBA发生反应,生成红色的MDA-TBA加合物,此加合物在535nm处有最大吸收,据次可以采用比色法测定MDA的含量。
小鼠血清、肝脏组织匀浆的丙二醛(MDA)含量测定采用碧云天生物有限公司的脂质氧化(MDA)检测试剂盒进行检测,检测载体为96孔板。样品测定步骤如下:
(1)取适量标准品,用蒸馏水稀释至1、2、5、10、20、50μM。在离心管内加入0.1ml生理盐水作为空白对照,加入0.1ml上述不同浓度的标准品,用于制作标准曲线,加入0.1ml样品用于测定;随后加入0.2mlMDA检测工作液,参考表11:
表11 MDA含量测定参考表
混匀后,沸水浴加热15min。加热时务必注意避免液体瀑沸溅出。
(3)水浴冷却至室温,1000g离心10min。取200μl上清加入到96孔板中,用酶标仪测定532nm处的波长。
(4)MDA含量的计算:血清样品可以直接根据标准曲线计算获得MDA的摩尔浓度,肝脏组织匀浆,计算出样品溶液中的MDA含量后,通过单位重量的蛋白含量来计算样品中MDA的含量。
2.3.3GSH-Px活力的测定
GSH-Px测定的意义及原理:谷胱甘肽过氧化物酶可以清除活细胞内的过氧化物,在保护细胞免受自由基损伤过程中起到了关键的作用。细胞内的脂类容易和自由基发生反应,产生脂类过氧化物。谷胱甘肽过氧化物酶可以利用还原型谷胱甘肽(GSH)还原脂类过氧化物,从而消除自由基的毒害作用。谷胱甘肽过氧化物酶还可以利用GSH催化过氧化氢以及许多有机过氧化物,产生水或有机醇。如果以过氧化氢为底物进行检测,则同样可以分解过氧化氢的过氧化氢酶的酶活性会干扰谷胱甘肽过氧化物酶的测定。本试剂盒利用了一种间接测定的方法,GSH-Px可以催化GSH产生GSSG,而GSH可以利用NADPH催化GSSG产生GSH,通过检测NADPH的减少量就可以计算出GSH-Px的活力水平。
小鼠血清、肝脏组织匀浆的GSH-Px活力测定采用碧云天生物有限公司的谷胱甘肽过氧化物酶检测试剂盒进行检测,检测载体为96孔板。样品测定步骤参考表12:
表12 GSH-Px活力测定参考表
(1)参考上表,依次加入检测缓冲液、待测样品和GPx检测工作液,混匀。加入4μl15mM过氧化物试剂溶液后,开始反应,需要混匀。
(2)采用酶标仪测定A340。每隔30s测定一次A340,,连续记录3min,获得6个点的数据,取中间三个数据的平均值作为最终数据。
(3)样品中谷胱甘肽过氧化物酶活力的测定:
a[样品中谷胱甘肽过氧化物酶活力]=[检测体系中谷胱甘肽过氧化物酶活力]×[稀释倍数]/[样品中的蛋白浓度]
注:[样品中谷胱甘肽过氧化物酶活力]的单位为:U/mg蛋白或mU/mg蛋白;
[样品中的蛋白浓度]的单位为:mg/ml。
B[检测体系中谷胱甘肽过氧化物酶活力]=[A340/min(sample)-A340/min(blank)]/0.00622
注:[检测体系中谷胱甘肽过氧化物酶活力]的单位为mU/ml。
2.3.4SOD活力的测定
SOD活力的测定的意义及原理:超氧化物歧化酶(SOD)是一种具有特殊生物催化功能的蛋白质,它能催化超氧化物阴离子发生歧化作用,生成过氧化氢(H2O2)和氧气(O2),维持机体中自由基产生和清除的动态平衡,可以保护生物体,是生物体内一种重要的抗氧化酶。因此,通过测定SOD的含量,就可以间接的反应体内自由基的活性。目前测定SOD比较先进的方法包括WST-1法和WST-8法,其中WST-8法更加稳定、灵敏,本试剂盒采用WST-8法,原理为WST-8可以和超氧化物阴离子(此为黄嘌呤氧化酶催化产物)反应产生甲臜染料,该反应可以被SOD所抑制。因此可以通过此方法测定出SOD的酶活力。
小鼠血清、肝脏组织匀浆的SOD活力测定采用碧云天生物有限公司的CuZn/Mn-SOD活性检测试剂盒进行检测,检测载体为96孔板。样品测定步骤参考表13:
表13 SOD活力测定参考表
注:如果样品有颜色或含有抗氧化物质,需要设置空白对照3,如果样品没有颜色且不含有抗氧化物质则不必设置空白对照3。
(1)按上表加入反应试剂37℃孵育30min。
(2)采用酶标仪测定450nm处的波长。
(3)样品中总SOD活力的计算:
a.SOD酶活力单位的意义:在上述黄嘌呤氧化酶偶联反应体系中抑制百分率为50%时,反应体系中的SOD酶活力定义为一个酶活力单位(unit)。
b.SOD酶活力的计算公式:[待测样品中SOD酶活力单位]=[检测体系中的酶活力单位]=[抑制百分率]/(1-[抑制百分率])units
[抑制百分率]=[(A空白对照1-A空白对照2)-(A样品-A空白对照3)]/(A空白对照1-A空白对照2)×100%
2.3.5GSH含量的测定
GSH含量测定的意义及原理:还原型谷胱甘肽(GSH)作为关键的抗氧化剂,对于维护蛋白巯基的氧化还原状态有着重要作用。因此,通过测定GSH的含量,就可以间接的反应自由基的活性。本试剂盒通过谷胱甘肽还原酶把氧化型谷胱甘肽(GSSG)还原成GSH,而GSH可以和生色底物DNTB反应产生黄色的TNB和GSSG。适当配置反应体系,前后两个反应合并起来后,总谷胱甘肽(GSSG+GSH)就相当于一个颜色产生的限速因素,总谷胱甘肽的量就决定了黄色的TNB的形成量。
小鼠血清、肝脏组织匀浆的GSH含量测定采用碧云天生物有限公司的GSH和GSSG检测试剂盒进行检测,检测载体为96孔板。样品的测定步骤参考如下:
(1)标准曲线的制备:把10mM GSSG储备液用蛋白取出试剂M溶液稀释成15μM GSSG溶液,然后依次稀释成10、5、2、1、0.5μM GSSG溶液,取15、10、5、2、1、0.5μM GSSG溶液六个点制作标准曲线。
(2)使用96孔酶标板,参考下表,依次加入样品或标准品,震荡,混匀。加入150μl总谷胱甘肽检测工作液后,混匀。25min孵育5min。立即用酶标仪测定412nm处的波长,每5min测定一次,共采5个点的数据,取第5个点作为最终结果。
表14 GSH含量测定参考表
(3)样品中总谷胱甘肽含量的计算:采用单点测定法,根据不同浓度标准品测得的吸光度作标准曲线。样品对照标准曲线即可计算出总谷胱甘肽的含量。
2.4试验结果
2.4.1小鼠血清抗氧化能力的变化
表15 党参多糖Co3对小鼠血清SOD、GSH-Px、GSH及MDA的影响
注:与空白对照组比较:aP<0.05;与模型对照组比较:bP<0.05;与VE对照组比较:cP<0.05;
由表15可得知:与空白对照组相比,模型组小鼠血清中SOD、GSH-Px和GSH的活性均明显降低(P<0.05),而MDA的含量显著增加(P<0.05),证明D-半乳糖致正常小鼠衰老模型造模成功。党参多糖Co3高剂量组,均能显著升高SOD、GSH-Px和GSH的活性(P<0.05),且显著降低MDA的含量(P<0.05),与VE阳性对照组无显著性区别(P>0.05),证明党参多糖组分Co3高剂量组对小鼠的抗氧化作用显著;而党参多糖Co3中剂量组和党参多糖Co3低剂量组对小鼠的抗氧化作用不明显。
2.4.2小鼠肝脏抗氧化能力的变化
表16 党参多糖Co3对小鼠肝脏组织匀浆SOD、GSH-Px、GSH及MDA的影响
注:与空白对照组比较:aP<0.05;与模型对照组比较:bP<0.05;与VE对照组比较:cP<0.05;
由表16可知:与空白对照组比较,模型组小鼠肝脏组织匀浆中SOD、GSH-Px和GSH的活性均明显降低(P<0.05),而MDA的含量显著增加(P<0.05),证明D-半乳糖致正常小鼠衰老模型造模成功。党参多糖高剂量组Co3能显著提高小鼠肝脏组织中SOD、GSH-Px和GSH酶的活性(P<0.05),并能显著降低MDA的含量(P<0.05),与VE阳性对照组相比,无显著性变化(P>0.05);而党参多糖Co3中剂量组和低剂量组对小鼠肝脏中SOD、GSH-Px和GSH的活性及MDA的含量的影响较小(P>0.05)。
目前,小鼠的抗衰老实验模型有自然衰老的实验模型、胆碱能神经损伤的衰老模型、转基因衰老动物实验模型、代谢紊乱诱发的衰老实验模型、实验性自身免疫性衰老模型等。本试验采用D-半乳糖颈背部皮下注射诱导模型。研究表明,D-半乳糖致衰老模型,与人类自然衰老有相似的细胞退行性变化和生化变化,其优点是可行性强、易于控制,能够较好的模拟实验动物的衰老行为、氧化应激等方面,常被用于实验动物行为学、抗免疫及抗氧化等的影响研究。D-半乳糖衰老模型的评估指标主要有外观特征观察、实验动物血清、肝脏组织中SOD、GSH-Px和GSH酶的活性以及MDA含量的变化。
SOD能催化超氧化物阴离子发生歧化作用,生成过氧化氢和氧气,是生物体内一种重要的抗氧化酶;GSH-Px可以通过清除活细胞内的过氧化物以及利用还原型谷胱甘肽还原脂类过氧化物,来保护细胞免受自由基的损伤及毒害;GSH作为关键的抗氧化剂,对于维护蛋白巯基的氧化还原状态具有重要的作用;MDA作为脂质氧化的产物,通过对其水平的检测,来用作评价脂质过氧化的指标。因此本试验选定SOD、GSH-Px和GSH酶的活性以及MDA含量作为小鼠抗衰老实验的指标。最终实验结果证明,党参多糖组分Co3对D-半乳糖诱导的小鼠衰老模型有显著的抗衰老作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!