一种丹皮提取物、提取方法及其在抗肿瘤药物中的应用与流程
技术领域:
本发明涉及一种丹皮提取物、提取方法及其在抗肿瘤药物中的应用,属于天然药物
技术领域:
。
背景技术:
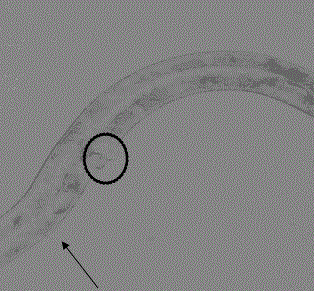
:丹皮为毛茛科植物牡丹干燥根皮。产于安徽、山东等地。秋季采挖根部,除去细根,剥取根皮,晒干。生用或炒用。丹皮入心、肝、肾经。具有清血,活血散瘀的功能。主治斑疹吐血,血滞经闭,经前发势,痈肿疮毒,损伤瘀血,阴虚发势,无汗骨蒸。临床上主要用于清肝火和凉血散瘀(消炎、降压),如因肝郁火而致的发热、盗汗、自汗、头痛目涩、月经不调,常配栀子、柴胡等。秀丽隐杆线虫作为模式生物,通过遗传分析和显微观察,对线虫由受精卵分裂、分化发育为成虫的过程做了全面的跟踪观察,发现线虫调节器官发育和程序性细胞死亡的几个关键因素,在高等动物和人体中也存在[1]。来自希伯来大学和约翰霍普金斯大学医学院的研究人员研究线虫细胞核膜中诱导的突变[2]。加拿大的研究人员利用秀丽隐杆线虫筛选了14100种小分子化合物找到了一个叫Nemadipine-A物质,它能够引起线虫形态和产卵异常[3],秀丽隐杆线虫还可用于对驱虫药物的筛选[4]。樟脑丸的一种代谢产物1,4萘醌课抑制线虫的促凋亡蛋白CED-3的活性,从而抑制细胞的凋亡[5]。生物分析已经广泛用于各种毒理研究,线虫进行药物毒性的研究最基本方法就是观察统计经过待测物质处理若干时间后线虫的存活率,将线虫应用于化学试剂毒性检测,如对(甲基硫酸乙酯)进行的毒性研究[6],还有将线虫用于环境水质的检测,通过线虫的成活率来评定水的毒性大小。Ras是一种小分子蛋白GTPase,是肉瘤病毒基因的同源物。秀丽隐杆线虫中的let-60编码的Ras是调节线虫阴门发育的一个因子[7]。随后,KayneandSternberg等[8]人利用遗传学工具阐明了LET-60Ras信号通路,该通路主要是调节线虫阴门发育和雄性交合刺的形成。Ras信号通路是高度保守的,线虫中的Ras蛋白与人类的K-Ras和N-Ras蛋白在最前面的164个氨基酸(总共184个氨基酸)中有83%是完全相同的,且其信号通路上的大部分因子都能在哺乳动物上找到同源物。技术实现要素:近年来,中药由于其毒副作用小越来越引起更多人的关注,本发明利用秀丽隐杆线虫作为模型生物筛选下调ras过渡激活的抗肿瘤中药及药物急性毒性研究。本发明发现采用秀丽隐杆线虫突变体筛选具有下调ras过渡激活的抗肿瘤活性中药,丹皮的提取物显示出抗肿瘤活性好且毒性较小的优点。技术方案是:一种丹皮提取物,它是由丹皮经过水提取之后,再经过大孔树脂进行吸附、洗脱处理而得到。丹皮提取物的提取方法,包括如下步骤:第1步,取丹皮,加水浸泡,再进行煎煮;第2步,将第1步得到的煎液经过大孔树脂进行吸附、洗脱处理,洗脱液经过减压浓缩、干燥后,得到提取物。所述的第1步中,加水浸泡步骤中加水重量是丹皮的5倍;煎煮次数是3次。所述的第1步中,大孔树脂是HPD400大孔吸附树脂,洗脱处理采用的是85v/v%的乙醇进行洗脱,洗脱液为提取物溶液。丹皮提取物在制备抗肿瘤药物中的应用。所述的抗肿瘤药物,是指抑制原癌基因ras通路过度激活的抗肿瘤药物。有益效果本发明提供了一种丹皮提取物,它对于Ras基因具有明显的抑制调节作用,采用本发明提供的提取方法可以获得效果明确的提取物,经过大孔吸附树脂处理了煎液之后,可以显著降低提取物的毒性以及提高对Ras基因的抑制效果,提取过程方法简单、收率高、纯度高。附图说明图1是成虫野生型在倒置显微镜下的形貌图;图2是有一个假阴门的突变体线虫在倒置显微镜下的形貌图;图3是有两个假阴门的突变体线虫在倒置显微镜下的形貌图;图4是有三个假阴门的突变体线虫在倒置显微镜下的形貌图;图5是丹皮提取物对线虫突变体MT2124的作用(**p<0.01);图6是实施例1提取物的急性毒性曲线;图7是对照例1提取物的急性毒性曲线。具体实施方式实验部分1、仪器、试剂及实验材料1.1仪器:CJ-26型洁净工作台,DXC型紫外线消毒车,TGL-13型电动离心机,XH-B型旋涡混匀器,HZQ-F160A型恒温振荡器,GFL303型气浴恒温摇床,海尔BCD20JV型电冰箱,ASV-3023型全自动高压消毒柜,Biofugestratos型高速冷冻离心机,浮游生物计数板,计时器,移液枪,枪头,离心管,微孔滤膜,温度计,注射器,烧杯,锥形瓶,枪盒,酒精灯,镊子,接种环,涂菌棒,培养皿,96孔板。1.2实验材料秀丽隐杆线虫(Caenorhabditiselegans):秀丽隐杆线虫MT2124,let-60ras(gf)突变体,购于美国线虫遗传中心。大肠杆菌:大肠杆菌OP50,线虫的食物,购于美国线虫遗传中心。丹皮药材,购于兰州惠仁堂药业。1.3溶液的配置NGM培养基:100ml纯净水加入0.3031g氯化钠,1.7033g磷酸二氢钾,0.2309g磷酸氢二钾,0.27185g蛋白胨,1.7155g琼脂,使其全部溶解。(灭菌后加0.2ml氯化钙,0.2ml硫酸镁,0.1ml胆固醇。)Sbasal:100ml纯净水加0.585g氯化钠,0.1g磷酸氢二钾,0.6g磷酸二氢钾,混合均匀灭菌。S基础液:100mlSbasal加入1ml柠檬酸,1mlTrace,100μl胆固醇,300μl硫酸镁,300μl氯化钙,混合均匀。(现配现用)LB培养基:100ml纯净水加入1.0g蛋白胨,0.5g酵母粉,1.0g氯化钠,混合均匀灭菌(再加1.7155g琼脂,灭菌,得LB固体培养基)。M9缓冲液:100ml纯净水加0.49725g氯化钠,0.5964g磷酸氢二钠,0.2992g磷酸二氢钾,0.012g硫酸镁,混合均匀,灭菌。裂解液:1M氢氧化钠:2.4%次氯酸钠按1:1的比例混合。实施例1丹皮提取物制备称取50g丹皮药材,加十倍量纯净水,浸泡半小时,煎煮三次,每次1h,合并滤液,浓缩至50ml,制成1g/ml(按生药材计)的药液,离心(10000rpm20min),0.22μm微孔滤膜过滤,收集滤液,再将滤液送入填充有HPD400大孔吸附树脂进行吸附,滤液进料量是5BV,再采用85v/v%的乙醇进行洗脱,洗脱液用量是3BV,洗脱液经过减压浓缩、干燥后,得到丹皮提取物。对照例1丹皮提取物制备与实施例1的区别在于:未采用大孔吸附树脂进行吸附和洗脱处理。称取50g丹皮药材,加五倍量纯净水,浸泡半小时,煎煮三次,每次1h,合并滤液,浓缩至50ml,制成1g/ml(按生药材计)的药液,离心(10000rpm,20min),微孔滤膜过滤,收集滤液,再将滤液经过减压浓缩、干燥后,得到丹皮提取物。实施例2药效试验大肠杆菌OP50培养将从线虫遗传中心购置的在固体培养基上培养的OP50,用接种环接种到LB液体培养基中,放在摇床上,培养条件200rpm,20℃,培养24h,一部分用于涂菌,每板加400μl菌液,用涂菌棒涂布均匀,放置恒温培养箱中培养24h,用于线虫转板;另一部分离心(10000rp10min)得到固体菌,将其称重,然后稀释成110mg/ml的菌液,置于4℃冰箱保存。线虫培养将冻存于-80℃冰箱中的秀丽隐杆线虫MT2124转接到涂有OP50的固体NGM培养基上,在20℃下培养成虫进行同步化。将同步化线虫孵化成L1期小线虫用于药物活性实验的生物模型和急性毒性实验。线虫同步化将培养了2-3d的固体板线虫用M9液冲洗至10ml离心管中,使线虫沉降,吸出上清液,先后加入3ml1M氢氧化钠和3ml2.4%次氯酸,在涡旋器上涡旋6min,快速吸入1.5ml的离心管中,离心(4min3000rp),快速吸出裂解液,再用M9液冲洗两次,最后加约1mlM9液,放置恒温箱中培养24h后。同步化液体线虫时,吸出S液时用M9液清洗一次,再加裂解液,后面步骤跟固体板线虫相同。对线虫突变体的抑制效果将实施例1和对照例1中的丹皮提取物用S基础液按照表1稀释成不同浓度梯度的药液,配制成均匀药液;再用S基础液将110mg/ml的OP50稀释成11mg/ml的菌液;同时把培养2d的同步化线虫用S基础液稀释成60-80条每20μl的线虫液。在96孔板的药物组的每一药孔中加160μl均匀药液,20μlOP50,20μl线虫,在空白组的每孔中加160μlS基础液,20μlOP50,20μl线虫,然后将其混合均匀,放置恒温振荡器中培养,不断观察,待线虫培养成成虫后,观察统计药物组与空白组中野生型的比例(野生型比例=野生型/线虫总数)[10],然后将药物组与空白组进行比较,判断药物对线虫突变体是否有抑制作用。表1稀释后的丹皮水提液的浓度线虫中的野生型和突变体的判定由于成虫野生型和突变体线虫真假阴门表型很容易在倒置显微镜下观察和区别,阴门发育从L1期开始,成虫期时发育完全,且便于观察。可以看出图1所表示野生型线虫,只有一个真阴门,图2-4表示的是突变体,图2中只有一个假阴门,图3中有两个假阴门,图4中有三个假阴门。不同中药对秀丽隐杆线虫ras过度激活突变体MT2124多阴门表型的影响将丹皮提取物按照表1进行稀释成不同浓度的药液,然后作用于L1期线虫,将所有组线虫培养至成虫后,在倒置显微镜下观察并统计其野生型比例。实施例1中的提取物作用效果如图5显示,与空白组比较丹皮提取物有显著的抑制线虫突变体的作用,并呈剂量依赖关系,与空白组比较,药物组在各浓度下对突变体线虫均有显著抑制作用,且这种效果与药液浓度呈正比关系。野生型比例试验结果如下:浓度mg/ml051020实施例1提取物12.5±4.231.1±3.8**▲44.2±5.6**▲60.4±4.3**▲对照例1提取物11.8±3.820.2±3.428.6±4.5**36.7±5.1****与空白组相比p<0.05,▲与对照例1相同浓度组相比p<0.05通过实施例1和对照例1组相比,在相同浓度下,实施例1中的提取物具有更高的线虫野生型比例,说明通过大孔吸附树脂可以富集了有效成分,经过该改进提取方法之后,提高了抑制药效。实施例3对线虫MT2124的急性毒性将丹皮提取液配制为溶液作用于L1期线虫,并将线虫培养24h,统计中药不同浓度时,线虫死亡比例,分别与其空白组对照,实施例1和对照例1的结果如图6和图7所示。可以看出,当实施例1和对照例1提取物浓度均为62.5mg/ml时,其所对应的线虫致死率分别是53.7%、83.1%,经过大孔吸附树脂处理后,可以有效地降低提取物的毒性。参考文献[1]Artal-SanzM.,deJongL.,TavernarakisN.,Caenorhabditiselegans:Aversatileplatformfordrugdiscovery[J].Biotechnol,2006,1(8):1405-1418.[2]Ben-HarushK.,WieselN.,KrispinF.,MoellerD.,SorepE.,AebisU.,HerrmannH.,GruenbaumY.,MedaliaO.,TheSupramolecularOrigazinationoftheC.elegansNuclearLaminFilament[J].Mol.Biol.2009,386(5):1392-1402.[3]KwokT.C.,RichenN.,FraserR.,ChanA.W.,BurnsA.,StanleyE.F.,MccourtP.,CutlerS.R.,RoyP.J.,Asmall-moleculescreeninC.elegansyieldsanewcalciumchannelantagomist[J].Nature,2006,441(7089):91-95.[4]GnoulaC.,GuissouI.,DuboisJ.,Duez-TalantaP.,5(6)-carboxyfluoresceindiacetateasanindicatorofCaenorhabditiselegansviabilityfortheDevelopmentofinvitroanthelminticdrugassay[J].Talanta,2007,71(5):1886-1892.[5]Tomokok.,MoriH.,MizushinaYoshiyuki.,MatsubaraK.,1,4-Naphthoquinoneisapotentinhibitorofhumancancercellgrowthandangiogenesis[J].CancerLetter,2009,278(1):34-40.[6]王渤.线虫Caenorhabditiselegans在甲基硫酸乙酯(EMS)中的毒性实验[J].中国动物检疫,2004,21(12):24-26.[7]HanM.,SternbergP.W.,let-60agenethatspecifiescellfatesduringC.elegansvulvalinduction,encodesarasprotein[J].Cell,1990,63(5):921-931.[8]KayneP.S.,SternbergP.W.,RaspathwaysinCaenorhabditiselegans[J].CurrentOpinioninGenetics.,Development,1995,5(1):38-43.[9]丁晓霞.以秀丽隐杆线虫作为模式生物对雄黄微生物浸出液活性和毒性的研究[D].2009。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1