双泡状荧光探针及其应用和试剂盒的制作方法
本发明属于核酸检测领域,具体涉及双泡状荧光探针,还涉及双泡状荧光探针在基因定量分析、检测单碱基变异或检测高度同源性核酸靶分子中的应用以及含有双泡状荧光探针的试剂盒。
背景技术:
基因表达异常或基因突变常常与疾病相关,如导致恶性肿瘤的癌基因突变,因此基因表达量或基因突变检测对临床疾病监测具有重要意义。
现有的检测技术方法众多,主要为针对单碱基变异的荧光探针检测技术,如水解探针(hydrolysis probes;亦叫TaqMan探针)、杂交探针(hybridization probes)、分子信标(molecular beacons)等是最为常见,也是最为常用的检测技术。但是,上述探针对单碱基变异检测并不理想。一方面针对单碱基变异的上述探针设计难度大,针对同一种单碱基变异,通常需要设计几种以上探针,以便最终筛选到一条特异性最好的探针;另一方面由于杂交动力学原因,探针对单碱基变异的识别能力有限,特异性不理想,由于不同基因型对应的探针熔解温度(melting temperature,Tm)极为接近,且探针的整体Tm值较高,上述探针主要依赖于Tm值的微弱差异来控制探针对模板杂交的特异性;因此,针对单碱基变异的荧光探针往往能够与其它未变异的模板(或核酸分子)非特异性杂交,产生假阳性结果。对于单碱基变异中的单核酸酸多态性(single nucleotide polymorphism,SNP),由于野生型或突变型丰度均较高(通常至少达到50%比例),因此,现有探针检测技术对SNP检测的非特异性对检测结果并不存在太多干扰。但是,针对疾病相关的基因突变,如导致恶性肿瘤的癌基因突变,突变基因的丰度通常较低。随着个体化治疗的发展,对癌基因突变检测的灵敏度提出了极高的要求,要求至少能够检测突变丰度仅有1%左右的突变基因,并且,对肿瘤患者外周血游离DNA的检测灵敏度要求更高。由于存在非特异性杂交而产生的假阳性结果,现有探针技术并不适用于低丰度突变基因的检测需要。因此,急需一种灵敏度更高的探针,能够用于检测突变丰度仅有1%左右的突变基因。
技术实现要素:
有鉴于此,为了解决现有探针检测低丰度突变基因灵敏度低,容易出现假阳性的问题,本发明首先提供在一种双泡状荧光探针,本发明的双泡状荧光探针设计简单,适用范围广,能够用于基因定量分析、单碱基变异检测、DNA或RNA甲基化分析、高度同源性的核酸靶分子的检测,具有高特异性识别能力,能够完全抑制非特异性杂交。
为实现上述发明目的,本发明提供如下技术方案:
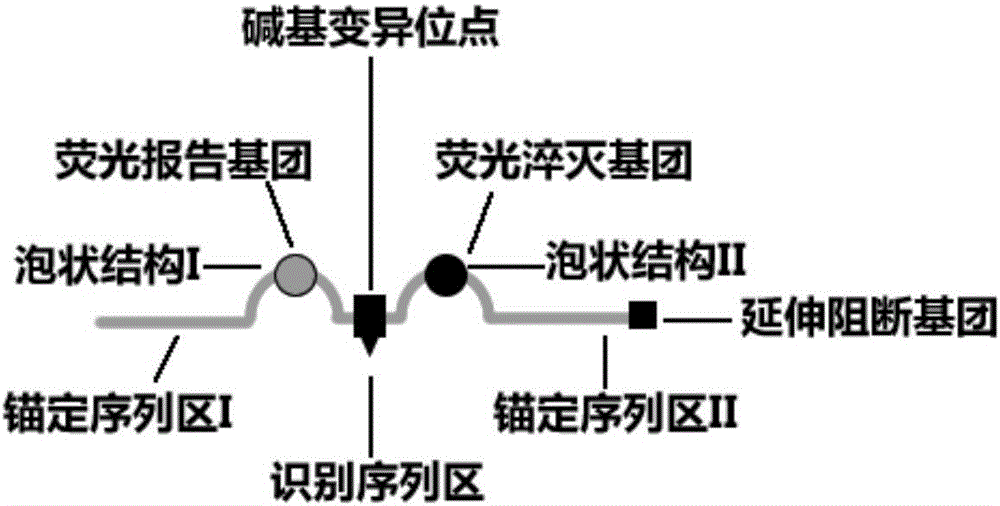
1、一种双泡状荧光探针(图1),所述荧光探针从5'-端至3'-端依次包括锚定序列区Ⅰ,泡状结构Ⅰ、识别序列区、泡状结构Ⅱ和锚定序列区Ⅱ,所述锚定序列区Ⅰ和锚定序列区Ⅱ特异结合靶序列,所述识别序列区与靶序列检测位点杂交,所述泡状结构Ⅰ和泡状结构Ⅱ分 别标记有相互作用性的荧光标记系统,且与靶序列杂交形成泡状结构。探针的3’-末端可以连接有延伸阻断基团,其功能是阻止双泡状荧光探针在核酸扩增体系中的延伸。其阻断基团是在锚定序列区的3'-末端碱基位置修饰磷酸基团、氨基基团,或者在锚定序列区的3'-末端使用反转碱基或双脱氧核苷酸(dideoxynucleotide)。
本发明中,锚定序列区Ⅰ或锚定序列区Ⅱ的核苷酸(nucleotide,nt)长度无特殊要求,优选长度为8~50nt,GC含量无具体要求,优选25~75%,Tm值远高于识别序列区,通常大于65℃,甚至可高达85℃;泡状结构Ⅰ和泡状结构Ⅱ的核苷酸长度通常为1~12nt,识别序列区的核苷酸长度通常为1~3nt;泡状结构Ⅰ、泡状结构Ⅱ和识别序列区的GC含量无特殊要求,并且通常不考虑其熔解温度(melting temperature,Tm),但因其序列极短,其Tm值通常极低,通常小于30℃。
本发明中,所述泡状结构Ⅰ或泡状结构Ⅱ含有至少一个错配碱基或核苷酸衍生物,错配碱基的错配优选方案一是GA、CT、TT错配,错配优选方案二是CC错配,错配优选方案三AA和GG错配,错配优选方案四CA和GT错配。上述四种错配优选方案中,错配识别能力大小依次是错配优选方案一至四。核苷酸衍生物可以为脱氧肌苷(deoxyinosine)、肌苷(inosine)、7-去氮-2’-脱氧肌苷(7-deaza-2’-deoxyinosine)、2-氮杂-2’-脱氧肌苷(2-aza-2’-deoxyinosine)、2’-甲氧基肌苷(2’-OMe inosine)、2’-F肌苷(2’-F inosine)、脱氧3-硝基吡咯(deoxy 3-nitropyrrole)、3-硝基吡咯(3-nitropyrrole)、2’-甲氧基3-硝基吡咯(2’-OMe3-nitropyrrole)、2’-F3-硝基吡咯(2’-F 3-nitropyrrole)、1-(2’-脱氧-β-D-呋喃核糖)-3-硝基吡咯(1-(2’-deoxybeta-D-ribofuranosyl)-3-nitropyrrole)、脱氧5-硝基吡咯(deoxy5-nitroindole)、5-硝基吲哚(5-nitroindole)、2’-甲氧基5-硝基吲哚(2’-OMe5-nitroindole)、2’-F5-硝基吲哚(2’-F 5-nitroindole)、脱氧4-硝基苯并咪唑(deoxy4-nitrobenzimidazole)、4-硝基苯并咪唑(4-nitrobenzimidazole)、脱氧4-氨基苯并咪唑(deoxy 4-aminobenzimidazole)、4-氨基苯并咪唑(4-aminobenzimidazole)、脱氧水粉蕈素(deoxy nebularine)、2’-F水粉蕈素(2’-F nebularine)、2’-F 4-硝基苯并咪唑(2’-F4-nitrobenzimidazole)、肽核酸-5-硝基吲哚(PNA-5-nitroindole)、肽核酸-水粉蕈素(PNA-nebularine)、肽核酸-肌苷(PNA-inosine)、肽核酸-4-硝基苯并咪唑(PNA-4-nitrobenzimidazole)、肽核酸-3-硝基吡咯(PNA-3-nitropyrrole)、吗啉基-5硝基吲哚(morpholino-5-nitroindole)、吗啉基-水粉蕈素(morpholino-nebularine)、吗啉基-肌苷(morpholino-inosine)、吗啉基-4-硝基苯并咪唑(morpholino-4-nitrobenzimidazole)、吗啉基-3-硝基吡咯(morpholino-3-nitropyrrole)、氨基磷酸酯-5-硝基吲哚(phosphoramidate-5-nitroindole)、氨基磷酸酯-水粉蕈素(phosphoramidate-nebularine)、氨基磷酸酯-肌苷(phosphoramidate-inosine)、氨基磷酸酯-4-硝基苯并咪唑 (phosphoramidate-4-nitrobenzimidazole)、氨基磷酸酯-3-硝基吡咯(phosphoramidate-3-nitropyrrole)、2’-0-甲氧基乙基肌苷(2’-0-methoxyethylinosine)、2’-0-甲氧基乙基水粉蕈素(2’0-methoxyethyl nebularine)、2’-0-甲氧基乙基5-硝基吲哚(2’-0-methoxyethyl 5-nitroindole)、2’-0-甲氧基乙基4-硝基-苯并咪唑(2’-0-methoxyethyl 4-nitro-benzimidazole)和2’-0-甲氧基乙基3-硝基吡咯(2’-0-methoxyethyl 3-nitropyrrole)一种或几种;由于错配碱基或核苷酸衍生物的存在,在锚定序列区Ⅰ、锚定序列区Ⅱ和识别序列区与靶分子互补的情况下,泡状结构Ⅰ和泡状结构Ⅱ无法与靶分子互补,形成“双泡”状结构,这也是本发明所述探针被命名为双泡状荧光探针的原因所在。本发明引入错配碱基的目的是当泡状结构Ⅰ或泡状结构Ⅱ所对应的靶序列不含有T碱基的G、C、A富含核酸时,泡状结构Ⅰ或泡状结构Ⅱ无法独立标记有相互作用性的荧光标记系统(即:无法同时标记荧光报告基团和淬灭基团),可在泡状结构Ⅰ或泡状结构Ⅱ使用错配碱基标记相互作用性的荧光标记系统外,可以不引入核苷酸衍生物,仅引入常用的碱基即可,大大降低了探针合成的成本。
本发明中,相互作用性的荧光标记系统由荧光报告基团或淬灭基团组成。相互作用性的荧光标记系统是在泡状结构Ⅰ标记荧光报告基团,泡状结构Ⅱ标记淬灭基团(图1),或在泡状结构Ⅰ标记淬灭基团,泡状结构Ⅱ标记荧光报告基团。
本发明所述荧光报告基团无具体要求,优选方案包括羧基荧光素(6-FAM)、六氯荧光素(HEX)、四氯荧光素(TET)、JOE、VIC、异硫氰酸荧光素(FITC)、吲哚二羧菁(Cy3、Cy5)、TAMRA和ROX,以及其它荧光分子或发光基团;荧光淬灭基团无具体要求,优选方案荧光类淬灭剂(如:TAMRA、ROX)和非荧光类淬灭剂(如:DABCYL,BHQ1,BHQ2,BHQ3)。
进一步,所述荧光报告分子及淬灭分子为荧光物质,均可利用本发明所属技术领域中公知的任何物质,包括:Cy2TM(506)、YO-PROTM-1(509)、YOYOTM-1(509)、Calcein(517)、FITC(518)、FluorXTM(519)、AlexaTM(520)、Rhodamine110(520)、Oregon GreenTM 500(522)、Oregon GreenTM488(524)、RiboGreenTM(525)、RhodamineGreenTM(527)、Rhodamine 123(529)、MagnesiumGreenTM(531)、CalciumGreenTM(533)、TO-PROTM-1(533)、TOTO1(533)、JOE(548)、BODIPY530/550(550)、Dil(565)、BODIPYTMR(568)、BODIPY558/568(568)、BODIPY564/570(570)、Cy3TM(570)、AlexaTM546(570)、TRITC(572)、Magnesium OrangeTM(575)、Phycoerythrin R&B(575)、RhodaminePhalloidin(575)、Calcium OrangeTM(576)、Pyronin Y(580)、Rhodamine B(580)、TAMRA(582)、RhodamineRedTM(590)、Cy3.5TM(596)、ROX(608)、Calcium CrimsonTM(615)、AlexaTM 594(615)、Texas Red(615)、Nile Red(628)、YO-PROTM-3(631)、YOYOTM-3(631)、R-phycocyanin(642)、C-Phycocyanin(648)、TO-PROTM-3(660)、TOTO3(660)、DiDDilC(5)(665)、Cy5TM(670)、Thiadicarbocyanine(671)、 Cy5.5(694)、HEX(556)、TET(536)、Biosearch Blue(447)、CAL Fluor Gold 540(544)、CAL Fluor Orange 560(559)、CALFluor Red 590(591)、CAL Fluor Red 610(610)、CAL Fluor Red 635(637)、FAM(520)、Fluorescein(520)、Fluorescein-C3(520)、Pulsar650(566)、Quasar 570(667),Quasar670(705)及Quasar 705(610)。括号的数字为以纳米单位表示的最大发光波长。
进一步,所述淬灭分子是利用本发明所属技术领域中公知的能够对广范围波长或特定波长的荧光进行淬灭的非荧光黑淬灭分子,包括黑洞淬灭剂(BHQ:black hole quencher;包括BHQ1、BHQ2、BHQ3)、4-[4-(二甲基氨基)苯偶氮]苯甲酸(DABCYL:4-[4-(Dimethylamino)phenylazo]benzoic acid)。
本发明所述延伸阻断剂基团无具体要求,本发明所述双泡状荧光探针的识别序列区和/或锚定序列区可进一步掺入提高其错配识别能力和/或Tm值的衍生核苷酸,优选方案包括锁核酸(locked nucleic acids,LNA)和肽核酸(peptide nucleic acids,PNA)。
本发明的另一技术方案,所述双泡状荧光探针在制备基因定量分析或单碱基突变的试剂中的应用。
基因定量分析检测原理如下(图2):锚定序列区Ⅰ和锚定序列区Ⅱ不具备序列选择性,分别识别核酸靶序列识别区的5'-侧翼区域和3'-侧翼区域,由于其较高的Tm值,该序列能够在较广的温度范围内与核酸靶分子互补杂交;识别序列区极短,Tm值较低,只有在锚定序列区Ⅰ和锚定序列区Ⅱ与核酸靶分子互补杂交后,才能在杂交热动力学的作用下与其核酸靶分子互补杂交,此时,识别序列区、锚定序列区Ⅰ和锚定序列区Ⅱ与核酸靶分子互补杂交,在此条件下,由于泡状结构Ⅰ和泡状结构Ⅱ的Tm值极低,不能与靶序列完全互补,所以在双泡状荧光探针所处的杂交温度条件下与核酸靶分子无法形成互补杂交双链,从而在识别序列区两端形成“双泡状结构”。在PCR扩增循环中,锚定序列区Ⅰ、锚定序列区Ⅱ和识别序列区与核酸靶分子形成互补杂交双链,在双泡状荧光探针5'-侧翼区域的引物延伸过程中,当引物的延伸产物延伸至泡状结构Ⅰ的5'-端时,在DNA聚合酶的5'→3'核酸外切酶的作用下,识别序列区的核苷酸按照5'→3'方向被依次水解成单个核苷酸,标记于泡状结构Ⅰ的荧光报告基团(或:荧光淬灭基团)与和泡状结构Ⅱ的淬灭基团(或:荧光报告基团)之间的荧光能量共转移作用(FRET)被消除,荧光报告基团释放荧光。根据释放的荧光强度可以分析目标基因的表达量。
单碱基突变检测原理如下(图3):当识别序列区对应的核酸靶分子互补时,原理与基因定量分析相同;当识别序列区对应的核酸靶分子杂交区域存在单碱基变异所导致的单碱基错配时,单碱基错配会导致识别序列区无法与核酸靶分子形成互补杂交双链,在此条件下,只有锚定序列区Ⅰ和锚定序列区Ⅱ与靶核酸分子形成互补杂交双链,泡状结构Ⅰ、泡状结构Ⅱ和识别序列区处于游离单链状态,形成一个“大泡状”。因此,在PCR扩增循环中,由于核酸靶分子单碱基变异所导致的识别序列区与核酸靶分子的单碱基错配,并且该单碱基错配导致识别序列区与核酸靶分子无法形成互补杂交双链时,识别序列区与泡状结构Ⅰ、泡状结构Ⅱ均处于游离单链状态,仅锚定序列区与靶核酸分子形成互补杂交双链,在此条件下,在双 泡状荧光探针5'-侧翼区域的引物会直接顺利延伸至锚定序列区Ⅰ的5'-末端,随后,DNA聚合酶的5'→3'核酸外切酶的作用下,在泡状结构Ⅰ与锚定序列区Ⅰ的接合碱基处,识别序列区与泡状结构Ⅰ和泡状结构Ⅱ被消解成一个完整的片段,随后,锚定序列区Ⅱ的核苷酸按照5'→3'方向被依次水解成单个核苷酸,在此条件下,由于识别序列区、泡状结构Ⅰ和泡状结构Ⅱ的完整性,荧光报告基团和淬灭基团之间仍然有FRET作用,因此,探针不发生荧光。由上可见,只有当识别序列区与核酸靶分子形成互补杂交双链后,识别序列区才会在DNA聚合酶的5'→3'核酸外切酶作用水解,并释放双泡状荧光探针所标记的荧光信号。但是,当识别序列区与核酸靶分子无法形成互补杂交双链时,识别序列区、泡状结构Ⅰ和泡状结构Ⅱ会保持完整形,双泡状荧光探针不释放荧光。由于识别序列区的Tm值极低,当其与核酸靶分子仅仅存在任意一种单碱基错配时,识别序列区均不能与核酸靶分子形成互补杂交双链,从而使双泡状荧光探针无法释放荧光信号。可见,双泡状荧光探针的特殊结构,以及识别序列区识别单碱基变异的能力与释放荧光信号的方式使双泡状荧光探针能够有效识别单碱基变异。
在本发明所述双泡状荧光探针检测单碱基变异或基因定量分析的应用中,可采用实时荧光定量PCR方法实时检测核酸靶分子。检测单碱基突变时,当靶向不同单碱基变异核酸靶分子的双泡状荧光探针分别标记了不同种类的荧光报告基团时,就可在单个反应管中通过荧光信号的种类检测不同单碱基变异的核酸靶分子,实现不同核酸靶分子的定性检测。同时,由于荧光信号的强度与核酸靶分子的初始浓度相关,因此,可根据荧光信号的强度,或者扩增体系的循环阈值(cycle threshold,CT;是指每个反应管中的荧光信号达到设定的阈值时所经历的循环数)判断不同核酸靶分子的初始浓度,实现不同核酸靶分子的定量检测。
本发明的另一技术方案,所述双泡状荧光探针在制备检测高度同源性核酸靶分子的试剂中的应用。例如,在各种感染性病原体种属或亚型,以及其耐药基因检测中的应用。通过识别序列区针对不同种属或亚型,以及其耐药基因的特异性核酸序列,检测病原体种属或亚型、以及耐药基因,其检测原理与检测单碱基变异相同。在此条件下,只有当识别序列区与核酸靶分子的特异性核酸序列完全互补时,双泡状荧光探针才释放荧光信号。当不同种属或亚型或不同耐药基因的双泡状荧光探针分别标记上不同种类荧光时,就可在同一个反应管中通过荧光信号的种类和强度(或:CT值)实现上述核酸靶分子的定性和定量检测。
上述所指的单碱基变异为单碱基缺失、突变、插入或SNP,所指的高度同源性序列是指待检测区域核酸靶分子特异性序列相差一个或一个以上碱基的不同核酸靶分子,如同一种属的不同亚型的感染性病原体核酸靶分子。
本发明的另一技术方案,所述双泡状荧光探针在制备DNA或RNA甲基化分析试剂中的应用。
本发明的另一技术方案,所述双泡状荧光探针在制备数字PCR检测探针中的应用,采用微流控或微滴化方法,将反应混合物分散至包括微滴或微反应孔在内的若干个微反应器中, 每个微反应器中的每种靶分子数少于或等于1个。
本发明的另一技术方案,含有所述双泡状荧光探针的试剂盒。
本发明优选的技术方案,所述试剂盒还包括扩增所述双泡状荧光探针靶序列结合区的引物对。还可以包括实时荧光定量PCR的常用试剂,如具有5'→3'核酸外切酶活性的耐热DNA聚合酶、dNTP、离子成分和缓冲体系。检测时通过将双泡状荧光探针、引物、PCR扩增需反应成分(包括但并不限于:具有5'→3'核酸外切酶活性的耐热DNA聚合酶、dNTP、适宜离子成分与缓冲体系)、核酸靶分子置于同一个反应管内;采用实时荧光定量PCR,经高温变性、适温退火与延伸等多个循环扩增核酸靶分子,并在每一个循环或循环终点检测荧光信号种类及其强度(或:CT值);根据荧光信号的种类、强度(或:CT值)实现核酸靶分子的定性和定量检测。
本发明的另一技术方案,所述的试剂盒在实时荧光定量PCR基因定量分析、检测单碱基变异或检测高度同源性核酸靶分子中的应用。
本发明的有益效果在于:本发明公开双泡状荧光探针设计简单,通过在泡状结构Ⅰ与锚定序列区Ⅰ引入错配碱基或核苷酸衍生物能提高探针的灵敏度,并提高识别单碱基变异的能力,且检测灵敏度高,可达到1%或更高灵敏度,不仅可避免常见单碱基变异(如:SNP、基因突变)检测中的假阳性,而且适用于低丰度基因突变检测(如:肿瘤组织或外周血中的癌基因突变),也可以用于同源性较高的感染性病原体种属或亚型及其耐药基因鉴定,还可以用于DNA或RNA甲基化分析。因此,本发明扩宽了探针的应用范围,对于疾病诊断具有重要意义。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图:
图1为双泡状荧光探针的典型结构示例图。
图2为双泡状荧光探针用于基因定量分析的原理示意图。
图3为双泡状荧光探针单管检测单碱基变异原理示意图。
图4为MTHFR 677C>T检测体系的特异性。
图5为MTHFR 677C>T检测体系的线性范围。
图6为MTHFR 677C>T检测体系的灵敏度。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。实施例中未注明具体条件的实验方法,通常按照常规条件,例如分子克隆实验指南(第三版,J.萨姆布鲁克等著)中所述的条件,或按照制造厂商所建议的条件。
实施例1MTHFR 677C>T基因型的检测
1、双泡状荧光探针引物的设计与合成
根据MTHFR(dbSNP ID:rs1801133;677C>T)基因型核酸序列特征,设计扩增该SNP 位点所在片段的上游引物SEQ ID No.1和下游引物SEQ ID No.2,同时,设计野生型和突变型所对应常规TaqMan探针(野生型:SEQ IDNo.3;突变型:SEQ IDNo.4)和双泡状荧光探针(野生型:SEQ IDNo.5;突变型:SEQ IDNo.6),二者的野生型和突变型探针均分别是FAM和VIC荧光标记探针,序列中加粗碱基代表野生型或突变型对应的单碱基变异序列。双泡状荧光探针的3'-末端修饰磷酸基团(PO4),下划线碱基是与靶序列错配的碱基,荧光基因及其所对应的淬灭基团均分别标记于上述错配碱基。所有引物和探针均由上海生工公司合成。
上游引物:5’-atccctcgccttgaacagg-3’(SEQ ID No.1);
下游引物:5’-acaaagcggaagaatgtgtcag-3’(SEQ ID No.2);
野生型TaqMan探针:5’-(FAM)gtgtctgcgggagccgatttcatcatc(BHQ1)-3’(SEQ ID No.3);
突变型TaqMan探针:5’-(VIC)gtgtctgcgggagtcgatttcatcatc(BHQ1)-3’(SEQ ID No.4);
野生型双泡状荧光探针:5’-gtgtctgcggt(FAM)agccgt(BHQ1)tttcatcatc(PO4)-3’(SEQ ID No.5);
突变型双泡状荧光探针:5’-gtgtctgcggt(VIC)agccgt(BHQ1)tttcatcatc(PO4)(SEQ ID No.6);
2、实时荧光定量PCR反应体系的构建
PCR反应体系共计20μl,该体系中包括以下组分:1×Premix Ex Taq master mix(Perfect Real Time;TaKaRa公司);0.6μM上游和下游引物(SEQ ID No.1和SEQ ID No.2);0.2μM野生型和突变型常规TaqMan荧光探针(野生型:SEQ ID No.3;突变型:SEQ ID No.4),或者,0.2μM野生型和突变型双泡状荧光探针(野生型:SEQ ID No.5;突变型:SEQ ID No.6);系列终浓度(1×101to 1×105copies)的野生型质控(wild-type quality control,WT-QC)质粒和突变型质控质粒,或者,20~100ng人类全血基因组DNA。实时荧光PCR反应条件为:95℃预变性30秒;95℃变性30秒,55℃、57℃、59℃条件下复性与延伸60秒(并同时采集荧光)。所用设备为ExicyclerTM96Real-time Quantitative Thermal Block(Bioneer,Daejeon,Korea),荧光信号采集与分析软件为ExicyclerTM96Software(Bioneer)。
3、结果与分析
3.1特异性:对于常规TaqMan探针(野生型:SEQ ID No.3;突变型:SEQ ID No.4),当反应体系中只存在野生型模板或突变型模板时,野生型(SEQ ID No.3)和突变型探针(SEQ ID No.4)均能释放荧光信号,提示突变型探针能够与野生型模板非特异性杂交,而野生型探针(SEQ ID No.3)则能够与突变型模板非特异性杂交,说明常规的TaqMan探针识别基因型的特异性差。但是,当使用本发明所述的双泡状荧光探针时(野生型:SEQ ID No.5;突变型:SEQ ID No.6),当反应体系中只存在野生型模板(图4中A)或突变型模板(图4中B)时,均只有基因型对应的探针释放荧光信号,即:野生型模板体系中只有野生型探针(SEQ ID No.5)释放荧光信号(图4中A),突变型模板体系中只有突变型探针(SEQ ID No.6)释放荧光信号(图4中B)。而对于同时具有野生型和突变型模板的杂合性样本,野生型和突变型双泡状荧光探针同时释放荧光信号(图4中C)。
3.2线性范围:系列终浓度(1×101to 1×105copies)的野生型质控质粒和突变型质控质粒(图5)均只产生其基因型对应的双泡状荧光探针的荧光信号,无任何非特异性扩增信号。在此线性范围内,野生型和突变型基因型的扩增效率分别是96.59%(R2=0.999)和99.11%(R2=0.998),杂合型模板中的野生型和突变型基因型的扩增效率分别是95.07%(R2=0.998)和98.27%(R2=0.999)。该结果进一步说明野生型和突变型在本发明方法中具有等效扩增。
3.3灵敏度:当系列浓度(1×106copies~1×105copies)的野生型质粒与系列浓度(1×101copies~1×105copies)的突变型质粒共同存在时,本发明所述方法对突变型的检测灵敏度达到1%(图6)。
3.4临床验证:采用3.2所述反应体系共计检测了324例人类外周血全血基因组DNA的基因型,其中,野生型占62.3%,杂合型占32.5%,突变型占5.2%,检测结果与核酸测序完全一致,并且,在检测过程中平行检测的质控质粒的基因型结果完全正确,说明检测结果准确可靠。
实施例2检测MTHFR 677C>T基因型的不同特性双泡状荧光探针
1.双泡状荧光探针的设计与合成
根据MTHFR(dbSNP ID:rs1801133;677C>T)基因型核酸序列特征,设计扩增该SNP位点所在片段的上游引物SEQ ID No.1和下游引物SEQ ID No.2,同时,设计野生型和突变型所对应双泡状荧光探针(野生型:SEQ ID No.7到11;突变型:SEQ ID No.12到16),野生型和突变型探针均分别是FAM和VIC荧光标记探针,序列中加粗碱基代表野生型或突变型对应的单碱基变异序列。双泡状荧光探针的3'-末端修饰氨基(NH4),下划线碱基是与靶序列错配的碱基,荧光基因及其所对应的淬灭基团均分别标记于上述错配碱基。所有引物和探针均由上海生工公司合成。
上游引物:5’-atccctcgccttgaacagg-3’(SEQ ID No.1);
下游引物:5’-acaaagcggaagaatgtgtcag-3’(SEQ ID No.2);
野生型双泡状荧光探针1:5’-gtgtctgcgggat(FAM)ct(BHQ1)gatttcatcatc(NH4)-3’(SEQ ID No.7);
野生型双泡状荧光探针2:5’-gtgtctgcgggai(FAM)ct(BHQ1)gatttcatcatc(NH4)-3’(SEQ ID No.8);
野生型双泡状荧光探针3:5’-gtgtctgcgggti(FAM)ccit(BHQ1)tttcatcatc(NH4)-3’(SEQ ID No.9);
野生型双泡状荧光探针4:5’-gtgtctgcgggt(FAM)gcct(BHQ1)atttcatcatc(NH4)-3’(SEQ ID No.10)
野生型双泡状荧光探针5:5’-gtgtctgcii(FAM)iagccgii(BHQ1)ttcatcatc(NH4)-3’(SEQ ID No.11);
突变型双泡状荧光探针1:5’-gtgtctgcgggat(FAM)tt(BHQ1)gatttcatcatc(NH4)-3’(SEQ ID No.12);
突变型双泡状荧光探针2:5’-gtgtctgcgggai(FAM)tt(BHQ1)gatttcatcatc(NH4)-3’(SEQ ID No.13);
突变型双泡状荧光探针3:5’-gtgtctgcgggti(FAM)tcit(BHQ1)tttcatcatc(NH4)-3’(SEQ ID No.14);
突变型双泡状荧光探针4:5’-gtgtctgcgggt(FAM)gtct(BHQ1)atttcatcatc(NH4)-3’(SEQ ID No.15);
突变型双泡状荧光探针5:5’-gtgtctgcii(FAM)iagtcgii(BHQ1)ttcatcatc(NH4)-3’(SEQ ID No.16)。
2.实时荧光定量PCR反应体系的构建
PCR反应体系共计20μl,该体系中包括以下组分:1×Premix Ex Taq master mix(Perfect Real Time;TaKaRa公司);0.6μM上游和下游引物(SEQ ID No.1和2);0.2μM野生型和突变型双泡状荧光探针(野生型:SEQ ID No.7到11中任意一种;突变型:SEQ ID No.12到16中任意一种);1×104拷贝的野生型质控质粒和突变型质控质粒,或者,20~100ng人类全血基因组DNA。实时荧光PCR反应条件为:95℃预变性30秒;95℃变性30秒,55℃、57℃、59℃条件下复性与延伸60秒(并同时采集荧光)。所用设备为ExicyclerTM96Real-time Quantitative Thermal Block(Bioneer,Daejeon,Korea),荧光信号采集与分析软件为ExicyclerTM96Software(Bioneer)。
3.结果与分析
3.1特异性:使用本发明所述双泡状荧光探针时,当反应体系中只存在野生型模板或突变型模板时,均只有基因型对应的探针释放荧光信号,即:野生型模板体系中只有野生型探针释放荧光信号,突变型模板体系中只有突变型探针释放荧光信号。同时,对于同时具有野生型和突变型模板的杂合性样本,野生型和突变型双泡状荧光探针同时释放荧光信号。
3.2临床验证:共计检测了324例人类外周血全血基因组DNA的基因型,其中,野生型占62.3%,杂合型占32.5%,突变型占5.2%,检测结果与核酸测序完全一致,并且,在检测过程中平行检测的质控质粒的基因型结果完全正确,说明检测结果准确可靠。
实施例3、双泡状荧光探针技术鉴别具有高度同源性的动物源性基因
临床上常规使用的肝素抗凝剂通常来源于猪小肠提取的肝素粗制品。由于肝素是临床常用药,欧美国家等规定,上述肝素粗制品不得来源于包括牛羊在内的反刍动物的小肠,主要原因在于防止反刍动物来源的肝素粗制品所导致的疯牛病等动物疫源性疾病。因此,通常需要对肝素粗制品的来源做鉴定,主要是鉴定肝素粗制品中是否含有反刍动物的基因。由于反刍动物与猪基因具有高度同源性,同时,不同反刍动物的基因也具有高度同源性,常规的方法往往难以高特异性地鉴别反刍动物的种属来源。本实施例采用本发明所述双泡状荧光探针检测奶牛、山羊和绵羊等三种反刍动物基因。
1、靶向反刍动物种属特异性线粒体序列的同侧竞争性探针及其扩增引物的设计
根据反刍动物之间及其与猪线粒体核酸序列的比对结果设计双泡状荧光探针,种属特异性探针的种属特异性序列位于识别序列区,包括靶向奶牛种属基因的SEQ ID No.17、靶向绵羊种属基因的SEQ ID No.18、靶向山羊种属基因的SEQ ID No.19,三者分别标记上FAM、VIC和CY5荧光报告基团。根据上述双泡状荧光探针所在核酸序列位置,设计扩增引物SEQ ID No.20和SEQ ID No.21。
靶向反刍动物种属特异性线粒体序列的同侧竞争性探针及其扩增引物
靶向奶牛种属基因双泡状荧光探针:
5’-aaactgtaaagit(FAM)ccatacct(BHQ1)iatagggttaaattctaac-3’(SEQ ID No.17);
靶向绵羊种属基因双泡状荧光探针:
5’-aaactgtaaagit(VIC)tcatactt(BHQ1)iatagagttaaattttaatt-3’(SEQ ID No.18);
靶向山羊种属基因双泡状荧光探针:
5’-aaactgtaaagit(CY5)ctacatct(BHQ2)iatagagttaaattctaat-3’(SEQ ID No.19);
上游引物:5’-taacccaagctaacaggagt-3’(SEQ ID No.20);
下游引物:5’-tgtagggtcactttcgtcat-3’(SEQ ID No.21);
2、实时荧光定量PCR反应体系的构建
PCR反应体系共计20μl,该体系中包括以下组分:1×Premix Ex Taq master mix(Perfect Real Time;TaKaRa公司),0.9μM正向引物和0.9μM反向引物,0.25μM奶牛种属基因的SEQ ID No.17,0.25μM靶向绵羊种属基因的SEQ ID No.18,0.25μM靶向山羊种属基因的SEQ ID No.19,50ng反刍动物种属特异性基因组DNA(包括:奶牛、绵羊和山羊)。
3、结果分析
当反应体系中分别只存在奶牛、绵羊和山羊基因组DNA时,均分别只能检测到其双泡状荧光探针释放的荧光信号,当同时存在上述三种种属特异性基因组DNA时,则能够同时检测到三种荧光信号。
实施例四、双泡状荧光探针技术鉴别感染性病原体种属
本实施例采用本发明所述双泡状荧光探针检测嗜肺军团菌的达拉斯株和诺克斯维尔株两种不同亚型。
1、靶向不同亚型的同侧竞争性探针及其扩增引物的设计
根据嗜肺军团菌的达拉斯株和诺克斯维尔株的亚型特异性序列,设计检测不同亚型的双泡状双泡状荧光探针,种属特异性探针的种属特异性序列位于识别序列区,包括靶向达拉斯株的SEQ ID No.22、靶向诺克斯维尔株的SEQ ID No.23,上述探针对应的扩增引物是SEQ ID No.24和SEQ ID No.25。
靶向达拉斯株双泡状荧光探针:
5’-ctaaaagattagcctgaatatii(FAM)itggatgaaagctii(BHQ1)igaccttcgggcctcgcg-3’(SEQ ID No.22);
靶向诺克斯维尔株双泡状荧光探针:
5’-ctaaaagattagcctgii(VIC)igtctgaggacgaii(BHQ1)ictggggaccttcgggcctcgcg-3’(SEQ ID No.23)
检测嗜肺军团菌上游引物:5’-gggggacaacttggggaaact-3’(SEQ ID No.24)
检测嗜肺军团菌下游引物:5’-ccgatcgtcgccttggtaggc-3’(SEQ ID No.25)
2、实时荧光定量PCR反应体系的构建
PCR反应体系共计20μl,该体系中包括以下组分:1×Premix Ex Taq master mix(Perfect Real Time;TaKaRa公司),0.9μM正向引物SEQ ID No.24和0.9μM反向引物SEQ ID No.25,0.25μM靶向达拉斯株的SEQ ID No.22,靶向诺克斯维尔株的SEQ ID No.23,10ng嗜肺军团菌亚型特异性基因组DNA(包括:达拉斯株和诺克斯维尔株)。
3、结果分析
当反应体系中分别只存在达拉斯株和诺克斯维尔株基因组DNA时,均分别只能检测到其对应的双泡状荧光探针释放的荧光信号,当同时存在上述两种亚型特异性基因组DNA时,则能够同时检测到两种荧光信号。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!