一种定量检测血液中HBVDNA和RNA的双通道实时荧光定量PCR检测方法与流程
本发明一般涉及乙型病毒性肝炎的诊断和治疗,以及感染病学、分子生物学、细胞生物学等领域。更具体地,本发明涉及一种血液中乙型肝炎病毒(HepatitisBvirus,HBV)DNA和RNA的双通道实时荧光定量PCR检测方法。
背景技术:
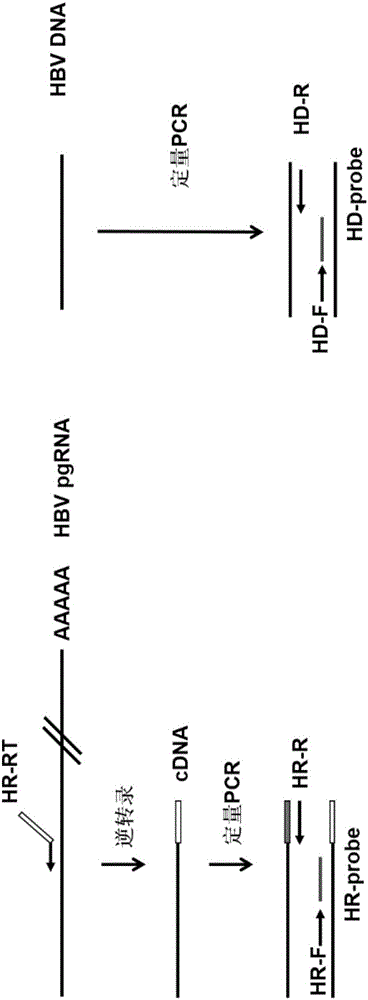
:乙型肝炎病毒(HepatitisBvirus,HBV)感染呈世界流行,但不同地区HBV感染的流行强度差异很大。我国属于中高流行区。在2006年全国乙型肝炎血清流行病学调查中,我国1~59岁一般人群HBsAg携带率为7.18%。据此推算,我国慢性HBV感染者约为9300万人,其中慢性乙型肝炎(慢性乙肝)患者约2000万例。在我国,慢性HBV感染与肝硬化、肝癌等终末期肝病的发生密切相关。目前治疗慢乙肝的药物主要为干扰素和核苷(酸)类似物两类。两类药物均可高效抑制HBV复制,但由于肝细胞内共价闭合环状DNA(CovalentlyclosedcircularDNA,cccDNA)的持续存在,使得目前慢乙肝治疗的临床治愈率很低(<5%),停药后慢乙肝复发率较高,因此慢乙肝患者需要长期甚至终身服药。长期服药会给患者甚至社会带来极大的负担,并且在治疗过程中有可能会导致HBV耐药株的出现。而且,目前临床上检测的HBV核酸只是HBVDNA。血清中HBVDNA水平能反映HBV的复制水平,可作为一个抗病毒疗效的监测指标,且有较好的预后监测价值(Martinot-PeignouxM,MarcellinP.VirologicalandserologicaltoolstooptimizethemanagementofpatientswithchronichepatitisB[J].LiverInternational,2016,36Suppl1(SupplementS1):78–84.)。在《慢性乙型肝炎防治指南(2015更新版)》中提到,HBVDNA定量检测主要用于判断慢性HBV感染的病毒复制水平,可用于抗病毒治疗适应症的选择及疗效的判断,并建议采用灵敏度和精确度高的实时荧光定量聚合酶链式反应。目前在临床上,治疗终点分为理想的终点,满意的终点和基本的终点:理想的终点即为慢性乙肝患者停药后获得持久的HBsAg消失;满意的终点根据慢性乙肝患者的HBeAg状态有所区别,最终状态是HBeAg阴性,有持续的病毒学应答和ALT复常;基本的终点是抗病毒期间长期维持病毒学应答。目前HBsAg转阴做为临床治愈的指标,当HBsAg转阴时可安全停药,但HBsAg转阴率过低,使其临床应用有着很大的限制。因此,基于此,目前迫切需要一种更加灵敏、精确、更加有效的血液学指标,用于监测慢乙肝治疗的疗效和监测安全停药(中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015年版)[J].中华肝脏病杂志(电子版),2015,7(3):1-18.)。根据我们的前期研究结果并结合相关报道,已经证实血清中存在HBVRNA,并且其水平动态变化与慢性乙肝治疗的疗效和预后密切相关。我们在前期研究中明确了血清中HBVRNA的存在形式和产生机制,证实了血清中的HBVRNA为3.5kb长的HBVPregenomeRNA(pgRNA),存在于类似丹氏颗粒的病毒颗粒的核衣壳内,其来源为未经逆转录或不完全逆转录的情况下,获得病毒外包膜并分泌至细胞外(JieW,TaoS,HuangX,etal.SerumhepatitisBvirusRNAisencapsidatedpregenomeRNAthatmaybeassociatedwithpersistenceofviralinfectionandrebound[J].JournalofHepatology,2016.)。由此可见,血清中的HBV病毒核酸既有存在于丹氏颗粒内的HBVDNA,也有存在于RNA病毒样颗粒内的pgRNA。由于核苷(酸)类似物作用于乙肝病毒的逆转录和DNA合成过程,能够抑制HBVDNA的产生,但对pgRNA病毒样颗粒的产生则无直接抑制作用。因此HBVDNA和HBVRNA的动态变化能够和好反映抗病毒治疗的疗效。乙肝病毒的基因组全长为3.2kb,而pgRNA是为病毒逆转录合成子代病毒DNA的模板,其大小则为3.5kb。其是以被感染肝细胞核内的HBVcccDNA为模板,部分重复转录形成的,而整合的HBV基因组则不能产生。因此,定量检测血清HBVpgRNA的水平可更好地监测肝细胞内HBVcccDNA的水平和转录活性状态,不失为一种良好的检测慢性乙肝治疗疗效和安全停药的预测指标。另外本室之前的研究表明HBVRNA的水平和停药后患者的复发有关,因此,HBVRNA可做为一个潜在的判断核苷(酸)类似物治疗过程中安全停药的监测指标(JieW,TaoS,HuangX,etal.SerumhepatitisBvirusRNAisencapsidatedpregenomeRNAthatmaybeassociatedwithpersistenceofviralinfectionandrebound[J].JournalofHepatology,2016.)。因此,本发明旨在建立一种高度灵敏和特异的可同时检测血液中HBVDNA和HBVRNA的双通道荧光定量PCR方法,用于临床上评价慢性乙肝抗病毒治疗的疗效并指导其安全停药。开发灵敏、精确、更加有效的定量检测血液中RNA和DNA双通道的诊断试剂或试剂盒对于临床上慢乙肝的有效治疗和安全停药具有重要的指导意义。技术实现要素:一方面,本发明提供了一种用于同时检测体液HBVDNA和RNA双通道实时荧光PCR的寡核苷酸组,其特征在于,所述寡核苷酸组包括用于体液HBVDNA和RNA双通道实时荧光PCR检测的特异性地扩增的专用引物以及反向锚定引物。在一些实施例中,如前所述寡核苷酸组还包括与所述专用引物配合使用的特异性地扩增的专用探针。在一些具体实施例中,特异性地扩增体液HBVDNA的专用引物选自SEQIDNOs﹕1、2、3和4的上游引物与选自SEQIDNOs﹕5和6的下游引物组成的一对寡核苷酸;特异性地扩增体液HBVRNA的专用引物选自SEQIDNO﹕8的上游引物与选自SEQIDNOs﹕9、10和16的下游引物组成的一对寡核苷酸;反向锚定引物选自SEQIDNOs﹕11和12。在一些具体实施例中,特异性地扩增体液HBVDNA的专用引物选自SEQIDNO﹕1的上游引物与选自SEQIDNO﹕6的下游引物组成的一对寡核苷酸;特异性地扩增体液HBVRNA的专用引物选自SEQIDNO﹕8的上游引物与选自SEQIDNOs﹕9的下游引物组成的一对寡核苷酸;反向锚定引物选自SEQIDNO﹕11。在本发明的一些实施例中,扩增RNA正向引物SEQIDNO﹕8为AGACCACCAAATGCCCCT;反向引物SEQIDNO﹕16为(N)16-30。(N)16-30是指作为随机锚定序列的核苷酸序列,N可为A、T、C或G,且下角标处16-30表示碱基数目。反向锚定引物SEQIDNO﹕17为(N)16-30-AGGCGAGGGAGTTCTTCTTCTA。SEQIDNO﹕16和SEQIDNO﹕17中的(N)16-30表示相同的随机锚定序列。本领域技术人员知晓,虽然(N)16-30为随机序列,但为了保证扩增的效率,其应避免设计成为与HR-F或Probe-HR形成引物二聚体。此外,为了增加扩增的效率,在引物两端添加随机碱基后形成的引物序列也涵盖在本发明中。在一些具体实施例中,特异性地扩增体液HBVDNA的专用探针选自SEQIDNO﹕7所示的核苷酸序列;特异性地扩增体液HBVRNA的专用探针选自SEQIDNO﹕13所示的核苷酸序列。在一些具体实施例中,所述探针为TaqMan探针、MGB探针、杂交探针中的一种。在一些具体实施例中,连接所述探针5’端的是一种荧光报告基团,所述荧光报告基团选自FAM、VIC、TET、JOE、ROX、CY3、CY5、HEX中的任意一种,且扩增DNA的专用探针和扩增RNA的专用探针具有不同的荧光报告基团;并且,连接所述探针3’端的是一种荧光猝灭基团,所述荧光猝灭基团选自BHQ1、BHQ2、BHQ3、TAMRA、DABCYL、NFQ、Eclipse中的任意一种。另一方面,本发明还提供了一种同时检测体液HBVDNA和RNA双通道实时荧光定量PCR检测体系,其特征在于,所述体系包括前述任一项中所述的寡核苷酸组。本发明还提供了如前任一项所述的寡核苷酸组或如前所述的检测体系在制备HBV诊断试剂或试剂盒中的应用。本发明还提供了如前任一项所述的寡核苷酸组或如前所述的检测体系在制备用于慢性乙肝抗病毒治疗的疗效评价和/或安全停药、治疗终点监测的HBV诊断试剂或试剂盒中的应用。血清中HBVDNA水平能反映HBV的复制水平,可作为一个抗病毒疗效的监测指标,且有较好的预后监测价值。因此,本发明中所述的寡核苷酸组或所述检测体系在制备HBV诊断试剂或试剂盒的应用中,用于慢性乙肝抗病毒治疗的疗效评价和/或安全停药、治疗终点监测的HBV诊断试剂或试剂盒也属于本发明的保护范围。另一方面,本发明还提供了一种同时检测体液HBVDNA和RNA双通道实时荧光定量PCR试剂盒,其特征在于,所述试剂盒包括如前任一项中所述的寡核苷酸组。本发明的一些实施例中,所述试剂盒还包括DNA标准品、RNA标准品。在本发明的一些具体实施例中,所述DNA标准品为包含SEQIDNO:14所示的核苷酸序列的pESAY-Blunt质粒;所述DNA标准品的扩增引物是由SEQIDNO﹕1所示的上游引物与SEQIDNO﹕6所示的下游引物组成的一对寡核苷酸;所述RNA标准品的扩增引物是由SEQIDNO﹕8所示的上游引物与SEQIDNO﹕9所示的下游引物组成的一对寡核苷酸。再一方面,本发明还提供了一种非诊断目的的同时检测体液中HBVDNA和RNA双通道实时荧光定量PCR检测方法,其特征在于,所述双通道实时荧光PCR检测方法使用如前任一项所述的寡核苷酸组或如前所述的检测体系或如前任一项所述的试剂盒。在一些具体实施例中,所述双通道实时荧光PCR检测方法的退火温度为58-60℃。在一些具体实施例中,所述双通道实时荧光PCR的反应条件为:50℃,5分钟;95℃,10分钟;94℃,15秒;50℃,45秒,共45个循环。在一些具体实施例中,所述检测方法的步骤包括:步骤1.提取体液中HBV核酸(包括HBVDNA和RNA),其中用反向锚定引物将HBVRNA逆转录为cDNA;以及步骤2.以HBVDNA和逆转录产物为模板,用HBVDNA和RNA双通道实时荧光PCR检测的特异性地扩增的专用引物、专用探针扩增DNA和RNA;或者以HBVDNA和逆转录产物为模板,用HBVDNA和RNA双通道实时荧光PCR检测的特异性地扩增的专用引物扩增,并掺入荧光染料,以SYBRGreen法定量检测体液中的HBVDNA和RNA。在本发明中,所述的体液包括血液、尿液和唾液。本发明的有益效果本发明首次在一个体系中通过双通道同时检测血液HBVDNA和RNA,在保持了良好的灵敏度和特异性重复性的基础上,使得检测时间大幅度减少,实际操作简便、快捷。除此之外,本发明还在逆转录引物上加上了一段人工设计的锚定序列用来排除在检测过程中HBVDNA带来的可能干扰,确保了血液HBVRNA检测的特异性。本发明的特异性引物和探针可检测A-H所有基因型HBV,包括我国主要存在A-D型HBV。本发明的引物、探针和锚定序列是在最初设计的多条序列的基础上,通过多轮筛选和优化后确定的特异性和灵敏度最优的序列。附图说明图1示出MegAlign软件分析针对不同基因型HBVDNA检测的上下游引物和探针序列的保守性。图2示出利用本发明实施的血清HBVDNA和RNA双通道实时荧光定量PCR检测方法对血液HBVDNA和RNA进行检测的流程图。图3示出利用SYBRGreen方法评价8对HBVDNA定量检测引物(HD-F+HD-R、HD-F1+HD-R、HD-F2+HD-R、HD-F3+HD-R、HD-F+HD-R1、HD-F1+HD-R1、HD-F2+HD-R1、HD-F3+HD-R1)的扩增效率。图4示出HBVRNA和HBVDNA引物的扩增效率。(A)和(B)是将HBVRNA样品分别进行10,100,1000,10000倍梯度稀释后的检测结果,最终算得扩增效率为:0.88665;(C)和(D)是将HBVDNA样品分别进行10,100,1000,10000倍梯度稀释后的检测结果,最终算得扩增效率为:0.88665。图5示出双通道体系中HBVDNA检测探针的含量。双通道体系中,在分别加入1.0μL浓度为10μM的HBVDNA和RNA检测引物的情况下,分别加入0.4μL、0.6μL、0.8μL和1.0μL浓度为10μM的用于检测HBVDNA的探针以及之前已确定的0.6μL浓度为10μM的用于检测HBVRNA的探针时的扩增曲线。图6示出双通道体系中HBVDNA检测引物的含量。双通道体系中,在分别加入0.6μL浓度为10μM的HBVDNA和RNA检测探针的情况下,分别加入0.5μL、1.0μL、1.5μL浓度为10μM的HBVDNA检测引物(HD-F和HD-R1)以及之前已经确定的1.0μL浓度为10μM的HBVRNA检测引物时的扩增曲线。。图7示出双通道定量扩增反应的退火温度。(A)分别利用56、58、60、62℃的退火温度进行定量PCR反应的扩增曲线;(B)分别利用54、56、58、60℃的温度进行定量PCR反应得到的Ct值。图8示出标准品测序结果。(A)DNA标准品的测序结果;(B)RNA标准品的测序结果。图9示出双通道荧光定量PCR法检测HBVDNA标准品的灵敏度。(A)不同终浓度HBVDNA质粒经过检测后的Ct值;(B)利用浓度和Ct值构建的标准曲线。(C)荧光定量PCR最终得到的扩增曲线。图10示出双通道荧光定量PCR法检测HBVRNA标准品的灵敏度。(A)不同终浓度HBVRNA质粒经过检测后的Ct值;(B)利用浓度和Ct值构建的标准曲线。(C)荧光定量PCR最终得到的扩增曲线。图11示出单通道荧光定量PCR法检测HBVDNA标准品的灵敏度。(A)不同终浓度HBVDNA质粒经过检测后的Ct值;(B)利用浓度和Ct值构建的标准曲线。(C)荧光定量PCR最终得到的扩增曲线。图12示出单通道荧光定量PCR法检测HBVRNA标准品的灵敏度。(A)不同终浓度HBVRNA质粒经过检测后的Ct值;(B)利用浓度和Ct值构建的标准曲线。(C)荧光定量PCR最终得到的扩增曲线。图13示出利用双通道检测未经DnaseI处理的逆转录样本。(A)同时显示DNA和RNA的扩增曲线。(B)经VIC通道检测的HBVDNA扩增曲线。(C)经FAM通道检测的HBVRNA扩增曲线(*表示HBVDNA的扩增曲线▲表示HBVRNA的扩增曲线)。图14示出利用双通道检测未经DnaseI处理的逆转录样本的重复性检测结果。具体实施方式除非特别说明,本发明的术语具有本领域通常使用的含义。术语“核苷酸”旨在包括那些不仅含有已知的嘌呤和嘧啶碱基还含有经修饰的其他杂环碱基的部分。此类修饰包括甲基化嘌呤或嘧啶、酰化嘌呤或嘧啶、烷基化核糖或其他杂环化合物。此外,术语“核苷酸”包括那些含有半抗原或荧光标记以及可以不仅含有常规核糖和脱氧核糖还含有其他糖的部分。修饰的核苷或核苷酸还可以在糖部分上包含修饰,例如,其中一个或多个羟基被卤素原子或脂族基团取代,被官能化为醚、胺等等。术语“引物”是指长度通常为约20至30个碱基的、短的、化学合成的寡核苷酸。它们与靶DNA杂交,然后靶DNA通过DNA聚合酶复制产生互补的DNA链。“正向引物”和“反向引物”构成PCR中所用的“PCR引物组”,其中它们与互补的DNA链杂交,并指导向着彼此复制,分别产生上链和下链,导致靶DNA片段以指数增长。根据本发明的方法包含对RNA的(优选地3'聚腺苷酸)尾和用于反转录的(聚腺苷酸)尾上游的最近的1到10个核苷酸,优选地1到5个核苷酸,更优选地3到5个核苷酸特异的引物和/或一个对cDNA的相应的(5'聚胸苷酸)序列特异的扩增引物,该序列对RNA尾(3'聚腺苷酸)尾和cDNA的相应的(5'聚胸苷酸)序列下游的最近的的1到10个核苷酸,优选1到5个核苷酸,更优选3到5个核苷酸互补。相应地,除前述公开的引物外,可增加引物对的选择能力并因而增加被最接近末端序列锚点的特定核苷酸所确定的cDNA群的数目。术语“锚定引物”是指在基因特异性引物的5’末端加入一段修饰序列(包括酶切位点、标签序列和人工设计的随机序列等),然后通过逆转录或PCR扩增将该修饰序列锚定在目的基因上,最终以该锚定序列作为引物进行后续检测。在一定程度上可提高特定基因检测的特异性。术语“探针”是指用捕获标记或检测标记来标记引物,检测引物产物。探针序列用于与引物序列所产生的序列进行杂交,并且通常与不包括引物序列的序列杂交。与引物序列类似,探针序列也用捕获标记或检测标记来标记,需说明的是当引物用捕获标记来标记时,用检测标记来标记探针,反之亦然。在本发明中探针可以为TaqMan探针、MGB探针、杂交探针中的一种。比如,所述探针为TaqMan探针,标记探针5’端的为一种荧光发光基团,其是FAM、VIC、TET、JOE、ROX、CY3、CY5、HEX中的一种;标记探针3’端为一种荧光猝灭基团,其是BHQ1、BHQ2、BHQ3、TAMRA、DABCYL、NFQ中的一种。下面结合具体实施例,对本发明作进一步的阐述说明。应理解,这些实施例仅用于说明本发明而不在于限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法;所用的材料,如无特殊说明,均为自常规生化试剂公司购买得到的。实施例1、引物的设计目前,HBV分为至少10种基因型,在我国存在A~D4种基因型。根据我国存在的HBV基因型和国外常见基因型,发明人从GenBank中下载多条A~H基因型HBV参考序列,通过MegAlign软件分析不同基因型HBV基因组的保守序列。遵循引物和探针的设计原则,在这些保守区域中通过PrimerPremier5软件设计了针对HBVDNA检测的多对引物(表1)。这些序列均为不同基因型HBV的保守序列(图1)。同时,设计了针对HBVRNA检测的特异性引物和探针序列(表2)。为排除HBVDNA的干扰,发明人在逆转录引物的5’端加入了一段随机锚定序列。在上述引物、探针和随机锚定序列设计过程中,尽量避免发卡结构、引物内部二聚体、引物间二聚体以及错配的形成。此外,发明人通过NCBIBlast在线数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对上述设计的HBV特异性引物和探针序列以及随机锚定序列进行比对分析避免与其它病毒或人类基因发生非特异结合。通过多轮筛选和优化,最终确定一套灵敏度和特异度最优的引物、探针和随机锚定序列,序列如表2所示。表1.针对HBVDNA检测的引物和探针序列序列名称SEQIDNO序列HD-F1CGGCGTTTTATCATMTTCCTCTHD-F12CGGCGTTTTATCATMTTCCTCHD-F23GCGGCGTTTTATCATMTTCCTHD-F34TGTCTGCGGCGTTTTATCATHD-R5GAGGACAAACGGGCAACATACHD-R16GACAAACGGGCAACATACCTTProbe-HD7CATCCTGCTGCTATGCCTCATCTTCTT其中,Probe-HD的5’端荧光探针为VIC,3’端荧光探针为BHQ1。表2.针对HBVRNA检测的引物和探针序列其中,Probe-HR的5’端荧光探针为FAM,3’端荧光探针为BHQ1。HR-R1、HR-RT1序列的下划线部分为相同的随机锚定序列,HR-R2、HR-RT2序列的下划线部分为相同的随机锚定序列。如本领域技术人员所知,发明人通过实验进一步证实,随机锚定序列不影响检测的效率,只要尽量不与HR-F或Probe-HR形成引物二聚体即可。实施例2、检测方法的建立提取血液中HBV核酸(包括HBVDNA和RNA),其中利用特异性逆转录引物HR-RT将提取出的HBVRNA逆转录为cDNA,然后利用定量PCR的方法同时检测HBVDNA和RNA的水平(图2)。HBVRNA逆转录为cDNA的具体操作如下,通过RevertAidFirstStrandDNASynthesisKit(ThermoFisherScientific,Waltham,MA,USA)将血液中提出的HBVRNA逆转录成为cDNA。逆转录反应体系(20μL)为:反应条件为:25℃5分钟,42℃60分钟,70℃5分钟。然后利用HBVDNA和RNA正向和反向引物以及探针序列进行定量PCR检测扩增,利用SYBRGreen方法评价了针对HBVDNA检测的不同引物组合的扩增效率,结果显示,不同引物组合扩增效率无明显差异(图3)。随后,我们比较分析了HBVDNA检测引物(HD-F和HD-R1)与HBVRNA检测引物的扩增效率,发现两组引物扩增效率无明显差异(图4)。基于HBVRNA检测体系为之前优化的体系,下面主要探索双通道检测方法中HBVDNA的检测体系,确定了用于HBVDNA定量检测的探针浓度和引物浓度,并确定了双通道扩增反应的温度。结果显示,在确定探针浓度时,箭头指示的曲线为加入0.6μL浓度为10μM的探针时的扩增曲线,表明体系中加入0.6μL浓度为10μM的探针时HBVDNA扩增效率最佳(图5);在确定引物浓度时,箭头指示的曲线为加入1μL浓度为10μM引物时的扩增曲线,表明体系中加入1.0μL浓度为10μM的引物时HBVDNA的扩增效率最佳(图6);在确定双通道扩增反应的退火温度时,扩增反应温度为58℃和60℃时的扩增效率优于其他温度(图7)。最终确定的反应体系和扩增条件如下:在ABIStepOnePlus荧光定量PCR仪中的扩增循环参数为50℃,5分钟,94℃,10分钟;然后94℃,15秒,58℃,45秒,45个循环;在每个循环的延伸阶段(58℃)同步多次采集荧光(FAM和VIC信号均要采集)。实施例3、HBVDNA质粒标准品的构建提取HBV稳定复制细胞系HepAD38细胞培养上清中的HBVDNA,用HD-F和HD-R1引物进行PCR扩增,将扩增后的目的片段切胶回收后连接至pEASY-Blunt克隆载体上。经测序验证为装入的目的片段后,作为实验室内部检测血清HBVDNA的标准品使用。最终目的片段序列为:CGGCGTTTTATCATCTTCCTCTTCATCCTGCTGCTATGCCTCATCTTCTTGTTGGTTCTTCTGGACTACCAAGGTATGTTGCCCGTTTGTC(SEQIDNO﹕14)测序验证的峰图如图8A所示。提取HBV稳定复制细胞系HepAD38细胞培养上清中的HBVRNA,利用HR-RT逆转录引物进行逆转录后,用HR-F和HR-R进行扩增,将扩增后的目的片段切胶回收后连接至pEASY-Blunt克隆载体上。经测序验证为装入的目的片段后,作为实验室内部检测血液HBVRNA的标准品使用。最终目的片段序列为:AGACCACCAAATGCCCCTATCCTATCAACACTTCCGGAAACTACTGTTGTTAGACGACGAGGCAGGTCCCCTAGAAGAAGAACTCCCTCGCCTGTGTCGTGTGTTACGGTGTGA(SEQIDNO﹕15)测序验证的峰图如图8B所示。实施例4、灵敏度检测将构建好的HBVDNA标准品和HBVRNA标准品进行10倍倍比稀释,浓度分别为3.00E+09、3.00E+08、3.00E+07、3.00E+06、3.00E+05、3.00E+04、3.00E+03、3.00E+02copies/mL。用上述确定的检测体系和循环参数分别对倍比稀释的HBVDNA和HBVRNA标准品进行定量检测。结果显示,在检测HBVDNA标准品时,线性范围可低至3.00E+03copies/mL;标准曲线的线性回归方程为:y=-3.3589x+50.371,相关系数的平方R2=0.9929(图9)。在检测HBVRNA标准品时,线性范围可低至3.00E+02copies/mL;标准曲线的线性回归方程为:y=-3.3431x+48.671,相关系数的平方R2=0.999(图10)。除此之外,还利用单通道的检测方法分别对倍比稀释的HBVDNA和HBVRNA标准品进行了检测。结果显示,在检测HBVDNA标准品时,线性范围可低至3.00E+03copies/mL;标准曲线的线性回归方程为:y=-3.0297x+47.853,相关系数的平方R2=0.9974(图11)。在检测HBVRNA标准品时,线性范围可低至3.00E+03copies/mL;标准曲线的线性回归方程为:y=-3.4843x+42.71,相关系数的平方R2=0.9992(图12)。上述结果表明,在双通道检测过程中,其灵敏度与单通道检测相比无明显差异。上述结果表明,HBVDNA和RNA双通道定量检测方法具有较高的灵敏性。尽管双通道检测过程中,其灵敏度与单通道检测相比无明显差异,但由于在一个体系中经过一次检测即可获得与单通道检测同样的高灵敏度,使得检测时间大为缩短,因此双通道检测具有明显的优势实施例5、特异性的检测利用双通道检测未经DnaseI处理的逆转录样本,此时样本中含有HBVDNA和HBVRNA逆转后形成的cDNA。当双通道检测后,经FAM通道只能检测到HBVRNA的扩增曲线;经VIC通道只能检测到HBVDNA的扩增曲线。由此可见,两个通道之间无扩增信号干扰现象,具有较高的特异性。(图13)实施例6、重复性的检测选取未经DnaseI处理的逆转录样本进行检测,重复20次。结果显示,20次重复检测的曲线基本重合,重复检测的ct值的标准差(SD值)为0.16466,重复性较好(图14)。以上,基于本发明的实施方式进行了说明,但本发明不限定于此,本领域的技术人员应该明白,在本发明的主旨的范围内能够以进行变形和变更的方式实施,这样的变形和变更的方式,理应属于本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1