脐带血再生粒子的提取方法及其用途与流程
本发明涉及生物医学领域,尤其是组织细胞学、再生医学领域。具体涉及一种脐带血再生粒子、其提取方法及其用途。
背景技术:
在过去的几十年中,治疗各种疾病相关的医学研究有了很大的发展。科学家们进行了各种的研究及探讨,从化学药物到基因治疗,以致目前公认的干细胞治疗。干细胞的理论早在几十年前就提出了。在过去的十几年中,全世界各国在干细胞领域的科研都有很重要的发现。首先,所有干细胞领域的科研人员都承认干细胞有很强的再生能力。那就是干细胞有能力进一步分化为人体各组织的细胞或器官。例如干细胞可以分化为心肌细胞对因心肌组织缺血而引起的坏死的心肌细胞进行再生。另外干细胞可以修复由于肝硬化引起的肝细胞坏死,可以再造肝细胞。再有就是干细胞可以再造骨髓、血管。总而言之,干细胞的功能有很多,它们几乎可以重建所有的细胞系。
虽然干细胞具有极大的临床治疗潜力,但成体干细胞的数量很少,新鲜骨髓或血液提取的干细胞用于治疗受到了数量的限制,而且体外扩增成体干细胞的技术目前并不十分成熟。到目前为止,骨髓分离的成体干细胞还不能进行成功的体外扩增,几乎所有的文献报导的成体干细胞在培养时期都分化为间充质样细胞,而不是分化成代表三个胚层的细胞。在体外扩增过程中,这些经过培养的细胞失去了干细胞表面的标志,也就是丧失了干细胞自我扩增及多分化的能力。
相比之下,本发明发现的脐带血再生粒子是自然存在于人体血液及骨髓中的活性成分,此外本发明脐带血再生粒子还不存在任何转染基因等外界物质带来的风险等。
技术实现要素:
本发明的目的旨在提供一种脐带血再生粒子、其提取方法以及通过该方法获得的脐带血再生粒子的用途。本发明获得的脐带血再生粒子可以修复因缺血而引起的心脏损伤,再生心肌干细胞和心肌组织,提供一条新的治疗缺血性心肌损伤的方法和道路。本发明的再生粒子特别应用于重大疾病之一的缺血性心肌损伤的治疗之中。本发明的再生粒子还特别应用于促进脑血管再生的治疗之中。
本发明提供一种脐带血再生粒子的提取方法,包括如下步骤:取脐带血进行50-300g离心,离心后分为上层溶液A和下层沉淀A;然后取下层沉淀A,加入缓冲液轻微洗涤,进行50-300g离心,离心后分为上层溶液B和下层沉淀B;接着取下层沉淀B,加入红细胞裂解液摇动,裂解之后进行1000-3000g离心,离心后分为上层溶液C和下层沉淀C;然后取下层沉淀C,加入缓冲液剧烈晃动,之后进行50-300g离心,离心后分为上层溶液D和下层沉淀D;接着分别取上层溶液A、上层溶液B、上层溶液D,进行3000-7000g离心,收集所有沉淀置于MEM的培养基中进行培养;最后收集培养10-30天的培养基,进行3000-7000g离心,以富集脐带血再生粒子。其中所述脐带血优选是新鲜的。
在本发明的技术方案中,取下层沉淀A,按体积比为1:2-5加入缓冲液。
在本发明的技术方案中,取下层沉淀B,按体积比为1:5-10加入红细胞裂解液置于水平摇床,摇动20分钟,之后进行1000-3000g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液C和下层沉淀C,上层溶液C弃掉。
在本发明的技术方案中,取下层沉淀C,按体积比为1:5-10加入缓冲液剧烈晃动,晃动时间为1-2分钟,之后进行50-300g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液D和下层沉淀D,下层沉淀D弃掉。
在本发明的技术方案中,分别取上层溶液A、上层溶液B、上层溶液D,进行3000-7000g离心,离心时间为5-20分钟,离心后,收集沉淀。
在本发明的技术方案中,将收集到的沉淀置于MEM的培养基(含20%的混合脐带血血清)进行培养,培养条件为37℃,5%CO2培养箱中,每2-3天更换培养基一次;培养10-30天的培养基收取,进行3000-7000g离心,以富集脐带血再生粒子。
本发明还提供了通过本发明的脐带血再生粒子的提取方法获得的脐带血再生粒子,所述提取方法包括如下步骤:取脐带血进行50-300g离心,离心后分为上层溶液A和下层沉淀A;然后取下层沉淀A,加入缓冲液轻微洗涤,进行50-300g离心,离心后分为上层溶液B和下层沉淀B;接着取下层沉淀B,加入红细胞裂解液摇动,之后进行1000-3000g离心,离心后分为上层溶液C和下层沉淀C;然后取下层沉淀C,加入缓冲液剧烈晃动,之后进行50-300g离心,离心后分为上层溶液D和下层沉淀D;接着分别取上层溶液A、上层溶液B、上层溶液D,进行3000-7000g离心,收集所有沉淀置于MEM的培养基中进行培养;最后收集培养10-30天培养基,进行3000-7000g离心,以富集脐带血再生粒子。其中所述脐带血优选是新鲜的。
在本发明的技术方案中,取下层沉淀A,按体积比为1:2-5加入缓冲液。
在本发明的技术方案中,取下层沉淀B,按体积比为1:5-10加入红细胞裂解液置于水平摇床,摇动20分钟,之后进行1000-3000g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液C和下层沉淀C,上层溶液C弃掉。
在本发明的技术方案中,取下层沉淀C,按体积比为1:5-10加入缓冲液剧烈晃动,晃动时间为1-2分钟,之后进行50-300g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液D和下层沉淀D,下层沉淀D弃掉。
在本发明的技术方案中,分别取上层溶液A、上层溶液B、上层溶液D,进行3000-7000g离心,离心时间为5-20分钟,离心后,收集沉淀。
在本发明的技术方案中,将收集到的沉淀置于MEM的培养基(含20%的混合脐带血血清)进行培养,培养条件为37℃,5%CO2培养箱中,每2-3天更换培养基一次;培养10-30天的培养基收取,进行3000-7000g离心,以富集脐带血再生粒子。
一方面,本发明提供一种脐带血再生粒子的提取方法,包括如下步骤:
1)取脐带血进行50-300g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液A和下层沉淀A。
2)取步骤1中下层沉淀A,按体积比为1:2-5加入缓冲液轻微洗涤,进行50-300g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液B和下层沉淀B。
3)取步骤2中下层沉淀B,按体积比为1:5-10加入红细胞裂解液置于水平摇床,摇动20分钟,之后进行1000-3000g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液C和下层沉淀C,上层溶液C弃掉。
4)取步骤3中下层沉淀C,按体积比为1:5-10加入缓冲液剧烈晃动,晃动时间为1-2分钟,之后进行50-300g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液D和下层沉淀D,下层沉淀D弃掉。
5)分别取步骤1中上层溶液A、步骤2中上层溶液B、步骤3中上层溶液D,进行3000-7000g离心,离心时间为5-20分钟,离心后,收集所有沉淀。
6)将步骤5收集到的沉淀置于MEM的培养基(含20%的混合脐带血血清)进行培养,培养条件为37℃,5%CO2培养箱中,每2-3天更换培养基一次。
7)将步骤6培养10-30天的培养基收取,进行3000-7000g离心,以富集脐带血再生粒子。
上述脐带血再生粒子的提取方法中所述采集的新鲜脐带血原保存在血液保存袋中,含抗凝剂。
步骤1中所用脐带血符合中华人民共和国国务院令第208号《血液制品管理条例》,脐带血的生产工艺及检验依据筛选符合国家食品药品监督管理总局于2007年01月25日发布的《如何筛查献血员?》,筛选过程由合作医院的产房职员进行:首先,通过询问病史和体检排除不宜献血者,特别是排除高危人群、各类肝炎及艾滋病、梅毒患者。其次,对献血员肝脏功能[包括丙氨酸氨基转移酶(ALT)和胆红素]、乙型肝炎表面抗原(HBsAg)、HIV-1/HIV-2抗体、HCV抗体及梅毒进行检测。再次,献血者通过筛选后签署《献血者知情同意书》。
步骤1中采集的合格的脐带血冷链运输回单位,温度保持在2到8℃。
步骤2和步骤4中所用的缓冲液可以是现有技术已知的任何一种,优选是PBS,为Life Invitrogen,批号为1747277,PBS,PH7.4,10X,500ML。
步骤3中红细胞裂解液可以是现有技术已知的任何一种,优选是155mM NH4CL(Sigma,CAS号12125-02-9),10mM KHCO3(Sigma,CAS号298-14-6)和0.1mM EDTA(Life Invitrogen,0.5M,LOT号1737880,PH8.0)。
步骤6中所用的MEM培养基是MEM ALPHA,为Life Invitrogen,批号为1713957,MEM ALPHA,500ML。
步骤6中所用的混合脐带血血清是按照以下方法获得的:按脐带血血浆与100mg/ml D-葡萄糖酸钙(Sigma-Aldrich,CAS号299-28-5)为10:1的比例混匀,置于56℃灭活30分钟,之后混匀,4000rpm/分钟,离心5分钟,弃沉淀,将上清-80℃保存备用,该方法为无菌操作。
步骤1至步骤7的全部操作应为无菌操作。
另一方面,本发明提供了通过下述提取方法获得的脐带血再生粒子,所述方法包括如下步骤:
1)取脐带血进行50-300g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液A和下层沉淀A。
2)取步骤1中下层沉淀A,按体积比为1:2-5加入缓冲液轻微洗涤,进行50-300g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液B和下层沉淀B。
3)取步骤2中下层沉淀B,按体积比为1:5-10加入红细胞裂解液置于水平摇床,摇动20分钟,之后进行1000-3000g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液C和下层沉淀C,上层溶液C弃掉。
4)取步骤3中下层沉淀C,按体积比为1:5-10加入PBS剧烈晃动,晃动时间为1-2分钟,之后进行50-300g离心,离心时间为5-20分钟,离心后分为两部分,上层溶液D和下层沉淀D,下层沉淀D弃掉。
5)分别取步骤1中上层溶液A、步骤2中上层溶液B、步骤3中上层溶液D,进行3000-7000g离心,离心时间为5-20分钟,离心后,收集所有沉淀。
6)将步骤5收集到的沉淀置于MEM的培养基(含20%的混合脐带血血清)进行培养,培养条件为37℃,5%CO2培养箱中,每2-3天更换培养基一次。
7)将步骤6培养10-30天的培养基收取,进行3000-7000g离心,以富集脐带血再生粒子。
上述脐带血再生粒子的提取方法中所述采集的新鲜脐带血原保存在血液保存袋中,含抗凝剂。
步骤1中所用脐带血符合中华人民共和国国务院令第208号《血液制品管理条例》,脐带血的生产工艺及检验依据筛选符合国家食品药品监督管理总局于2007年01月25日发布的《如何筛查献血员?》,筛选过程由合作医院的产房职员进行:首先,通过询问病史和体检排除不宜献血者,特别是排除高危人群、各类肝炎及艾滋病、梅毒患者。其次,对献血员肝脏功能[包括丙氨酸氨基转移酶(ALT)和胆红素]、乙型肝炎表面抗原(HBsAg)、HIV-1/HIV-2抗体、HCV抗体及梅毒进行检测。再次,献血者通过筛选后签署《献血者知情同意书》。
步骤1中采集的合格的脐带血冷链运输回单位,温度保持在2到8℃。
步骤2和步骤4中所用的缓冲液可以是现有技术已知的任何一种,优选是PBS,为Life Invitrogen,批号为1747277,PBS,PH7.4,10X,500ML。
步骤3中红细胞裂解液可以是现有技术已知的任何一种,优选是155mM NH4CL(Sigma,CAS号12125-02-9),10mM KHCO3(Sigma,CAS号298-14-6)和0.1mM EDTA(Life Invitrogen,0.5M,LOT号1737880,PH8.0)。
步骤6中所用的MEM培养基是MEM ALPHA,为Life Invitrogen,批号为1713957,MEM ALPHA,500ML。
步骤6中所用的混合脐带血血清是按照以下方法获得的:按脐带血血浆与100mg/ml D-葡萄糖酸钙(Sigma-Aldrich,CAS号299-28-5)为10:1的比例混匀,置于56℃灭活30分钟,之后混匀,4000rpm/分钟,离心5分钟,弃沉淀,将上清-80℃保存备用,该方法为无菌操作。
步骤1至步骤7的全部操作应为无菌操作。
进一步地,本发明提供了含有本发明脐带血再生粒子的生物制剂,包含本发明脐带血再生粒子的组合物,以及包括本发明脐带血再生粒子的试剂盒。
本发明还提供了本发明的脐带血再生粒子生物制剂在制备用于治疗心肌损伤、脑血管损伤的药物中的用途,以及在制备用于再生心肌组织、再生血管、再生皮肤及毛囊、再生肝脏组织细胞、再生肾脏组织细胞的药物中的用途,特别是在制备促进心肌损伤再生修复或促进脑血管再生的药物中的用途。本发明脐带血再生粒子特别可以用于治疗重大疾病之一的缺血性心肌损伤的治疗。
本发明脐带血再生粒子在再生医学、药物发现、细胞治疗、化妆品中具有广阔的用途。用于细胞治疗中,治疗心肌损伤、脑血管损伤等。
本发明脐带血再生粒子用于再生医学中,再生心肌组织、再生血管、再生皮肤及毛囊、再生肝脏组织细胞、再生肾脏组织细胞。
在本发明的实施方式中,使细胞或组织再生的方法包括给予至患者有效量的本发明脐带血再生粒子或者含有本发明脐带血再生粒子的组合物或药物,使细胞或组织再生。在优选的实施方式中,在给予至患者前,可选地体外培养和扩增本发明脐带血再生粒子。在一个实施方式中,可以使用本发明脐带血再生粒子以再生心肌细胞(cardiomyocyte)以生理地修复心脏损伤(例如来自急性或慢性心脏病)的受损组织。可以通过移植、植入(例如本发明脐带血再生粒子自身或作为基质细胞组合物的部分的植入)、注射(例如直接注射至疾病或病况的位点处,例如直接注射至已经具有心肌损伤的个体的心脏中的缺血性位点或脑血管损伤的缺血性位点)、输注、通过导管递送、或任何其他本领域技术人员已知的用于提供治疗的方法完成将本发明脐带血再生粒子或包含本发明脐带血再生粒子的治疗性组合物给予至需要其的个体。
在某些实施方式中,包含本发明脐带血再生粒子的治疗组合物可选地包含一种或多种另外的细胞类型,例如,成熟细胞(例如成纤维细胞或内皮细胞),或干细胞或祖细胞。这类治疗剂和/或一种或多种另外的细胞可以单独或与两种或更多这类化合物或试剂组合给予至需要它们的个体。
在某些实施方式中,待治疗的个体是哺乳动物。在具体的实施方式中,待治疗的个体是人。在一些具体的实施方式中,个体是畜牧动物或家畜。在其他具体的实施方式中,待治疗的个体是马、羊、牛、猪、狗或猫。
虽然上面已经描述了本发明的各种实施方式,应理解的是仅以实例而不是限制的方式提出。根据本发明可以对公开的实施方式做出各种改变而不背离本发明的精神或范围。因此,本发明的宽度和范围不应由任何上面描述的实施方式限制。
本发明脐带血再生粒子是一项新发现,解决了成体干细胞的难题。第一,脐带血再生粒子是体内存在的正常细胞,没有任何加工或感染。第二,我们发明了脐带血再生粒子体外扩增技术,扩增后的脐带血再生粒子仍然保持其功能,没有自行分化。第三,体内移植的脐带血再生粒子没有任何副作用。在数百只动物实验中,我们没有发现一例肿瘤。由于本发明脐带血再生粒子可以从血液中提取,这样就避免使用胚胎组织,也就没有宗教及伦理的问题。另外脐带血再生粒子不引起免疫排斥反应。
除非另外限定,本文使用的所有术语(包括技术和科学术语)都具有与本领域技术人员通常理解的相同意义。此外应当理解的是,术语,如在通用词典中限定的那些,应被解释为具有与它们在相关领域的背景中的含义一致的含义,并且不得以理想化或过度形式化的意义进行解释,除非明确规定如此限定。
附图说明
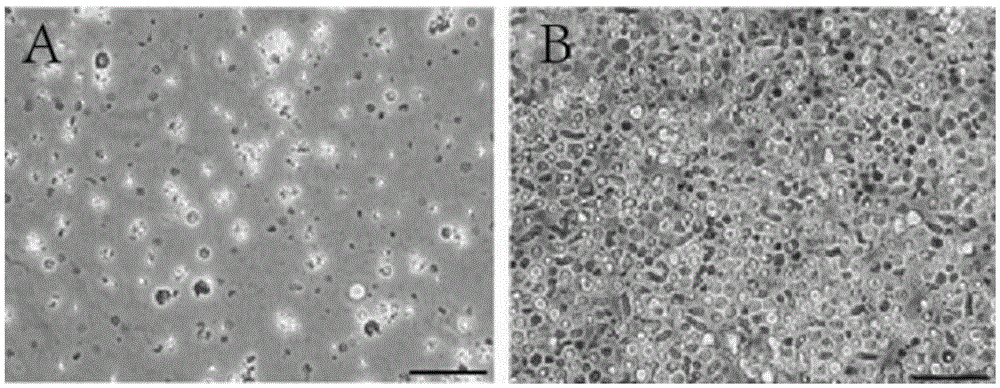
图1显示的是脐带血再生粒子的形态,图1A为脐带血再生粒子刚培养时的形态,图1B为脐带血再生粒子培养1周后的形态。
图2显示的是再生粒子移植后,小鼠体内位于MI区域的多细胞球状结构。再生粒子移植的小鼠(图2A,2C,2E)和以盐水作对照的小鼠(图2B,2D,2F)的心脏的心室壁通过2.5×,10×和40×透镜进行了比较。心室肌外层的厚度大致相同(图2C和2D中黑色线所示),但是植入再生粒子小鼠的心脏心室壁的总厚度更厚。
图3显示是另一个再生粒子移植小鼠心脏的图像,图3G到3J分别在2.5×,10×,40×和100×倍下的图像,结果表明MI区域再生粒子移植小鼠心脏有更多的Cardiospheres。
图4显示是再生粒子移植小鼠心脏中Oct4和CXCR4的表达情况,结果发现Oct4和CXCR4都在细胞核中表达,对照组中没有检测到阳性染色,且通过图像发现Oct4在密集的小颗粒物质中表达而非完全分化的细胞。
图5显示的是新形成细胞的染色照片。图5A是注射2周再生粒子的心脏切片;图5B是注射8周再生粒子的心脏切片;图5C是注射2周再生粒子的心脏中,Sox2+GFP的表达情况;图5D是注射2周再生粒子的心脏中,DDX4+GFP的表达情况;图5E是注射8周再生粒子的心脏中,Sox2+GFP的表达情况;图5F是注射8周再生粒子的心脏中,DDX4+GFP的表达情况。
图6显示的是10周的大脑部分切片,图6A是对照组,无血管生成;图6B是实验组,有血管生成。
图7显示的是荧光显微照片,图7C-7F显示的是GFP,Oct4,DAPI和复合图,图7G-7J显示的是GFP,nestin,DAPI和复合图。
具体实施方式
通过下面的实施例可以对本发明进行进一步的描述,而本发明的范围并不局限下述实施例。
本发明对实验中所用到的材料及实验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍在此作尽可能详细的描述。
实施例1.脐带血再生粒子的提取和培养
在本实施例中,示例性说明了脐带血再生粒子的提取和培养。
血源:把脐带血采集到含抗凝剂的血袋中,抗凝剂是血袋中原有的枸橼酸钠,通过冷链运输方式(温度保持在2到8℃)将脐带血运到公司。
条件:获取脐带血再生粒子的处理过程需要全程无菌操作。
(1)取脐带血进行200g离心,离心时间为10分钟,离心后分为两部分,上层溶液A和下层沉淀A。
(2)取下层沉淀A,按体积比为1:2-5加入PBS轻微洗涤,进行200g离心,离心时间为10分钟,离心后分为两部分,上层溶液B和下层沉淀B。
(3)取下层沉淀B,按体积比为1:5-10加入红细胞裂解液置于水平摇床,摇动20分钟,之后进行2000g离心,离心时间为10分钟,离心后分为两部分,上层溶液C和下层沉淀C,上层溶液C弃掉。
(4)取下层沉淀C,按体积比为1:5-10加入PBS剧烈晃动,晃动时间为2分钟,之后进行200g离心,离心时间为10分钟,离心后分为两部分,上层溶液D和下层沉淀D,下层沉淀D弃掉。
(5)分别取上层溶液A、上层溶液B、上层溶液D,进行5000g离心,离心时间为10分钟,离心后,收集所有沉淀。
(6)将收集到的沉淀置于MEM的培养基(含20%的混合脐带血血清)进行培养,培养条件为37℃,5%CO2培养箱中,每2-3天更换培养基一次。
(7)将培养10天的培养基收取,进行5000g离心,以富集脐带血再生粒子(再生粒子形态见图1)。
实施例2.脐带血再生粒子促进心肌损伤再生修复的功能
实验组通过尾静脉注射实施例1获得的脐带血再生粒子(GFP标记)到缺血性心肌损伤的小鼠,对照组注射生理盐水。注射后每24小时收集每只小鼠的血液,进行AST检测。注射后,连续9周收集小鼠心脏并切片检测受损区域。
在脐带血再生粒子移植到小鼠后,实验组中有更多的cardiospheres聚集在心肌梗死区域(见图2,图3),表明脐带血再生粒子形成了cardiospheres。通过对实验组cardiospheres区域的Oct4和CXCR4检测(见图4),发现在细胞核区呈染色阳性,表明在cardiospheres区域有脐带血再生粒子聚集形成有核细胞或干细胞。为进一步证明新形成的细胞是否为干细胞,又使用荧光组化检测Sox2和DDX4来验证绿色荧光蛋白标记的细胞,结果证明新形成的细胞为干细胞(见图5)。
以上的实施例说明,本发明脐带血再生粒子具有促进心肌损伤再生修复的功能。
实施例3.脐带血再生粒子促进脑血管再生的功能
实验组通过尾静脉注射实施例1获得的再生粒子(GFP标记)到缺血性脑损伤的小鼠,对照组注射生理盐水。
在10周的大脑检查中,发现在对照组没有GFP染色(图6A),但是在实验组的GFP特异抗体反应部分的血管样结构中有强的GFP表达(图6B)。进一步研究发现,在血管样结构中共表达的GFP和Oct4(图7C-7F)或者nestin也被检查到(图7G-7J)。
以上的实施例说明,本发明脐带血再生粒子具有促进脑损伤血管再生的功能。
- 还没有人留言评论。精彩留言会获得点赞!