一种芳氧苯氧丙酸类除草剂水解酯酶及其应用的制作方法
本发明属于基因工程领域,涉及一种芳氧苯氧丙酸类除草剂水解酯酶及应用。
背景技术:
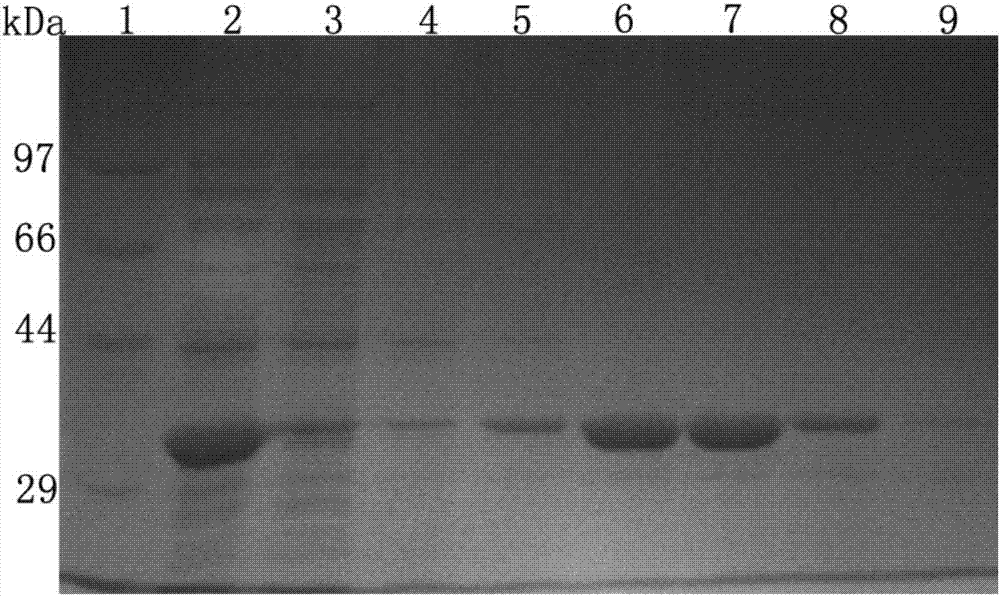
:芳氧苯氧丙酸类除草剂(aopp)主要用于防除禾本科杂草,因其高效、低毒而在我国及世界作物田广泛应用。当前国际市场上销量最大的aopp除草剂品种是炔草酯和精恶唑禾草灵,2003年和2009年该除草剂的销售额分别为2.5亿美元和2.8亿美元,占该类除草剂总销售量的31.2%,位于全球除草剂销量榜第七位。尽管除草剂的毒性相对较低,但大量研究表明aopp对水生生物表现为高毒性,过渡残留会给水体生物和人类健康带来了巨大的威胁。环境污染物在环境中的降解主要分为光解、水解和生物降解。aopp的降解主要依赖于土壤中微生物的作用,而微生物对物质的降解主要由细胞内的酶来完成。微生物是各种酶制剂的重要来源,利用分子克隆技术从产酶微生物中克隆产酶基因,再将其与合适的载体连接并转入相应宿主细胞,可进行酶的大量表达便于应用。目前,通过基因工程技术手段进行生产酶,已经成为工业用酶的主导。酯酶广义上是指具有催化水解酯键能力的一类水解酶的总称,而通常所说的酯酶往往是羧酸酯酶,主要用来水解脂肪酸族和芳香族酯类物质。三酰甘油酯类以及对硝基苯酯类物质都是酯酶的特异性底物。由于酯酶具有很高的活性,作为生物催化剂,利用其水解反应、酯转化和酯合成反应可以广泛应用于医药、化工、食品、能源及环保领域。技术实现要素:本发明的目的是针对芳氧苯氧丙酸类除草剂对水生生物会产生高毒性的问题,提供一种aopp水解酯酶。本发明的目的可通过如下技术方案实现:一种芳氧苯氧丙酸类除草剂水解酯酶aoph,其氨基酸序列如seqidno:2所示。本发明还提供了编码该水解酯酶的基因aoph,其核苷酸序列如seqidno:1所示。该基因全长(从起始密码子到终止密码子)为927bp,g+c含量为45.88%。本发明以aopp除草剂炔草酯为唯一碳源从土壤中分离筛选到一株高效降解炔草酯的菌株acinetobactersp.vl-2,所述菌株vl-2为本实验室自主筛选,已于2016年7月4日保藏于中国典型培养物保藏中心cctcc,保藏编号为:cctccno:m2016374。本发明以该菌株vl-2为材料构建其基因组文库,并成功从该文库中克隆出所述水解酯酶基因aoph。本发明的另一目的是提供含有上述编码基因aoph的表达载体及基因工程菌。所述表达载体的出发载体选用pet-28a(+),构建含aoph的重组质粒pet-aoph作为表达载体。选用宿主菌e.colibl21(de3)构建含有aopp水解酯酶基因aoph的基因工程菌e.colibl21(de3-pet-aoph),高效表达酯酶基因。所述的基因工程菌e.colibl21(de3-pet-aoph)的构建方法:所述的含aopp水解酯酶基因的pet-28a(+)重组质粒转化到表达宿主菌e.colibl21(de3)获得重组微生物e.colibl21(de3-pet-aoph),再将所获得的重组微生物转接到含有100mg/l炔草酯(aopp)、50mg/l卡那霉素和24mg/liptg的平板,37℃培养16h后,挑取有透明水解圈的阳性转化子,经测序验证基因序列无误后,保存。本发明的又一目的是提供该基因酶的应用。利用该基因生产的酶制剂可用于环境的生物修复、食品加工、医药、洗涤等行业,不仅可以解决aopp的环境污染问题,还可以取得可观的经济效益。其中,所述的aopp包括精恶唑禾草灵、精喹禾灵、炔草酯、氰氟草酯、氟吡甲禾灵。所述的aopp水解酯酶aoph在水解三酰甘油酯中的应用,所述的三酰甘油酯优选三乙酸甘油酯、三丁酸甘油酯、三己酸甘油酯、三辛酸甘油酯或、三癸酸甘油酯。所述aopp水解酯酶aoph在水解对硝基苯酯中的应用,所述的对硝基苯酯优选乙酸对硝基苯酯、丁酸对硝基苯酯、己酸对硝基苯酯、辛酸对硝基苯酯、癸酸对硝基苯酯、月桂酸对硝基苯酯、肉豆蔻酸对硝基苯酯、棕榈酸对硝基苯酯,进一步优选乙酸对硝基苯酯。所述的aopp水解酯酶aoph在水解三酰甘油酯中的应用,所述的三酰甘油酯优选三乙酸甘油酯、三丁酸甘油酯或三己酸甘油酯。利用本发明的基因aoph构建的工程菌株能高效表达芳氧苯氧丙酸类除草剂水解酯酶aoph,所述水解酯酶aoph还可以作用于三酰甘油酯、对硝基苯酯等其他酯类化合物,生产的酶制剂可用于环境的生物修复、食品加工、医药、洗涤等行业,不仅可以解决aopp的环境污染问题,还可以取得可观的经济效益。附图说明图1是芳氧苯氧丙酸类除草剂水解酯酶基因克隆及基因表达流程图。图2是芳氧苯氧丙酸类除草剂水解酯酶aoph纯化sds-page电泳图谱。图3是aoph对对硝基苯酯和三酰甘油酯类化合物的底物特异性。图4是芳氧苯氧丙酸类除草剂水解酯酶aoph的系统发育树。本发明所述的生物材料,其分类命名为acinetobactersp.vl-2,已保藏于中国典型培养物保藏中心(简称cctcc),保藏编号为:cctccno:m2016374,保藏日期为:2016年7月4日,保藏地址为:中国.武汉.武汉大学。具体实施方式下述的实施例中所使用的实验方法无特殊说明均为常规方法。下述的实施例中所使用的实验试剂耗材等无特殊说明均可从商业用途购买。下面结合实施对本发明进一步详细的描述,但发明的实施方式不限于此。实施例一acinetobactersp.vl-2基因组文库的构建:以aopp除草剂炔草酯为唯一碳源从土壤中分离筛选到一株高效降解炔草酯的菌株acinetobactersp.vl-2,所述菌株vl-2已于2016年7月4日保藏于中国典型培养物保藏中心cctcc,保藏编号为:cctccno:m2016374。采用高盐法提取vl-2的染色体总dna,用限制性内切酶sau3ai将其部分酶切,再经琼脂糖凝胶电泳分离回收4-6kb的dna片段,与脱磷载体puc118(bamhi/bap)连接后,化学转化导入制备好的e.colidh5α感受态细胞,构建acinetobactersp.vl-2基因组文库。通过含100mg/l炔草酯的lb平板挑选含芳氧苯氧丙酸类除草剂水解酯酶基因的阳性克隆(图1)。阳性克隆子插入片段的测序委托上海英潍捷基生物技术有限公司完成。测序引物为puc118(bamhi/bap)载体上特异性引物(m13+:agggttttcccagtcacg;m13-:gagcggataacaatttcacac),并根据两端测序结果设计引物walking直至整个插入片段测通。将测序完成的序列在ncbi数据库中进行比对,序列分析,并利用orffinder工具鉴定插入片段所含的orf。实施例二芳氧苯氧丙酸类除草剂水解酯酶基因在e.colibl21(de3)中的高效表达:(1)芳氧苯氧丙酸类除草剂水解酯酶基因的pcr扩增:根据推断的芳氧苯氧丙酸类除草剂水解酯酶orf,设计两对引物aoph-f(含有ndei酶切位点,5’-catatgtcagtagagatatacaa-3’)和aoph-r(含有xhoi,5’-ctcgagctatgcgttgattttgataactt-3’),用于扩增芳氧苯氧丙酸类除草剂水解酯酶全基因。50μl扩增体系如下:5×primestarbuffer(mg2+plus)10.0μldntpmixture(2.5mm)4.0μlaoph-f1.0μlaoph-r1.0μl模板dna(菌株vl-2总dna,约20ng·μl-1)1.0μlprimestarhsdnapolymerase5u·μl-10.5μl无菌ddh2o32.5μl总体积50.0μlpcr扩增程序:98℃变性10sec,55℃退火30sec,72℃延伸1min,进行30个循环;72℃延伸10min;10℃冷却10min。扩增产物经0.75%琼脂糖凝胶电泳检测,回收试剂盒回收后储于-20℃。pcr产物经加a尾后与pmd19-tvector按摩尔比3:1混合,在连接液作用下,16℃水浴过夜。酶连产物转化至e.colidh5α,通过含100mg/l炔草酯的lb平板挑选含芳氧苯氧丙酸类除草剂水解酯酶基因的阳性克隆,利用质粒提取试剂盒提取质粒,送上海英潍捷基生物有限公司测序。(2)芳氧苯氧丙酸类除草剂水解酯酶基因表达载体的构建:将克隆载体pmd19t-aoph和表达载体pet-28a(+)用ndei和xhoi双酶切,酶切体系如下:在37℃水浴中,反应3h以上。酶切产物进行0.75%的琼脂糖凝胶电泳切胶回收含有酶切位点的aoph基因和线性的pet-28a(+)表达载体。将上述两个片段进行酶连得含芳氧苯氧丙酸类除草剂水解酯酶基因的pet-28a(+)重组质粒pet-aoph。酶连好的pet-aoph重组质粒转化到表达宿主菌e.colibl21(de3)获得重组微生物e.colibl21(de3-pet-aoph),涂布含有100mg/l炔草酯、50mg/l卡那霉素和24mg/liptg的平板,经37℃培养16-20h后,挑取有透明水解圈的阳性克隆子,经测序验证基因序列无误。(3)重组芳氧苯氧丙酸类除草剂水解酯酶的诱导表达及纯化:将构建的表达菌株e.colibl21(de3-pet-aoph)在lb固体平板(50mg·ml-1kan)划线活化,接种单菌落于含有50mg·ml-1kan的3ml液体lb培养基中,37℃过夜振荡培养作为种子液。取1ml种子液转接于100ml液体lb培养基(含50mg·ml-1kan),37℃,180rpm培养至od600nm为0.6左右,加入1miptg20μl,18℃,180rpm培养24h,5,000rpm离心5min收集菌体,超声波破碎后,12,000rpm离心20min,蛋白质电泳,经考马斯亮蓝染色、脱色后观察结果。取10ul酶液在含有炔草酯的水平板上检测是否有水解圈生成。其中,12%sds聚丙烯凝胶电泳(sds-page)检测aoph的表达情况和纯化情况,并初步判断其分子量(图2)。ni2+-nta亲和层析柱在20%的乙醇中保存,首先去除乙醇,用5倍体积的超纯水冲洗。以两倍柱体积的20mmtris-hcl(ph7.5)平衡柱子,将含有重组酶aoph的破碎液离心上清上样至ni2+-nta亲和层析柱,4℃孵育1h,以5倍柱体积的20mmtris-hcl(ph7.5,50mm咪唑)洗去杂蛋白,然后以20mmtris-hcl(ph7.5,100mm、200mm、300mm咪唑)进行梯度洗脱,经酶活测定以及sds-page电泳,收集合并重组酶纯度最高的洗脱液,4℃,以截留分子量10kda的透析袋在20mmtris-hcl(ph7.0)缓冲液中透析过夜去除咪唑,用于后续研究。(4)验证aoph对炔草酯的水解功能:取10μl重组芳氧苯氧丙酸类除草剂水解酯酶纯酶液加至4ml含有0.2mm炔草酯的磷酸缓冲液中,于50℃反应10min后,用高效液相色谱检测炔草酯的降解情况。酶活单位定义为每分钟产生1μmol炔草酯酸即为一个单位,测得纯酶的比活力为329.13u/mgprotein,即1mg纯酶酶以炔草酯为底物在最适条件下反应每分钟可获得329.13μmol炔草酯酸。实施例三重组芳氧苯氧丙酸类除草剂水解酯酶aoph的底物特异性:将适量的重组酶aoph加至含精恶唑禾草灵、氰氟草酯、炔草酯、精喹禾灵、氟吡甲禾灵、对硝基乙酰苯酯、对硝基丁酰苯酯、对硝基已酰苯酯、对硝基辛酰苯酯、对硝基癸酰苯酯、对硝基月桂酰酯、对硝基肉豆蔻酰酯、对硝基软脂酰酯、三乙酸甘油酯、三丁酸甘油酯、三已酸甘油酯、三辛酸甘油酯、三癸酸甘油酯等底物的20mmtris-hcl(ph7.5)反应体系,底物终浓度为2mm,37℃反应10min。检测重组酶aoph对不同底物的水解情况。以炔草酯等芳氧苯氧丙酸类除草剂为底物时,根据不同底物的标准曲线,利用hplc检测各个底物的残留量,同时以不加酶作为对照,根据底物的减少量计算酶活。酶活单位定义为每分钟转化1μmol底物所需的酶量。经过hplc分析,重组酶aoph均可以水解测试的芳氧苯氧丙酸类除草剂,但是表现出的活性强弱不同。其作用于精恶唑禾草灵、精喹禾灵、氰氟草酯、炔草酯和氟吡甲禾灵的比酶活力分别为216.39、123.86、146.29、329.13、189.62u·mgprotein-1,这表明aoph对炔草酯具有最好的水解酶活性(表1)。以对硝基苯酯类化合物为底物时,酶促反应完毕后迅速煮沸终止酶反应,将反应液稀释10倍,测定od410nm光度值,根据对硝基苯酚浓度-od410nm绘制标准曲线,计算酶促反应产生的对硝基苯酚的量。酶活单位定义为每分钟产生1μmol对硝基苯酚所需的酶量。酶活力测定结果显示,重组酶aoph对所有测试的对硝基苯酯类化合物均有水解活性,但其酶活力差异较大,其中以乙酸对硝基苯酯为底物时酶活力最高,可达5648u·mgprotein-1;随着羧酸碳链的延长,其酶活性显著降低,当羧酸碳链长度大于10碳时,其酶活力均跌至1000u·mgprotein-1以下(图3)。以甘油三酯类化合物为底物时,反应完毕后,加入2倍体积的乙醇终止反应,加20μl1%酚酞溶液,用10mm的naoh滴定至淡粉色,记录消耗的naoh的量。酶活单位定义为每分钟产生1μmol羧酸所需的酶量即为一个单位。当以三酰甘油酯为底物时,重组酶aoph仍然具有较高的酶活力,且酶活力亦随着羧酸链的延长而降低。以三乙酸甘油酯为底物时,其活力23482u·mgprotein-1,而以三己酸甘油酯为底物时,活力仅为240u·mgprotein-1(图3)。将重组酶aoph加入到含不同浓度底物(0.1-2mm)的测活反应体系中,37℃,反应10min后迅速终止酶反应,测定酶活力。根据底物浓度和所测定的反应速率作michaelis-menten双倒数曲线图,计算重组酶aoph对不同底物km值和vmax。aoph的最适底物为pnpc2,酶活力为5648u·mgprotein-1,km为0.21mmol·l-1,vmax为9.21mmol·min-1·mg-1。在所测试的芳氧苯氧丙酸类除草剂中,最适底物为炔草酯,酶活力为329u·mgprotein-1,km为0.72mmol·l-1,vmax为8.53mmol·min-1·mg-1。重组酶aoph对不同aopp除草剂的酶活力大小排序为:炔草酯>精恶唑禾草灵>氟吡甲禾灵>氰氟草酯>精喹禾灵(表1)。表1aopp水解酯酶aoph的底物特异性与表观动力学常数实施例四重组芳氧苯氧丙酸类除草剂水解酯酶aoph的氨基酸序列分析:将aoph的氨基酸序列与proteindatabank(pdb)数据库的蛋白序列进行同源性分析,发现和aoph氨基酸序列相似度最高的是α/β水解酶超家族的成员,例如与来源于staphylococcusaureus的水解酯酶同源性30%(3d7r),与来源于宏基因组文库的α/β水解酯酶同源性28%(3dnm)等。选择5个同源最高的已知蛋白质结构的α/β水解酯酶进行序列比对分析,发现aoph具有α/β水解酯酶超家族蛋白典型的三联体催化活性位点ser-glu/asp-his(ser159,asp253andhis283)以及该家族蛋白的特征序列标签(g-x-s-x-g)。从而确定aoph是α/β水解酶家族的一个新成员。将aoph氨基酸序列在ncbi(http://blast.ncbi.nlm.nih.gov/)上以blastp进行比对,与已报道的芳氧苯氧丙酸类除草剂水解酯酶和相关农药水解酯酶以邻接法构建系统发育树。结果表明,aoph与来源于rhodococcussp.t1的精恶唑禾草灵水解酯酶feh同源性10%;与来源于pseudomonasazotoformansqdz-1的氰氟草酯水解酯酶chbh同源性12%;与来源于sphingopyxissp.ob-3的溴苯腈水解酯酶broh同源性9%;与来源于delftiasp.t3-6的具有酯酶活性的cmepa水解酰胺酶damh同源性22%(图4)。这表明α/β水解酶aoph是一个新的芳氧苯氧丙酸类除草剂水解酯酶。序列表<110>南京工业大学<120>一种芳氧苯氧丙酸类除草剂水解酯酶及其应用<130>xb16101202<160>2<170>patentinversion3.5<210>1<211>927<212>dna<213>artificialsequence<220><223>1<220><221>cds<222>(1)..(927)<400>1atgtcagtagagatatacaatggtgagagaagcgaggagtcaatacag48metservalgluiletyrasnglygluargserglugluserilegln151015ttcgagaccctcataaccagtcagtcaaacaaggaatcattcgcatca96phegluthrleuilethrserglnserasnlysgluserphealaser202530gtagagaagacgaagaatatcttgagccagatcgagaacataaaaccg144valglulysthrlysasnileleuserglnilegluasnilelyspro354045tacgctataggtgacgacgttaagttggtttcagagatcaaagaacag192tyralaileglyaspaspvallysleuvalsergluilelysglugln505560atatttgagggtatgcaagtatttaccctcaacgatcagatgagccag240ilephegluglymetglnvalphethrleuasnaspglnmetsergln65707580aaacagaaagttatattgtacatccacgggggggcatgggttaatcaa288lysglnlysvalileleutyrilehisglyglyalatrpvalasngln859095ccgttgcactttcactggtggtatatggacaagatggcacagagtttg336proleuhisphehistrptrptyrmetasplysmetalaglnserleu100105110aacgcaaaggttgtagcaccgatctacccgaagctcccgcactactca384asnalalysvalvalalaproiletyrprolysleuprohistyrser115120125tatcaggacacgtaccctaagatactcaacttgtacaaggagatcttg432tyrglnaspthrtyrprolysileleuasnleutyrlysgluileleu130135140aagaccgtagaatcaacggaccagctcaccataatgggtgacagcgct480lysthrvalgluserthraspglnleuthrilemetglyaspserala145150155160gggggtaacataagcttggggttagctcacttgctcaaaatggagtca528glyglyasnileserleuglyleualahisleuleulysmetgluser165170175ttacctcaacctaaagacataatactcctcagcgcttgcgtagacatg576leuproglnprolysaspileileleuleuseralacysvalaspmet180185190tcactctcaaacgcgttgatcagcgagtacgcattgaaggacccgata624serleuserasnalaleuileserglutyralaleulysaspproile195200205ctcgcaccggagggtatcgacgtaataaccaagatatgggctgctgac672leualaprogluglyileaspvalilethrlysiletrpalaalaasp210215220aagaaaatcacggatcctctcatatcacctatacatggggatttcaat720lyslysilethraspproleuileserproilehisglyasppheasn225230235240gggttgggtaagataacgcacttcataggtacccacgacatactctac768glyleuglylysilethrhispheileglythrhisaspileleutyr245250255cctgacgctttgaaattggacgagaaattgaccgagcagggtatagat816proaspalaleulysleuaspglulysleuthrgluglnglyileasp260265270atgaagacgttcgtataccctgagatgttacacgttttcgtagtaatg864metlysthrphevaltyrproglumetleuhisvalphevalvalmet275280285cctataccggaagctcaggatgcacaagagaagataatacaagttatc912proileproglualaglnaspalaglnglulysileileglnvalile290295300aaaatcaacgcatag927lysileasnala305<210>2<211>308<212>prt<213>artificialsequence<220><223>syntheticconstruct<400>2metservalgluiletyrasnglygluargserglugluserilegln151015phegluthrleuilethrserglnserasnlysgluserphealaser202530valglulysthrlysasnileleuserglnilegluasnilelyspro354045tyralaileglyaspaspvallysleuvalsergluilelysglugln505560ilephegluglymetglnvalphethrleuasnaspglnmetsergln65707580lysglnlysvalileleutyrilehisglyglyalatrpvalasngln859095proleuhisphehistrptrptyrmetasplysmetalaglnserleu100105110asnalalysvalvalalaproiletyrprolysleuprohistyrser115120125tyrglnaspthrtyrprolysileleuasnleutyrlysgluileleu130135140lysthrvalgluserthraspglnleuthrilemetglyaspserala145150155160glyglyasnileserleuglyleualahisleuleulysmetgluser165170175leuproglnprolysaspileileleuleuseralacysvalaspmet180185190serleuserasnalaleuileserglutyralaleulysaspproile195200205leualaprogluglyileaspvalilethrlysiletrpalaalaasp210215220lyslysilethraspproleuileserproilehisglyasppheasn225230235240glyleuglylysilethrhispheileglythrhisaspileleutyr245250255proaspalaleulysleuaspglulysleuthrgluglnglyileasp260265270metlysthrphevaltyrproglumetleuhisvalphevalvalmet275280285proileproglualaglnaspalaglnglulysileileglnvalile290295300lysileasnala305当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1