一种硫链丝菌素‑庆大霉素抗性基因体系及还有其的抗性表达盒和重组质粒的制作方法
本发明属于基因工程领域,具体涉及一种用于高效构建无抗性标记重组分枝杆菌的抗性表达盒及其应用。
背景技术:
目前在对分枝杆菌进行基因操作的过程中,能用于筛选的抗性标记基因非常有限,主要原因是分枝杆菌对多种抗生素天然耐药,且其要求低频抗性即更加稳定的药物作为抗性标记基因。而多种抗性标记联合使用则使得分枝杆菌的遗传操作需要多种遗传修饰,如多质粒的稳定维持以及多基因的失活,因此可行性相当困难。
氨基糖苷磷酸转移酶(APH)基因,因其对卡那霉素有抗性,并且对于需要长期培养的慢速生长分枝杆菌具有高度稳定性,故被作为第一个用于分枝杆菌的抗性筛选标记。然而,APH的使用由于分枝杆菌对其自发抗性的出现而受限,尽管这种抗性是低频的。与快速生长细菌不同,慢速生长的分枝杆菌具有单一的rRNA操纵子,其更容易发生突变从而产生抗性,如抗卡那霉素。此外,卡那霉素在分枝杆菌属菌株w和牛分枝杆菌中作为抗性筛选标记尚未实现。Radford与Hodgson于1991年首次报道潮霉素在耻垢分枝杆菌和牛结核分枝杆菌BCG中作为抗性筛选标记,且可以用于其他的分枝杆菌中。潮霉素作为抗性筛选标记,最大的优点是对于目前临床上使用的药物不会出现交叉耐药。并且,潮霉素作为抗性筛选标记的转化成功率高于卡那霉素,且其在分枝杆菌中的表达效率也远远高于来源于大肠杆菌的APH基因对卡那霉素的抗性。
安普霉素在慢速和快速生长的分枝杆菌中作为抗性筛选标记使用首次被Paget和Davies于1996年报道,但在临床上却未被批准使用。主要原因是,安普霉素能使得与其自身相近的氨基糖苷类抗生素发生乙酰化,如卡那霉素,且其转化率很低。此外,安普霉素属于β-内酰胺类的抗性筛选标记,由于其含有β-内酰胺酶故会使分枝杆菌产生天然抗性,且青霉素也是如此,因此在分枝杆菌中并不能作为稳定可靠的抗性筛选标记。
其它报道的可用于分枝杆菌的抗性筛选标记有氯霉素,但却由于其稳定性低以及高频率的自发突变而使其使用受到限制,尤其不适合慢速生长的分枝杆菌。链霉素,磺胺类药以及汞盐也曾经被报道可用于分枝杆菌的抗性筛选标记,但直到目前,卡那霉素、潮霉素和庆大霉素抗性基因仍然是分枝杆菌中使用最普遍的抗性筛选标记。
由于可用于分枝杆菌的抗性筛选标记数量有限,因此我们研发了一种可接受甲基的趋药性蛋白I且对硫链丝菌素(THS)有抗性的丝氨酸敏感受体tsr基因,作为结核分枝杆菌和牛结核分枝杆菌BCG-Tice的抗性筛选标记基因。THS,一种噻唑类的抗生素,于1954年首次从远青链霉菌(Streptomyces azureus)中分离和鉴定出来,主要用于治疗动物的乳腺炎,也用于治疗狗类的部分疾病,然而,其用途却由于低溶解性和高毒性受到了限制。THS通过紧密地结合到细菌中的由23S rRNA和核糖体蛋白L11形成的复合体上,从而抑制相关蛋白质的翻译。而tsr基因可以编码一种RNA甲基转移酶,该酶可以通过甲基化23S rRNA阻止THS结合到核糖体复合体上。因此tsr基因对THS完全耐药,故在多种放线菌类的克隆载体中作为抗性筛选标记基因。Aminake等人于2011年报道THS以及其衍生物有希望用于治疗疟疾,因为其能靶向人类的疟疾寄生虫P.Falciparum的蛋白酶体而使寄生虫被快速清除。
最近,Westhoff等在乳腺癌细胞系上的研究发现,当THS与紫杉醇/顺铂化疗药联合使用时,Forkhead box M1(FOXM1)基因的表达就会下降,同时对来源于铂类耐药病人的腹水细胞的协同杀伤作用也明显增强。除此以外,Wada等于2015年也报道了THS除了可用于链霉菌中单拷贝条件下的精确筛选标记外,还可用于嗜热地芽胞杆菌的稳定性抗性筛选标记。然而,THS用于结核分枝杆菌的抗性筛选标记的资料却并不充足,但这却是很有必要的。
技术实现要素:
本发明的一个目的在于提供一种自带人工启动子的硫链丝菌素-庆大霉素抗性基因tsr-aacC1。
本发明的另一个目的在于提供一种用于高效构建无抗性标记重组分枝杆菌的抗性表达盒。
本发明的另一个目的在于提供一种用于高效构建无抗性标记重组分枝杆菌的重组质粒。
本发明所采取的技术方案是:
发明人自主研发了一种硫链丝菌素(tsr)-庆大霉素抗性基因(aacC1)抗性基因体系,其核苷酸序列如SEQ ID NO:1所示。
一种用于高效构建无抗性标记重组分枝杆菌的抗性表达盒,含有硫链丝菌素抗性基因和庆大霉素抗性基因,以及能启动硫链丝菌素抗性基因和庆大霉素抗性基因表达的hsp60启动子,此外还有位于hsp60启动子和硫链丝菌素抗性基因两端的dif1和dif2序列,所述的硫链丝菌素抗性基因和庆大霉素抗性基因的核苷酸序列如SEQ ID NO:1所示,hsp60启动子序列如SEQ ID NO:6所示,dif1和dif2序列分别如SEQ ID NO:7和SEQ ID NO:8所示。在此将该抗性表达盒命名为“dif2-hsp60-aacC1-tsr-dif1抗性表达盒”。
优选的,所述抗性表达盒两端还添加了多重酶切位点。
所述抗性表达盒的核苷酸序列如SEQ ID NO:4或SEQ ID NO:5所示。
含有以上所述dif2-hsp60-aacC1-tsr-dif1抗性表达盒的重组质粒。
优选的,所述重组质粒的核苷酸序列如SEQ ID NO:2所示。
一种用于高效构建无抗性标记重组分枝杆菌的新型重组质粒,其含有:启动子、噬菌体整合位点、整合酶基因、氨苄青霉素抗性基因Amp R、M13引物、复制起始位点以及所述抗性表达盒。按顺时针方向为,Lac Z启动子、Lac Z操纵子、M13反向引物、权利要求2~5任一项所述的抗性表达盒、噬菌体整合位点、整合酶基因、M13正向引物、大肠杆菌复制起点(f1)、氨苄青霉素抗性基因启动子、氨苄青霉素抗性基因Amp R、分枝杆菌复制起点ori M依次连接在一起。
所述启动子为Hsp60启动子、Amp R启动子以及Lac Z启动子,所述复制起始位点为大肠杆菌复制起点f1和分枝杆菌复制起点ori M。
优选的,所述新型重组质粒的的核苷酸序列如SEQ ID NO:3所示。
本发明的有益效果是:
(1)本发明首次阐明硫链丝菌素THS可以作为分支杆菌属的抗性筛选标记,且其工作浓度远低于其它在分枝杆菌中使用的抗性标记,如表2和表3所示;此外,在硫链丝菌素(tsr)-庆大霉素抗性基因(aacC1)体系中,庆大霉素抗性基因用于大肠杆菌和耻垢分枝杆菌的抗性筛选标记,GEN作为抗性筛选标记对于M.smegmatis mc2155的转化效率如表1所示;而硫链丝菌素抗性基因则用于结核分枝杆菌和牛结核分枝杆菌的抗性筛选标记,THS作为抗性筛选标记对于M.bovis BCG and M.tuberculosis H37Rv的转化效率如表1所示;
(2)硫链丝菌素(tsr)-庆大霉素抗性基因(aacC1)抗性基因体系自带短的启动子hsp60,在大肠杆菌和分枝杆菌中均可表达,定向插入时不影响下游基因的转录和翻译;
(3)本发明的抗性表达盒在tsr-aacC1基因两端添加了dif序列,可以在分枝杆菌中自动解离。tsr-aacC1基因丢失后,被破坏的基因仍可继续表达缩短的小肽,不影响下游基因的翻译,从而可有效避免极性效应;
(4)本发明的抗性表达盒两端还添加了多重酶切位点,使得该表达盒既可以插入到特定序列中,还便于在其两侧定向添加其他序列。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
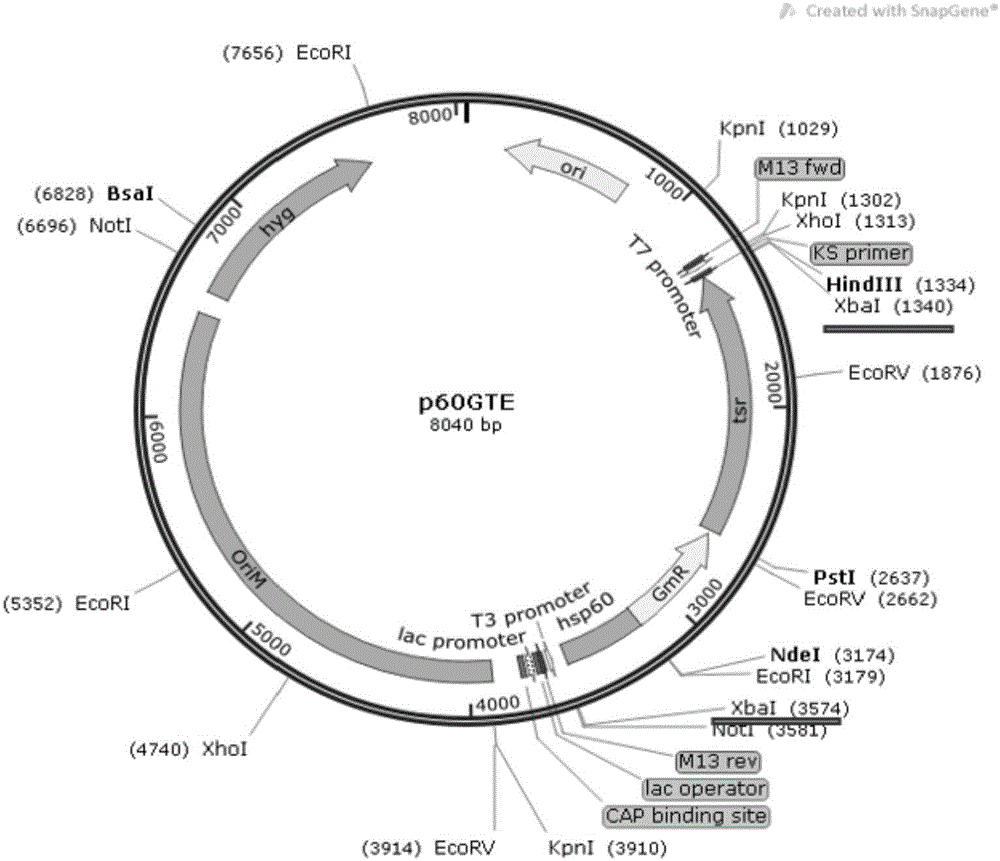
图1为质粒p60GTE的结构示意图;
图2为质粒p60GTE酶切位点图;
图3为质粒p60GTE的构建流程图;
图4为整合型质粒p60GTI的结构示意图;
图5为整合型质粒p60GTI的构建流程图。。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
以下实施例中所采用的分子生物学实验技术包括PCR扩增、质粒提取、质粒转化、DNA片段连接、酶切、凝胶电泳等,如无特殊说明,通常按照常规方法操作,具体可参见《分子克隆实验指南》(第三版)(Sambrook J,Russell DW,Janssen K,Argentine J.黄培堂等译,2002,北京:科学出版社),或按照制造厂商所建议的条件。
以下实施例中PCR反应所用的pfu酶、dNTP以及相关试剂均购买自上海生工生物有限公司;抗生素硫链丝菌素和庆大霉素购自上海西格玛奥德里奇公司;大肠杆菌感受态DH5a购买于广州东盛生物科技有限公司,货号为C1042;DNA连接反应均采用Takara宝生物公司的T4DNA连接试剂盒,型号:D6020A;质粒DNA提取试剂盒(BSC01M1)、DNA回收试剂盒(BSC02M1)、PCR纯化试剂盒(BSC03M1)购自博日生物公司。
以下实施例中所用到的PCR引物和DNA片段由上海捷瑞生物工程有限公司负责合成。
实施例1构建质粒p60GTE
质粒p60GTE的结构示意图见图1,酶切位点图见图2,其含有上述的tsr-aacC1性基因。由图1可见,质粒p60GTE按顺时针方向依次含有:大肠杆菌复制起点(ori E),tsr-aacC1抗性基因,启动子hsp60(用于启动硫链丝菌素-庆大霉素抗性基因,即tsr-aacC1),主要用于质粒筛选。
所述质粒p60GTE含有硫链丝菌素-庆大霉素抗性基因(tsr-aacC1),如SEQ ID NO:1所述,该基因上的第2760-3145序列为启动子序列(hsp60),用于启动tsr-aacC1基因的表达。tsr-aacC1基因序列两端连接的hsp60序列如SEQ ID NO:6所示。
另外在hsp60-aacC1-tsr抗性体系的两端分别依次连接Not I酶切位点、XbaI酶切位点,HindIII酶切位点、XhoI酶切位点,此4个酶切位点可用来切下质粒上的hsp60-aacC1-tsr抗性体系。
1)质粒p60GTE的构建流程图见图3,本流程中将使用到质粒p60Lux N(由本实验室自己构建,质粒图谱见图3,具体构建方法见参考文献22)。质粒p60Lux N中含有原始潮霉素抗性基因(Hyg*),约长1.7kb。
具体方法如下:
1.质粒p60Gm的构建
用限制性内切酶Nde I和Pst I消化质粒p60Lux N,纯化回收试剂盒回收7.9kb的片段;
合成DNA片段aacC1(如SEQ ID NO:9所示,由上海捷瑞生物工程有限公司负责合成),合成的aacC1两端带有Nde I和Pst I酶切位点,所以,将aacC1和已经纯化回收后的质粒p60Lux N进行片段连接,转化大肠杆菌感受态DH5α,利用含庆大霉素抗性的LB固体平板筛选出阳性克隆,挑取单克隆到LB液体培养基中培养后,提取质粒,酶切鉴定出正确的克隆即为质粒p60Gm。
2.质粒p60GTE的构建
用限制性内切酶PstI和Hind III消化质粒p60Gm,纯化回收试剂盒回收
6.7kb的片段;
合成DNA片段tsr(如SEQ ID NO:10所示,由上海捷瑞生物工程有限公司负责合成),合成的tsr两端带有Pst I和Hin酶切位点,所以,将tsr和已经纯化回收后的质粒p60Gm进行片段连接,转化大肠杆菌感受态DH5α,利用含庆大霉素抗性的LB固体平板筛选出阳性克隆,挑取单克隆到LB液体培养基中培养后,提取质粒,酶切鉴定出正确的克隆即为质粒p60GTE。
实施例2整合型质粒p60GTI的构建及应用
整合型质粒p60GTI的结构示意图见图4,质粒p60GTI按顺时针方向依次含有:Lac Z启动子和Lac Z操纵子(可用于蓝白斑筛选,以及启动后面整个质粒骨架的表达),M13反向引物(用于PCR扩增鉴定),dif2-hsp60-aacC1-tsr-dif1抗性表达盒,噬菌体整合位点attP、整合酶基因Int(可表达出整合酶,使质粒通过attP位点整合入分枝杆菌基因组),M13正向引物(用于PCR扩增鉴定),大肠杆菌复制起点(f1),氨苄青霉素抗性基因启动子,氨苄青霉素抗性基因Amp R(用于质粒筛选),分枝杆菌复制起点ori M。dif2-hsp60-aacC1-tsr-dif1抗性表达盒两端分别依次连接HindIII酶切位点、XhoI酶切位点,可用于切下质粒上的dif2-hsp60-aacC1-tsr-dif1抗性表达盒。
整合型质粒p60GTI的构建流程见图5,本构建流程中所用到的质粒pUCDHmke由本实验室自己构建,质粒图谱见图5,具体构建方法见参考文献23;质粒pMH94由美国约翰霍普金斯大学WilliamBishai实验室惠赠,质粒图谱见图5,具体构建方法见参考文献24。
具体操作如下:
1.质粒pUCDGT的构建
用限制性内切酶Xba I消化质粒pUCDHmKE,纯化回收试剂盒回收2.7kb的片段(含dif2-ΩHYG-dif1);
用限制性内切酶Xba I消化质粒p60GTE,纯化回收试剂盒回收1.8kb的片段(hsp60-aacC1-tsr);将两个片段进行连接反应后,转化大肠杆菌感受态DH5α,利用含庆大霉素抗性的LB固体平板筛选出阳性克隆,挑取单克隆到LB液体培养基中培养后,提取质粒,酶切鉴定出正确的克隆即为质粒pUCDGT(含dif2-hsp60-aacC1-tsr-dif1)。
2.质粒p60GTI的构建
用限制性内切酶HindIII消化质粒pUCDGT,纯化回收试剂盒回收1.8kb的片段(含dif2-hsp60-aacC1-tsr-dif1);
用限制性内切酶HindIII消化质粒pMH94,纯化回收试剂盒回收6.1kb的片段;将两个片段进行连接反应后,转化大肠杆菌感受态DH5α,利用含庆大霉素抗性的LB固体平板筛选出阳性克隆,挑取单克隆到LB液体培养基中培养后,提取质粒,酶切鉴定出正确的克隆即为质粒p60GTI。
3.转化
将质粒p60GTI和p60GTE通过电转化的方法将其分别转入耻垢分枝杆菌(转化方法见参考文献25),以及结核分枝杆菌和牛结核分枝杆菌BCG(H37Rv结核标准菌株,转化方法见参考文献26),获得相应的转化株。
将所得转化株于37℃孵箱中孵育12小时,充分复活细菌并使其抗性表达。用带滤芯的枪尖吹吸混匀后,分装至小管中,10000rpm离心1分钟沉淀转化菌,弃上清,用0.6mL 7H9培养基重悬后,以500μL/板铺于7H11含相应抗生素(耻垢分枝杆菌:GEN 5μg/mL;结核分枝杆菌和牛结核分枝杆菌BCG:THS 5和10μg/mL)培养板中。同时稀释一百倍后,500μL/板铺板,避光于37度孵箱培养。
在含有相应抗生素(GEN和THS)的平板上可获得含有p60GTI和p60GTE质粒的耻垢分枝杆菌,以及结核分枝杆菌和牛结核分枝杆菌BCG,此步证明了本发明的dif2-hsp60-aacC1-tsr-dif1抗性表达盒可成功在分枝杆菌中表达。
将获得的带有p60GTI和p60GTE质粒的耻垢分枝杆菌,以及结核分枝杆菌和牛结核分枝杆菌BCG转化株进行液体传代培养,在培养3天后(对于耻垢分枝杆菌)或14天后(对于结核分枝杆菌和牛结核分枝杆菌BCG),将培养的菌液进行稀释后铺平板(THS 10μg/mL),所得的平板上约有80%的菌落丢失了THS抗性,即无法在含有硫链丝菌(THS)的平板上生长,此步证明了本专利中的dif2-hsp60-aacC1-tsr-dif1抗性表达盒可成功在分枝杆菌中自动解离,且有较高的效率。THS作为抗性筛选标记对于M.bovis BCG and M.tuberculosis H37Rv的转化效率以及GEN作为抗性筛选标记对于M.smegmatis mc2155的转化效率如表1所示。
表1:THS作为抗性筛选标记对于M.bovis BCG and M.tuberculosis H37Rv的转化效率以及GEN作为抗性筛选标记对于M.smegmatis mc2155的转化效率
转化效率:定义为每微克DNA转化成功长出的克隆数;
结果是由三个平行平板中长出的平均克隆数计算得来的。
表2:THS对于野生型和重组分枝杆菌的MIC(最小抑菌浓度)
表3:GEN对于野生型和重组分枝杆菌M.smegmatis mc2155的MIC
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!