维生素D2糖苷类似物、合成及应用的制作方法
技术领域
本发明主要涉及维生素D2糖苷类似物、合成及其应用,属于医药化学领域。
背景技术:
蘑菇作为天然的自然资源大量存在于我们的生活中,因其具有很好的药用价值长期以来一直受到人们的关注。许多具有抗癌活性的生物活性分子就是从不同品种的蘑菇中分离提取出来的。如化合物a和化合物b,分别是从植物中提取出来的两种天然糖苷化合物。最近有文章报道了化合物a和化合物b能抑制脂多糖刺激的巨噬细胞产生NO,达到清除过氧亚硝基阴离子(ONOO-)的目的,在治疗许多疾病如联合关节炎、动脉粥样硬化及癌症方面具有潜在的应用。
维生素D2作为维生素D的一种重要的活性物质,其在人体内的代谢产物1,25-(OH)2D能够调节钙磷代谢,抑制癌细胞增殖、调节血压和免疫系统等。麦角固醇在紫外光作用下发生开环反应可以转化成维生素D2,在结构上与维生素D2具有相似性。同样的,化合物b的苷元结构与维生素D2片段(CD环和支链部分)结构相似。我们基于此点对维生素D2结构进行修饰希望得到维生素D2的糖苷类似物。而目前大量的关于维生素D类似物的合成研究主要是以1,25-(OH)2D为基本骨架对其侧链的修饰改造,或者是以维生素D为原料在其7,8-位断键成片段(C,D环及侧链)然后与A环的类似物结合重组得到1,25-(OH)2D的结构类似物,而对于直接以维生素D2为原料合成糖苷类似物并研究其在抗癌活性方面的工作却很少。
技术实现要素:
本发明的目的在于提供以天然存在的维生素D2为原料合成的维生素D2糖苷类似物,其制备方法和它在治疗癌症方面的应用。
本发明的原理:基于本小组已有的工作,我们利用化学方法,以维生素D2为原料,通过氧化还原反应制备了维生素D2片段醇,然后再分别以维生素D2及其片段醇为原料合成了a和b的结构类似物,以期得到具有优良的抗癌等生物活性的药物。
实现本发明目的的技术解决方案是:一种维生素D2糖苷类似物,其结构如式Ⅰ或式Ⅱ所示:
式Ⅰ中,R1为
式Ⅱ中,R2为
一种维生素D2糖苷类似物的合成方法,包括如下步骤:
步骤1、化合物4或化合物6的合成:将化合物3或维生素D2、氧化银、四乙酰基溴代糖、分子筛溶于无水二氯甲烷中,然后氮气保护下搅拌反应,反应结束后用氯仿稀释,过滤除去银盐,然后浓缩,柱层析纯化后相应得到化合物4或化合物6,其中,化合物3结构如下:
步骤2、目标化合物的合成:将化合物4或化合物6和甲醇钠溶于无水甲醇中,加入二氯甲烷,然后搅拌反应,反应完全后,浓缩除去甲醇,加入适量水,然后用乙酸乙酯萃取,合并有机层,干燥,浓缩,相应得到式Ⅰ或式Ⅱ化合物,其中,化合物4和化合物6的结构分别如下:
步骤1中所述的化合物3与四乙酰基溴代糖及氧化银的摩尔比为1:2:3.5,维生素D2与四乙酰基溴代糖及氧化银的摩尔比为1:3.5:3.5,反应均在室温下进行,反应时间为5h。
步骤1中柱层析纯化过程中采用的硅胶为300-400目,所用洗脱液为石油醚:乙酸乙酯=4:1。
步骤2中化合物4或化合物6与甲醇钠的摩尔比为1:5,反应温度为室温,反应时间为2h。
上述结构的维生素D2糖苷类似物在抑制人肝癌细胞Hep G2和人乳腺癌细胞MCF-7上的应用。
本发明具有以下显著优点:(1)本次合成的为两种具有显著生理活性的维生素D2糖苷类似物;(2)首次公开了两类维生素D2糖苷类似物的合成方法;(3)合成原料易得、反应条件温和,操作简单,且产率较高。(4)初步的MTT实验表明该类化合物对Hep G2及MCF-7细胞具有很好的抑制作用,是一类很有潜力的用于抗癌的候选药物。
附图说明
图1化合物4a的(1H NMR,500MHz,溶剂:CDCl3)核磁共振谱图。
图2化合物5a的(1H NMR,500MHz,溶剂:CDCl3)核磁共振谱图。
图3化合物4b(α)的(1H NMR,500MHz,溶剂:CDCl3)核磁共振谱图。
图4化合物5b(α)的(1H NMR,500MHz,溶剂:CDCl3)核磁共振谱图。
图5化合物4b(β)的(1H NMR,500MHz,溶剂:CDCl3)核磁共振谱图。
图6化合物5b(β)的(1H NMR,500MHz,溶剂:CDCl3)核磁共振谱图。
图7化合物6的(1H NMR,500MHz,溶剂:CDCl3)核磁共振谱图。
图8化合物7的(1H NMR,500MHz,溶剂:CDCl3)核磁共振谱图。
具体实施方式
本发明维生素D2糖苷类似物的合成路线如下:
(一)式(I)的合成路线
(a):高锰酸钾,乙醇-水,-30℃--20℃;(b):四乙酸铅,甲苯,常温;(c):硼氢化钠,甲苯-甲醇,0℃-常温;(d):α-四乙酰基溴代半乳糖,氧化银,无水CH2Cl2,分子筛,常温或α-四乙酰基溴代葡萄糖,碳酸镉,甲苯,回流;(e):甲醇钠,无水甲醇,常温。.
(二)式(Ⅱ)的合成路线
(i):α-四乙酰基溴代半乳糖,氧化银,无水CH2Cl2,分子筛,常温;(ii):甲醇钠,无水甲醇,常温。
下面结合实例详细说明本发明维生素D2糖苷类似物的合成方法。实例不代表限制本专利的发明范围。
实施例1
结合式(I)的合成路线,化合物1的合成:
于100mL三口烧瓶中分别加入维生素D2(0.50g,1.26mmol)和50mL的乙醇,置于低温循环槽中,缓慢降温至-20℃以下,然后用20mL水溶解高锰酸钾(0.80g,5.04mmol),逐滴加入到反应体系中(控制温度不超过-20℃)。滴加完毕后,维持温度在-30℃--20℃之间,继续搅拌反应2.5h。然后缓慢升温,控制温度在-17℃--15℃之间继续反应1.5h。之后自然升温至室温,再慢慢加热到45℃,继续反应10min。然后TLC监测反应(V乙酸乙酯:V石油醚=1:1)。反应结束后,冷却至室温,过滤,浓缩除去乙醇和水得到橘黄色固体粗品。通过柱层析(硅胶:200-300目,V乙酸乙酯:V石油醚=1:1)进行纯化得化合物1的白色固体(0.34g,62.70%)。1H NMR(500MHz,CDCl3)δ5.54(d,J=9.7Hz,1H),5.22-5.11(m,2H),5.00(s,1H),4.89(d,J=9.5Hz,2H),3.80(s,1H),2.56(dd,J=12.4,3.1Hz,2H),2.44(dd,J=8.9,4.6Hz,2H),2.23-2.15(m,2H),2.10-1.93(m,4H),1.87-1.75(m,5H),1.73-1.54(m,5H),1.47(td,J=13.4,6.7Hz,4H),1.31-1.22(m,4H),1.20-1.05(m,5H),0.97(d,J=6.6Hz,4H),0.92-0.88(m,5H),0.81(dd,J=8.2,7.1Hz,11H).
实施例2
结合式(I)的合成路线,化合物2的合成:
于50mL双口烧瓶中分别加入化合物1(0.10g,0.23mmol),四乙酸铅(0.13g,0.279mmol)迅速称取及10mL甲苯。然后通入氮气保护,于室温下继续搅拌反应5h。TLC监测反应(V乙酸乙酯:V石油醚=1:4)。反应完全后,过滤,减压浓缩得粗品化合物。此步无需纯化,直接进行下一步。
实施例3
结合式(I)的合成路线,化合物3的合成:
将上一步得到的粗产物浓缩干燥后称重(0.19g,0.68mmol)用10mL重蒸过的甲苯溶解,再加入5mL的乙醇。将反应置于低温循环槽中,缓慢降温至-10℃。然后边搅拌边缓慢加入硼氢化钠(0.10g,1.45mmol)。加毕,继续低温下搅拌反应15min,然后将反应移置室温下,继续搅拌反应2h。TLC监测反应进程(V乙酸乙酯:V石油醚=1:10)。反应完全后,在低温下缓慢加入适量水淬灭反应。然后加入100mL乙酸乙酯和100mL水,振荡分层后,分出有机层。有机层再用水洗(2×100mL),饱和氯化钠溶液洗(2×100mL),然后用无水硫酸钠干燥,过滤,浓缩,得粗品。通过柱层析(硅胶:100-200 目,V乙酸乙酯:V石油醚=1:10)进行纯化,得纯品3(24.40mg,37.54%)。1H NMR(500MHz,CDCl3)δ5.17(qd,J=15.3,7.8Hz,2H),4.07(d,J=2.3Hz,1H),2.00(ddd,J=17.2,10.3,5.6Hz,2H),1.88-1.77(m,3H),1.68(ddd,J=15.4,9.4,4.7Hz,1H),1.46(qdd,J=12.0,11.2,4.8Hz,5H),1.37-1.20(m,3H),1.20-1.06(m,2H),0.99(d,J=6.6Hz,3H),0.94(s,3H),0.91(t,J=5.9Hz,3H),0.85-0.80(m,6H).
实施例4
结合式(I)的合成路线,化合物4a的合成:
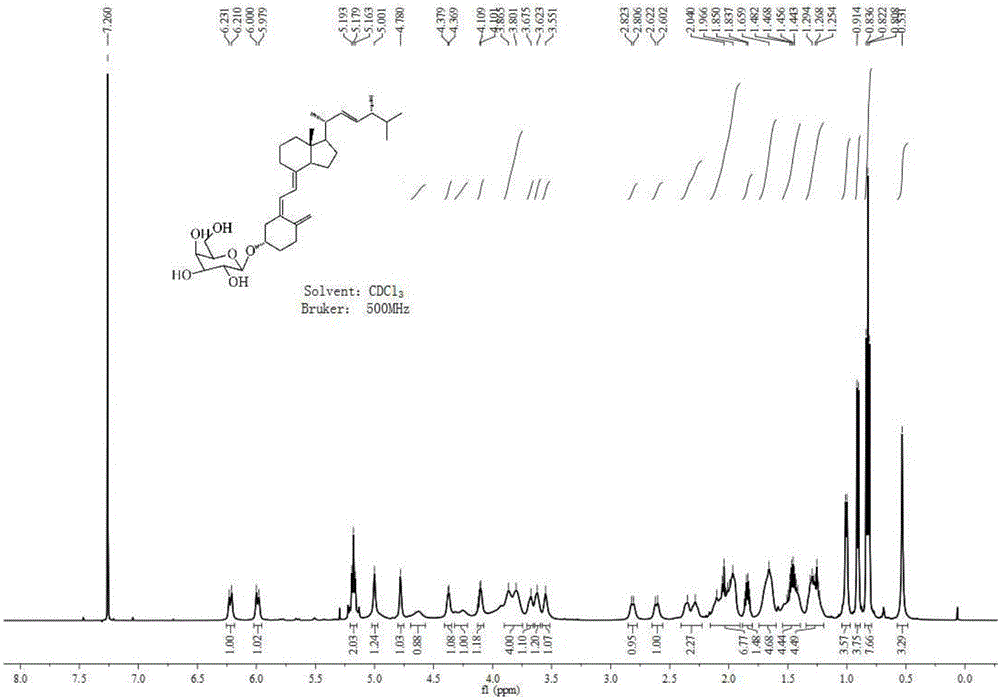
于50mL的圆底烧瓶中分别加入维生素D2片段醇3(0.25g,0.90mmol),四乙酰基溴代葡萄糖(0.74g,1.80mmol),氧化银(0.73g,3.15mmol),分子筛(1.25g),以及用五氧化二磷干燥过的二氯甲烷(15mL),然后在氮气保护下,于室温下搅拌反应2.5h。TLC监测反应完全后(V乙酸乙酯:V石油醚=1:4),加入3mL氯仿淬灭反应,然后过滤,减压浓缩的得到粗品化合物,通过柱层析(硅胶:300-400目,V乙酸乙酯:V石油醚=1:6)纯化,得β-构型的产物4a(0.29g,53.10%)。1H NMR(500MHz,CDCl3)δ5.18-5.06(m,3H),5.04-4.94(m,2H),4.39(d,J=7.9Hz,1H,H-1),4.21(dd,J=12.1,5.3Hz,1H),4.06(dd,J=12.1,2.1Hz,1H),3.81(s,1H),3.62(ddd,J=9.6,5.2,2.5Hz,1H),2.03(s,3H),1.99(s,3H),1.98(s,3H),1.96(s,3H),1.82-1.77(m,1H),1.72(d,J=3.3Hz,1H),1.64-1.57(m,1H),1.47-1.39(m,2H),0.93(d,J=6.6Hz,3H),0.87(d,J=6.8Hz,3H),0.77(dd,J=15.4,8.1Hz,9H).见图1所示。
实施例5
结合式(I)的合成路线,化合物4b的合成(结构如下所示):
于50mL的圆底烧瓶中分别加入维生素D2片段醇3(0.2g,0.72mmol),四乙酰基溴代半乳糖(0.59g,1.44mmol),氧化银(0.584g,2.52mmol),分子筛(1g),以及用五氧化二磷干燥过的二氯甲烷(15mL),然后在氮气保护下,于室温下搅拌反应2.5h。TLC监测反应完全后(V乙酸乙酯:V石油醚=1:4),加入3mL氯仿淬灭反应,然后过滤,减压浓缩的得到粗品化合物,通过柱层析(硅胶:300-400目,V乙酸乙酯:V石油醚=1:6)纯化,得到化合物4b的α-和β-构型的产物,其中α(58.73mg,13.40%):1H NMR(500MHz,CDCl3)δ5.43(d,J=2.7Hz,1H,H-1),5.28(dd,J=10.8,3.1Hz,1H),5.22-5.09(m,1H),5.06(dd,J=10.8,3.6Hz,1H),4.27(t,J=6.4Hz,1H),4.08(dd,J=11.2,5.9Hz, 1H),4.00(dd,J=11.2,7.1Hz,1H),3.94(s,1H),2.11(s,1H),2.05(s,1H),2.01(s,1H),1.99-1.94(m,1H),1.83(dd,J=13.3,6.7Hz,1H),1.57-1.51(m,1H),1.45(dd,J=13.1,6.6Hz,1H),1.39(d,J=5.7Hz,1H),0.96(d,J=6.5Hz,1H),0.92(s,1H),0.89(d,J=6.8Hz,1H),0.81(t,J=7.5Hz,1H).见图3所示。
β(0.36g,81.82%):1H NMR(500MHz,CDCl3)δ5.34(d,J=3.0Hz,1H),5.21-5.15(m,1H),5.11(dd,J=15.3,7.9Hz,1H),4.99-4.94(m,1H),4.36(d,J=7.9Hz,1H,H-1),4.17(dd,J=11.1,6.6Hz,1H),4.05(dd,J=11.1,7.0Hz,1H),3.84(d,J=7.0Hz,1H),2.15(s,1H),2.01(d,J=2.9Hz,1H),1.97(s,1H),1.95(s,1H),1.92(d,J=13.2Hz,1H),1.65-1.60(m,1H),1.48-1.40(m,1H),0.95(d,J=6.5Hz,1H),0.89(d,J=6.8Hz,1H),0.82-0.78(m,1H).见图5所示。
实施例6
结合式(I)的合成路线,化合物5a的合成:
于50mL单口圆底烧瓶中分别加入化合物4a(0.29g,0.48mmol),甲醇钠(0.13g,2.4mmol),20mL的甲醇,然后通入氮气保护,在室温下搅拌反应5h,TLC显示(V甲醇:V二氯甲烷=1:10)反应完全后,减压浓缩除去甲醇,然后加入100mL二氯甲烷,用水(3×100mL)洗有机层至中性,再用无水硫酸钠干燥有机层,过滤,浓缩得纯品化合物5a。1H NMR(500MHz,)δ5.17(dd,J=15.0,7.6Hz,2H),4.90(s,1H),4.25(d,J=7.6Hz,1H,H-1),3.93(s,1H),3.83(s,2H),3.58(t,J=9.1Hz,1H),3.52(t,J=9.0Hz,1H),3.38(t,J=8.4Hz,1H),3.29-3.24(m),2.00-1.94(m),1.84(dd,J=13.1,6.7Hz),1.77(d,J=13.2Hz),1.65(dd,J=15.5,9.8Hz),1.50-1.36(m),1.35-1.20(m),0.99 (d,J=6.5Hz),0.91(d,J=6.9Hz),0.82(t,J=7.1Hz).见图2所示。
实施例7
结合式(I)的合成路线,化合物5b的合成(结构如下所示):
于50mL单口圆底烧瓶中分别加入化合物4b-α(0.36g,0.59mmol),甲醇钠(0.16g,2.95mmol),15mL的甲醇,然后通入氮气保护,在室温下搅拌反应5h,TLC显示(V甲醇:V二氯甲烷=1:10)反应完全后,减压浓缩除去甲醇,然后加入100mL二氯甲烷,用水(3×100mL)洗有机层至中性,再用无水硫酸钠干燥有机层,过滤,浓缩得纯品化合物5b-α。1H NMR(500MHz,CDCl3)δ5.18-5.13(m,1H),4.66(s,1H),4.39(s,1H),4.19(s,1H),4.08(s,1H),3.94(s,1H),3.81(s,2H),3.65(s,2H),3.51(s,1H),1.97(s,3H),1.88-1.80(m,1H),1.76(d,J=11.1Hz,1H),1.64(s,2H),1.48-1.30(m,5H),1.25(s,3H),0.98(d,J=5.5Hz,2H),0.90(d,J=5.5Hz,6H),0.82(t,J=6.8Hz,6H).HRMS[M+Na]+:calcd for C25H44O6463.3036,Found 463.3035.见图4所示。
化合物4b-β按照同样步骤脱保护,得到化合物5b-β。1H NMR(500MHz,CDCl3)δ5.20(dd,J=15.2,7.4Hz,1H),5.13(dd,J=15.2,8.1Hz,1H),4.94(s,1H),4.09(s,1H),4.00(s,1H),3.89-3.85(m,1H),3.82(dd,J=11.9,6.7Hz,1H),3.72(d,J=8.6Hz,1H),2.65-2.33(m,1H),1.97(d,J=13.5Hz,1H),1.91(d,J=13.8Hz,1H),1.84(dd,J=13.3,6.6Hz,1H),1.70-1.61(m,1H),1.31-1.19(m,2H),0.98(d,J=6.4Hz,1H),0.90(d,J=6.8Hz,1H),0.87(s,1H),0.82(t,J=7.3Hz,2H).见图6所示。
实施例8
结合式(Ⅱ)的合成路线,化合物6的合成:
将维生素D2(0.05g,0.126mmol),氧化银(0.102g,0.44mmol),四乙酰基溴代半乳糖(0.18g,0.44mmol),适量分子筛溶于无水二氯甲烷(5ml)中,然后氮气保护,于室温下搅拌5h,反应结束后用氯仿稀释,过滤除去银盐,然后浓缩,柱层析纯化得到76.2mg化合物6(β-构型)。1H NMR(500MHz,CDCl3)δ6.16(d,J=11.2Hz,1H),5.99(d,J=11.1Hz,1H),5.37(d,J=3.0Hz,1H),5.16(dd,J=14.7,7.4Hz,3H),5.01(dd,J=9.8,3.8Hz,2H),4.79(s,1H),4.57(d,J=7.9Hz,1H),4.17(dd,J=11.2,6.5Hz,1H),4.10(dd,J=11.4,7.0Hz,1H),3.90(dt,J=13.7,5.3Hz,2H),2.83–2.77(m,1H),2.46(d,J=11.5Hz,1H),2.36(d,J=7.5Hz,1H),2.29(dd,J=13.4,7.7Hz,1H),2.12(d,J=11.6Hz,4H),2.02(d,J=10.7Hz,4H),1.97(dd,J=16.0,3.8Hz,10H),1.83(dd,J=12.9,6.5Hz,1H),1.80–1.61(m,5H),1.46(dddd,J=23.5,17.0,12.8,7.7Hz,5H),1.34–1.18(m,5H),1.00(d,J=6.6Hz,3H),0.89(t,J=6.2Hz,4H),0.82(dd,J=16.8,9.4Hz,7H),0.53(s,3H).见图7所示。
实施例9
结合式(Ⅱ)的合成路线,化合物7的合成:
于50mL单口圆底烧瓶中分别加入化合物6(0.31g,0.43mmol),甲醇钠(0.12g,2.15mmol),15mL的甲醇,然后通入氮气保护,在室温下搅拌反应5h,TLC显示(V甲醇:V二氯甲烷=1:10)反应完全后,减压浓缩除去甲醇,然后加入100mL二氯甲烷,用水(3×100mL)洗有机层至中性,再用无水硫酸钠干燥有机层,过滤,浓缩得纯品7。1H NMR(500MHz,CDCl3)δ6.22(d,J=10.7Hz,1H),5.99(d,J=10.4Hz,1H),5.18(t,J=7.5Hz,1H),5.00(s,1H),4.78(s,1H),4.37(d,J=5.0Hz,1H),4.13-4.08(m,1H),3.68(s,1H),3.62(s,1H),3.55(s,1H),2.81(d,J=8.7Hz,1H),2.61(d,J=10.2Hz,1H),2.35(s,1H),2.28(s,1H),1.84(dd,J=12.9,6.5Hz,1H),1.66(s,1H),1.34-1.22(m,1H),1.00(d,J=6.2Hz,1H),0.91(d,J=6.8Hz,1H),0.82(t,J=7.2Hz,3H),0.53(s,1H).见图8所示。
细胞毒性试验:
为研究化合物对癌细胞(Hep G2和MCF-7)的抑制能力,我们用化合物5a,5b(α、β)7进行MTT实验,具体步骤如下:
(1)细胞培养:用完全(高糖)培养基制备Hep G2细胞悬浮液,然后置于37℃,含5%CO2空气及100%湿度的细胞培养箱中孵育适当时间。然后去对数期细胞进行MTT试验。
(2)浓度配置:本实验设置了样品组和对照组。其中样品组用PBS溶液溶解样品配置9个浓度:2×10-6,1×10-6,2×10-7,1×10-7,2×10-8,1×10-8,2×10-9,1×10-9,2×10-10(mol/L),每个浓度设置6个复孔。
(3)MTT试验:(a)在96孔板加入细胞培养液200μL(约1×104),置37℃5%CO2细胞培养箱培养24h。(b)样品组加入适当浓度的受试化合物培养48h。对照组,只加入等量的PBS溶液。(c)将96孔板在37℃,含5%CO2空气及100%湿度的细胞培养箱中孵育适当时间。(d)将5×MTT用Dilution Buffer稀释成1×MTT。(e)每孔加20μL 1×MTT,在37℃孵育4小时,使MTT还原为甲臢。(f)吸出上清液,每孔加200μL DMSO使甲臢溶解,用平板摇床摇匀。(g)酶标仪在490nm波长处检测每孔的吸光值,通过吸光度值间接计算出受试化合物的半抑制浓度IC50值。测试结果见表1。
(4)结果分析:
化合物对两种细胞的半抑制率(IC50)值如表1所示,根据《新药(西药)临床前研究指导原则》中说明,当IC50<10μg/mL时,化合物对癌细胞具有一定的抑制作用。从本发明实验数据结果看该类化合物分别作用Hep G2和MCF-7两种细胞均有不同程度的抑制作用,表明两种维生素D2糖苷类似物对两种细胞均有很好的抗癌活性,可以作为潜在的抗癌药物。
表1为化合物对两种细胞的半抑制率(IC50)值
- 还没有人留言评论。精彩留言会获得点赞!