一种新的天然产物黄丝菌多糖CEC‑A及其应用的制作方法
本发明属于真菌多糖应用技术领域,具体地说,涉及一种新的天然产物黄丝菌多糖CEC-A及其应用。
背景技术:
多糖(polysaccharides)又称多聚糖,是生物体普遍存在的一类生物大分子,不仅参与细胞骨架的构成,而且是多种内源性生物活性分子的重要组成成分。近代生物化学一直把多糖视作生物体内维持细胞结构(如纤维素和几丁质)和提供能量来源(如淀粉和糖元)的物质,没有给予足够的重视。多糖的发展较蛋白质、核酸晚得多,加上多糖本身的复杂性和多样性,对多糖结构测定、表征鉴定都提出了巨大挑战。目前,多糖的研究水平要大大落后于蛋白质和核酸的研究。
近20年来,关于多糖生物活性的研究报道主要集中在免疫调节、抗肿瘤、抗病毒、抗氧化和降血糖等方面,其作用是多途径、多环节、多靶点的。
黄丝菌(鸡油菌、杏菌)Canthar-ellus cibarius Fr.英文名:Chanterelle.子实体肉质,喇叭形,全菌杏黄色、蛋黄色或枇杷黄色,菌盖宽3—9厘米,最初扁平,后下凹。有浓郁的杏仁果香味,微甜;可食,香气浓郁,颜色悦目,鲜美可口,营养丰富,是著明的世界型食用菌。富含有胡萝卜素、维生素A、C和钙、铁、磷等多种矿质营养
目前,对黄丝菌多糖CEC-A的精细结构与抗氧化活性研究及其应用尚未见任何报道。
技术实现要素:
本发明的目的在于克服上述技术存在的缺陷,提供一种新的天然产物黄丝菌多糖CEC-A及其应用。
其具体技术方案为:
一种新的天然产物黄丝菌多糖CEC-A,由两个单糖组成的杂多糖,即β-D-葡萄糖和α-D–木糖以5:1的比例组成,平均分子量约为61056D,具有(1-4)β-D-葡萄糖的骨架,6-O上连接一个→1)-α-D–木糖的侧链,黄丝菌多糖CEC-A的结构式为:
本发明所述新的天然产物黄丝菌多糖CEC-A在抗氧化药物及免疫调控药物制备过程中的应用。
与现有技术相比,本发明的有益效果为:
本发明的黄丝菌多糖CEC-A具有显著的抗氧化能力,浓度为4.5mg/ml时,对DPPH·自由基的清除能力为35.23%;浓度为6.4mg/mL,对ABTS自由基的清除能力为40.70%。对T,B细胞具有促增殖活性。对T,B细胞具有促增殖活性。
附图说明
图1黄丝菌纯多糖CEC-A重均分子量;
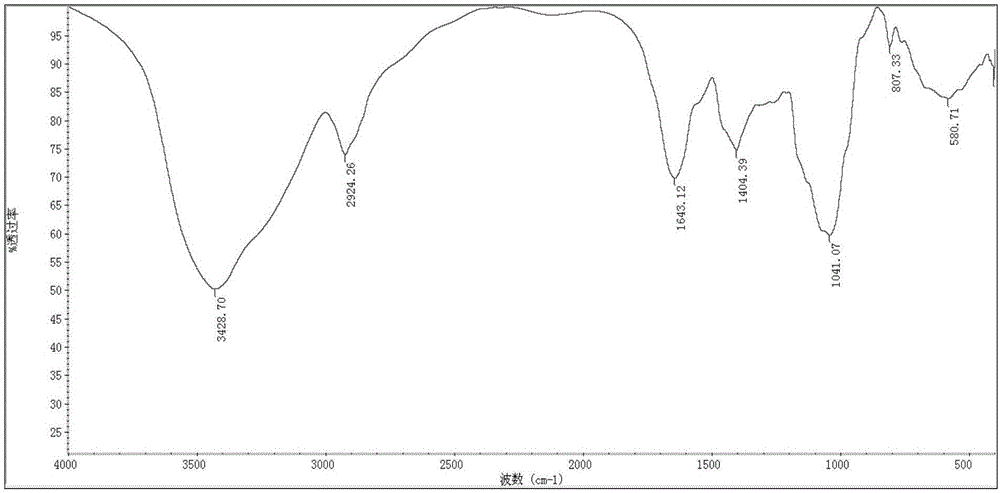
图2黄丝菌多糖CEC-A的红外谱;
图3黄丝菌多糖CEC-A的高效液相图谱;
图4黄丝菌多糖CEC-A的1H NMR图谱;
图5黄丝菌多糖CEC-A的13C NMR图谱;
图6黄丝菌多糖CEC-A的GC-MS图谱,其中,图6a(1,4,6)β-D-葡萄糖,图6b(1-4)β-D-葡萄糖,图6c→1)-α-D–木糖的侧链;
图7黄丝菌多糖CEC-A的结构;
图8黄丝菌多糖CEC-A对DPPH自由基的清除作用;
图9黄丝菌多糖CEC-A对ABTS自由基的清除作用;
图10黄丝菌多糖CEC-A对T细胞增殖的影响;
图11黄丝菌多糖CEC-A对T细胞形态的影响,其中,空白组:图11a;CEC-A实验组:图11b-图11i,浓度分别为0.625,1.25,2.5,5,10,20,40,80μg/mL;LPS对照组:图11j浓度为5μg/mL;
图12黄丝菌多糖CEC-A对B细胞增殖的影响;
图13黄丝菌多糖CEC-A对B细胞形态的影响,其中,空白组:图13a;CEC-A实验组:图13b-图13i,浓度分别为0.625,1.25,2.5,5,10,20,40,80μg/mL;LPS对照组:图13j浓度为5μg/mL。
具体实施方式
下面结合附图和具体实施例对本发明的技术方案作进一步详细地说明。
实施例1黄丝菌多糖CEC-A的分离提取
1.1.经过热水浸提、醇沉后,得到黄丝菌多糖CEC-A粗提物。运用DEAE-cellulose column和Sephadex G-100column进行分离纯化,得到黄丝菌多糖CEC-A。
1.2.黄丝菌多糖CEC-A的结构鉴定
运用水解、甲基化分析、气相色谱和质谱联用技术(GC-MS)、扫描电镜技术(SEM)、红外谱技术(IR)、核磁共振技术(NMR),对橙盖鹅膏菌纯品多糖进行结构解析。
1.2.1分子量的测定
将3mg黄丝菌多糖CEC-A样品溶解于1mlddH2O中,超声5min,进行HPGPC分析,数据用GPC软件分析后与标准曲线对照测得分子量1.1×104D(标准品T-10,20,50,80,130)。
1.2.2黄丝菌多糖CEC-A的硅烷化衍生与甲基化分析
将标准单糖和上述干燥后水解产物进行硅烷化衍生步骤如下:1.0mg的样品溶解于0.2ml的无水吡啶,然后加0.2ml的六甲基二硅氮烷和0.1mg的三甲基氯硅烷,50℃温育20min,然后10000rpm离心20min,取上层溶液用于甲基化分析。
1.2.3黄丝菌多糖CEC-A GC-MS谱分析
GC条件:色谱柱:Rtx-5sil MS(5%phenylmethylsiloxane 30mm×0.25mm×0.25μm);
进样器温度、GC-MS界面温度、离子源温度和检测器温度分别为250、250、230和250℃,升温程序:80℃(3min)10℃/min 250℃(30min);载气:高纯氦气。
1.2.4黄丝菌多糖CEC-A的红外谱分析
当黄丝菌多糖CEC-A样品2mg左右,KBr压片,红外分光光度计4000cm-1-400cm-1。
1.2.5黄丝菌多糖CEC-A的核磁共振分析
取黄丝菌多糖CEC-A样品10mg左右溶于0.5mL重水(D2O)中,在核磁共振仪上常温测定,400MHz测1HNMR谱,400MHz测13CNMR谱。
1.3结果
1.3.1黄丝菌多糖CEC-A的基本性质结果
黄丝菌纯多糖重均分子量为61056D(见图1)。
1.3.2黄丝菌多糖CEC-A的FTIR谱分析
如图2所示,黄丝菌多糖CEC-A在红外谱中显示3428.78cm-1的宽吸收峰指定为O-H和N-H伸缩振动峰,存在着分子内和分子间的氢键。2926.89cm-1指定为-CH2,-CH3的伸缩振动峰。2127.55cm-1指定为-CH2,-CH3的伸缩振动峰。1651.82cm-1指定为C=O,C=C振动峰。1124.92cm-1,1082.90cm-1在1200-1000cm-1范围内指定为-COOH中的C-O-H伸缩振动和吡喃环中醚键C-O-C伸缩振动。791.10cm-1指示黄丝菌多糖CEC-A有α型吡喃环。
1.3.3黄丝菌多糖CEC-A的高效液相分析结果
黄丝菌多糖CEC-A由α-D-葡萄糖和α-D-木糖两种糖构成,比例为5:1(图3)
1.3.4黄丝菌多糖CEC-A的NMR谱分析
异头氢信号δ4.865,δ4.854指示在黄丝菌多糖CEC-A中α型异头氢存在(见图4),且两者均与红外谱显示相一致。在碳谱中13C NMR(400MHz)95–105ppm区域的共振信号峰归属于β-D-葡萄糖和α-D-半乳糖的碳质子信号(见图5,表1)。
表1黄丝菌多糖CEC-A的13C NMR图中的化学位移
1.3.5黄丝菌多糖CEC-A的GC-MS谱分析结果
从黄丝菌中获得一个结构新颖的由两个单糖组成的杂多糖,即β-D-葡萄糖(见图6a,图6b)和α-D-半乳糖(图6c),以2:1的比例组成,平均分子量约为9279D,具有(1-4)β-D-葡萄糖的骨架,6-O上连接一个→3)-α-D-半乳糖的侧链(表2),综上可初步推断黄丝菌多糖CEC-A的结构(见图7)。
表2黄丝菌多糖CEC-A的甲基化GC-MS数据
实施例2.黄丝菌多糖CEC-A的抗氧化活性研究
在体外运用两种化学方法测定橙盖鹅膏菌纯多糖的抗氧化活性,包括DPPH-自由基的清除、ABTS+阳离子自由基清除。
2.1试剂
1,1-二苯基-2-苦基肼(DPPH-);30%H2O2;维生素C(Vc);2,6-二叔丁基-4-甲基苯酚(BHT);ABTS
2.2仪器
721型分光光度计(上海第三分析仪器厂);
2.3方法
2.3.1 DPPH自由基清除能力测定
DPPH自由基清除能力测定参照Braca方法,样品提取液配置成合适浓度(1,2,3,4,5,6mg/mL)。取1mL待测溶液,加入2.0mL 0.2mM DPPH-溶液(用无水乙醇配制),摇匀后放置30min。乙醇调零,517nm处测定A样品的吸光值。同时测定1.0mL样品溶液与2.0mL乙醇混合液,在517nm处的吸光度作为A对照。以Vc和BHT作为阳性对照。DPPH清除能力=(1-A样品/A对照)×100%。
2.3.2 ABTS+阳离子自由基清除能力测定
7mmol/LABTS水溶液和2.45mmol/L过硫酸钾避光还原12-16h,ABTS溶液用PBS(pH7.4)稀释至630nm测定值为0.50±0.05。取10μL样品90μLABTS溶液混合反应,置于暗处3min。用样品PBS溶液作为样品颜色空白参比,PBS溶液为空白对照,在酶标仪上于734nm处检测。依据下列公式计算清除率:ABTS清除率(%)=[A空白-(A样品-A对照)]/A空白×100%
实施例3.黄丝菌多糖CEC-A的免疫调控活性研究
3.1 CEC-A对T、B细胞的增殖作用
用细胞计数试剂盒CCK-8(cell counting kit)法测定CEC-A对T、B细胞的增殖实验中的细胞数。用培养液溶解CEC-A多糖,用0.22μm滤器除菌储存备用,用时用培养液逐级稀释。取对数生长期的T、B细胞和RAW264.7细胞,更换新鲜的培养液,并用培养液稀释至2×10 5细胞/mL,将PBS缓冲液加入96孔板的四周,保持无菌的水环境,再在其余的孔加入100μL细胞稀释液。在37℃、5%CO2的培养箱中培养24小时后,依次加入100μL细胞培养液(空白对照)、LPS(终质量浓度10μg/mL,阳性对照)以及不同浓度的CEC-A溶液,在37℃、5%CO2的培养箱中培养24小时。每孔加入CCK-8溶液5μL继续培养3小时,测定450nm下吸光值,记录结果。绘制以浓度为横坐标,吸光值为纵坐标的曲线,并拍照。
统计与分析
所有数据均用mean±SD表示,用t-test检验差异的显著性,与对照组对比显著用*表示,P<0.05,极显著用**表示,P<0.001。
结果
1).黄丝菌多糖CEC-A对DPPH-自由基清除活性
图8说明了纯化的黄丝菌多糖CEC-A样品多DPPH自由基有很好的清除活性,浓度为4.5mg/ml时,对DPPH·自由基的清除能力为35.23%。
2).黄丝菌多糖CEC-A对ABTS+阳离子自由基清除的活性
使用分光光度计在734nm处的测定黄丝菌多糖CEC-A对ABTS+阳离子自由基清除的活性。结果表明(图9),浓度为6.4mg/mL,对ABTS自由基的清除能力为40.70%。
3).CEC-A对T淋巴细胞增殖的影响
T增殖效果如图10所示,对照组为浓度为5μg/mL的LPS。CEC-A在0.625-20μg/mL的浓度范围内,与T细胞增殖效果呈正相关;CEC-A浓度为0.625-2.5μg/mL时,T细胞增殖效果显著(P<0.05),在浓度为5-20μg/mL时,T细胞增殖效果为极显著(P<0.001);当CEC-A浓度在5μg/mL时达到最大值(P<0.001),继续增大浓度,细胞受到周围环境的影响导致细胞增殖效果反而下降。
T细胞的增殖形态如图11a-11j所示。随着CEC-A浓度的增大,细胞加速分裂,变大成团。在用5μg/mL的CEC-A浓度刺激时,细胞成团最多且最大。
4).CEC-A对B淋巴细胞增殖的影响
结果如图12所示,对照组为5μg/mL的LPS。CEC-A在浓度为0.625-80μg/mL的时,增殖效果达到极显著(P<0.001);在20μg/mL的浓度增殖效果亦为最好。从形态上看,B细胞呈规则的圆形,明显的集簇生长。本发明的B细胞增殖形态如图13a-13j所示,B细胞悬浮在培养孔中,生长状态良好,受到CEC-A刺激后,细胞体积变大后聚成团,增殖能力旺盛。
以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围不限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可显而易见地得到技术方案的简单变化或等效替换均落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!