一种黄褐牛肝菌中的抗氧化多糖及其制备方法及用途与流程
本发明属于生物技术领域,具体涉及一种黄褐牛肝菌中抗氧化多糖的提取与纯化方法。
背景技术:
我国真菌资源丰富,许多真菌作为珍贵的药、食两用菌受到广泛关注。食用菌含有丰富的营养成分,富含多种维生素以及矿物质,高膳食纤维、低能值、高蛋白、低脂肪。食用菌中的蛋白含量约为18%-35%,约为牛肉的1.6倍,包含有人体必需的8种氨基酸,且比例与人体接近,所以易被吸收。此外,食用菌被人们称之为“植物肉”,因为它含有种类多样的维生素,含有丰富的VB1、VB2、VC、叶酸、VB12等。随着对真菌资源开发和研究的不断深入,已从中分离获得了许多活性成分,诸如腺苷、甾醇类、有机酸、萜类等小分子活性物质,除此之外,还有多糖、蛋白、多糖-蛋白复合物等大分子化合物,具有良好的抗病毒、降血糖和增强免疫调节等功能,因此,食、药用真菌作为中草药中的“上上药”,其研究开发存在很大潜力。
黄褐牛肝菌,属担子菌纲,伞菌目,牛肝菌科,主要分布在我国的云南、四川等地。生于柞、栎等阔叶林及针阔混交林地上,单生或群生。该菌菌体较大,肉肥厚,柄粗壮,菌盖扁半球形,直径5-13cm,光滑、不粘,淡黄褐色,黄褐色或橙褐色,边缘内卷,有酱香味,可入药。黄褐牛肝菌营养丰富,味道香美,营养丰富,是一种世界性著名食用菌。
食用菌中包含有多种功能性成分,其中,多糖作为一种具有抗氧化、抗肿瘤、免疫调节、降血糖、抗病毒、抗衰老等多种生物学活性的功能性成分,受到国内外学者的广泛关注。到目前为止,多糖分离、纯化和生物活性的测定已经比较成熟,但其方法仍在不断的发展和完善,食用菌多糖的生物活性、结构分析是当下多糖研究的主要热点,由于多糖结构的复杂性限制,这部分的研究仍然十分困难。本发明首次从黄褐牛肝菌子实体中分离纯化得到一种具有抗氧化活性的多糖。
技术实现要素:
本发明目的在于提供黄褐牛肝菌中的一种抗氧化多糖,同时提供了该抗氧化多糖的制备方法,本发明还提供了该抗氧化多糖该多糖具有一定的清除DPPH、超氧阴离子和羟基自由基的生物活性的用途。
为了达到上述目的,本发明采用的技术方案是:
一种黄褐牛肝菌中的抗氧化多糖,所述的抗氧化多糖提取自黄褐牛肝菌,命名为HNG2,HNG2为淡黄色粉末,是一种同时含有α-和β-两种糖苷键构型的多糖,分子量为177KDa,由岩藻糖、木糖、葡萄糖、半乳糖、甘露糖5种单糖组成,比例为0.36:0.8:30:2:1.6,易溶于水,不溶于乙醇、乙醚、丙酮等有机溶剂。
一种黄褐牛肝菌中的抗氧化多糖的制备方法,包括如下步骤:
1)将黄褐牛肝菌子实体烘干,用高速粉碎机粉碎后,加入30倍体积蒸馏水,水浴震荡,8000r离心10min后取上清,重复浸提2-3次,合并离心上清液,用旋转蒸发仪进行旋蒸,浓缩到一定体积,加入无水乙醇静置过夜;离心后沉淀进行复溶,得到多糖溶液;经sevage法除蛋白,剧烈震荡,静置,等到水相和有机相之间的界面出现白色时,将分液漏斗打开,将下层有机相和中间白色絮状物去除,重复上述操作7-8次,取上层水相,透析后,经旋转蒸发除去残留的有机溶剂,经过冷冻干燥得到粗多糖;
2)将1)步中得到的黄褐牛肝菌粗多糖溶于Tris-HCl缓冲液,上样于DEAE Sepharose F.F.柱中,用0-2M NaCl溶液进行线性洗脱,蒽酮-硫酸法与分光光度计跟踪监测每管洗脱液;根据吸光值绘制曲线,收集洗脱峰,透析后冻干;
3)将2)步中得到的洗脱峰用蒸馏水溶解后上样于Sephadex G-75凝胶柱,并用蒸馏水洗脱,用分布收集器3mL/管收集洗脱液,蒽酮-硫酸法跟踪检测,绘出洗脱曲线并按峰收集,得到的组分旋蒸浓缩,冷冻干燥,产物即为HNG2抗氧化多糖。
进一步的,步骤1)中的水浴震荡温度为80℃,震荡5h。
进一步的,步骤1)所得离心上清液经旋蒸、浓缩后,加入4倍体积的无水乙醇于4℃静置过夜。
进一步的,步骤1)的sevage法中,Sevage试剂按照三氯甲烷:正丁醇=4:1的比例进行配制,并按照粗品溶液:Sevage试剂=4:1的比例加入Sevage试剂,剧烈震荡8-10min静置。
进一步的,步骤2)中所述的粗多糖溶于10mM Tris-HCl缓冲液,其pH值为7.4。
进一步的,步骤3)中所述的洗脱流速为0.5mL/min。
一种黄褐牛肝菌中的抗氧化多糖的用途,用于治疗因自由基等引起氧化应激水平升高导致疾病的药物。
本发明具有的优点和有益效果:
(1)本发明中黄褐牛肝菌抗氧化多糖为天然提取物,具有良好的安全性;(2)本发明中黄褐牛肝菌抗氧化多糖HNG2为纯品;(3)本发明中黄褐牛肝菌抗氧化多糖具有良好的抗氧化效果;(4)本发明中黄褐牛肝菌抗氧化多糖制备简单,成本低,适于大规模生产。
附图说明
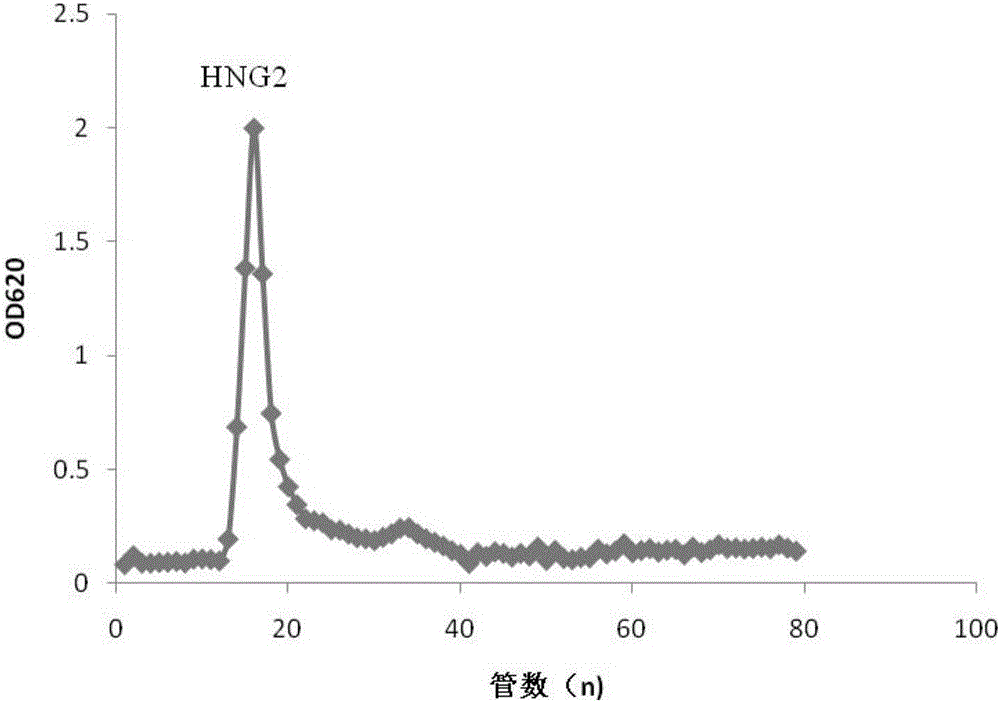
图1是本发明黄褐牛肝菌抗氧化多糖的离子交换层析图。
图2是本发明黄褐牛肝菌抗氧化多糖的凝胶柱析图。
图3是本发明黄褐牛肝菌抗氧化多糖的HPLC-ELSD图。
图4是标准葡聚糖的分子量标准曲线图。
图5是本发明黄褐牛肝菌抗氧化多糖对DPPH的清除作用图。
图6是本发明黄褐牛肝菌抗氧化多糖对超氧阴离子清除作用图。
图7是本发明黄褐牛肝菌抗氧化多糖对羟基自由基的清除作用图。
图8是本发明黄褐牛肝菌抗氧化多糖的红外光谱图。
图9是本发明黄褐牛肝菌抗氧化多糖的核磁共振氢谱图。
图10是本发明黄褐牛肝菌抗氧化多糖酸水解产物的HPLC-ELSD法单糖组成分析图。
图11是对照葡萄糖标品HPLC-ELSD分析图
图12是6种标准单糖混合物的HPLC-ELSD分析图
图13是本发明黄褐牛肝菌抗氧化多糖GC-MS法单糖组成分析图
图14是5种标准单糖的GC-MS法分析图。
具体实施例
下面结合具体实施例对本发明作进一步的说明。
实施例1、本发明抗氧化多糖的制备
(1)将黄褐牛肝菌子实体烘干,用高速粉碎机粉碎后,加入30倍体积蒸馏水,于80℃条件下水浴震荡5h,8000r离心10min后取上清,重复浸提2-3次,合并离心上清液,用旋转蒸发仪进行旋蒸,浓缩到一定体积,加入4倍体积的无水乙醇于4℃静置过夜。离心后沉淀进行复溶,得到多糖溶液。经sevage法除蛋白,Sevage试剂按照三氯甲烷:正丁醇=4:1的比例进行配制,并按照粗品溶液:Sevage试剂=4:1的比例加入Sevage试剂,剧烈震荡8-10min,静置,等到水相和有机相之间的界面出现白色时,将分液漏斗打开,将下层有机相和中间白色絮状物去除,重复上述操作7-8次,取上层水相,透析后,经旋转蒸发除去残留的有机溶剂,经过冷冻干燥得到粗多糖;
(2)将(1)步中得到的黄褐牛肝菌粗多糖溶于10mM Tris-HCl(pH 7.4)缓冲液,上样于DEAE Sepharose F.F.柱中,用0-2M NaCl溶液进行线性洗脱,蒽酮-硫酸法与分光光度计跟踪监测每管洗脱液。根据吸光值绘制曲线(图1),收集洗脱峰,透析后冻干。
(3)将(2)步中得到的洗脱峰用蒸馏水溶解后上样于Sephadex G-75凝胶柱,并用蒸馏水洗脱,0.5mL/min,用分布收集器3mL/管收集洗脱液,蒽酮-硫酸法跟踪检测,绘出洗脱曲线(图2)并按峰收集,得到的组分旋蒸浓缩,冷冻干燥,产物即为HNG2抗氧化多糖。
实施例2、本发明抗氧化多糖的纯度和分子量测定
分别用双蒸水将已知分子量的标准葡聚糖(Dextran T-10、T-50、T-70、T-100、T-200)配制成浓度为10mg/mL的标准液,经0.22μm滤膜过滤后上样于SUGAR KS-804糖柱,进样量20μl,以不同葡聚糖的分子量Mw为纵坐标,以标准葡聚糖的保留时间t为横坐标,绘制出标准曲线(图4)。
用双蒸水配制成浓度10mg/mL的溶液,经0.22μm滤膜过滤后上样,采集图谱,根据出峰情况判定纯度,图3显示单一狭窄对称峰,可以判定该多糖为纯品,保留时间为6.02min,将其代入图4所示多糖分子量的标准曲线y=-54x+502.77中,计算得到黄褐牛肝菌HNG1的分子量为177KDa。
实施例3、本发明抗氧化多糖的清除DPPH自由基作用
(1)抗氧化多糖用无水甲醇做溶剂,配制成浓度为0.5mg/mL的溶液,DPPH用无水甲醇配制成终浓度为1×10-4mol/L的溶液。
(2)分别取上述多糖溶液0.06、0.12、0.18、0.3、0.6mL于1.5mL离心管中,用DPPH溶液补足1.2mL,等体积无水甲醇代替样品溶液的处理作为空白对照,抗坏血酸作为正对照,黑暗中放置30min。
(3)在517nm处测定各处理的吸光值。
(4)按“清除率=[1-(As-Ab)/Ai]×100%”公式计算DPPH清除率,其中Ai为不加样的DPPH溶液的吸光值,As为样品与DPPH反应后的吸光值,Ab为样品的吸光值。
该抗氧化多糖的清除DPPH自由基活性见图5,该图显示,在工作浓度为50~300ug/ml范围内,该多糖的DPPH自由基清除活性随着浓度的增大而升高,在300ug/ml时清除活性最高,达到61.63%以上。
实施例4、本发明抗氧化多糖的超氧阴离子自由基清除作用
本研究采用1mL Tris-HCl缓冲液(mM,pH 8.0)的超氧阴离子产生体系,其中含有78uM NADH,50uM NBT,10uM PMS以及不同浓度的试样,以没食子酸作为正对照,用Tris-HCl补足1mL,在560nm测定超氧阴离子与NBT的颜色反应。
按“清除率=(A-A1)/A×100%”公式计算试样的超氧阴离子自由基清除率,其中A为对照体系的吸光值,A1为含试样体系的吸光值。
如图6所示,本发明抗氧化多糖在工作浓度为50~300ug/mL浓度范围内,随浓度升高,其超氧阴离子清除率也逐步升高,在300ug/mL时清除率达到19.54%以上。
实施例4、本发明抗氧化多糖的羟基自由基清除作用
本研究采用1ml体系,内含有100mM Vc,100μM CuSO4,12μM Cytc以及待测样品。此体系于25℃温育90min后,用分光光度计于550nm处测定透光率。硫脲作为正对照,T为体系的透光率,T1为对照体系的透光率,T2为待检测物的透光率,按羟基自由基清除率的计算公式:清除率=(T-T2)/(T-T1)×100%计算试样的羟基自由基清除率。
如图7所示,本发明抗氧化多糖在工作浓度为50~300ug/mL浓度范围内,随浓度升高,其羟基自由基清除率也逐步升高,在300ug/mL时清除率达到46.39%。
可见本发明抗氧化多糖可应用于治疗因自由基等引起氧化应激水平升高导致疾病的药物方面。
实施例5、本发明抗氧化多糖的红外光谱分析
1mg样品与适量的KBr于研钵中混合研磨充分,小心放于样池,对照窗口放置研磨后的KBr,置于FTS 6000型傅里叶红外变换光谱仪中,在4000~400cm-1波数范围内进行红外扫描。
结果如图8所示,可以得出:HNG2在3333.61cm-1处的吸收峰表明是多糖O-H的伸缩振动,在2925.41cm-1处存在的吸收峰是C-H的伸缩振动,1400-1200cm-1的吸收是由C-H伸缩振动和变角振动引起的,通过这三组糖类的特征峰可以判断HNG2为多糖。
HNG2在1659.93cm-1附近的吸收峰是C=O非对称伸缩振动,在1428.9cm-1的吸收意味着CH2和OH键的伸缩振动,1245.23cm-1和1137.28cm-1处的吸收分别属于OH和C-O-C的伸缩振动,多糖在1043.43cm-1的吸收说明多糖含有半乳糖,并且具有吡喃糖苷键。此外,918.25cm-1处的吸收是D-葡萄吡喃糖的特征吸收峰,这都表明HNG1的糖环构型为吡喃型,多糖在850cm-1的吸收说明多糖HNG1含有α型糖苷键,在802.556cm-1处的吸收表明HNG2含有甘露糖,红外光谱分析得出HNG2含有葡萄糖、半乳糖以及甘露糖,均在单糖组成分析中得到了验证。
实施例6、本发明抗氧化多糖的核磁共振氢谱分析
多糖的1H-NMR中,糖环碳上大部分质子的化学位移受羟基的屏蔽作用而位于δ3~4ppm范围内,由于信号重叠,解析比较困难。异头氢质子H-1的化学位移位于较低场,在δ4.5~5.5ppm,通常此区域内质子信号的多少表示单糖种类的多少。
图9所示,δ4.70ppm处为重氢信号,HNG2在δ4.5~5.5ppm之间共有5个信号峰,表明该多糖含有5种单糖。另外,δ4.5~5.5ppm为异头氢(端基质子)区,其中δ>5.0ppm的信号(δ5.01ppm,δ5.09ppm,δ5.27ppm)表明存在糖环构型为α型,δ<5.0ppm的信号(δ4.95ppm,δ4.84ppm)表明HNG2中同时存在β型。
实施例7、本发明抗氧化多糖的单糖组成分析
本发明采取了两种方法,包括GC-MS法和离子排阻液相色谱(IEC)法,其中,HPLC-ELSD法进行单糖组成分析,酸水解产物可以直接进样分析,无需衍生化处理,更为方便便捷;GC-MS法相比于糖腈乙酸酯衍生气相色谱法(AA-GC)法在数据处理上更为方便。
经HPLC-ELSD法分析,HNG2酸水解产物得到4个信号峰(图10),从左至右各峰的出峰时间依次为6.7min、8.0min、10.1min和11.2min。实验发现,每次谱图中均会在2-4min之间出现未知峰,与对照图11比对,得知2-4mi出现的小峰是体系中的物质造成的,很有可能是未除尽的三氟乙酸等杂质。
6种单糖标准品的混合物经HPLC-ELSD分析,得到图12,自左至右各峰对应的单糖分别为鼠李糖、岩藻糖、木糖、果糖、甘露糖、葡萄糖,出峰时间依次为6.4min、6.7min、8.0min、8.6min、10.2min和11.2min。对应HNG2酸解产物的HPLC-ELSD分析数据可知,HNG2含有3种单糖为岩藻糖、木糖和葡萄糖。另外,第三个峰通过所有其他单糖对比都没有符合的峰,需要通过GC-MS进一步的分析。
糖与盐酸羟胺在吡啶中加热生成糖肟,加入乙酰化试剂醋酸酐,继续加热可生成具有挥发性的糖腈乙酸酯衍生物,该衍生物可直接进样。如图13为鼠李糖、岩藻糖、木糖、果糖、甘露糖、葡萄糖六种标准单糖用GC-MS法进行的检测,图14为黄褐牛肝菌(Boletus subsplendidus Chiu)抗氧化多糖HNG2进行的单糖组成分析。进样后,可以发现由于衍生物种类较多,形成的峰多且复杂,通过与数据库进行比对,得出:HNG2中存在岩藻糖(15.40min),木糖(15.45min),葡萄糖(18.81min),半乳糖(19.02min),甘露糖(20.14min)。通过与标准单糖出峰时间及峰面积分析等,得到单糖组成比例为:岩藻糖:木糖:葡萄糖:半乳糖:甘露糖=0.36:0.8:30:2:1.6。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!